P-элементы
P-элементы
1. Общая характеристика р-элементов IIIА группы
Электронная конфигурация основного состояния у этих элементов ns1np2 характерезуется наличием одного неспаренного электрона. В возбужденном состоянии они содержат три неспаренных электрона, которые, находясь в sр2-гибридизации, участвуют в образовании трех ковалентных связей. При этом у атомов элементов IIIА группы остается одна незанятая орбиталь, а число валентных электронов остается меньше числа доступных по энергии орбиталей. Поэтому многие ковалентные соединения элементов IIIА группы являются кислотами Льюиса – акцепторами электронной пары, приобретая которую, они не только повышают координационное число до четырех, но и изменяют геометрию своего окружения – одна из плоскостей становится тетраэдрической (состояние sр2-гибридизации).
Бор отличается по свойствам от других элементов этой подгруппы. Бор - единственный неметалл, химически инертен и образует ковалентные связи BF, BN, BC и т.д., кратность которых часто повышена за счет рр – связывания. Химии бора близка химия кремния, в этом проявляется диагональное сходство. У атомов алюминия появляются вакантные d-орбитали, возрастает радиус атома, поэтому увеличиваетсякординационное число до шести. Галлий, индий, таллий располагаются сразу за металлами d-блока; заполнение d-оболочки сопровождается последовательным сжатием атомов. В результате d-сжатия ионные радиусы алюминия и галлия близки, а атомный радиус галлия даже меньше. При переходе от Al к Ga рост эффективного заряда ядра оказывается более значительным, чем изменение радиуса атома, поэтому энергия ионизации повышается. Рост энергий ионизации при переходе от Iп к Tl является результатом d- и f-сжатия, приводящего к усилению взаимодействия валентных электронов с ядром атома. Увеличение энергии связи 6s2-электронов таллия с ядром затрудняет их участие в образовании связей и приводит к понижению стабильности их соединений в высшей степени окисления. Так для талля, свинца, висмута и полония устойчивы соединения со степенью окисления +1, +2, +3, +
К р-элементам III группы относятся типические элементы - бор и аллюминий и элементы подгруппы галлия - галлий, индий, таллий. Все перечисленные элементы, кроме бора, являются металлами. Все элементы редкие, за исключением алюминия, на долю которого приходится 8,8 % массы земной коры. На внешнем электронном уровне они имеют три электрона ns2np1, а в возбужденном состоянии – ns1np2 электроны. Высшая степень окисления элементов подгруппы бора равна +3. Из-за того, что в атомах Ga, In, T1 предпоследний уровень содержит 18 электронов, нарушаются закономерные различия некоторых свойств при переходе от А1 к Ga. Некоторые физические константы элементов подгруппы IIIА приведены в табл.7.
2 Элементы IIIА группы (подгруппа бора)
2.1.Бор
Природные ресурсы. В свободном состоянии бор не встречается, а только в связанном состоянии. Основные минералы - бораты: Na2B40710Н2О -бура, Н3ВО3 - борная кислота, нитрид бора BN.
Получение. Технический (аморфный) бор получают магнийтермическим восстановлением его оксида:
3Mg + B2О33MgO + 2B ; Н<0.
MgO удаляют растворением в HCl. Кристаллический бор получают восстановлением галогенидов водородом:
2ВВr3 + ЗН2 6HBr + 2B.
Свойства. Бор известен в аморфной (коричневой) и кристаллической (черной) формах. Кристаллическая решетка бора очень прочна (икосаэдры), это проявляется в высокой твердости, малой энтропии S0(в) =7э.е. и высокой температуре плавления. Бор - полупроводник, ширина запрещенной зоны составляет 1,42 эВ.
Бор - первый р - элемент в периодической системе элементов. Строение внешней электронной оболочки 2s22pl. Возбуждение переводит атом в sp2 - гибридное валентное состояние, в котором орбитали расположены под 1200 (ВFз, ВС1з). Благодаря наличию свободной р-орбитали и малому размеру атома, бор - один из сильнейших акцепторов неподеленных электронных пар, образует комплексные ионы типа:
BF3(г) + HF = H[BF4](p),
BF3(г) + F- (p) = [BF4]-1 (p).
Комплексный ион [ВF4]-1 имеет тетраэдрическое строение, которое характерно и для других соединений бора.
Таблица 7
Свойства элементов подгруппы III А
|
Свойства элементов |
В |
Аl |
Ga |
In |
Tl |
|
Содержание в земной коре, % |
310-4 |
8,8 |
1,5I0-3 |
1,510-5 |
4,510-5 |
|
Атомный радиус, нм |
0,083 |
0,143 |
0,122 |
0,166 |
0,171 |
|
Ионный радиус Э3+, нм |
0,027 |
0,054 |
0,061 |
0,08 |
0,189 |
|
Энергия ионизации, Э0 Э+ , эВ |
8,298 |
5,986 |
5,998 |
5,786 |
6,108 |
|
Температура плавления, °С |
2040 |
660,2 |
298 |
156,2 |
302,5 |
|
Температура кипения, °С |
2550 |
2270 |
2070 |
2075 |
1457 |
|
Плотность, г/см3 |
2.46 |
2.70 |
5.90 |
7.31 |
11.85 |
|
Е0 (Э3+/ Э0), В |
- |
-1,67 |
-0,65 |
-0,343 |
+0,71 |
|
Электроотрицательность |
2,04 |
1,61 |
1,81 |
1,78 |
2,04 |
|
Степень окисления |
-3, +3 |
+3 |
+3 |
+3 |
+1,+3 |
С донорно-акцепторным взаимодействием связано наличие большого числа неорганических боросодержищих полимеров. По значению электроотрицательности бор находится почти в середине шкалы электроотрицательности, поэтому он может быть как окислителем в соединениях со степенью окисления +3 (ВF3, В2О3), так и восстановителем в соединениях со степенью окисления –3 (Mg3B2, В3Н6). Связи, образуемые бором, - ковалентные. Для бора типичны соединения, в которых он входит состав комплексного аниона (В4O72-, BF4-).
Бор обнаруживает диагональную аналогию с кремнием. Для бора и кремния наиболее характерны производные, в которых эти элементы поляризованы положительно. Для обоих элементов их низшие гидриды малоустойчивы и газообразны. Много общего имеет химия кислородных соединений бора и кремния: кислотная природа оксидов и гидроксидов, стеклообразование оксидов, способность образовать многочисленные полимерные структуры и т.д. При обычных условиях бор химически инертен. Вода не действует на бор; концентрированная азотная и серная кислоты окисляют его до борной кислоты:
2В + ЗН2S04 = 2Н3ВО3 + 3SO2,
В + 3HNO3 = Н3ВО3 + ЗN02.
Кипящие соляная и плавиковая кислота на него не действуют. Аморфный бор растворяется в концентрированных растворах щелочей с образованием метаборатов:
2В + 2КОН + 2Н2О 2КВО2 + ЗН2.
Во всех случаях кристаллический бор химически менее активен, чем аморфный. В химических реакциях бор чаще выступает как восстановитель.
Взаимодействие бора с простыми веществами можно представить следующей схемой:
N2,P(1000-12000C) BN,BP
F2(20-250C) C (20000C) B4C
BF3
O2, S(600-7000C) B2O3, B2S3
CI2, Br2, I2 (400-9000C) BГ3
Водородные соединения бора. С водородом бор не реагирует; бороводороды или бораны получают искусственным путем. Это газы или легколетучие жидкости с неприятным запахом, очень ядовиты! Их можно разделить на две группы: BnHn+4(B2H6) и BnHn+6 (B4H10). Боран ВНз существует как промежуточный продукт в химических реакциях, частицы которого, взаимодействуя друг с другом образуя димер (диборан):
2BH3(г) = B2H6(г) , G0 = -126кДж
Дибораны получают:
1)ЗNа[ВН4] + 4ВF3 газовая фаза 2В2Н6 + ЗNа[ВF4];
2)2ВСз+6H2(г) газовая фаза В2Н6 + 6НС1;
эти реакции протекают в газовой фазе или в неводных средах.
Диборан является энергичным восстановителем; воспламеняется на воздухе:
В2Н6 + 3О2 3Н2О + В2О3;
энергично взаимодействует с водой с выделением водорода:
В2Нб + 6Н20 2В(ОН)3 + 6Н2.
В среде эфира В2Нб реагирует с гидридом лития, образуя тетрагидроборат лития:
В2Н6 + 2LiН 2Li[BH4].
С кислородом бор образует оксид В2О3 – белый гигроскопичный порошок или хрупкую стекловидную массу. B2O3 энергично присоединяет воду, образуя кислоты:
B2 O3 + H2O = 2HBO2 (метаборная кислота),
HBO2 + H2O = H3BO3 (ортоборная кислота).
Ортоборная (или просто борная) кислота - белое кристаллическое вещество, легко расслаивается на очень тонкие перламутровые чешуйки. Молекулы Н3ВО3, расположенные в плоских параллельных слоях, связаны между собой водородными связями, а связь между слоями осуществляется слабыми силами Ван-дер-Ваальса. Борная кислота хорошо растворима в воде, а также в некоторых растворах органических растворителей. В водных растворах она проявляет себя как одноосновная кислота, вследствие образования гидроксокомплекса:
В(ОН)3 + Н20 = Н[В(ОН)4].
Тетрагидроксоборат водорода представляет собой слабую кислоту, близкую по силе к угольной кислоте. Ортоборная кислота Н3ВО3 при 100°С с отщеплением молекулы воды переходит в метаборную кислоту НВO2. И ортобораты, и метабораты активных металлов подвергаются гидролизу:
Na2B407 + ЗH2O2NaB02 +2H3BO3.
Тeтpaбopнaя кислота Н2B4О7 в свободном состоянии неизвестна, ее соли тетрабораты встречаются в природе; тетраборат натрия образуется при нейтрализации H3BO3 водными растворами щелочей:
4Н3ВО3 + 2NаОН = Nа2В4О7 + 7Н2О.
Степень окисления +3 у бора проявляется в соединениях с более электроотрицательными элементами (нитриды, галогениды).
Кислотная природа галогенидов проявляется при их гидролизе:
ВС13 + ЗН2О = Н3ВО3 + ЗНС1.
С азотом бор образует соединение BN - нитрид бора. Синтез осуществляется при температуре выше 1200°С по реакции:
B2O3 + 2NH3 = 2BN + 3H2O.
Полученный таким образом нитрид бора представляет собой белый, похожий на тальк, порошок; его часто называют «белым графитом». Его кристаллическая структура аналогична графиту. Атомы бора и азота связаны между собой sp2 - гибридными связями. В плоскости слоев осуществляется дополнительное - связывание за счет пустой р- орбитали атома бора и неподеленной электронной пары атома азота. Отдельные слои связаны силами Ван-дер-Ваальса. «Белый графит» обладает высокой огнеупорностью, химически инертен и расслаивается на чешуйки, как графит.
Другая модификация нитрида бора имеет кубическую алмазоподобную структуру. В ней атомы бора и азота находятся в sp3- гибридном состоянии. При КЧ=4 три связи образованы по обменному механизму, а одна по донорно-акцепторному, причем атом бора является акцептором электронной пары, а атом азота - донором. Эта модификация BN- называется боразоном или эльбором. При высоких температурах эльбор можно получить из «белого графита», подобно тому как алмаз получается из черного графита:
BN (гекс) BN (куб).
При нагревании с углеродом бор образует карбид В4С:
7С + 2В2O36СО + В4С.
Карбид бора уступает по твердости лишь алмазу и боразону.
При нагревании бор взаимодействует со многими металлами, образуя бориды различного состава, например: Сг4В, Сг3В, СгВ, СгВ2. Это кристаллические вещества. Все бориды d-элементов характеризуются большой твердостью, тугоплавки и химически инертны. Бориды s- элементов, например, MgB2, реакционноспособны.
Применение. Бор применяют как добавку к сплавам, увеличивающую их жаропрочность и износостойкость. Поскольку ядро бора имеет высокое сечение захвата нейтронов, бор используют для защиты от нейтронов и в регулирующих устройствах атомных реакторов.
Бораты входят в состав многих моющих средств. В2О3 - необходимая часть ряда эмалей, глазурей и специальных сортов стекла. В микроэлектронике бор используется в качестве полупроводника, применяется для легирования полупроводниковых материалов. Белый графит служит изолятором и твердой высокотемпературной смазкой. Боразон применяют как сверхтвердый материал в буровых работах, при обработке металлов. Бориды применяют для изготовления высокоогнеупорных деталей.
Борная кислота применяется в медицине. Тетраборат натрия Nа2В407 (бура) используется в качестве флюса при пайке, т.к. в расплаве этой соли хорошо растворяются оксиды металлов с образованием метаборатов:
Na2B4O7 + CuO2NaBO2 Cu(BO2)2.
2.2 Алюминий
Второй типический элемент III группы периодической системы. Алюминий является первым и самым легким р-металлом. У алюминия по сравнению с бором атомный радиус больше, а потенциал ионизации меньше; следовательно, возрастают его металлические свойства. В отличие от неметалла бора алюминий является амфотерным элементом. Алюминий и его гидроксид растворяются в кислотах и щелочах. Для химии алюминия исключительно важное значение имеет его большое сродство к кислороду, в таблице 8 приведены значения энтальпий и энергий Гиббса образования оксидов алюминия и его аналогов.
Таблица 8
Термодинамические параметры оксидов IIIА группы
|
Параметр |
А12О3 |
Gа2О3 |
In2O3 |
Тl2О3 |
|
H0298, кДж/моль |
-1675.7 |
-1089.1 |
-925.9 |
-390.4 |
|
G0298, кДж/моль |
-152.4 |
-998.3 |
-831.3 |
-321.3 |
И энтальпия, и энергия Гиббса образования алюминия резко отличаются от таковых для галлия и его аналогов, что указывает на его высокую устойчивость. И, наконец, для алюминия наблюдается горизонтальная аналогия с кремнием. Отчетливо проявляется она в алюмосиликатах, наиболее распространенных в земной коре химических соединений.
Природные ресурсы. Алюминий - один из самых распространенных на земле элементов, занимает третье место по распространенности после кислорода и кремния. Алюминий входит в состав 250 минералов, главным образом алюмосиликатов, из которых образована земная кора; продуктом их разрушения является глина А12О32SiO22Н2O (каолинит). Обычно глина содержит примесь соединений железа, придающую ей бурый цвет. Иногда встречается белая глина, без примесей железа. Техническое название А12O3 – глинозем. Для добычи алюминия используют минералы: боксит А12O3Н2O, а также нефелин Na2OAl2O32SiO2, криолит Na3[AIF6]. Встречается чистый А12O3 - корунд. В зависимости от содержания примесей корунд имеет различную окраску и названия. Драгоценные камни рубин и сапфир - это кристаллы корунда, окрашенные примесью оксида хрома (рубин) и оксидов титана и железа (сапфир).
Алюминий получают электролизом расплава смеси глинозёма с криолитом. Расплав A2O3 в криолите Na3[AF6] подвергают электролизу при 950оС и напряжении 6-7 B. Протекаемые процессы:
Al2O3 = 2A3+ + 3O2- (диссоциация на ионы);
на катоде: A3++3e = A;
на аноде: 2O2-- 4e =O2.
Особо чистый алюминий, необходимый, например, в электронной технике, получают специальными методами: вакуумной дистилляцией или зонной плавкой.
Физические и химические свойства алюминия. Алюминий - серебристо-белый металл. Очень мягок, легко вытягивается в фольгу. Кристаллизуется в ГЦК - структуре. По электрической проводимости занимает четвертое место после серебра, золота и меди. На воздухе покрывается тончайшей пленкой (10-5мм) Al2O3, отличающейся большой прочностью. Защитная пленка надежно предохраняет металл от дальнейшего окисления. Почти все реакции с участием алюминия идут с латентным (скрытым) периодом, необходимым для разрушения оксидной пленки или диффузии реагента через нее.
С пниктогенами и халькогенами алюминий взаимодействует при высокой температуре. С галогенами, за исключением йода, алюминий непосредственно не реагирует. Концентрированные серная и азотная кислоты пассивируют его, поэтому он в них не растворяется. Алюминий растворяется в соляной кислоте и в растворах щелочей:
2А + 6НС = 2АС13 + ЗН2,,
2A + 2NaOH + 6H2O = 2Na[A (OH)4] + 3H2..
Алюминий, лишенный защитной пленки, энергично взаимодействует с водой:
2А + 6Н2O = 2А (ОН)3 + 3H2.
Химическая связь в соединениях алюминия обладает большей долей ионности, чем в соединениях бора. Так, ВF3-газ, АF3-твердое соединение с высокой температурой плавления, его вполне можно назвать солью; галогениды АС13, АВг3, АI3 обнаруживают свойства, промежуточные между свойствами галогенидов неметаллов и солей.
Ион A3+, имеющий малый радиус и большой заряд, проявляет склонность к комплексообразованию, причем у алюминия она больше, чем у магния, и меньше, чем у бора. Алюминий образует прочные комплексы с H2O, OH-, F-; как все s- и р- элементы не дает прочных комплексов с аммиаком и его производными. При комплексообразовании в химическую связь могут вносить вклад свободные d- орбитали атома алюминия. Этим объясняется возможность образования комплексов с К.Ч.=6, например, [А(Н2O)6]3+ (sp3d2 -гибридизация).
Соединения. Алюминий не вступает в реакцию с водородом. Гидрид алюминия получают косвенным путем, действуя гидридом лития в эфирном растворе на А1С13:
AC3 + 3LiH AH3 + 3LiC.
Гидрид алюминия АlН3 - белый порошок; это полимерное соединение (А1Н3)n. Если предыдущую реакцию провести с избытком LiH, то получаем тетрагидроалюминат лития:
AC3 + 4LiHLi[AlH4] + 3HC.
Li[AlH4] сильный восстановитель, бурно реагирует с водой с выделением водорода:
Li[AH4] + 4H2OLiOH + A (OH)3 + 4H2.
При нагревании алюминий энергично взаимодействует с кислородом:
4А (г) + 3O2(г) = 2А2O3(к); G° = -3164 кДж.
Оксид алюминия Аl2О3- очень твердое, тугоплавкое, химически стойкое соединение (Tпл=2072оC, Ткип= З500оС), разрушается лишь при длительном нагревании с кислотами или щелочами:
А2O3 + 6НС = 2АС3 + ЗН2O,
A2O3 + 2NaOH = 2NaA1O2 + H2O.
В щелочных растворах образуются гидроксоалюминаты:
A2O3 + 2NaOH + 7H2O = 2Na[A (OH)4(H2O)2].
Гидроксид алюминия А (ОН)3 амфотерное соединение, ему соответствуют два типа солей: соли алюминия (III), например, A2(SO4)3, АС3 , и алюминаты - соли алюминиевых кислот. В водных растворах алюминаты существуют в виде гидроксокомплексов, например, К[А(ОН)4], в расплавах в виде cолей несуществующей в свободном состоянии метаалюминиевой кислоты, например, КАO2. Схему равновесия в насыщенном водном растворе А1(ОН)3 можно представить следующим образом:
A3++3ОHA (OH)3 H[A (OH)4]H++[A (OH)4]-
раствор осадок раствор
Добавление кислоты (Н+) приводит к смещению равновесия в сторону образования катиона Al3+ (солей алюминия катионного типа):
А (ОH)3 + ЗН+ = A3+ + ЗH2O.
Добавление щелочи (ОН-) - в сторону образования анионов (солей алюминия анионного типа):
А (ОН)3 + ОН- = [A (OH)4]- .
Соли алюминия в водных растворах сильно гидролизованы. Реакция среды зависит от типа растворенной соли:
A3+ + H2OAOH2+ + Н+ рН < 7.
Соли А3+ и слабых кислот гидролизуются полностью с образованием осадков гидроксида алюминия или гидроксосолей алюминия:
A (СН3СОО)3+2Н2OAOН(СН3СОО)2++А (ОН)2СН3СОО+ СН3СООН.
Вследствие сильного гидролиза многие соли алюминия не удается выделить из водных растворов (например, сульфид, карбонат, цианид и др.):
А2S3 + 6H2O = 2А(OH)3 + 3H2S
Соли алюминия и кислородосодержащих кислот растворимы в воде. Исключение составляет фосфат алюминия АРО Образование малорастворимого фосфата играет важную роль в жизнедеятельности организмов. Усвоение фосфора организмом уменьшается в присутствии катионов А3+ вследствие образования в кишечнике малорастворимого фосфаталюминия. Это обстоятельство необходимо учитывать при назначении препаратов алюминия, например средства против повышенной кислотности желудка А(ОН)3.
В желудке гидроксид алюминия образует гель, который нейтрализует ионы гидроксония желудочного сока:
A(ОН)3 + 3Н3О+ = A3+ + 6Н2О
Перешедшие в раствор ионы алюминия в кишечнике переходят в малорастворимую форму – фосфат алюминия:
A3+(р) +РО43–(р) = AРО4(т)
В живых организмах с биолигандами (оксикислотами, полифенолами, углеводами, липидами) алюминий образует хелатные комплексные соединения. Как правило, связи с органическими лигандами он образует через атомы кислорода. например, при взаимодействии A3+ с полифенолами получаются комплексные соединения следующего состава:
В стоматологической практике находят широкое применение соединения алюминия, например, белая глина (каолин) A2О3 SiO2 2H2O. Каолин входит в состав цементов, которые используют как временный пломбировочный материал, а также для штамповки коронок.
С сульфатами металлов в степени окисления +1 сульфат алюминия образует двойные соли типа Ме2SO4А2(SO4)312Н2O. Эти соединения получили название алюминиевых квасцов. Квасцы в твердом состоянии устойчивы, а в растворах диссоцированы на составляющие ионы. Квасцы хорошо растворимы в воде и кристаллизуются из растворов, образуя большие октаэдрические кристаллы.
Гидроксид алюминия получается в виде аморфных осадков. Кристаллический A(ОН)3 можно получить, пропуская СО2 через щелочные растворы алюмината натрия:
2 Na[A(OH)4(H2O)2] + 2CO2 = 2A(OH)3 + 2naHCo3 + 4H2O
Применение. Алюминий - второй (после железа) металл по объему производства и применения в технике. Используют как чистый алюминий, так и его сплавы. Сплав - дюралюминий, содержащий 4%(масс.) Сu, 1,5% Mg , 0,5% Mn - основной конструкционный материал в самолетостроении. Большое количество алюминия идет на изготовление проводов. Из алюминиевых сплавов был изготовлен первый искусственный спутник Земли. Благодаря высокому сродству с кислородом алюминия, возможен процесс алюмотермии - выделение металлов из их оксидов при действии алюминия. Алюмотермию используют для лабораторного получения многих металов (Mn, Cr, V, W, и др.), в ряде случаев в промышленности (получение Sr, Ba, и др.)
Из оксида алюминия изготовляют огнеупорную и химически стойкую керамику. В больших количествах выращивают монокристаллы чистого А2О3 с добавками примесей (искусственные рубины и сапфиры). Из них изготавливают лазеры и подшипники для точных механизмов.
Соединения алюминия входят в состав многих продуктов силикатной промышленности (цемент, фарфор, керамика). Квасцы применяют в кожевенной и в текстильной промышленности. Сульфат алюминия применяют для очистки воды. В основе первого этапа водоочистки используется реакция:
А2(SO4)3 + ЗСа(НСО3)2ЗСаSO4 + 2А (ОН)3 + 6СO2 .
Образующиеся хлопья гидроксида алюминия увлекают в осадок различные примеси. Хлорид алюминия и гидроалюминат лития используют в органических синтезах.
Из кристаллогидратов солей алюминия в медицинской практике находят применение алюмокалиевые квасцы КA(SO4)2 12H2O и жженые квасцы КA(SO4)2 которые получают нагреванием алюмокалиевых квасцов при температуре не выше 433 К.
Жженые квасцы используют в виде присыпок как вяжущее и высушивающее средство. Осушающее действие связано с тем, что жженые квасцы медленно поглощают воду:
КA(SO4)2 + xH2O = KA(SO4)2 xH2O
Фармакологическое действие солей алюминия основано на том, что ионы A3+ образуют с белками (протеинами Pr) комплексы, выпадающие в виде гелей:
A3+ + Pr APr
Это приводит к гибели микробных клеток и снижает воспалительную реакцию.
Квасцы применяют для полосканий, промываний и примочек при воспалительных заболеваниях слизистых оболочек и кожи. Кроме того, этот препарат применяют как кровоостанавливающее средство при порезах (свертывающее действие).
2.3 Подгруппа галлия
Несмотря на то, что элементы подгруппы галлия - типовые аналоги, наблюдаются особенности в свойствах отдельных ее представителей. Галлий непосредственно следует за первой десяткой переходных 3d-металлов, для которых особенно сильна d-контракция, поэтому атомный радиус галлия не только меньше его более тяжелых аналогов, но и алюминия, вследствие этого другие энергетические характеристики отличаются от его аналогов.
Природные соединения. Галлий, индий, таллий, в отличие от алюминия, - редкие и рассеянные элементы. Они входят в качестве примеси в различные руды. Практически существует один минерал галлия - галлит CuGaS2, редко встречающийся. Галлий сопутствует алюминию и цинку. Индиевые руды рокезит CuInS2 и индит FeInS2 встречаются тоже очень редко. Основным сырьем для получения таллия являются полиметаллические руды.
Получение. Соли и оксиды Ga, In, T выделяют путем переработки отходов производства алюминия и извлечения соединений этих металлов из полиметаллических руд. Свободные металлы получают электролизом подкисленных водных растворов из солей или восстановлением их оксидов углем или водородом. Выделенные металлы очищают зонной плавкой или методами амальгамной металлургии.
Свойства. Существование галлия - экаалюминия было предсказано Д.И.Менделеевым в 1870г, а также «вычислены» основные свойства этого элемента. В 1875г. французский химик Лекок де Буабодран открыл и выделил этот элемент. В свободном состоянии галлий, индий, таллий - серебристо-белые металлы. Галлий хрупкий, а индий и таллий очень мягкие металлы. Галлий и индий на воздухе устойчивы, в отличие от таллия, который во влажной атмосфере покрывается слоем гидроксида и быстро разрушается. Уникальная среди металлов кристаллическая решетка галлия, состоящая из атомных пар Ga2, обуславливает необычные свойства металлического галлия. Для него характерна низкая температура плавления, меньшая плотность кристаллов по сравнению с жидкостью, большая склонность к переохлаждению. Галлий - вещество с очень большим температурным интервалом существования жидкой фазы. В парах галлий одноатомен.
Галлий, индий, таллий - химически активны. По отношению к различным окислителям они проявляют индивидуальные особенности. Галлий напоминает алюминий (особенно по отношению к щелочам); в HNO3 растворяется медленно, хорошо растворяется в НС1 и H2SO4; таллий хорошо растворяется в HNO3:
T + 4HNO3 = T (NO3)3 + NO + 2H2O,
а в НС1 и Н2SO4 медленно из-за пассивирующих пленок ТС и T2SO При растворении в кислотах галлий и индий ведут себя как трехвалентные металлы, а таллий образует соли ТI+; т.к. ион Tl3+ неустойчив:
2Ga + 6HC = 2GaC3 + 3H2,
2Т + 2НС= 2ТС+ Н2
Галлий и индий взаимодействует со щелочами с образованием галлатов и индатов с выделением водорода, причем галлий реагирует быстро, а индий – медленно.
2Ga + 6NaOH + 6H2O = 2Na3[Ga(OH)6] + ЗH2 .
С водородом галлий, индий и таллий не реагируют. Косвенным путем можно получить легко разлагающиеся гидриды: Ga2H6 (жидкость) и GaН3, InН3 (полимеры, аналогичные АIН3). При нагревании галлий, индий и таллий образуют оксиды типа Ме2O3 и соответствующие гидроксиды Ме(ОН)3 (табл.9).
Повышение устойчивости низких степеней окисления в ряду Ga-In-TI показывает следующая закономерность: Gа2O3 плавится без разложения, Iп2O3 разлагается при нагревании выше 850°С, Т2О3 начинает отщеплять кислород при 90°С, превращаясь в ТI2О.
С увеличением атомного номера возрастает интенсивность окраски: Ga2O3- белый, In2O3-светло-желтый, T2O3- коричневый. Этот факт указывает на усиление доли ионности в оксидах с ростом атомной массы элемента. Ga2O3 - изоструктурен корунду, а In2O3 и T2O3 кристализируются в решетке типа О.Ц.К. Взаимодействие со щелочами в указанном ряду ослабевает: Ga2O3 растворяется в растворах щелочей хорошо, образуя гидроксогаллаты, T2O3 практически не растворяется:
Ga2O3 + 2NaOH +3H2O = 2Na[Ga(OH)4] .
В расплавах щелочей образуются безводные галлаты:
Ga2O3 + 2NaOH = 2NaGaO2 + H2O.
Гидроксоиндаты Na3[In(OH)6] образуются только при большем избытке щелочи. При действии воды галлаты и индаты полностью гидролизуются:
NaGaO2 + 2HOH = NaOH + Ga(OH)3 .
Гидроксиды Ga(OH)3, In(OH)3, T(OH)3 получают действуя растворами щелочей на растворы соответствующих солей. Гидроксид галлия растворяется в сильных кислотах и основаниях. Он является редким примером идеального амфолита, для которого кислотные и основные свойства выражены практически в равной мере. Для обезвоживания Ga(OH)3 требуется нагревание, а TI(OH)3 самопроизвольно теряет воду при комнатной температуре, о чем свидетельствуют значения G0298:
2Ga(OH)3(k) = Ga2O3(k) + 3H2O(r); G0298 = - 8 кДж ,
2T (OH)3(k) = T2O3(k) + 3H2O(r); G0298 = -117 кДж.
Таблица 9
Кислородосодержащие элементы подгруппы галлия
|
Элемент: |
Оксиды |
Гидроксиды |
Соли |
|||
|
Формула |
Характер |
Формула |
Название |
Ион |
Название |
|
|
Ga, галлий |
Ga2O3 |
Амфотерный |
Ga(OH)3 H3GaO3 H3[Ga(OH)6] |
Гидроксид галия, Галлиевая кислота Гексогидроксогаллат водорода |
Ga3+ GaO33- [Ga(OH)6]3- |
Соли Галлаты Гексагидроксо- галлаты |
|
In, индий |
In2O3 |
Амфотерный |
In(OH)3 H3InO3 H3[Jn(OH)6] |
Гидроксид индия, Индиевая кислота Гексогидроксоиндат водорода |
In3+ InO33- [In(OH)6]3- |
Соли Индаты Гексогидроксо- индаты |
|
Окончание таблицы 9 |
||||||
|
Элемент: |
Оксиды |
Гидроксиды |
Соли |
|||
|
Формула |
Характер |
Формула |
Название |
Ион |
Название |
|
|
T, таллий |
T2O T2O3 |
Основной |
T (OH) T (OH)3 |
Гидроксид таллия (1), Гидроксид таллия (III) |
T+ T3+ |
Соли таллия(I) Соли таллия(III) |
Оксид T2O3 в отличие от своих аналогов разлагается при 100оС: и окисляет НС до С2: T2O3 + 6НС = 2ТС+3Н2О +2С2.
T2O получают прямым окислением металла на воздухе при небольшом нагревании. TI2O - порошок черного цвета; в расплавленном состояниии - желтый, легко растворяется в воде с образованием щелочи, то есть ведет себя как оксид щелочного металла. Расплав TI2O разрушает силикаты – стекло, фарфор. Такое же действие оказывает и растворTOH (сильная щелочь). Гидроксид ТОН получают по реакции обмена: гидроксид таллия (I) поглащает угдлекислый газ:
2TOH + СО2 = T2СО3 + Н2О
T2СO3 + СО2 + Н2О = 2TНСО3
При комнатной температуре Ga, In, T реагируют с галогенами F2, C2, Br2, а при нагревании с I2. В результате образуются галогениды ЭГ3. По свойствам GaГ3 ближе к галогенидам неметеллов, а InГ3 и TГ3 к солям.
Известно много солей Ga+3, In+3, T+3, большинство из них хорошо растворимы в воде. Ионы Ga3+, In3+ бесцветны , T3+ имеет светло-желтую окраску. Все соли рассматриваемых металлов Э3+ подвержены гидролизу. Халькогениды известны для галлия и индия. Для таллия известен сульфид T2S3, который может быть получен сухим путем. Гидроксид TOH получают по реакции обмена:
TSO4 + Ba(OH)2 = BaSO4 + 2TOH
Применение. Металлический галлий и индий используются в вакуумной технике: галлий для жидкометаллических затворов (заменяющих ртутные), в качестве уплотняющих прокладок в аппаратах, где создается высокий вакуум. Галлий можно использовать для изготовления оптических зеркал, отличающихся высокой отражающей способностью.
Разнообразные применения имеют полупроводниковые материалы элементов подгруппы галлия (GaAs, GaSb, InAs, InSb, Т12S3 и др.). Эти полупроводники работают в фотоэлементах и в фотосопротивлениях, воспринимающих инфракрасное излучение.
2. Биологическая роль р-элементов IIIА-группы
Бор. Бор относится к примесным микроэлементам, его массовая доля в организме человека составляет 10-5%. Бор концентрируется главным образом в легких (0,34 мг), щитовидной железе (0,30 мг), селезенке (0,26 мг), печени, мозге (0,22 мг), почках, сердечной мышце (0,21 мг). Биологическое действие еще недостаточно изучено. Известно, что бор входит в состав зубов и костей, в виде труднорастворимых солей борной кислоты с катионами металлов.
Избыток бора вреден для организма человека. Имеются данные, что большой избыток бора угнетает амилазы, протеиназы, уменьшает активность адреналина. Предполагается, что снижение активности адреналина, являющегося производным полифенола, связано с его взаимодействием с отоборной кислотой.
Давно известно, что бор необходим высшим растениям, однако данные о его биологической роли противоречивы.
Исследования, проведенные в последние годы, показали, что бор является необходимым для некоторых животных. Установлено, что бор участвует в углеродно-фосфатном обмене, взаимодействует с рядом биологически активных соединений (углеводами, ферментами, витаминами, гормонами). Вместе с тем употребление пищевых продуктов с большим содержанием бора нарушает в организме обмен углеводов и белков, что приводит к возникновению эндемических кишечных заболеваний – энтеритов.
Алюминий. По содержанию в организме человека (10-5%) алюминий относится к примесным микроэлемен6там. Алюминий концентрируется главным образом в сыворотке крови, легких, печени, костях, почках, ногтях, волосах, входит в структуру нервных оболочек мозга человека.
Суточное потребление алюминия человеком составляет 47 мг. Алюминий влияет на развитие эпителиальной и соединительной тканей, на регенерацию костных тканей, влияет на обмен фосфора.
Алюминий оказывает действие на ферментативные процессы. В большинстве случаев катион A3+ замещает ионы Э2+ - активаторы ферментов Е, например, ионы Mg2+, Са2+:
Э2+Е + A3+ = Э2+ + A3+Е
Такая взаимозамещаемость возможна вследствие сходства ряда свойств ионов A3+ и Mg2+, Са2+. Избыток алюминия в организме тормозит синтез гемоглобина, так как благодаря довольно высокой комплексообразующей способности алюминий блокирует активные центры ферментов, участвующих в кроветворении.. Имеются данные, что алюминий может катализировать реакцию трансаминирования (перенос NH2-группы.)
Галлий. Галлий – примесный микроэлемент (содержание в организме человека 10–6 – 10–5%). Биологическая роль галлия в живых организмах почти не выяснена.
Индий. В настоящее время биологическое действие индия неизвестно, не имеется достоверных сведений о его наличии в живых организмах. Учитывая близость атомного строения и физико-химических свойств индия и галлия, можно прогнозировать сходство их биологического действия. Очевидно индий, как и алюминий, попадая в организм должен накапливаться в костной и других тканях в виде малорастворимого фосфата.
Таллий. Таллий относится к весьма токсичным элементам. Ион Tl+ склонен, подобно Ag+, образовывать прочные соединения с серосодержащими лигандами:
Tl+ + R – SH R – S – Tl + H+
Вследствие этого он токсичен, так как подавляет активность ферментов, содержащих тиогруппы – SH. Даже весьма незначительные количества соединений Tl+ при попадании в организм вызывают выпадение волос.
Вследствие близости радиусов К+ и Tl+ (r = 11 пм) они обладают сходными свойствами и способны замещать друг друга в ферментах. Ионы Tl+ и К+ являются синергистами. Этим объясняется тот факт, что ферменты пируваткиназа и диолдегидратаза активируются не только ионами К+, но ионами Tl+ (ион Tl+ замещает К+ в каталитическом центре ферментов). Синергизм таллия и калия проявляется и в том, что подобно ионам К+, ионы Tl+ накапливаются в эритроцитах.
В качестве противоядия при отравлениях ионами Tl+ используют серосодержащий лиганд – аминокислоту цистин HS–CH2CH(NH2)COOH.
В заключение необходимо отметить, что биологическая роль р-элементов IIIА-группы изучена недостаточно. В настоящее время известно, что бор и галлий взаимодействуют в растениях с ингибиторами их развития полифенолами, уменьшая токсичность последних. Установлена также несомненная роль алюминия в построении эпителиальной и соединительной тканей, а кроме того его участие в ферментативных процессах как в качестве активатора, так и в качестве ингибитора. Свойством ингибировать многие серосодержащие ферменты обладает ион Tl+.
Биологическая активность р-элементов IIIА-группы связана главным образом с их способностью к образованию комплексных соединений с кислородосодержащими лигандами и нерастворимых фосфатов.
3 Элементы IVА группы (подгруппа углерода)
3.1. Общая характеристика элементов IVА группы
Четвертая главная группа периодической системы включает два типических элемента углерод и кремний, и элементы: германий, олово свинец (подгруппа германия). Углерод является основой органической химии, главным органогенным элементом, необходимым компонентом организма всех живых существ. Второй типический элемент – кремний- основной элемент неорганической химии и всей неживой природы. Кремний и германий – доминирующие полупроводниковые материалы. Интегральные схемы на основе кремния и германия являются основой компьютеров, микропроцессоров и т.д.
Все элементы этой подгруппы содержат по четыре валентных электрона – это ns2np2 электроны. Это число валентных электронов является оптимальным для возникновения тетраэдрических связей по обменному механизму. Некоторые физико-химические константы данных элементов подгруппы приведенные в табл.10.
В пределах IVА – группы наблюдается зависимость свойств от положения элемента. Так, ОЭО германия больше, чем кремния, хотя первый потенциал ионизации германия меньше. Это объясняется существованием у атома германия в отличие от кремния, заполненного внутреннего 3d10 – уровня, который служит экраном для р-электронов. В ряду C – Si – Ge – Sn – Pb энергия ионизации уменьшается и увеличивается атомный радиус, то есть усиливаются металлические свойства. Первые два элемента – типичные неметаллы, кремний и германий – полуметаллы. Свинец типичный – металл. Все элементы проявляют степень окисления: +4, +2, причем, сверху вниз устойчивость высокой степени окисления уменьшается, а низкой возрастает. У соединений элементов со степенью окисления (+4) в ряду от углерода к свинцу усиливаются окислительные свойства, а у соединений со степенью окисления (+2) ослабляются восстановительные свойства. Например, германий и олово в степени окисления (+2) являются сильными восстановителями, у соединений Ge (+2) восстановительные свойства настолько сильны, что в отсутствие окислителя они диспропорционируют. Для свинца степень окисления (+2) является наиболее устойчивой, а соединения Pb (+4) – сильные окислители.
Таблица 10
Свойства элементов подгруппы углерода
|
Свойства |
С |
Si |
Ge |
Sn |
Pb |
|
Атомный радиус, нм |
0,077 |
0,118 |
0,139 |
0,158 |
0,175 |
|
Ионный радиус Э-4,нм |
0,260 |
0,271 |
0,272 |
0,294 |
0,313 |
|
Ионный радиус Э+4, нм |
0,015 |
0,041 |
0,053 |
0,071 |
0,084 |
|
Потенциал ионизации I, В ЭЭ0 + е |
11,26 |
8,15 |
7,899 |
7,344 |
7,417 |
|
ОЭО |
2,6 |
1,9 |
2,0 |
1,8 |
1,7 |
|
Ширина запрещенной зоны, ЭВ |
5,2 (алмаз) |
1,21 |
0,78 |
0,08 (-Sn) |
_ |
|
Температура плавления, 0С |
3247 |
1414 |
937 |
231,9 |
327,4 |
|
Температура кипения, 0С |
3927 |
3249 |
2847 |
2337 |
1751 |
|
Плотность, г/см3 |
3,51 (алмаз) |
2 |
5,72 |
6,7 |
9,8 |
|
Е (Э3+р-р/Э), В |
– |
– |
–0,2 |
–0,136 |
–0,126 |
|
Степень окисления |
-4,+2,+4 |
4,+2,+4 |
-4,+2,+4 |
-4,+2,+4 |
+2,+4 |
3.2 Углерод и его соединения
Природные ресурсы. Содержание углерода в земной коре составляет 0,1%. Встречается как в свободном виде (алмаз, графит), так в связанном состоянии (диоксид углерода, карбонаты, нефть, природный газ, сланцевое масло, битумы).
В зависимости от числа –связей координационное число углерода равно четырем (sp3 – гибридизация), трем (sp2 – гибридизация), или двум (sp – гибридизация) валентных орбиталей:
|
Характер гибридизации орбиталей атома углерода |
Пространственное расположение –связей |
Примеры соединений |
|
sp3 |
Тетраэдрическое |
Алмаз, СН4, С(На)4 |
|
sp2 |
Треугольное |
Графит, С6Н6 |
|
sp |
Линейное |
Карбин, СО2, СS2 |
В соответствии с характерными гибридными состояниями орбиталей атомы углерода могут объединятся в полимерные образования координационной (sp3), слоистой (sp2) и линейной (sp) структуры.
Этому соответствует три простых типа веществ: алмаз, графит, карбин. В продуктах конденсации паров графита выделена новая модификация углерода – фуллерен.
Алмаз (sp3) - кристаллическое вещество с атомной координационной решеткой, обладающее большой твердостью и значительной плотностью. Он тверже всех веществ. Его широко используют для резки стекол, бурения горных пород, шлифования особо твердых материалов. Образцы его в чистом виде сильно преломляют свет (светятся). При специальной огранке прозрачных кристаллов получают бриллианты. Это самый дорогой из драгоценных камней. Массу алмаза выражают в каратах (1 карат соответствует 0,2 грамма). Стоимость алмаза растет пропорционально квадрату его массы.
При sp2 гибридизации образуется плоская структура графита. Графит - черно-серое кристаллическое вещество со слабым металлическим блеском. Расстояние между слоями очень велико (0,335 нм), а межмолекулярные силы между слоями в графите очень малы. Графит расщепляется на тонкие чешуйки, которые сами по себе очень прочны и легко прилипают к бумаге. Графит тугоплавок, из него готовят тигли для металлургии. В ядерных реакторах графит используют в качестве замедлителя нейтронов. Встречается в виде залежей (Алтай), получается из кокса. Переход графита в алмаз осуществляется при температуре 1800 °С и давлении 6 ГПа в присутствии растворителей (расплавленный FeS, Та, Ni и др.).
При sp гибридизации образуется карбин, открытый в 1963 году, позднее обнаруженный в природе. Карбин получают путем каталитического окисления ацетилена. Карбин - мелкокристаллический порошок черного цвета. Кристаллы карбина состоят из линейных цепочек углеродных атомов, соединенных чередующимися одинарными и тройными связями:
- - С С - С С - . . . (- С С -) n
По твердости карбин превосходит графит, но уступает алмазу. Обладает полупроводниковыми свойствами. При нагревании (Т=2880°C) без доступа воздуха превращается в графит.
К разновидностям графита относят сажу и древесный уголь. Уголь получается при термическом разложении углеродистых соединений. Уголь представляет собой тонко измельченный графит. Древесный уголь получается при обугливании древесины. Уголь (особенно древесный) содержит большое количество пор, поэтому обладает большой адсорбционной способностью. Адсорбцией называется свойство угля и других твердых тел удерживать на своей поверхности пары, газы и растворенные вещества. Вещества, на поверхности которых происходит адсорбция, называются адсорбентами. Если пропустить через растертый уголь чернила (уголь - адсорбент, чернила - адсорбат), то они обесцвечиваются. В технике в качестве адсорбентов применяются алюмосиликаты. В медицине таблетки из активированного угля используют для удаления вредных веществ.
Химические свойства. При обычной температуре углерод весьма инертен, при определенных условиях проявляет окислительные и восстановительные свойства. Окислительные свойства проявляются в реакциях:
4А1 + 3 = Al4+3С3-4 (карбид А) ;
СаО + 3С = С+2О + СаС2 (карбид Са);
С + 2Н2 = С-4H4 (метан).
Восстановительные свойства для угля более характерны:
С° + О2 = СО2 .
Уголь восстанавливает Fe, Cu, Zn, Pb и другие металлы из их оксидов, например:
2ZnO + С° = 2Zn + С+4О2 .
При высоких температурах углерод взаимодействует с кислородом, азотом, галогенами и многими другими металлами.
Оксид углерода (II) СО образуется в процессе сгорания угля при недостатке кислорода:
2С + O2 = 2СО.
В молекуле монооксида тройная химическая связь, поэтому СО характеризуется низкой температурой плавления и малой растворимостью в воде. В промышленности СО получают пропусканием диоксида углерода над раскалённым углём при высокой температуре:
СО2 + С = 2СО.
Вследствие протекания этой реакции выхлопные газы автомобилей содержат СО, также содержат СО, отходящие газы печей при плохой тяге.
В лаборатории оксид углерода СО получают, добавляя по каплям муравьиную кислоту к концентрированной серной кислоте, которая отнимает от неё воду:
НСООН 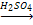 СО + Н2О.
СО + Н2О.
Щавелевая кислота при нагревании с серной кислотой даёт смесь двух оксидов:
Н2С204 = СО + С02 + Н2О.
Смесь полученных газов пропускают через раствор гидроксида бария, который поглощает только CO2.
Физиологическое действие. Монооксид углерода очень ядовит, смертельная доза СО в воздухе 0,2%. С гемоглобином крови СО связывается прочнее, чем кислород, тем самым блокируя перенос кислорода в организме. Признаки отравления малыми дозами: кровь необычно яркой окраски, сильная головная боль, иногда потеря сознания.
Свойства. Оксид углерода (СО) - бесцветный газ, тяжелее воздуха, мало растворим в воде. Поглощается активированным углём, а также фильтрующим слоем, содержащим I2O5. Оксид углерода при обычных температурах химически инертен, однако при участии катализаторов реагирует с водородом с образованием углеводородов. Из-за наличия неподеленных пар у углерода и кислорода монооксид углерода является лигандом и образует прочные комплексы с переходными металлами, например, [Ni(CO)4], [Co2(CO)9], [Fe(CO)5]. При высоких температурах СО восстанавливает многие металлы из их оксидов:
CO + CuO = Cu + CO2.
Это свойство оксида углерода (II) используется при выплавке металлов из руд. Соединяясь с серой, образует тиооксид:
СО + S = COS.
Соединяясь с хлором, образует фосген:
СО + C2 = СОС2 .
Фосген (СОС2) - бесцветный газ со слабым сенным запахом. Очень ядовит, в первую мировую войну его использовали как удушающее и отравляющее средство. Фосген медленно гидролизуется водой с образованием соляной и угольной кислот:
СОС2 + 2НОН = Н2СО3 + 2НС.
Диоксид углерода СO2 - образуется в природе при сгорании и гниении органических веществ. В воздухе его концентрация составляет 0,03%, содержится он также во многих минеральных источниках (нарзан, боржоми). Атмосфера Венеры на 95% состоит из СО2. Диоксид углерода ассимилируется в процессе фотосинтеза зелеными растениями с помощью имеющегося у них хлорофилла; при поглощении солнечной энергии в растениях образуются органические вещества (в первую очередь глюкоза), а кислород освобождается и выделяется в атмосферу. Поглощенная энергия при диссимиляции в живых организмах животных и растений снова высвобождается. Диссимиляция органических веществ в организмах - это процесс их окисления в присутствии ферментов с образованием диоксида углерода и воды:
ассимиляция
6С02 + 6Н2О С6Н12О6 + 6O2 .
диссимиляция глюкозы
Из всей падающей на Землю солнечной энергии 0,12% фотохимически усваивается растениями. Зеленые листья площадью 1 м2 за время освещения 1ч производят 1г виноградного сахара.
Оксид углерода (IV) - бесцветное газообразное вещество, тяжелее воздуха, поэтому его можно переливать из сосуда в сосуд. Не поддерживает горения и дыхания. Зажженная лучина в нем гаснет, человек и животные при больших концентрациях СO2 задыхаются. Часто в опасных количествах он скапливается в шахтах, колодцах. СО2 сжижается при комнатной температуре под давлением 6МПа. В жидком состоянии хранится и транспортируется в стальных баллонах. При понижении температуры кристаллизуется в виде молекулярных кристаллов, которые сублимируются при температуре -78С. Твердый СO2 называется сухим льдом; используется, как хладоагент. Известно, что люди вдыхают воздушную смесь, содержащую 4%СO2. Чистый СO2 действует удушающе, при вдыхании воздуха, содержащего 10%СO2 возникает головокружение и возможна потеря сознания, а при более высоких концентрациях происходит паралич органов дыхания.
Получение диоксида углерода:
а) полное сгорание кокса:
С + O2 = СO2.
Полученный газ очищают, пропуская через раствор К2СОз, в результате происходит реакция:
К2СО3 + СO2 + Н2O = 2КНСО3.
Примеси проходят через раствор, а СO2 выделяют из раствора кипячением (термическое разложение гидрокарбоната):
2КНСОз К2СО3 + СO2 + Н2O,
б) обжиг известняка и других карбонатов:
СаСО3 СаО + СO2.
в) обработка карбонатов (например, мрамора) сильной кислотой:
СаСО3 + 2НС = CaC2 + Н2О + СO2.
г) спиртовое брожение:
С6Н12O6 = 2С2Н5OН + 2СO2.
Диоксид углерода взаимодействует с основными гидроксидами, образуя соли: карбонаты -Na2СО3, (NН4)2СО3 и гидрокарбонаты - Са(НСО3)2, Мg(НСО3)2.
Восстанавливается магнием до углерода:
СO2 + 2Mg = С + 2MgO.
Диоксид углерода - кислотный оксид, при взаимодействии с водой образует угольную кислоту Н2СО3:
СO2 + Н2O Н2СО3.
Равновесие смещено влево, поэтому большая часть растворённого диоксида углерода находится в виде СO2, а не Н2СО3. Угольная кислота при небольшом нагревании разлагается:
Н2СО3 Н2O + СO2.
Это слабая кислота, как двухосновная диссоциирует ступенчато:
Н2СО3 НСО–3 + H+; K1 = 4,210 –7 ,
HСО3 СО32– + H+; К2 = 4,810 –11 .
Соли угольной кислоты называются карбонатами. Существуют средние карбонаты с анионом СО32- и кислые - гидрокарбонаты (NaHCO3). Соли угольной кислоты устойчивы, хотя сама она не устойчива. Большинство карбонатов не растворимо в воде. Растворимы карбонаты щелочных металлов и (NH4)2CO3, ТI2СО3. Гидрокарбонаты в воде растворяются.
При нагревании гидрокарбонаты легко переходят в карбонаты:
2NaHCO3 = Na2CO3 + СО2 + H2O.
При пропускании СO2 через известковую воду происходит помутнение раствора вследствие образования карбоната кальция:
Са(ОН)2 + СO2 = СаСО3 + Н2O .
При длительном пропускании углекислого газа раствор становится прозрачным:
СаСО3 + Н2O + СO2 = Са(НСО3)2 .
Способ обнаружения карбонатов основан на обработке их сильной кислотой и последующим пропускании отходящего газа через баритовую воду.
Соединения. Водородные соединения - углеводороды изучаются в курсе органической химии. При взаимодействии углерода с водородом образуется метан:
C + 2H2 C-4H4+1 .
В лабораторных условиях метан получают нагреванием безводного ацетата натрия со щелочью:
CH3COONa + NaOH CH4 + Na2СО3.
Основным промышленным источником метана является природный газ.
. Дисульфид углерода (сероуглерод) CS2 получают из метана обработкой парами серы при 600 °С с участием катализатора:
СН4 + 4S = CS2 + 2H2S,
или при взаимодействии углерода с серой при повышенных температурах:
C + 2S = CS2.
Сероуглерод CS2 - бесцветная жидкость с запахом редьки, очень быстро улетучивается уже при комнатной температуре. Не растворим в воде. Растворяет жиры, смолы, каучук, серу, фосфор, йод. Ядовит!
Сероуглерод огнеопасен; при поджигании на воздухе сгорает с образованием соответствующих оксидов:
CS2 + 3O2 = 2SO2 + СO2.
Карбамид (мочевина) CO(NH2)2 - диамид угольной кислоты. Карбамид был обнаружен в моче, впервые синтезирован в 1828 г. Его получают по реакции:
t, р
2NH3 + СO2 == СО(NН2)2 + Н2O.
Карбамид - конечный продукт белкового обмена у людей и млекопитающих. Человек ежедневно выделят 20-30 г мочевины. Карбамид применяется в качестве удобрения и как добавка в корма, а также используется в органической химии.
Циан и его производные. Циан, точнее дициан C2N2 (NC-CN), бесцветный газ, ядовит! Сгорает в кислороде; при нормальном давлении температура пламени достигает 4500°С:
С2N2 + 2O2 = 2СO2 + N2.
Циановодород HCN - бесцветная жидкость с характерным запахом горького миндаля. Очень ядовит! Смертельная доза - 50 мг HCN, продолжительность действия несколько секунд, HCN блокирует дыхание и вызывает удушье. Хорошо растворим в воде. Водный раствор HCN называется циановодородной (синильной) кислотой; это слабая кислота.
Цианиды - соли циановодорода, например, цианид натрия NaCN и цианид калия KCN хорошо растворимы в воде. Очень ядовиты (смертельная доза 150 мг); при хранении во влажном воздухе переходят в карбонаты с выделением циановодорода (отравляя атмосферу помещений).
2KCN + Н2O + СO2 = К2СО3 + 2HCN.
В гальванотехнике используются комплексные цианиды: Na3[Cu(CN)4]- тетроцианокупрат (I) натрия, Na2[Zn(CN)4] - тетроцианоцинкат (II) натрия , Na2[Cd(CN)4] - тетроцианокадмат (II) натрия , K[Ag(CN)2] - дицианоаргентат (I) калия , K[Au(CN)2] - дицианоаурат (I) калия.
Тиоционат водорода HCNS (устаревшее название - роданистоводородная кислота) получают при кипячении растворов цианидов с серой:
KCN + S = KCNS.
образует соли - тиоционаты (ранее роданиды).
3.3 Парниковый эффект
Основные антропогенные выбросы оскидов углерода в атмосферу вызваны сжиганием органического топлива на электростанциях, в котельных, промышленных печах и двигателях внутреннего сгорания, а также переработкой руд и получения различных химических продуктов.
Значительная часть вредных атмосферных выбросов обусловлена горением топлива. Продукты горения топлива зависят от его состава и условий сжигания; при этом образуются Н2О, СО2 и СО. Соотношение между СО2 и СО в продуктах горения зависит от соотношения топлива и воздуха. Если подача воздуха недостаточна, то топливо сгорает неполностью, в продуктах горения увеличивается доля CO и сажи. Поступающий в атмосферу монооксид углерода окисляется до СО2.
Оксид углерода (II) может продуцироваться в почвах как биологическим (выделение организмами), так и небиологическим путем. Экспериментально установлено выделение СО за счет фенольных соединений, содержащих группы ОСН3 или ОН. Общий баланс выделения небиологического СО и его окисления микроорганизмами зависит от конкретных экологических условий – влажности и значения рН почвы.
Метан образуется в болотных и очень влажных рисовых почвах. Метан устойчив в восстановительной среде, но при доступе кислорода может окисляться с образованием СО2 и воды.
Попавший в атмосферу диоксид углерода прозрачен для солнечного света, но не пропускает в атмосферу инфракрасное излучение Земли, т.е. ведет себя подобно полиэтиленовой пленке в парнике. В связи с возрастанием темпов сжигания топлива растет концентрация СО2 в атмосфере. Ожидается, что к 2050 г концентрация СО2 удвоится по сравнению с 1978 г., что вызовет повышение температуры на Земле на 2,5 – 3,5 К. Аналогично СО2 на инфракрасное и тепловое излучение воздействует метан и другие углеводороды, которые поступают в атмосферу при добыче и переработке нефти и газа. До некоторой степени «парниковый эффект» компенсируется образованием аэрозолей твердых и жидких частиц. Аэрозоли снижают способность атмосферы пропускать солнечный свет и соответственно снижают среднюю температуру земной поверхности. Тем не менее человечеству необходимо снизить поступление СО2 в атмосферу.
3.4 Кремний и его соединения
В отличие от углерода, кремний встречается в виде одной устойчивой модификации; для кремния также характерна sp3-гибридизация электронных орбиталей. На внешнем электронном слое атома кремния есть валентные 3d-орбитали (3s23p23d0), что отличает структуру внешнего слоя атома кремния от атома углерода (2s22p2). Вакантные 3d-орбитали могут участвовать в образовании связей, что сказывается на свойствах образуемых простых веществ: алмазоподобная модификация углерода - диэлектрик, а алмазоподобная модификация кремния - полупроводник.
Кремний - второй элемент по распространенности в атмосфере Земли (27,6%). Встречается только в связанном виде в различных горных породах и продуктах их выветривания, в виде оксидов и силикатов, из которых на 90% состоит земная кора.
Получение кремния:
1. В лаборатории кремний получают восстановлением диоксида кремния SiO2 магнием:
SiO2 + 2Mg 2MgO + Si.
2. В промышленности для получения кремния, его диоксид восстанавливают углеродом в электрической печи:
SiO2 + 2С Si + 2СО.
3. Кремний высокой чистоты (полупроводниковый) получают восстановлением водородом соединений SiСl4, SiНСl3:
SiСl4 + 2Н2 = Si + 4НСI,
SiНСl3 + Н2 = Si + 3НСI.
а также термическим разложением силана:
SiН4 Si + 2Н2 .
Свойства. Алмазоподобный кремний - темносерое, почти черное вещество с металлическим блеском. Это типичный полупроводник. Кремний тугоплавок, обладает большой твердостью. Химически стоек. При комнатной температуре взаимодействует только с F2, Cl2 и раствором горячей щелочи:
Si + Н2O + 2КOН = К2SiО3 + 2H2.
Кремний растворяется в смеси плавиковой и азотной кислот:
3Si + 4HNO3 + 18НF = 3H2[SiF6] + 4NO +8Н2O.
В приведенных реакциях кремний проявляет восстановительные свойства и степень его окисления в продуктах реакции равна + При взаимодействии с металлами кремний является окислителем:
2Mg + Si = Mg2Si.
Соединения кремния. Кремний не реагирует с водородом. Силаны ( Si n Н2n+2 ), где n = 1-6, получают косвенным путем, так же, как и бораны:
Mg2Si + 2Н2 SО4 SiН4 +2MgSО
Моносилан SiН4 получают окислением гидридоалюмината лития хлоридом кремния:
Si+4Cl4 +Li[AlH4-1] 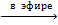 LiСl + Si-4Н4 + АlCl3.
LiСl + Si-4Н4 + АlCl3.
Силаны – легколетучие вещества. Ядовиты. На воздухе они воспламеняются. Они реакционноспособны и являются сильными восстановителями, реагируют с водой при комнатной температуре:
SiH4 + 2 Н2O SiO2 + 4Н2,
в щелочной среде:
SiH4 + 2NaOH + Н2O Na2 SiO3 + 4Н2.
C галогенами кремний реагируют быстро со взрывом:
SiH4 + 2Cl2 SiCl4 + 2Н2.
Подобно углероду, кремний с кислородом образует два оксида: SiO и SiO2. Моноксид SiO в природе не встречается; получить SiO можно восстановлением SiO2 при 1350 – 1500 0С углем:
SiO2 + C = SiO + CO.
При медленном охлаждении SiO диспропорционирует:
2SiO = Si + SiO2.
Твердый SiO – порошок темножелтого цвета, не проводит электрический ток и является прекрасным изолятором; SiО легко растворяется в щелочах:
SiO + 2NaOH = Na2SiO3 + H2, т.е. проявляет восстановительные свойства.
Диоксид кремния SiO2 (кремнезем). Кристаллический SiO2 встречается в виде минерала кварца, который является составной частью песчаников и морского песка. Хорошо образованные кристаллы кварца, часто с окрашивающими его примесями, представляют собой следующие минералы: горный хрусталь (белый, прозрачный), дымчатый кварц или раух-топаз (от серого до коричневого), розовый кварц, аметист (фиолетовый), цитрин (желтый).
Кристалл кварца представляет собой гигантскую полимерную молекулу, состоящую из отдельных тетраэдров, в которых атом кремния окружен четырьмя атомами кислорода, а каждый атом кислорода осуществляет мостиковую трехцентровую связь, являясь общим угловым атомом для двух тетраэдров. Взаимное расположение этих тетраэдров, связанных общими вершинами, может быть различным, что обуславливает существование огромного многообразия структур силикатов.
Наряду с обычными -связями между атомами Si и O возникают еще и нелокализованные -связи, которые образуются по донорно-акцепторному механизму за счет свободных 3d-орбиталей атома кремния и неподеленных 2p-электронных пар атомов кислорода. Подобная структура полимерного диоксида кремния обуславливает ряд свойств кварца, резко отличных от свойств диоксида углерода. Кварц обладает большой твердостью, высокой температурой плавления (1728C) и кипения (2950C), а также химической стойкостью по отношению к другим реагентам. При охлаждении расплава SiO2 образуется стекловодная форма – плавленный кварц или кварцевое стекло. На кварц не действуют никакие кислоты, кроме фтороводородной:
SiO2+4HF SiF4+2H2O,
SiF4+2HF H2[SiF6].
Со щелочами кварц реагирует очень медленно при комнатной температуре, нагревание ускоряет процесс:
SiO2+2NaOHNa2SiO3+H2O.
Будучи нелетучим кислотным оксидом SiO2 при сильном нагревании вытесняет из солей летучие оксиды:
Na2CO3+SiO2 Na2SiO3+CO2.
При сплавлении SiO2 c оксидами металлов образуются соли различных кремниевых кислот - силикаты.
Кремниевые кислоты и силикаты. Кремниевые кислоты не образуются при непосредственном взаимодействии SiO2 и H2O. Они образуются при гидролизе соединений кремния (IV):
SiCl4 + 3H2O H2SiO3 + 4HCl.
Химическая формула кремниевой кислоты H2SiO3 условна, так как в зависимости от концентрации и pH раствора в молекулу кислоты входит переменное число молей SiO2 и H2O. Состав молекулы правильнее выражать формулой nSiO2mH2O. Разный состав имеют и соли – силикаты (табл. 11) .
Таблица 11
|
Состав |
Кислота |
Соль |
n |
m |
|
SiO2H2O=H2SiO3 |
Метакремневая |
Метасиликат |
1 |
1 |
|
SiO22H2O=H4SiO4 |
Ортокремневая |
Ортосиликат |
1 |
2 |
|
2SiO23H2O=H6Si2O7 |
Дикремневая |
Дисиликат |
2 |
3 |
Все кислоты, для которых n1 называются поликремниевыми. В свободном состоянии эти кислоты выделить не удается.
Силикаты составляют 75% массы земной коры. Простейшей структурной единицей всех силикатов является силикат-анион SiO4-4, представляющий собой тетраэдр, в котором четыре атома кислорода образуют связи с атомом кремния. Изолированные тетраэдры содержат некоторые минералы, например, альмандин Fe3Al2(SiO4)3.
В некоторых силикатах одни металлы могут быть замещены на другие металлы. Например, при замещении части алюминия в берилле Be3Al2(Si6O18) на хром желтая окраска изменяется на травянисто-зеленую /изумруд/. Замена части бериллия на Fe3+ приводит к изменению окраски на зеленовато-голубую /аквамарин/.
Многие горные породы содержат цепочечные силикаты, например, пироксены и асбесты. Плоские макроанионы, соединенные вершинами, составляют основу слоистых минералов, например, талька, слюды, каолина. Сложные каркасные структуры характерны для полевых шпатов и цеолитов.
Различают природные силикаты и искусственные. Природные: гранит, кварц, слюда, полевые шпаты, цеолиты.
Обширный класс силикатов составляют алюмосиликаты, которые наряду с атомами кремния содержат атомы алюминия.
Все кремниевые кислоты очень слабые, поэтому растворимые в воде силикаты сильно гидролизованы:
Na2SiO3 + 2H2O = 2NaOH + H2SiO3.
Примерами таких силикатов могут быть полевые шпаты. Из полевых шпатов наиболее распространены: калиевый полевой шпат (ортоклаз) -K2O A2O3 6SiO2 и натриевый полевой шпат (альбит) - Na2O A2O3 6SiO2.
Глины – водосодержащие минералы, образующиеся при выветривании горных пород: A2O3 2SiO2 2H2O (каолин).
Слюды, тальк (3MgO4SiO2H2O), асбесты (3MgO2SiO22H2O) - материалы с волокнистым строением.
Применение. Элементный кремний в больших количествах используется для получения различных сплавов. Добавка к стали 2-4% Si сильно увеличивает ее магнитную проницаемость, получается и трансформаторная сталь, которая применяется для изготовления трансформаторов, электромоторов и генераторов. Чугун, содержащий 15-17% Si, кислотоупорен (образование защитной пленки SiO2), его широко применяют в химическом машиностроении. Кремний (в виде ферросилиция) часто добавляют в сталь при ее выплавке, чтобы удалить содержащийся в металле кислород (образуется SiO2, который уходит в шлак).
Особо чистый кремний применяют для изготовления полупроводниковых устройств (интегральные схемы ЭВМ, солнечные батареи и др.). Разработана технология производства интегральных схем, позволяющая размещать на 1см2 поверхности пластинки, вырезанной из монокристалла кремния, десятки тысяч транзисторов и других радиоэлементов.
Ценными свойствами обладает кварц. Изделия из кварцевого стекла выдерживают нагревание до 1200С и пропускают ультрафиолетовое излучение. Благодаря ничтожно малому коэффициенту термического расширения кварца изделия не растрескиваются, даже если их нагреть до красного каления, а затем опустить в холодную воду. Кварцевая аппаратура используется в лабораториях и на производстве. Сверхчистый кварц применяют для изготовления волоконной оптики и устройств для глубокой очистки веществ.
Большое применение находит и кристаллический кварц, обладающий пьезоэлектрическими свойствами. Широко используют кварцевые ультразвуковые вибраторы и эталоны частоты.
Фторокремниевую кислоту часто используют в качестве дезинфицирующего средства.
Большое применение имеют цеолиты. Это селективные адсорбенты, использующиеся для глубокой осушки и очистки газов (в том числе природного газа), различных органических жидкостей, разделения газовых смесей. Эффективность использования цеолитов обусловлена избирательностью их действия и легкостью регенерации (нагреванием). Цеолиты применяют и в качестве ионообменных веществ, в частности, в водоочистке.
К полимерным соединениям кремния относятся силиконы, скелет которых представлят чередующиеся и связанные друг с другом кремний и кислород.
Исходными веществами для синтеза кремнийорганических соединений (наличие связи Si – C ) являются SiCl4 и SiH Из кремнийорганических соединений получают различные каучукоподобные полимеры, выдерживающие длительное нагревание до +250°С и сохраняющие эластичность даже при -60С, высокопрочные клеи, огнеупорные лаки и эмали, водоотталкивающие вещества для пропитки тканей, электроизоляционные материалы, морозостойкие и жаростойкие силиконовые смазки, пластмассы разнообразного ассортимента, в частности, пригодные для изготовления протезов, работающих внутри человеческого организма.
Стекло. Большое применение имеет стекло. М. В. Ломоносов не ошибся, написав оду об исключительном значении этого материала. Стекло получают при сплавлении силикатов и других соединений. Состав обычного стекла близок к Na2OСаО6Si02. Его получают при 1500°С сплавлением соды, известняка и кварцевого песка:
Na2 CO3 + CaCО3 + 6SiO2 Na2OCaO6SiO2+2CO2,
Na2 SO4 + C + CaCО3 + 6SiO2Na2OCaO6SiO2 + CO2 + CO + SO2.
По второй реакции получается менее чистый продукт, поскольку применяемый для восстановления Na2S04 технический углерод содержит примеси (золу).
Для придания тех или иных свойств в состав стекла вводят добавки: кобальт для придания стеклу розовой, а железо - коричневой или зеленой окраски. Состав стекла может изменяться в широких пределах, поэтому получают стекла с самыми разнообразными свойствами. Отметим лишь некоторые. Замена СаО на РЬО дает стекло с большой плотностью и высоким показателем преломления. Это флинтглас (бытовое название - хрусталь). Частичной заменой СаО на ВаО и SiO2 на В2O3 получают химически стойкое стекло. Тугоплавкое стекло пирекс имеет повышенное содержание SiO2 и В2O3.
Во второй половине прошлого века появились уникальные по свойствам материалы - ситаллы. Это частично закристаллизованные силикатные стекловидные фазы (кристаллы имеют микроскопические размеры; термин «ситалл» представляет собой объединение слов «стекло» и «кристалл»). Ситаллы обладают исключительно высокой механической прочностью и химической стойкостью.
Из стекла готовят стекловолокно и стеклоткань, используемые для теплоизоляции.. Материалы из кварцевого волокна выдерживают температуру выше 1000С в окислительной атмосфере, сохраняя при этом прочность и эластичность.
Водный раствор силиката натрия получил название жидкого стекла. Он используется как клей. Силикат натрия применяют для огнезащитного покрытия древесины, для упрочнения грунта под фундаментами в зоне вечной мерзлоты, в производстве некоторых силикатных материалов. При нагревании жидкое стекло превращается в силикагель, представляющий собой пористую структуру с очень развитой поверхностью. Силикагель служит адсорбентом, осушителем, основой для катализаторов.
Из природных алюмосиликатов производят цемент, керамику, огнеупоры, кирпич, фаянс, фарфор, асбоцементные изделия.
При производстве различных видов керамики алюмосиликаты подвергаются сложным превращениям, приводящим к образованию из пластичного сырья высокопрочных термостойких изделий желаемой формы.
Керамика. С древних времен человечество использует керамику: фарфор, фаянс, черепицу, кирпич. Керамику получают формованием массы (влажность 18-24%), состоящей из каолина, кварца и полевого шпата с последующим спеканием при высокой температуре. При спекании происходит удаление воды, а поры заполняются расплавленной массой силикатов. Строительную керамику (черепицу и кирпич) получают обжигом смеси песка и глины при 950 -1050С.
В последние годы все более широкое применение в электронике находят специальные виды керамики, изготовленные из оксидов алюминия, циркония, титана, редкоземельных элементов. Керамическим методом также получают некоторые высокотемпературные сверхпроводники и керметы.
Цемент. В строительстве в огромных количествах потребляются цементы, чаще всего силикатные /портландцементы/. Это гидравлическое вяжущее вещество, получаемое путем тонкого измельчения клинкера, гипса и других добавок. Клинкер получают обжигом при температуре 1400-1500С известняка, глины и других компонентов во вращающихся печах.
В строительстве цемент смешивают с песком, гравием и водой. Вода взаимодействует с безводными соединениями цемента, протекают процессы гидролиза и гидратации. Постепенно происходит кристаллизация гидросиликатов и затвердение бетона, и увеличение его прочности.
3.5 Подгруппа германия
Германий является типичным полупроводником с преимущественно ковалентной связью. С более электроотрицательными элементами германий выступает в роли катионообразователя, что отражает металлическую природу с химической точки зрения. В бинарных соединениях с металлами германий - анионообразователь. В ряду Ge - Pb усиливаются металлические свойства, уменьшается доля ковалентной связи в соединениях. Олово существует в двух полиморфных модификациях, низкотемпературной (-Sn) c кристаллической решеткой алмаза и обладающее полупроводниковыми свойствами, а высокотемпературной модификации (-Sn-белое олово), которые представляет металл по физическим свойствам, но кристаллизуется в малохарактерной для металлов тетрагональной структуре.
Единственным типичным металлом в этой подгруппе является свинец, который кристаллизуется в плотноупакованной ГЦК с К.Ч.=12. В своих соединениях свинец всегда выступает в качестве катионообразователя. Bсе три элемента проявляют степени окисления -4,+2 и +
Природные ресурсы. Содержание в земной коре: Gel0-4 %, Sn810-3%, Рb1,610-3%. Это мало распространённые элементы. Олово и свинец были известны ещё до новой эры. Германий открыли в конце прошлого века. До открытия германия его свойства предсказал Д.И. Менделеев. Сульфид германия GeS2 встречается как примесь к сульфидам цинка, меди, серебра. Источником соединений германия служит зола некоторых сортов каменного угля. Важнейшие минералы олова и свинца: SnO2 - касситерит (оловянный камень) и PbS- галенит (свинцовый блеск). Свинец - продукт радиоактивного распада урана и тория.
Получение. Начальная стадия производства германия - извлечение его соединений из природных образований (отходы цинкового производства). Германий восстанавливают водородом из оксидов:
GeO2 + 2H2 Ge + 2H2О.
Для получения германия высокой чистоты пользуются зон ной плавкой. Производство олова и свинца включает стадию обогаще ния руды, проводимую обычно методом флотации. Олово также получают восстановлением его диоксида:
SnO2 + 2CSn + 2CO.
Для получения свинца сначала подвергают обжигу сульфид свинца:
2PbS + 3O2 2PbO + 2SO2.
Затем восстанавливают РЬО оксидом углерода:
РbО + CО Рb + СО2.
Физические свойства. Германий - хрупкое с металлическим блеском вещество. По свойствам занимает промежуточное положение между метал лами и неметаллами. Олово - серебристо белый легкоплавкий металл при обычных условиях. При температурах ниже 13°С устойчиво -Sn-олово, хрупкое и твёрдое. В области температур 14-173°С существует -Sn - белое металлическое олово. Конфигурация внешних электронных оболочек в основном состоянии: Ge 3d104s24p2; Sn 4d10 5s25p2; Рb 5d10 6s2 6р2 . Рассматриваемые элементы отличаются от углерода (и отчасти от кремния) тем, что образование их многих химических соединений описывает sр3d2-гибридизация. Для этих элементов характерны октаэдрические комплексы. Примера ми таких комплексов являются [Се(ОН)6]2-; [Sn(OH)6]2-;[SnCI6]2-; [РЬСI6]2-. Отличие свинца от германия и олова проявляется во взаимодействии с концентрированной азотной кислотой:
Ge + 4HNO3 H2GeO3 + 4NO2 + H2O,
германиевая кислотa
Sn + 4HNO3 H2SnO3 + 4NO2 + H2O,
-оловянная кислота,
(получающиеся кислоты фактически имеют состав ЭO2Н2O)
Рb + 4НNО3 РЬ (NО3)2 + 2NO2 + 2H2O.
При взаимодействии олова с очень разбавленной азотной кислотой образуется Sn(NO3)2 и NН4NОз:
4 Sn + 10HN03 4Sn(NО3)2 + NН4NО3 + ЗН2O.
очень разбавл.
С кислотами, не являющимися окислителями, германий не взаимодействует, а олово реагирует с выделением водорода:
Sn + 2HCl 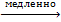 SnCl2 + H2 ,
SnCl2 + H2 ,
разбав.
Sn + 4HCl  H2[SnCl4] + H2,
H2[SnCl4] + H2,
конц.
Sn + 4H2SO4 Sn (SО4)2 + 2SO2 + 4H2O.
конц.
Соляная кислота и разбавленная серная кислота пассивируют свинец за счет образования нерастворимых в воде пленок РЬСI2 и PbSO Оксидная плёнка на свинце рыхлая и не защищает металл от воздействия окислителей, поэтому свинец хорошо растворяется в кислотах, анионы которых не образуют со свинцом трудно растворимых солей, например, в НNОз и СНзСООН:
Рb + 2СН3СООН = РЬ (СНЗСОО) 2 + Н2.
С растворами щелочей олово и свинец реагируют лишь при нагревании. образуя соответствующие гидроксокомплексы:
Sn + 2KOH + H2O = K2[Sn (ОН) 4] + H2.
тетрагидроксостаннит калия
Это подтверждает амфотерную природу и свинца, и олова. Германий взаимодействует со щелочами только в присутствии окислителей:
Ge + 2KOH + 2H2O2K2[Ge (ОН)6].
C водородом Ge, Sn, Pb не взаимодействуют. Германоводород или моногерман получают по реакции, аналогичной по лучению силана:
Mg2Ge + 4HClGeH4 + 2MgCl2.
При этом образуются Ge2H6 и Ge3H8. Моногерман GeH4- газ; гидриды Ge2H6 и Gе3Н8- жидкости. Гидрид олова (станнан) SnH4 (газ) мало устойчив. Ещё менее устойчив гидрид свин ца РЬН4, который нельзя выделить в виде индивидуального вещества. Германиты и станниты как производные низших степеней окисления являются сильными восстановителями:
ЗNa2[Sn+2 (ОН) 4] + 2Bi(OH) 3 = 2Bi + 3Na2[Sn+4(ОН)6].
восстановитель окислитель
При нагревании Ge и Sn в присутствии кислорода получают диоксиды: GeO2 и SnO2 . При нагревании свинца на воздухе образуется жёлтый монооксид РЬО и ярко-красный Pb3O4 (сурик), который можно рассматривать как соль ортосвинцовой кислоты (РЬ2РЬO4) . При действии азотной ки слоты на сурик образуется РbO2 .
Рb3О4 + 4НNО3РЬO2 + 2РЬ (NО3) 2 + 2Н2O.
В лаборатории РbO2 получают:
РЬ (СН3СОО) 2+ CaOCl2 + H2OPbO2 + CaCl2 + 2СН3СООН.
Диоксид свинца РbO2- темнокоричневый порошок. Это сильнейший окислитель.
В ряду Ge- Sn - Рb происходит увеличение стабильности низшей степени окисления в полном соответствии с нарас танием металлических свойств. Оксиды GeO и SnO менее стабильны, чем РbО. Оксид олова SnO при 400°С начинает диспропорционировать:
4SnO = 2Sn + 2SnO2.
Все оксиды элементов подгруппы германия мало растворимы в воде, поэтому соответствующие им гидроксиды Э(ОН)2 и Э(ОН)4 амфотерны. Схемы равновесия в насыщенных растворах гидроксидов олова (II), (IV) и свинца (II) (IV) отражены ниже:
Sn2+ + 2OH- Sn(OH)2 H2[Sn (ОН)4] 2H++ [Sn(ОН)4]2-.
осадок раствор
Sn4+ + 4OH-Sn (ОН) 4Н2[Sn (ОН)6] 2Н++ [Sn (ОН)6]2-.
осадок раствор
Аналогична схема равновесия для гидроксидов свинца. Добавление кислоты приводит к смещению равновесия влево (диссоциация по основному типу) вследствие течения про цессов:
Sn(OH)2 + 2H+ = Sn2++ 2H2O,
Sn(ОН)4 + 4H+ = Sn4++ 4H2O.
Добавление щелочи ОН- приводит к смещению равновесия вправо (диссоциация по кислотному типу ) вследствие те чения процессов:
Sn2+(ОН)2 + 2OН- = [Sn+2(ОН)4]2-,
Sn+4(ОН)4 + 4ОН- = [Sn+4(ОН)6]2-.
При этом образуются соли катионного и анионного типов. Гидролиз солей олова и свинца протекает с образованием основных солей:
SnCl2 + H2O SnOHCl + HCl,
2РbСО3 + 2Н2O[РbОН]2СО3 + Н2O + СО2.
Большинство солей олова хорошо растворяются в воде. Сульфиды олова SnS (бурого цвета) и SnS2 (жёлтого цвета) нерастворимы. Растворимы Рb(NОз)2 и РЬ(СН3СОО)2, в горячей воде растворимы PbCl2 и PbI2. Нерастворимы PbSO4 (белого цвета), РbСг04 (жёлтого цвета), PbS (чёрного цвета).
В зависимости от степени окисления соединения подгруппы германия могут быть:
а) Э-4- только восстановителями;
б) Э° и Э+2- окислителями и восстановителями;
в) Э4+ - только окислителями.
Соединения германия (II) и олова (II) являются сильными восстановителями, а для солей свинца (II), в отличие от солей оло ва (II) восстановительные свойства не характерны, в то время как соединения свинца (IV) сильнейшие окислители:
а) гидриды (Э4-), являясь сильными восстановителями, энергично окисляются кислородом воздуха (самовоспламеняются):
Ge-4H4 + 2O2 = GeO2 + 2H2O;
GeН4 +4C2 = GeC4+ 4Н
б) Э+2- восстановитель:
Sn+2C2 + 2FeC3 = 2FeC2 + Sn+4C4,
3Sn+2C2 + 2AuC3 = 2Au +3SnC4;
в) Э+2 - окислитель:
РЬ (NО3)2 + Zn = Pb° + Zn (NО3)2;
г) Э4+ - окислитель:
5PbO2 + 2MnSO4 + 3H2SO4 = 5PbSO4 + 2HMnO4 + 2H2O.
Применение. Германий широко используется как полупроводник. Почти половина производимого олова идет на изготовление жести, главным потребителем которой является производство консервов. Значительное количество олова расходуется на получение сплавов - бронзы (Cu+10-20%Sn). Диоксид олова применяется для изготовления полупроводниковых сенсоров. Химические полупроводниковые сенсоры – чувствительные элементы на основе SnO2 , InO3, ZnO, TiO, преобразующие энергию химического процесса в электрическую. Взаимодействие определяемого газа (О2, СО, NO2) с чувствительным материалом сенсора вызывает обратимое изменение его электропроводности, которое регистрируется электронным устройством. Процесс взаимодействия газов с материалом и соответствующие изменение концентрации электронов могут быть представлены реакциями:
3.6. Биологическая и экологическая роль
р-элементов IVА-группы и их соединений
Углерод. По содержанию в организме человека (21,5%) углерод относится к макроэлементам. Он входит в состав всех тканей и клеток в форме белков, жиров, углеводов, витаминов, гормонов. С биологической точки зрения углерод является органогеном номер один.
Монооксид углерода СО. Из соединений элементов IVА-группы, в которых они проявляют степень окисления +2, интерес для экологов и биологов представляет оксид углерода (II) СО. Это соединение ядовито и чрезвычайно опасно, потому что не имеет запаха.
Оксид углерода (II) (угарный газ) - продукт неполного окисления углерода. Как это не парадоксально, одним из источников СО является сам человек, организм которого производит и выделяет во внешнюю среду (с выдыхаемым воздухом) за сутки около 10 мл. СО. Это так называемый эндогенный оксид углерода (II), который образуется в процессе кроветворения.
Проникая с кислородом в легкие оксид углерода (II) быстро проходит через альвеолярно-капиллярную мембрану, растворяется в плазме крови, диффундирует в эритроциты и вступает в обратимое химическое взаимодействие как с окисленным HbO2, так и с восстановленным гемоглобином Hb:
HbO2 + СО HbСO2 + О2
Hb + СO HbСO
Образующийся карбонилгемоглобин (HbСO) не способен присоединить к себе кислород. Вследствие этого становится невозможным перенос кислорода из легких к тканям.
Высокое химическое сродство оксида углерода (II) к двухвалентному железу является основной причиной взаимодействия СО с гемоглобином. Можно полагать, что и другие бионеорганические соединения, содержащие ионы Fe2+, должны реагировать с этим ядом.
Так как реакция взаимодействия оксигемоглобина с угарным газом обратима, то повышение в дыхательной среде парциального давления О2 будет ускорять диссоциацию карбонилгемоглобина и выделение СО из организма.
В настоящее время имеются лечебные препараты, которые используют в качестве антидотов при отравлении организма оксидом углерода (II). Например, введение восстановленного железа резко ускоряет удаление СО из организма в виде, очевидно карбонила железа. Действие этого препарата основано на способности СО выступать в качестве лиганда в различных комплексах.
Кремний. По содержанию в организме человека (10-3%) кремний относится к примесным микроэлементам. Больше всего кремния в печени, надпочечниках, волосах, хрусталике. Так как природный диоксид кремния плохо растворим в воде, то в организм человека он попадает не столько через пищеварительный тракт. сколько воздушным путем через легкие в виде пылеобразного SiO2.
С нарушением обмена кремния связывают возникновение гипертонии, ревматизма, язвы, малокровия.
Недавно было установлено, что кремний содержится в коже, хрящах, связках млекопитающих и входит в состав полисахаридов, где прочно связан эфирными связями, возникающими при взаимодействии ортокремневой кислоты с гидроксильными группами углеводов:
В отличие от углерода в составе биомолекул кремний связан только с атомами кислорода (связь Si–O), так как энергия этой связи существенно выше энергии связей Si–Н, Si–С, Si–S и т.д.
Необходимо отметить, что пыль, состоящая из частиц диоксида кремния SiO2, алюминия, при систематическом воздействии на легкие вызывает заболевание – пневмокониозы. При действии угольной пыли развивается антракоз – профессиональное заболевание шахтеров. При вдыхании пыли, содержащей SiO2, возникает силикоз, при действии алюминиевой пыли – амеминоз.
Механизм развития пневмокониозов недостаточно изучен. Предполагается, что при длительном контакте силикатных песчинок с биологическими жидкостями образуется гелеобразная поликремниевая кислота, отложение которой в клетках ведет к их гибели.
Германий. По содержанию в организме человека (10-4 – 10-6%) германий относится к микроэлементам. Биологическая роль окончательно не выяснена. Соединения германия усиливают процессы кроветворения в костном мозге. Соединения германия малотоксичны.
Олово. По содержанию в организме человека (10-4%) олово относится к микроэлементам. Сведения о биологической роли противоречивы.
Олово попадает в организм человека, с кислыми продуктами, консервированными в жестяных банках, покрытых слоем олова. В кислой среде олово растворяется и в форме соли поступает в кровь, проявляя токсическое действие.
Sn + 2HA SnA2 + H2
Свинец. Свинец и его соединения, особенно органические, весьма токсичны. Соединения свинца влияют на синтез белка, энергетический баланс клетки и её генетический аппарат.
Существуют многочисленные доказательства постепенного накопления свинца в растениях и тканях животных и человека в результате повседневного загрязнения окружающей среды свинцом. С пищей, водой, атмосферным воздухом человек поглощает до 100мкг свинца. Свинец депонируется в основном в скелете (до 90%) в форме труднорастворимого фосфата:
3Pb2+ (p) + 2PO43- (p) = Pb3(PO4)2 (т)
Массовая доля свинца в организме человека 10-6%. Безопасным для человека считают суточное поступление 0,2-2 мг свинца.
Биологическая активность свинца определяется его способностью проникать в организм и накапливаться в нем.
Свинец и его соединения относятся к ядам, действующим преимущественно на нервно-сосудистую систему и непосредственно на кровь. Химизм токсического действия свинца весьма сложен. Ионы Pb2+ являются сильными комплексообразователями по сравнению с катионами остальных р-элементов IVА-группы. Они образуют прочные комплексы с биолигиндами.
Ионы Pb2+ способны взаимодействовать с сульфгидрильными группами SH белков в молекулах ферментов, участвующих в синтезе порфиринов, регулирующих синтез биомолекул, блокируя их:
R — SH + Pb2+ + HS — R R — S — Pb — S — R + 2H+
Часто ионы Pb2+вытесняют естественные ионы М2+, ингибириуя металлоферменты ЕМ2+:
ЕМ2+ + Pb2+ ЕPb2+ + М2+
Значительное повышение содержания свинца в окружающей среде. (в т.ч. и в поверхностных водах) связано с сжиганием углей, с применением тетраэтилилсвинца в качестве антидетонатора в моторном топливе, с выносом в водные объекты со сточными водами рудообогатительных фабрик, некоторых металлургических заводов, химических производств, шахт и т.д. Существенными факторами понижения концентрации свинца в воде является адсорбция его взвешенными веществами и осаждения с ними в донные отложения. В числе других металлов свинец извлекается и накапливается гидробионтами.
Свинец находится в природных водах в растворенном и взвешенном (сорбированном) состоянии. В растворенной форме встречается в виде минеральных органоминеральных комплексов, а также простых ионов в нерастворимой форме (сульфиды, сульфаты и карбонаты).
Свинец – промышленный яд, способный при неблагоприятных условиях оказаться причиной отравления. В организм человека проникает главным образом через органы дыхания и пищеварения. Удаляется из организма очень медленно, вследствие чего накапливается в костях, печени и почках.
ПДКв свинца составляет 0,03мг/дм3 (лимитирующий показатель вредности - токсилогический).
Тетраэтилсвинец поступает в природные воды в связи с использованием в качестве антидетонатора в моторном топливе водных транспортных средств, а также с поверхностным стоком с городских территорий.
Данное вещество характеризуется высокой токсичностью, обладает кумулятивными свойствами.
Содержание тетраэтилсвинеца в воде водоемов хозяйственно-питьевого, культурно-бытового и рыбохозяйственного назначения не допускается.
р-Элементоы IVА-группы резко различаются как по содержанию в организме человека, так и по биологической роли. Макроэлемент углерод играет основополагающую роль в жизнедеятельности организмов; микроэлемент кремний, вероятно, является жизненно необходимым; микроэлемент германий, возможно выполняет некоторую физиологическую роль в организме, в то время олово и в особенности свинец токсичны и являются примесными элементами. Следует отметить закономерность – токсичность соединений металлов IVА-группы с ростом атомной массы элемента возрастает.
4 Элементы VA группы (пниктогены)
1 Общая характеристика элементов VA группы
Валентная электронная конфигурация всех элементов VA-группы ns2np3 , т.е. на внешнем энергетическом уровне они содержат два спаренных ns- электрона и три неспаренных электрона на трехкратно выраженном np- уровне. Однако у элементов этой группы существуют и различия в электронном строении. У мышьяка, сурьмы и висмута к вакантному nd- уровню добавляется еще в отличиe от фосфора полностью завершенный внутренний (n-1)d - уровень, а у висмута, следующего за лантаноидами, кроме того и 4f14 – уровень. В силу наличия внутренних d и f оболочек, экранирующих внешние электроны, в ряду As - Sb - Bi проявляется вторая периодичность, в результате для среднего элемента ряда – сурьмы – степень окисления +5 оказывается более стабильной, чем для мышьяка и висмута.
Основные константы элементов этой подгруппы приведены в табл.12.
В ряду N - P - As - Sb - Bi происходит монотонное возрастание радиусов и уменьшение электроотрицательности. Сумма первых трех потенциалов ионизации уменьшается, что указывает на усиление металлических свойств. Для элементов подгруппы мышьяка стабильность отрицательной степени окисления в ряду As - Sb - Bi уменьшается, для висмута степень окисления -3 неизвестна, что характеризует висмут как металл. В состоянии простых веществ азот - газ, фосфор - твердое тело. Химическая активность фосфора выше химической активности азота, так как энтальпия диссоциации молекулы N2 на атомы в 1,5 раза больше этой величины для молекул фосфора P Азот и фосфор - типичные неметаллы, их производные - важнейшие составные части растительных и животных организмов.
Таблица 12
Свойства элементов подгруппы азота
|
Свойства |
N |
Р |
As |
Sb |
Bi |
|
Содержание в земной коре, % |
110-2 |
810-2 |
510-4 |
410-5 |
210-5 |
|
Атомный радиус, нм |
0,070 |
0,110 |
0,121 |
0,141 |
0,146 |
|
I, B |
91,5 |
0,4 |
58,0 |
52,3 |
52 |
|
ОЭО |
3 |
2,1 |
2,0 |
1,9 |
1,8 |
|
Характерные степени окисления |
-3,-2,-1 +1,+2, +3,+4,+5 |
-3, +3, +5 |
-3, +3, +5 |
-3, +3, +5 |
+3, +5 |
|
Температура кипения, 0 С |
-195,8 |
429 |
615 |
1634 |
1552 |
|
Плотность, г/см3 |
0,808 (ж) |
2 |
5,72 |
6,7 |
9,8 |
|
Е (Э3+р-р/Э), В |
- |
- |
0,3 |
0,24 |
0,2 |
2 Азот и его соединения
У атома азота в невозбужденном состоянии два спаренных электрона на 2s- орбитали, а три неспаренных электрона 2p-орбитали, ответственные за трехковалентность азота. У азота нет возможности промотирования электронов с переходом в возбужденное состояние, так как ближайшие орбитали при n=3 слишком высоки по энергии, поэтому максимальная валентность азота равна четырем. При этом три валентные связи могут быть образованны по обмен ному механизму, а одна - по донорно-акцепторному механизму. Азот проявляет большое разнообразие степеней окисле ния: -3 (NH3), -2 (N2H4), -1 (NH20H), 0 (N2), +1 (N2O), +2 (NO), +3 (HNO2), +4 (NO2), +5 (НNО3). Наиболее часто встречаются степени окисления: -3, +3 и +5.
Природные ресурсы. Основная масса азота сосредоточенна в атмосфере: (воздух: 78,09% N2; 20,95% O2; 0,932% Аr). Содержание в земной коре 4х10-2 %. Связанный азот образует минералы в форме нитратов: чилийская NaNO3, индийская KNO3 и норвежская Са(NО3)2 селитры. Азот содержится во всех живых микроорганизмах, разви тие жизни без него невозможно, поскольку белки - азотосодержащие соединения.
Получение. В промышленности азот получают ректификаци ей жидкого воздуха. В лаборатории нагреванием NH4Cl и NaNO2:
NaNO2 + NH4C1 NH4NO2 + NaCI,
NH4NO2 N2 + 2H2O.
Чистый азот получается термическим разложением азидов металлов:
2NaN3 = 2Na + 3N2.
При нагревании:
(NH4)2Cr2O7 N2+ Cr2O3 + 4H2O.
Свойства. Азот - бесцветный газ, не имеющий вкуса и запаха. Азот плохо растворим в воде и в органических растворителях. Химическая связь в молекуле азота характеризуется исключительной прочностью (энергия связи равна 941 кДж/моль), несравнима ни с какими другими двухатомными молекулами. Особая устойчивость молекулярного азота определяет химию этого элемента. Азот не го рит и не поддерживает горения других веществ. Напротив, он сам в молекулярном виде является конечным продуктом окисления многих азотосодержащих веществ. При комнатной температуре азот реагирует лишь с литием:
N2 + 6Li = 2Li3N.
При повышенных температурах он взаимодействует с другими активными металлами с образованием нитридов. Образующийся при электрических разрядах атомарный азот уже при обычных ус ловиях взаимодействует с серой, фосфором, ртутью. Химическая ак тивность азота резко повышается в условиях высоких температур (азот соединяется с водородом, кислородом, углеродом и другими элементами).
Водородные соединения азота. В присутствии катализатора и при нагревании азот реагирует с водородом с образованием аммиака NH3:
N2+3H2<=>2NH3
В молекуле аммиака атом азота образует три - связи с тремя атомами водорода, которые занимают три (валентные электроны 2s22p3) вершины чуть искаженного тетраэдра. Четвертая вершина тетраэдра занята неподеленной электронной парой азота, что обеспечивает химическую активность, ненасыщенность и реакционную способность молекул аммиака, а так же большую величину дипольного момента моолекул (µ= 0,510-29 Кл м).
Получение аммиака:
а) Термическим разложением аммонийных солей от кислот, не являющихся окислителями:
(NH4)3PO4 = 3NH3+ H3PO
б) Обработкой солей аммония щелочами:
2NH4Cl + Ca(OH)2 = 2NH3+ CaCl2 + 2H2O.
При обычных условиях аммиак - бесцветный газ с резким запахом. Он токсичен: раздражает слизистые оболочки, а острое отравление аммиаком вызывает поражение глаз и воспаление легких. При охлаждении до -33°С аммиак сжижается, а при -78°С затвердевает. Вследствие полярности молекул и достаточно высокой диэлектрической проницаемости жидкий аммиак является хорошим неводным растворителем. В жидком аммиаке хорошо растворяются щелочные и щелочноземельные металлы, сера, фосфор, йод и т.д.
Аммиак хорошо растворяется в воде. Прекрасная растворимость аммиака в воде обусловлена образованием межмолекулярных водородных связей:
NH3 + H2O NH4OH.
Константа равновесия. характеризующая равновесие реакции взаимодействия аммиака с водой при 289 К равна:
относительно низкое значение константы диссоциации свидетельствует, что в растворах аммиака концентрация ОН ионов незначительна.
В водном растворе NH4OH диссоциирует:
NH4OHNH4++ OH-.
В водном растворе аммиак находится в виде гидрата
NH4OH - слабое основание, Kдис.= 210-5 . Поскольку азот в NН3 имеет низшую степень окисления -3, аммиак является сильным восстановителем. На воздухе он не горит, но в атмосфере кислорода окисляется до свободного азота:
4NH3 + 3O22N2 + 6H2O.
Аммиак взаимодействует с хлором:
2NH3 + 3Cl2N2 + 6HCl,
при избытке NH3 образуется не HCl, а NH4Cl,
NH3 + HCl = NH4Cl.
При взаимодействии аммиака с активными металлами образуются амиды:
Na + NH3 = NaNH2 + l/2H2.
В амидах замещен один атом водорода (NaNH2); в имидах - два (Li2NH), а в нитридах - все три (A1N). Эти соединения - твердые вещества, подвергаются гидролизу с образованием аммиака и гидроксидов металлов:
NaNH2+H2ONaOH+NH3,
Mg3N2+6H2O3Mg(OH)2+2NH3.
При введении в избытке NH3 в растворы солей d – элементов, как правило, образуются их амминокомплексы, например:
CuSO4 + 4NH3 [Cu(NH3)4]SO4,
Ni(NO3)2 + 6NH3 [Ni(NH3)6](NO3)2.
Комплексообразование сопровождается изменением окраски раствора: в первой реакции голубой цвет CuSO4 переходит в темносиний, во второй реакции зеktyfz окраска нитрата никеля становится фиолетовой (окраска комплекса).
При осторожном окислении аммиака мягким окислителем (например, NaClO) получают гидразин или (N2H4):
-3 +1 -2 -1
2NH3 + NaOCl = N2H4 + NaCl + H2O.
Гидразин - это бесцветная, легко испаряемая жидкость с высокой диэлектрической проницаемостью (Е=52 при 25°С), ядовит, взрывается в присутствии кислорода.
При восстановлении азотной кислоты атомарным водородом получается гидроксиламин:
HNO3 + 6Н = NH2OH + 2Н2O.
Гидроксиламин- бесцветные кристаллы (Тпл=33°С), термически нестоек, выше 100°С взрывается. Водные растворы гидроксиламина более устойчивы, так как возникают межмолекулярные водородные связи. Гидроксиламин проявляет свойства восстановителя: NH2OH + I2 + 2KOH = N2 + 2KI + 4H2O
Азот образует с кислородом ряд оксидов. Кислородные соединения азота: N2O, NO, N2O3, NO2, N2O4, N2O5 ,все ядовиты, за исключением N2O (см. табл. 11).
N2O- бесцветный газ с приятным запахом и сладковатым вкусом, вдыхание вызывает состояние, сходное с опьянением, “веселящий газ” используется в качестве наркоза в медицине. Его получают разложением аммонийной селитры:
NH4NO3 N2O + 2H2O.
При нагревании его активность растет. Он окисляет водород, серу, уголь, медь, органические соединения:
Cu + N2O = CuO + N2.
При высоких температурах оксид азота (I) разлагается на азот и кислород:
700 °С
2N2O 2N2 + O2.
Оксид азота (II) NO (монооксид азота) получают в больших количествах, при производстве HNO3 , каталитическим окислением аммиака:
2NH3 + 5O24NO + 6H2O.
Катализатором в этой реакции служит тонкая платинородиевая проволока. На воздухе оксид азота (II) мгновенно окисляется:
2NO+O2 = 2NO2 (Н°298 = -113,4 кДж/моль).
Однако ОН восстанавливается водородом до элементарного азота
Водные растворы NO нейтральны. Монооксид азота окисляется галогенами, образуя нитрозилгалогениды:
2NO + Г2 = 2NOГ,
2NO + Cl2 = 2NOC1.
Таблица 13
Кислородосодержащие соединения азота
|
Степени окисления |
Оксиды |
Гидроксиды |
Соли |
|||
|
формула |
название |
характер |
формула |
Название кислоты |
Название |
|
|
+1 |
N2O |
Оксид азота (I) |
Безразличный |
- |
- |
- |
|
+2 |
NO |
Оксид азота (II) |
Безразличный |
- |
- |
- |
|
+3 |
N2O3 |
Оксид азота (III) |
Кислотный |
HNO2 |
Азотистая |
Нитриты |
|
+4 |
NO2 |
Оксид азота (IV) (диоксид) |
Кислотный |
HNO2 HNO3 |
Азотистая Азотная |
Нитриты Нитраты |
|
+5 |
N2O5 |
Оксид азота (V) |
Кислотный |
HNO3 |
Азотная |
Нитраты |
Известно много комплексов, содержащих в качестве лигандов группу NO. Качественной реакцией на NO является образование бурого комплекса при взаимодействии с сульфатом железа (II):
[Fe(H2O)6]SO4+NO[Fe(H2O)5NO]SO4+H2O.
NO - бесцветный газ, в лаборатории его получают, действуя 30%-ной азотной кислотой на медь:
3Cu + 8HNO33Cu(NO3)2 + 2NO + 4H2O.
Образующийся в небольших количествах NO2 удаляют, про пуская газ через воду, в которой NO2 в отличие от NO растворим. При нагревании NO окисляет многие вещества (С, Р, S, SO2, Н2 и некоторые металлы).
Триоксид азота N2O3 при низких температурах - темно-синяя жидкость, разлагающаяся при температуре выше 0°С:
N2O3NO + NO2 ; Н°298= - 41.2 кДж/моль.
Его получают взаимодействием 50%-ой азотной кислоты с оксидом мышьяка (+3):
+5 +2 +4
2HNO3 + As2O3 = 2HAsO3 + NO + NO2.
Оксиду азота (+3) отвечает известная лишь в растворе неустойчивая азотистая кислота HNO2. Ее можно получить растворен ием равных объемов NO и NO2 в воде:
NO + NO2 + H2O = 2HNO2.
При хранении и нагревании HNO2 диспропорционирует:
+3 +5 +2
3HNO2 = HNO3 + 2NO + H2O.
Для нее более характерны окислительные свойства:
2HNO2 + 2HI = I2 + 2NO + 2H2O.
Сильные окислители переводят азотистую кислоту в азотную. Соли азотистой кислоты - нитриты, производятся от обеих форм. Азотистая кислота является амфолитом с более выраженной кислотной функцией. В её водных растворах существует равновесие:
NO+ + OH–HNO2H+ + NO2–
Ион NO+- нитрозил или нитрозоний чрезвычайно устойчив. Производные азотной кислоты, отвечающей её основной функции, содержащие группу [NO]+, называются нитрозильными соединениями, например, нитрозилсерная кислота NOHSO4 является важным промежуточным продуктом при нитрозном способе получения серной кислоты.
NO2 – оксид азота (IV) бурый газ, обладающий характерным запахом, раздражает дыхательные пути, очень ядовит, получают растворением меди в концентрированной азотной кислоте:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 +2H2O.
Диоксид азота NO2 в лаборатории получают действием серной кислоты на нитрит натрия:
2NaNO2 + H2SO4 Na2SO4 + NO + NO2 + H2O.
и последующим окислением кислородом, содержащегося в газовой смеси NO. NO2 является хорошим окислителем, в нем горят фосфор, сера, уголь и некоторые органические вещества.
Выше 150 °С диоксид азота начинает разлагаться:
2NO2 = 2NO + O2.
Диоксид азота с одним неспаренным электроном по существу представляющий собой радикал
легко димеризуется: 2NO2N2O4; H0298 = -58 кДж.
Димер N2O4 бесцветен и диамагнетен в отличие от окрашенного в красно - бурый цвет и парамагнитного NO2. Диоксид азота при взаимодействии с водой диспропорционирует:
+4 +3 +5
2NO2 + H2O = HNO2 + HNO3.
Соответственно при взаимодействии диоксида азота с щелочами образуются соли нитриты и нитраты:
2NO2 + 2КOH = КNO3 + КNO2 + Н2О
Поскольку степень окисления азота в нитратах промежуточная (+3), они могут проявлять как окислительные, так и восстановительные свойства.
+3 +2
2NаNO2 + 2КJ + H2SO4 = I2 + 2NO + K2SO4 + Nа2SO4 + H2O
окислитель
2KMnO4 + 5NaNO2 + 3H2SO4 = 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
восстановитель
Нитриты щелочных, щелочноземельных металлов и аммония – бесцветные или желтоватые кристаллические вещества, хорошо растворимые в воде. Нитриты переходных металлов в воде малорастворпимы. А при нагревании легко разлагаются (диспропорционируют):
2AgNO2 AgNO3 + Ag + NO
3 Участие оксидов азота в фотохимических реакциях
Фотохимические реакции в верхних слоях атмосферы. Фотохимическая реакция возможна, если энергия поглощенного кванта получения выше энергии. необходимой для протекания той или иной химической реакции. Энергия фотона равна
Е = hv = hc/,
К наиболее важным фотохимическим процессам, протекающим в верхних слоях атмосферы (на высоте 100 км и выше), относится фотодиссоциация молекул газа и прежде всего кислорода:
О2 (г) + hv = 2O(г), кДж/моль (8,2 10–19 Дж/молекула).
Энергией 8,2 10–19 Дж/молекула обладают фотоны с длиной волны 241 нм.
Как видно, фотодиссоциация кислорода происходит при поглощении коротковолнового (ультрафиолетового) излучения (<241 нм).
Кроме фотодиссоциации кислорода, также присходит ионизация газов:
Ионизация газов приводит к появлению плазмы в верхних слоях атмосферы, которая обуславливает распространение радиоволн.
Как показывают расчеты, фотоионизация указанных газов возможна при поглощении фотонов с длиной волн 130-80 нм и ниже.
Образующиеся ионы затем рекомбинируют с образованием атомов:
Кроме того, идут реакции переноса и обмена, например:
В верхних слоях атмосферы наиболее распространены атомарные кислород и азот и ионы NO+.
Рассмотренные выше реакции имеют огромное значение для жизни на Земле, так как в результате их протекания поглощается значительная часть губительных для живого коротковолновых солнечных лучей. Однако, часть коротковолнового излучения проходит через этот слой и поглощается низлежащим озоновым слоем.
Озоновый слой образуется в основном по реакциям:
или
(* - частица находится в возбужденном состоянии)
Скорость образования озона максимальна на высоте 30-50 км.
Указанные реакции экзотермические, поэтому на высоте 50 км наблюдается максимальная температура верхних слоев атмосферы (270 К). Озон, в свою очередь, поглощает коротковолновое излучение и при этом диссоциирует:
О + hv = О2 + О
Этот процесс фотодиссоциации озона исключительно важен, так как иначе коротковолновые лучи попадали бы на землю. Растения и животные погибают под воздействием этого излучения. Однако. озон может разлагаться также при взаимодействии с некоторыми газами и прежде всего с оксидами азота и водородом:
Как видно, оксиды азота при этом не расходуются, играя роль катализаторов процесса. Под воздействием водорода озон восстанавливается до дикислорода и воды:
О3 +2Н = О2 + Н2О
Указанные процессы являются природными процессами, в результате которых установилось равновесие, обеспечивающее определенную концентрацию озона в атмосфере (или определенную толщину озонового слоя). Однако, в последние годы обнаружены, так называемые озоновые дыры, т.е. области и с пониженной концентрацией озона или с пониженной толщиной озонового слоя. Многие ученые связывают появление озоновых дыр с деятельностью человека и прежде всего с неблагоприятным воздействием антропогенных хлорфторметанов (фреонов), а также антропогенного оксида азота. Хлорфторметаны оказывают неблагоприятное воздействие на озоновый слой из-за их фотолиза
CFxCl4-x (r) + hv = CFxCl3-x (r) +Cl(r)
Образующийся хлор ускоряет разложение О3
Как видно, газообразный хлор ведет себя как катализатор процесса, аналогично монооксиду азота. Монооксид азота в верхние слои атмосферы попадает из нижних слоев атмосферы (тропосферы), а также из стратосферы от самолетов за счет реакции
N2 +O2 2NO
Фотохимические реакции в нижних слоях атмосферы (в тропосфере). В тропосферу (на высоте ниже 10 км) проникает солнечное излучение с длинами волн выше 300 нм. Эти лучи взаимодействуют с элементами тропосферы и прежде всего с антропогенными веществами: NO2, SO2? углеводородами и др.
Диоксид серы окисляется до триоксида серы:
CО2 (r) + hv + О2= SO3 (r) +O(r)
Образующийся триоксид серы реагирует с Н2О с образованием H2SO4:
CО3 + Н2О = Н2SO4
Серная кислота растворенная в воде, выпадает на землю в виде «кислотных» дождей, вызывая многие неприятные экологические последствия.
Одним из компонентов антропогенных выбросов в атмосферу (сжигание угля и нефти, выхлопные газы автомобилей) содержат монооксид азота NO, который взаимодействует с кислородом воздуха:
2NO + O2 + hv = 2NО2,
образующихся диоксид азота NО2 в присутствии паров воды и кислорода воздуха образует азотную кислоту НNО3:
4NО2 + O2 + Н2О = 4НNО3,
которая вносит свой вклад в образование кислотных дождей.
С другой стороны при облучении с длиной волны 393 нм протекает реакция:
NО2(r) + hv = NО(r) + О(r), кДж/моль.
Образующийся атомарный кислород взаимодействует с молекулярным кислородом с образованием озона:
О2 (r) + O(r) = O3 (r)
Атомный кислород также окисляет углеводороды до альдегидов: формальдегида, ацетальдегида и др. Кроме того, при взаимодействии органических соединений с атомарным кислородом, озоном и оксидами азота образуются свободные радикалы, которые участвуют в различных реакциях с органическими соединениями, вызывающие появление вредных компонентов, например, пероксиацилнитратов (ПАН):
СН3СОО2(r) + NО2(r) СН3СОО2NО2
(ПАН)
Указанные выше соединении являются составными частями смога в крупных городах.
Азотная кислота и её соли
Оксид азота (V) N2O5 имеет молекулярную структуру только в газовой фазе. В твердом состоянии это кристаллическое вещество (бесцветные взрывчатые кристаллы), с ионной структурой, образованoe ионами NO2+ и NO3-. При возгонке кристаллов оксида азота(V) , ионы NO2+ и NO3- объединяются в молекулы N2O5.
Оксид азота (V) получают:
а) дегидратацией азотной кислоты фосфорным ангидридом:
2HNO3 + P2O5 = 2HPO3 + N2O5,
б) окислением N2O3 озоном:
N2O3(ж)+2O3N2O5(к)+2O2,
в) окислением нитрата серебра хлором: