МЕТАБОЛИЗМ МОЗГА
Контрольная работа
МЕТАБОЛИЗМ МОЗГА
Содержание
1. Роль клеточных органелл в энергетических процессах, нервной клетки.
2 Обмен углеводов и особенности энергетического обеспечения мозга.
3. Метаболизм липидов
4. Метаболизм белков и аминокислот
5. Особенности метаболизма нуклеиновых кислот
6. Роль воды в обеспечении функционирования головного мозга
7. Химические особенности миелина
8. Обеспечение энергией проведения возбуждения по нервам
9. Церебральный энергетический обмен в детстве
10. Церебральный энергетический обмен в среднем возрасте и при старении
Литература
1. Роль клеточных органелл в энергетических процессах, нервной клетки.
Основным источником энергии для клетки являются питательные вещества: углеводы, жиры и белки. Прежде чем достичь клеток организма, углеводы превращаются в глюкозу, белки расщепляются до аминокислот, липиды – до жирных кислот благодаря деятельности желудочно-кишечного тракта и печени. В клетке питательные вещества окисляются под действием кислорода и при участии ферментов. Почти все окислительные реакции происходят в митохондриях, а высвобождаемая энергия запасается в виде макроэргического соединения АТФ. В дальнейшем для обеспечения внутриклеточных метаболических процессов энергией используется именно АТФ, а не питательные вещества.
Синтез АТФ на 95 % осуществляется в митохондриях. Пировиноградная кислота, жирные кислоты и аминокислоты в матриксе митохондрий в итоге превращаются в ацетил-КоА, который, в свою очередь, вступает в серию ферментативных реакций под общим названием «цикл трикарбоновых кислот», чтобы отдать свою энергию.
Кроме того, в митохондриях происходит окисление водорода. В процессе этих реакций каждый атом водорода преобразуется в ион водорода и электрон; электроны в итоге связываются с растворенным атомарным кислородом, образуя молекулы воды и гидроксильные ионы. В последующем ионы водорода и образующиеся гидроксильные ионы объединяются с образованием воды. В ходе этих реакций выделяется огромное количество энергии в форме АТФ. Этот механизм образования АТФ называют окислительным фосфорелированием. Процесс осуществляется в митохондриях посредством высокоспециализированного механизма, названного хемоосмотическим.
Молекула АТФ содержит азотистое основание аденин, пентозный углевод рибозу и три остатка фосфорной кислоты. При соблюдении характерных для организма физических и химических условий энергия фосфатных макроэргических связей молекулы АТФ составляет 7300 калорий на 1 моль. Эти связи легко разрушаются, обеспечивая внутриклеточные процессы энергией сразу, как только возникает потребность. При высвобождении энергии АТФ превращается в аденозиндифосфат. Затем происходит восполнение запасов АТФ путем воссоединения АДФ с остатком фосфорной кислоты за счет энергии питательных веществ. Время оборота АТФ составляет несколько минут (Гайтон А. и Д. Холл, 2008)
Энергия АТФ используется нервной клеткой для выполнения трех важнейших функций:
- транспорта веществ через многочисленные мембраны клеток (ионы калия, кальция, магния, фосфора, хлора, органические вещества);
- синтеза веществ в разных участках клетки, особенно в фазу роста;
- проведения нервного импульса.
2 Обмен углеводов и особенности энергетического обеспечения мозга.
В нервной ткани, составляющей всего 2% массы тела человека, потребляется 20% кислорода, поступающего в организм. За сутки в мозге окисляется 100-120 г глюкозы.
В состоянии спокойного бодрствования на долю мозга приходится примерно 15 % общего метаболизма, следовательно, в покое метаболизм мозга на единицу массы ткани примерно в 7,5 раз превышает усредненный метаболизм тканей, не относящихся к нервной системе. Большая часть повышенного метаболизма мозга связана именно с нейронами, а не с глиальной тканью. Главным потребителем энергии в нейронах являются ионные насосы их мембран, транспортирующие главным образом ионы натрия и кальция наружу, а калия – внутрь клетки. Во время проведения потенциала действия увеличивается потребность в дополнительном мембранном транспорте для восстановления соответствующей разности концентраций ионов по обе стороны мембран нейронов. Функция нервной клетки заключается в проведении нервного импульса, который зависит от градиента концентрации ионов K+ и Nа+ внутри и вне клетки. АТФ необходима для поддержания активной работы Nа+/K+ — АТФ-азы — фермента, поддерживающего потенциал покоя и восстанавливающего его после прохождения нервного импульса. Поэтому, во время интенсивной мозговой активности метаболизм нервной ткани может возрастать на 100-150 % .
Основной путь получения энергии - аэробный распад глюкозы по ГБФ-пути. Глюкоза является почти единственным энергетическим субстратом, поступающим в нервную ткань, который может быть использован ее клетками для образования АТФ. Полное окисление 1 грамм-молекулы глюкозы сопровождается выделением 686000 калорий энергии, при этом только 12000 калорий необходимо для образования 1 грамм-молекулы АТФ. За счет последовательного поэтапного расщепления молекулы глюкозы при окислении каждого моля образуется 38 моль АТФ.
Проникновение глюкозы в ткань мозга не зависит от действия инсулина, который не проникает через гематоэнцефалический барьер. Влияние инсулина проявляется лишь в периферических нервах. следовательно, у больных тяжелым диабетом при практически нулевом уровне секреции инсулина глюкоза легко диффундирует в нейроны, что чрезвычайно важно для предупреждения потери умственных функций у данной категории больных.
В нормальных условиях почти вся энергия, используемая клетками мозга обеспечивается глюкозой, доставляемой кровью. Глюкоза должна постоянно доставляться из капиллярной крови: в любой момент необходим двухминутный запас глюкозы в нейронах в виде гликогена. Окисление неуглеводных субстратов с целью получения энергии невозможно, поэтому при гипогликемии и/или даже кратковременной гипоксии в нервной ткани образуется мало АТФ. Следствием этого являются быстрое наступление коматозного состояния и необратимых изменений в ткани мозга.
Процессы метаболизма глюкозы осуществляются в теле нейрона, и его отростках, шванновских клетках (миелиновой оболочке), следовательно, все отделы нервной ткани способны синтезировать АТФ.
Высокая скорость потребления глюкозы нервными клетками обеспечивается, в первую очередь, работой высокоактивной гексокиназы мозга. В отличие от других тканей, здесь гексокиназа не является ключевым ферментом всех путей метаболизма глюкозы. Гексокиназа мозга обладает в 20 раз большей активностью, чем соответствующий изофермент печени и мышц. Под воздействием гексокиназы и при участии АТФ глюкоза превращается в глюкозо-6-фосфат. Фосфорелирование глюкозы является необратимым процессом и служит способом захвата глюкозы клетками. Глюкоза немедленно связывается с фосфатом и в такой форме уже не может покинуть клетку. Активность изоцитратдегидрогеназы даже при нормальном уровне утилизации глюкозы в состоянии покоя максимальна. Поэтому при повышенном энергопотреблении нет возможностей ускорения реакций ЦТК.
Образование НАДФН2, который используется в нервной ткани в основном для синтеза жирных кислот и стероидов, обеспечивается сравнительно высокой скоростью протекания ГМФ-пути распада глюкозы.
Энергия АТФ в нервной ткани используется неравномерно. Аналогично скелетным мышцам, функционирование нервной ткани сопровождается резкими перепадами в потреблении энергии. Скачкообразное повышение энергозатрат происходит при очень быстром переходе от сна к бодрствованию. Для этого существует еще один механизм: образование креатинфосфата. Несмотря на исключительную важность АТФ в качестве способа трансформации энергии, это вещество не является самым представительным хранилищем макроэргических фосфатных связей в клетках
Количество креатинфосфата, содержащего макроэргические фосфатные связи, в клетках в 3-8 раз больше. Кроме того, в условиях организма макроэргические фосфатные связи креатинфосфата содержат более 13000 к/моль. В отличие от АТФ креатинфосфат не может действовать как агент, напрямую сопряженный с переносом энергии питательных веществ функциональным системам клетки, но он может обмениваться энергией с АТФ. Когда в клетках присутствует чрезвычайно большое количество АТФ, энергия АТФ используется для синтеза креатинфосфата, который становится дополнительным депо энергии. Затем, по мере использования АТФ, энергия, содержащаяся в фосфокреатине, быстро возвращается АТФ, которую последняя может передавать функциональным системам клеток.
Эта реакция полностью обратима, ее направление зависит от соотношения АТФ/АДФ в клетках нервной ткани.
В условиях покоя концентрация АДФ в клетках низка, поэтому химические реакции, которые зависят от АДФ как одного из субстратов, осуществляются медленно. Таким образом, АДФ является главным лимитирующим скорость фактором практически всех путей обмена энергии. Когда клетки активируются, АТФ превращается в АДФ, увеличивая его концентрацию пропорционально степени активности клетки. Повышение концентрации АДФ автоматически увеличивает скорость всех метаболических реакций, направленных на высвобождение энергии из питательных веществ. Снижение активности клетки приостанавливает высвобождение энергии вследствие очень быстрого превращения АДФ в АТФ.
Известно, что на работу мозга расходуется около 20% энергии, производимой человеческим организмом. Но на что расходует эту энергию сам мозг?
До недавних пор считалось, что практически вся потребляемая мозгом энергия используется для передачи нервных импульсов, другими словами - на мыслительную деятельность. Сегодня полагают, что только две трети потребляемой мозгом энергии расходуется на распространение импульсов, а оставшаяся часть идёт на поддержание жизнедеятельности клеток самого мозга (С.Е.Северин, 2009).
Эксперименты, проведённые на лабораторных крысах с использованием магнитно-резонансной томографии, помогли установить взаимосвязь между интенсивностью обмена веществ – "скоростью" синтеза молекулы АТФ – и энергопотреблением при различных уровнях мозговой активности.
Это в свою очередь позволило оценить, какая часть общего расхода энергии не зависит от мозговой активности и расходуется на "собственные нужды", в данном случае на поддержание так называемого изоэлектрического состояния: равенства положительных и отрицательных зарядов в клетках мозговой ткани.
Известно, что физические упражнения приводят к значительному расходованию глюкозы мышцами. По этой причине в момент физических нагрузок уровень глюкозы в крови человека снижается. При этом мозг переходит на использование молочной кислоты.
Одним из важнейших факторов, определяющих специфику реакции разных нейронов на недостаток кислорода, является их различие в энергетических потребностях. Последнее, по-видимому, определяется степенью разветвленности дендритов и общей площадью клеточной мембраны, поляризация которой требует постоянного расхода энергии. Системы и центры, включающие в себя преимущественно нейроны, богатые деидритами (новая кора с ее богатейшей сетью вставочных нейронов, клетки Пуркинье мозжечка), согласно этой гипотезе, оказываются особенно ранимыми при гипоксии. Вероятно, существенную роль играют и особенности биохимии нейронов разных областей мозга (теория патоклиза - тенденция определенного анатомического образования центральной нервной системы реагировать определенным патологическим процессом на данный повреждающий фактор, например образование очагов некроза и кист в бледном шаре при отравлении окисью углерода (Рубенштейн, 1998). Именно различием биохимической структуры нейронов пытаются объяснить неодинаковую ранимость различных секторов гиппокампа.
При умирании от кровопотери на фоне длительной артериальной гипотензии важнейшее значение приобретают особенности кровоснабжения различных образований мозга, так как в этих случаях в более выгодном положении оказываются области мозга, расположенные ближе к магистральным сосудам (подкорковые области, системы основания мозга, особенно ствол), функции которых угасают позднее функций новой коры больших полушарий. Распределение областей повреждения в мозге, пережившем прекращение кровообращения, определяется как спецификой обмена веществ различных видов нейронов, так и особенностями кровоснабжения разных отделов и участков мозга.
К этим двум факторам избирательной ранимости различных отделов мозга следует добавить фактор относительной сложности функции (и соответственно ее филогенетического «возраста»), так как более молодые в филогенетическом отношении функции, являющиеся и более сложными (например, мышление), обслуживаются большим числом нейронных систем, расположенных на многих, в том числе и на более высоких анатомических уровнях и, естественно, оказываются более уязвимыми при кислородном голодании. Немаловажное значение имеет и степень функциональной активности систем мозга (а следовательно, их энергетические потребности и состояние кровоснабжения) в момент возникновения гипоксии.
3. Метаболизм липидов
Большая часть липидов нервной ткани находится в составе плазматических и субклеточных мембран нейронов и в миелиновых оболочках. В нервной ткани по сравнению с другими тканями организма содержание липидов очень высокое. Особенностью липидного состава нервной ткани можно считать присутствие фосфолипидов (ФЛ), гликолипидов (ГЛ) и холестерина (ХС) и отсутствие нейтральных жиров. В нервной системе содержится большое количество сфингомиелинов, являющихся по своим электрическим свойствам изоляторами. Эфиры холестерина можно встретить только в участках активной миелинизации. Холестерин интенсивно синтезируется только в развивающемся мозге, так как у взрослого человека низка активность ОМГ-КоА-редуктазы - ключевого фермента синтеза холестерина. Содержание свободных жирных кислот в мозге весьма низкое.
Важная роль холестерола и фосфолипидов в образовании структурных компонентов клеток обусловлена низкой скоростью замещения этих веществ и их функциональное участие в обеспечении процессов памяти в клетках мозга сопряжено именно с этим.
Некоторые нейромедиаторы после взаимодействия со специфическими рецепторами изменяют свою конформацию и изменяют конформацию фермента фосфолипазы С, которая катализирует расщепление связи в фосфатидилинозите между глицерином и остатком фосфата, в результате чего образуется фосфоинозитол и диацилглицерин. Эти вещества являются регуляторами внутриклеточного метаболизма. Диацилглицерин активирует протеинкиназу С, а фосфоинозитол вызывает повышение концентрации Са2+. Ионы кальция влияют на активность внутриклеточных ферментов и участвуют в работе сократительных элементов нервных клеток: микрофиламентов, что обеспечивает передвижение различных веществ в теле нервной клетки, аксоне и его растущем кончике. Протеинкиназа С участвует в реакциях фосфорилирования белков внутри нервных клеток. Если это белки-ферменты, то меняется их активность, если это рибосомальные или ядерные белки, то изменяется скорость биосинтеза белков.
Липиды в нервной ткани постоянно обновляются. Скорость их обновления различна, но в целом низка. Некоторые липиды (например: холестерин, цереброзиды, фосфатидилэтаноламины, сфингомиелины) обмениваются медленно - в течение нескольких месяцев и даже лет. Исключение составляют фосфатидилхолин и, особенно, фосфатидилинозиты (содержат глицерин, фосфат, спирт (инозит, жирные кислоты) - они обмениваются очень быстро (в течение суток или недель).
В развивающемся мозге в период миелинизации синтез цереброзидов и ганглиозидов протекает с большой скоростью. У взрослых почти все цереброзиды (до 90%) находятся в миелиновых оболочках, а ганглиозиды - в нейронах. При этом клетки мозга не могут использовать жирные кислоты в целях получения энергии.
4. Метаболизм белков и аминокислот
Свободные аминокислоты нервной ткани или так называемый аминокислотный пул на протяжении многих лет были объектом тщательного изучения. Это объясняется не только исключительной ролью аминокислот как источника синтеза большого числа биологически важных соединений, таких, как белки, пептиды, некоторые липиды, ряд гормонов, витаминов, биологически активных аминов и др. Аминокислоты или их дериваты участвуют и в синаптической передаче, в осуществлении межнейрональных сетей в качестве нейротрансмиттеров и нейромодуляторов. Существенной является также их энергетическая значимость, ибо аминокислоты глутаминовой группы непосредственно связаны с циклом трикарбоновых кислот. Ткань мозга интенсивно обменивается аминокислотами с кровью. Для этого существует две специальные транспортные системы для незаряженных и еще несколько - для аминокислот, имеющих положительный или отрицательный заряд.
До 75% общего количества аминокислот нервной ткани составляют аспартат, глутамат, а также продукты их превращений или вещества, синтезированные с их участием (глутамин, ацетильные производные, глутатион, ГАМК и другие). Их концентрация, и в первую очередь, глутамата, в нервной ткани очень высока. Например, концентрация глутаминовой кислоты может достигать 10 ммоль/л (А.Я.Николаев,2004).
Глутаминовая кислота по праву занимает центральное место в обмене аминокислот мозга. Она используется для образования глутатиона, глутамина и гамма-аминомасляной кислоты. Образуется глутамат из своего кетоаналога - -кетоглутаровой кислоты в ходе реакции трансаминирования. Реакция превращения альфа-КГ в глутамат протекает в ткани мозга с большой скоростью. Образующийся при этом глутамат является для ЦТК побочным продуктом. Большое расходование альфа-КГ восполняется за счет превращения аспарагиновой кислоты в метаболит ЦТК - ЩУК.
Образующаяся из глутамата ГАМК в результате нескольких реакций может быть превращена снова в ЩУК. Так образуется ГАМК-шунт, имеющийся в тканях головного и спинного мозга. Поэтому в этих тканях содержание ГАМК, как промежуточного метаболита циклического процесса, значительно выше, чем в остальных. На образование ГАМК здесь используется до 20% от общего количества глутамата (рис.1). Остальные пути метаболизма аминокислот сходны с имеющимися в других тканях.До сих пор непонятным остается наличие в мозге почти полного набора ферментов орнитинового цикла, не содержащего карбамоилфосфатсинтазы, поэтому мочевина здесь не образуется.
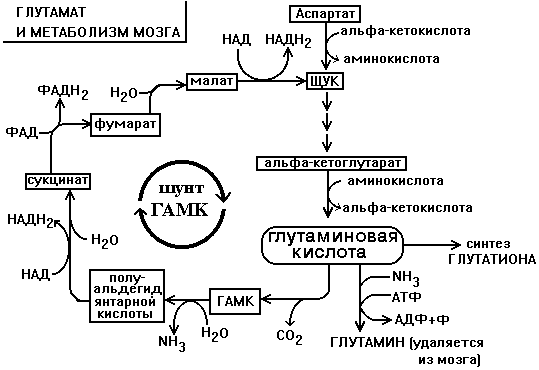
Рис. 1. Схема шунтирования ГАМК (подробности в тексте).
Ткань мозга, как и другие ткани, способна синтезировать заменимые аминокислоты. Здесь постоянно образуется аммиак; его непосредственным источником служит дезаминирование АМФ. Образующийся аммиак связывается с глутаматом и в форме глутамина покидает мозг. Первичными источниками аминогруппы для регенерации АМФ из ИМФ служат разные аминокислоты, а промежуточными переносчиками - глутамат и аспартат. Таким образом, первичным источником аммиака в мозге являются аминокислоты.
Дезаминирование – это процесс отдачи аминогруппы кислотой, в основе которого лежит трансаминирование, т.е. перенос аминогруппы какому-либо акцептору. Аминогруппа аминокислоты переносится к -кетоглутаровой кислоте, которая после этого становится глутаминовой кислотой. Глутаминовая кислота может передавать аминогруппу каким-то веществам либо высвобождать ее в виде аммиака. В процессе утраты аминогруппы глутаминовая кислота вновь становится -кетоглутаровой кислотой, и цикл может повторяться снова. После дезаминирования аминокислот образующиеся кетокислоты в большинстве случаев могут окисляться с выделение энергии для метаболических нужд. При этом обычно осуществляется два последовательных процесса: 1) кетокислоты превращаются в химические вещества, которые могут включаться в цикл лимонной кислоты; 2) затем эти вещества, расщепляясь в цикле лимонной кислоты, служат источником энергии аналогично ацетил – КоА, образующегося при метаболизме углеводов. В целом при окислении 1 г белка образуется АТФ несколько меньше, чем при окислении 1 г глюкозы.
5. Особенности метаболизма нуклеиновых кислот.
Содержание РНК в нервных клетках самое высокое по сравнению с клетками остальных тканей организма. Скорость синтеза РНК тоже очень велика.
В клетках нервной ткани не могут синтезироваться пиримидины (в нервной ткани отсутствует фермент карбамоилфосфатсинтаза). Пиримидины обязательно должны поступать из крови - ГЭБ для них проницаем. ГЭБ легко проницаем и для пуриновых мононуклеотидов, в отличие от пиримидиновых, которые могут синтезироваться в нервной ткани.
В нервной ткани, так же, как и в других, нуклеиновые кислоты обеспечивают хранение и передачу генетической информации и ее реализацию при синтезе клеточных белков. Например, сильные раздражители: громкие звуки, сильные зрительные стимулы и эмоции приводят к повышению скорости синтеза РНК и белка в определенных участках мозга. Это указывает на то, что изменения в нервной системе, отражающие индивидуальный опыт организма, кодируются в виде синтезированных макромолекул.
Информация, благодаря которой нейроны устанавливают селективные связи с определенными нейронами, кодируется в структуре полисахаридных веточек мембранных гликопротеинов. Образование таких связей, не заложенных в период эмбрионального развития, является результатом опыта индивидуума и составляет материальную основу для хранения информации, определяющей особенности поведения данного организма.
6. Роль воды в обеспечении функционирования головного мозга
С обезвоживанием организма сначала уменьшается объем клеточной жидкости, затем внеклеточной, а затем уже вода извлекается из кровяного русла. Этот механизм призван обеспечить водой головной мозг, в котором содержится около 75% воды. Потеря даже 10% воды приводит к тяжелым последствиям. Ведущая роль воды для головного мозга ребенка, находящегося в утробе матери подчеркивается разными исследователями. Ребенок там практически всегда находится вниз головой. В данном положении улучшается кровоснабжение мозга, от которого в этот период зависит вся последующая жизнь человека. Особенно чувствительны к недостатку воды клетки мозга, которые должны постоянно удалять токсические продукты, образующиеся в результате его деятельности. Чтобы мозг мог использовать энергию, получаемую из пищи, она должна пройти множество промежуточных реакций, для чего необходимо достаточное количество воды, которая сама по себе не является энергетическим продуктом.
Кроме того, мозг омывается жидкостью, вырабатываемой капиллярами мозга (спинномозговая жидкость содержит больше натрия и меньше калия, чем все остальные жидкости).
7. Химические особенности миелина
Нервные волокна окружены миелиновой оболочкой, которую в мозге образуют клетки глии (олигодендроглиальные клетки). В расчете на массу сухого вещества миелиновая оболочка содержит 70% липидов и 30% белков. Около 65% всех липидов мозга находится в миелиновых оболочках (табл. 2).
Белки миелина, как правило, гиброфобны, не растворяются в воде, но образуют нековалентные соединения с липидами мембраны. Около 1/3 от всех белков миелина приходится на водорастворимый щелочной белок, получивший название «энцефалитного» белка.
Таблица 1.
Липидный состав миелина нервной ткани человека
липиды |