Фазы внедрения, соединения включения
Контрольная работа
Фазы внедрения, соединения включения
Содержание
Введение
1 Соединения внедрения
1.1 Гидриды переходных элементов
1.2 Оксиды, нитриды, карбиды, бориды
2 Соединения графита
3. Нитрид бора, сульфиды
4. Вольфрамовые бронзы
5. Соединения включения
5.1 Клатраты газов
5.2 Цеолиты
6. Фуллерены.
7. Фуллериты
Литература
Введение
Образование химического соедине�ния из простых веществ,
nА + mВ АnBm (1)
как правило, протекает со значительным изменением структуры исходных веществ.
Однако иногда образование соединения может происходить таким образом, что структура одного из ис�ходных веществ не меняется (или почти не меняется).
В этом случае частицы другого исходного вещества (атомы, ионы, молекулы, кластеры) в нее внедряются. Такие соединения называются соедине�ниями внедрения или фазами внед�рения.
А + xВ АBx (2)
Вообще говоря, соединения внедре�ния могут относиться к разным классам, иметь различные состав, строение и свойства. Мы рассмотрим наиболее характерные из этих соединений:
1. соединения внедрения в кристаллические решетки металлов (гидриды, оксиды, нитриды, карбиды, бориды);
2. соединения графита и родственных по структуре соединений;
3. соединения типа вольфрамовых бронз;
Другим типом подобных систем являются соединения включения или клатраты (от латинского слова clathratus – окружение или защита поперечным барьером или решеткой). Клатратными соединениями (соединениями включения) называют�ся соединения, образующиеся в результате обратимо�го внедрения молекул одного сорта (молекул-"гостей") в межкристаллическое пространство молекул другого сорта (молекул-"хозяев") без образования химических связей. Всегда можно подобрать условия, способствующие образованию такого типа соедине�ний, и условия выделения включенных молекул. Включение возможно только при том условии, что полость в кристаллах молекул-"хозяев" соответствует размерам молекул-"гостей".
Будут рассмотрены следующие классы таких соединений:
1. клатраты газов
2. цеолиты
3. соединения на основе фуллеренов.
1 Соединения внедрения
Кристаллические решетки металлов в большинстве случаев представляют собой плотные упаковки, в которых имеются два вида пустот - октаэдрические и тетраэдрические. (см. рис. 1 и 2 )
Рис. 1 Образование октаэдрических пустот в структуре плотнейшей упаковки атомов металла.
Рис. 2 Образование тетраэдрических пустот в структуре плотнейшей упаковки атомов металла.
Если на металл подействовать каким-то веществом, содержащим атомы небольшого раз�мера (водород, углерод, азот, бор и т.п.), то оказывается, что такие небольшие атомы могут внедряться в пустоты, имеющиеся в плотной упаковке атомов металла. Именно так образуются типичные соединения внедрения. Образование соеди�нений внедрения на основе металлической решетки особенно характерно для металлов побочных под�групп. Это связано с целым рядом факторов (возможно, не все еще известны). Однако одной из основных причин являются высокие энергии кристаллических решеток переходных металлов. С термодинамической точки зрения оказывается выгоднее образовать фазу внедрения, нежели разрушать структуру металла в процессе химического превращения. Кроме того, характер связи в кристаллах переходных элементов нельзя отнести к типично металлическому. Там есть заметная доля ковалентной составляющей.
Определяя размеры вне�дряющихся атомов, был использован термин "небольшие". Однако здесь необходимо определиться точнее. Из геометрических соображений следует, что отношение радиуса внедряющихся атомов rВ к радиусу атомов, образующих плотную упаковку, rА не должно превы�шать 0,59 - только в этом случае внедрение может произойти. Необходимым условием образования фаз внедрения, следовательно, является следующее соотношение:
(3)
Тогда атомы металла находятся во взаимном контакте, а атомы неметалла занимают промежуточные позиции в решетке. Атомы металла обычно располагаются так же, как и в решетке свободного металла. Встречаются кубические или гексагональ�ные плотноупакованные структуры с координационным числом 12 или кубические объемо-центрированные структуры с координа�ционным числом 8. Реже встречаются простые гексагональные решетки. В результате внедрения атомов неметалла образуются структуры, отраженные в таблице 1
Естественно, не только относительные размеры атомов определяют возможность внедрения. Известно немало случаев, когда при rВ/rА << 0,59 атомы В не могут внедриться в плот�ную упаковку атомов А. Не все металлы побочных подгрупп, например, поглощают водород.
Таблица 1 Классификация структур внедрения
|
Координационное число атомов металла
|
Тип металлической решетки
|
Координационное число атомов неметалла
|
Тип структуры
|
Отношение атомных радиусов rB/rA
|
|
12
8
|
ГЦК
ГПУ
ОЦК
|
6
4
6
4
4
|
NaCl
Флюорит (цинк. обманка)
NaCl
Вюрцит
|
>0.41
>0.23
>0.41
>0.23
>0.29
|
Таким образом, соотношение размеров атомов определяет принципиальную возможность существо�вания фаз внедрения. А реализуется эта возмож�ность или нет, в каждом конкретном случае зависит от целого ряда причин.
Рассмотрим на примере соеди�нений элементов побочных под�групп с водородом, какие физиче�ские и химические свойства опреде�ляются именно тем, что они являются продуктами внедрения одних атомов в решетку, состоящую из других атомов.
1.1 Гидриды переходных элементов
Начнем с состава соединений внедрения. Рассмотрим этот вопрос на примере гидридов переходных элементов. Если при образо�вании фазы внедрения атомы водорода попадают только в тетраэдрические пустоты в решетке металла, то пре�дельное содержание водорода в таком соединении должно соответствовать формуле МеН2 (где Ме - металл, атомы которого образуют плотную упаковку). Ведь тетраэдрических пустот в решетке в два раза больше, чем атомов, образующих плотную упаковку. Если же атомы водорода попадают только в октаэдрические пустоты, то из таких же соображений следует, что предельное содержание водорода должно соответ�ствовать формуле МеН, - октаэдрических пустот в плотной упаковке столько же, сколько слагающих эту упаковку атомов.
Обычно при образовании соединений переходных металлов с водородом заполняются либо октаэдрические, либо тетраэдрические пустоты. В зависимости от природы исходных веществ и условий проведения процесса может произойти полное или только ча�стичное заполнение. В последнем случае состав соединения будет отклоняться от целочисленной формулы, будет неоп�ределенным, например МеН1-x; МеН2-x . Соединения внедрения, следовательно, по самой своей природе должны быть соединениями переменного состава, т. е. такими, состав которых в зависимости от усло�вий их получения и дальнейшей обработки меняется в довольно широких пределах.
Рассмотрим некоторые типичные свойства фаз внедрения на примере соединений с водородом. Для этого сравним гидриды некоторых переходных элементов с гидридом щелочного металла (лития).
При соединении лития с водородом, образуется вещество определенного состава LiH. По физическим свойствам оно не имеет ничего общего с исходным металлом. Литий проводит электрический ток, обла�дает металлическим блеском, пластичностью, словом, всем комплексом ме�таллических свойств. Гидрид же лития не обладает ни од�ним из этих свойств. Это бесцветное солеобразное вещество, нисколько не похожее на металл. Как и другие гидриды щелочных и щелочноземельных ме�таллов, гидрид лития - типичное ионное соединение, где атом лития имеет значительный положительный заряд, а атом водорода - такой же отрицательный за�ряд. Плотность лития равна 0,53 г/см3, а плотность гид�рида лития 0,82 г/см3 - происходит заметное возрастание плотности. (То же самое наблюдается при образовании гидридов других ще�лочных и щелочноземельных металлов).
Совершенно иные превращения претерпевает палладий (типичный переходный элемент) при взаимодействии с водородом. Хорошо известен демонстрационный опыт, при котором пластина палладия, покрытая с одной стороны газонепроницаемым лаком, изгибается при обдувании водородом.
Это происходит потому, что плотность образующегося гидрида палладия уменьшается. Такое явление может иметь место, только если расстояние между атомами металла возрастает. Атомы внедрившегося водорода "расталкивают" атомы металла, изменяя характеристики кристаллической решетки.
Увеличение объема металлов при погло�щении водорода с образованием фаз внедрения происходит настолько заметно, что плотность металла, насыщенного водородом, оказывается существенно ниже, плотности исходного металла (см. таблицу 2)
Строго говоря, решетка, образованная атомами металла, обычно не остается совсем неизменной пос�ле поглощения этим металлом водорода. Как ни мал атом водорода, он все-таки вносит в решетку иска�жения. При этом обычно происходит не просто пропор�циональное увеличение расстояний между атомами в решетке, но и некоторое изменение ее симметрии. Поэ�тому часто лишь для простоты говорится, что атомы водорода внедряются в пустоты в плотной упаков�ке - сама по себе плотная упаковка атомов металла при внедрении атомов водорода все же нарушается.
Таблица 2 Изменение плотности некоторых переходных металлов при образовании фаз внедрения с водородом.
|
Металл /Гидрид металла
|
Плотность г/см3
|
|
Ti
TiH2
Zr
ZrH2
Hf
HfH2
|
54
3.75
6.5
5.62
13.3
11.37
|
Это далеко не единственное отличие между гидридами типичных и переходных металлов.
При образовании гидридов внедрения сохраняются такие типичные свойства металлов, как металличе�ский блеск, электропроводность. Правда, они могут быть выра�жены слабее, чем у исходных металлов. Таким образом, гидриды внедрения значительно боль�ше похожи на исходные металлы, чем ги�дриды щелочных и щелочноземельных металлов.
Значительно сильнее изменяется такое свойство как пластичность - насыщенные водородом металлы делаются хрупкими, часто ис�ходные металлы трудно превратить в порошок, а с гидридами тех же металлов это сделать гораздо лег�че.
Наконец нужно отметить очень важное свойство гидридов внедрения. При взаимодействии переходных металлов с водородом металлический образец не разрушается. Более того, он сохраняет первоначальную форму. Это же происходит и при обратном процессе – разложении гидридов (потере водорода).
Может возникнуть естественный вопрос: а можно ли считать процесс образования фаз внедрения химическим в полном смысле этого слова? Возможно образование водных растворов – процесс, имеющий куда больше "химизма"?
Для ответа надо привлечь химическую термодинамику.
Известно, что образование химических соединений из простых веществ (как впрочем, и другие химические процессы) обычно сопровождается заметными энергетическими эффектами. Чаще всего эти эффекты экзотермические, причем, чем больше энергии выделяется, тем проч�нее полученное соединение.
Тепловые эффекты - один из важнейших при�знаков того, что происходит не просто смешение ве�ществ, а протекает химическая реакция. Раз изменяется внутренняя энергия системы, следовательно, происходит образование новых связей.
Посмотрим теперь, какие же энергетические эффекты вызывает образование гид�ридов внедрения. Оказывается, что разброс здесь достаточно велик. У металлов побочных подгрупп III, IV и V групп периодической системы образование гидридов внедрения сопровож�дается значительным выделением тепла, порядка 30—50 ккал/моль (при образовании ги�дрида лития из простых веществ выделяется около 21 ккал/моль). Можно признать, что гидриды внедрения, по крайней мере, элемен�тов указанных подгрупп, вполне "настоя�щие" химические соединения. Следует, однако, отметить, что для многих металлов, расположенных во второй половине каждого переходного ряда (например, для железа, никеля, меди), энергетиче�ские эффекты образования гидридов внедрения неве�лики. Например, для гидрида примерного состава FeH2 тепловой эффект со�ставляет всего 0,2 ккал/моль.
Малая величина Н обр таких гидридов диктует методы их получения – не прямое взаимодействие металла с водородом, а косвенный путь.
Рассмотрим несколько примеров.
Гидрид никеля, состав которого близок к NiH2, можно получить, действуя на эфирный раствор хлористого никеля фенилмагнийбромидом в токе Н2:
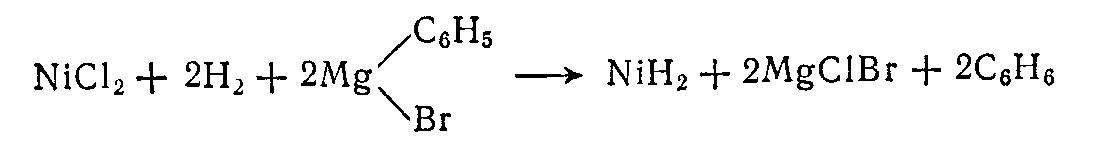
(4)
Получаемый в результате этой реакции гидрид никеля представляет собой черный порошок, легко отдающий водород (что вообще свойственно гидри�дам внедрения), при небольшом нагревании в атмо�сфере кислорода он воспламеняется.
Таким же путем могут быть получены гидриды соседей никеля по периодической системе - кобальта и железа.
В основе другого способа получения гидридов переходных лежит исполь�зование аланата лития LiAlH При взаимодействии хлорида соответствующего металла с LiAlH4 в эфир�ном растворе образуется аланат этого металла:
MeCl2 + LiAlH4 Me(AlH4)2 + LiCl (5)
Для многих металлов аланаты - непрочные сое�динения, распадающиеся при повышении темпера�туры.
Me(AlH4)2 MeH2 + Al + H2 (6)
Но для некоторых металлов побочных подгрупп протекает иной процесс:
Me(AlH4)2 MeH2 + AlH3 (7)
В этом случае вместо смеси водорода и алюминия образуется гидрид алюминия, который растворим в эфире. Промыв продукт реакции эфиром, можно получить в остатке чистый гидрид переходного металла. Таким путем были получены, например, малоустойчивые гидриды цинка, кадмия и ртути.
Можно сделать вывод, что получение гидридов элементов побочных подгрупп основано на ти�пичных методах неорганического синтеза: реак�ции обмена, термическое разложение непрочных соединений в определенных условиях и т. д. Этими способами были получены гидриды почти всех переходных элементов, даже весьма непрочные. Состав полученных гидридов обычно близок к стехиометрическому: FeH2, CоH2, NiH2 ZnH2, CdH2, HgH2. По-видимому, достижению стехиометрии способствует невысокая температура, при которой проводятся эти реакции.
Разберем, теперь влияние условий реакции на состав получаемых гидридов внедрения. Оно прямо вытекает из принципа Ле-Шателье. Чем вы�ше давление водорода и ниже темпе�ратура, тем ближе к предельной ве�личине насыщение металла водородом. Иными сло�вами, каждой определенной температуре и каждой величине давления соответствует определенная степень насыщения металла водородом. И наоборот, каждой темпе�ратуре соответствует определенное равновесное дав�ление водорода над поверхностью металла.
Отсюда проистекает одно из возможных применений гидридов переходных элементов. Допустим, в какой-то системе нужно создать строго определенное давление водорода. В такую систему помещается насыщен�ный водородом металл (в опытах использовался титан). Нагре�вая его до определенной температуры, можно создать в системе нужное давление газо�образного водорода.
Любой класс соединений интересен своей химической природой, составом и строением частиц из которых состоит и характером связи между этими частицами. Этому химики посвящают свои теоретические и экспериментальные работы. Не являются исключением с фазы внедрения.
Окончательной точки зрения на природу гидридов внедрения пока нет. Ча�сто разные, иногда противоположные точки зрения удачно объясняют одни и те же факты. Иными словами, пока не существует единых теоретических воззрений на строение и свойства соединений внедрения.
Рассмотрим некоторые экспериментальные факты.
Наиболее подробно изучен процесс поглощения водорода палладием. Для этого переходного металла характерно, что концентрация рас�творенного в нем водорода при постоянной темпера�туре пропорциональна квадратному корню из величины внешнего давления водорода.
(8)
При любой темпера�туре водород в какой-то степени, диссоциирует на свободные атомы, поэтому имеется равновесие:
Н2 2Н (9)
Константа этого равновесия:
(10)
где рН — давление (концентрация) атомарного водо�рода.
Отсюда (11)
Видно, что концентрация атомарного водорода в газовой фазе пропорциональна корню квадратному от величины давления (концентрации) молекулярного водорода. Но той же величине пропорциональна и концентрация водорода в палладии.
Отсюда можно сделать вывод, что палладий растворяет водород в виде отдельных атомов.
Каков, в таком случае характер связи в гидриде палладия? Для ответа на этот вопрос был проделан ряд экспериментов.
Было обнаружено, что при пропускании электри�ческого тока через насыщенный водородом палладий атомы неметалла перемещаются к катоду. Надо полагать, что оказавшийся в решетке металла водород полностью или частично диссоциируют на протоны (т. е. ионы Н+) и электроны.
Данные об электронном строении гидрида палладия были получены при изучении магнитных свойств. Исследовалось изменение магнитных свойств гидрида от количества водорода, вошедшего в структуру. На основании изучения магнитных свойств вещества можно оценить, какое число неспаренных электронов содержится в частицах, из которых это вещество состоит. В среднем на один атом пал�ладия приходится примерно 0,55 неспаренного электрона. При насыщении палладия водородом число неспаренных электронов уменьшается. А в веществе состава PdH0,55 неспаренные электроны практически отсутствуют.
На основании этих данных можно сделать вывод: неспаренные электроны палладия образуют пары с неспаренными электронами атомов водорода.
Однако, свойства гидридов внедрения (в частности, электрические и магнитные) можно объ�яснить и на основе противоположной ги�потезы. Можно предположить, что в гидридах внедрения имеются ионы Н-, образую�щиеся за счет захвата атомами водорода части полу�свободных электронов, имеющихся в решетке метал�ла. В этом случае электроны, полученные от металла, также образовывали бы пары с электронами, имею�щимися на атомах водорода. Такой подход также объясняет результаты магнитных измерений.
Возможно, в гидридах внедрения сосуществуют оба вида ионов. Электроны металла и электроны водорода образуют пары и, следователь�но, возникает ковалентная связь. Эти электронные пары могут быть смещены в той или иной степени к одному из атомов - металла или водорода.
Электронная пара смещена сильнее к атому металла в гидридах тех металлов, которые ме�нее склонны отдавать электроны, например в гидри�дах палладия или никеля. А вот в гидридах скандия и урана, по-видимому, электронная пара сильно сме�щена в сторону водорода. Поэтому гидриды лантаноидов и актиноидов во многом похожи на гидриды щелочноземельных металлов. Кстати, гидрид лан�тана достигает состава LaH3. Для типичных же гидридов внедрения содержание водорода, как мы теперь знаем не выше чем соответствующее формулам МеН или МеН2.
Еще один экспериментальный факт показывает трудности определения характера связи в гидридах внедрения.
Ес�ли при низкой температуре удалить из гидрида палладия водород, то удается сохранить искаженную ("расширенную") решетку, которая была у насыщен�ного водородом палладия. Магнитные свойства (отметьте это), электропроводность и твердость у такого палладия в целом те же, что были у гидрида.
Отсюда следует, что при образовании гидридов внедрения изменение свойств вызвано не только присутствием в них водорода, но и просто изменением межатомных расстояний в решетке.
Приходится признать, что вопрос о при�роде гидридов внедрения очень сложен и далек от окончательного разрешения.
Человечество всегда славилась тем, что, даже не зная до конца всех аспектов каких-либо явлений, оно умело практически использовать эти явления. Это в полной мере касается гидридов внедрения.
Образование гидридов внедрения в од�них случаях сознательно используют на практике, в других случаях, наоборот, его стараются избегать.
Гидриды внедрения сравнительно легко отдают водород при нагревании, а иногда и при низких температурах. Где можно использовать это свойство? Конечно в окислительно-восстановительных процессах. Тем более, что отдаваемый гидридами внедрения во�дород на какой-то стадии процесса находится в атомарном состоянии. С этим, вероятно, связана хими�ческая активность гидридов внедрения.
Известно, что хорошими катализаторами для реакций, в кото�рых водород присоединяется к какому-либо веществу, являются металлы восьмой группы (железо, никель, платина). Возможно, их каталитическая роль связана с промежуточ�ным образованием непрочных гидридов внедрения. Диссоциируя в дальнейшем, гидриды обеспечивают реакцион�ную систему определенным количеством ато�марного водорода.
Например, тонкодисперсная платина (так назы�ваемая платиновая чернь) катализирует реакцию окисления водорода кислородом - в ее присутствии эта реакция идет с заметной скоростью даже при комнатной температуре. Это свойство платиновой чер�ни используется в топливных элементах - устрой�ствах, где химические реакции ис�пользуются для непосредственного получения электрической энергии, ми�нуя получение тепловой (этап горения). На этом же свойстве тонкодисперсной платины основан так называемый водородный элек�трод - важный инструмент изуче�ния электрохимических свойств растворов.
Образование гидридов внедрения используют для получения особо чистых порошков металлов. Ме�таллический уран и другие актиниды, а также очень чистые титан и ванадий пластичны, и поэтому практически невозможно приго�товить из них порошки методом растирания металла. Чтобы лишить металл пластич�ности, его насыщают водородом (эта операция называется "охрупчивание" металла). Об�разовавшийся гидрид легко растирают в порошок. Некоторые металлы уже при насыщении водородом сами переходят в порошковое состояние (уран). Затем при нагревании в вакууме, водород удаляется и остается порошок чистого металла.
Термическое разложение некоторых гидридов (UH3, TiH2) можно исполь�зовать для получения чистого водорода.
Наиболее интересны области применения гидрида титана. Его применяют для производства пенометаллов (например, пеноалюминия). Для этого гидрид вводят в расплавленный алюми�ний. При высокой температуре он разлагается, а образо�вавшиеся пузырьки водорода вспенивают жидкий алюминий.
Гидрид титана можно использовать как восстановитель оксидов некоторых металлов. Он может служить припоем для соединения металлических деталей, и веществом, ускоряющим процесс спекание частиц металла в порошковой металлургии. В последних двух случаях также используются восстановительные свойства гид�рида. На поверхности частичек металла, и металлических деталей обычно образуется слой оксидов. Он препятствует сцеплению соседних участков металла. Гидрид титана при на�гревании восстанавливает эти оксиды, очищая тем самым поверхность металла.
Гидрид титана применяют для получения некоторых осо�бых сплавов. Если разлагать его на поверхности медного изделия, то обра�зуется тонкий слой сплава меди с титаном. Этот слой придает поверхности изделия особые механические свойства. Таким образом, можно сочетать в одном изделии несколько важных свойств (электропроводность, прочность, твердость, устойчивость к истиранию и т. п.).
Наконец, гидрид титана является весьма эф�фективным средством для защиты от нейтронов, гамма-лучей и других жестких излучений.
Иногда же с образованием гидридов внедрения напротив приходится бороться. В металлургии, в химической, нефтяной и других отраслях промышленности водород или его соединения находятся под давлением и при высоких температурах. В таких условиях водород может в заметной степени диффундировать через нагретый металл, попросту "уходить" из аппаратуры. Кроме того (и это, пожалуй, важнее всего!), из-за образования гидридов внедрения может сильно понизиться проч�ность металлической аппаратуры. А это уже таит в себе серьезную опасность при работе с высоки�ми давлениями.
1.2 Оксиды, нитриды, карбиды, бориды.
Переходные металлы способны образовывать фазы внедрения не только с участием водорода, но и других относительно небольших атомов неметаллов (углерода, азота, кислорода).
Рассмотрим процесс постепенного поглощения металлическим титаном кислорода. Допустим, процесс протекает со скоростью, позволяющей после присое�динения каждой новой порции кислорода устанавливаться химическому равновесию. Пока отношение числа атомов кислорода к числу ато�мов титана не превысит 0.5, твердое тело остается внешне однородным. Это будет одна и та же твердая фаза независимо от количества поглощенного кисло�рода. Свойства такого твердого тела будут изменяться непрерывно от состава Ti (чистый титан) до со�става Ti2O. Таким образом, эту фазу можно считать твердым раствором кисло�рода в металлическом титане или твердым раствором Ti2O в титане.
В таком твердом теле атомы кислорода внедряют�ся в октаэдрические пустоты между атомами метал�ла. Это внедрение оказывает влияние на кристаллическую ре�шетку - атомы металла немного смещаются по сравнению со своими положениями в решетке чистого металла.
Можно считать, что твердый раствор кислорода в титане представляет собой ти�пичную фазу внедрения. Однако в сравнении с гидридом титана имеются существенные отличия. Поскольку атомы кислорода заметно крупнее атомов водорода, то они зани�мают не тетраэдрические, а большие по размерам октаэдрические пустоты в решетке титана. Состав фазы внедрения для водорода достигает (или почти достигает) формулы TiH2, т. е. предельной форму�лы при заполнении тетраэдрических пустот. Состав же твердого раствора кислорода в титане не достигает даже предельной формулы для случая, когда запол�няются октаэдрические пустоты.
Если количество присоединенного к титану кисло�рода больше, чем отвечает формуле Ti2О, то избы�ток кислорода образует оксид титана (II) (соединение переменного состава, примерно отвечающее формуле TiO). У этого вещества свойства и главное - другая структура.
Исследования продуктов внедрения кислорода в титан обнаружили, интересное явление. При невысоких температурах атомы кислорода распределяются по пу�стотам решетки металла не хаотически, а в опреде�ленном порядке. Образуется так называемая сверхструктура из атомов кислорода внутри твердой фазы.
Определенному типу структуры должен соответствовать и определенный состав. Оказалось, что в слу�чае фазы Ti-Ti2O имеются такие структуры из атомов кис�лорода, которые соответствуют формулам Ti6O или Ti3O. Можно с определенной натяжкой говорить, что существуют химические соеди�нения Ti6O и Тi3О - определенные состав и струк�тура это признанные атрибуты химического соеди�нения.
Правда, это соединения особого рода. Они называются субокси�дами. Субоксиды титана не имеют своей области гомогенности, а находятся вну�три области гомогенности фазы Ti - Ti2O. Но изуче�ние зависимости свойств фазы Ti — Ti2O от состава яв�но показывает, что при составах Ti6O и Ti3O свойства изменяются именно так, как это должно быть при наличии определенного химического соединения.
Кислород может внедряться в довольно больших количествах также в решетки других переходных элементов (например, вольфрама, ниобия).
Как и в случае титана, для вольфрама и ниобия были обнаружены схожие субоксиды (например, W3O, Nb6O).
Как и внедрение водорода, внедрение кислорода в решетку металла может резко изменить его меха�нические свойства. Например, нельзя получить пластичный титан, не удалив из него кислород. Поэтому титан долгое время считался непластичным металлом - те образцы, которые исследовались, были твердыми и хрупкими из-за примесей, в частности кислорода. После получения высокоочищенного от примесей титана выяснилось, что это – пластичный металл. Теперь считается, что механические свойства (в частности хрупкость) некоторых переходных металлов – это лишь следствие наличия примесных атомов в их кристаллических решетках, а не собственно свойства этих металлов.
Рассмотрим теперь некоторые свойства нит�ридов и карбидов внедрения. Такими являются многие соединения переходных элементов с углеродом и азотом. Типичными карбидами внедрения являются карбиды титана, ванадия, хрома, марган�ца, железа, кобальта, никеля и их аналогов, а также те карбиды скандия, иттрия, лантана, лантаноидов и актиноидов, которые имеют формулы Ме3С и МеС. Ти�пичными нитридами внедрения являются низшие нит�риды титана, циркония, гафния.
Как и большинство соединений внедрения, карби�ды и нитриды внедрения имеют довольно широкие области гомогенности. Так, ширина областей гомоген�ности карбидов титана, циркония и гафния равна 20 – 30% ат. углерода. Содержание углеро�да и азота обычно ниже, чем отвечает предельной це�лочисленной формуле (TiC, TiN и т. д.).
Внедрение атомов углерода и азота в решетку ме�талла чаще всего мало изменяет взаимное расположе�ние атомов металла. Образовавшийся карбид или нит�рид внедрения сохраняет многие свойства исходного металла, в частности - непрозрачность, вы�сокую электропроводность и металлический блеск. По�этому карбиды и нитриды внедрения часто называют металлоподобными или металлическими.
По сравнению с исходными металлами у карбидов и нитридов внедрения резко увеличивается твердость. Они являются химически устойчивыми и очень туго�плавкими веществами. Например, температуры плав�ления карбидов и нитридов титана, циркония, гафния и тантала лежат в пределах 3100-3900 °С.
Формулы карбидов и нитридов внедре�ния часто бывают простейшего типа вне зависимости от обычных валент�ностей образующих эти соединения элементов. Например, TiC, ZrC. HfC, NbC, TaC, TiN, ZrN, HfN, TaN. Если состав определяется в первую очередь кристаллохимическими факторами, а не валентностью - это типичный признак фазы внедре�ния.
Известно много карбидов переходных элементов, содержащих большой избыток металла в сравнении с углеродом. Таковы карбиды Мn4С, Мn7С3, Mn3C, Fe3C (цементит). Структура таких кар�бидов довольно сложна.
Часто карбиды и нитриды внедрения оказываются более тугоплавкими, чем исходные металлы. Са�мым тугоплавким из известных в настоящее время яв�ляется карбид гафния с добавкой карбида титана (температура плавления около 4200 °С) Сам по себе карбид гафния имеет температуру плавления около 3900 °С. А температура плавления самого тугоплавкого металла - вольфрама "всего" 3400°С
Карбиды и нитриды внедрения имеют довольно большие теплоты образования - поряд�ка 30—50 ккал/моль (если считать на стехиометрический состав МеС или MeN). Как правило, чем отрицательнее величина Нобр. соединения, тем оно лег�че образуется при взаимодействии соответствующих простых веществ. Поэтому карбиды многих переходных элементов легко образуются при нагревании металл в присутствии углерода или углерод содержащих веществ.
Иногда вместо металла можно взять его оксид или иные соединения. Тогда углерод или его соединение служат восстановителями, а восстановленный металл реагирует с избытком углерода. Карбид титана получают, нагревая в электрических печах при 1900—2000°С смесь двуокиси титана с сажей:
TiO2 + C TiC + CO (13)
Карбид тантала в виде тон�кого порошка получают в результате реакции между газообразным хлоридом тантала TaCl5 и метаном при ~ 1500°С
TaCl5 + CH4 TaC + HCl (14)
В металлургии вольфрама или молибдена избегают использовать в качестве восстановителя углерод или CO. В этом случае вместо чистых металлов могут образоваться карбиды внедрения.
Напротив, при желании придать металлу твердость, создают такие условия, при которых об�разовывались бы карбиды внедрения. Классический пример использования углерода для изменения свойств металла – получение чугуна и стали
Железо может сущест�вовать в двух кристаллических моди�фикациях: до 910°С это так называе�мое -железо, а выше этой темпера�туры- -железо. Отношение размеров атомов железа и углерода rC/rFe близко к упомянутой величине 0,59. Поэтому образование фаз внедрения в системе желе�зо — углерод сильно зависит от кристалли�ческой структуры железа. В то время как -железо может образовать фазу внедрения, содержащую до нескольких процентов углерода, -железо может рас�творить не более 0,06% углерода.
Обычные марки сталей содержат 0,2—0,5% угле�рода. При тех температурах, при которых устойчиво -железо, все это количество углерода образует типичную фазу внедрения. Такая сталь назы�вается аустенитом.
Если медленно охлаждать аустенит, то при 910 °С -железо изменит структуру и превратится в -железо, которое сможет содержать в виде фазы внедрения лишь очень небольшое количество углерода. При медленном охлаждении аустенит превращается в смесь кристаллов твердого раствора углерода в -железе (так называемый феррит) и карбида железа со�става Fe3C (цементит). Поэтому медленно охлажден�ная сталь (так называемый перлит) неоднородна. С практической точки зрения важно то, что перлит - относительно мягкая сталь.
Но если очень быстро охлаждать аустенит до тем�пературы ниже 150 °С, то он претерпевает совсем иные превращения. Расположение атомов железа в струк�турах - и -железа различается сравнительно мало. Поэтому даже при быстром охлаждении -железо ус�певает превратиться в -железо. Иное дело - угле�род. Его атомы рассеяны по всей массе железа. Чтобы углерод сконцентрировался в какой-то фазе, например в виде кристаллов цементита Fe3C или даже графита, атомы углерода должны переместиться на значитель�ные расстояния в кристаллической решетке. При не�высоких температурах они этого сделать не мо�гут и остаются внутри кристаллической решетки -железа.
В результате образуется пересыщенный твердый раствор углерода в -железе (так называемый мар�тенсит). Мартенсит - это очень твердая сталь. На этих особенностях свойств соединений железа с углеродом основана такая технологическая операция, как закалка стали.
Еще одной часто применяемой технологической операцией является отпуск стали. Ее проводят для придания мягкости ранее закаленным изделиям (если, например, потребовалась его механическая обработка). Для этого стальное изделие нагревают немного выше 200 оС. Отпуск сталей основан на том, что при таком нагревании ато�мы углерода становятся более подвижными, могут перераспределиться в кристаллической решетке и сконцентрироваться с образованием кристаллов це�ментита. В результате при отпуске стали образуются те же кристаллы, что и при медленном охлаждении аустенита, т. е. феррит и цементит, но более крупные. Такая сталь сорбитом. Такая сталь значительно более мягкая. В последствии можно снова ее закалить.
Следовательно, зная свойства фаз внедрения можно управлять свойствами веществ.
Разнообразное применение находят также другие карбиды и нитриды внед�рения. Использование этих соединений связано с их специфическими свойствами: тугоплавкостью, очень высокой твердостью и элект�ропроводностью при высоких температурах. Так, кар�биды вольфрама, титана и тантала используются для изготовления сверхтвердых сплавов. Такие сплавы представляют собой хрупкие зер�на карбидов, связанных частицами какого-то более мягкого металла, например кобальта. Карбиды неко�торых металлов входят в состав специальных прочных сталей. Карбиды внедрения используются иногда как абразивные (шлифовальные) материалы.
У многих соединений внедрения (карбидов, нитридов) высокая прочность сохраняется при высоких тем�пературах, в то время как многие металлы в таких условиях ее теряют. Поэтому из карбидов титана, ниобия, тантала и некоторых других элементов изготовляют детали ракетных и авиационных дви�гателей.
Хорошая электропроводность некоторых карбидов позволяет изготовлять из них электроды, работающие при высоких температурах. Карбид титана используется в дуговых лампах.
Некоторые карбиды и нитриды внедрения при низ�ких температурах обнаруживают сверхпроводимость. Такие соединения как VN, NbN, WC и МоС делаются сверхпроводника�ми при температурах ниже соответственно 8,2; 15,6; 10,0 и 14,3 °К. Несмотря на низкие температуры перехода в сверхпроводящее состояние, они являются сверхпроводниками первого рода и имеют большие критические токи. Это позволяет использовать их в мощных установках (двигатели, магниты и т.п.) где ВТСП - материалы не применимы.
В металлургии используется так называемое азо�тирование стали и других металлов. Металл нагре�вают в атмосфере аммиака. При этом в его поверхно�стный слой внедряются атомы азота, что придает по�верхности твердость и сопротивление истиранию.
Другой метод обработки поверхности стали — це�ментация— основан на внедрении атомов углерода в поверхностный слой металла. Цементацию обычно про�водят, нагревая сталь до 900—950°С в атмосфере оки�си углерода и углеводородов (например, метана), ко�торые при этом частично распадаются с образованием свободного углерода:
СО СО2 + С (15)
СН4 Н2 + С (16)
Иногда цементацию проводят в ваннах из расплав�ленных солей в присутствии карбида кремния. Цементация широко применяется в современной технике для обработки ответственных частей машин, например де�талей автомобильных двигателей. Она повышает изно�состойкость и так называемую усталостную проч�ность сталей.
Многие рассмотренные ранее соединении внедрения характеризовались тем, что одно из исходных веществ (Н2, О2, N2) не имело кристаллической решетки. Однако, говоря о соединениях бора и углерода, надо отметить, что эти элементы образуют простые вещества с достаточно прочной кристаллической решеткой. Вспоминая о термодинамических причинах образования соединений внедрения, можно предположить, что такие простые вещества (при соответствующей геометрии кристаллов) сами могут быть основой для фаз внедрения. В крайнем случае могут образовываться соединения внедрения не отдельных атомов а многоатомных фрагментов (кластеров).
Кристаллические решетки боридов построены по типу фаз внедрения, но в то время, как атомы углерода и азота в карбидах и нитридах расположены изолированно друг от друга в порах метал�лических решеток, атомы бора весьма склонны к валентным связям друг с другом, вслед�ствие чего они редко находятся в изолированном состоянии, а обычно образуют цепи (прос�тые или сдвоенные), двухмерные сетки или трехмерные карка�сы (см. Рис. 3).
В соответствии с этим производится классификация структурных типов боридов: 1) структурные типы с изолиро�ванными атомами бора (типы Мn4В — ромбический и Fe2B — тетрагональный, а также тип ZnS с плотнейшей кубической упаковкой из металлических атомов); 2) структурные типы с цепями из атомов бора (типы ТаВ и FeB — ромбические и МоВ — тетрагональный); 3) структурный тип со сдво�енными цепями из атомов бора — Та3В4; 4) структурные типы с сетками из атомов бора (типы А1В2 и W2B5 — гексагональные и Мо2В5 — ромбоэдрический); 5) структурные типы с каркасом из атомов бора (UB4 — тетрагональ�ный, СаВ6 и UB12 (см. Рис. 4).
Рис. 3 Структурные элементы из атомов бора в боридах переходных элементов.
а – изолированные атомы;
б – цепочки; в – двойные цепочки; г – сетки.
Рис. 4 Структурный тип UB12 (каркас из атомов бора)
В Таблице 2 приведены отношения радиусов металлов и бора для некоторых типов боридов внедрения.
Таблица 2 Отношение радиусов металла и бора для
различных боридов.
Данные показывают, что металлы побочных подгрупп IV и V групп имеют отношение rB/rA близкое к отмеченному выше (0,59). Исключение составляет ванадий. Для металлов VI, VII, и VIII групп это отношение заметно выше. Этим можно объяснить, соединения типа MeB2 наиболее устойчивы именно для металлов IV и V групп. Напротив, соединения МеВ2 металлов VI группы значительно менее устойчивы, причем существование борида WB2 пока не доказано. Это еще одно обстоятельство, заставляющее бориды в "поисках" стабильности образовывать иные структурные типы.
Однако даже в системах металлов IV и V групп с бором имеются соединения более сложного типа, впрочем, менее устойчивые, чем дибориды.
Таким образом "правило 0.59" применимо к соединениям переходных металлов с бором только в ограниченной степени.
Геометрическими факторами можно объясняют высокую хрупкость многих боридов. Это связано с расширением решетки и увеличением межатомных расстояний. Такое расширение объясняется отклонением от идеального состава. недостаток или избыток бора приводит к увеличению или уменьшению углов между связями, что заставляет часть атомов бора занимать более узкие части каналов и расширять решетку. (см. Табл. 3 )
Интересно, что замена металла в бориде практически не изменяет расстояния между атомами бора, в то время как заметно изменяются расстояния между атомами металла. Из Таблицы 3 следует, что прочность связи внутри данной переходной подгруппы увеличивается с уменьшением атомного номера элемента.
Таблица 3 Межатомные расстояния в решетке диборидов
2 Соединения графита
Переходя непосредственно к углероду можно утверждать, что алмазоподобная аллотропная модификация неспособна к "приему" каких-либо частиц из-за малых размеров полостей в кристаллической решетке. Совсем иначе обстоит дело с графитом – пустоты в его решетке вполне достаточно, для приема "гостей".
Вообще, среди соединений внедрения значительное место занимают структуры, образованные слоистыми решетками. К таковым относятся в частности соединения графита.
Это, возможно, единственный случай в химии, когда речь идет не о соединениях элемента, а о соединениях конкретного простого вещества. В таких соединениях в значительной мере сохраняет�ся структурная индивидуальность исходного простого вещества - графита.
Когда свободный углерод или любое его соеди�нение взаимодействует с кислородом или галогенами при высокой температуре, исходные кристаллические решетки или молекулы полностью разрушаются. В ре�зультате образуются новые молекулы оксидов или галогенидов углерода. Строение и свойства вновь образованных форм не зависят от того, в каком конкретном виде в реакцию вводился углерод. При сжигании графита, алмаза, углеводородов или древесины, получаются одни и те же молекулы СО2 (СО). Здесь химическая индивидуаль�ность исходного вещества совершенно не проявляется в конечном продукте.
Дело обстоит совсем иначе, когда графит реа�гирует с кислородом или галогенами при относительно низких температу�рах. Если на графит подействовать фтором при температуре от комнатной до ~ 100 °С, то обра�зуется черное порошкообразное вещество, состав которого колеблется в пределах от C4F до C3,6F. Для простоты ему припи�сывают формулу C4F. Это вещество химически доволь�но устойчиво, оно не взаимодействует с разбавленны�ми кислотами и щелочами, не реагирует с кислородом воздуха. При нагревании выше 100 °С оно разлагается.
Формула C4F дает понять, что обычные представления о валент�ности к этому веществу неприменимы. Если соединение имеет переменный состав, а его формула не соответствует обычным валентностям составляющих его элемен�тов - это основание считать такое соединение фазой внедрения. Фторид графита C4F – Действительно фаза внедрения.
Вспомним, что представляет собой структура графита. Как известно, она слоистая. Каждый слой состоит из большого числа симмет�ричных шестиугольников, образованных атомами угле�рода (см. Рис. 5).
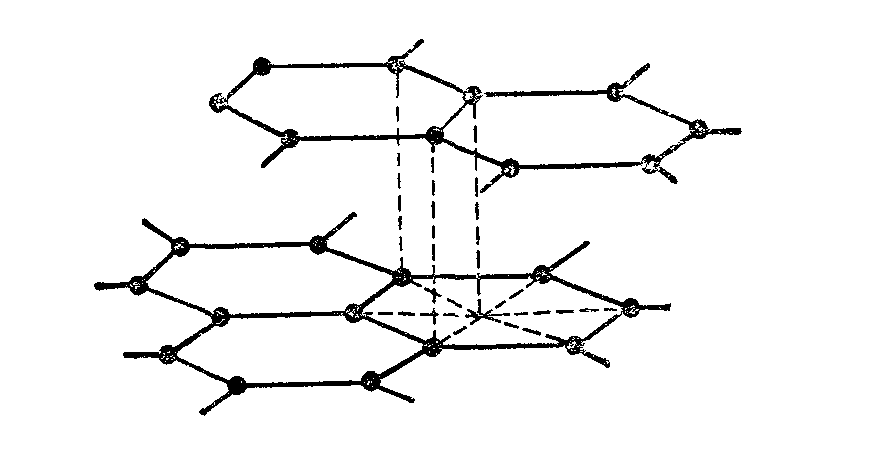
Рис. 5 Строение кристаллической решетки графита.
В пределах слоя атомы углерода свя�заны между собой обычными ковалентными связями. Порядок связи C – C внутри слоя равен примерно 1,33.
Связь же между слоями заметно отличается по своей природе. Ее можно определить и как межмолекулярное вандерваальсово взаимодействие, и как близкую по свойствам к металлической связи. Последнее обстоятельство подтверждается высокой электропроводностью графита. Именно за счет нелокализованных электро�нов, обеспечивающих связь между слоями, графит обладает высокой проводимостью.
Оказывается, что в решетку графита между слоями углеродных атомов могут внедряться другие частицы (атомы, ионы, молекулы).
Можно отметить определенную аналогию. В случае гидри�дов, нитридов и карбидов металлов внедрение проис�ходит между атомами, связанными металлической связью. И в случае графита происходит нечто подобное. Возможно именно структуры с делокализованными электронами обладают способность образовывать соединения внедрения.
Рассмотрим подробнее соединение C4F. Структура этого со�единения немного отличается от струк�туры графита. В графите слои из ато�мов углерода смещены один относительно другого. Атом углерода, находящийся в одном слое, располагается над центром шестиугольника из следующего слоя.
В структуре же C4F углеродные атомы расположе�ны точно один над другим, а между слоями находятся атомы фтора. Атомы фтора расположены в два слоя - уже это показывает, что в данном случае происходит что-то более сложное, чем механическое внедрение. За счет внедрения атомов фтора графит как бы «раз�бухает» (аналогия с гидридом палладия). Расстояния ме�жду слоями углеродных атомов в структуре графита равны 3.35 , в то время как в C4F они увеличивают�ся до 5.5 .
Внедре�ние атомов фтора приводит и к заметному изменению физических и химических свойств графита. Электропро�водность уменьшается на два порядка. Это происходит потому, что "металлические" электроны графита частично задействованы на образование связи между атомами углерода и фтора.
Помимо C4F, графит может образовывать при тем�пературах порядка 420 – 460 °С другое соединение со фтором. Оно также имеет переменный состав: пример�но от CF0,7 до CF. Для простоты ему приписы�вают формулу CF. Это тоже довольно инертное в химическом смысле вещество - не реагирует даже с концентрированными кислотами и щелочами. По�скольку состав этого соединения меняется в довольно широких пределах (до 30%), так же значительно из�меняются и свойства. При составе CF0,7 вещество имеет черный цвет, при возрастании содержания фтора оно светлеет, а достигнув состава близкого к CF, делается бесцветным.
При составе близком к стехиометрическому CF почти не проводит электрический ток. Отсюда можно сделать вывод, что при таком составе в структуре CF отсутствуют "металлические" электроны (электроны проводимости). Оче�видно, они полностью израсходованы на образование ковалентной связи между атомами угле�рода и фтора. Действительно, в графите имеется один электрон проводимости на один атом углерода. При со�ставе CF на один атом углерода приходится один атом фтора, также имеющий один неспаренный электрон. Отсюда - образование из этих электронов электрон�ной пары, т. е. ковалентной связи.
При образовании CF слои углеродных атомов раз�двигаются на расстояние до 8,17 и становятся неплоскими.
Рис. 6 Строение кристаллической решетки CF.
При нагревании выше 500 °С CF разлагается с об�разованием "обычных" фторидов углерода различного состава (CF4 и C2F6). Таким образом, при температурах ниже 100 °С образуется соединение C4F, при 420 - 460° — CF. Соединения иного состава не известны.
Графит может также поглощать кислород. Такой продукт, условно называется "оксидом графита". Он образуется при об�работке графита сильными окислителями - перманганатом калия KMnO4, бертолетовой солью КСlO3, смесью серной и азотной кислот. Как и в слу�чае CF, присоединение кислорода к графиту сопровож�дается изменением окраски. Сначала графит из чер�ного делается коричневым или зеленоватым, затем - желтым. При присоединении наибольшего количества кислорода (до соотношения С : О = 2 : 1) вещество де�лается бесцветным.
Структура окиси графита похожа на структуру CF, т. е. слои углеродных атомов несколько искажены. Расстояние между слоями углерода равно 6,2 . Поскольку кислород двухвалентен, для "связы�вания" электронов проводимости достаточно одного атома кислорода на два атома углерода (т.е. на два электрона проводимости). Поэтому предельный состав окиси графита должен быть С2О. По мере приближения к этому составу, проводимость оксида графита сильно уменьшается.
Внедрением атомов кислорода не ис�черпываются возможности решетки графита. Окись графита может дополнительно погло�щать молекулы воды и некоторых органических ве�ществ (кетоны, спирты).
Процесс сопровождается дальнейшим разбуханием кристалла. Если по�глощается вода, то расстояние между слоями угле�рода возрастает до 11 , а если спирт, то даже до 19 . Так как получают окись графита в водной среде или по крайней мере в присутствии воды, она всегда содержит переменные количества воды. Из-за этого со�став обычно получаемых препаратов окиси графита довольно сложен. В частности, она содержит гидроксильные группы.
Теперь рассмотрим внедрение в решетку графита атомов металлов.
На сегодняшний день получено много ве�ществ, представляющих собой продук�ты внедрения в структуру графита ато�мов щелочных металлов. Такие вещества образуются при обработке графита парами или расплавами щелочных металлов, а также растворами комплексов ще�лочных металлов с некоторыми органическими молекулами, например нафталином.
Рис 7 Строение фазы внедрения щелочного металла в графит C8Me.
Соединение состава С8К внешне напоминает бронзу. При нагревании последовательно образуется ряд менее насыщенных калием фаз: С24К, С36К, C48K и С60К. Аналогичные со�единения получены для рубидия и цезия.
Структура соединений графита со щелочными ме�таллами состоит из чередующихся в определенном по�рядке слоев атомов углерода и щелочного металла (см. Рис. 7).
Как и в C4F, в соединениях графита со щелочными металлами углеродные шестиугольники, непосредствен�но примыкающие к слою атомов щелочного металла, расположены точно один над другим. Атомы же ще�лочного металла расположены напротив центров не�которых из этих шестиугольников (см. Рис. 8).
Рис. 8 Расположение атомов щелочного металла по отношению к атомам углерода в соседнем слое.
При этом расположение атомов в слое щелочного металла для соединения С8Ме более "густое", чем для остальных соединений. Поэтому при переходе от С8Ме к С24Ме содержание щелочного металла уменьшается в три раза, хотя число слоев атомов углерода между двумя ближайшими слоями щелочного металла возрастает лишь в два раза (см. Рис 9).
Изучение физических свойств соединений графита со щелочными металлами позволило сделать некото�рые выводы об их электронном строении. По-видимому, внедряясь в кристаллическую решетку графита, атомы щелочных металлов теряют свои валентные электроны. В результате образуются положительные ионы щелочных металлов и отрицательно заряженные слои углеродных атомов.
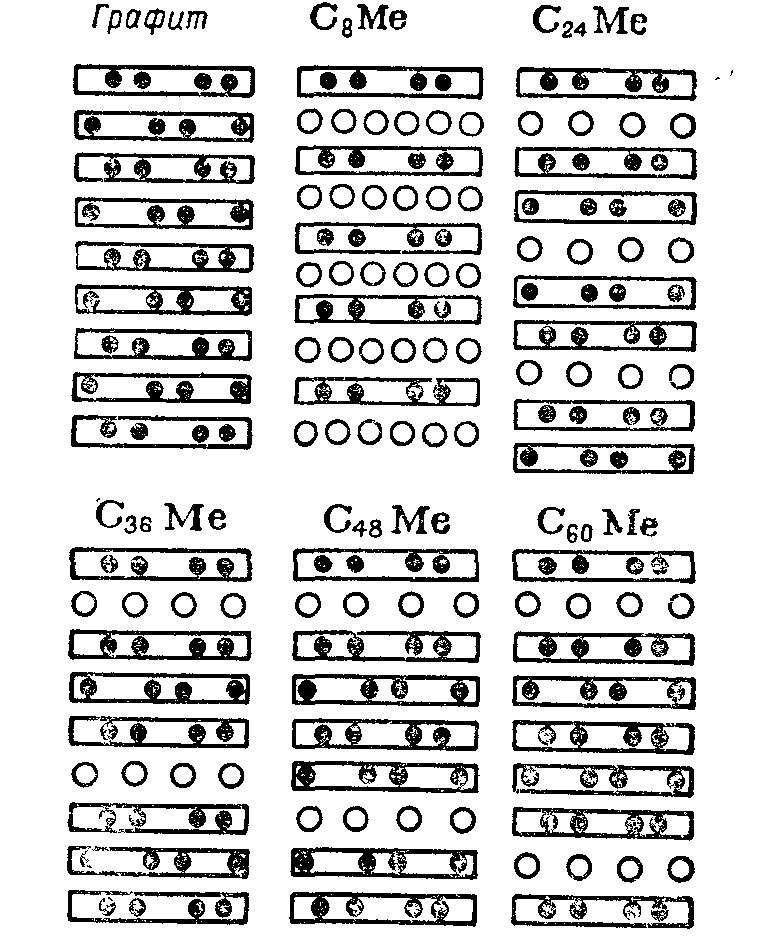
Рис. 9 Расположение атомных слоев углерода и металла в фазах внедрения различного состава.
Продукты внедрения щелочных металлов в графит довольно устойчивы при обычных температурах, если их изолировать от кислородной атмосферы. На воздухе же они лег�ко окисляются и могут даже воспламениться. Следовательно, щелочной металл, даже внедренный в решетку гра�фита, сохраняет высокую химическую активность.
При высокой температуре щелочной металл легко испаряется из решетки графита. Подвижность атомов ще�лочного металла в графите сказывается еще и в том, что они могут быть замещены нейтральными молекулами, в частности аммиаком. Это приводит к образо�ванию темно-синих продуктов состава C12Me(NH3)2, C28Me(NH3)2 и C28Me(NH3)
Хорошо известны продукты внедрения в графит хлори�дов железа и алюминия. Внедрение хлорного железа происходит, когда графит выдерживают в его расплаве (FeCl3 плавится при относительно низкой температуре). Внедрившиеся в графит, молекулы удерживается там довольно прочно. Не смотря на хорошую растворимость в воде, выщелачивание хлорного желе�за из графита водой протекает очень медленно.
Соединение графита с хло�ристым алюминием получают совместным нагреванием этих веществ в присутствии газооб�разного хлора. При этом в за�висимости от температуры по�лучаются продукты с разной структурой, составом и свойст�вами. При ~ 265 °С молекулы А1Сl3 внедряются между всеми слоями углеродных атомов в графите, и образуется синее вещество состава С9А1С13. При более высокой температуре часть хлористого алюми�ния покидает графит, и образуется вещество состава C18AlCl3 серого цвета. Здесь слой хлористого алюминия чередуется с двумя графитовыми слоями. При еще более высокой температуре (~ 440 °С) образуется вещество, внешне очень похо�жее на графит и имеющее состав С36А1С13. Здесь слой хлористого алюминия приходится на четыре графито�вых слоя. Предполагается, что во всех трех случаях в структуру графита внедряются как нейтральные мо�лекулы А1С13, так и ионы [А1С14]-. Похожие соедине�ния графит образует также с хлоридом галлия.
Способны внедряться в графит и частицы многих других веществ, например UC14, WC16, CuCl2, CuBr2, MoO3. Кроме фтора внедряться в графит могут и другие галогены, даже два галогена сразу, например йод и хлор, йод и бром. Но эти продукты менее прочны, чем соединения графита с фтором. Содержание галогена в них не превышает состава С8На1. Если не считать увеличения расстояния между слоями углеродных атомов, внедрение хлора, брома и йода мало сказывается на структуре графита. Особым случаем соединений внедрения на базе структуры графита являются так называемые соли графита. Они образуются при энергичном окислении (в том числе анодном) графита в сильнокислой среде. Примером может служить би�сульфат графита. Его состав выражается формулой CxHSO42H2SO4, где x имеет переменную величину. При уменьшении значения х цвет бисульфата графи�та меняется от черного до темно-синего.
При образовании солей графита между слоями уг�леродных атомов внедряются как нейтральные моле�кулы кислот, так и анионы. Для сохранения электро�нейтральности решетки в целом необходимо, чтобы слои графита приобретали суммарный положительный заряд, эквивалентный суммарному отрицательному заряду внедренных анионов. Для этого и необходим окислитель — он окисляет графит, т. е. отнимает от него часть электронов.
Внедрение анионов и молекул кислоты между слоя�ми углеродных атомов, естественно, вызывает разбу�хание графита. Поэтому, например, в бисульфате гра�фита расстояние между слоями углерода равно ~ 8 .
Интересно, что электропроводность солей графита выше, чем у исходного графита. Это объясняется тем, что при образовании солей графит теряет не электро�ны проводимости, а те, которые в исходном графите связывали атомы в пределах слоя. С потерей этих электронов возникают так называемые дырки. Дырки, как и свободные электроны, могут пе�ремещаться в кристаллической решетке – возникает проводимость, называемая дырочной проводимостью.
Соли графита способны вступать в реакции обме�на - свойство, типичное для электролитов вообще и солей в частности. Например, действуя на нитрат гра�фита серной кислотой, можно превратить его в суль�фат, а действуя на сульфат хлорной кислотой - перхлорат графита.
Таким образом, продукты внедрения на базе графита характеризуются разной степенью химического взаимодействии между внедренным веществом и гра�фитом. В свою очередь, степень химического взаимо�действия определяет степень искажения исходной структуры графита. Если, например, внедрение моле�кул А1С13 приводит только к увеличению расстояний между слоями углеродных атомов, то при внедрении атомов щелочных металлов слои смещаются. Образо�вание же такого соединения, как CF, связано не толь�ко со смещением графитных слоев, по и с их дефор�мацией - значит, здесь химическое взаимодействие между графитом и внедряемым веществом наиболее сильное.
3. Нитрид бора, сульфиды
Некоторые другие вещества со слоистой структу�рой образуют соединения внедрения, во многих отно�шениях подобные соединениям графита.
Так, структура устойчивой при обыч�ных условиях формы нитрида бора BN похожа на структуру графита. Это сходство не случайно. Нитрид бора - вещество, изоэлектронное с углеродом, т. е. содержащее в расчете на один атом такое же число электронов, как углерод. Подобно графиту, нитрид бора в обычных условиях образует кристаллы, состоящие из слоев атомов, внут�ри которых атомы образуют шестиугольники (см. Рис. 10). Различие состоит лишь в том, что в графите шести�угольники смещены одни относительно другого, а в нитриде бора они приходятся точно один над дру�гим.
Естественно ожидать, что нитрид бора будет обра�зовывать соединения внедрения, похожие на соедине�ния графита. И действительно, он может поглощать такие вещества, как хлориды сурьмы, мышьяка, меди, железа, алюминия, а также гидразин N2H
Рис 10 Строение атомного слоя нитрида бора.
Слоистой структурой и способствующей к образованию соединений внедрения, об�ладают также некоторые сульфиды и галогениды: TiS2, TaS2, MoS2, WS2, SnS2, CrCl3.
4. Вольфрамовые бронзы.
До сих пор подробно рассматривались фазы внедрения преимущественно в кристаллические решетки простых веществ. Однако существует большой класс соединений (сложных оксидов) способных принять в свою решетку различные частицы (молекулы, ионы). К наиболее типичным относятся так называемые оксидные бронзы. Самыми известными и изученными являются вольфрамовые бронзы.
Вольфрамовые бронзы обладают рядом поразительных и совсем не свой�ственных классу оксидных соединений металлических свойств:
1) интенсивная окраска от желтой до черной и блеск;
2) электропроводность, характерная для металлов; полупровод�никовые свойства;
3) широкая область гомогенности, объясняющая наличием стабильной каркасной решетки;
4) инертность к химическому воздействию кислот, не являющихся окислителями.
Все это и породило большой интерес к изучению их строения, а также к поиску подобных систем с другими переходными металлами. Термин "бронзы", возникший вследствие наличия указанных свойств у этих соединений, разумеется, условен, однако он устоялся и постоянно используется в научной литературе..
Формально вольфрамовые бронзы представляют собой соединения оксида щелочного металла, с окисидами пяти- и шестивалентного вольфрама:
nM2OmW2O5pWO3
Если положить n=m (см ниже), то состав может быть представлен общей формулой: MexWO3 ,
где Me — атом щелочного металла. В зависимости от состава бронз величина х может принимать дробные значения от 0 до 1.
Многочисленные химические анализы показали, что отношение числа (томов вольфрама к числу атомов кислорода в бронзах равно 1 : 3. Это подтверждает законность предположения о равенстве m и n и указывает на то, что в вольфрамовых бронзах октаэдры WO6 соединяются исключи�тельно вершинами.
В настоящее время известно значительное количество методов получения вольфрамовых бронз.
1. Впервые бронзы были получены восстановлением паравольфрамата щелочного металла при нагревании в токе сухого водорода. В за�висимости от длительности и температуры восстановления изменяется средняя валентность вольфрама в бронзе, а вместе с этим и величина х. Иногда в качестве восстановителей, кроме водорода, применяются также металлы (цинк, олово).
2. Вольфрамовая бронза может быть получена также электролизом паравольфраматов, однако при этом трудно получить достаточно гомо�генный продукт.
3. Способ основан на самопроизвольном восстановлении вольфрама при охлаждении смеси метавольфрамата щелочного металла с вольфрамовым ангидридом. При этом система самопроизвольно теряет кислород.
Способ основан на длительном прогреве смеси вольфрамата щелочного металла, двуокиси вольфрама и металлического вольфрама. В вакууме при определенной температуре (800-850 оС).
Особенностью структуры вольфрамового ангидрида WO3 является то, что между расположенными (по типу структуры RеО3) октаэдрами WO6 имеются пустоты, куда без искажения решетки может поместиться ион, размером меньший или равны кислородному. Поэтому естественно ожидать, что такие ионы, как Li+ Na+ и К+, внедряясь в решетку WO3, будут образовывать бронзы на ocнове последней. Следовательно, если отвлечься от возможного искажения в структуре WO3, вольфрамовые бронзы лития, натрия должны иметь структуру типа перовскита. (см. Рис 9.11). Это и подтверждается на практике.
Рис. 11 Строение кубических вольфрамовых бронз (структура типа перовскита).
В дальнейшем было показано, что кроме кубической, вольфрамовые бронзы могут иметь еще тетрагональную и гексагональную структуры.
В первом случае кислородные октаэдры связаны друг с другом вершинами, образуя решетку, отвечающую формуле WO3. Эта решетка содержит кубические ячейки структуры типа перовскита и пятигранные туннели, проходящие через всю структуру. Проекциями их являются соответ�ственно квадраты и пятиугольники. Октаэдры могут перераспреде�ляться, образуя несколько большие пространства для внедрения атомов щелочных металлов по сравнению с пространствами, име�ющимися в бронзе с кубической решеткой (см. рис 12).
Рис. 12 Строение тетрагональных вольфрамовых бронз.
Формула бронзы с тетрагональной струк�турой может быть записана в виде AI0.2 АII0.4 WO3, -где АI - кубические (име�ющие координационное число 12), а АII— пятиугольные призматические (имеющие координационное число 15) туннельные пози�ции. При этом те и другие позиции лишь частично за�няты атомами щелочных металлов.
Третий класс вольфрамовых бронз (см. Рис. 13) составляют соединения AxWO3 (0< х < 0,33). Они образуются путем восстановления водородом поливольфраматов К, Rb или Cs либо по реакции в твердой фазе этих металлов с WO2 . Бронзы, относящиеся к этому классу, имеют гек�сагональную каркасную решетку, которая встре�чается также в разновидности бронзы, не содержащей щелочных металлов.
Кислородно-вольфрамовые октаэдры каркасной решетки всеми шестью вершинами соединяются с подобными же октаэдрами и обра�зуют шестичленные кольца, являющиеся, по сути дела, проекциями туннелей, проходящих в определенном направлении через весь кристалл.
Рис. 13 Структура вольфрамовой бронзы с гексагональной решеткой.
Отметим некоторые свойства вольфрамовых бронз. Цвет вольфрамовых бронз оказался чрезвычайно разнообразным и стойким (см. Табл. 4). Интересно, что окраска не зависит от природы щелочного металла, а зависит только от его концентрации.
Поскольку бронзы являются фазами с переменной валентностью атомов вольфрама и дефектной кристаллической решеткой, они должны обладать каталитическими свойствами. Поиски вариантов использования этих соединений в качестве катализаторов продолжаются.
Возможность включать в кристаллическую решетку ионы различной природы и размера позволяет использовать вольфрамовые бронзы в качестве ион-селективных элементов в различных процессах.
Высокая электрическая проводимость и ее зависимость от состава позволяет использовать бронзы в качестве электродов в аналитических электрохимических исследованиях.
Соединения типа вольфрамовых бронз теперь известны не только для вольфрама. Получены молибденовые, ванадиевые (MexV2O5), титановые (MexTiO2) и другие.
Таблица 4 Цвет вольфрамовых бронз
5. Соединения включения
5.1 Клатраты газов
Клатратные соединения, или просто клатраты представляют собой разно�видность соединений внедрения. Эти соединения часто кристаллизуются из растворов, со�держащих, помимо растворителя, малополярные или неполярные молекулы. Например, аргон, криптон и ксенон образуют гидраты примерного состава Х6Н2О (где X — инертный газ). Эти гидраты плавятся соответственно при 8; 13 и 24 °С, т. е. значительно выше температуры плавления чистой воды. Кристаллические гидраты об�разуют также насыщенные и ненасыщенные углево�дороды, галогены, галогенпроизводные метана и этана, водородные соединения элементов V и VI групп и дру�гие летучие при обычных условиях вещества. Посколь�ку клатраты образуются не путем внедрения молекул в уже "готовую" кристаллическую решетку, а в про�цессе кристаллизации, их называют также соедине�ниями включения.
Образование клатратов связано с тем, что молеку�лы растворителя, кристаллизуясь, могут образовывать ажурные структуры с пустотами, в которые внедряют�ся "посторонние" молекулы.
Рассмотрим в качестве примера гидраты газов. Первым гидратом газа, полученным эксперименталь�но, был гидрат хлора. В настоящее время известно до�вольно много гидратов на основе газов самой различной химической природы.
Эти соединения могут иметь структуру двух типов. В каждом из них основной структурной единицей яв�ляется пентагональный додекаэдр. Такой блок состоит из 20 мо�лекул воды, находящихся в вершинах координационного полиэдра и связанных между собой водородными связя�ми. Каждая молекула воды связана с тремя молекулами того же самого полиэдра и с одной молекулой соседнего полиэдра. При этом вокруг кислорода образуется почти правильный тетраэдр из атомов водорода. С помощью пентагон-додекаэдров нельзя образовать плотнейшую упа�ковку. Однако она может быть сформирована из пентагон-додекаэдров в сочетании с тетрадекаэдрами (12 пентагональных граней и 2 гексагональные грани) или гексадекаэдрами (12 пентагональных граней и 4 гексагональ�ные грани) (см. Рис 14).
Рис. 14 Координационные полиэдры, имеющие место в структуре гидратов.
Два типа гидратов (I и II) разли�чаются набором полиэдров. Обе структуры куби�ческие с параметрами решетки примерно 12 и 17 соответственно. (Рис 15).
Рис.15 Расположение полиэдров в гидратах типа I и типа II
В гидратах типа I додекаэдры занимают вершины и центры куба, образуя следующие полости: две додекаэдрические (объем 169 3) и шесть тетрадекаэдрических (объем 216 3), т. е. элементарная ячейка содер�жит 46 молекул Н2О и 8 полостей.
Элементарная ячейка гидратов типа II содержит 136 молекул Н2О, 16 додекаэдрических (объем 169 3) и 8 гексадекаэдрических полостей (объем 250 3), (всего 24 полости).
Если в гидратах типа I все полости заняты, то обра�зуются гидраты состава 53/4Н2ОМ (М - внедренная частица); если заняты только самые большие полости, то состав гидрата соответствует формуле 72/3Н2ОМ.
Если в гидратах типа II заняты все полости, то соеди�нение имеет формулу 52/3Н2ОМ, если заняты только самые большие полости - формулу 17Н2ОМ.
Рассмотрим насколько примеров гидратов типа I.
Если внедряющиеся молекулы относительно невелики (Аг, Хе, СН4, СН3С1, C2H6, СО2, SO2), то они могут занять все восемь пустот. В этом случае предельное отноше�ние числа внедренных молекул к числу молекул воды равно 8 : 46 = 1 : 5,75. Действительно, состав, на�пример, гидрата аргона выражается формулой Аг5,75Н2О.
Более крупные молекулы (Сl2, Вг2, СН3Вг) могут внедриться только в шесть более крупных пустот. Следовательно, предельное отно�шение числа внедренных молекул к числу молекул воды составит 6 : 46 = 1 : 7,67. Действительно, хлор образует гидрат предельного состава Сl28Н2О.
Возможно образование смешанные гидратов типа 17H2OM2N, в которых М - молекула боль�шого размера (М — COS, C3H8, С2Н5С1, СС14 и др.) и N - молекула меньшего размера (Н2).
Устойчивость клатратов также зависит, прежде всего, от размеров и фор�мы внедренных молекул. Если молекулы-"гости" очень малы по сравнению с пустотами в структуре вещества-"хозяина", то они смогут легко его поки�дать. Тогда равновесное давление внедряемого ком�понента будет большим. Система будет менее устойчивой. Если молекулы внедряемого вещества соответствуют раз�меру пустот, им будет не так легко покидать - кристал�лическую решетку "хозяина" и клатрат будет более устойчив. Равновесное давление вне�дряемого компонента будет низким. И, наконец, при очень крупных молекулах внедрение вообще не прои�зойдет, и клатрат попросту не образуется.
Вот несколько примеров, иллюстрирующих это положение. Молекула водорода очень мала, поэтому водород вообще не образует индивидуальных гидратов. У инертных газов прочность клатратов ра�стет от аргона к ксенону. Так, равновесное давление гидрата аргона при 0 °С равно примерно 100 атм., а гидрата ксенона - около одной атмосферы. Еще более устойчив гидрат хлора - для его образования требуется давление хлора лишь около 0,3 атмосферы.
Метан, этан, пропан и изобутан образуют гидраты, а нор�мальный бутан и предельные углеводороды с большим числом атомов углерода - нет. Имеющий вытянутую мо�лекулу 1,2-дихлорэтан, гидратов не образует, в то время как его изомер -1,1-дихлорэтан с бо�лее компактной молекулой имеет гидраты.
Существует эмпирическое правило. Образование гидратов возможно в том случае, если молярный объем жидкости (т.е. объем, занимаемый одним мо�лем) не больше 85 см3. Пересчитав эту величину на объем одной молекулы (ее эффективный радиус), можно предсказать, частицы каких веществ способны образовывать гидраты.
Многие органические вещества (фенол, гидро�хинон и другие) также могут служить матри�цей для образования клатратов.
Около ста лет назад было получено соединение гидрохи�нона С6Н4(ОН)2 с двуокисью серы. Позже, было изучено строение этого клатрата (см. Рис 16).
У гидрохинона, как и у воды, кри�сталлическая структура вещества-"хозяина" в клатрате оказы�вается иной, нежели в свободном состоянии. Если в обычных ус�ловиях устойчива кристаллическая структура так называемого -гидрохинона, то в клатратах гидрохинон образует иную, более рыхлую структуру--гидрохинон. В ней молекулы гидрохинона, соединенные водородными связями, располагаются таким обра�зом, что между ними остаются пустоты. При кристал�лизации гидрохинона клетки могут быть заняты молекулами других веществ, например SO2, H2S, HC1, СН3ОН, НСООН, НС1, НВг.
Рис. 16 образование полости из молекул гидрохинина, связанных водородными связями.
Во всех таких клатратах на три молекулы гидрохинона при�ходится одна полость. Предельный состав клатратов гид�рохинона, следовательно - 3С6Н4(ОН)2Х (где X – частица внедренного вещества). Обыч�но этот предел не достигается. Поэтому сначала этим клатратам приписывали формулу 4С6Н4(ОН)2Н2S.
В клатратах гидрохинона включенные молекулы не имеют возможности покинуть кристаллическую решетку - они заклю�чены в клетки, не связанные сколько-нибудь широкими каналами. Поэтому клатраты гидрохинона с двуокисью серы и другими ве�ществами очень устойчивы. Они могут быть разрушены лишь тогда, когда раз�рушается кристаллическая решетка самого гидрохинона, напри�мер, при растворении.
Первоначально считалось, что образование клатратов исчерпывается только инертным в химическом отношении заполнением пустот в кристаллической решетке, т.е. механическими факторами. Однако, если бы молекулы внедряющегося вещества были совершенно инертны по отношению к решетке "хозяина", внедрение не при�водило бы к повышению устойчивости таких кристал�лических форм "хозяина", которые вне клатрата не�устойчивы. Кроме того, клатраты, более устойчивы, когда размеры внедряемой молекулы близки к размерам пустот в решетке "хо�зяина". Очевидно, в этом случае прочность клатрата возрастает благодаря более тесному контакту и, сле�довательно, взаимодействию электронных оболочек молекул "гостя" и "хозяина".
Интересно, что устойчивость гидратов часто увеличивается при одновременном внедрении молекул двух разных веществ. Например, гидрат хлороформа делается прочнее в присутствии ксенона. Очевидно, что в клатратах имеет место гораздо более сильное химическое взаи�модействие, чем предполагалось раньше.
Все способы получения клатратов основываются на знании свойств получаемых соединений. Чаще всего используется высокое давление газа и относительно низкая температура. Так соединения аргона были получены при давлении 200-400 атм., соединения криптона – 30-40 атм., соединения ксенона – при атмосферном давлении.
Клатраты на основе гидрохинона можно получать уже при обычных условиях, например пропусканием газообразного вещества через спиртовой раствор гидрохинона.
В последние 30-40 лет соединения включения широко изучаются. Большой теоретический и практический интерес, в частности, представ�ляют клатраты газов. Ряд технологических процессов нефтедобывающей, газовой и нефтехимической промышленности сопровождается образованием уг�леводородных гидратов, приводящим к негативным последствиям (закупорка трубопроводов и других агрегатов). В частности, в газопроводах при низких темпе�ратурах и высоком давлении (-29 °С и 26 атм.) может образо�ваться гидрат метана.
Чтобы не допустить этого, необходимо точно знать условия образования клатратных соединений (температура, давление и другие параметры состояния) при различных составах газовой фазы.
Образование и затем разрушение газовых клатратов используются, например, для разделения газов (углеводородов, благородных газов), соединений-изомеров.
Важным приложением химии клатратов является процесс опреснения морской воды. Он основан на высокой стабильности угле�водородных газовых клатратов. Нагнетанием газа в соленую воду (при температуре 1,1—24 °С и давлении 4—70 атм получают твердые угле�водородные клатраты. Например, кристаллогидраты пропана обра�зуются при 1,7°С и 4 атм. Полученный гидрат не содержит ионов солей, содержащихся в морской воде. Затем кристаллы клатратов выделяют, про�мывают и разлагают при 7,2°С и давлении 5 атм. При этом получается пресная вода, а высвободившийся пропан снова направляют для образования клатрата. Процесс опреснения морской воды этим мето�дом высоко экономичен.
Клатраты можно использовать, как удобную форму хранения газов. При этом не требуется специального оборудования для высокого давления. Подобное использование клатратов подсказала сама природа.
Клатраты в природе часто играют роль естественного храни�лища газов. Так, российскими учеными в рай�онах вечной мерзлоты обнаружены на значительной глубине в недрах земли (при 200 атм и до 25°С) твердые газовые гидраты метана. Подобное хранилище газа было недавно обнаружено при исследовании озера Байкал.
Соединения включения на�чинают играть все большую роль в процессах разде�ления веществ и получения их в очень чистом виде. Так, широкое применение находят клатраты в промыш�ленности для выделения нормальных парафинов из нефтяных фракций, разделения ароматических угле�водородов, осушки газов, опреснения воды и др. Клатраты используются в химическом анализе и даже для разделения рацематов. Большое значение клатраты имеют в процессах, происходящих в биоло�гических объектах.
Надо напоследок отметить, что упорядоченные твердые растворы внедрения типа соль — лед (некоторые кристаллогидраты с большим числом молекул воды типа Na2SO4 10H2O, Na2CO310H2O) обладают свойствами схожими с клатратными соединениями, рассмотренными выше. Такие кристаллогидраты называют тектогидратами. Они имеют структуру льда, которая стабилизируется за счет электростатического взаимодействующих противоположно заряженных ионов. Кулоновское взаимодействие как бы стягивает структуру, делая ее достаточно устойчивой. Вследствие этого температура плавления тектогидратов могут заметно превышать точку плавления льда.
5.2 Цеолиты.
Цеолиты представляют собой алюмосиликаты каркасной структуры. Одной из характерных особенностей алюмосиликатов является особое положение Al в их структуре.
В цеолитах, как и в других алюмосиликатах, А1, как и Si, находится в тетраэдрической координации по кислороду и изоморфно замещает кремний в общем кремнеалюмокислородном каркасе. Химия цеолитов в значительной мере определяется состоянием А1 в их структуре.
Чередующиеся (Si,О)- и (А1,О)-тетраэдры соединяются в трех�мерных каркасных структурах цеолитов таким образом, что все их кислороды оказываются поделенными между двумя соседними тетраэдрами, подобно тому как это имеет место в случае тех мо�дификаций SiO2, в которых кремний находится в тетраэдрической координации. Поэтому у всех цеолитов, как и у полевых шпатов, (Si+Al) : 0 = 1 : 2.
Другим химическим проявлением тетраэдрического А1 в кар�касных структурах цеолитов является обязательное для таких структур присутствие катионов щелочных или щелочноземельных металлов в количествах, строго эквивалентных содержанию Al. Это обстоятельство связано с необходимостью компенсации за�ряда избыточного электрона, в тетраэдрических группах АlO4/2, в которых А1, имея только три собственных валентных электрона, образует равноценные (образованные электронными парами) связи с каждым из четырех окружающих его кислородов за счет привлечения одного дополнительного электрона. В связи с этим в отличие от электронейтрального каркаса SiO2, каркасы (Si, A1)O2 будут нести избыточные отрицательные заряды, число которых будет отвечать числу (А1,О)-тетраэдров в них. Поэтому у всех цеолитов суммарное содержание щелочных и щелочнозе�мельных катионов таково, что отношение (Ме2О+МеО) : А12О3=1.
Замещение нейтральных (Si,О)-тетраэдров заряженными (А1,О)-тетраэдрами в каркасах цеолитов и алюмосиликатов вообще может идти лишь в некоторых ограниченных пределах. Было сформулировано эмпирическое правило, согласно которому содержание тетраэдрического А1 в кремнеалюмокислородных каркасах может быть либо меньше, либо равно содержанию кремния, но не может быть больше его. Среди цеолитов (при�родных и синтетических), это пра�вило не имеет исключений. Эта закономерность (Правило Лёвенштейна не только огра�ничивает содержание А12О3, а следовательно, и содержание Ме2О и МеО в цеолитах, но из него следует, что в (Si, A1, О)-каркасах цеолитов (а также и других алюмосиликатов) возможны лишь связи типа Si—О—Si и Si—О—А1, тогда как связи типа А1—О—А1 . невозможны. Одной из причин этого может быть электростатиче�ское отталкивание отрицательно заряженных тетраэдрических (AlO4/2)-групп, препятствующее их непосредственному сочленению помощью общих кислородов (вершин тетраэдров).
Кроме того, считается, что еще одной характерной чертой химии цео-литов является типичный для последних изо�морфизм по схеме замещения CaAl NaSi. Было показано, что у некоторых цеолитов отношение SiO2 : А12О3 изменяется вместе с изменением отношения Na2O : CaO.
Если сравнивать цеолиты с полевыми шпатами, то главным отличием, является, безусловно отличие их кристаллических структур.
Будучи построенными из одних и тех же элементарных структурных звеньев — (Si, О)- и (А1, О)-тетраэдров, каркасы цеолитов представляют собой откры�тые структуры (см. Рис. 17), в которых эти структурные звенья упакованы очень неплотно. Различия в плотности кристаллов полевых шпатов (2.6—2.7 г/см3) и цеолитов (2.0—2.3 г/см3) при близости их составов являются непосредственным проявлением различий в строении их (Si, A1, О)-каркасов.
Рис. 17 Пример кристаллического строения цеолитов.
Особенностью архитектуры кремнеалюмокислородных кар�касов цеолитов, является наличие в них системы регулярных каналов и сообщающихся полостей с минимальными размерами, сравнимыми с размерами молекул. Максимальные размеры каналов и полостей в цеолитах могут достигать 10—15 . Щелочные и щелочноземельные катионы, компенсирующие отрицательные заряды (А1, О)-тетраэдров каркаса, располагаются в цеолитах в этих пустотах кристаллической решетки, занимая лишь сравнительно малую часть их объема. Именно благодаря наличию каналов в кристаллической решетке цеолитов в отличие от полевых шпатов обеспечиваются возможности встречной диффузии ионов и гетеровалентного ионного обмена даже при комнатной температуре. Способность цеолитов обмену катионов является одним из их характерных свойств, незанятая катионами большая часть пустот в кристаллической решетке цеолитов заполнена молекулами воды.
Вода является характерной составной частью всех цеолитов, и цеолиты в отличие от других близких алюмосиликатов являются водными алюмосиликатами. Вода находится во внутрикристаллических каналах цеолитов в одних случаях в виде отдельных, в значительной степени обособленных молекул, занимающих фиксированные положения в решетке. В других случаях, когда пустоты в решетке достаточно велики, вода существует там в виде ассоциатов (кластеров) из нескольких молекул, взаимодействующих не только с каркасом, но и между собой с помощью межмолекулярных водородных связей, как и в жидкой воде. Количества воды, содержащиеся в кри�сталлах разных цеолитов, могут существенно различаться - они зависят от объема внутрикристаллических пустот, которые могут запол�ниться молекулами воды. Объемы пустот, доступных для молекул воды в кристаллах некоторых цеолитов, могут достигать поло�вины всего объема кристалла.
Вода может быть удалена из кристаллов цеолитов путем их нагревания без разрушения структуры их кремнеалюмокислородного каркаса. При этом кристаллы цеолитов становятся пористыми. Способность цеолитов превращаться в пористые кристаллы после их дегидратации является одним из наиболее замечательных их свойств. В этом качественно новом состоянии — состоянии по�ристых кристаллов — цеолиты могут устойчиво существовать лишь в условиях вакуума. В атмосфере паров воды или во влажном воздухе пористые кристаллы цеолитов могут полностью регидратироваться. Процесс дегидратации цеолитов обратим только в тех случаях, когда выделение воды при нагревании кристаллов не сопровождалось необратимыми изменениями структуры кри�сталлической решетки; в противном случае регидратация цеоли�тов либо вообще невозможна, либо происходит лишь ограни�ченно.
В атмосфере паров других веществ пористые кристаллы ведут себя как молекулярные сита; они селективно поглощают молекулы малых размеров, способные проникать во внутрикристаллические пустоты цеолитов, и не поглощают молекулы, эффективные раз�меры которых превышают размеры самых узких участков в си�стеме регулярных каналов, пронизывающих каркасы цеолитов. Узкими участками в системе внутрикристаллических каналов и полостей разных цеолитов являются шести-, восьми- и двенадцатичленные кислородные кольца, диаметры которых зависят от числа атомов кислорода в этих кольцах и от их геометрии.
В зависимости от геометрии существенно меняется размер "окна" (см. рис. 18). Приведен пример на основе восьмичленных кислородных циклов.
Молекулярноситовые свойства пористых кристаллов не опре�деляются только особенностями собственно геометрии их кремнеалюмокислородных каркасов, но они в значительной степени за�висят от химического состава кристаллов и в первую очередь от природы и количества катионов, компенсирующих отрицатель�ный заряд полимерного алюмокремниевого аниона. От химического состава цеолитов зависят и другие их свойства: термическая стабильность решетки, химическая устойчивость в кислых средах, адсорбционная способность, взаимодействие со связующими в процессе грануляции и др.
Рис. 18 Различие в форме и размеров восьмичленных кислородных колец у различных гидратированных цеолитов.
Существенно иными специфическими свойствами обладают водородные формы цеолитов. В химическом смысле цеолиты могут быть названы солями соответствующих алюмокремниевых кислот. Такие кислоты не существуют в природе, но с помощью некоторых химических реакций цеолиты могут быть переведены в состояние, в котором значительная часть катионов, компенсирующих отрицательный заряд (Al,О) -тетраэдров каркаса, оказывается замещенной на протоны. Такие Н-формы цеолитов обладают всеми свойствами алюмокремниевых кислот. Подобно алюмосиликатным катализаторам, цеолиты в водородных формах обладают высокой каталитической активностью и способностью к обмену водорода на другие катионы, как это свойственно кислым формам других ионообменников. Таким образом, свойства цеолитов, с одной стороны, связаны специфическими особенностями геометрии их кристаллических решеток, а с другой — с их химическим составом.
Цеолиты, как было сказано, способны обменивать содержащуюся в них воду на другие жидкости (спирт, аммиак и т. п.). При осторожном нагревании цео�литов вода постепенно удаляется, и даже полное обезвоживание не приводит к разрушению кристаллической решетки. Особенно важно то, что в цеолитах одни катионы могут замещаться другими. На послед�нем свойстве основано применение цеолитов в качестве ионообменников (катионитов). Цеолиты с внедренными в них ионами d-элементов являются катализаторами.
Ряд искусственных цеолитов используется в качестве так называе�мых молекулярных сит. Кристаллы последних характеризуются нали�чием узких сквозных пустот с диаметром от 3 до 13 А. Молекулярные сита поглощают вещества, молекулы которых могут войти в эти от�верстия. Например, молекулярное сито с диаметром отверстия 3,5 А может поглотить молекулы Н2, О2, N2) но практически не поглощает более крупные молекулы типа СН4 или атомы Аг. Молекулярные сита используют также для разделения углеводородов, осушки газов и жидкостей.
6. Фуллерены.
Значительно увеличилось количество соединений включения после открытия фуллеренов.
Открытие фуллеренов - новой формы существования одного из самых распространенных элементов на Земле - углерода - признано одним из важнейших открытий в науке XX столетия. Несмотря на хорошо известную способность атомов углерода образовывать сложные разветвленные и объемные молекулярные структу�ры (см. Рис 19), составляющую основу органической химии, возможность образования стабильных каркасных моле�кул из одних только атомов углерода оказалась неожиданной. Экспериментальное подтвер�ждение, что молекулы подобного типа из 60 и более углеродных атомов могут возникать в ходе естественно протекающих в природе процессов, получено в 1985 г.
Обнаружение фуллеренов напрямую связано с исследованием про�цессов сублимации и конденсации углерода. Исследование вели преимущественно методами масс-спектрометрического анализа, позволяющими определять молекулярные массы частиц пара и их осколки, получающиеся после обработки жесткими излучениями.
Рис. 19. Некоторые соединения углерода с объемным каркасом.
Состав насыщенного пара углеро�да, оказался совсем не таким простым, как можно было бы предполагать для простого вещества. В нем обнаружи�ли молекулы с общей формулой Сn, где индекс n принимает значения от 1 до 10. подобные многоатомные частицы часто называют кластерами. Долгое время научные исследования сводились к изучению именно этих углеродных кластеров.
При некоторых условиях синтеза состав кластеров становятся больше n = 40 – 100 атомов. Особенностью этих больших кластеров является то что количество атомов в них всегда определяется четным числом. Среди них наибольшей устойчивостью отличались частицы с числом атомов углерода 60 и 70.
Строение кластера С60 было предложено и вскоре подтвердилось, дав название производное от самой популярной в мире игры (см. Рис 20).
В дальнейшем были разработаны самые разнообразные методы получения фуллеренов их очистки, экстракции и разделения.
Одним из уникальных свойств молекул фуллеренов является спо�собность заключать внутри своего углеродного каркаса другие частицы (атомы, моле�кулы, кластеры). Получающиеся таким образом соединения называют эндоэд-ральными, в отличие от экзоэдральных производных фуллеренов, в которых не входящие в углеродный каркас атомы находятся снаружи него. Очень заманчиво выглядят перспективы использования этой способности. Возможно создание мо�лекулярных контейнеров. Все, однако, не так просто. Самое сложное - понять и научиться управлять процессом внедрением эндоэдральных групп внутрь молекул фуллеренов. Процессы замыкания и размыкания углеродного каркаса фуллеренов достаточно сложно реа�лизовать обычными синтетическими методами.
Рис. 20 Строение фуллерена С60 (два способа изображение молекулы).
Таким образом, была обнаружена новая аллотропическая модификация углерода наряду с графитом, алмазом и карбином.
Среди соединений, которые принято относить к эндоэдральным фуллеренам, выделяют две основные группы. Первая и главная - эндоэдральные металлофуллерены, содержащие внутри углеродного каркаса один или более атомов металла. Известно уже достаточно много та�ких соединений с более чем двумя десятками различных атомов метал�лов, относящихся к различным группам периодической системы. Ко второй, значитель�но меньшей группе, относятся эндоэдральные соединения фуллеренов с атомами инертных газов и азота, а также небольшими двухатомными молекулами (N2, CO). Эти соединения менее интересны, чем металлофуллерены, поскольку взаимодействие между эндоэдральным атомом и углеродным каркасом незначительно и получающиеся соединения практически не отличаются своими свойствами от исходных фуллеренов.
Основной способ получения металофуллеренов состоит в испарении в ду�говом разряде в атмосфере инертного газа графитовых стержней со вставками из труднолетучих соединений соответствующего металла (оксиды лантаноидов, карбиды щелочных металлов и.т.п.). При этом получается сажа, содержащая смесь самих фуллеренов и их металлопроизводных, требующая их экстракции и дальнейшего разделения. Главная проблема выделения металлофуллеренов - их низкое содержание в саже. Кроме того, требуется этап разделения продуктов, который также является довольно сложной технологической операцией.
Эндоэдральные фуллерены с атомами щелочных метал�лов могут быть получены посредством бомбардировки фуллереновых пленок быстрыми ионами этих металлов (т.н. ионной имплан�тацией), способными, начиная с определенной энергии (от нескольких до нескольких десятков эВ в зависимости от размера иона), проникать внутрь фуллеренов. Эта энергия затрачивается на разрыв и де�формацию связей в углеродном каркасе, обеспечивающую образование "окна", через которое проникает налетающий ион. Таким же образом получают эндоэдральные молекулы с атомами инертных газов. Этот способ, однако, не универсален, так как под воздействием ионного пучка могут протекать различные полимеризационные процессы в фуллереновой мишени. Поэтому эндоэдральные молекулы с атомами инертных газов получают иным способом - помещают фуллерены в атмосферу соот�ветствующего инертного газа под определенным давлением. Если ато�мы гелия не требуют больших затрат энергии для прохождения сквозь углеродный каркас, то внедрение атома ксенона потребует уже повы�шенных температур и давлений порядка 300 МПа.
Сейчас известно более 20 различных металлов, атомы которых при синтезе в дуговом разряде могут "входить" в структуру фуллерена. К ним относится почти весь лантаноидный ряд, переходные металлы третьей группы, некоторые щелочноземель�ные и другие металлы. Причины, по которым некоторые металлы (например, большинство переходных металлов) не образуют подобных со�единений, пока не вполне ясны. Главной причиной, возможно, является термо�динамическая предпочтительность карбидных форм соединений таких металлов с углеродом. Кроме того, было обнаружено, что в эндоэдральных соединениях происходит перенос до трех электронов от каждого атома металла на углеродный каркас. Вероятно, подобное взаимодей�ствие проходит более эффективно для металлов с более "мягкой" валент�ной электронной оболочкой, т.е. металлов лантаноидного ряда и пере�ходных металлов третьей группы.
Эндоэдральные молеку�лы, содержащие более одно�го атома металла, известны практически для всех ме�таллов, образующих эндо�эдральные соединения. Мо�лекулы с большим числом атомов металла внутри уг�леродного каркаса пред�ставлены преимущественно производными скандия. Для него обнаружено соедине�ние Sc4@C82 (Значок @ был предложен для обозначения внедренного атома или молекулы).
Подобная ситуация объясняется размерным фактором – скандий имеет наименьший радиус из элементов третьей группы. Интересным является образование эндоэдральных фуллеренов с внедренными внутрь углеродного каркаса кластерами, включающими атомы неметаллов. Одной из таких частиц яв�ляется кластер М2С2. Получение таких кластеров не требует особых синтетических процессов. Они обра�зуются в дуговом разряде сами собой. Одно из таких соединений -Sc2C2@C84 - удалось количественно выделить.
Самым своеобразным видом эндоэдральных металлофуллеренов являются молекулы, содержащие внутри углеродного каркаса слегка искаженные треугольные кластеры M3N. Первые из подобных соединений, содержащие кластеры ScxEr3-xN, производные фуллерена С80 (см. рис. 21), полученные добавлением азота в гелиевую ат�мосферу, в которой осуществляется синтез металлофуллеренов в дуго�вом разряде.
Рис. 21 структура молекулы состава Sc3N@C80. Кластер Sc3N имеет плоское симметричное строение с атомом азота в центре.
Для некоторых подобных соединений выращены и изучены моно�кристаллы молекулярных комплексов с ароматическими молекулами. Среди них наиболее известны молекулы ErSc2N@C80, Sc3N@C78, Sc3N@C80 и Lu3N@C80. Среди молекул этого класса также известно соединение, имеющее нехарактерный для самих фуллеренов углеродный каркас (не отвечающий правилу изолированных пяти�угольников) - Sc3N@C68.
Структурные исследования металлофуллеренов (моле�кула Y@C82) показали, что атом металла не хочет находиться в центре фуллереновой полости. Смещение атомов от центра углеродного каркаса было ранее пред�сказано на основании квантово-химических расчетов для молекул Са@С60 и Sс@С60 а также для молекул M@C82 со скандием и лантаном.
Причины возникновения подобных асимметричных структур заключены в характере связи атома металла с углеродным каркасом. Оказалось, что формальный заряд атомов металла составляет от +2 (Са) до +3 (La), т.е. имеет место суще�ственный перенос заряда с атомов металла на углеродный каркас. Од�нако это, образно говоря, не вся правда. Более поздние и тщательные исследования электронной структуры соединений показали, что отрицатель�ный заряд преимущественно локализован на примыкаю�щих к атому металла участках углеродного каркаса, а не распределен равномерно по всем атомам углерода.
Так для соединения состава La@C82 характер связи может быть описан как ионный (La3+@C823-) только формально.
В случае соединений гадолиния атому ме�талла приписан заряд +2, во всех же остальных случаях +3. В основ�ном эти выводы подтверждались данными квантово-химических расчетов. Главные же противоречия возникли в случае скандия, для которого расчет предсказывал заряд +2, а по данным эксперимента получался заряд +3.
Еще одним важным экспериментальным результатом стало обнаружение явления изомерии у эндоэдральных фуллеренов. Это связано с возможностью атомом металла занимать различные, близкие по энергии положения внутри полости. Для соединения Er2@C82 установлено, что атомы металла предпочитают занимают область пояса из шестиугольных циклов.
В отличие от пустых фуллеренов менее доступные эндоэдральные фуллерены изучены мало. Можно предположить, что хи�мические свойства эндоэдральных фуллеренов, заключающих в себе атомы инертных газов, не отличаются от свойств пустых фул�леренов. Иначе обстоит дело в случае металлофуллеренов – электронные свойства их заметно изменены наличием атома (атомов) металла.
Наиболее заметное химическое свойство эндоэдральных металло�фуллеренов, отличающее их от пустых фуллеренов, - их высокая спо�собность к полимеризации. Эта способность объясняется тем, что в случае нахождения внутри углеродного каркаса атома с нечетным зарядом ядра молекулы металлофуллеренов представляют собой радика�лы. В иных случаях возможно существование бирадикалов. Кстати, возможность полимеризации металлофуллеренов существенно затрудняет их ис�следования на молекулярном уровне.
Лучше всего изучена сравнительная реакционная способ�ность эндоэдральных моно- и диметаллофуллеренов, содержащих скандий и лантан, и пустых фуллеренов в реакциях цикло-присоединения по двойной связи.
Рис. 22 Реакция La@C82 с дифенилдиазометаном.
Также изучена представленная на рис. 22 протекающая через образование карбена реакция La@C82 с дифенилдиазометаном, приводящая к образованию трехчленного углерод�ного цикла.
Ис�следования показали, что подобные реакции протекают при облучении (фотохимический процесс) как в случае пустых, так и эндоэд�ральных фуллеренов. Однако пустые фуллерены при термоактивации в реакцию не вступают, тогда как с участием металло�фуллеренов подобные реакции успешно протекают. Это связано с иным характером заполнения электронных орбиталей.
Известны успешные попытки получения неорганических произ�водных металлофуллеренов. Так, в реакции соединения Pr@C82 с азотной кислотой в CCl4 при небольшом нагревании получены продукты окисления металлофуллерена состава Рг@С82Оm(ОН)n со значениями m и n близкими к 10. Нагреванием на воздухе растворов металлофуллеренов в ароматических растворителях в присутствии концентрирован�ной щелочи и катализатора межфазного переноса получены гидро-ксипроизводные соединений Но@С82, Но2@С82 и Но2@С84 общей формулы Ноx@Су(ОН)n.
Можно отметить некоторые возможные варианты применения эндоэдральных фуллеренов.
Они могут оказаться перспективными в качестве материалов для микроэлектроники. Од�нако высокая стоимость и высокая реакционная способность делают широкое применение этих соединений пока ограниченным. Существуют, тем не менее, направления, где применение эндоэдральных фуллеренов достаточно реально. Перспективными областями применения фуллеренов и их производных являются биология и медицина. Фуллерены способны достаточно легко проникать сквозь различные биологические мембраны, что позволяет использовать их в качестве меток или индикаторов в медико-биологических исследованиях. Главный барьер на пути медико-биологического применения фуллеренов и их производных - их плохая растворимость в воде. Но после разработки методов получения эндоэдральных гидроксифуллеренов эта проблема может быть снята. Эндоэдральные металлофуллерены, содержащие внутри углеродного каркаса парамагнитные атомы металлов, предос�тавляют исследователям более широкие возможности, связанные с применением различных магнитных методов. В частности их используют в магнитно-резонансной томографии, для получения более четких изображений.
Применение внутри человеческого организма требует малой токсичности т.е. высокой их устойчивости по отношению к распаду с высвобождением атома металла. Сегодня с этой целью, обычно применяют хелатные комплексы. В срав�нении с ними эндоэдральные гидроксифуллерены, содержащие атом металла внутри замкнутого каркаса, могут оказаться существенно безопаснее.
Помимо томографических применений, существует возможность использования эндоэдральных соединений с радиоактивными нукли�дами металлов в качестве радиопрепаратов. Такие соединения получе�ны при облучении гольмиевых эндоэдральных фуллеренов потоком нейтронов, что привело к образованию внутри углеродного каркаса ра�диоактивных нуклидов 166Но. В настоящее время исследуются возмож�ности химической модификации таких молекул функциональными группами, спо�собными обеспечить бы их сродство к тем или иным органам.
Интересное химическое применение найдено гелиевым эндоэдральным фуллеренам. Химические модификации молекулы влияют на ве�личину химического сдвига в спектрах ЯМР на ядрах 3Не. При этом эндоэдральный атом гелия не влияет на реакционную способ�ность молекулы, и химические свойства соединений Сn и Не@Сn прак�тически идентичны.
7. Фуллериты.
Фуллерены, находящиеся в твердом состоянии, принято называть фуллеритами. Фуллерены С60 и С70, так же, как и молекулы высших фуллеренов (С76, C78, C80, С82, и т.д.), конденсируются в кристаллы, от�носящиеся к типу молекулярных. Такие кристаллы образует подав�ляющее большинство органических соединений. Молекулярные кристаллы характеризуются относительной небольшой величиной энергии взаимодействия молекул. Это обуслов�лено сравнительно слабыми силами Ван-дер-Ваальса, в противоположность тому, что имеет место в ионных кристаллах, где главную роль играют кулоновские силы или атомным кристаллам, где связь осуществляется благодаря ковалентному взаимодействию.
Прочность связи между атомами углерода в молекуле фуллерена намного прочнее, чем связь между фуллереновыми молекулами в кристалле, что видно из сравнения приведенных ниже величин.
Энергия сублимации кристалла фуллерена - 180 кДж/моль.
Энергия атомизации кристалла фуллерена - 714 кДж/моль
По этой причине фуллерит легко переводится при нагревании в га�зовую фазу без разложения.
Фуллериты принадлежат одновременно к разряду пластических кристаллов, отличительное свойство которых ориентационная разупорядоченность, связанная со способностью молекул легко менять при тепловом движении относительную пространственную ориентацию даже в условиях кристаллического окружения. Это может происхо�дить, когда энергетические барьеры, разделяющие различные положе�ния молекулы, достаточно низкие (20—30 кДж/моль). В случае фуллеренов указанная способность вполне понятна, принимая во внимание высоко симметричную, почти сферическую форму молекул. Очевидно, что доля молекул, способных преодолеть такой барьер и участвующих во вращательных движениях зависит от температуры. Для фуллеритов (С60) за�мораживание вращательных перестроек начинается лишь при 80-90 К.
На кристаллическую структуру (и связь между молекулами) фуллеренов влияет термообработка фуллерита, воздействие давления, све�та, электронного пучка, интеркаляции атомов металлов.
Фуллериты - термодинамически нестабильные фазы по отношению к другим формам углерода - графиту при нормальных условиях и ал�мазу при высоких давлениях. Тем не менее, благодаря высокой кине�тической устойчивости, экспериментально определенные ключевые характеристики этих веществ - энтальпия образования, теплоемкость, энтальпия сублимации и растворения - позволяют рассчитывать фазо�вые равновесия точно так же, как и в случае термодинамически устой�чивых фаз.
Существенное отличие кристаллов фуллеренов от молекулярных кристаллов многих других органических веществ в том, что для них не удается получить жидкую фазу. Это связано с тем, что температура перехода в жидкое состояние (примерно 1200 К для фуллерита С60), уже превышает значение, при котором наступает заметная деструкция углеродного каркаса самих молекул фуллерена. однако происходит не разрушение каркаса С60, а начинается переход в более устойчивое состояние, например С60(фуллерит) С60(графит).
Ниже в приведены (см. табл ***) некоторые физические характеристики фуллеритов
Таблица 5 Физические свойства фуллерита (С60).
Экспериментальные структурные исследования показали, что молекулы С60 при комнатной температуре кристаллизуются в гранецентрированную кубическую (ГЦК) структуру — са�мую плотноупакованную из кубических решеток с постоянной ре�шетки а = 117 . Расстояние между центрами ближайших молекул С60 10.02 . Кристаллическая решетка рассматриваемой модификации фуллерена С60 относится к простран�ственной группе симметрии, обозначаемой в номенклатуре Шенфли-са символом Oh5, а согласно Международной кристаллографической номенклатуре (система Германа-Могена) - Fm 3m.
Ниже (см. рис 23) приведены четыре молекулы фуллерена, расположенные в кристалле фуллерита.
Рис. 23 Элементарная ячейка фуллерита С60 с молекулами в стандартной ориентации.
Под воздействием температурых и иных факторов фуллериты могут претерпевать фазовые переходы в иные кристаллические структуры (орторомбичекая, тетрагональная, ромбоэдрическая).
При комнатной температуре, как уже было сказано, С60 кристаллизуется в форме гранецентрированной кубической решетки с относительно слабыми межмоле�кулярными силами связи. В плотноупакованной ГЦК структуре (пара�метр решетки равен 117 ) молекулы C60 представляются шарами радиусом 10.02 . На одну молекулу С60 приходится одна октаэдрическая и две тетраэдрические пустоты с радиусами 2.06 и 1.12 соответ�ственно. Такие большие пустоты делают фуллериты перспективными объектами для синтеза новых соединений внедрением в них разнооб�разных атомов и молекул. Классификацию образующихся продуктов в результате внедрения в фуллерит атомных или молекулярных форм можно провести в соответ�ствии с тем, происходит ли перенос заряда в результате интеркаляции. Атомы щелочного (или щелочноземельного) металла, диффундируя в кристаллическую решетку фуллерита С60, передают свои валентные электроны молекулам С60. Тем самым они образуют молекулярные анионы, в которых заряд делокализован по всей оболочке С60, при этом разница в длинах двойной и одинарной связей уменьшается. Такие соединения принято называть фуллери-дами.
Если в результате интеркаляции не происходит переноса заряда, говорят об образовании клатрата. В этом случае молекулы С60 нахо�дятся в своей подрешетке, а внедренные атомы (или молекулы) или образуют свою подрешетку, или случайным образом распределены по пустотам в решетке фуллерита. Последняя ситуация чаще всего реа�лизуется при внедрении в фуллерит газов под давлением (с нагре�вом или без): Не, Ne, Н2, О2, N2, Аг, СО, N2O, Кг, СО2, Хе, СН4, CF Гранецентрированная кубическая решетка С60, как правило, сохраня�ется, но параметр решетки может увеличиться. Так как, по определению, ника�кого переноса заряда в клатратах не происходит, то их основные свойства могут быть предсказаны из свойств составляющих молеку�лярных компонент. Перенос заряда в интеркалятах приводит к суще�ственным изменениям свойств фуллеритов, что возбуждает к ним больший интерес и возможность практического применения.
Не только большими пустотами в решетке фуллерита, но и способ�ностью молекул С60 принимать электроны объясняется успешный синтез многочисленного класса интеркалированных соединений "ще�лочной металл - фуллерит С60". Их свойства чрезвычайно разнообразны. Достаточно упомянуть сверхпроводимость в соединениях М3С60 (в RbCs2C60 тем�пература перехода в сверхпроводящее состояние составила 33 К) и возможность полимеризации.
Структура соединений МxС60 (х = 0-6) определяется размером катиона щелочного металла и количеством внедренных ато�мов.
Сравнение радиусов пустот и ионов щелочных металлов (см. Табл. 6) помогает понять многие структурные закономерности этих соедине�ний.
Структура МС60 (см. далее Рис 24) с заполнением исключительно октаэдрических пустот ГЦК C60 известна для М = К, Rb, Cs. Структура М2С60 с заполнением только тетраэдрических пустот известна для Na2C60 и, возможно, для Li2C60, что обусловлено относительно малыми размерами атомов Na и Li.
Рис. 24 Структуры С60 и MxС60 молекулы фуллерена – большие шары, атомы металла – малые шары. Под изображениями указан состав и структурный тип кристалла.
Заполнение двух тетраэдрических и одной октаэдрической пустоты в ГЦК структуре С60 приводит к образова�нию сверхпроводящих фаз К3С60, Rb3С60 и несверхпроводящей Na3С60.
Таблица 6 Размеры ионов и пустот в ГЦК решетке фуллеридов.
|
Структуру С60
|
Тип пустоты
|
Количество пустот
|
Радиус пустоты
|
Щелочной металл
М+ радиус,
|
|
ГЦК
а = 117
|
октаэдрическая
тетраэдрическая
|
1
2
|
2.06
1.12
|
Cs
Rb
K
Na
Li
|
1.70
1.49
1.38
1.01
0.69
|
При образовании Cs3С60 размещение трех больших атомов Cs приводит к деформации фуллерита в объемноцентрированную кубическую (ОЦК) структуру. Дальнейшее внедрение атомов К и Rb деформирует ГЦК-решетку и ведет к образованию объемоцентрированной тетрагональ�ной (ОЦТ) решетки К4С60 и Rb4C60. "Насыщенные" соединения М6С60 имеют ОЦК решетку и известны для К, Rb и Cs. Благодаря своему маленькому диаметру Na образует соединения состава Na4С60, Na6C60 и даже Na9C60, не нарушая ГЦК упаковки С60.
Электроны щелочного металла переходят на нижние свободные орбитали С60, образуя катион щелочного металла и анион С60 с зарядом от -1 до -6. Как показывают теоретические расчеты последовательное заполнение этой орбитали, должно приводит сначала к росту проводимо�сти с максимумом на трех атомах щелочного металла, а полное запол�нение орбитали шестью электронами - к образованию изолятора М6С60. Подобная модель согласуется с экспери�ментальными данными.
Термодинамические характеристики некоторых соединений (см. Табл. 7) говорят об их достаточной устойчивости.
Одним из основных методов получения соединений внедрения является прямая твердофазовая реакция щелочного метал�ла и фуллерита.
При этом синтез проходит при высоких температурах (500-700 К) в течение нескольких недель. Сокращение времени реак�ции приводит к получению неравновесной смеси. Порошкообразные образцы проявляют лучшие свойства, чем пленоч�ные, которые не выдерживают длительного отжига, необходимого для максимального приближения к равновесию.
Таблица 7 термодинамические характеристики некоторых фуллеритов.
|
Соединение
|
G0(925 K) кДж/моль
|
|
КС60
|
-173
|
|
К3С60
|
-424
|
|
К4С60
|
-535
|
|
К6С60
|
-703
|
Исследование кинетики твердофазовой реакции синтеза интеркалятов различного состава в системах K(Rb)-C60 продолжительностью от 24 часов до 60 суток позволяет предложить модель изменения фазового состава образцов. Подготовитель�ная процедура синтеза заключается в том, что взвешенное количество щелочного металла (М) запаивается под вакуумом в ампулу с опреде�ленным количеством С60. Когда начинается отжиг, пары щелочного металла адсорбируются на поверхности кристаллов С60. При этом на поверхности образуется насыщенное металлом соединение М6С60, а внутри остается ядро чистого С60. Со течением времени в результате диффузии щелочного металла по направлению к центру появляется фаза М3С60 и исчезают М6С60 и С60. Процесс синтеза соединений вне�дрения контролируется диффузией, поэтому результирующий состав не обязательно является равновесным, а зависит от температурного режима и времени отжига. Длительность и сложность полу�чения равновесных фаз являются недостатками метода твердофазного синтеза.
Замена щелочного металла на его соединения - гидриды, боргидриды, нитриды, бинарные сплавы, амальгамы - облегчают работу, исключая или уменьшая взаимодействие щелочного металла с мате�риалом ампул, тем самым увеличивается точность исходных соста�вов. Но время и температурный режим отжига остаются прежними.
Получение соединений внедрения из растворов выглядит очень привлека�тельно из-за возможности быстрого получения гомогенных образцов. Для этого используются растворы аммиака, ТГФ, толуола, смеси толуола с бензонитрилом и др. Здесь, однако есть свои сложности. Так, при использовании аммиака или ТГФ полу�ченные соединения K(Rb)3C60 остаются в растворе, поэтому для их вы�деления требуется нагревание до 573 К. В результате образцы часто оказываются плохо закристаллизованными и содержат в качестве примеси MCN, МОН, оксиды и исходные реагенты М и C60, т.е. требу�ют дальнейшей очистки.
Электрохимическое интеркалирование с использованием твердых электролитов также является перспективным методом синтеза, поскольку позволяет вводить дозированное количество ионов металла в матрицу фуллерита в отсутствие реакционноспособных щелочных металлов и органических раство�рителей и проводить исследование прямо в электрохимической ячейке.
Немного позже на основе углерода были получены объекты, которые получили название нанотрубок (см. Рис. 25). По своей природе, способам получения и многим свойствам (кроме геометрических размеров и формы) они аналогичны фуллеренам.
Рис. 25 Два варианта нанотрубок.
Как и в случае с фуллеренами внутрь нанотрубок могут быть помещены различные атомы, молекулы или кластеры. Кроме того, значительно больший объем внутренней полости, позволяет помещать внутрь значительные количества молекул газов, создавая, таким образом, самые маленькие в мире "газовые баллоны". Существует теоретическая возможность сохранения внутри нанотрубок неустойчивых (крайне реакционных) молекул и даже проведение, как в реакторе химических процессов. Размеры нанотрубок позволяют помещать внутрь объемные фрагменты различных веществ, получая новые свойства и нанокомпозиты. Все это, однако, имеет пока в основном теоретический характер из-за сложностей получения значительного количества самих нанотрубок.
Литература
БелГУ; Кафедра неорганической химии; Л.Н. Балятинская, Г.М. Фофанов, А.Н. Володченко и др.; Рец.: И.И. Василенко, В.П. Батлуцкий: Общая и неорганическая химия. - Белгород: БелГУ, 2008
Гузей Л.С.: Химия. 10 класс. - М.: Дрофа, 2008
Фельдман Ф.Г.: Химия. 9 класс. - М.: Просвещение, 2008
Зуева М.В.: Контрольные и проверочные работы по химии. 8-9 классы. - М.: Дрофа, 2007
Лидин Р.А.: Справочник по общей и неорганической химии. - М.: Просвещение: Учебная литература, 2007
Рудзитис Г.Е.: Химия: Неорганическая химия. 8 класс. - М.: Просвещение, 2007
Степин Б.Д.: Неорганическая химия. - М.: Высшая школа, 2014
Хомченко Г.П.: Химия для поступающих в вузы. - М.: Высшая школа, 2014
Карапетьянц М.Х.: Общая и неорганическая химия. - М.: Химия, 2013
Князева Р.Н.: Задания по химии для учащихся малокомплектной школы. - М.: Просвещение, 2003
под ред. Ю.Н. Кукушкина: Что мы знаем о химии?. - М.: Высшая школа, 2003
Под ред.Третьякова Ю.Д.: Химия: Справ.материалы. - М.: Просвещение, 2013
Сост. В.А. Крицман; Рец. М.В. Покровская: Книга для чтения по неорганической химии. - М.: Просвещение, 2011
Сост. В.А. Крицман; Рец. Т.Н. Прокопенко: Книга для чтения по неорганической химии. - М.: Просвещение, 2010
Шакирова Д.М.: Неорганическая химия. - М.: Просвещение, 2012
: Неорганическая и аналитическая химия. - М.: [Б.И.], 1991
: Неорганическая химия. - М.: [Б.И.], 2011
Ахметов Н.С.: Актуальные вопросы курса неорганической химии. - М.: Просвещение, 2001
Кудрявцев А.А.: Составление химических уравнений. - М.: Высшая школа, 2011
Л.В. Бабич и др.: Практикум по неорганической химии. - М.: Просвещение, 2001
Лидин Р.А.: Неорганическая химия в вопросах. - М.: Химия, 2011
Атомы азота
Атомы бора
тетрадекаэдр
Пентагональный додекаэдр
гексадекаэдр
Гидрат типа I Гидрат типа II
Фазы внедрения, соединения включения