Галлий и его хлориды. Синтез трихлорида галлия
Санкт-Петербургский государственный университет.
Химический факультет, кафедра общей и неорганической химии.
Курсовая работа.
Тема: "Галлий и его хлориды.
Синтез трихлорида галлия."
Выполнил: студент I курса II группы
Александров Евгений Александрович
Преподаватель: доц. Севастьянова Т.Н.
Научный руководитель: асп. Казаков И.В.
Санкт-Петербург
2011
Содержание:
Введение .................................................................................................................. 3
§1. Галлий ...................................................................................................................... 4
Открытие .................................................................................................. 4
Нахождение в природе ............................................................................. 4
Общая характеристика и физические свойства .................................... 5
Химические свойства.................................................................................. 6
§2.Обзор важнейших соединений................................................................................ 6
§3.Трихлорид галлия, его строение, физические и химические свойства .............. 8
Общая характеристика ............................................................................. 8
Диаграмма состояний галлий-трихлорид галлия ..................................... 9
Физические свойства ................................................................................... 9
Химические свойства ................................................................................... 12
Металлорганические комплексы .................................................................. 12
Низшие хлориды ............................................................................................ 13
Применение ..................................................................................................... 14
§4.Обзор прочих галогенидов галлия ....................................................................... 14
§5.Синтез трихлорида галлия ..................................................................................... 15
Подготовка .....................................................................................................15
Синтез .............................................................................................................16
Очистка ...........................................................................................................16
Заключение ................................................................................................................... 17
Литература .................................................................................................................... 17
Введение.
Мы знаем, что наука не стоит на месте – она непрерывно развивается. Одним из важнейших стимулов развития химии во все времена было прежде всего практическое применение получаемых и необходимых соединений, осознанно применяемых в повседневной жизни, было немного. Но со развитием потребностей развивались и науки, в том числе и химия. Первое её поприще – металлургия – прочно закрепилось за ней ещё три тысячелетия назад и остаётся важнейшим до сих пор. Со становлением цивилизации, развитием технического прогресса возникла необходимость в получении тысяч важнейших веществ, необходимых человечеству – лекарств, красителей, удобрений. Затем пришла очередь развития чисто теоретических исследований в области химии – всё-таки человек является не только потребителем, его всегда томит жажда познания материальных основ этого мира, расширение своего кругозора, накопление и обобщение знаний, полученных прошлыми поколениями.
Однако с наступлением XX века развитие человечества пошло семимильными шагами. Наука и техника, теория и практика теперь практически неразделимы. На службу человеку пришли миллионы разнообразных веществ, львиная доля которых в прошлом не имела практического применения. Химические элементы, полученные ради научного интереса, вдруг стали незаменимыми в молодых областях науки и техники – биофизике, радиоэлектронике, космических и нано-технологиях. Совершенно привычные и, казалось, ненужные вещества пригодились в неожиданных и необычных областях.Уран, например, ещё в начале XX века был одним из «неприкаянных» металлов, сейчас же он – основа ядерной энергетики.
Ещё один экзотический на первый взгляд металл – это галлий. В земной коре его не так много, к тому же выделение его очень трудоёмко ввиду сильной рассеяности, а довольно необычная и по-своему красивая химия галлия не так давно имела только теоретический интерес. Однако в последние десятилетия он и его соединения, наконец, «нашли работу»: полу- и сверхпроводники, люминофоры, органический катализ, новые материалы, исследование космоса – вот далеко не полный список.
Цель данной работы – обзор химии галлия и его основных соединений, сбор и систематизация информации о химических и физических свойств одного из важнёйших и интереснейших соединений галлия - GaCl3, а также существующие и перспективные направления применения этого соединения.
Основные задачи данной работы:
1) Оформление теоретической части работы, в которой в доступной форме идёт ознакомление аудитории с химией галлия и его трихлорида;
2) Синтез безводного GaCl3 на базе лаборатории высокотемпературной химии кафедры неорганической химии.
§1.Галлий
п.1.Открытие.
Галлий - один из элементов, существование и свойства которого были довольно точно предсказаны Д.И.Менделеевым в 1871 году на основе открытого им Периодического закона химических элементов.
Галлий был открыт в 1874 году. Французский химик Поль Эмиль Лекок де Буабодран с помощью спектрального анализа обнаружил в спектре цинковой обманки (сфалерит ZnS) новую фиолетовую линию с длинной волны 4172, приписанную им неизвестному элементу. Этот элемент был назван галлием в честь родины его первооткрывателя – Франции (латинское название – Галлия). Позже учёный предпринял меры для выделения его из руды. Для этого ему пришлось приложить максимум усилий – содержание элемента в руде составляло менее 0,1%, и по химическим свойствам он был сходен с цинком. Наконец, удалось получить около миллиграмма вещества. Химические и физические характеристики галлия были определёны Буабодраном далеко не полно из-за небольшого количества и недостаточной чистоты металла, которым располагал исследователь. Он также неверно определил плотность галлия, получив значение 4,7 г/см.
В декабре 1875 года Буабодран продемонстрировал 3,4 мг галлия парижской ученой элите и вскоре сделал доклад в Академии наук. Через некоторое время в Петербурге с сообщением об открытии галлия ознакомился Д.И.Менделеев и 15 ноября 1875 года направил сообщение в «Записки Французской Академии наук», что открытый элемент является ранее предсказанным им экаалюминием и что его удельный вес должен быть около 6, а не 4,7.
В 1876 году Буабодрану удалось получить 650 мг чистого галлия после переработки 435 кг сфалерита. Действительно, оказалось, что первоначально определенная им плотность металла была заниженной.Таким образом, открытие галлия послужило одним из первых доказательств Периодического закона, сформулированного Д.И.Менделеевым.
п.2.Нахождение в природе.
С геохимической точки зрения галлий – рассеянный элемент. Он проявляет более или менее халькофильный характер, накапливаясь в сульфидных минералах. Кларк (числовая оценка среднего содержания в земной коре) галлия довольно велик и составляет 1,5·10-3 % по массе. Таким образом, его содержание больше, чем молибдена, висмута, вольфрама, ртути и некоторых других элементов, обычно не относимых к редким.
Для галлия характерна крайняя редкость собственных минералов, самый характерный – галлит CuGaS2 (Рис.1), очень редко сопутствующий сфалериту и халькопириту. Природный галлий состоит из двух изотопов: 69Ga (61,2%) и 71Ga (38,8%).
Рис.1. Минералл галлит

Рис.2. Внешний вид галлия

п.3.Общая характеристика и физические свойства.
Тпл = 29,79 °С
Ткип = 2205 °С
Твёрдость по шкале Мооса – 1,5-2
Относительная атомная масса - 69,723
Плотность - 5,91 г/см
Галлий – элемент IV периода III группы главной подгруппы. Его порядковый номер – 31, в группе он следует за бором и алюминием.
Это светло-серый металл с синеватым оттенком (Рис.2). Довольно мягок при комнатной температуре и может быть прокатан в тонкие листы, но при резке довольно хрупок и ломается по линии разреза. Галлий обладает уникальной структурой. Он кристаллизуется в ортогональной сингонии. Структура галлия похожа на структуру кристаллического йода и состоит из псевдомолекул Ga2. Расстояние между атомами галлия в них равняется 2,44, и каждый атом в псевдомолекуле окружен шестью более удаленными атомами, расположенными (попарно) на расстояниях 2,70, 2,73 и 2,79. В расплавленном состоянии молекулы Ga2 сохраняются. Структура жидкого галлия гексагональная плотноупакованная; в парах же галлий почти исключительно одноатомен.
Благодаря молекулярной кристаллической решётке галлий – исключительно легкоплавкий металл, в этом отношении он уступает только ртути и цезию. Однако же температура кипения его является довольно высокой для легкоплавких металлов, вследствие чего температурный интервал существования жидкой фазы элемента очень широк. Плотность жидкого металла выше, чем твёрдого, вследствие чего при кристаллизации объём его возрастает. Один из немногих металлов, в жидком состоянии хорошо смачивающих многие материалы, в т.ч. и стекло. Очень склонен к переохлаждению - будучи расплавлен и вновь охлаждён, может месяцами сохраняться при комнатной и даже более низкой температуре. При кристаллизации сильно переохлаждённого металла вместо обычной -модификации могут образоваться кристаллы неустойчивой -модификации с температурой плавления – 16,3 °С, в структуре которой атомы образуют зигзагообразные цепочки. Кроме неё, получены ещё три неустойчивые модификации галлия с ещё более низкими температурами плавления. При высоком давлении металл претерпевает обратимое полиморфное превращение в галлий (II),имеющий структуру индия, а затем в галлий (III).
п.4.Химические свойства.
Подобно алюминию, галлий является типичным амфотерным металлом. Минеральные кислоты растворяют его медленно на холоду и быстро при нагревании.
2Ga + 6HCl = 2GaCl3 + 3H2
Растворяется в щелочах, образуя гидроксогаллаты.
2Ga + 6H2O + 2NaOH = 2Na[Ga(OH)4] + 3H2
Легко реагирует с галогенами при небольшом нагревании,
2Ga + 3Br2 = 2GaBr3
при более значительном – с серой. С водородом и азотом непосредственно не соединяется. При нагревании в атмосфере аммиака до температуры выше 900 °С образует нитрид GaN. При высокой температуре обладает сильными коррозионными свойствами, и разъедает материалы сильнее, чем любой другой расплавленный металл.
В обычных условиях на поверхности металла образуется тонкая плёнка оксида, предотвращающая металл от дальнейшего окисления кислородом воздуха. Во влажном воздухе, особенно в расплавленном состоянии галлий гораздо более склонен к окислению, на его поверхности образуется метагидроксид (GaO)OH.
§2.Обзор важнейших соединений
Гидрид Ga2H6 — летучая жидкость, Тпл = 21,4 °C, Ткип = 139 °C. В эфирной суспензии с гидридом лития или таллия образует соединения LiGaH4 и TlGaH4. Образуется в результате обработки тетраметилдигаллана триэтиламином. Имеются «банановые» электрон-дефицитные связи, как и в диборане.
Оксид Ga2O3 — белый или жёлтый тугоплавкий порошок. Существует в виде двух модификаций. -Ga2О3 — бесцветные тригональные кристаллы, малорастворимые в воде, но растворимые в кислотах. -Ga2О3 — бесцветные моноклинные кристаллы, малорастворимые в воде, кислотах и щёлочах. Получают нагреванием металлического галлия на воздухе при 260 °C или в атмосфере кислорода, или прокаливанием нитрата или сульфата галлия. Проявляет амфотерные свойства, хотя основные свойства, по сравнению с алюминием, усилены.
Гидроксид Ga(OH)3 — выпадает в виде желеобразного осадка при обработке растворов солей трёхвалентного галлия гидроксидами и карбонатами щелочных металлов (pH 9,7). Растворяется в концентрированном аммиаке и концентрированном растворе карбоната аммония, при кипячении осаждается. При нагревании гидроксид галлия претерпевает ряд префращений:
Ga(OH)3 GaOOH Ga2O3·H2O Ga2O3.
Можно получить гидролизом солей трёхвалентного галлия.
Сульфат Ga2(SO4)3·18H2O — бесцветное, хорошо растворимое в воде вещество. Получается при взаимодействии галлия, его оксида и гидроксида с серной кислотой. По некоторым химическим свойствам напоминает сульфат алюминия, сульфатами щелочных металлов и аммония легко образует квасцы, например, KGa(SO4)2·12Н2О.
Нитрат Ga(NO3)3·8H2O — бесцветные, растворимые в воде и этаноле кристаллы. При нагревании разлагается с образованием оксида галлия (III). Получается действием азотной кислоты на гидроксид галлия.
Арсенид GaAs — тёмно-серые кубические кристаллы,нерастворимые в воде. Замечателен своими полупроводниковыми свойствами, что делает его одним из перспективных материалов в радиоэлектронике и нанотехнологии (Рис.3). Получается прямым синтезом из элементов.

Рис.3.Арсенид галлия высокой чистоты.
Нитрид GaN — белый или желтоватый порошок, отличающийся большой химической стойкостью. Ни вода, ни концентрированные минеральные кислоты нa него не действуют, очень слабо действуют разбавленные кислоты. Из паров нитрида (испаряется он преимущественно и виде димерных молекул) удается вырастить мелкие монокристаллы в виде прозрачных игл. Получается нагреванием до 1200 °С металлического галлия в токе аммиака. Является важным полупроводником.

Рис.4.Сверхчистый нитрид галлия: слева обычные кристаллы, справа крупный монокристалл.
Фосфид GaP — оранжево-желтые или зеленовато-желтые кристаллы. Устойчив на воздухе, плохо растворяется в концентрированных и разбавленных серной и соляной кислотах, но легко растворяется при нагревании в азотной кислоте. С растворами щелочей при нагревании он реагирует с выделением фосфина. Используется в люменисцентных приборах.
Галлаты различных металлов, имеющие разнообразный состав и свойства. Известно три наиболее распространённых типа этих соединений: галлаты I группы (МеGaО2 или Ме5GaО4), галлаты II группы (МеGa2О4, Ме2Ga2О5 и Ме3Ga2О6) и различные галлаты редкоземельных металлов LnnGamОk, которые могут кристаллизоваться в искажённой решётке перовскита или граната. [1] Галлаты находят широкое применение в различных отраслях науки и техники. Они применяются в производстве полупроводников, в качестве оптического материала для люминесцентного покрытия, электронных изоляторов и т. д.
§3.Трихлорид галлия, его строение, физические и химические свойства.
п.1.Общая характеристика.
Трихлорид галлия (химическая формула GaCl3) – в чистом виде прозрачное, бесцветное, похожее на лёд крайне гигроскопичное вещество, кристаллизующееся в виде игольчатых кристаллов. Дымит на воздухе, сильно гигроскопичен. Хорошо растворяется в воде, при этом сильно гидролизуется.
п.2.Диаграмма состояний галлий - трихлорид галлия.
Ниже приведена диаграмма системы галлий-трихлорид галлия (Рис.5).
Рис.5. Система галлий – трихлорид галлия [2].
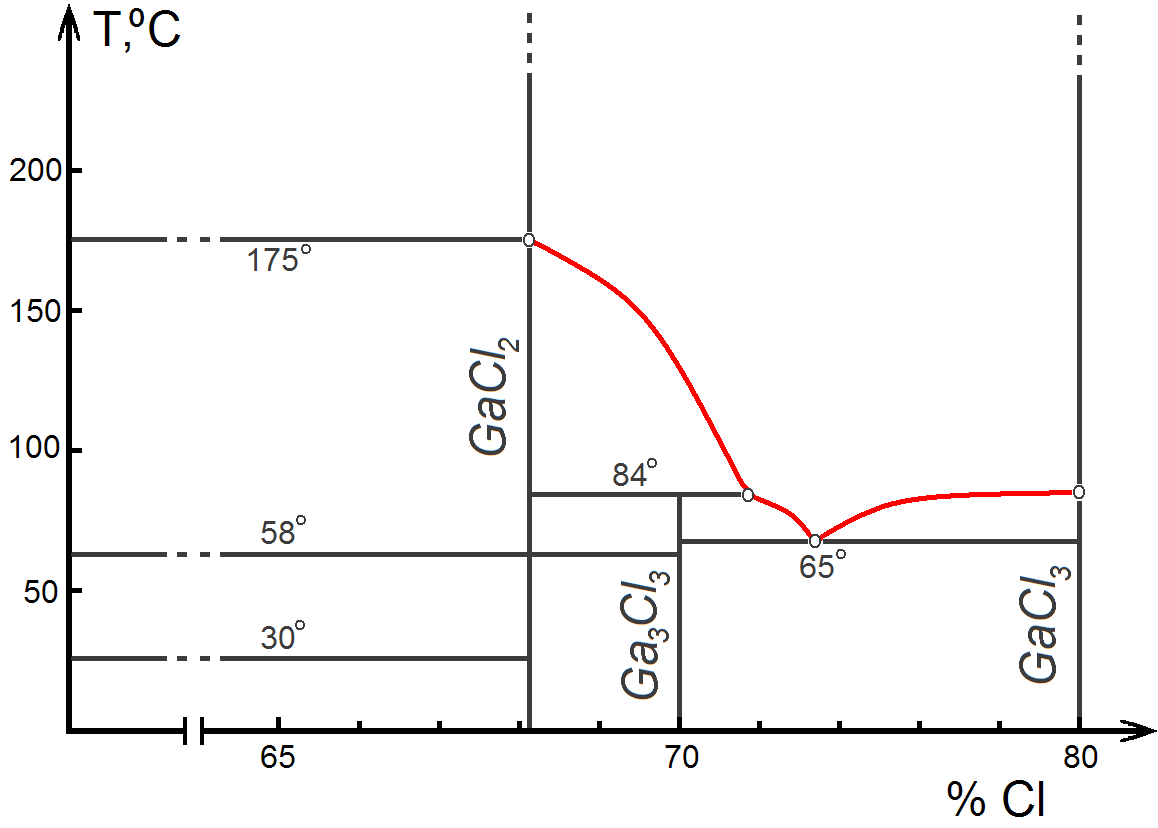
п.3.Физические свойства.
Температура плавления хлорида галлия равна (77,9±0,2 °С).Различные источники приводят несколько отличающиеся значения температуры плавления (в °С): 75,5 76,0 76,65 77,0 77,5 (77,75±0,05) (78,0±0,3) что вызвано, по-видимому, различной степенью чистоты хлорида.
Плотность твердого хлорида, определенная пикнометрическим методом, равна 2,47 г/см. Из рентгеновских данных вычислена плотность 2,50 г/см.
Кристаллическая структура хлорида галлия была исследована Велвоком и Воррелом. По их данным, он обладает триклинной решеткой со следующими параметрами (в ):
a=6,94 , b=6,84 , c=6,82 , a=119,5 , b=90,8 , g=118,8 , z=1 (Ga2Cl6)
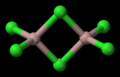
Атомы хлорида образуют в структуре хлорида галлия искаженную гексагональную плотнейшую упаковку со слоями, параллельными (001). В каждом слое 1/4 часть позиций упаковки не занята, так что каждый из двух периферических атомов хлора имеет 8 контактов с соседями вместо 12. Атомы галлия занимают половину имеющихся в структуре тетраэдрических пустот между двумя слоями атомов хлора, в результате чего в структуре наблюдаются димерные молекулы Ga2Cl6. Вследствие вакантности части позиций в структуре образуются каналы, параллельные (011). На основании изучения спектров комбинационного рассеяния можно прийти к выводу о существовании в твердом хлориде галлия димерных молекул . Считалось, что димер Ga2Cl6 можно рассматривать как комплексное соединение с координацинно-ковалентной связью, которое, однако, в значительной степени диссоциировано с образованием комплексного иона [GaH4] Измерения ядерного квадрупольного резонанса твердого хлорида галлия также интерпретированы в смысле образования димерных молекул со степенью ионности связей галлий - хлор 50%. Последующие исследования ИК-спектров спектров комбинационного рассеяния подтвердили образование трихлоридом димерных мостиковых молекул (с симметрией D2h) как в кристаллическом состоянии, так и в расплаве.
Изменение объема при плавлении хлорида галлия составляет 17.%
Удельная электропроводность твёрдого хлорида галлия составляет (1,5·10-5)Ом -1см -1 при плавлении уменьшается до (1,7·10-6)Ом -1см -1, что объясняется превращением ионного кристалла в жидкость, состоящую главным образом из димерных молекул.
Плотность жидкого хлорида галлия при температуре плавления равна 2,0536 г/см3. Для зависимости плотности от температуры (в интервале 71-196 °С) Клеммом и Тильком предложено уравнение
Р = 2,063 - 0,00205*(t - 78)
В работе Гринвуда и Воде для этого же интервала рекомендуется уравнение:
Р = 2,0531 - 0,00209*(t - 78)
Зависимость давления пара от температуры представлена в таблице ниже и взята из статьи [3].
Таблица 1. Зависимость давления насыщенного пара и стандартной энтальпии сублимации GaCl3 от температуры.
Опыт 1.
T (log P/Па) H(298K)
(K) кДж · моль-1
293.0 |0.83| 89.2
297.0 |1.06| 89.2
299.0 |1.13| 89.5
302.0 |1.23| 89.7
303.5 |1.32| 89.6
305.0 |1.37| 89.7
306.0 |1.40| 89.8
307.0 |1.46| 89.8
308.0 |1.49| 89.9
Средняя 89.6
Опыт 2.
T (log P/Па) H(298K)
(K) кДж · моль-1
290.5 |0.76| 88.9
293.0 |0.84| 89.2
296.5 |0.95| 89.5
298.0 |1.07| 89.4
300.5 |1.15| 89.7
304.0 |1.31| 90.0
307.0 |1.42| 90.0
308.0 |1.47| 90.0
Средняя 89.6
Опыт 3.
T (log P/Па) H(298K)
(K) кДж · моль-1
292.0 |0.79| 89.1
294.0 |0.90| 89.2
297.0 |1.03| 89.3
299.0 |1.12| 89.4
301.0 |1.22| 89.4
303.0 |1.28| 89.7
305.0 |1.32| 90.0
308.0 |1.45| 90.2
Средняя 89.5
Опыт 4.
T (log P/Па) H(298K)
(K) кДж · моль-1
289.0 |0.63| 89.1
292.0 |0.79| 89.1
293.5 |0.87| 89.2
295.5 |0.96| 89.2
297.0 |1.02| 89.4
298.5 |1.07| 89.5
300.5 |1.14| 89.7
303.0 |1.26| 89.8
306.0 |1.44| 89.6
Средняя 89.4
В этой же статье авторами было предложено уравнение температурной зависимости давления насыщенных паров над твердым GaCl3 в небольшом интервале температур (289-308)°К :
log(P) = 13,80 – 3800*(Т) -1
п.4.Химические свойства.
Хлорид галлия – типичное молекулярное соединение, по многим свойствам напоминающее хлорид алюминия.
Очень хорошо растворяется в воде и органических растворителях, при этом в воде он сильно гидролизуется. Из кислых, (порядка 6М) водных растворов практически полностью экстрагируется такими органическими растворителями, как эфир, бутилацетат и т. п., что позволяет количественно отделить галлий от алюминия, хлорид которого не обладает подобным свойством. В таких кислых растворах галлий присутствует и виде хлоргаллиевой кислоты HGaCl4, которая и экстрагируется растворителем.
Хлорид галлия является очень сильной кислотой (по Льюису). Он может образовывать соединения с хлоридами большинства других элементов.
В настоящее время изучено около сорока двойных систем из хлорида галлия с хлоридами других элементов. В большинстве случаев при взаимодействии компонентов образуются соединения, количество которых в одной системе не превышает двух. Состав соединений независимо от валентности другого элемента отвечает отношению хлорида галлия к другому хлориду 1: 1 или 2: 1. Из двух соединений всегда более устойчиво то, где отношение компонентов 1: 1.
Соединения, образующиеся в системах с хлоридом галлия, относятся к следующим типам.
1. Хлорогаллаты - соединения, содержащие анионы [GaCl4]. К ним относятся Ме[GaCl4], где Ме - катионы щелочных металлов, аммония, меди, серебра, одновалентных галлия, индия, таллия. Такой же анион образуется в соединениях с пентахлоридом фосфора [PCl4]+[GaCl4]–, тетрахлоридами селена и телура, а также, по-видимому, с трихлоридами висмута, сурьмы и мышьяка. В последних соединениях при переходе от висмута к мышьяку следует ожидать увеличения доли ковалентной связи.Возможно, что соединения (МеCl2·3GaCl3), где Mе = Mg, Ca, Sr, Ba, Cd, Hg, Sn, Pb, также содержат этот комплексный анион и образуют соединение Ме[GaCl4]2.
2. Хлордигаллаты - соединения с ионом [Ga2Cl7] представляющим собой два искаженных тетраэдра с общей вершиной. К ним относятся соединения Mе[Ga2Cl7] где Ме = Nа, K, Rb, Cs, Tl, In+, Ga+. По-видимому, именно такое соединение образуется и в системе с LiCl, хотя авторы приписали ему состав 2:3. Можно предположить, что такой же анион существует в соединении с трихлоридом висмутата [BiCl2]+[Ga2Cl7] –. Во всех случаях термическая устойчивость хлордигаллатов ниже, чем хлорогаллатов.
3. Пентахлорогаллаты Mе(GaCl5) найдены в системах с хлоридами магния, кальция, стронция, бария, кобальта и железа. Соединения такого типа были предсказаны Горюновой. Структура их неясна.
4. Соединения состава MеGaCl8 с пентахлоридами ниобия, тантала и молибдена, скорее всего, представляют собой молекулярные структуры, хотя не исключено строение, подобное соединению с пентахлоридом фосфора.
Хлорогаллаты различного состава используются для изучения и получения некоторых интерметаллических соединений галлия, которые могут применяться в качестве полупроводников.
п.5.Металлорганические комплексы.
Галлий не является типичным комплексообразователем, например, по сравнению с d-элементами. Тем не менее получено множество металлорганических комплексных соединений хлорида галлия с различными лигандами. Так,наиболее простой комплекс можно получить прямым взаимодействием хлорида с аммиаком:
GaCl3 + NH3 = [GaCl3 · NH3]
Также хлорид галлия образует аддукты с другими азотсодержащими соединениями – пиридином, дипиридилом, триментиламином и т.д. С трифенилфосфином образует соединение[GaCl3 · PPh3], можно получить аналогичный продукт с триметиларсином.
Многочисленные комплексные соединения галогенидов галлия активно изучаются в последние годы, т.к. по результатам исследований этих соединений могут быть получены новые материалы для нанотехнологий. Так, соединения состава InxGa1-xN – перспективные материалы для твердотельной оптоэлектроники и преобразователей световой энергии в электрическую – синтезируются из аммиачных комплексов InCl3 и GaCl3.
п.6.Низшие хлориды.
При сплавлении с металлическим галлием трихлорид переходит в низшие хлориды. В литературе часто упоминается хлорид двухвалентного галлия GaCl2 и смешанный [2GaCl2·GaCl3], но, по-видимому, галлий в степени окисления +2 в кристалле существовать не может. По данным структурных исследований установлено, что дихлорид и гептахлорид тригаллия на самом деле представляют собой хлорогаллаты одновалентного галлия Ga[GaCl4] и Ga[Ga2Cl7]. Это нелетучие твёрдые белые вещества, неустойчивые к нагреванию (выше 300 °C дихлорид начинает диспропорционировать на трихлорид и металлический галлий). Дихлорид галлия растворим в бензоле (4,6 г на 100 г бензола), а также толуоле, причем эти растворы проводят электрический ток.
Монохлорид галлия GaCl образуется в газовой фазе при действии паров трихлорида на металл; при конденсации он диспропорционирует с образованием дихлорида. Степень окисления галлия в этом соединении - +1.
В присутствии воды низшие хлориды галлия разлагаются с выделением оранжево-коричневого осадка, который постепенно превращается в гидроокись галлия.
п.7.Применение.
Трихлорид галлия находит применение в различных отраслях науки.
GaCl3 служит для рафинирования галлия – его можно легко очистить от нелетучих примесей многократной пересублимацией, а затем, восстановив, получить довольно чистый металл.
Так как это соединение является сильной кислотой Льюиса, оно, наряду с другими веществами, используется в органической химии как катализатор некоторых реакций хлорирования, например, реакции Фриделя-Крафтса.
Трихлорид галлия является исходным веществом для получения некоторых важных соединений галлия, комплексов
Наверное, одно из самых интересных применений трихлорида галлия – нейтринная астрономия. Дело в том, что нейтрино крайне слабо взаимодействует с веществом, поэтому регистрировать эти элементарные частицы возможно лишь косвенно. Нейтрино в определённых условиях может поглощаться изотопами 71Ga и 37Cl, с образованием соответственно радиоактивных нуклидов 71Ge и 37Ar*, которые затем распадаются с образованием -частиц высоких энергий:
e+71Ga 71Ge+e
37Cl+e 37Ar*+e
В нейтринных телескопах проектов GALLEX (Италия; Рис.6), SAGE (Россия) и GNO (США) используются несколько десятков тонн сверхчистого GaCl3, раствор которого помещён в герметичный резервуар, окруженный слоем воды и специальными детекторами: -частицы, выделяющиеся в результате нейтринного захвата, имеют крайне высокую энергию и, проходя через слой воды, вызывают свечение (эффект Вавилова-Черенкова), которое регистрируется датчиками.

Рис.6. Фото нейтринного телескопа GALLEX (из ресурсов интернет-форума Астрофорум).
Также в США и России предлагалось, наряду с другими соединениями, использование трихлорида галлия в качестве теплоносителя в первом контуре ядерных реакторов малой мощности. Однако для этой цели его не стали использовать, что связано с рядом нерешённых технологических проблем: в частности, недостаточно хорошо очищенный GaCl3 может образовать малолетучий тугоплавкий дихлорид, который забивает технологические каналы; кроме того, галлий довольно активно захватывает нейтроны (сечение захвата 2,71 барна).
Хлорид галлия с радиоактивным изотопом 72Ga (период полураспада - 14,2 часа) используется в современной медицине для лучевой диагностики рака костей.
§4.Обзор прочих галогенидов галлия.
GaF3 — Фторид галлия - белое негигроскопичное вещество, образующее игольчатые кристаллы. Существуют две кристаллические модификации – устойчивая гексагональная и метастабильная тетрагональная. Он малорастворим в воде и в разбавленных минеральных кислотах, но легко растворяется в щелочах. При нагревании на воздухе разлагается. В инертной атмосфере возгоняется начиная с температуры 800 °C.
Существуют два основных метода получения фторида галлия - нагревание оксида галлия в атмосфере фтора, либо разложение гексафторгаллата аммония в инертной атмосфере. Из растворов получаемых действием плавиковой кислоты на галлий,его оксид или гидроксид, фторид галлия выделяется в виде гидрата GaF3·3H2O.
Фторид галлия интересен тем, что может образовывать комплексные соли с фторидами различных металлов.
GaBr3 — бесцветные гигроскопичные кристаллы. Тпл = 122 °C, Ткип = 279 °C плотность — 3,69 г/см. Основные его свойства очень похожи на свойства GaCl3. Растворяется в воде. В водных растворах гидролизуется, дымит на воздухе. Малорастворим в NH3, при этом образуются комплексы с аммиаком. Получают прямым синтезом из элементов.
GaI3 — гигроскопичные светло-жёлтые либо белые иглы (по-видимому, окраска зависит от степени чистоты вещества). Тпл = 212 °C, Ткип = 346 °C, плотность — 4,15 г/см. Гидролизуется тёплой водой. Получают прямым синтезом из элементов.
§5.Синтез трихлорида галлия.
На базе лаборатории высокотемпературной химии кафедры общей и неорганической химии мною под руководством И.Казакова был провёден синтез трихлорида галлия.
Методика синтеза была взята из книги Брауэра – получение прямым взаимодействием галлия с хлором.
I. Подготовка.
Для синтеза соединения была спаяна стеклянная система (Рис.7).
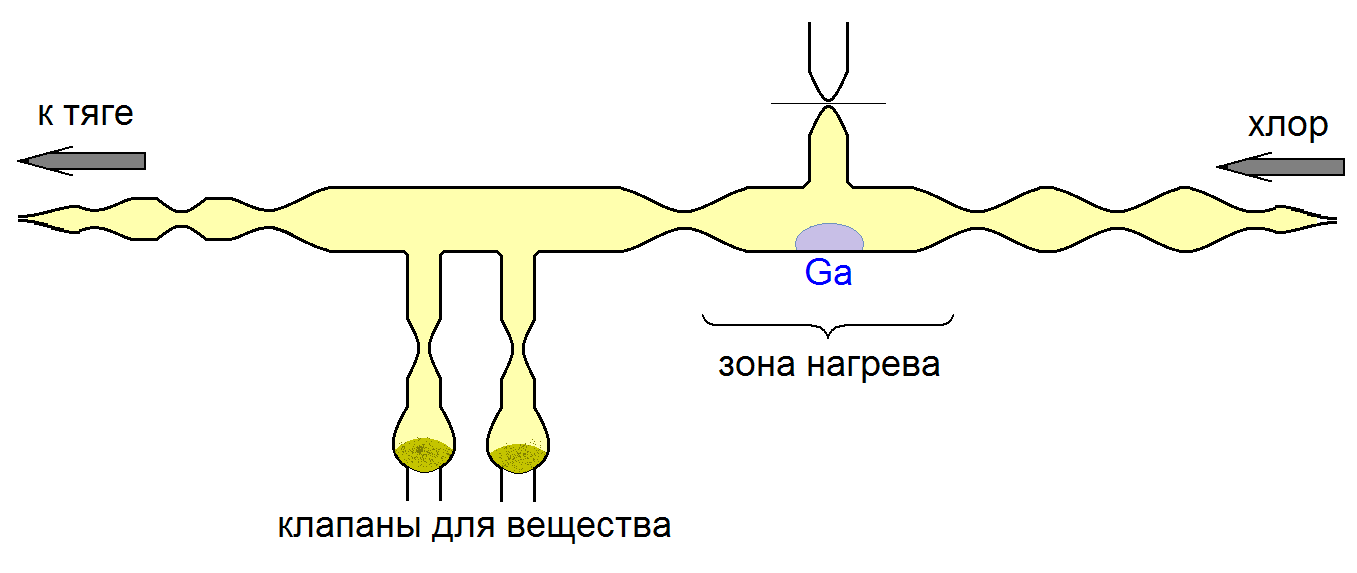
Рис.7. Система для синтеза вещества (в разрезе).
Спайка системы производилась из трубок (молибденовое стекло) на кислородно-ацетиленовых горелках.
В систему предварительно была помещена навеска 1,506 г галлия чистоты 99,999%. Хлор для реакции получался в колбе Вюрца с капельной воронкой взаимодействием соляной кислоты с перманганатом калия:
2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2+ 8H2O
Система была укреплена в штативе, к одному её концу был присоединён шланг от аппарата для получения хлора, к другому – шланг к склянке с серной кислотой. Перед синтезом вся система предварительно хорошо прогревается.
II. Синтез.
Согласно выбранной методике, помещённый в нашу систему галлий сжигается в токе хлора.
После подготовки системы к синтезу кран капельной воронки был открыт, в систему начал поступать хлор. После того, как хлор вытеснил из системы воздух, началось прогревание трубки с металлом. При этом металл плавится и начинает реагировать с галогеном. На поверхности металла появляется налёт хлорида, который затем постепенно возгонятется и оседает в конце трубки в виде жёлтой жидкости. В конце опыта галлий загорелся в хлоре белым пламенем с фиолетовым подсвечением. Когда с хлором прореагировал весь металл, нагревание прекратили. На месте нахождения металла остался белый налёт нелетучих низших хлоридов. Образовавшийся хлорид галлия кристаллизовался в виде жёлтых игольчатых кристаллов, и затем был перегнан в два клапана, которые были отпаяны от системы. Желтый цвет, вероятно, объясняется избытком хлора, часть которого поглотилась хлоридом.
III. Очистка.
Полученное в ходе синтеза вещество очищалось перегонкой. Для этого была спаяна система (Рис.8):
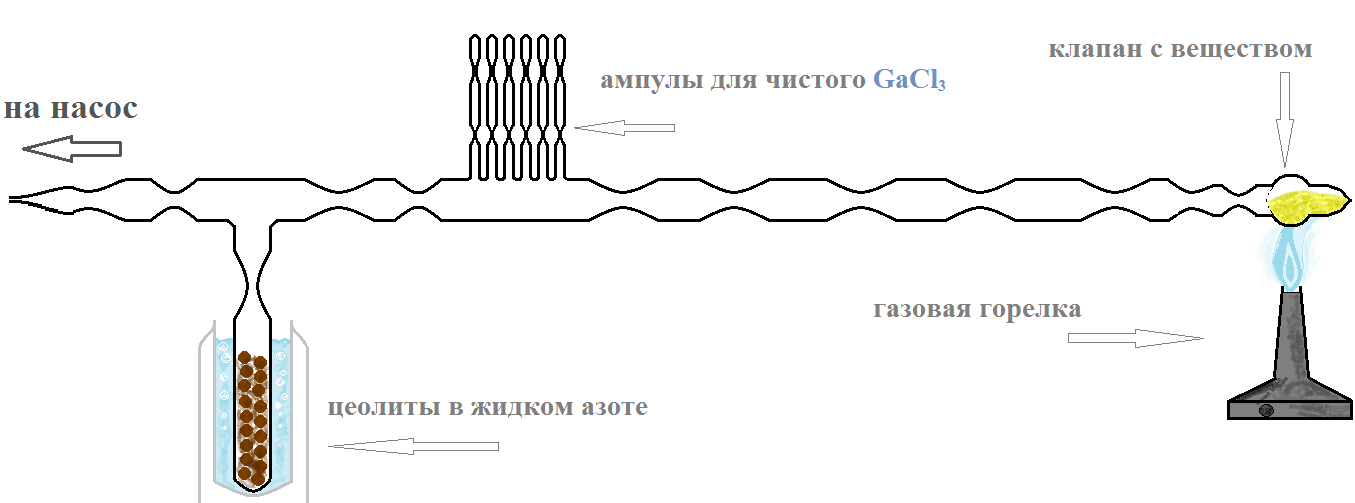
Рис.8. Система для очистки полученного вещества.
К системе припаян один из клапанов с веществом и ампула с цеолитами. Система была откачана на ваккуумном насосе 15 минут и хорошо прогрета для удаления следов влаги, отпаяна от насоса, затем мембрана клапана была разбита специальным бойком. Разрядником Тесла систему проверили на отсутствие трещин и микроотверстий. Цеолиты погрузили в сосуд с жидким азотом. После чего опять-таки последовало прогревание системы. Это нужно для удаления влаги, с которой может прореагировать препарат. Наконец, нагреванием клапана хлорид был последовательно перегнан в первую, вторую, а затем третью секцию (использованные секции затем отпаивались). Он оседал крупными прозрачными кристаллами на стенках системы. Потом отпаяли цеолиты и последовала перегонка очищенного трихлорида в ампулы.
Заключение.
Итак, в качестве заключения – некоторые итоги проделанной работы.
Литературная часть курсовой работы собрала в себе наиболее интересные, на мой взгляд, факты из богатой и необычной химии галлия и его трихлорида. Как можно убедиться, в этой области много привлекательных аспектов не только с теоретической, но и с практической точки зрения.
Работая в лаборатории высокотемпературной химии, я научился работать со стеклом, изготавливать специальные ваккуумные системы для синтеза легкогидролизующихся химических веществ, получил некоторое количество трихлорида галлия. Я надеюсь продолжить работу в этой лаборатории - следующим этапом будет синтез металлорганических комплексов трихлорида галлия с различными органическими донорами.
Использованная литература.
1. Фёдоров П.И., Алексеев Ф.П., Мохосоев М.В. «Химия галлия, индия и таллия.» Монография. Новосибирск, Изд. «Наука», 1977. 224 с.
2.Под редакцией Большакова К.А. «Химия и технология редких и рассеяных элементов» Изд.2,Том 1, 1976. с.223-40
3. Bruno Brunetti, Vincenzo Piacente and Paolo Scardala. «Vapor Pressures of Gallium Trifluoride, Trichloride, and Triiodide and Their Standard Sublimation Enthalpies»
Istituto per lo Studio dei Materiali Nanostrutturati, Sezione Roma 1, CNR Dipartimento di Chimica, Universita` di Roma “La Sapienza”, Piazzale Aldo Moro 5, 00185 Rome, Italy.
4. E.I. Davydova, T.N. Sevastianova, A.V. Suvorov, A.Y. Timoshkin.
«Coordination Chemistry Reviews. Molecular complexes formed by halides of group 4,5,13–15 elements and the thermodynamic characteristics of their vaporization and dissociation found by the static tensimetric method.»
5. Шека И. А, Чаус И. С, Митюрева Т. Т., «Галлий», К., 1963
6. А.М.Дымов, А.П.Савостин., Серия «Аналитическая химия элементов». «Аналитическая химия галлия» Изд. «Наука», 1958. 122 с.
7.Интернет-ресурсы: Википедия: свободная энциклопедия (http://www.wikipedia.org/, портал «Химия»);Сайт о химии - «ХuMuK.ru»; Форум любителей астрономии «Астрофорум» (http://www.astronomy.ru/forum/index.php).
Галлий и его хлориды. Синтез трихлорида галлия