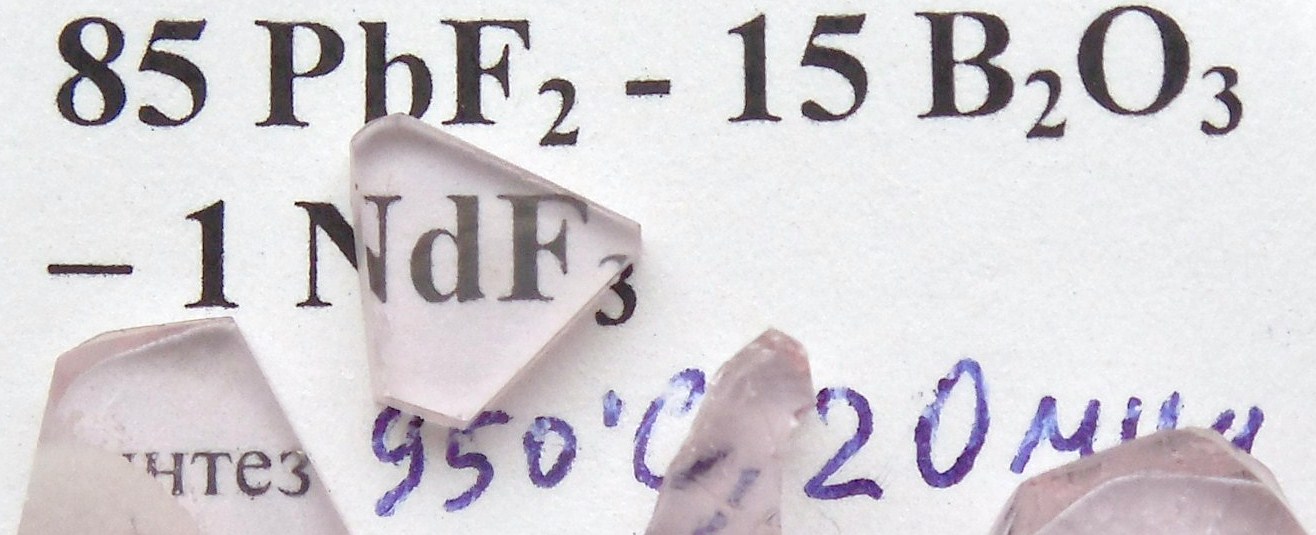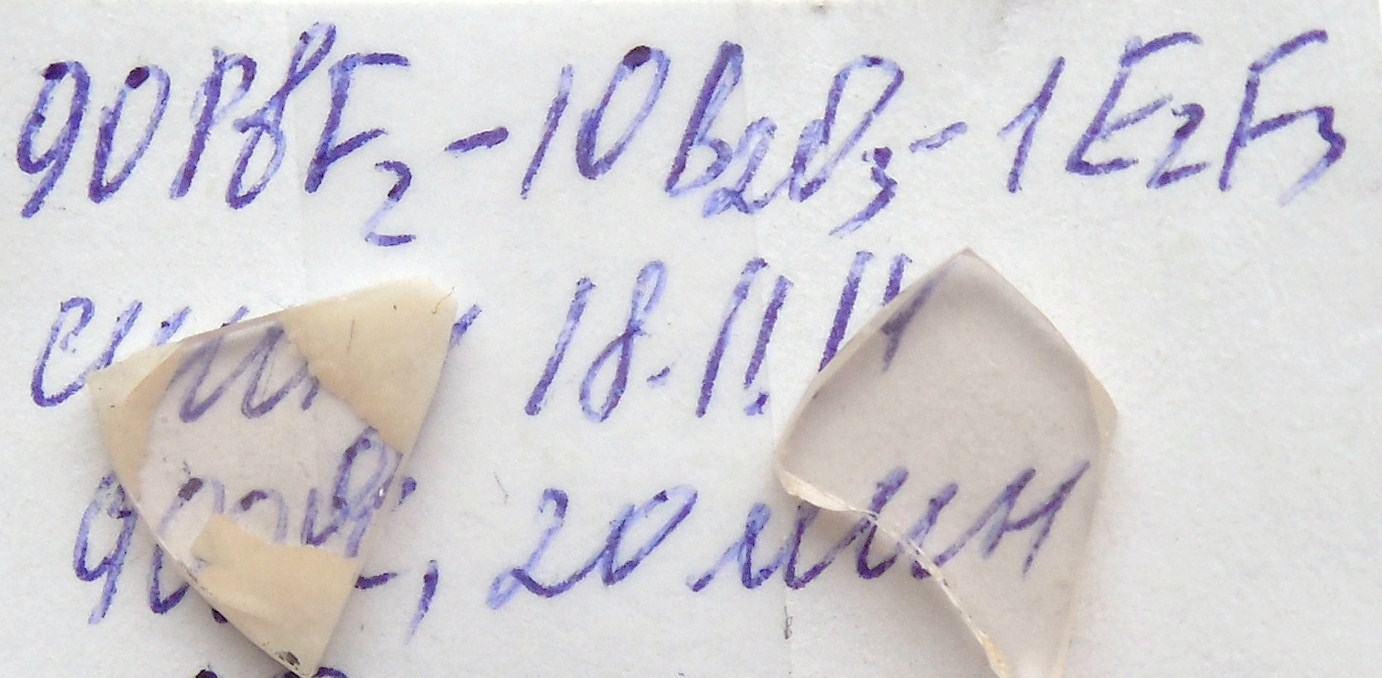Получение активированных различными РЗЭ стекол в системе PbF2-B2O3
Российский химико-технологический университет им. Д.И. Менделеева
__________________________________________________________
Кафедра химии и технологии кристаллов
Отчет
по учебной научно-исследовательской работе студента
«Получение активированных различными РЗЭ
стекол в системе PbF2-B2O3 »
Проверила: доц. к.х.н. Петрова О.Б.
Выполнила: Жукова Е.В.
Группа: Н-45
Москва 2014
Содержание:
- Введение…………………………………………………………………2
- Обзор литературы………………………………………………...……..4
- Боратные стекла ..........................................................................4
- Оксифторидные стекла с фторидом свинцом …………..……7
- Стеклование в системе PbF2-B2O3……………………………10
- Спектрально-люминесцентные свойства РЗЭ в стеклах ...…11
2.4.1. Свойства Pr3+ ………………………………….………..11
2.4.2. Свойства Nd3+ ……………………….…………………..15
2.4.3. Свойства Ho3+……………………………………………17
2.4.4. Свойства Eu3+ …………………………………….……..19
2.4.5. Свойства Er3+ ………………………………….………..22
2.4.6. Свойства Yb3+ …………………………………….……..24
2.5. Выводы их обзора литературы………………………….……….27
- Экспериментальная часть
- Получение фтороборатных стекол……………………………28
- Отжиг стекол…………………………………………….……..31
- Обработка стекол ……………………………………...………32
- Спектры поглощения стекол ……………………………….…33
- Люминесценция стекол …………………………….…………35
- Показатель преломления стекол ………………………...……36
4. Результаты работы ………………………………………………...……37
Использованная литература ………………………………………………38
-
ВВЕДЕНИЕ
(актуальность темы 2 стр)
В настоящее время прозрачные стеклокристаллические материалы легированные РЗЭ представляют большой интерес для современной элементной базы фотоники. Высокие электрические и спектральные характеристики, широкая область изменения теплофизических параметров, сравнительная легкоплавкость выдвинули стекла и СКМ на основе боратных оксифторидных систем активированных РЗЭ в число наиболее перспективных для создания полифункциональных и конструкционных материалов [1].
Прозрачную стеклокерамику можно рассматривать как композиционный материал, сочетающий в себе преимущества обоих компонентов, стекла и кристаллов. Стеклокерамика содержит внутри кристаллические частицы разных размеров. Если размер этих микрокристаллов меньше, чем длина волны видимого света, то данный материал называют прозрачной стеклокерамикой [2].
Стоит отметить, что прозрачная стеклокерамика, кроме новых отличительных признаков, имеет преимущества стекол и монокристаллов и отсутствие недостатков, характерных для этих материалов. Аналогично стеклам, стеклокерамика может быть легко обработана и использована для изготовления волокон; они имеют большую емкость, к активирующим легирующим примесям, изотропны и имеют равномерно распределенные активаторы. Аналогично монокристаллам, стеклокерамика содержит редкоземельные примеси в строго упорядоченном лигандном окружении. В результате, их спектры люминесценции имеют более высокую интенсивность и меньшую полуширину по сравнению с аналогичными легирующие добавками в стеклах, то есть, их спектральные и люминесцентные свойства аналогичны свойствам монокристаллов. Сравнительно небольшой размер кристаллических частиц, погруженных в стеклянную матрицу может существенно повлиять на фононные спектры компонента, изменения в которых влияют на люминесцентные свойства всего композиционного материал, в том числе и на время жизни возбужденного состояния, что отличает их от полностью кристаллических образцов.
Прозрачную оксифторидную стеклокерамику можно рассматривать как новый класс материалов, который сочетает в себе все лучшие свойства фторидных нанокристаллов, ответственных за контроль спектральных свойств редкоземельных легирующих примесей и отличные макроскопические особенности оксидных стекол (например, химическую стойкостью, механическую прочность и оптическое качество).
Оксифторидная прозрачная керамика привлекает внимание исследователей, поскольку содержит в виде кристаллических компонентов фторидные нанокристаллы , обладающие узкими фононными спектрами, высоким квантовым выходом люминесценции и длительным временем жизни для метастабильных состояний. Прозрачная оксифторидная стелокерамика имеет нанокомпозитный харктер и в ее стеклянной матрице естественным образом предотвращается агломерация наночастиц (последнее является ключевой проблемой современной нанотехнологии).
Таким образом, разработка и исследование новых лазерных СКМ в системе PbF2 - B2O3, активированных различными РЗЭ, представляет перспективное направление в области изучения материалов, в которых используется стекло. Цели данного раздела науки весьма разнообразны. Они могут заключаться как в создании новых материалов для оптических приборов (традиционный комплекс задач), так и в решении других, пока нетрадиционных задач в области фотоники (некоторые проблемы волоконно-оптических коммуникаций, проблемы микрооптики и др.
2. ОБЗОР ЛИТЕРАТУРЫ
2.1. Боратные стекла
Оксид бора В2О3 (М=69.64) принадлежит к группе стеклообразователей и имеет самое широкое применение в оптическом стекловарении и в других технологических приложениях.
Получение
Сам оксид чрезвычайно гигроскопичен и очень трудно кристаллизуем. Получается в виде стеклующейся жидкости обезвоживанием борной кислоты H3BO3 в вакууме выше 500 °С. Кристаллизация в виде безводных кристаллов В2О3 происходит только при повышенном давлении; Тпл. =723 К (450°С), Ткип. = 2250 °С. Плотность стекла (d20 = 1.781.83) с ростом содержания воды резко снижается. Тпл ~ 270 °C (540 K); с ростом содержания воды Тg также резко уменьшается. Вода удаляется из расплава барботированием осушенного азота или инертного газа. Через 3 часа при 1200 °С в расплаве остается ~ 0.25 мас.% Н2О, через 19 часов – 0.13 %. Полностью удалить воду из расплава не удается.
Технология, режимы варки и выработки боратных стекол
Для составления шихт применяют химически чистые материалы, в качестве источника бора используют борный ангидрид В2O3 или борную кислоту. Большинство шихт следует предварительно плавить при температурах 500-650оС (максимум), т.е. до полного удаления паров Н2О из шихт. Подъем температуры при этом производится медленно во избежание вспучивания шихты. Затем фриттированную шихту следует измельчить и загрузить в тигли для плавки. Плавка шихт производится при возможно быстром подъеме температуры. Длительный процесс плавки шихты, а также выдержка расплава в печи приводят к интенсивному улетучиванию компонентов стекломассы, особенно В2О3.
Чтобы снять термические напряжения проводится отжиг стекол. Верхняя температура отжига стекол, установленная на основании температур размягчения, находится в пределах 200- 600оС [19].
Строение
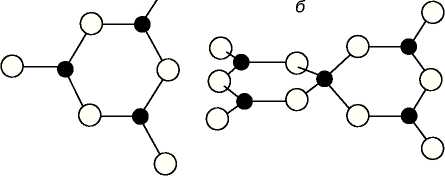
Боратные стекла состоят из планарных треугольников (BO3)3- или тетраэдров (ВО4), соединенных через атомы кислорода в трехмерную сеть [20,21]. Результаты исследования стекол структурно-чувствительными методами (ЯМР — ядерный магнитный резонанс, ЭПР — электронный парамагнитный резонанс, инфракрасная спектроскопии и спектроскопия комбинационного рассеяния света и др.) хорошо интерпретируются в предположении существования в стеклах структурных группировок, аналогичных, но несколько искаженных по отношению к имеющимся в соответствующих кристаллах [20, 22-27]. Например, предполагается, что стеклообразный борный ангидрид в основном построен из бороксольных колец, образованных тремя борокислородными треугольниками BO3 .
а) 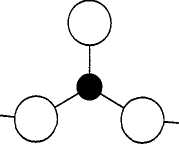 б)
б) 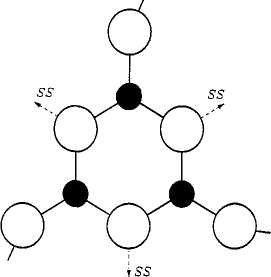
- атом кислорода - атом бора
Рис. 1.2. Структурные элементы боратных стекол. а) треугольник ВО3,
б) бороксольное кольцо В2О3 [24].
В структурах боратных кристаллов и стекол с содержанием B2O3 более 50 мол.% одновременно встречаются два типа жестких координационных полиэдров: треугольные ВО3 и тетраэдрические ВО4 комплексы. Другая отличительная особенность боратов состоит в том, что такие треугольники и тетраэдры объединяются в более крупные группировки, которые также могут рассматриваться как жесткие фрагменты структуры, поскольку они встречаются практически в неизменном виде в различных кристаллических структурах боратов и слабо изменяются в функции от температуры и давления. Распространены несколько типов таких борокислородных группировок, причем количество координационных полиэдров в каждой из них редко превышает пять. Безводные бораты характеризуются каркасным, в редких случаях слоистым строением, среди водных боратов часто встречаются цепочечные и ленточные структуры [28,29].
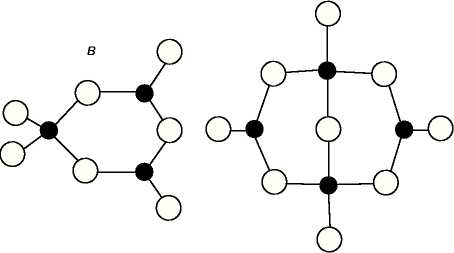
Кроме основных группировок в стеклах: боратных треугольников [ВО3] и тетраэдров [ВО4], могут формироваться другие «сверхструктурные единицы»: бороксольные и метаборатные кольца, метаборатные цепи, пентаборатные, триборатные, диборатные и пироборатные группы [30].
а) б) в)
Рис. 1.3. Структуры некоторых боратных группировок, образующихся в боратных стеклах [23].
а) – пентоборатная; б) – триборатная;в) – диборатная группировки.
Свойства
Свойства боратных стекол зависят от катиона модификатора и сильно отличаются от свойств чистого стеклообразного оксида бора.
- Плотность.
Значение плотностей отдельных оксидов при одинаковом процентно-молекулярном их содержании пропорциональны их молекулярным массам. Введение в состав боратных стекол определенного количества щелочей упрочняет их структуру и увеличивает плотность. Оксиды МеО повышают плотность стекла соответственно росту их молекулярных масс [28].
- Вязкость.
В [28, 29] отмечается высокая вязкость боратных стекол и расплавов. Одной из важнейших характеристик стекла является температурная зависимость вязкости (Т). Переход от расплава в стеклообразное состояние и обратно происходит постепенно, когда вязкость непрерывно меняется от 108 до 1012 Пас без образования в системе новой фазы. Отличие вязкостного поведения борного ангидрида от кварцевого стекла показано в [31]. Для борного ангидрида и боратных стекол характерны нелинейная температурная зависимость вязкости в координатах lg() - 1/T и существенное увеличение энергии активации при значениях температуры, отвечающих величине вязкости ~103 Пас, что говорит о существенных структурных изменениях, происходящих в расплаве стекла.
- Коэффициент термического расширения.
Коэффициент линейного термического расширения (КТР) тела – это относительное изменение его длины при изменении температуры на один градус; объемного - аналогичное увеличение объема материала. На рост термического расширения стекла преобладающее влияние оказывают ионный радиус и координационное число. Чем больше межатомное расстояние оксида, тем больше значение . Абсолютное значение коэффициента линейного термического расширения боратных стекол находится в пределах от 50 до 110·10-7 [32,33].
- Характеристические температуры стекол и критерий устойчивости
От температуры стеклования очень сильно зависят термодинамические и упругие свойства стекол [22].
Стекла характеризуются температурой стеклования Tg и температурой кристаллизации Тх. В качестве критерия устойчивости стекол в литературе часто используют параметр[34]:
Т= Тх- Tg (1.1),
реже - S1=(Tx-Tg)/Tg (1.2),
S=(Tx-Tg)·(Tp-Tx)/Tg (1.3),
где Tg – температура стеклования,
Тх – температура начала кристаллизации,
Тс – температура пика кристаллизации.
- Показатель преломления
Для B2O3 nD составляет 1.461.47 и зависит от содержания воды. Введение оксидов щелочных металлов увеличивает показатель преломления. Увеличение показателя при введении в B2O3 щелочных оксидов используется для поддержания показателя на необходимом уровне в составах трёхкомпонентных боросиликатных кронов, имеющих высокую химическую устойчивость и приемлемые для эксплуатации механические свойства. Сравнительное влияние оксидов МеО на увеличение показателя преломления идет в следующем порядке: ВеО, MgO, CaO, ZnO, CdO, BaO и PbO.
- Механические свойства
В однокомпонентном стекле B2O3 реализуется графитоподобная структура: сильные химические связи внутри плоскостей и слабые связи между плоскостями или слоями.
Однако, если вводить в B2O3 оксиды щелочных или щелочно-земельных металлов, то благодаря тому, что ион кислорода, вносимый оксидом, может играть роль донора, бор, имеющий свободную p-орбиталь, образует дополнительную донорно-акцепторную связь с кислородом. При этом в стекле MexOy–B2O3 вследствие sp3-гибридизации образуются пространственные (трехмерные) BO4-тетраэдры. Каждая молекула оксида может перевести в четырехкоординированное состояние только одну молекулу бора. В результате получается смешанная структура, в которой плоские BO3 - треугольники чередуются с трехмерными BO4 - тетраэдрами. Таким образом обеспечивается частичная химическая сшивка плоскостей, что повышает общую связность структуры. Чем выше содержание оксида в стекле, тем выше его степень связности.
- Электрические свойства
Электрическая проводимость стеклообразных композиций превосходит электропроводность твердых кристаллических тел того же состава. Благодаря химической устойчивости, простоте изготовления деталей различной сложности, значительной ионной проводимости стеклообразные твердые электролиты все больше привлекают к себе внимания ученых разных стран и все чаще находят широкое практическое применение в различных электрохимических устройствах.
- Химическая стойкость.
Химическая устойчивость характеризует сопротивляемость стекол воздействию водных растворов, влажной атмосферы и других агрессивных сред. Она зависит от химического состава стекла, природы воздействующей среды, температуры, давления и ряда других факторов.
Химическая устойчивость очень сильно зависит от структуры стекол. Химическая устойчивость боратных стекол связана с отношением в стекле ВО4:ВО3 и со степенью связанности В2О3 в бораты [28]
Наиболее устойчивы боратные стекла, которые содержат в своем составе оксиды металлов в количестве, необходимом для связывания всего В2О3 в метабораты. Наиболее эффективно повышают устойчивость боратных стекол La2O3, ZrO2, TiO2, Nb2O3, Y2O5 [35].
2.2. Оксифторидные стекла с фторидом свинца
Оксифторидная прозрачная керамика привлекает внимание исследователей, поскольку содержит в виде кристаллических компонентов фторидные нанокристаллы , обладающие узкими фононными спектрами, высоким квантовым выходом люминесценции и длительным временем жизни для метастабильных состояний. Прозрачная оксифторидная керамика имеет нанокомпозитный характер и в ее стеклянной матрице естественным образом предотвращается агломерация наночастиц (последнее является ключевой проблемой современной нанотехнологии). [36]
Получение
Методы синтеза прозрачной оксифторидной стеклокерамики могут быть классифицированы с использованием следующих двух функций (критериев): (1) методы изготовления для получения исходного стекла или аморфного матрицы, и (2) расстекловывание (отжиг и / или лазерное облучение).
Общая черта этих групп их конечная ступенчатая термическая обработка необходимая, чтобы выполнить частичную кристаллизацию начальной матрицы.
Одним из самых известных методов этой группы является частичная девитрификация - контролируемая кристаллизация исходных стекол. Она включает два последовательных этапа, первый из которых – изготовление стекла. Он начинается с плавления смеси порошков оксида и фторида и последующего быстрого охлаждения расплава. Второй этап включает термообработку стекла при определенной температуре. Кинетика зарождения и роста кристаллов в стеклянной матрице определяет ее размер и концентрацию и, в свою очередь, определяется температурой и длительностью термической обработки образца, а также химическим составом стекломатериала. Температура обработки образца выбирается на основе данных термического анализа температуры для формирования стекла (стеклование) (Tg) и температуры кристаллизации (Тс). Таким образом, второй шаг всегда выполняется при температурах, близких к Tс.
Обычно термическую обработку проводят на воздухе при атмосферном давлении. Это приводит к значительной (до десятков процентов) потери фтора [37].
В действительности, существует два основных механизма потери фтора в процессе подготовки оксифторидной стеклокерамики. Первый - пирогидролиз [38,39], то есть, реакция фторидов с водяным паром:
MF2 + H2O = MO + 2HF (1)
RF3 + H2O = ROF + 2HF (2)
Возможно, присутствие оксифторида свинца в стеклянной матрице [40] было результатом аналогичной реакции типа:
2PbF2 + H2O = Pb2OF2 + 2HF (3)
Стабильность различных соединений по отношению к пирогидролизу увеличивается в следующем ряду [41], [42], [43] :
(наименее устойчивы) UF4 - ThF4 - ZnF2 - CdF2 - PbF2 - AlF3 - CeF3 - MgF2 - BeF2 - CaF2 - SrF2 - BaF2 - NaF (наиболее устойчивы)
И
(наименее устойчивые) Sc; Lu - Ce - Yb - Ho - Tb - Tm - Gd – Er – Dy - Sm - Nd; Y - Eu - Pr - La (наименее устойчивые) для RF3
Кроме того, важно помнить, что фториды металлов, как правило, не реагируют с сухим кислородом. Использование графитового тигля (вместо обычных алундовых-Al2O3-Те) приводит к созданию безводной восстановительной атмосферы и, следовательно, предотвращает пирогидролиз образцов.
Тем не менее, второй механизм является главной причиной потерь фтора, и это связано с обменными реакциями, приводящими к образованию и испарению летучего бора [44]:
3MF2 + B2O3 = 3MO + 2BF3 (4)
В обоих механизмах фтор улетучивается в дифузионных процессах.
Строение оксифторидных стекол(вообще то ли здесь написано???)
Соседние наночастицы в оксифторидных стеклах когерентно ориентированных с кристаллографической точки зрения. Это было неоднократно отмечено при изучении различных кристаллических фаз, таких как шестиугольная LaF3 [45,46] и кубические NaYF4 [47] и PbF2 [48] (рис. 1) и др. Образовавшиеся наночастицы в конце концов сливаются друг с другом и образуют агрегаты из монокристаллов очень сложной формы. Холм-капля распределение??? образующихся наночастиц указывает на начало латентной ликвации стеклофазы , а именно, пространственной модуляции состава стекла и спинодального фазового распада стекла.
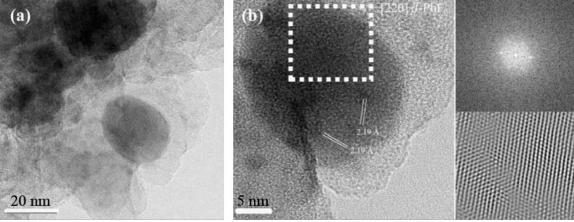
Рис. 1. (а)РЭМ изображение светлого поля 90 (SiO2) 10 (PbF2) NGC совместно с примесью 0,1 Er3 + и 0,3 Yb3 + (мол.%), который обрабатывали при 400°C, показывает наличие наночастиц PbF2 (темные пятна). (б) СЭМ микрофотография аналогичного состава образца, где наблюдаются PbF2 нанокристаллы. Правая верхняя боковая вставка соответствует спектру мощности, полученному из увеличенной области белого цвета. Правая нижняя вставка соответствует увеличенной детализации области кристаллическую структуры наночастиц PbF2 . Воспроизводится с разрешения из работы. [48]. Авторское Право Эльзевир 2009.
Для того чтобы понять формирование редкоземельных активированных нанофторидных кристаллов в стеклянных матрицах оксифторидной стеклокерамики, необходимо рассмотреть физико-химические процессы, происходящие в этих системах.
MF2-RF3 (М = Са, Sr, Ba, Pb, R = редкоземельный элемент) системы склонны к гетеровалентному изоморфизму и формированию M1xRxF2 + X твердых растворов [49-52]. Область гомогенности для этих твердых растворов может достигать 50 моль.% в равновесии при высоких температурах [278].
Формирование вышеупомянутых твердых растворов сопровождается заменой катионов в отдельных позициях кристаллической решетки флюорита (пространственная группа симметрии Fm3m) [53-59]. Катионная подрешетка остается полно-стью заполнена, и возможно лишь незначительное местное смещение некоторых катионов. Тем не менее, для того, чтобы компенсировать чрезмерный положительный заряд трехвалентных катионов лантаноидов, вводят дополнительные интерстициальные анионы. Взаимодействие интерстициальных фторид-анионов с катионами редкоземельных металлов приводит к образованию кластерных дефектов. Такие R6F37 кластеры могут быть легко встроены в кристаллическую решетку типа флюорит (рис. 2), и изоморфное замещение в образующихся твердых частицах может быть представлено следующим образом:
M6F3220- = R6F3719- + Fint- (9)
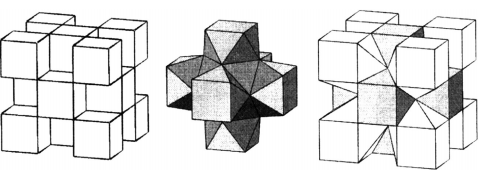
Рис.2. R6F37 кластер, построенный в флюоритной матрице.
Разница между формальными зарядами гексамерного кластера R6F37 и замененными блоками внутренней флюоритной матрицы требует введения дополнительного интерстициальной фторид-иона.
Соотношение параметров кристаллической решетки и химического состава M1xRxF2 + X твердых растворов определяется вышеупомянутым гетеровалентным катионным изоморфизмом. Этот процесс зависит от двух различных эффектов: замены относительно большими М2 + катионами небольших катионов R3 +, а также включение дополнительных фторид-ионов в полости кристаллической решетки. Эти эффекты имеют противоположное влияние на кристаллические параметры решетки, могут варьироваться 5.46-6.2 для вышеупомянутых редкоземельных щелочно-земельных систем фторидов металлов.
В соответствии с существующими MF2-RF3 фазовыми диаграммами [233,278,288,289], снижение температуры в условиях равновесия приводит к разложению M1xRxF2 + X твердых растворов и образованию ряда упорядоченных флюоритовых одноименных фаз в некоторых системах (преимущественно редкоземельных элементов иттриевой подгруппы): таких, как M2RF7, M9R5F33, M8R5F31, M4R3F17 и т.д. Формирование этих соединений обусловлено упорядочением R6F37 кластеров, которые статистически распределенны в кристаллической решетке при высоких температурах. Типичный пример фазовой диаграммы PbF2-YF3 (по данным разных авторов) [298-301], представлен на рис. 23.
Рис.3. Комбинированная фазовая диаграмма системы PbF2-YF3 [298] полученная по данным ДТА, полученная в герметически закрытых платиновых тиглях (1) и открытых в графитовых тиглях (1, 6) (поправка на испарение PbF2 была учтена) и в соответствии с функциональными данных рентгеновской дифракции (2-5, 7-8) (однофазные образцы (2, 4, 7) и двухфазные образцы после отжига в золотом (3), платиновом (5) и медном (8) тиглях, соответственно).
Свойства оксифторидных стекол
Оксифторидная стеклокерамика отличается от других видов СКМ не только их неоднородностью, но и рядом других специфических особенностей:
- Фторидная добавка способствует снижению плотности щелочно-силикатных стекол. Тенденции к уменьшению плотности при введении фтора в щелочно-силикатные стекла наблюдаются и для бесщелочных систем, в том числе при введении хлоридных добавок.
- Действие фтора как ускорителя варки силикатных стекол имеет свои особенности. Фтор считается плавнем по отношению к силикатным расплавам, при введении его в шихту значительно снижается высокотемпературная вязкость.
- С введением фторидов температуры кристаллизации стекол уменьшаются, также уменьшается и устойчивость стекол к кристаллизации.
- Известно, что добавление в силикатное стекло фтора вызывает заметное изменение его оптических характеристик, в частности уменьшение показателя преломления.
- Кристаллы встроенные в стеклянную матрицу – это, главным образом, кристаллы фторидов, в то время как сама стеклянная матрица имеет преимущественно оксидную природу.
- Спектроскопические свойства такой оксифторидной стеклокерамики похожи на свойства фторидных монокристаллов. Нанокристаллы фторидов, содержащиеся в оксифторидной стеклокерамике, характеризуются низкоэнергетическим фононным спектром, высоким квантовым выходом люминесценции, и длительным временем жизни в метастабильном состоянии. [11,12].
- Данный класс материалов способен стабилизировать метастабильные кристаллические фазы, которые не могут быть получены и/или сохранены при комнатной температуре.
- В этом материале стеклофаза препятствует агломерации наночастиц.
- Стеклокерамика (в том числе оксифторидная керамика) содержит кристаллические включения наночастиц в стеклянной матрице, следовательно, решается одна из очень важных проблем современной нанотехнологии – инактивация высокоразвитой и активной поверхности наночастицами. Это особенно важно в случае фторидных наночастиц, так как их свечение может быть легко погашено путем адсорбции воды на их поверхности.
- Стеклянная фаза оксифторидной стеклокерамики является химически довольно инертной, и это приводит к сниженной токсичности стеклокерамики по сравнению с кристаллическими фторидами.
- Стеклокерамика часто легируется одним или более редкоземельными ионами в целях получения оптических материалов со свойствами, подходящими для различных применений в фотонике, со-активация позволяет в дальнейшем регулировать оптические свойства изготовленных образцов. Редкоземельные легирующие добавки и сo-легирующие примеси могут быть введены в исходную стекольную шихту в виде оксидов, которые являются более стабильными и менее гигроскопичными, чем соответствующие фториды [13-16]. Эти редкоземельные ионы будут находиться в нанокристаллической фазе полученной стеклокерамики. Последняя будет гарантировать, что редкоземельные ионы будут окружены таким же набором лигандов; их координация полиэдров будет такой же, как если бы они были введены в виде фторидов вместо вышеупомянутых оксидов.
- Стеклокерамические изделия стоят сравнительно недорого. Они обладают лучшими механическими и тепловыми свойствами, чем стекла. Они могут быть легко получены путем термической обработки. Стеклокерамика сохраняет преимущества стекла как функционального материала; например, она используется для изготовления оптических волокон [17,18].
Применение
Включение полупроводниковых, ферроэлектрических и нелинейных оптических фаз в стеклянные матрицы может произвести к созданию весьма перспективных материалов для современной промышленности [7-12]. Это особенно важно для прозрачной стеклокерамики применяемой в фотонике, в связи с масштабами ее промышленного производства. Такие материалы, активированные ионами редкоземельных элементов, играют решающую роль в оптических усилителях, ап-конверсионных волокнах, твердотельных лазерах, медицинских датчиках, оптико-электронных чипах, свечении, надписях, 3D-дисплеях и т. д. [13-15].
2.3. Стеклование в системе PbF2-B2O3
Стеклование в системе PbF2-B2O3 является частным случаем стеклования в системе PbF2-PbO-B2O3. Более того, в связи с частичным улетучиванием фтора из расплава стекол, как в виде PbF2, так и BF3 состав стекол из шиты PbF2-B2O3 эволюционирует в сторону PbF2-PbO-B2O3 [7].
Данные по различным исследованиям стекол в системе PbF2-B2O3 приведены в табл. 1.3.
Таблица 1.1. Обобщенные данные по исследованиям в системе B2O3 – PbF2
|
Состав, мол.% |
Условия получения |
Измерения |
Ссылка, год публикации |
|
|
PbF2 |
B2O3 |
|||
|
40-75 |
60-25 |
не указаны |
Tg |
[8], 1989 |
|
25-80 |
75-20 |
Плавка в кварцевом тигле при 100 К выше Tm. Охлаждение между двумя нержавеющими стальными пластинами. |
Плотность, Tg, удельное электрическое сопротивление (частота 10 Гц-100 Гц, золотые напыленные электроды) |
[9], 1994 |
|
50 |
50 |
не указаны |
Tg |
[10], 1998 |
|
70.3 60.2 50,3 |
29.7 39.7 49.6 |
не указаны |
не указаны |
[11], 2002 |
Из данных таблицы видно, что стекла подучены в диапазоне составов от 25 до 80 мол.% PbF2. В основном исследовали Tg.
На рис. 1.3. представлены обобщенные литературные данные по температуре стеклования в данной системе.
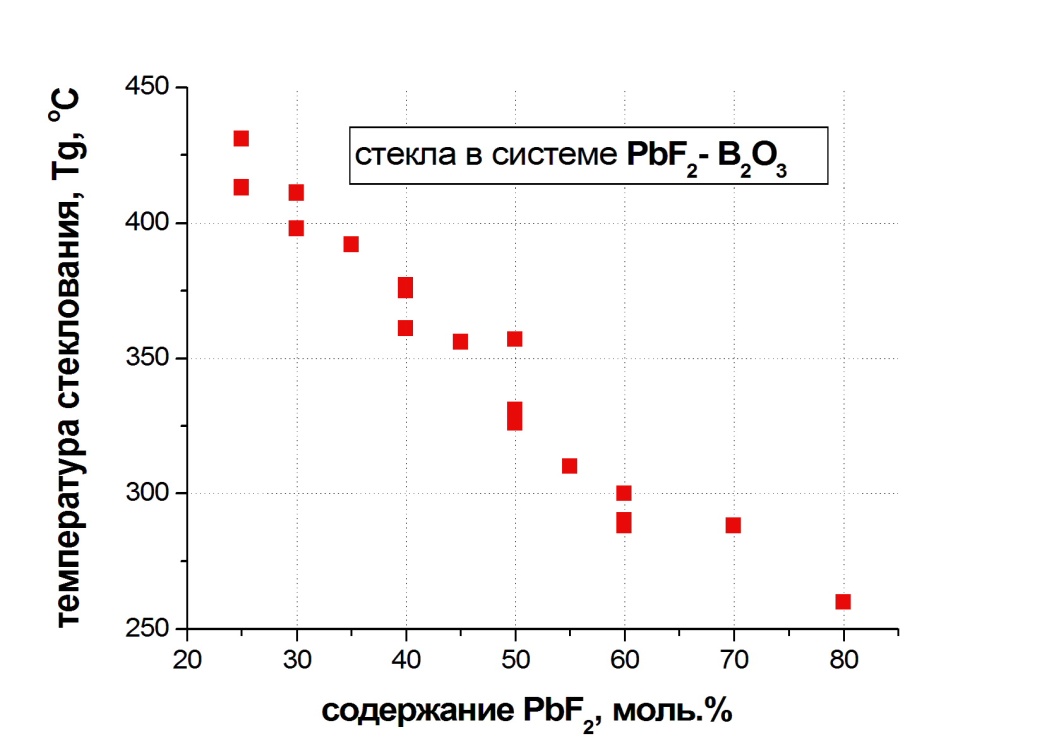
Рис.4 Обобщенные литературные данные по температуре
стеклования в системе PbF2-B2O3.
С ростом содержания PbF2 температура стеклования монотонно уменьшается.
- . Спектрально-люминесцентные свойства РЗЭ в стеклах
2.4.1. Свойства Pr3+
Оптические свойства иона активатора Рг3 + рассмотрим на примере системы 4SrO · 7B2O3: Рг3 +.
Спектры поглощения 4SrO · 7B2O3: Рг3 + представлены на рис. 5:
А - образец 4SrO · 7B2O3
В - образец 4SrO · 7B2O3: Рг3 + (C1Pr3 + = 1,7 · 1020 см-3)
С - образец 4SrO · 7B2O3: Рг3 + (N2Pr3 + = 3,5 · 1020 см-3).
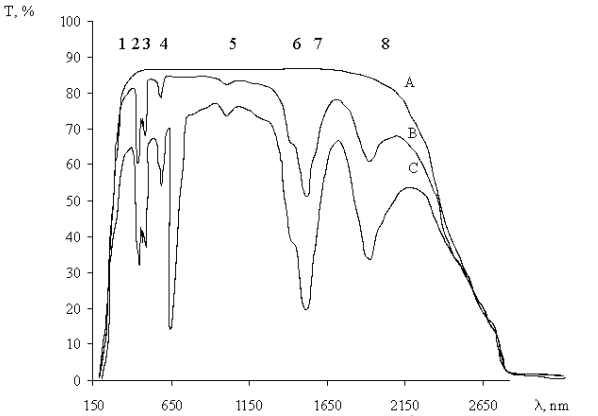
Рис.5. Спектры поглощения 4SrO · 7B2O3: Pr3 + стекол.
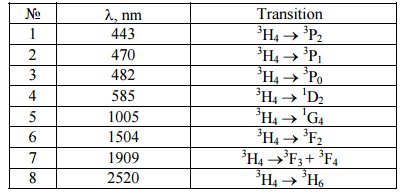
Спектры поглощения 4SrO · 7B2O3: Рг3 + состоят из 8 негомогенных неструктурных широких полос поглощения. Энергетическая диаграмма переходов поглощения представлена на рис. 6. В таблице 1 представлены электронные переходы в соответствии с длиной волны поглощения излучения. Наибольшая интенсивность имеет 3Н4 3 F2 и 3H4 3F3 + 4 линии. Линии поглощения 3H4 3P2, 3P1 3H4 , 3H4 3P0 также очень интенсивны. Полоса поглощения max= 482 нм (3H4 3P0) находится в хорошем согласии со спектральным Ar + - лазерным излучением и может быть использовано для эффективной люминесценцентной накачки.
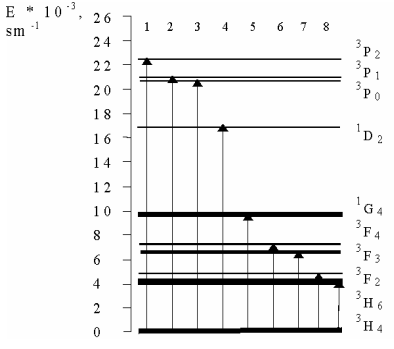
Рис. 6. Энергетическая диаграмма иона Pr3 +.
Таблица 1. Электронные переходы 4SrO · 7B2O3: Рг3 +.
Люминесценция 4SrO · 7B2O3: Рг3 + с Ar + -лазерной накачкой линии поглощения, соответствует переходу 3P0 3H4. На рис.7 представлены спектры люминесценции 4SrO ·7B2O3: Рг3 +. Зарегистрированные спектры люминесценции состоят из трех, не являющихся структурно неоднородными, широких спектральных полос. Наибольшая интенсивность имеет линия max = 606 нм. Контур этой линии имеет комплексный характер из трех крайних точек. Это объясняется перекрытием трех линий люминесценции, соответствующих переходам 1D23H4 ( max= 595 нм), 3P0 3H6 ( max = 606 нм), 3P0 3F2 (max=624нм). Меньшая интенсивность перехода также была зарегистрирована в 3P0 3F3 (=702нм), 1D2 3H6 ( = 824 нм), 1D2 3F2 ( = 877 нм).
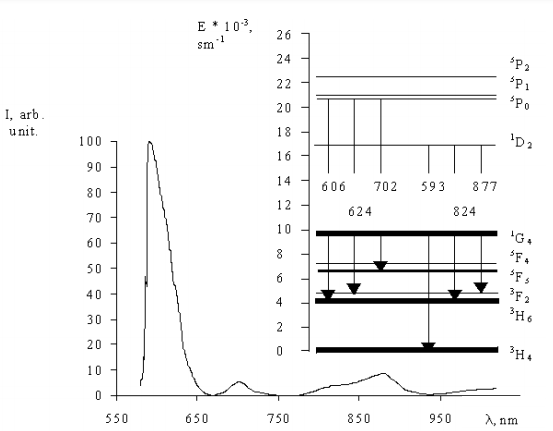
Рис. 7. Спектры люминесценции 4SrO · 7B2O3: Рг3 +.
2.4.2. Свойства Nd3+
Наиболее используемыми активаторами на протяжении 35 лет являются ионы редкоземельного иона неодима (Nd3+). Электронная конфигурация этого иона такова, что его энергетический спектр, то есть совокупность энергий, которыми обладает этот ион, позволяет осуществить наиболее энергетически выгодную четырехуровневую схему работы лазера.
Схема нескольких энергетических уровней иона Nd3+ эскизно представлена на рис. 1.9.
Рис. 1.9. Схема энергетических уровней Nd3+
Энергетические уровни свободного иона неодима вырождены. Это означает, что в случае, когда ион неодима находится в вакууме, энергией, соответствующей данному энергетическому уровню, будут обладать несколько состояний, отличающихся друг от друга ориентацией в пространстве момента количества движения. Когда же ион находится в кристалле, то он оказывается в электрическом неоднородном поле, созданном окружающими его ближними и дальними ионами или ионными группами, образующими кристалл (или стекло). В этом случае энергия иона будет зависеть от того, как ориентировано электронное облако иона неодима относительно выделенных направлений в кристалле. Говорят, что в таком случае вырождение снимается и уровень расщепляется на штарковские подуровни. Число штарковских компонентов определяется симметрией неоднородного кристаллического поля, которая соответствует симметрии окружения данного иона, и теми состояниями, которые имеют место в свободном ионе. Величина же расщепления определяется силой кристаллического поля, то есть напряженностью этого поля в том месте, где находится примесный ион [16].
Для стекол, легированных неодимом, характерны относительно широкие полосы поглощения. На рис. 1.10 показаны полосы поглощения в фторборатном стекле:
Рис. 1.10. Спектр поглощения стекла с Nd3+ при комнатной температуре.
Люминесценция как в стеклах, так и кристаллах и СКМ, в основном, изучается на переходах 4F3/2- 4I11/2 (длина волны для разных стекол 1045 - 1062 нм) и 4F3/2- 4I9/2 (870 - 880 нм). На рис. 1.11 приведен характерный вид кривых люминесценции, соответствующих этим переходам.
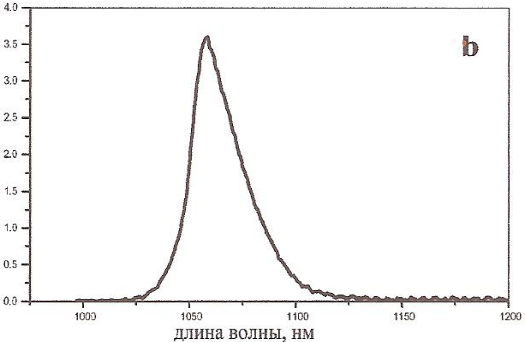
Рис. 1.11. Спектры люминесценции стекла, легированного Nd3+
a) 4F3/2 - 4I 9/2, b) 4F3/2 - 4I11/2.
Спектры люминесценции представляют собой широкие полосы, состоящие из перекрывающихся линий межштарковских переходов между состояниями 4F3/2 4I9/2 (рис. 1.11. a) и 4F3/2 4I11/2 (рис. 1.11. б) ионов Nd3+ с различным локальным окружением. Подобный спектр люминесценции характерен для всех стекол, активированных Nd3+ [17].
2.4.3. Свойства Ho3+
На рис. 1.12 представлены спектры поглощения керамики CaF2:Ho (CHo= 1 мол.%) и монокристалла аналогичного состава при T=300 К. Из рис. 1.12 видно, что форма спектра поглощения является одинаковой для монокристалла и керамики CaF2:Ho (CHo=1 мол.%), стрелкой указана длина волны возбуждения на уровень 5I7 ионов Ho3+ в монокристалле и керамике CaF2:Ho. [18].
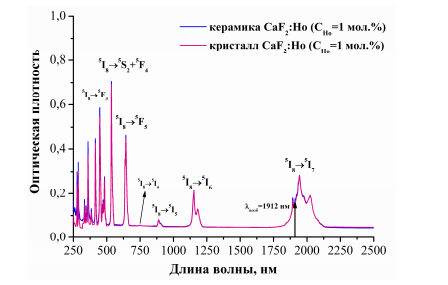
Рис.1.12. Спектры поглощения ионов Но3+ в монокристалле
и керамика CaF2 :Ho при Т=300К
Для монокристаллов и керамики CaF2:Ho выявлено наличие антистоксовой люминесценции обусловленной переходами 5G45I8, 5G55I8,5F35I8,5F4(5S2)5I8,5F55I8,5S25I7,5I45I8,5I55I8,5F55I6, 5F35I6, 5I65I8, 5F55I6, 5I55I7 ионов Ho3+ при возбуждении на уровень 5I7 этих ионов (рис. 1.13).
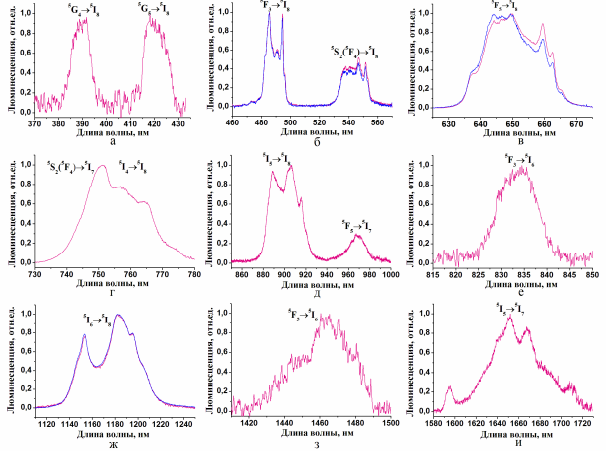
Рис. 1.13 Спектры антистоксовой люминесценции ионов Но3+ для монокристалла и керамики CaF2 :Ho при Т=300К.
Все процессы, происходящие в кристалле CaF2:Ho можно схематично изобразить в виде уровней на рис. 1.14:
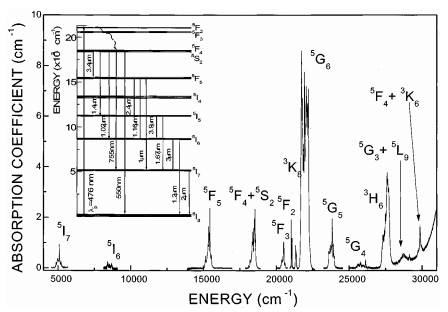
Рис. 1.14. Спектр поглощения Но3+ и
схема энергетических уровней (на врезке)
2.4.4. Свойства Еu3+
Наиболее интенсивными электронными переходами в ионе Eu3+ являются переходы 5D07F2 (рис. 1.15). Поскольку уровень 5D0 не расщепляется (2J+1=1), а уровень 7F2 может расщепиться на 5 уровней (2J+1), то мы должны наблюдать пять спектральных линий в красной (~600 нм) области спектра. [19].

Рис. 1.15. Схема энергии уровней Еu3+
При неселективном возбуждении через высокие возбужденные состояния Eu3+ в спектрах люминесценции отчетливо наблюдаются неоднородно-уширенные структурированные полосы, отвечающие переходам из нижнего излучательного уровня Eu3+ 5D0 на уровни основного мультиплета 7F0, 7F1, 7F2, 7F3, 7F4 (рис. 1.16).
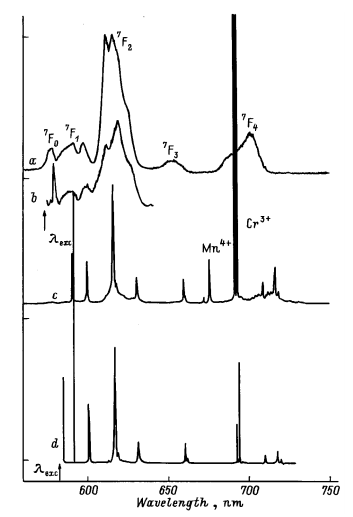
Рис. 1.16. Спектры люминесценции ионов Eu3+
Спектры поглощения ионов Eu3+ представлены на рис 1.17:
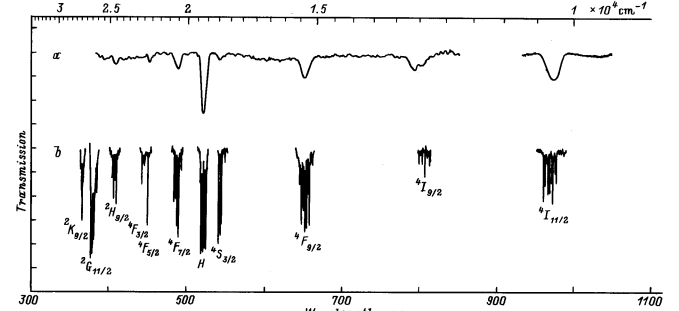
Рис. 1.17. Спектры поглощения ионов Eu3+
2.4.5. Свойства Er3+
Особенностью люминесценции Er3+ в легированном галогенами аморфном диоксиде кремния является отсутствие концентрационного тушения, которое связано с образованием кластеров, квантовая эффективность возбуждения люминесценции лазерного перехода 4I13/2 4I15/2 ионов Er3+ может быть высокой. Такие лазеры и усилители особенно актуальны для телекоммуникационного диапазона длин волн в окрестности 1.55 мкм. [20].
Даже при умеренной концентрации эрбия, когда еще нет явного образования кластеров, ведущего к расслоению оксидов на отдельные, несмешивающиеся фазы, в силикатных стеклах происходит значительное снижение квантовой эффективности люминесценции лазерного перехода 4I13/24I15/2 из-за эффекта ап-конверсии. Этот эффект вызван парным взаимодействием близкорасположенных в матрице ионов, одновременно находящихся в возбужденном состоянии 4I13/2, результатом которого является безызлучательная релаксация одного из них в основное состояние 4I15/2 и возбуждение другого на более высокий энергетический уровень 4I11/2 (рис. 1.18).
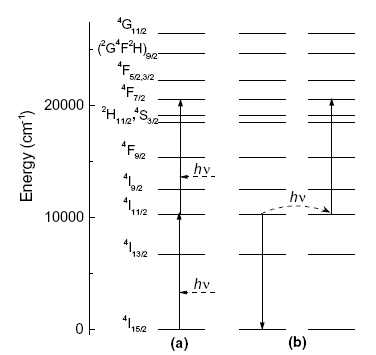
Рис. 1.18. Возможные механизмы люминесценции Er:
а) поглощение из возбужденного состояния, б) ап-конвресия.
Таким образом, люминесценция в видимом диапазоне при ИК-накачке на длине волны 975 нм может быть возбуждена за счет ап-конверсионного заселения высоколежащих термов или в результате поглощения из возбужденного состояния (переход 4I11/2 4F7/2).
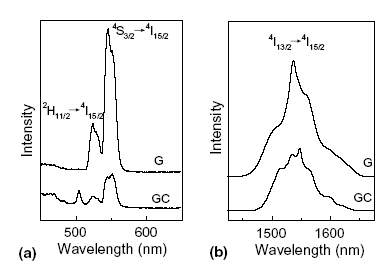
На рис. 1.19 представлены спектры люминесценции Er в стекле состава 50SiO2–50PbF2–3ErF3 и СКМ на его основе.
 с)
с)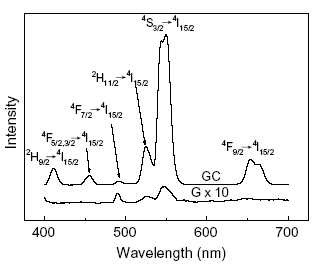
Рис. 1.19. Спектры люминесценции стекла (G) и СКМ (GC) :
а) возбуждение 378 нм, б) и с) возбуждение 980 нм
Из рисунка видно, что в образцах СКМ становится заметной штарковская структура уровней. Интенсивность ап-конверсионной люминесценции в СКМ возрастает многократно.
Изменение спектров поглощения и ИК-люминесценции оксифторидных стекол состава (SiO2)(Al2O3)(CdF2)(PbF2)(ZnF2): x(ErF3) после контролируемой кристаллизации (рис. 1.20).
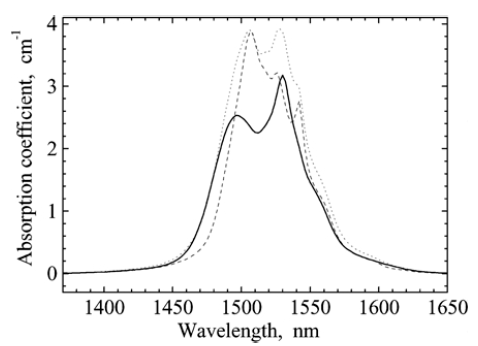
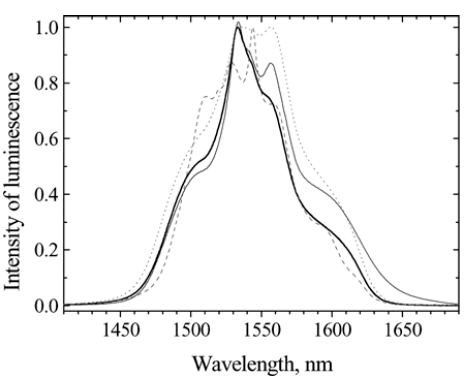
а) б)
Рис. 1.20. а) Спектр поглощения Er3+ на переходе 4I15/24I13/2
б) Спектр люминесценции Er3+ на переходе 4I13/24I15/2
сплошная линия - исходное стекло, пунктир - термообработка 440 оС, 5 ч, точечная линия - термообработка 400оС, 4 ч,
тонная линия – теллуридное стекло
Наблюдается проявление отдельных штарковских компонент и перераспределение интенсивности компонент спектра.
2.4.6. Свойства Yb3+
Редкоземельный ион иттербия Yb3+ представляет интерес в оптике и лазерной технике, так как является f-элементом. Материалы, легированные ионами иттербия, хорошо подходят для создания на их основе лазеров благодаря очень простой схеме энергетических уровней. У Yb3+ внешняя электронная оболочка 4f (4f146s2) заполнена почти полностью, за исключением одного электрона. Эти ионы имеют только 2 энергетических уровня – основной 2F7/2 и возбужденный 2F5/2. Энергетический зазор между ними составляет около 10000 см-1. кроме того, поскольку другие переходы на 4f – уровне отсутствуют, то на лазерный выход не могут оказывать влияние такие эффекты, как ап-конверсия и поглощение из возбужденного состояния, в отличие от других трехвалентных ионов. [21].
Энергетическая схема для иона иттербия в упрощённом виде представлена на рис. 1.21.
Рис. 1.21. Упрощённая схема энергетических переходов Yb3+.
Сплошные стрелки показывают переходы в поглощении и люминесценции при низкой температуре. Штриховые – соответствуют поглощению при повышенной температуре, когда растет заселенность возбужденных штарковских уровней.
В последнее время появилось много работ, посвященных материалам, активированным ионом Yb3+. Такой интерес обусловлен преимуществами Yb3+ по сравнению с ионами других редкоземельных элементов:
1. простая схема электронных уровней, из-за чего отсутствуют эффекты кросс-релаксации, ап-конверсии и поглощения из возбужденного состояния, которые в большинстве случаев негативно влияют на населенность лазерного уровня;
2. малый стоксов сдвиг, приводящий к незначительному тепловыделению в активном элементе (что особенно актуально при активации стекол и стеклокристаллических материалов, теплофизические свойства которых уступают таковым в кристаллических средах);
3. возможность применения широко используемых светодиодов на основе InGaAs или InAlGaAs для накачки, так как полоса поглощения иона Yb3+ находится в спектральном диапазоне 930-980 нм, совпадающем с диапазоном излучения лазерных диодов.
Все это делает ион Yb3+ не только перспективным для применения в лазерах, но так же и удобным для исследования материалов, т.к. упрощает интерпретацию спектров сложных по составу и структуре стекол.
В лазерах на основе кристаллов и стекол, легированных Yb3+ осуществляется квазичетырехуровневая схема за счет штарковского расщепления уровней.
Характерным для стекол видом спектров, как поглощения, так и люминесценции являются линии, представленные на рис. 2 - контур линий представляет собой сильно неоднородно уширенную полосу.
На рис. 1.22 пунктирной линией показан спектр испускания Yb3+ в исследуемом стекле. Пик соответствует переходу 2F5/2 2F7/2. Длина волны этого перехода составляет 1022 нм. На этом же рисунке показан и спектр поглощения – сплошная линия. Длина волны данного пика равна 976 нм.
Рис. 1.22. Спектр поглощения и люминесценции для свинцово-боратного стекла, легированного ионом Yb.
Ярко выражена линия основного перехода между нижними компонентами штарковских подуровней основного и возбужденного состояния (р=976 нм). Спектр люминесценции достаточно далеко заходит в длинноволновую область (1,04 – 1,1мкм). Это свидетельствует о наличии оптических центров с большим расщеплением основного состояния 2F7/2. Такое расщепление благоприятствует увеличению значения сечения усиления g на этих длинах волн (0 ~ 1020 нм) при достаточно низких величинах коэффициента инверсии min.
2.5. Выводы их обзора литературы
- Стекла и СКМ в фтороборатных системах являются перспективными матрицами для получения люминесцентных и лазерных материалов.
- В активированных Pr, Nd, Eu, Ho, Er, Yb стеклах можно получать люминесценцию в видимой и ИК-области. Для Ho и Er характерна ап-коверсия.
3. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
3.1. Получение фтороборатных стекол
Были синтезированы стекла в системе PbF2-B2O3, а также в системе BaO-PbF2-B2O3 (образцы для сравнения), легированные различными РЗЭ в концентрациях 1 - 6моль.%. Для синтеза стекол были подготовлены навески соответствующих составов. Навески были тщательно перемешаны в агатовой ступке, помещены в корундовый тигель и поставлены в печь. Масса навески шихты для одного эксперимента составляла ~ 9 г.
Варка стёкол осуществлялась в корундовых тиглях в печи ПМ-12M1 при температурах 850-1050 0С на воздухе. Толщина образцов составляла 2-3 мм.
Таблица 3.1. Условия синтеза стекол
|
№ |
Состав |
Условия получения |
Результат |
|
1 |
80 PbF2 20 В2O3 |
Плавление в тигле при 850С в течение 30 минут. Отливка на стальную пластинку при комнатной температуре. |
Расплав жидкий. Стекло желтоватое, чистое |
|
2 |
80 PbF2 20 В2O3 1 PrF3 |
Плавление в тигле при 850С в течение 30 минут. Отливка на стальную пластинку при комнатной температуре. |
Расплав жидкий. Стекло ярко-зеленоватое, чистое |
|
3 |
80 PbF2 20 В2O3 1 Eu(NO3)3 |
Плавление в тигле при 850С в течение 30 минут. Отливка на стальную пластинку при комнатной температуре. |
Расплав жидкий. Стекло желтоватое, чистое |
|
4 |
80 PbF2 20 В2O3 1 HoF3 |
Плавление в тигле при 850С в течение 30 минут. Отливка на стальную пластинку при комнатной температуре. |
Расплав жидкий. Стекло розоватое, чистое |
|
5 |
80 PbF2 20 В2O3 6 YbF3 |
Плавление в тигле при 850С в течение 30 минут. Отливка на стальную пластинку при комнатной температуре. |
Расплав жидкий. Стекло желтоватое, чистое |
|
6 |
80 PbF2 20 В2O3 3 YbF3 |
Плавление в тигле при 850С в течение 30 минут. Отливка на стальную пластинку при комнатной температуре. |
Расплав жидкий. Стекло желтоватое, чистое |
|
7 |
85 PbF2 15 В2O3 1 NdF3 |
Плавление в тигле при 950С в течение 20 минут. Отливка на стальную пластинку при комнатной температуре. |
Расплав жидкий. Стекло голубовато-лиловое, небольшая кристаллизация по краю отливки |
|
8 |
85 PbF2 15 В2O3 1 EuF3 |
Плавление в тигле при 950С в течение 20 минут. Отливка на стальную пластинку при комнатной температуре. |
Расплав жидкий. Стекло желтоватое, небольшая кристаллизация по краю отливки |
|
9 |
85 PbF2 15 В2O3 1 ErF3 |
Плавление в тигле при 950С в течение 20 минут. Отливка на стальную пластинку при комнатной температуре. |
Расплав жидкий. Стекло розоватое, чистое
|
|
10 |
90 PbF2 10 В2O3 1 NdF3 |
Плавление в тигле при 900С в течение 20 минут. Отливка на стальную пластинку при комнатной температуре. |
Расплав очень жидкий. Кристаллизация примерно половины объема. Стекло голубовато-лиловое, сильно растрескавшееся. |
|
11 |
90 PbF2 10 В2O3 1 ErF3 |
Плавление в тигле при 900С в течение 20 минут. Отливка на стальную пластинку при комнатной температуре. |
Расплав очень жидкий. Кристаллизация примерно трети объема. Стекло розоватое. |
|
12 |
95 PbF2 5 В2O3 1 NdF3 |
Плавление в тигле при 900С в течение 20 минут. Отливка на стальную пластинку при комнатной температуре. |
Белый поликристаллический образец с заметными кристаллитами чешуйчатой формы |
|
13 |
25 PbF2 25 BaO 50 В2O3 1 Eu(NO3)3 |
Плавление в тигле про 1050 0С в течение 30 минут. Отлив на стальную пластинку или в дюралевую форму при комнатной температуре. |
Расплав вязкий, стекло бесцветное, чистое, растрескалось.
|
|
14 |
10 PbF2 40 BaF2 50 В2O3 6 YbF3 |
Плавление в тигле про 1050 0С в течение 30 минут. Отлив на стальную пластинку или в дюралевую форму при комнатной температуре. |
Расплав вязкий, стекло бесцветное, чистое. |
|
15 |
20 PbF2 30 BaO 50 В2O3 1 Eu(NO3)3 |
Плавление в тигле про 1050 0С в течение 30 минут. Отлив на стальную пластинку или в дюралевую форму при комнатной температуре. |
Расплав вязкий, стекло бесцветное, чистое. |
В системе PbF2-B2O3 получение качественных стекол возможно из шихты с содержанием PbF2 до 85%, при этом добавление 1 моль.% РЗЭ ионов положительно влияет на стеклование, чем более тяжелый РЗИ добавляется, тем заметнее положительное влияние.
Для закристаллизовавшихся при застывании составов был проведен рентгенофазовый анализ (рис. 3.1). Рентгенограммы кристаллической фазы отливок 90PbF2-10B2O3, активированных Nd и Er, практически совпадают. В обоих случаях выпадают фазы фторида свинца, в основном, -PbF2 и немного -PbF2. В случае 95PbF2-5B2O3 происходит полная кристаллизация расплава, что хорошо видно по отсутствию стеклянного гало (на предыдущих рентгенограммах, даже с учетом того, что на анализ отдавали отобранную закристаллизованную часть отливок, гало хорошо видно). В этом случае выпадают фазы -PbF2 и бората свинца, скорее всего, Pb(BO2)2.
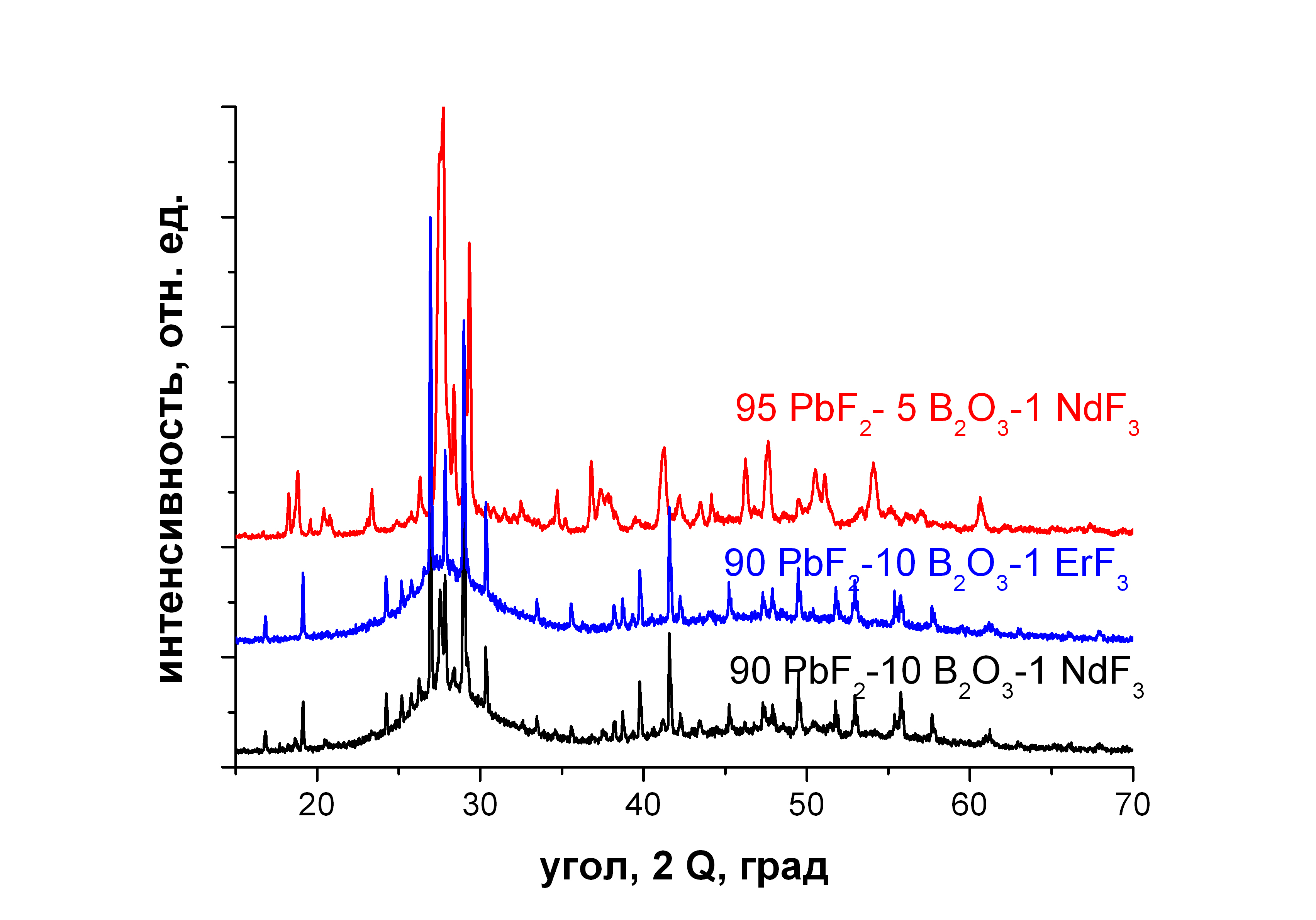
Рис. 3.1. Рентгенограммы закристаллизованных составов
3.2. Отжиг стекол
Для снятия термических напряжений стекла отжигали при температуре на 20-30 C ниже температуры стеклования.
Для составов 80PbF2-20B2O3 (Tg=225C) выбрали температуру отжига 200 C. Для составов 85PbF2-15B2O3 и 90PbF2-10B2O3 Tg неизвестно, но по данным базы SciGlass температура стеклования убывает с ростом содержания PbF2, поэтому для этих составов выбрали температуру отжига также 200 C. Для составов 25PbF2-25BaO-50В2O3 (Tg=375C), 20PbF2-30BaO-50В2O3 (Tg=380C) и 10PbF2-40BaF2-50В2O3 (Tg=360C) выбрали температуру отжига 350 C.
Отжиг проводили при выбранных температурах, 4 часа, до снятия напряжений в прецизионной печи сопротивления, оснащенной силовым блоком СБ25М3 и регулятором температуры ТЕРМОДАТ-14Е5. Охлаждение образцов проводилось со скоростями, не превышающими 5 0С/мин. Стёкла не деформировались, внешний вид остался прежним.
3.3. Обработка стекол
Для измерения микротвёрдости, показателя преломления, спектроскопических исследований образец должен быть плоскопараллельным, прозрачным и хорошо отполированным. Поэтому подготовка стёкол включает в себя стадии шлифовки и полировки. Каждая операция производилась поочерёдно для каждой стороны стекла.
Шлифовка. Обработка поверхности производилась на станке, снабжённом двигателем, вращающимся валом, на который надевается планшайба. Процесс осуществлялся с водой в две стадии – с использованием планшайб различной зернистости для сокращения времени шлифовки и улучшения качества поверхности: 60/40 и 40/28.
Полировка. Полировка образцов проводилась на том же станке. В ряде случаев отшлифованный образец наклеивали на кич при помощи мастики; затем производилась полировка с использованием керамической планшайбы. По достижении необходимого качества полировки кич нагревали для размягчения мастики и отклеивания образца. Некоторые образцы полировались без кича (придерживались рукой) на оловянной планшайбе без воды.
Качество поверхности оценивалось визуально с помощью лупы 10х увеличения. Толщина образцов в среднем составила 1,5 – 2 мм.
3.4. Спектры поглощения стекол
Поглощение стёкол различных составов измеряли на спектрофотометре UNICO 2800 (UV/VIS) с диапазоном измерений 190-1100 нм (рис. 3.2).
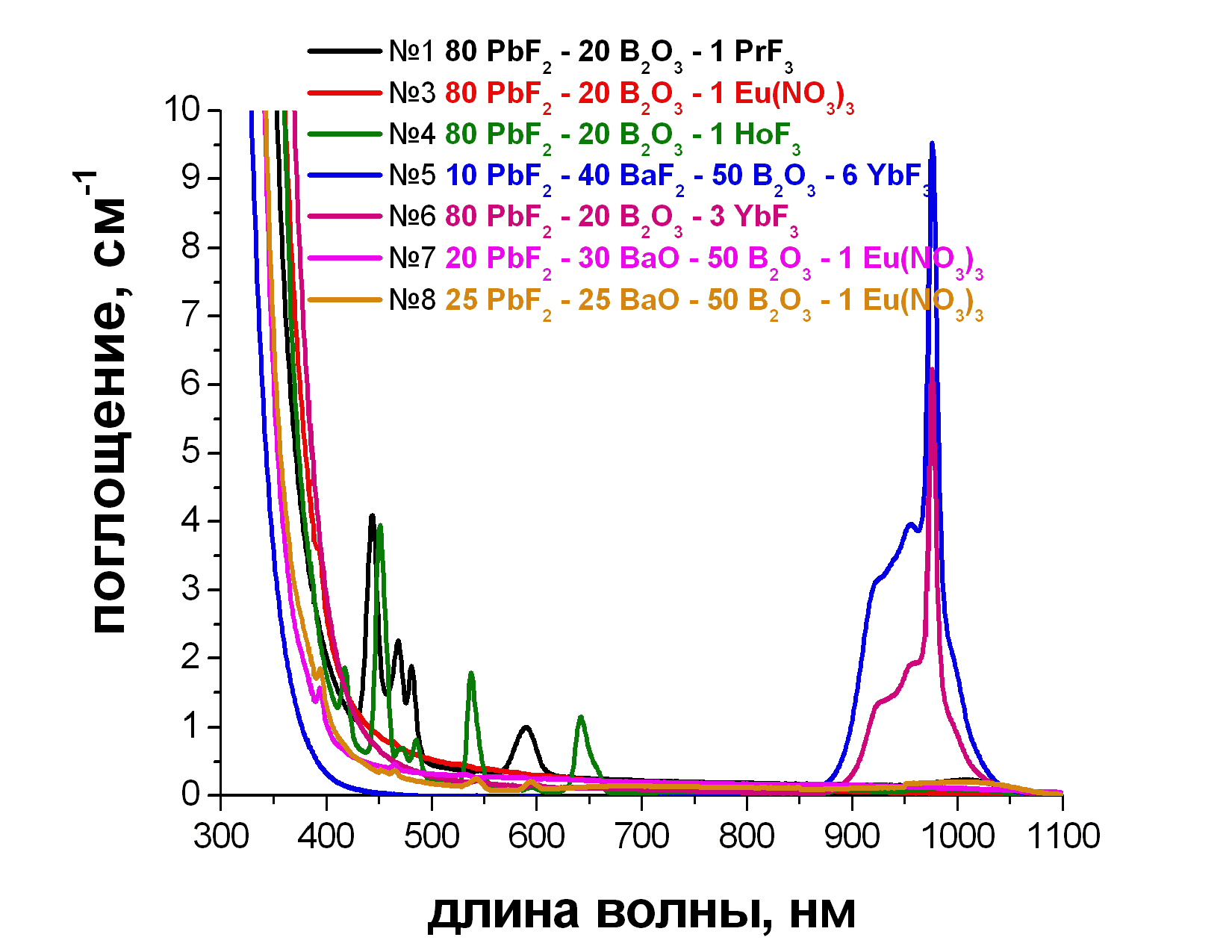
Рис. 3.2. Спектры поглощения стекол.
На спектрах стекол, активированных Yb (рис.3.3) хорошо видна полоса поглощения в области 950-1000 нм, отвечающая электронному переходу в Yb3+ с основного состояния на возбужденное.
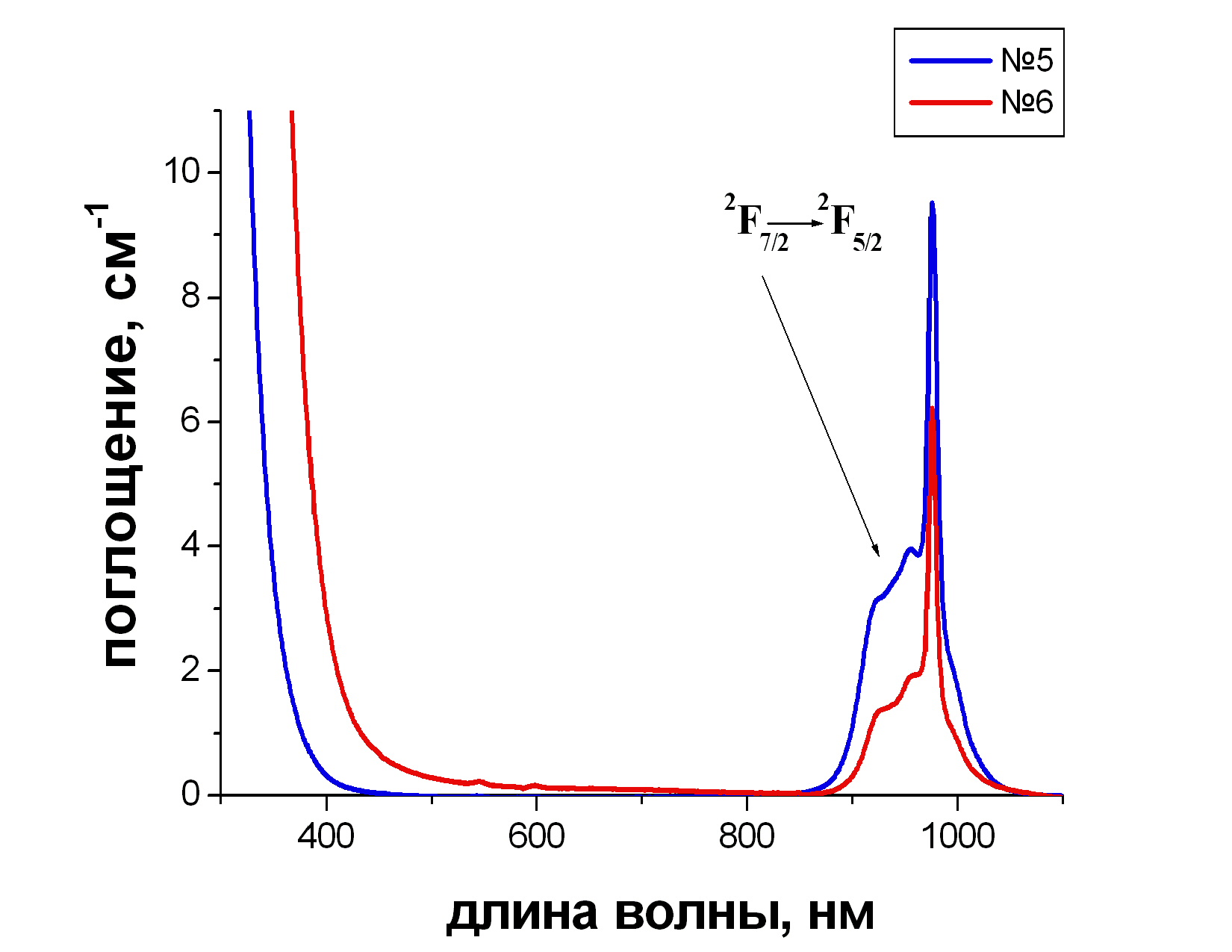
Рис. 3.3. Спектры поглощения стекол:
№5 10 PbF2 - 40 BaF2 - 50 В2O3 - 6 YbF3
№6 80 PbF2 - 20 В2O3 - 3 YbF3
На спектрах хорошо видна разница в крае поглощения (340 и 410 нм), ответственная за желтоватую окраску стекла PbF2 - 20 В2O3 - 3 YbF3
На спектрах стекол, активированных Pr (рис. 3.4) и Ho (рис. 3.5), видны все типичные полосы поглощения этих ионов.

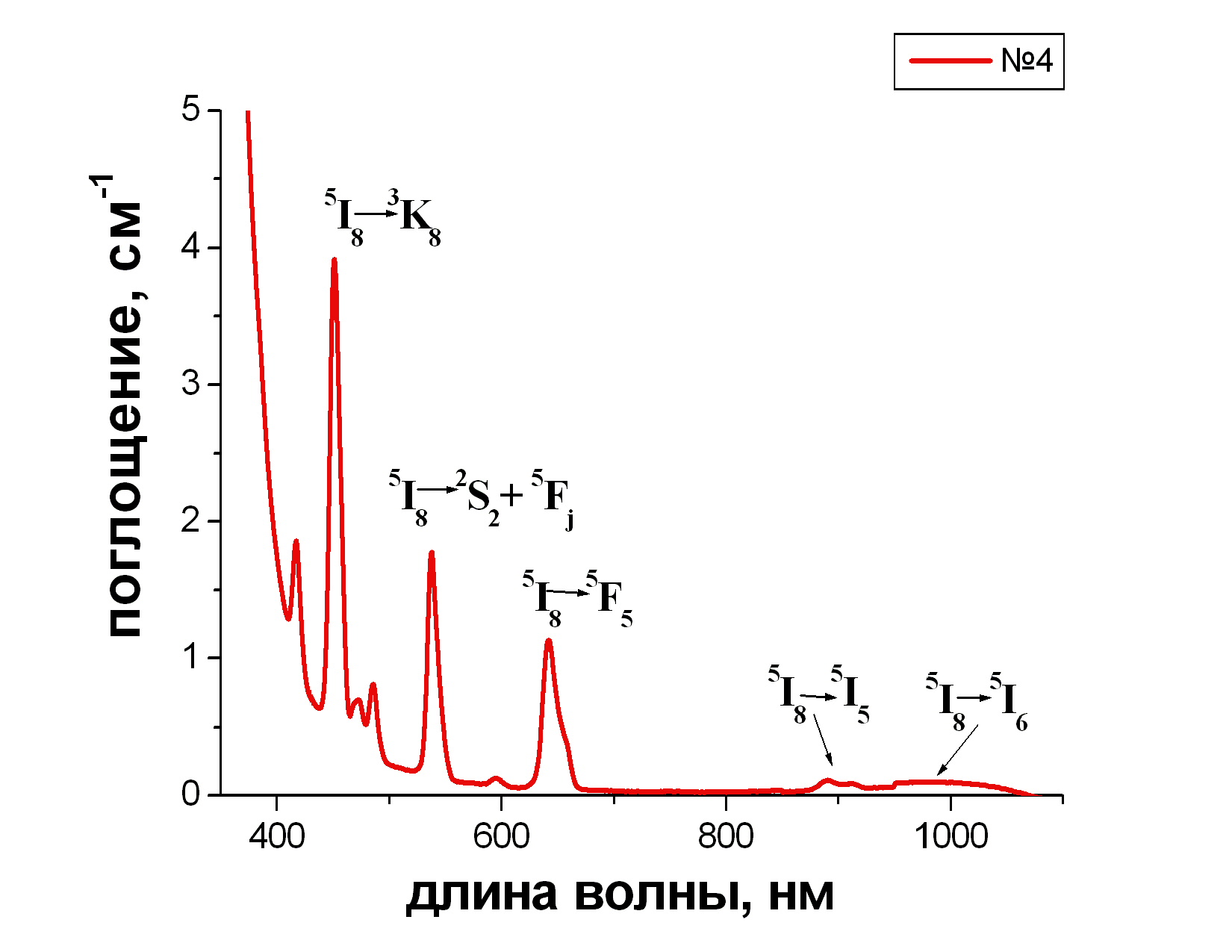
|
Рис. 3.4. Спектр поглощения стекла 80 PbF2 - 20 В2O3 - 1 PrF3 |
Рис. 3.5. Спектр поглощения стекла 80 PbF2 - 20 В2O3 - 1 НоF3 |
Поглощение в области 400-470 и 570-600 нм обеспечивает стеклу, активированному Pr яркий зелено-желтый цвет.
На спектрах стекол, активированных Eu (рис. 3.6), видна одна полоса поглощения, приходящаяся на 370 нм.
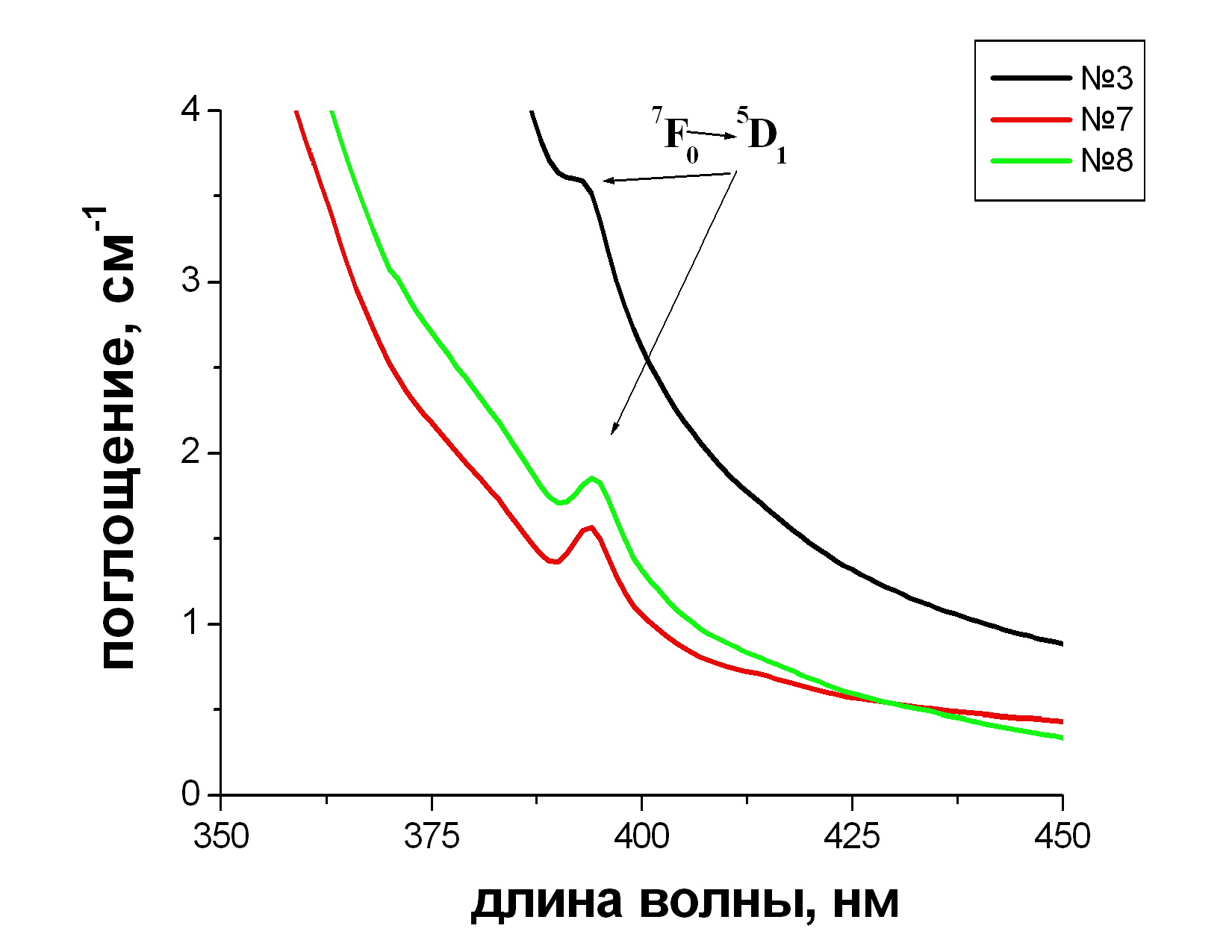
Рис. 3.6 Спектры поглощения стекол:
№3 80 PbF2 - 20 В2O3 - 1 Eu(NO3)3
№7 20 PbF2 - 30 BaO - 50 В2O3 - 1 Eu(NO3)3
№6 25 PbF2 - 25 BaO - 50 В2O3 - 1 Eu(NO3)3
3.5. Люминесценция стекол
Была исследована люминесценция стекол, активированных Eu, при возбуждении в линию поглощения 370 нм (рис. 3.7).
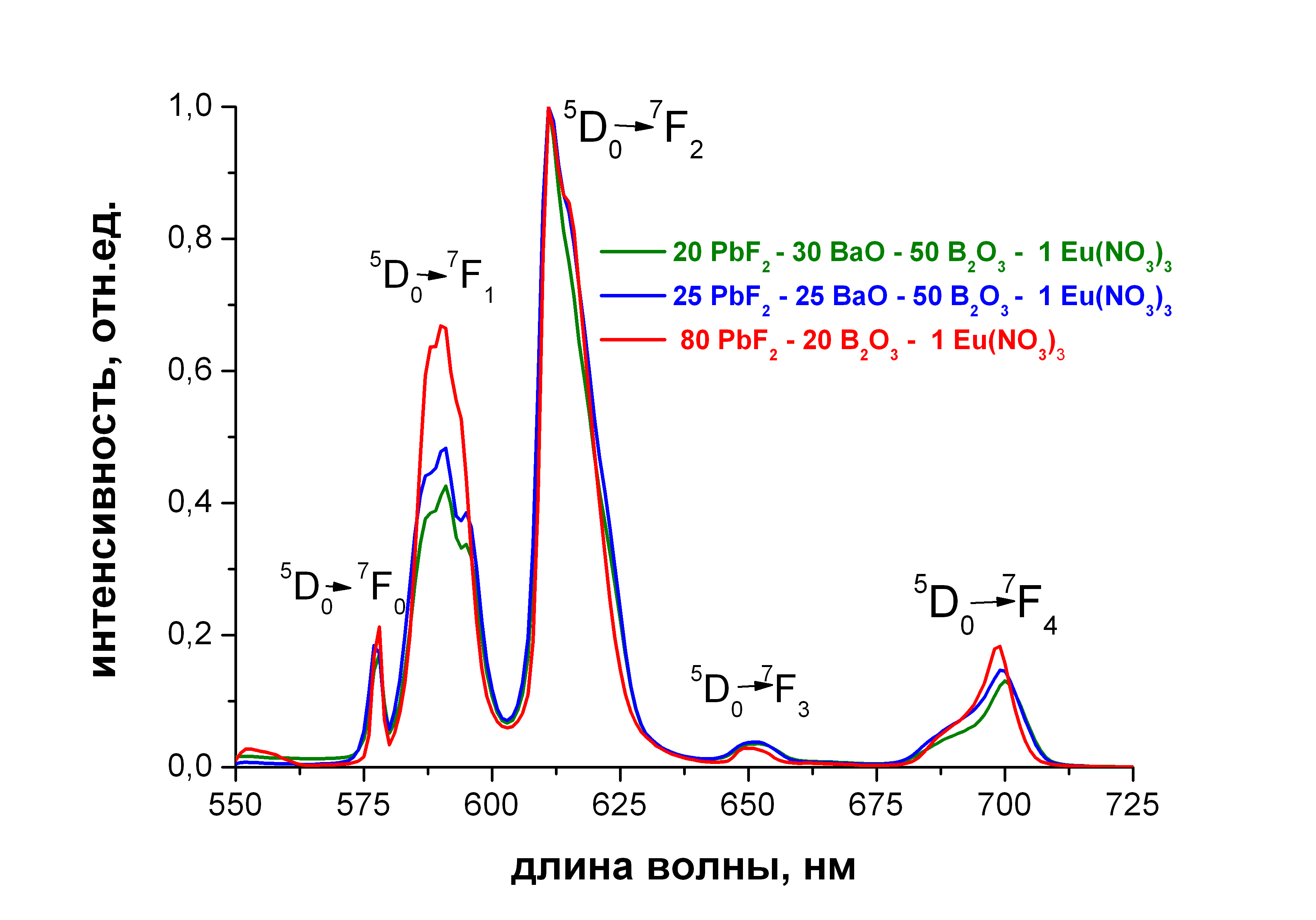
Рис. 3.7. Спектры люминесценции стекол:
80 PbF2 - 20 В2O3 - 1 Eu(NO3)3
20 PbF2 - 30 BaO - 50 В2O3 - 1 Eu(NO3)3
25 PbF2 - 25 BaO - 50 В2O3 - 1 Eu(NO3)3
На спектрах стекол присутствуют полосы, соответствующие энергетическим переходам иона Eu(III): 5D07F0 (578 нм), 5D07F1 (дублет 591, 596 нм, линии частично перекрыты), 5D07F2 (наиболее интенсивная дублетная полоса 611, 618 нм, тоже перекрытая), 5D07F3 (652 нм), 5D07F4 (700 нм).
3.6. Показатель преломления стекол
Показатель преломления измеряли с помощью микроскопа МИН-8 по методу Лодочникова. Пластинку исследуемого образца с плоскопараллельными полированными поверхностями закрепляли на стекле с нанесенной горизонтальной риской, причем боковая грань исследуемого образца была перпендикулярна нанесенной риске. Стекло помещали на столик Лодочникова, и, поворачивая столик вокруг горизонтальной оси, меняли угол падения лучей на пластинку, при этом наблюдали и измеряли смещение тени от риски. Показатель преломления рассчитывали по формуле Лодочникова:
(3.1)
где d – толщина образца;
l – величина смещения тени от риски;
– угол наклона наклона.
Таблица 3.2. Показатели преломления стекол
|
№№ |
Состав |
Показатель преломления, nd 0.02 |
|
1 |
80 PbF2 – 20 В2O3 – 1 PrF3 |
1.70 |
|
2 |
85 PbF2 – 15 В2O3 – 1 NdF3 |
1.75 |
|
3 |
85 PbF2 – 15 В2O3 – 1 EuF3 |
1.87 |
|
4 |
85 PbF2 – 15 В2O3 – 1 ErF3 |
1.70 |
4. РЕЗУЛЬТАТЫ РАБОТЫ
1. В результате выполнения УНИР был составлен обзор литературы по вопросам стеклования в оксифторидных боратных системах и спектрально-люминесцентных свойств материалов, активированных РЗИ.
2. Получены стекла в системах PbF2-B2O3 и BaO-PbF2-B2O3, активированные Pr, Nd, Eu, Ho, Er, Yb. Для системы PbF2-B2O3 уточнена предельная концентрация PbF2 для получения стекол – 85 моль.%.
3. Стекла отожжены, отшлифованы и отполированы.
4. Исследованы спектры поглощения и люминесценции стекол и их показатель преломления.
ИСПОЛЬЗОВАННАЯ ЛИТЕРАТУРА
1. Павлушкин Н.М. «Химическая технология стекла и ситаллов» М. Стройиздат, 1977, –360 с.
2. M.A. Ramos, J.A. Moreno, S. Vieira, C. Prieto, J.F. Fernandez. Correlation of elastic, acoustic and thermodynamic properties in B2O3 glasses.// J. Non-Cryst. Sol. 221 (1997) 170–180.
3. Павлушкин Н.М. «Основы технологии ситаллов». Учебное пособие для ВУЗов. М: Стройиздат, 1979.
4. Киприянов А.А., Карпухина Н.Г., Оксигалогенидные силикатные стёкла.// Физика и химия стекла, том 32, №1, 2006, c.3-40
5. Н.М. Павлушкин «Стекло. Справочник» М., Стройиздат, 1973, 487 с.
6. J. Lucas. Fluoride glasses for modern optics // Journal of fluorine Chemistry 72, 1995, 177-181
7.Петрова О. Б., Щукина В. Е., Чередниченко А. Г., Шукшин В. Е. Свинцовофтороборатные стеклокристаллические материалы, активированные ионами Nd3+. // Оптика и спектроскопия конденсированных сред. Материалы XVIII всероссийской конференции, Краснодар, 20-26 сентября 2012 г., с. 118-122.
8. K. Xu. Synthesis and characterization of octahedral PbF2. // Mat. Let., 2008, V.62, p. 4322–4324
9. Baliakin S.N. Deformation and Thermal Treatment application to Heavy Scintillator Production. // Crystal 2000 International Conference on Heavy Scintillators for Scientific and Industrial Applications, Chamonix, France, September 22-26, 1992.
10. Алов Д.Л., Рыбченко С.И. Люминесценция орторомбического и кубического PbF2. //ФТТ, 1995, т.37, вып. 2, с. 573-577
11. Шмытько И.М., Савченко И.Б., Классен Н.В., Багаутдинов Б.Ш. Емельяненко Г.А. Куланов А.Д., Синицин В.В. Структурные состояния и структурные перестройки в дифториде свинца в температурном интервале 4.2-300 K. // ФТТ, 1996, т. 38, вып. 4, с. 1240-1250.
12. А.С. Потапов, П.А. Родный, С.Б. Михрин, И.Р. Магунов. Люминесцентные свойства празеодима в некоторых фторидах. // ФТТ, 2005, том 47, вып. 8 с. 1-3
13. Zhou B., Tao L., Tsang Y.H., Jin W., Pun E.Y. Superbroadband near-IR photoluminescence from Pr3+-doped fluorotellurite glasses. // Optics Express, 2012, v . 20, №4, pp. 3803-3813
14. Synthesis and optical spectroscopy of the Eu- and Pr-doped glasses with SrO–2B2O3 composition // Optica Applicata, Vol. XL, №. 2, 2010 с.10
15. B. Padlyak1, M. Grinberg, B. Kukliski, Y. Oseledchik, O. Smyrnov, D. Kudryavtcev, A. Prosvirnin. Synthesis and optical spectroscopy of the Eu- and Pr-doped glasses with SrO–2B2O3 composition. // Optica Applicata, Vol. XL, No. 2, 2010 с.413-426
16. Pisarska J., Ryba-Romanowski W., Dominiak-Dzik G., Goryczka T., Pisarski W.A. Nd-doped oxyfluoroborate glasses and glass-ceramics for NIR laser applications.// J. All. and Comp., 2008, V.451, p. 223–225.
17. E. De la Rosa-Cruz, G.A. Kumar, L.A. Diaz-Torres, A. Martinez, O. Barbosa-Garcia. Spectroscopic characterization of Nd3+ ions in barium fluorobo-rophos-phate glasses // Optical-Materials, 2001, V.18, p. 321-329.
18. M. C. Pujol, J. Massons, M. Aguil, F. Daz, M. Rico, and C. Zaldo. Emission Cross Sections and Spectroscopy of Ho3+ Laser Channels in KGd(WO4)2 Single Crystal. // IEEE Journal Of Quantum Electronics, Vol. 38, № 1, 2002, pp. 323-325
19. А.А. Каплянский, А.Б. Кулинкин, А.Б. Куценко, С.П. Феофилов, Р.И. Захарченя, Т.Н. Василевская. Оптические спектры трехзарядных редкоземельных ионов в поликристаллическом корунде. // Физико-технический институт им. А.Ф. Иоффе Российской академии наук, 194021 Санкт-Петербург, Россия (Поступила в Редакцию 16 февраля 1998 г.)
20. Hatta B., Tomozawa M. Effect of Al2O3 on phase separation of SiO2-Nd2O3 glasses. // J.Non-Cryst. Sol., 2008, V. 354, p. 3184–3193.
21. В. В. Ковгар, Г.Е. Малашкевич. Структура и спектрально-люминесцентные свойства Yb-содержащих стекол и нанопорошков. // Сборник научных работ студентов Республики Беларусь «НИРС 2011». - Минск, 2012, с. 16-17.
PAGE \* MERGEFORMAT19
Е
4F3/2
4I15/2
4I13/2
4I11/2
I9/2
0,94 мкм
1,06 мкм
1,34 мкм
Получение активированных различными РЗЭ стекол в системе PbF2-B2O3