СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА ПРИМЕНЕНИЯ АНТИТРОМБОТИЧЕСКИХ ПРЕПАРАТОВ У БОЛЬНЫХ С ИНФАРКТОМ МИОКАРДА ПРИ ПРОВЕДЕНИИ ЭКСТРЕННОГО ЧРЕСКОЖНОГО ВМЕШАТЕЛЬСТВА
ФГАОУ ВПО «Северо-Восточный федеральный университет им.М.К.Аммосова»
Медицинский институт
Факультет последипломного обучения врачей
Кафедра внутренних болезней и общеврачебной практики (семейной медицины)
СОРГОЕВА
Алёна Витальевна
СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА ПРИМЕНЕНИЯ АНТИТРОМБОТИЧЕСКИХ ПРЕПАРАТОВ У БОЛЬНЫХ С ИНФАРКТОМ МИОКАРДА ПРИ ПРОВЕДЕНИИ ЭКСТРЕННОГО ЧРЕСКОЖНОГО ВМЕШАТЕЛЬСТВА.
Научный руководитель:
заведующий кафедрой внутренних болезней,
доктор медицинских наук
Кылбанова Елена Семеновна
Якутск-2014
ОГЛАВЛЕНИЕ
СПИСОК СОКРАЩЕНИЙ…………………………………………… 3 с.
ВВЕДЕНИЕ………………………………………………………… 4-5 с.
Глава 1. ЛИТЕРАТУРНЫЙ ОБЗОР: Антитромботические препараты:…………………………………………….…………... 6-9 с.
Антикоагулянты:
1.1.1.Антикоагулянты прямого действия………………… 10-12с.
1.1.2. Антикоагулянты непрямого действия……………. . 12-14с.
1.1.3. Новые перспективные антикоагулянты…………… . 14-16с.
Антиагреганты:
Ингибиторы циклооксигеназы……………………... .. 17-18с.
Антагонисты гликопротеинов IIb/IIIa……………….. 18-21с.
Блокаторы АДФ-индуцируемой активации тромбоцитов..21-24с.
Ингибиторы цАМФ фосфодиэстеразы………………… 24-25с.
Фибринолитики………………………………………………... 25-27с.
1.4. Сравнительные исследования эффективности антагонистов IIb/IIIa гликопротеиновых рецепторов тромбоцитов (Эптифибатид, Монафрам) и прямого ингибитора тромбина – Бивалирудина……………………. 27-31с.
Глава 2. МАТЕРИАЛЫ И МЕТОДЫ………………………………. 32-36с.
Глава 3. РЕЗУЛЬТАТЫ СОБСТВЕННОГО ИССЛЕДОВАНИЯ…………………………………………………. 37-58с.
ЗАКЛЮЧЕНИЕ……………………………………………………… 58-63с.
ВЫВОДЫ…………………………………………………………….. 64-65с.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ…………………………….. 66с.
СПИСОК ЛИТЕРАТУРЫ…………………………………………… 67-68с.
СПИСОК СОКРАЩЕНИЙ
АК аортальный клапан
АСК ацетилсалициловая кислота
АЧТВ активированное частичное тромбопластиновое время
ГЛЖ гипертрофия левого желудочка
ДАД диастолическое артериальное давление
ДАТТ двойная антитромбоцитарная терапия
ЗБВ ПКА задняя базальная ветвь правой коронарной артерии
ИМТ индекс массы тела
МНО международное нормализованное отношение
НМГ низко-молекулярный гепарин
НФГ нефракционированный гепарин
ОА огибающая артерия
ОБА общая бедренная артерия
ОИМ острый инфаркт миокарда
ОХС общий холестерин
ПИКС постинфарктный кардиосклероз
ППС приобретенный порок сердца
ПТИ протромбиновый индекс
САД систолическое артериальное давление
СКАГ селективная коронароангиография
СКФ скорость клубочковой фильтрации
ССЗ сердечно-сосудистые заболевания
ССО сердечно-сосудистые осложнения
ТБКА транслюминальная баллонная коронарная ангиопластика
ФСК факторы свертывания крови
ФК функциональный класс
ХСН хроническая сердечная недостаточность
ЧКВ чрескожное коронарное вмешательство
ЧСС частота сердечных сокращений
Введение
Важной целью при лечении пациентов с острым инфарктом миокарда (ОИМ) является как можно более раннее и полное восстановление коронарного кровотока. Проведение ранней реперфузионной терапии при ОИМ позволяет спасти максимально больший объем миокарда и улучшить как непосредственные, так и отдаленные результаты лечения.
Из двух методов реперфузионной терапии (фармакологического с использованием тромболитика и механического с использованием ангиопластики) наиболее эффективным в настоящее время является чрескожное коронарное вмешательство (ЧКВ), которое позволяет более эффективно и более полно восстановить кровоток по инфаркт зависимой артерии (ИЗА) [1]. К разновидностям ЧКВ относят баллонную ангиопластику, установку специальных «протезов» - стентов, различные типы атероэктомии, лазерную ангиопластику и некоторые другие вмешательства. Широкое распространение ЧКВ определяется их малой инвазивностью (в сравнении с шунтирующими операциями на коронарных артериях), непрерывным совершенствованием используемых устройств и наличием медикаментов, применение которых до, во время и после ЧКВ существенно снижает риск осложнений.
Основу медикаментозного «прикрытия» при ЧКВ составляют антитромботические средства. Предпосылки для эффективного использования именно этой группы лекарственных препаратов с целью снижения вероятности тромбоза подвергнутой вмешательству артерии заложены в самом принципе выполнения ЧКВ. Механическое воздействие на внутреннюю поверхность стенки артерии практически всегда сопровождается повреждением эндотелия, следствиями которого оказываются активация и агрегация тромбоцитов, а иногда и следующий за агрегацией тромбоцитов тромбоз просвета коронарной артерии [2].
Острый окклюзирующий тромбоз влечет за собой развитие острых событий, таких как рецидив инфаркта миокарда и/или острая коронарная смерть. Именно из-за первичности активации тромбоцитов в развитии ишемических осложнений ЧКВ основу антитромботического лечения при выполнении этих процедур составляют антитромбоцитарные средства [2]. Современная антитромбоцитарная терапия включает одновременное использование двух антитромбоцитарных препаратов для приема внутрь (аспирин и блокатор P2Y12 рецепторов тромбоцитов – так называемая двойная антитромбоцитарная терапия – ДАТТ), парентеральный антикоагулянт – нефракционированный гепарин (НФГ) или один из низкомолекулярных гепаринов (НМГ): эноксапарин натрия, фондапаринукс натрия. Кроме этого, для усиления подобного лечения, при высоком риске осложнений нередко используется третий антитромбоцитарный агент – блокаторы гликопротеиновых IIb/IIIa рецепторов тромбоцитов (Монафрам, Интегрилин) или прямой ингибитор тромбина (Бивалирудин), вводимые внутривенно в течение проводимого ЧКВ [3].
В связи с вышеуказанным, целью нашего исследования явился сравнительный анализ применения антитромботических препаратов ( Бивалирудин, Монафрам, Эптифибатид) у больных с инфарктом миокарда при проведении экстренного ЧКВ.
Задачи исследования:
- Оценить антитромбоцитарную терапию у больных с инфарктом миокарда, прошедших экстренное ЧКВ.
- Рассчитать риск кровотечения по шкале CRUSADE у данных пациентов.
- Проанализировать геморрагические осложнения после проведения ЧКВ у больных с инфарктом миокарда.
- Провести фармако-экономический анализ на примере больных с инфарктом миокарда в зависимости от применения антитромботических препаратов.
Глава 1. ЛИТЕРАТУРНЫЙ ОБЗОР.
Антитромботические препараты:
Антитромботические препараты используются для профилактики и лечения артериальных и венозных тромбозов и эмболий. Они препятствуют тромбообразованию за счет воздействия на факторы свертывания в плазме крови (антикоагулянты), противодействия активации и агрегации тромбоцитов (антиагреганты) или разрушения фибрина, составляющего основу тромба (фибринолитики).
Антикоагулянты прямого действия нейтрализуют факторы свертывания крови. Эти препараты вводятся парентерально; начинают действовать быстро и используются для профилактики и раннего (острого) лечения тромбозов и эмболий. Антикоагулянты непрямого действия противодействуют синтезу в печени факторов свертывания крови. Их эффект появляется и исчезает достаточно медленно. Препараты этой группы предназначены для перорального применения и им нет альтернативы, если необходимо достаточно длительное противодействие процессам свертывания крови. Фибринолитики вводятся парентерально, переводят содержащийся в крови неактивный белок плазминоген в активный фермент плазмин, вызывающий лизис фибрина.
Несмотря на общность основного механизма действия, отдельные антитромботические препараты имеют многочисленные особенности фармакодинамики, фармакокинетики, профиля побочных эффектов и различаются по изученности в тех или иных клинических ситуациях. С этим связано несовпадение показаний, дозировок и особенностей использования отдельных лекарственных средств. Наиболее частый побочный эффект при применении антитромботических препаратов – кровотечения [4].
В процессах тромбообразования участвует система свертывания крови, тромбоциты и развитие эндогенного фибринолиза. Факторы свертывания крови (ФСК) - белки, участвующие в осуществлении последовательности биохимических реакций, приводящих к образованию фибрина, составляющего основу тромба. Этот процесс (каскад коагуляции) в упрощенном виде представлен на рис.1.
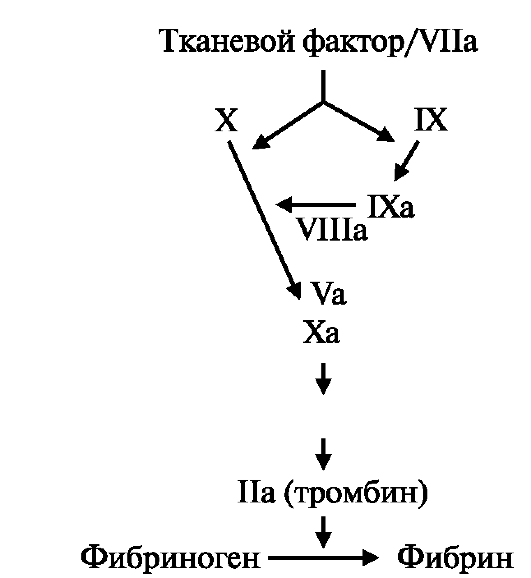
Рис.1. Этапы процесса свертывания крови
Ключевую роль в нем отводят двум ФСК: активированному ФСК Х (Ха) и активированному ФСК II (IIa), или тромбину. Тромбин - многофункциональная молекула, которая участвует в превращении фибриногена в фибрин, по механизму обратной связи регулирует интенсивность тромбообразования, влияет на выраженность процессов фибринолиза и вызывает активацию тромбоцитов. Практически важно, что процесс свертывания крови носит «лавинообразный» характер. Так, одна молекула ФСК Ха способствует образованию нескольких десятков молекул тромбина. Поэтому нейтрализация ФСК на более ранних этапах каскада коагуляции может эффективнее противодействовать образованию фибрина [4].
В организме существуют возможности противодействия процессу свертывания крови. Среди них - выделение клетками эндотелия простациклина и оксида азота, наличие в плазме крови антитромбина III, ингибитора пути тканевого фактора, а также система протеинов С, S и тромбомодулина.
Образующийся фибрин может разрушаться сериновой протеазой плазмином - ключевым ферментом эндогенной системы фибринолиза (рис.2). Плазмин образуется из циркулирующего в крови плазминогена под влиянием активаторов плазминогена, которые выделяются клетками эндотелия. Этим процессам противодействуют ингибиторы активатора плазминогена и а,2-антиплазмин.
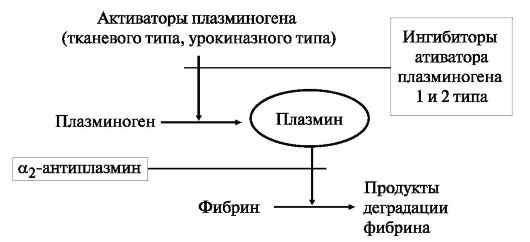
Рис.2. Система фибринолиза
Активации, адгезия и агрегация тромбоцитов начинается при взаимодействии ряда веществ (индукторов агрегации) с рецепторами на поверхности клетки (рис.3) [4].
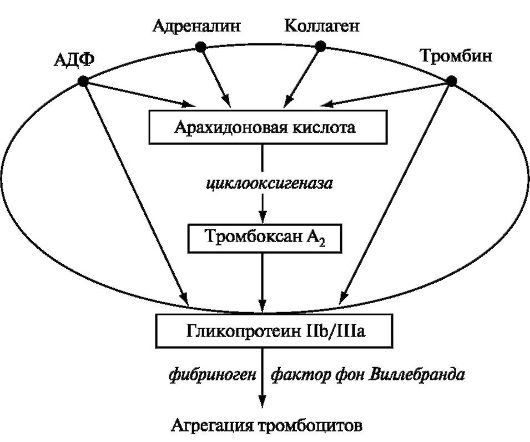 Рис.3. Агрегация тромбоцитов.
Рис.3. Агрегация тромбоцитов.
В итоге на наружной стороне мембраны тромбоцита становятся доступны гликопротеины IIb/IIIa, взаимодействующие с фибриногеном, фактором фон Виллебранда и другими адгезивными молекулами, что приводит к соединению тромбоцитов между собой и образованию стойких агрегатов [4].
Классификация антитромботических препаратов: в клинической практике используют 4 группы лекарственных средств, влияющих на процессы свертывания крови, агрегацию тромбоцитов или фибринолиз.
1. Антикоагулянты прямого действия: нефракционированный гепарин, препараты низкомолекулярного гепарина (далтепарин натрия, надропарин кальция, эноксапарин натрия), фондапаринукс натрия и ингибиторы тромбина прямого действия (бивалирудин).
2. Антикоагулянты непрямого действия. В зависимости от химической структуры выделяют производные монокумарина (варфарин, аценокумарол), производные индандиона (фениндион) и производные дикумарина (этил бискумацетат).
3. Антиагреганты: ацетилсалициловая кислота, производные тиенопиридина (клопидогрел, тиклопидин), дипиридамол, блокаторы гликопротеина IIb/IIIa тромбоцитов (абциксимаб, тирофибан, эптифибатид, монафрам).
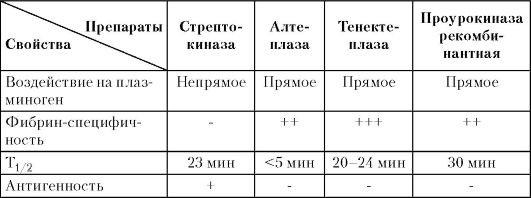
4. Фибринолитики. По механизму действия выделяют непрямой активатор плазминогена стрептокиназу, рекомбинантный тканевой (прямой) активатор плазминогена алтеплазу и ее производные, полученные с помощью генной инженерии (тенектеплаза), а также рекомбинантный предшественник прямого активатора плазминогена урокиназного типа (проурокиназа). В зависимости от избирательности в отношении фибрина фибринолитики разделяют на не фибрин-специфичные (стрептокиназа) и относительно фибринспецифичные препараты (алтеплаза, тенектеплаза, проурокиназа рекомбинантная) [4].
Антикоагулянты:
Антикоагулянты препятствуют тромбообразованию за счет воздействия на ФСК в плазме крови, что в конечном итоге приводит к уменьшению числа активно функционирующих молекул тромбина и подавлению образования фибрина [4].
Антикоагулянты прямого действия:
Антикоагулянты прямого действия нейтрализуют ФСК в плазме крови. В настоящее время на практике используются только лекарственные средства для парентерального введения (табл.1).
Нефракционированный гепарин представляет собой смесь сульфатированных полисахаридов (гликозамингликанов) разной молекулярной массы (от 3000 до 30000 Дальтон, в среднем около 15000 Дальтон). Около трети полисахаридов, входящих в состав нефракционированного гепарина, могут связываться с антитромбином III. В результате многократно увеличивается способность антитромбина III образовывать соединение с рядом активированных ФСК (IIa, Ша, Ха, XIa и XIIa) [4].
Таблица 1
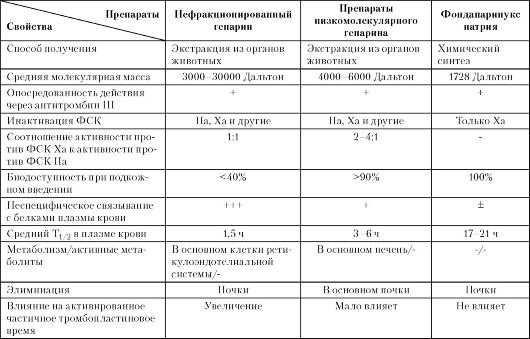
Нефракционированный гепарин оказывает также ряд других эффектов:
• стимулирует высвобождение ингибитора пути тканевого фактора;
• инактивирует фактор фон Виллебранда;
• угнетает формирование остеобластов и стимулирует остеокласты, что лежит в основе развития остеопороза;
• связывается с тромбоцитами и тромбоцитарным фактором 4, что лежит в основе развития иммунной тромбоцитопении;
• стимулирует высвобождение липопротеинлипазы и может оказывать гипотриглицеридемическое действие;
• может увеличить проницаемость сосудистой стенки.
Препараты низкомолекулярного (фракционированного) гепарина получают в результате химической или ферментативной деполимеризации нефракционированного гепарина (табл.2). Их молекулярная масса колеблется от 1000 до 10000 Дальтон и составляет в среднем 4000-6000 Дальтон. По механизму действия препараты низкомолекулярного гепарина не отличаются от нефракционированного гепарина, но в большей степени влияют на ФСК Ха, чем на ФСК IIa (тромбин) [4].
Таблица 2
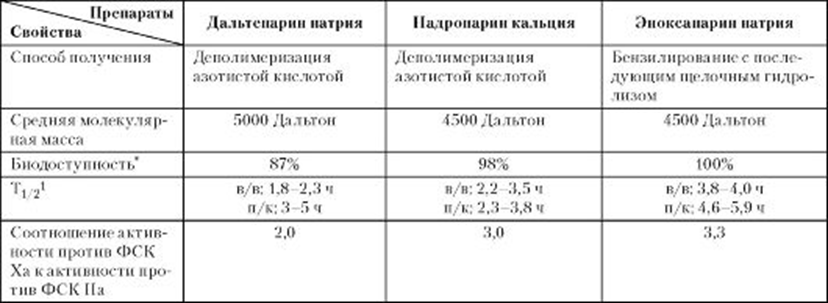
* На основании активности против ФСК Ха.
Кроме того, по сравнению с нефракционированным гепарином препараты низкомолекулярного гепарина в большей степени стимулирует высвобождение ингибитора пути тканевого фактора, лучше инактивирует фактор фон Виллебранда, меньше связываются тромбоцитами, тромбоцитарным фактором 4 и остеобластами, меньше активируют остеокласты. Помимо различий в способах получения, препараты низкомолекулярного гепарина заметно различаются по составу и биологической активности. Поэтому их рассматривают как отдельные, не взаимозаменяемые лекарственные средства.
Фондапаринукс натрия - синтетический сульфатированный пентасахарид, аналог участка молекулы гепарина, с помощью которой он взаимодействует с антитромбином III. В результате из каскада свертывания крови селективно удаляется ФСК Xa. Фондапаринукс практически не взаимодействует с тромбоцитами и тромбоцитарным фактором 4 [4].
Антикоагулянты непрямого действия:
По химической структуре антикоагулянты непрямого действия подразделяются на три основные группы:
- монокумарины - варфарин, маркумар, синкумар;
- дикумарины - дикумарин, тромексан;
- индандионы - фенилин, дипаксин, омефин. Препараты третьей группы вышли из употребления во всем мире в связи с нестабильностью их действия, токсичностью и рядом серьезных побочных эффектов [5].
В зависимости от быстроты начала гипокоагуляционного эффекта продолжительности последствий АНД подразделяются:
- А - на высококумулятивные с длительным периодом действия (синкумар, дикумарин),
- Б - препараты со средними кумулятивными свойствами (неодикумарин);
- В-быстродействующие (через 10-12 часов от начала приема) с коротким (около двух суток) последствием [5].
В мировой клинической практике наибольшую популярность приобрел Варфарин, который представляет собой рацемическую смесь, содержащую примерно равные количества двух оптически активных изомеров - R- и S - формы. Эти изомеры варфарина различаются по активности, путям элиминации и величине Т1/2. Так, S-варфарин в 4-5 раз активнее его Дизомера. Оказывает непрямое антикоагуляционное действие: угнетая в печени синтез ряда факторов, участвующих в регуляции процесса свертывания крови. Предупреждает образование новых тромбов и препятствует увеличению уже сформировавшихся.
Аценокумарол (синкумар) нарушает синтез протромбина (фактора свертывания крови II), проконвертина (фактора свертывания крови VII), факторов IX и X. Максимум действия - через 24-48 ч после перорального приема. После отмены содержание протромбина восстанавливается на 2-4 день.
Фениндион (фенилин) обладает K-антивитаминной активностью, тормозит образование протромбина, вызывает гипопротромбинемию, уменьшает образование VII, IX, X факторов свертывания крови, снижает толерантность плазмы к гепарину. Действие наступает через 8-10 ч и достигает максимума через 24-30 ч [5].
Антикоагулянты непрямого действия угнетают ферменты, преобразующие витамин К в его эпоксидную форму, необходимую для карбоксилирования ряда ФСК, образующихся в печени (протромбин, VII, IX и X). В результате синтезируются частично декарбоксилированные протеины со сниженной коагуляционной активностью. Одновременно нарушается синтез протеинов С и S, обладающих антикоагулянтными свойствами. Среди лекарственных средств, воздействующих на процессы свертывания крови и
доступных на практике, это пока единственные препараты для приема внутрь.
Быстрота наступления эффекта зависит не только от влияния антикоагулянтов непрямого действия, но и от времени сохранения в плазме крови образовавшихся ранее полноценных ФСК (табл. 3) [4].
Таблица 3
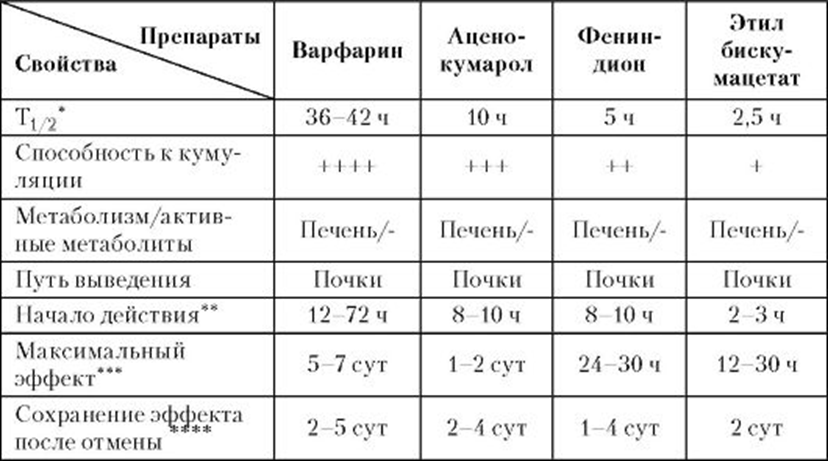
Новые перспективные антикоагулянты:
Дабигатран и ривароксабан - новые пероральные антикоагулянты, зарегистрированные в РФ для использования с целью профилактики ВТЭ после эндопротезирования тазобедренного и коленного сустава.
Дабигатрана этексилат (ПРАДАКСА®) является низкомолекулярным пролекарством, не обладающим фармакологической активностью. После приема внутрь быстро всасывается и путем гидролиза, катализируемого эстеразами, превращается в дабигатран. Дабигатран является активным, конкурентным, обратимым прямым ингибитором тромбина и оказывает действие в основном в плазме. Так как тромбин (сериновая протеаза) превращает в процессе каскада коагуляции фибриноген в фибрин, то угнетение его активности препятствует образованию тромба [5].
Дабигатрана этексилат не метаболизируется с участием системы цитохрома, в связи с чем не отмечается значимого межлекарственного взаимодействия при совместном приеме с другими препаратами. Дабигатрана этексилат и ривароксабан по эффективности сопоставимы с низкомолекулярными гепаринами, по удобству применения превосходят все парентеральные антикоагулянты, а по безопасности – варфарин. Дополнительный довод в пользу более широкого применения дабигатрана - отсутствие необходимости рутинного лабораторного контроля системы гемостаза. Во всех исследованиях дабигатран характеризовался хорошей переносимостью и высокой безопасностью. В настоящее время продолжается изучение эффективности дабигатрана при остром коронарном синдроме, острых тромбозах и при вторичной профилактике тромбоэмболических осложнений [5].
Бивалирудин — избирательный, обратимый и прямой ингибитор тромбина, который связывается с каталитическим участком тромбина, а также с анионсвязывающим участком как свободного, так и связанного с фибрином тромбина. Тромбин играет центральную роль в процессе тромбообразования, расщепляя фибриноген с образованием мономеров фибрина и активируя фактор свертывания XIII с образованием активного фактора свертывания XIIIa, который способствует образованию ковалентных поперечных связей между молекулами фибрина, что приводит к образованию устойчивого тромба. Тромбин также активирует факторы свертывания V и VIII, способствуя дальнейшему образованию тромбина, и активирует тромбоциты, стимулируя их агрегацию и высвобождение гранул. Бивалирудин ингибирует каждый из этих эффектов тромбина. Связывание бивалирудина с тромбином, а следовательно, подавление активности последнего, является обратимым, поскольку тромбин медленно расщепляет бивалирудин, Арг3-Про4 — связь, что приводит к восстановлению функции активного участка тромбина [5].
Поэтому первоначально бивалирудин действует как полный неконкурентный ингибитор тромбина, но с течением времени становится конкурентным ингибитором, способным первоначально ингибировать взаимодействие молекул тромбина с другими субстратами сгустка и при необходимости ингибировать процесс коагуляции.
Бивалирудин увеличивает активированное частичное протромбиновое время (АЧТВ), тромбиновое время (ТВ) и протромбиновое время (ПВ) нормальной человеческой плазмы in vitro в зависимости от концентрации. Бивалирудин не вызывает агрегацию тромбоцитов в сыворотке, полученной от пациента с синдромом гепарин-индуцированной тромбоцитопении/тромбоза в анамнезе.
Бивалирудин оказывает противотромботическое действие во время проведения чрескожного транслюминального коронарного вмешательства (ЧТКВ) и стентирования. При проведении ЧКВ бивалирудин вводят в/в струйно в дозе 0,75 мг/кг с последующим немедленным продолжением инфузии со скоростью 1,75 мг/кг/ч до окончания процедуры. При необходимости введение препарата в этой же дозе может продолжаться еще в течение 4 ч после окончания ЧКВ, а затем, в последующие 4–12 ч — в дозе 0,25 мг/кг/ч. После проведения ЧКВ больные должны находиться под постоянным наблюдением [5].
1.2.Антиагреганты:
Выделяют следующие группы антиагрегантов:
1. Вещества, действующие на метаболизм арахидоновой кислоты путем ингибирования циклооксигеназы-1(ЦОГ-1): ацетилсалициловая кислота (аспирин), индобуфен, трифлюзал.
2. Антагонисты рецептора АДФ Р2Y12 на тромбоцитарных мембранах: тиенопиридины — тиклопидин (тиклид), клопидогрел (плавикс) и празугрел, необратимо ингибирующие активность P2Y12, и обратимые антагонисты этого рецептора — AZD6140 (для перорального применения) и ARC69931МХ (кангрелор) для внутривенного использования).
3. Антагонисты гликопротеинов (GP) IIb/IIIa: для внутривенного введения — абциксимаб (РеоПро), эптифибатид (интегрилин), тирофибан (агграстат); для перорального применения — ксимелофибан, орбофибан, сибрафибан, лотрафибан и др. В клинических испытаниях не были доказаны эффективность и безопасность перорального применения блокаторов GP IIb/IIIa.
В 2007 г. в России начат выпуск первого отечественного антагониста GP IIb/IIIa монафрама для внутривенного введения, который по своим свойствам сходен с препаратом абциксимаб.
4. Ингибиторы цАМФ фосфодиэстеразы: дипиридамол и трифлюзал. Последний также ингибирует ЦОГ-1.
5. Стимуляторы аденилатциклазы: илопрост и другие простациклинмиметики, которые также повышают в тромбоцитах уровень цАМФ.
6. Ингибиторы рецептора ТХА2/PGH2: ифетробан, сулотробан и др.
7. Антагонисты рецепторов PAR (protease activated receptors) тромбина: SCH530348, Е5555 [6].
1.2.1.Ингибиторы циклооксигеназы:
Ацетилсалициловая кислота (аспирин) вызывает необратимое ингибирование ЦОГ-1 — ключевого фермента метаболизма арахидоновой кислоты в тромбоцитах. Этот фермент ответствен за образование PGH2 — предшественника тромбоксана А2 (ТХА2).
Клинически действие аспирина может быть определено по увеличению времени кровотечения. Эффект развивается в течение 1 ч после однократного приема и сохраняется не менее 5 дней (в течение всего периода жизни тромбоцита) [7].
Период полужизни аспирина в циркулирующей крови не превышает 20 мин, а антитромботический эффект после однократного приема 75—100 мг сохраняется в течение 24—48 ч, подтверждая необратимую инактивацию ЦОГ-1 и подавление синтеза ТХА2. При приеме повторных доз действие аспирина на ЦОГ-1 кумулируется, чем и объясняется эффективность малых доз препарата. Постоянный ежедневный прием 75—100 мг аспирина
эффективен для снижения риска серьезных сосудистых осложнений. В
ситуациях, требующих достижения немедленного антитромботического эффекта (острый инфаркт миокарда, острый ишемический инсульт), для быстрой и полной блокады ТХА2-зависимой агрегации тромбоцитов назначается нагрузочная доза в 160—300 мг [7].
1.2.2.Антагонисты гликопротеинов IIb/IIIa:
Различают препараты, созданные на основе моноклональных антител к данному рецептору, а также синтетические вещества с пептидной или непептидной (пептидомиметики) структуры, сходной с последовательностью
аргинин—глицин—аспарагин. Эта последовательность содержится в составе фибриногена и играет важную роль во взаимодействии с GP IIb/IIIa.
Препараты — производные антител (абциксимаб, монафрам), взаимодействуя с GP IIb/IIIa, фактически «закрывают» и делают недоступным участок связывания фибриногена, т.е. ингибируют рецепторную функцию GP IIb/IIIa по неконкурентному механизму. Они образуют прочный комплекс с GP IIb/IIIa и могут достаточно долго циркулировать в кровотоке в связанном с тромбоцитами состоянии. Именно поэтому после прекращения введения этих препаратов агрегационная активность тромбоцитов остается сниженной еще в течение нескольких дней, несмотря на быстрое (10—12 ч) выведение из плазмы несвязанных с тромбоцитами антительных молекул.
В отличие от этих лекарств, эптифибатид и тирофибан являются конкурентными ингибиторами связывания фибриногена. Связывание этих антагонистов с GP IIb/IIIa характеризуется более низким сродством и быстрой скоростью диссоциации комплекса препарата с рецептором. Поэтому для эффективного блокирования активности GP IIb/IIIa на поверхности циркулирующих тромбоцитов требуется постоянное присутствие в крови высоких концентраций данных препаратов, а после прекращения инфузии агрегационная активность тромбоцитов восстанавливается в течение нескольких часов [5].
Фармакологические свойства некоторых блокаторов гликопротеиновых IIb/IIIа рецепторов тромбоцитов представлены в таблице 4 [4].
Таблица 4
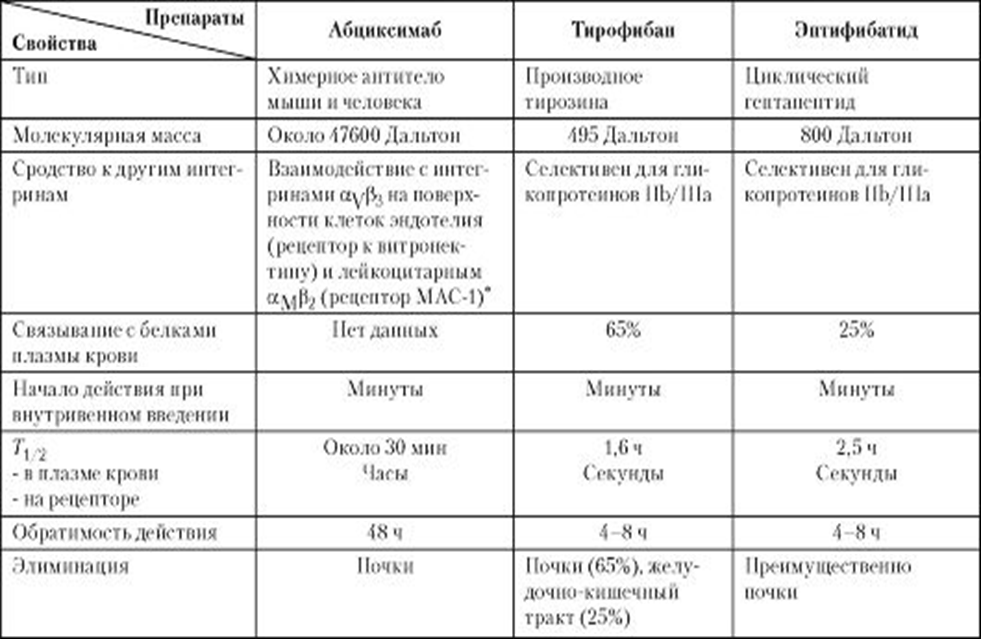
* В дополнение к антитромбоцитарному действию подавляет активацию нейтрофилов, адгезию моноцитов к поврежденной сосудистой стенке, миграцию и апоптоз гладкомышечных клеток и др.
Абциксимаб (РеоПро) является первым антагонистом GP IIb/IIIa, получившим клиническое применение. Этот препарат представляет собой Fab-фрагменты рекомбинантного химерного иммуноглобулина, состоящего из вариабельных участков мышиных моноклональных антител и константных участков иммуноглобулина человека. Абциксимаб оказывает антитромбоцитарное действие только в том случае, если связывает более 50% рецепторов тромбоцита. РеоПро обычно вводят внутривенно болюсно с последующей 12—24-часовой инфузией. Уже через 30 мин после начала введения более 60% антител оказываются связанными с тромбоцитами. После окончания введения абциксимаба агрегация тромбоцитов восстанавливается через 48—72 ч, а время кровотечения нормализуется через 24 ч [6].
Эптифибатид (интегрилин) представляет собой циклический гептапептид с заменой аргинина положительно заряженным лизином. Препарат вводят внутривенно в виде болюса 180 мкг/кг, затем в виде непрерывной инфузии по 2 мкг/кг/мин (при уровне креатинина сыворотки ниже 1,912 ммоль/л) или 1 мкг/кг/мин (при уровне креатинина сыворотки 1,912–3,824 ммоль/л) продолжительностью не более 72 ч (или до выписки из стационара, если она происходит раньше). В случае проведения больному ЧКВ по неотложным показаниям инфузию следует продолжать еще в течение 18–24 ч после вмешательства (максимальная общая продолжительность терапии — 96 ч). Применяется, как правило, совместно с ацетилсалициловой кислотой и нефракционированным гепарином. Сразу после болюсного введения и на протяжении всего периода введения эптифибатид практически полностью ингибирует агрегацию тромбоцитов, однако после прекращения инфузии агрегационная активность тромбоцитов восстанавливается через 4—6 ч. Эптифибатид отличается достаточно высокой специфичностью по отношению к GP IIb/IIIa и существенно не влияет на активность других интегринов.
Тирофибан (аггратраст) — непептидное производное тирозина (пептидомиметик). Тирофибан вводят внутривенно болюсно с последующей длительной, до нескольких суток, поддерживающей инфузией. Практически полное ингибирование агрегации тромбоцитов достигается уже через несколько минут после введения, а после окончания инфузии функциональная активность тромбоцитов восстанавливается в течение 8 ч. Как и эптифибатид, тирофибан селективно ингибирует активность GP IIb/IIIa [6].
Монафрам — первый отечественный ингибитор GP IIb/IIIa, который был создан в Российском кардиологическом научно-производственном комплексе (старое название — фрамон). Выпуск этого препарата начат в 2007 г. Монафрам представляет собой F(ab’)2-фрагменты анти-GP IIb/IIIa мышиного моноклонального антитела ФраМон (CRC64). Это антитело, как и сам препарат, обладает способностью препятствовать взаимодействию GP IIb/IIIa с фибриногеном и другими лигандами и таким образом полностью блокировать агрегацию тромбоцитов. При внутривенном болюсном введении монафрама в дозе 0,25 мг/кг массы тела АДФ-индуцированная агрегация тромбоцитов снижается более чем на 90, 80, 60 и 30% через 1, 12, 24 ч и 3 дня соответственно. Сходная динамика ингибирования агрегации наблюдается при применении абциксимаба, вводимого по стандартной схеме: 0,25 мг/кг массы тела болюсно + 12-часовая инфузия 0,125 мкг/кг массы тела/мин. В отличие от абциксимаба, монафрам селективно блокирует активность GP IIb/IIIa и не взаимодействует с другими интегриновыми молекулами [6].
1.2.3. Блокаторы АДФ-индуцируемой активации тромбоцитов:
Тиенопиридины:
Тиклопидин и клопидогрель выборочно ингибируют вызванную аденозиндифосфатом (АДФ) агрегацию тромбоцита без прямого воздействия на метаболизм арахидоновой кислоты (АК).
Тиклопидин и клопидогрель селективно и необратимо ингибируют связывание АДФ с его рецепторами на поверхности тромбоцитов, блокируют активацию тромбоцитов и подавляют их агрегацию.
Через 2 часа после приема внутрь разовой дозы клопидогреля наблюдается статистически значимое и зависящее от дозы торможение
агрегации тромбоцитов (угнетение агрегации на 40 %). Максимальный эффект (60% подавление агрегации) наблюдается на 4–7-е сутки постоянного приема поддерживающей дозы препарата и сохраняется на протяжении 7–10 дней [6].
Фармакологические свойства антиагрегантов для приема внутрь представлены в таблице 5 [4].
Таблица 5
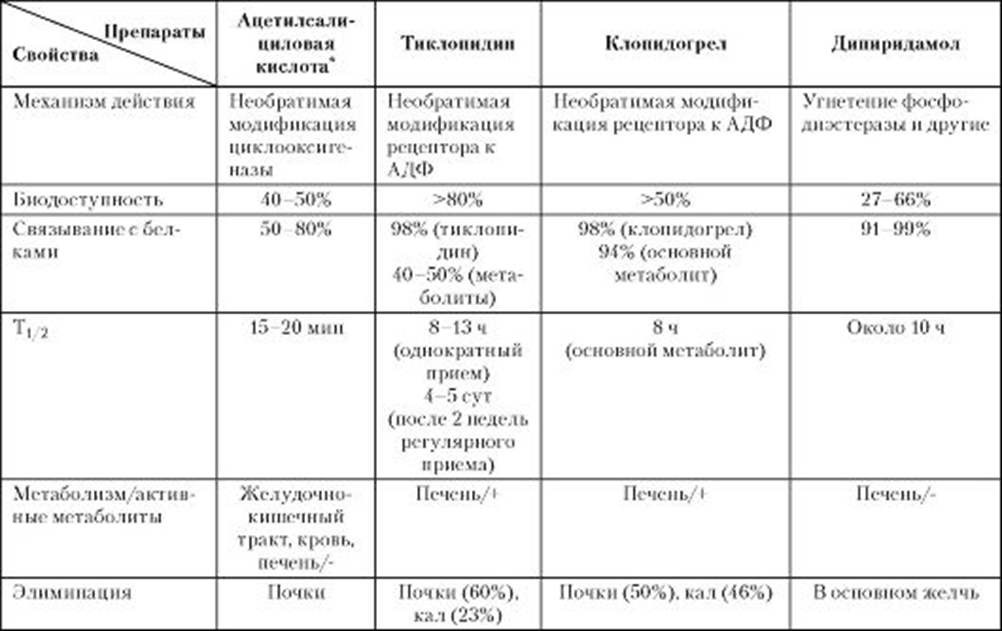

* Для лекарственных форм, не покрытых кишечно-растворимой оболочкой.
** При использовании нагрузочной (ударной) дозы наступает быстрее.
Прасугрель — новый и более мощный тиенопиридин. Прасугрель, как и клопидогрель, является пролекарством, которое, чтобы приобрести
антитромбоцитарную активность, требует превращения в активный метаболит. В изучаемых в настоящее время дозах прасугрель ингибирует агрегацию тромбоцитов, индуцируемую АДФ быстрее, более стабильно (воспроизводимо) и в большей степени, чем стандартные и даже более высокие дозы клопидогреля, как у здоровых, так и больных коронарной болезнью сердца, включая тех, кто подвергается чрескожным коронарным вмешательствам (ЧКВ). Фармакодинамические исследования показали, что степень агрегации тромбоцитов, достигаемая в пределах 30 мин после приема прасугреля, близка к пиковому эффекту клопидогреля через 6 часов после его приема. Подобно клопидогрелю, он необратимо связывает и блокирует рецептор ADP P2Y12 [8].
Кангрелор — новый внутривенный ингибитор P2Y12, структура которого отлична от группы тиенопиридинов. Для проявления антитромбоцитарной активности кангрелора не требуется метаболических превращений, так как он является прямым ингбитором P2Y12. Его действие на тромбоциты наступает быстро (практически немедленно) и так же быстро прекращается.
Тикагрелор (AZD6140) — перорально активный препарат, который связывает рецептор P2Y12. В отличие от клопидогреля и прасугреля он, как и кангрелор, не относится к группе тиенопиридинов, это новый класс антиагрегантов под названием «циклопентил-тиазоло-пиримидин». Еще одним очень важным свойством тикагрелора является то, что его связь с рецептором P2Y12 обратима. Тикагрелор из-за его обратимой ингибиции тромбоцитов имеет преимущество у пациентов с неизвестной коронарной анатомией и/или у которых аортокоронарное шунтирование (АКШ) не может быть отсрочено.
В настоящее время проходит II фазу испытаний новый антагонист рецепторов P2Y12 прямого действия — элиногрель. Одна доза препарата (60 мг) существенно снижает реактивность тромбоцитов у пациентов после ЧКВ, которые не отвечали на клопидогрель. Однако оценка его клинической эффективности еще предстоит [8].
Ингибиторы рецепторов PAR-1:
Новый класс антитромбоцитарных препаратов — ингибиторы рецепторов PAR-1 (SCH 530348, SCH 205831, SCH 602539, E5555) селективно влияют на активацию тромбоцитов, индуцированную тромбином, но не влияют на опосредованную тромбином генерацию фибрина и коагуляцию и являются более безопасными и эффективными. Проведены клинические исследования двух ингибиторов PAR-1: E-5555 и SCH530348. E-5555 проявляет антитромбоцитарный эффект без увеличения времени кровотечения и дозозависимо ингибирует агрегацию тромбоцитов в исследованиях in vitro. SCH530348 ингибирует активацию и агрегацию тромбоцитов, индуцированную тромбином, и не влияет на коагуляционный каскад или время кровотечения, не ингибирует агрегацию тромбоцитов, индуцированную АДФ, коллагеном, миметиками ТхА2 или агонистами PAR-4 [8].
Антагонисты тромбоксана ТхА2/PGH2:
Рецептор тромбоксана TхA2/PGH2 (TP) связан с белком G и отвечает на стимуляцию лиганда активацией фосфолипазы C с последующим увеличением концентраций инозитола с трифосфатами, диацилглицеролом и внутриклеточным Ca2+ [21]. Были разработаны эффективные и длительные (период полураспада более 20 часов) антагонисты TP, включая GR 32191, ифетробан (ifetroban) и сулотробан (sulotroban).
Ридогрель — комбинированный ингибитор тромбоксан А2-синтетазы и антагонист рецепторов к тромбоксану А2/эндопироксиду простагландина прошел испытания в исследовании RAPT (Ридогрель против аспирина в открытии коронарных артерий — Ridogrel Versus Aspirin Patency Trial) по сравнению с АСК у больных с острым инфарктом миокарда, которым вводили стрептокиназу. Ридогрель не улучшил раскрытие коронарных сосудов по данным ангиографии, но при ретроспективном анализе отмечено снижение частоты новых возникших ишемических приступов.
Тербогрель — другой препарат этой группы, является активным при пероральном применении ингибитором тромбоксана А2-синтетазы и антагонист рецепторов к тромбоксану А2. У большого количества пациентов его прием сопровождался резкой болью в нижних конечностях, что ограничивало клиническое применение [8].
1.2.4.Ингибиторы цАМФ фосфодиэстеразы:
Дипиридамол представляет собой производное пиримидо-пиримидина с вазодилатирующими и антитромбоцитарными свойствами. Известно два механизма антитромбоцитарного действия дипиридамола: первый связан с повышением содержания в тромбоцитах ц-АМФ за счет ингибирования фосфодиэстеразы — фермента, превращающего ц-АМФ в 51-АМФ, второй — с блокадой захвата аденозина и стимуляцией аденилатциклазного механизма тромбоцитов. Результаты исследований ESPS-2, ESPRIT показали эффективность комбинации дипиридамола (форма с модифицированным освобождением) и малых доз аспирина у больных с ишемической болезнью мозга. У коронарных больных с развитой коллатеральной сетью препарат может вызывать синдром обкрадывания, обусловленный его коронародилатирующим действием. Добавление дипиридамола к аспирину не привело к дополнительному снижению серьезных сосудистых осложнений в обзоре 25 исследований 10 тыс. пациентов с высоким риском [8].
1.3.Фибринолитики
Фибринолитики (активаторы плазминогена) переводят содержащийся в крови неактивный белок плазминоген в активный фермент плазмин, вызывающий лизис фибрина и разрушение недавно образовавшегося тромба (тромболизис) (таблица 6).
Таблица 6
Препараты этой группы не предупреждают дальнейшего тромбообразования, могут способствовать увеличению образования тромбина и усилению агрегации тромбоцитов [4].
Стрептокиназа - непрямой активатор плазминогена, получаемый из культуры -гемолитического стрептококка. Первоначально молекула стрептокиназы образует соединение с молекулой плазминогена, которая приобретает способность активировать другие молекулы плазминогена, как связанные с тромбом, так и циркулирующие в крови. В результате в плазме крови снижаются уровни фибриногена, плазминогена, ФСК V, VIII и возникает гипокоагуляция, сохраняющаяся некоторое время после прекращения введения препарата. Через несколько суток после однократного введения стрептокиназы в крови могут появиться антитела, способные сохраняться много лет.
Тканевой активатор плазминогена - сериновая протеаза, идентичная человеческому активатору плазминогена, синтезируемому эндотелием сосудов.
В настоящее время используется преимущественно одноцепочечная рекомбинантная молекула тканевого активатора плазминогена (алтеплаза). Алтеплаза обладает повышенным сродством к фибрину. Системное влияние этого фибринолитика намного менее выражено. Кроме того, по сравнению со стрептокиназой алтеплаза способна разрушать фибрин с более выраженными перекрестными связями, входящий в состав дольше существующих тромбов. Действию алтеплазы препятствуют ингибиторы активатора плазминогена. В отличие от стрептокиназы препарат не иммуногенен.
Тенектеплаза - производное алтеплазы, созданное с помощью генной инженерии за счет замены аминокислотных остатков в трех участках исходной молекулы. Это привело к увеличению фибринспецифичности и появлению устойчивости к влиянию ингибитора активатора плазминогена 1 типа [4].
Проурокиназа рекомбинантная - созданная с помощью генной инженерии модифицированная молекула нативной проурокиназы человека. Специфически взаимодействует со связанным с фибрином плазминогеном. В области тромба не угнетается ингибиторами, циркулирующими в плазме крови. Под воздействием плазмина одноцепочечная молекула проурокиназы превращается в более активную двухцепочечную молекулу урокиназы [4].
Сравнительные исследования эффективности антагонистов IIb/IIIa гликопротеиновых рецепторов тромбоцитов (Эптифибатид, Монафрам) и прямого ингибитора тромбина - Бивалирудина:
Эффективность антагонистов IIb/IIIa гликопротеиновых рецепторов при профилактике осложнений, ассоциирующихся с чрескожными вмешательствами, была документально подтверждена в многочисленных исследованиях, во многих из которых участвовали исключительно или в
значительной степени пациенты с нестабильной стенокардией/инфарктом миокарда [9].
Осуществлены 7 рандомизированных исследований, в которых блокаторы рецепторов гликопротеина IIb/IIIa систематически применяли в дополнение к ацетилсалициловой кислоте и «стандартному» нефракционированному гепарину у пациентов с острым коронарным синдромом (EPIC (Evaluation of 7E3 for the Prevention of Ischemic Complications), CAPTURE (Chimeric C7E3 Fab Antiplatelet Therapy in Unstable Refractory angina), EPILOG (Evaluation of PTCA to Improve Longterm Outcome by c7E3 GP IIb/IIIa Receptor Blockade), EPISTENT (Evaluation of Platelet IIb/ IIIa Inhibitor for Stenting), RESTORE (Randomized Efficacy Study of Tirofiban for Outcomes and REstenosis), IMPACT II (IMProving Asthma Control Trial), ESPRIT (European/Australasian Stroke Prevention in Reversible Ischaemia Trial).
В общем, их результаты свидетельствуют об умеренном, но достоверном снижении риска смерти или ИМ через 30 дней у пациентов с острым коронарным синдромом без стойкой элевации сегмента ST. Медикаментозная терапия блокаторами рецепторов гликопротеина IIb/IIIa в первые дни после поступления больного, после чего осуществляется перкутанное коронарное вмешательство или шунтирование коронарных артерий, достоверно снижает риск смерти или ИМ с 4,3 до 2,9% [10].
Эптифибатид изучался в исследовании PURSUIT, охватившем 10 948 пациентов, у которых отмечалась боль в грудной клетке в покое в течение предшествующих 24 ч и изменения ST— T либо повышение уровня MB-КФК (128). Изучаемый препарат был добавлен к стандартному лечению до выписки из стационара или на 72 ч, хотя пациентам с нормальными коронарными артериями или другими смягчающими обстоятельствами делались инфузии меньшей продолжительности. Инфузия могла быть продолжена еще на 24 ч, если вмешательство выполнялось ближе к концу
72-часового периода инфузии. Частота первичного исхода в виде смерти или нефатального инфаркта миокарда к 30-му дню снизилась с 15,7% до 14,2% в группе эптифибатида (СР 0,91, p = 0,042). В течение первых 96 ч был выявлен значительный лечебный эффект (9,1% против 7,6%, p = 0,01). Преимущества сохранялись к моменту последующего наблюдения через 6 мес. Эптифибатид был одобрен для лечения пациентов с острым коронарным синдромом (НС/ИМ БП ST), получающих фармакотерапию или подвергающихся ЧКВ. Обычно его дают вместе с АСК или гепарином [8].
Клиническая эффективность препарата Монафрам при коронарной ангиопластике высокого риска оценивалась в рамках второй и третьей фазы клинических испытаний. Испытания проводились в Российском кардиологическом научно-производственном комплексе, Российском научном центре хирургии РАМН, 3-ем Центральном военном клиническом госпитале им А.А. Вишневского и НИИ трансплантологии и искусственных органов. В исследование было включено 279 больных с ишемической болезнью сердца, которым проводилась ангиопластика высокого риска. Из них 153 пациентов, кроме стандартной терапии получали препарат Монафрам (0,25 мг/кг веса в виде болюса непосредственно перед проведением ангиопластики), а 126 не получали антагонистов ГП IIb-IIIa. Высокий риск тромботических осложнений у этих больных был обусловлен наличием острого коронарного синдрома (около 50% больных в обеих группах), осложненных стенозов (2 стеноза типа В или 1 стеноз типа С), сахарным диабетом (около 15% больных в обеих группах) и другими факторами. В качестве базовой антитромбоцитарной терапии все больные принимали аспирин, однако тиенопиридины (тиклопидин + клопидогрель) в группе Монафрама принимали лишь 44%, в то время как в контрольной группе 77% пациентов [11].
В течение 6 месяцев после проведения ангиопластики регистрировали следующие неблагоприятные исходы: смерть от сердечно-сосудистых причин, острый инфаркт миокарда и показания к экстренной реваскуляризации в связи с возвратом стенокардии. Монафрам достоверно снижал количество неблагоприятных исходов в течение первых 3 дней (на 89%), 1 месяца (на 71%) и 6 месяцев (на 44%) после КА (рис. 4).
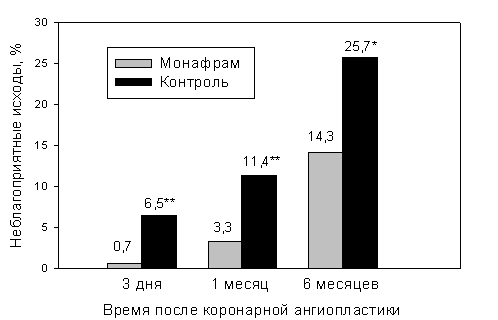
Рис. 4. Уменьшение количества неблагоприятных исходов при применении Монафрама у пациентов с ишемической болезнью сердца, которым проводилась коронарная ангиопластика высокого риска.
Таким образом, уменьшение частоты неблагоприятных исходов достигались, в основном, за счет снижения риска острых и подострых тромбозов в течение первого месяца после процедуры. Наблюдаемые различия проявились на фоне приема аспирина и более интенсивного использования тиенопиридинов в контрольной группе [11].
Бивалирудин (Ангиокс). При проведении плановых ЧКВ в исследовании REPLACE-2 было показано, что по сравнению со стандартной схемой введения НФГ в сочетании с блокатором IIb/IIIа рецепторов тромбоцитов эптифибатидом внутривенное введение бивалирудина в дозе 0,75 мг/кг с последующей инфузией во время ЧКВ в дозе 1,75 мг/кг сопровождалось снижением риска больших кровотечений Т1МI на 41 % (с 4,1 до 2,4%; р=0,001). При этом частота ишемических событий (смерть, инфаркт миокарда, экстренная реваскуляризация) достоверно не различались. Поэтому на сегодняшний день бивалирудин рекомендован в качестве альтернативного НФГ и эноксапарину антикоагулянта при проведении плановой (элективной) ЧКВ [12].
При выполнении ЧКВ у больных с острым коронарным синдромом без подъема сегмента ST монотерапия бивалирудином оказалась не менее эффективной и в то же время более безопасной, чем комбинированное применение НФГ и блокатора IIb/IIIa рецепторов тромбоцитов (исследование REPLACE-2 и исследование ACUITY) или эноксапарина в сочетании с блокатором IIb/IIIa рецепторов тромбоцитов (исследование ACUITY). В исследовании ACUITY, куда были включены 13 818 больных с острым коронарным синдромом без подъема сегмента ST умеренного либо высокого риска, монотерапия бивалирудином по сравнению с сочетанным применением НФГ/эноксапарина с блокатором IIb/IIIa рецепторов тромбоцитов к 30 дню наблюдения сопровождалась снижением риска больших кровотечений TIMI на 47% (р<0,001) при одинаковой частоте ишемических событий (смерть, инфаркт миокарда, экстренная реваскуляризация). Это обусловило «чистый клинический выигрыш» би-валирудина в 14%. Исходя из имеющихся данных, согласно последним международным рекомендациям по диагностике и лечению больных с острым коронарным синдромом без подъема сегмента ST, бивалирудин (наряду с НФГ) считается препаратом выбора при необходимости проведения безотлагательной ЧКВ у больных с острым коронарным синдромом без подъема сегмента ST [12].
Чрезвычайно интересными и важными оказались недавно (в 2008 г) опубликованные результаты применения бивалирудина в качестве антитромботической терапии при первичных ЧКВ у 3 602 больных с острым коронарным синдромом с подъемом сегмента ST, полученные в исследовании HORIZONS-AMI. Это исследование показало, что к 30-му дню наблюдения использование монотерапии бивалирудином при первичных ЧКВ у больных ОКС с подъемом сегмента ST сопровождается достоверным снижением на 42% (р= 0,0001) частоты больших кровотечений по сравнению с сочетанным применением НФГ и блокаторов IIb/IIIa рецепторов. При этом частота тяжелых сердечно-сосудистых осложнений (смерть от любых причин, инфаркт миокарда, повторная реваскуляризация, инсульт) достоверно не различалась, в результате «чистый клинический выигрыш» бивалирудина составил 24% (р=0,005). Учитывая эти результаты, нельзя исключить, что в следующих международных рекомендациях бивалирудин будет рассматриваться, как препарат выбора при проведении первичных ЧКВ у больных с острым коронарным синдромом с подъемом сегмента ST [12].
В исследовании ACUITY (Acute Catheterization and Urgent Intervention Triage Strategy) сравнивали эффективность 3 медикаментозных стратегий у больных с острым коронарным синдромом среднего и высокого риска, у большинства из которых проведено перкутанное коронарное вмешательство (56,3%) и шунтирование (11,1%). На 30-й день сравнивали частоту значительных коронарных событий (смерти от любой причины, ИМ или внеплановой реваскуляризации вследствие повторной ишемии) и частоту кровотечений на фоне применения нефракционированного гепарина или низкомолекулярных гепаринов в сочетании с ингибиторами гликопротеиновых рецепторов IIb/IIIa (1-я группа — 4603 больных); бивалирудин в сочетании с ингибиторами гликопротеиновых рецепторов IIb/IIIa (2-я группа — 4604 больных); только бивалирудин (4612 больных). Не выявлено разницы в частоте кардиальных осложнений во всех трех группах, но частота кровотечений была меньше у больных, получавших бивалирудин, в сравнении с 1-й группой (3,0% против 5,7%; р<0,001) [9].
Глава 2. Материалы и методы:
Ретроспективно проведен анализ 60 историй болезни пациентов, находившихся на стационарном лечении с июня по сентябрь 2013 года в отделении неотложной кардиологии с группой реанимации и интенсивной терапии РБ№2-ЦЭМП города Якутска с клиническим диагнозом: ИБС. Инфаркт миокарда. Из них - 48 лиц мужского пола и 12 женщин, средний возраст составил 58 лет.
Всем пациентам с высоким риском сердечно-сосудистых осложнений по экстренным показаниям в день поступления в стационар было выполнено ЧКВ, а именно коронарография со стентированием окклюзированных участков артерий с использованием антитромботических препаратов различных групп.
Все пациенты с учетом использованного при проведении ЧКВ антитромботического препарата были разделены на 3 равные группы: 1 группа (20 человек) - при проведении операции был использован прямой ингибитор тромбина Бивалирудин (Ангиокс) в зависимости от массы тела пациента, 2 группа (20 человек) - использовался ингибитор гликопротеиновых IIb/IIIa рецепторов тромбоцитов Монафрам и 3 группа (20 человек) - использовался ингибитор гликопротеиновых IIb/IIIa рецепторов тромбоцитов Эптифибатид (Интегрилин).
Клиническая характеристика на момент поступления в стационар у больных представлена в таблице 7.
Таблица 7
Клиническая характеристика пациентов:
|
Показатель
|
1 группа (n=20)
Бивалирудин
|
2 группа (n=20)
Монафрам
|
3 группа(n=20)
Интегрилин
|
|
Средний возраст, лет
|
57,9
|
60,7
|
59,4
|
|
Среднее САД, мм.рт.ст
|
129
|
138
|
134
|
|
Среднее ДАД, мм.рт.ст
|
81
|
81
|
79
|
|
Средний холестерин, ммоль/л
|
4,71
|
5,07
|
5,24
|
|
Средний ИМТ
|
27,5
|
27,1
|
28,1
|
|
Факторы риска:
|
абс.число
( n=20)
|
%
|
абс.число
( n=20)
|
%
|
абс.число
( n=20)
|
%
|
|
Артериальная гипертония
|
18
|
90
|
18
|
90
|
18
|
90
|
|
Гиперхолестеринемия (>4ммоль/л)
|
8
|
40
|
10
|
50
|
12
|
60
|
|
Курение
|
15
|
75
|
11
|
55
|
11
|
55
|
|
Нарушение углеводного обмена ( СД, НТГ)
|
1
|
5
|
1
|
5
|
2
|
10
|
|
ИМТ> 30 кг/м2
|
5
|
25
|
5
|
25
|
5
|
25
|
Пациенты трех групп по показателям ОХС, САД, ДАД, ИМТ и факторам риска ССЗ не различались.
В таблице 8 представлены соотношения Q-позитивного и Q-негативного инфаркта миокарда у исследуемых пациентов по группам, а также наличие в анамнезе у них ПИКС.
Таблица 8
|
Показатель
|
1 группа (n=20)
Бивалирудин
|
2 группа (n=20)
Монафрам
|
3 группа(n=20)
Эптифибатид
|
|
|
абс.число
( n=20)
|
%
|
абс.число
( n=20)
|
%
|
абс.число
( n=20)
|
%
|
|
Q (+) ИМ
|
17
|
85
|
14
|
70
|
12
|
60
|
|
Q (-) ИМ
|
3
|
15
|
6
|
30
|
8
|
40
|
|
ПИКС в анамнезе
|
5
|
25
|
1
|
5
|
6
|
30
|
С Q-позитивным инфарктом миокарда было больше пациентов в 1 группе (Бивалирудин) – 85% (17 больных), с Q-негативным инфарктом миокарда – в 3 группе (Эптифибатид) 40% (8 больных). ПИКС в анамнезе был зарегистрирован больше в 3 группе (Эптифибатид) - 30% и 1 группе (Бивалирудин) – 25%.
Для каждого пациента до операции по шкале CRUSADE (таблица 9) был проведен расчет риска кровотечения и частота кровотечений при разных уровнях риска (таблица 10), учитывалось наличие факторов риска геморрагических осложнений после проведения ЧКВ как язвенная болезнь желудка в анамнезе, повышенный риск кровотечения из-за врожденных или приобретенных нарушений гемостаза в виде тромбоцитопении, тяжелой
неконтролируемой артериальной гипертензии, тяжелой хронической почечной недостаточности (скорость клубочковой фильтрации <30 мл/мин).
Таблица 9
Шкала оценки риска кровотечений CRUSADE:
|
Показатель
|
Интервал значений
|
баллы
|
|
Исходный гематокрит %
|
< 31
|
9
|
|
|
31 - 33,9
|
7
|
|
|
34 - 36,9
|
3
|
|
|
37 - 39,9
|
2
|
|
|
40
|
0
|
|
Клиренс
креатинина
|
15
|
39
|
|
|
> 15 – 30
|
35
|
|
|
> 30- 60
|
28
|
|
|
> 60 – 90
|
17
|
|
|
> 90- 120
|
7
|
|
|
> 120
|
0
|
|
Частота сердечных сокращений
( уд/ мин )
|
70
|
0
|
|
|
71 – 80
|
1
|
|
|
81 - 90
|
3
|
|
|
91 - 100
|
6
|
|
|
101 - 110
|
8
|
|
|
111 - 120
|
10
|
|
|
121
|
11
|
|
Пол
|
Мужской
|
0
|
|
|
женский
|
8
|
|
Предшествующие заболевания сосудов
|
Нет
|
0
|
|
|
да
|
6
|
|
Сахарный диабет
|
Нет
|
0
|
|
|
Да
|
6
|
|
Систолическое артериальное давление
(мм рт. ст.)
|
90
|
10
|
|
|
91 – 100
|
8
|
|
|
101 – 120
|
5
|
|
|
121 – 180
|
1
|
|
|
181 – 200
|
3
|
|
|
> 201
|
5
|
Таблица 10
Расчет риска кровотечения и частота кровотечений при разных уровнях риска (N):
|
Оценка риска
|
N
|
Диапазон
|
Кровотечения
|
|
Очень низкий
|
19,486
|
1 - 20
|
3.1%
|
|
Низкий
|
12,545
|
21 – 30
|
5.5%
|
|
Средний
|
11,530
|
31 – 40
|
8.6%
|
|
Высокий
|
10,961
|
41 – 50
|
11.9%
|
|
Очень высокий
|
15,210
|
51 - 91
|
19.5%
|
После расчета риска кровотечения на каждого больного была заполнена форма (таблица 11) – «Оценка риска кровотечения» у конкретного пациента по показателям кровотечения по шкале CRUSADE.
Таблица 11
Оценка риска кровотечения у пациента:
|
Оценка риска
|
ПОКАЗАТЕЛИ Кровотечения CRUSADE
|
ПОКАЗАТЕЛИ Кровотечения ДЛЯ КОНКРЕТНОГО ПАЦИЕНТА (УКАЗАТЬ)
|
|
Очень низкий
|
3.1%
|
|
|
Низкий
|
5.5%
|
|
|
Средний
|
8.6%
|
|
|
Высокий
|
11.9%
|
|
|
Очень высокий
|
19.5%
|
|
Проведен анализ использования других антитромботических препаратов (антикоагулянты: нефракционированный гепарин, фондапаринукс натрия, эноксапарин натрия; антиагреганты: ацетилсалициловая кислота, клопидогрель, тикагрелор).
В исследовании определяли наличие геморрагических осложнений в виде тромбоцитопении (подсчет тромбоцитов до и после ЧКВ), гипокоагуляционного синдрома (учитывались показатели коагулограммы: МНО, ПТИ, АЧТВ, тромбиновое время до и после ЧКВ), а также осложнения в виде наличия подкожной гематомы на месте пункции на второй день после операции и другие возникшие геморрагические осложнения.
Проведен фармако-экономический анализ лечения пациентов с инфарктом миокарда, которым было проведено экстренное ЧКВ: рассчитана средняя курсовая стоимость медикаментозного лечения одного пациента с инфарктом миокарда из каждой исследуемой группы с учетом затрат на проведение самой операции ЧКВ с использованием лекарственного покрытия до, во время и после операции (в 1 группе – Бивалирудин, во 2 группе – Монафрам, в 3 группе – Эптифибатид).
Глава 3. Результаты собственного исследования:
Оценка антитромбоцитарной терапии у больных с инфарктом миокарда, прошедших экстренное ЧКВ:
Нами проведен анализ применения антитромботических препаратов в стандартных дозах при лечении больных с ОИМ в зависимости от препарата, примененного при проведении ЧКВ (таблица 12 и рис.5).
Таблица 12
Использование антитромботических препаратов
при лечении ОИМ, %:
|
Антитромботические средства
|
1 группа n=20
|
2 группа
n=20
|
3 группа
n=20
|
|
Нефракционированный гепарин
|
50
|
75
|
90
|
|
Фондапаринукс натрия
|
95
|
100
|
80
|
|
Эноксапарин натрия
|
5
|
00
|
20
|
|
Ацетилсалициловая кислота
|
100
|
100
|
100
|
|
Клопидогрель (Зилт, Плавикс)
|
70
|
85
|
80
|
|
Тикагрелор (Брилинта)
|
30
|
15
|
20
|
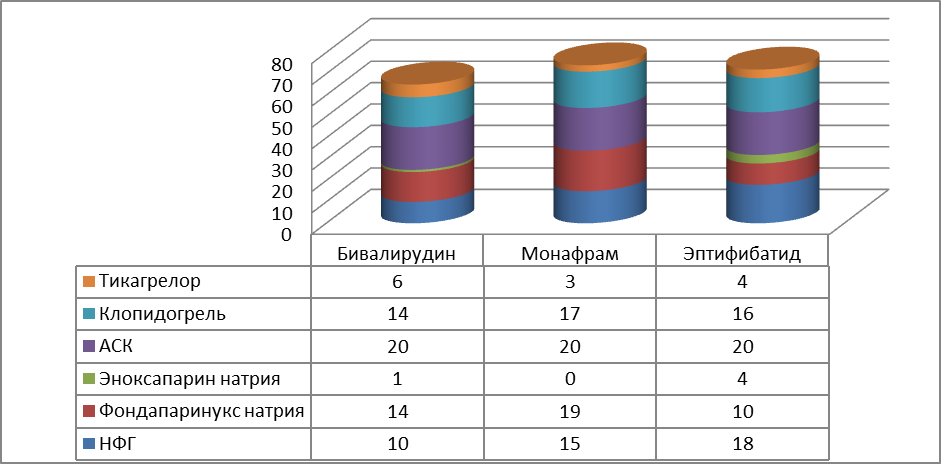
Рис.5. Использование антитромботических препаратов по группам (n=20).
Пациентам 2 группы – Монафрам и 3 группы - Эптифибатид (во 2 группе – 75%, в 3 группе – 90%) вводился нефракционированный гепарин в дозе 24 тыс. ЕД в/в до и после проведения ЧКВ в течении 24 часов. В 1 группе, где применялся Бивалирудин, у 50% больных НФГ был использован только до проведения ЧКВ в дозе 5-7 тыс. ЕД.
Во всех трех группах всем пациентам были назначены двойная антитромбоцитарная терапия (Ацетилсалициловая кислота в дозе 75-125 мг + Клопидогрель 75 мг или Ацетилсалициловая кислота в дозе 75-125 мг + Тикагрелор 180 мг/сут), и Фондапаринукс натрия.
Из антикоагулянтов практически во всех случаях ( у 55 пациентов из 60) использовался Фондапаринукс натрия (Арикстра) в дозе 2,5 мг/сут п/к, который избирательно связывается с антитромбином III, катализируя инактивацию им Ха фактора системы гемостаза и прерывая дальнейшее тромбообразование. В отличие от других препаратов гепарина, не инактивирует IIа и другие факторы свертывающей системы, не изменяет результатов таких коагуляционных тестов, как АЧТВ, МНО, не влияет на фибринолитическую активность и время кровотечения. У 5 пациентов из 60, особенно в 3 группе (Эптифибатид) – 20%, был использован низкомолекулярный гепарин - Клексан в суточной дозе 80 мг п/к (по 40 мг 2 раза в сутки). НМГ и Фондапаринукс натрия применяли в течении 7-8 суток.
Расчет риска кровотечений по шкале CRUSADE
у пациентов с ОИМ:
По исходному гематокриту, уровню СКФ, ЧСС, показателям САД, половой принадлежности, наличию признаков застойной сердечной недостаточности, сахарного диабета 2 типа, наличию в анамнезе предшествующих ССЗ проведен расчет риска кровотечения для каждого пациента до операции по шкале CRUSADE (таблица 13 и рис.6):
Таблица 13
Результаты оценки риска кровотечения по шкале CRUSADE
у пациентов с ОИМ, %:
|
Диапазон баллов
|
Оценка риска
|
1 группа (Бивалирудин)
n=20
|
2 группа (Монафрам)
n=20
|
3 группа (Эптифибатид)
n=20
|
|
1-20
|
Очень низкий
|
45
|
25
|
15
|
|
21-30
|
Низкий
|
20
|
25
|
20
|
|
31-40
|
Средний
|
20
|
15
|
30
|
|
41-50
|
Высокий
|
15
|
15
|
25
|
|
51-91
|
Очень высокий
|
0
|
20
|
10
|
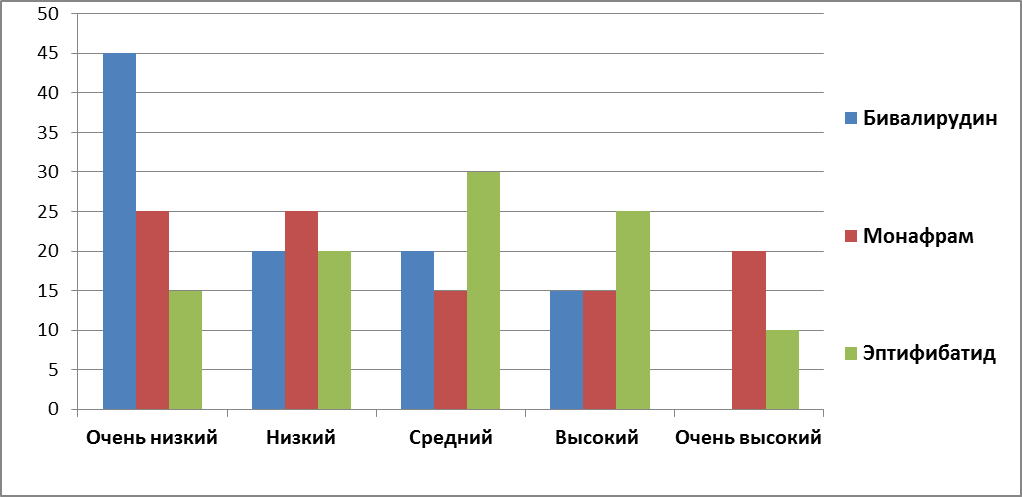
Рис.6. Риск кровотечения у пациентов с ОИМ в зависимости от применения антитромботического препарата.
- В 1 группе (Бивалирудин) пациентов с очень высоким риском кровотечения по шкале CRUSADE (19,5%) не было, а высокий риск кровотечения (11,9%) зарегистрирован лишь у 15% пациентов, несмотря на доказанную эффективность бивалирудина при проведении ЧКВ у больных с ОИМ именно с очень высоким и высоким риском кровотечения. Пациентов со средним риском кровотечения (8,6%) в данной группе было 4 (20%). И большинство пациентов – 13 человек (65%) были с низким (5,5%) и очень низким (3,1%) риском кровотечения.
- Во 2 группе (Монафрам) очень высокий риск кровотечения по шкале CRUSADE (19,5%) зарегистрирован у 20% пациентов, высокий риск (11,9%) – у 15%. Средний риск кровотечения (8,6%) в данной группе отмечался у 3 пациентов (15%). И половина пациентов – 10 человек (50%) были с низким (5,5%) и очень низким (3,1%) риском кровотечения.
- В 3 группе (Эптифибатид) у 35% пациентов зарегистрирован очень высокий и высокий риск кровотечения по шкале CRUSADE: у 10% пациентов очень высокий риск (19,5%) и у 25% - высокий риск (11,9%). Пациентов со средним риском кровотечения (8,6%) было 30%, то есть у 6 пациентов из 20. Низкий (5,5%) и очень низкий (3,1%) риск кровотечения был зарегистрирован лишь у 7 пациентов (35%).
Таким образом, полученные результаты приводят к следующим выводам:
- Риск кровотечения по шкале CRUSADE у большинства пролеченных пациентов соответствовал очень низкому, низкому и среднему.
- Большинство пациентов с высоким и очень высоким риском были зарегистрированы во 2 (Монафрам) и 3 (Эптифибатид) группах.
Определение геморрагических осложнений после проведения ЧКВ у больных с инфарктом миокарда:
Проведенная оценка наличия факторов риска геморрагических осложнений у пациентов с ОИМ, которым было проведено экстренное ЧКВ показана в таблице 14, в рис.7,8,9 представлены факторы риска геморрагических осложнений по группам.
Таблица 14
Наличие факторов риска геморрагических осложнений у пациентов с ОИМ, получивших ЧКВ, %:
|
Критерии
|
1 группа Бивалирудин
n=20
|
2 группа Монафрам
n=20
|
3 группа Эптифибатид
n=20
|
|
Повышенный риск кровотечения из-за врожденных или приобретенных нарушений гемостаза (тромбоцитопения)
|
10
|
5
|
5
|
|
Тяжелая неконтролируемая артериальная гипертензия
|
5
|
5
|
5
|
|
Тяжелая почечная недостаточность (СКФ <30 мл/мин), в том числе у пациентов находящихся на гемодиализе
|
---
|
---
|
---
|
|
Наличие в анамнезе язвенной болезни
|
10
|
5
|
10
|
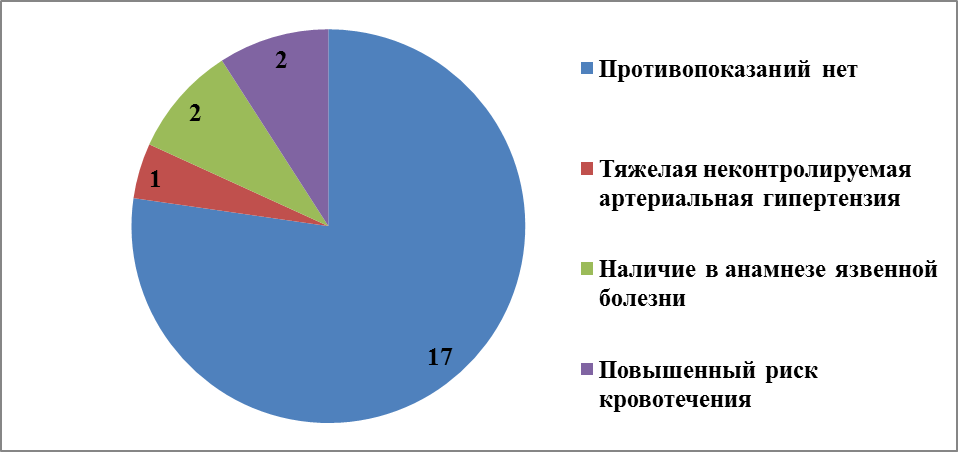
Рис.7. Факторы риска геморрагических осложнений у пациентов с ОИМ, получивших Бивалирудин при проведении ЧКВ.
У проанализированных больных, согласно таблице 15 и рис.5, в 1 группе (Бивалирудин) язвенная болезнь желудка в анамнезе отмечена у 2 пациентов (10%), тяжелая неконтролируемая артериальная гипертензия до проведения ЧКВ – у 1 пациента (5%), повышенный риск кровотечения из-за врожденных или приобретенных нарушений гемостаза в виде тромбоцитопении – у 2 пациентов (10%). Тяжелая почечная недостаточность (СКФ <30 мл/мин), в том числе у пациентов находящихся на гемодиализе не была зарегистрирована.
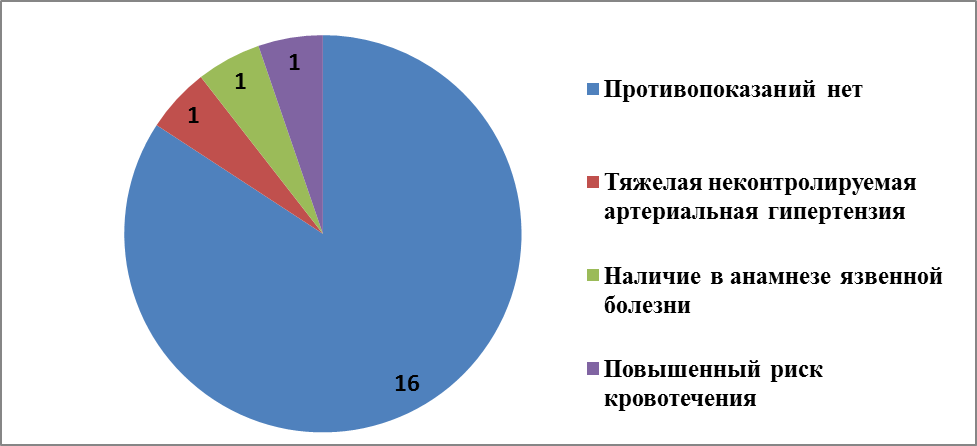
Рис.8. Факторы риска геморрагических осложнений у пациентов с ОИМ, получивших Монафрам при проведении ЧКВ.
Во 2 группе пациентов (Монафрам), согласно таблице 15 и рис.6, язвенная болезнь желудка в анамнезе, тяжелая неконтролируемая артериальная гипертензия до проведения ЧКВ, повышенный риск кровотечения из-за врожденных или приобретенных нарушений гемостаза в виде тромбоцитопении зарегистрированы по 1 пациенту (5%). Тяжелая почечная недостаточность (СКФ <30 мл/мин), в том числе у пациентов находящихся на гемодиализе не была зарегистрирована, как и в 1 группе.
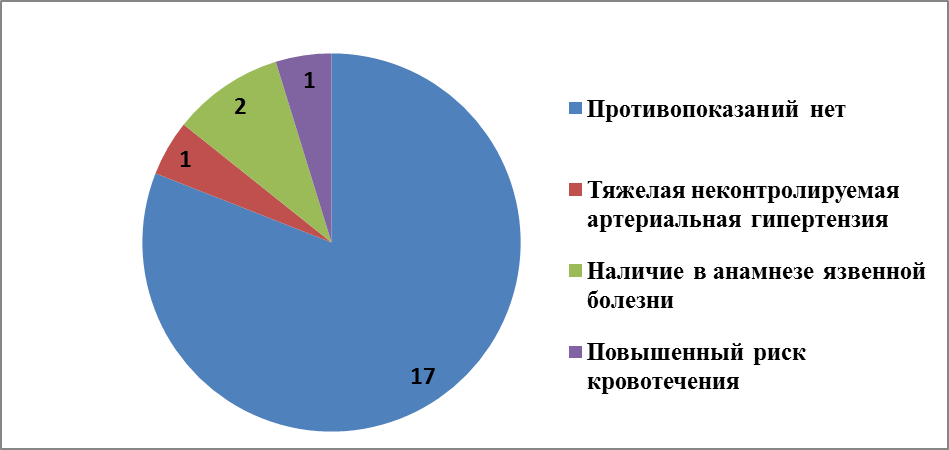
Рис.9. Факторы риска геморрагических осложнений у пациентов с ОИМ, получивших Эптифибатид при проведении ЧКВ.
По данным таблицы 15 и рис.7, в 3 группе пациентов (Эптифибатид) язвенная болезнь желудка в анамнезе была зарегистрирована у 2 пациентов (10%); повышенный риск кровотечения из-за врожденных или приобретенных нарушений гемостаза в виде тромбоцитопении и тяжелая неконтролируемая артериальная гипертензия до проведения ЧКВ отмечены по 1 пациенту (5%). Тяжелая почечная недостаточность (СКФ <30 мл/мин), в том числе у пациентов находящихся на гемодиализе не была зарегистрирована, как и в остальных группах.
Таким образом, полученные результаты приводят к следующим выводам:
- повышенный риск кровотечения из-за приобретенных нарушений
гемостаза в виде тромбоцитопении до проведения ЧКВ имели в 1 группе (Бивалирудин) - 10% пациентов, во 2 (Монафрам) и 3 (Эптифибатид) группах – по 5% пациентов. Соответственно, у данных пациентов после проведения ЧКВ, также регистрировалась тромбоцитопения.
- тяжелая неконтролируемая артериальная гипертензия до проведения ЧКВ отмечена по 1 пациенту (5%) в каждой исследуемой группе.
- язвенная болезнь желудка в анамнезе была зарегистрирована в 1 группе (Бивалирудин) и 3 группе (Эптифибатид) у 2 пациентов (10%) в каждой группе; во 2 группе (Монафрам) был отмечен 1 пациент (5%).
- тяжелая почечная недостаточность (СКФ <30 мл/мин), в том числе у пациентов находящихся на гемодиализе не была зарегистрирована ни в одной из исследуемых групп.
В таблице 15, рис.10 представлены наличие и отсутствие геморрагических осложнений у пациентов с ОИМ после проведения экстренного ЧКВ, %.
Таблица 15
Геморрагические осложнения (и/или их отсутствие), возникшие после проведения ЧКВ у пациентов с ОИМ, %:
|
осложнения
|
1 группа
n=20
|
2 группа
n=20
|
3 группа
n=20
|
|
Тромбоцитопения всего, из них:
PLT>100*109/л
PLT 100-140*109/л
PLT 140-180*109/л
|
15
--
15
--
|
50
15
15
20
|
15
--
--
15
|
|
Гипокоагуляция
|
15
|
5
|
15
|
|
Подкожная гематома на месте пункции
|
15
|
20
|
20
|
|
Другие (указать какие)
|
---
|
острый тромбоз стента-5, дистальный тромбоз берцовых артерий-5 постгеморр анемия-5 дистальная тромботическая эмболизация ЗБВ ПКА-5.
|
желудочное кровотечение-10,
частично тромбированная псевдоаневризма ОБА- 5.
|
|
Нет осложнений
|
60
|
35
|
50
|
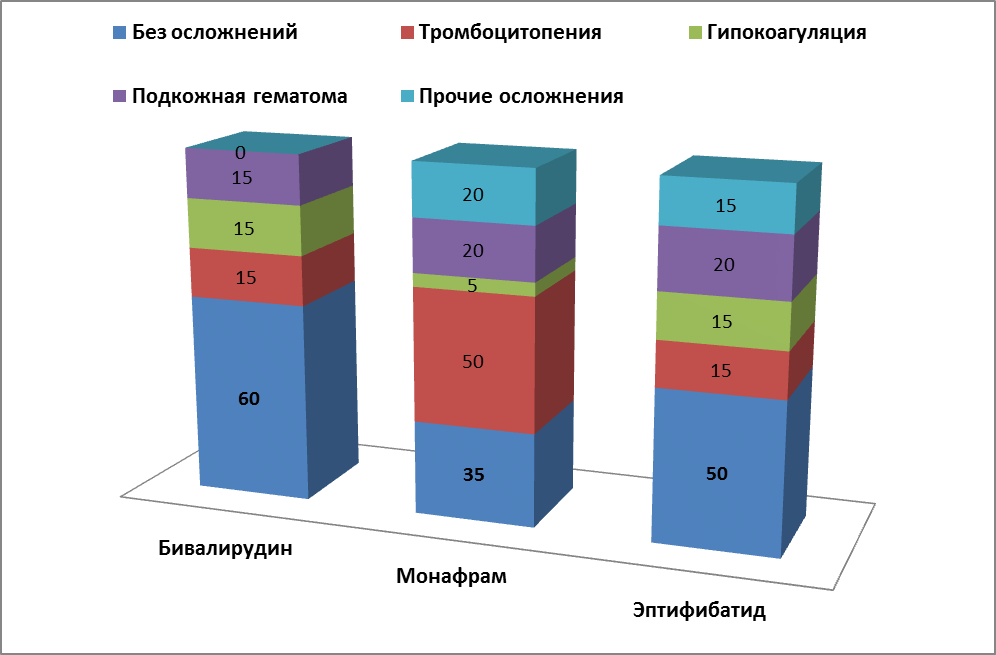
Рис.10. Геморрагические осложнения после ЧКВ в зависимости от примененного антитромботического препарата.
По данным анализа геморрагических осложнений (таблица 15, рис.10) в 1 группе пациентов, получавших Бивалирудин, после проведения ЧКВ у 60% пациентов отсутствовали геморрагические осложнения, у 15% пациентов имело место наличие осложнений в виде тромбоцитопении в диапазоне 100-140*109/л, причем у 2 пациентов (10%) регистрировалась тромбоцитопения до проведения ЧКВ в диапазоне 140-180*109/л; гипокоагуляционный синдром и наличие подкожной гематомы на месте пункции в послеоперационном периоде была отмечена у 15% пациентов, при этом гипокоагуляционный синдром у 1 пациента (5%) был отмечен до проведения операции, и в 1 случае (5%) гипокоагуляционный синдром и подкожная гематома имели место у одного и того же пациента.
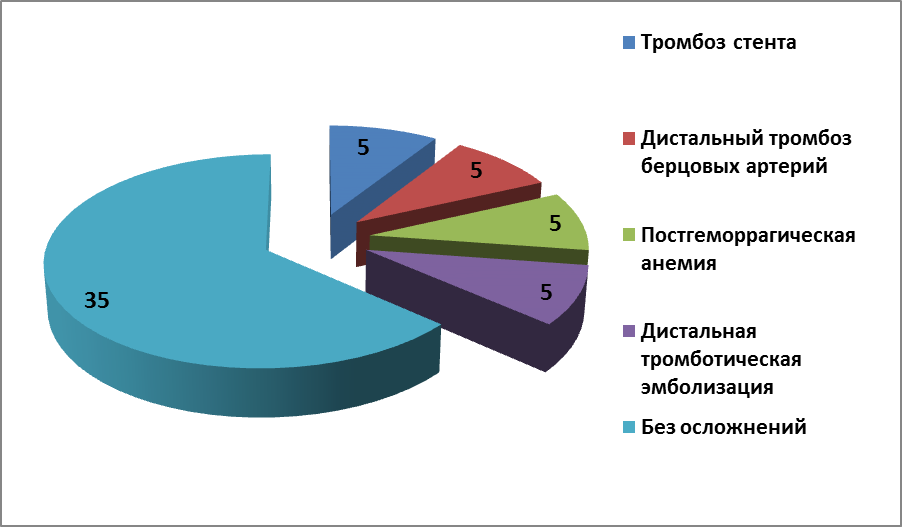
Рис.11. Другие геморрагические осложнения после ЧКВ
в группе Монафрама.
Во 2 группе пациентов, получавших Монафрам ( согласно таблице 15, рис.10), после проведения ЧКВ у 35% пациентов отсутствовали геморрагические осложнения; у 50% пациентов зарегистрирована тромбоцитопения: в диапазоне >100*109/л и 100-140*109/л по 3 пациента (15%) и 140-180*109/л - у 4 пациентов (20%), причем у 1 пациента была отмечена тромбоцитопения до проведения ЧКВ в диапазоне 140-180*109/л; гипокоагуляционный синдром выявлен лишь у 5% пациентов, подкожная гематома на месте пункции в послеоперационном периоде – у 20%. Кроме вышеперечисленного имелись и другие осложнения в послеоперационном периоде (рис.11): тромбоз стента – 1 случай (5%), дистальный тромбоз берцовых артерий и постгеморрагическая анемия – 1 случай (5%), дистальная тромботическая эмболизация ЗБВ ПКА – 1 случай (5%). При этом надо отметить, что у 1 больного выявлены тромбоцитопения, подкожная гематома на месте пункции, постгеморрагическая анемия и при этом дистальный тромбоз берцовых артерий; у пациента с дистальной тромботической эмболизацией ЗБВ ПКА была отмечена тромбоцитопения.
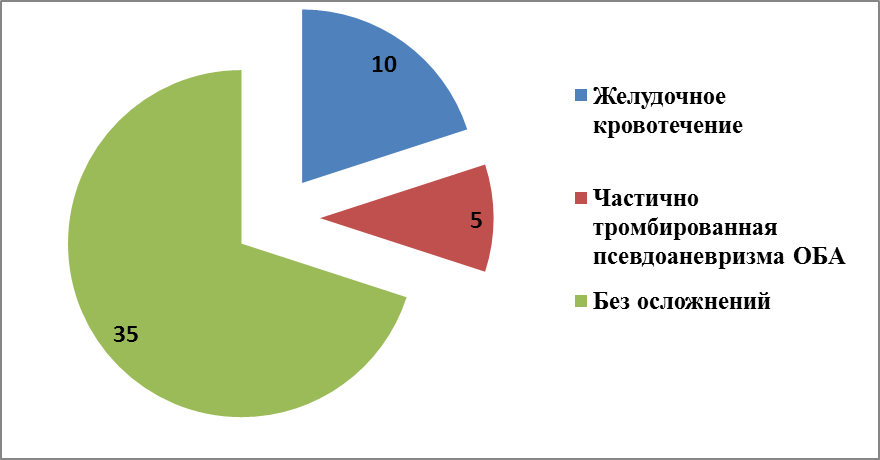
Рис.12. Другие геморрагические осложнения после ЧКВ
в группе Эптифибатида.
В 3 группе пациентов, получавших Эптифибатид после проведения ЧКВ у 50% пациентов отсутствовали геморрагические осложнения; у 15% пациентов зарегистрирован гипокоагуляционный синдром и тромбоцитопения в диапазоне 140-180*109/л, причем у 1 пациента – 5% тромбоцитопения была отмечена до проведения ЧКВ в диапазоне 140-180*109/л ); у 20% - определялась подкожная гематома на месте пункции в послеоперационном периоде. Определяются другие осложнения в послеоперационном периоде (рис.12): желудочное кровотечение – 2 случая (10%), частично тромбированная псевдоаневризма ОБА – 1 случай (5%). При этом стоит отметить, что желудочное кровотечение в обеих случаях произошла у пациентов с язвенной болезнью желудка в анамнезе на фоне гипокоагуляционного синдрома и оба пациента имели очень высокий риск кровотечения по шкале CRUSADE; у пациента с частично тромбированной псевдоаневризмой ОБА была отмечена тромбоцитопения до и после операции.
Оценка риска кровотечений по шкале CRUSADE у пациентов, у которых в послеоперационном периоде отмечались осложнения в виде тромбоцитопении, гипокоагуляционного синдрома, подкожной гематомы на месте пункции и других представлена в рис.13 и в среднем составила: в 1 группе (Бивалирудин) – 7,6% (соответственно относится к низкому риску по шкале CRUSADE), во 2 группе (Монафрам) – 7,7% (низкий риск), в 3 группе (Эптифибатид) – 9,2% (средний риск кровотечения).
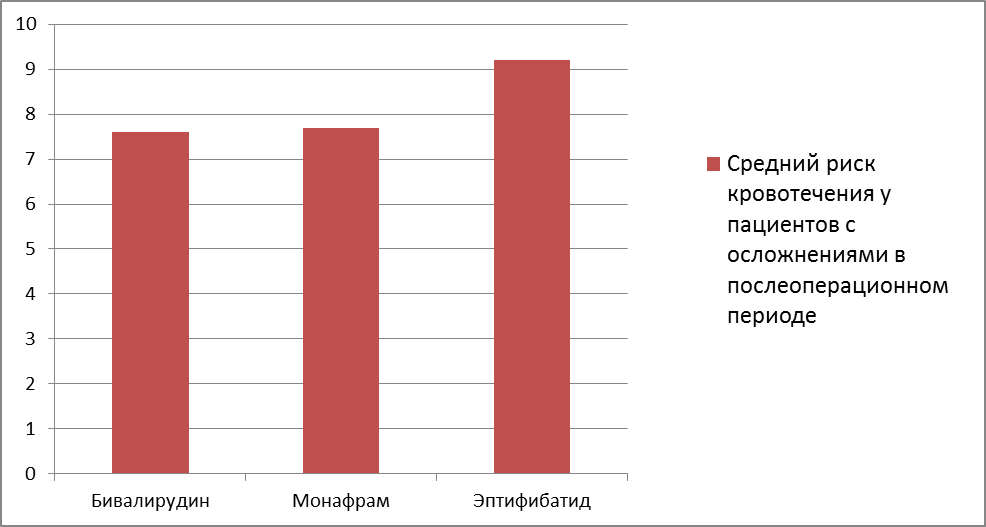
Рис.13. Средний риск кровотечения у пациентов с послеоперационными осложнениями.
Изначальный риск кровотечения у пациентов, имевших более серьезные осложнения после ЧКВ во 2 группе (Монафрам) представлен в рис.14. Выяснилось, что пациент с острым тромбозом стента и пациент с дистальным тромбозом берцовых артерий и постгеморрагической анемией имели низкий риск кровотечения по шкале CRUSADE (5,5%); пациент с дистальной тромботической эмболизацией ЗБВ ПКА имел высокий риск кровотечения (11,9%).
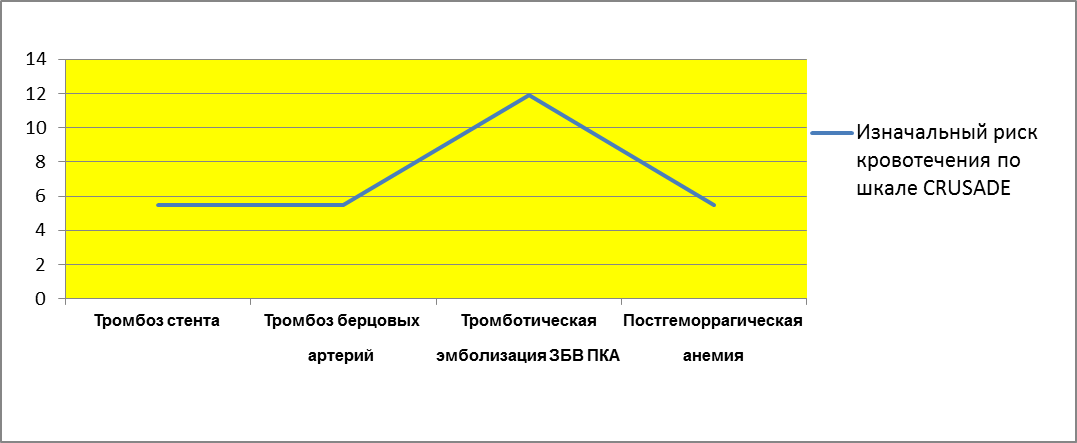
Рис.14. Изначальный риск кровотечения по шкале CRUSADE у пациентов с послеоперационными осложнениями в группе Монафрама.
В 3 группе (Эптифибатид) изначальный риск кровотечения у пациентов, имевших более серьезные осложнения после ЧКВ, по рис.15 выглядит таким образом: пациент с частично тромбированной псевдоаневризмой ОБА имел низкий риск кровотечения по шкале CRUSADE (5,5%); 2 пациента с желудочным кровотечением имели высокий риск (11,9%) и очень высокий риск кровотечения (19,5%) по шкале CRUSADE.
Рис.15. Изначальный риск кровотечения по шкале CRUSADE у пациентов с послеоперационными осложнениями в группе Эптифибатида.
Фармако-экономический анализ на примере больных с инфарктом миокарда в зависимости от применения антитромботических препаратов:
Для фармако-экономической оценки лечения пациентов с инфарктом миокарда, которым было проведено экстренное ЧКВ, проведен расчет курсового медикаментозного лечения с учетом затрат на проведение ЧКВ с использованием лекарственного покрытия до, во время и после операции. Изучена средняя стоимость лечения на 1 пациента из каждой исследуемой группы. При данном расчете выбраны пациенты, которым при ЧКВ было проведено стентирование пораженной артерии с использованием двух коронарных баллонорасширяемых стентов с лекарственным покрытием (DES-стенты).
Пациент Г., 46 лет. Находился в ОНК РБ№2-ЦЭМП с клиническим диагнозом:
- Основной: ИБС. Q-позитивный инфаркт миокарда задне-нижней локализации, подострая стадия. Состояние после СКАГ с ТБКА со стентированием с/3 ПКА, с/3 ОА. Сложные нарушения ритма: пароксизм наджелудочковой тахикардии, желудочковая тахикардия. Одиночные полифокусные, биморфные желудочковые экстрасистолы. Одиночные полифокусные, мономорфные суправентрикулярные экстрасистолы. ППС: недостаточность АК 0-1 ст.
- Фон: Гипертоническая болезнь 3 стадии. Артериальная гипертензия 3 степени, риск ССО4.
- Осложнение основного: ХСН I стадии ФК I по NYHA.
По экстренным показаниям проведено ЧКВ: СКАГ. Стентирование с/3 ПКА. Реканализация ОА. ТБКА со стентированием с/3 ОА с использованием прямого ингибитора тромбина – Бивалирудина по схеме. Риск кровотечения у данного пациента по шкале CRUSADE – 3,1% (очень низкий), послеоперационный период протекал без геморрагических осложнений.
Общая стоимость медикаментозного лечения за весь период стационарного лечения, включая прикрытие во время операции антитромботическим препаратом Бивалирудин, представлена в таблице 16, стоимость расходов на операцию – в таблице 17.
Таблица 16
Стоимость лечения больного Г. с ОИМ по стандарту:
Таблица 17
Стоимость оперативного вмешательства (ЧКВ) у больного Г. с ОИМ:
|
Наименование
|
Един.измерения
|
Цена
|
Потребность на 1-го пац
|
Сумма
|
|
Шприц медицинский инъекционный однократного применения
|
шт
|
2,55
|
2
|
5,10
|
|
Электроды накожные для регистрации ЭКГ
|
шт
|
4,40
|
1
|
4,40
|
|
Катетер кубитальный для внутривенных вливаний
|
шт
|
29,33
|
1
|
29,33
|
|
Заглушки для кубитального катетера
|
шт
|
6,43
|
1
|
6,43
|
|
Кран перфузионный
|
шт
|
23,44
|
1
|
23,44
|
|
Система перфузионная для переливания растворов
|
шт
|
7,25
|
1
|
7,25
|
|
Пеленка впитывающая стерильная
|
шт
|
18,43
|
1
|
18,43
|
|
Проводниковый катетер для левой коронарной артерии JL
|
шт
|
8000
|
1
|
8000
|
|
Проводниковый катетер для правой коронарной артерии JR
|
шт
|
8000
|
1
|
8000
|
|
Проводник коронарный
|
шт
|
4805,76
|
2
|
9611,52
|
|
Устройство для вращения коронарного проводника
|
шт
|
1320
|
2
|
2640,0
|
|
Игла проводниковая ангиографическая
|
шт
|
259,29
|
2
|
518,58
|
|
Индефлятор
|
шт
|
2827,33
|
1
|
2827,33
|
|
Катетер баллонный коронарный
|
шт
|
13418,19
|
1
|
13418,19
|
|
Стент коронарный баллоннорасширяемый с лекарственным покрытием
|
шт
|
58595
|
2
|
117190,00
|
|
Интродьюсер 6F
|
шт
|
761,2
|
2
|
1522,40
|
|
Материал шовный плетеныйнерассасывающийся (нить хирургическая)
|
шт
|
47,3
|
1
|
47,30
|
|
Итого (руб.)
|
163869,70
|
Общая стоимость лечения = 208436,60 руб.
Пациент Д., 53 года. Находился в ОНК РБ№2-ЦЭМП с клиническим диагнозом:
- Основной: ИБС. Q-позитивный нижний инфаркт миокарда, стадия рубцевания. Состояние после ТБКА со стентированием ПКА DES-стентом XIENCE V с/3 2.75х18мм, п/3 3.0х18мм. Стеноз ПНА ЛКА 40%, ВТК 1 стеноз с/3 70%.
- Фон: Гипертоническая болезнь III стадии. Артериальная гипертензия I степени. Риск ССО 4. ГЛЖ. Дислипидемия 2А тип.
- Осложнение основного: ХСН IIА стадии II ФК по NYНA.
При поступлении проведено экстренное ЧКВ: Коронарная ангиография. Тромбоэкстракция. Стентирование п/3, с/3 ПКА с использованием ингибитора гликопротеинов– Монафрама по схеме. Риск кровотечения у данного пациента по шкале CRUSADE – 3,1% (очень низкий), послеоперационный период протекал без геморрагических осложнений.
Общая стоимость медикаментозного лечения за весь период стационарного лечения, включая прикрытие во время операции антитромботическим препаратом Монафрам, представлена в таблице 18, стоимость расходов на операцию – в таблице 19.
Таблица 18
Стоимость лечения больного Д. с ОИМ по стандарту:
Таблица 19
Стоимость оперативного вмешательства (ЧКВ) у больного Д. с ОИМ:
|
Наименование
|
Един.измерения
|
Цена
|
Потребность на 1-го пац
|
Сумма
|
|
Шприц медицинский инъекционный однократного применения
|
шт
|
2,55
|
2
|
5,10
|
|
Электроды накожные для регистрации ЭКГ
|
шт
|
4,40
|
1
|
4,40
|
|
Катетер кубитальный для внутривенных вливаний
|
шт
|
29,33
|
1
|
29,33
|
|
Заглушки для кубитального катетера
|
шт
|
6,43
|
1
|
6,43
|
|
Кран перфузионный
|
шт
|
23,44
|
1
|
23,44
|
|
Система перфузионная для переливания растворов
|
шт
|
7,25
|
1
|
7,25
|
|
Пеленка впитывающая стерильная
|
шт
|
18,43
|
1
|
18,43
|
|
Проводниковый катетер для правой коронарной артерии JR
|
шт
|
8000
|
2
|
16000
|
|
Проводник коронарный
|
шт
|
4805,76
|
2
|
9611,52
|
|
Устройство для вращения коронарного проводника
|
шт
|
1320
|
2
|
2640,0
|
|
Игла проводниковая ангиографическая
|
шт
|
259,29
|
2
|
518,58
|
|
Индефлятор
|
шт
|
2827,33
|
1
|
2827,33
|
|
Катетер для мануальной тромбоаспирации
|
шт
|
21157
|
1
|
21157,00
|
|
Катетер баллонный коронарный
|
шт
|
13418,19
|
1
|
13418,19
|
|
Стент коронарный баллоннорасширяемый с лекарственным покрытием
|
шт
|
58595
|
2
|
117190,00
|
|
Интродьюсер 6F
|
шт
|
761,2
|
2
|
1522,40
|
|
Материал шовный плетеныйнерассасывающийся (нить хирургическая)
|
шт
|
47,3
|
1
|
47,30
|
|
Итого (руб.)
|
185026,70
|
Общая стоимость лечения = 226609,56 руб.
3. Пациент Р., 53 года. Находился в ОНК РБ№2-ЦЭМП с клиническим диагнозом:
- Основной: ИБС. Q-позитивный переднебоковой инфаркт миокарда, подострая стадия. Суправентрикулярная экстрасистолия. Состояние после ТБКА со стентированием д/3 ПКА (DES-стентом Xience №2 - 4.0x15mm). Нарушения ритма и проводимости по типу одиночных полифокусных, биморфных желудочковых экстрасистол. Одиночные полифокусные, мономорфные суправентрикулярные экстрасистолы.
- Фон: Гипертоническая болезнь III стадии. Аретриальная гипертензия 1 степени. Риск ССО 4.
- Осложнение основного: ХСН IIА стадии II ФК по NYНA.
При поступлении проведено экстренное ЧКВ: СКАГ. Стентирование д/3 ПКА с использованием ингибитора гликопротеинов – Эптифибатида по схеме. Риск кровотечения у данного пациента по шкале CRUSADE – 8,6% (средний), в послеоперационном периоде отмечалась тромбоцитопения.
Общая стоимость медикаментозного лечения за весь период стационарного лечения, включая прикрытие во время операции антитромботическим препаратом Эптифибатид (Интегрилин), представлена в таблице 20, стоимость расходов на операцию – в таблице 21.
Таблица 20
Стоимость лечения больного Р. с ОИМ по стандарту:
Таблица 21
Стоимость оперативного вмешательства (ЧКВ) у больного Р. с ОИМ:
|
Наименование
|
Един.измерения
|
Цена
|
Потребность на 1-го пац
|
Сумма
|
|
Шприц медицинский инъекционный однократного применения
|
шт
|
2,55
|
2
|
5,10
|
|
Электроды накожные для регистрации ЭКГ
|
шт
|
4,40
|
1
|
4,40
|
|
Катетер кубитальный для внутривенных вливаний
|
шт
|
29,33
|
1
|
29,33
|
|
Заглушки для кубитального катетера
|
шт
|
6,43
|
1
|
6,43
|
|
Кран перфузионный
|
шт
|
23,44
|
1
|
23,44
|
|
Система перфузионная для переливания растворов
|
шт
|
7,25
|
1
|
7,25
|
|
Пеленка впитывающая стерильная
|
шт
|
18,43
|
1
|
18,43
|
|
Проводниковый катетер для левой коронарной артерии JL
|
шт
|
8000
|
1
|
8000,00
|
|
Проводниковый катетер для правой коронарной артерии JR
|
шт
|
8000
|
1
|
8000,00
|
|
Проводник коронарный
|
шт
|
4805,76
|
2
|
9611,52
|
|
Устройство для вращения коронарного проводника
|
шт
|
1320
|
2
|
2640,00
|
|
Игла проводниковая ангиографическая
|
шт
|
259,29
|
2
|
518,58
|
|
Стент коронарный баллоннорасширяемый с лекарственным покрытием
|
шт
|
58595
|
2
|
117190,00
|
|
Интродьюсер 6F
|
шт
|
761,2
|
2
|
1522,40
|
|
Материал шовный плетеныйнерассасывающийся (нить хирургическая)
|
шт
|
47,3
|
1
|
47,30
|
|
Итого (руб.)
|
164388,28
|
Общая стоимость лечения = 183874,38 руб.
По результатам проведенного фармако-экономического расчета выявлено: в 1 группе (Бивалирудин) – расход на медикаментозное лечение 1 пациента, включая лекарственное прикрытие во время ЧКВ Бивалирудином, и расход на саму операцию в общей сумме составил 208436,60 руб.
Во 2 группе (Монафрам) - расход на медикаментозное лечение 1 пациента, включая лекарственное прикрытие во время ЧКВ препаратом Монафрам, и расход на саму операцию в общей сумме составил 226609,56 руб.
В 3 группе (Эптифибатид) - расход на медикаментозное лечение 1 пациента, включая лекарственное прикрытие во время ЧКВ менее дорогостоящим из трех препаратов Эптифибатидом, и расход на саму операцию в общей сумме составил 183874,38 руб.
Из полученных данных оказалось, что Эптифибатид, в качестве лекарственного прикрытия при проведении экстренного ЧКВ, является из трех препаратов самым экономически выгодным, так как расходы на лечение с его применением меньше, чем при использовании других антитромботических препаратов – Бивалирудина на 24562,22 руб и Монафрама на 42735,18 руб.
На втором месте по фармако-экономической выгоде стоит Бивалирудин: лечение данным препаратом на 18172,96 руб оказалось выгоднее лечения с использованием в качестве антитромбоцитарного прикрытия при ЧКВ Монафрама, хотя сам препарат «Монафрам» на 5185,58 руб дешевле, чем «Ангиокс» (Бивалирудин).
Однако по результатам отчета, проведенного в 2012 году российского фармако-экономического исследования «Сравнительная клинико-экономическая оценка сопроводительной антитромбоцитарной терапии при проведении ЧКВ с использованием Бивалирудина и комбинации НФГ с ингибиторами рецепторов IIb/IIIa», под руководством директора НИИ клинико-экономической экспертизы и фармакоэкономики РГМУ профессора В.В.Омельяновского, было выявлено, что в течение 1-го года проведения процедуры ЧКВ экономические издержки в случае использования бивалирудина выше на 38,44% (13.345 руб.) по сравнению с комбинацией НФГ + ингибиторы гликопротеиновых рецепторов IIb/IIIa, что связано с большими затратами на препарат, в течение последующих 2 лет за счет большей клинической эффективности бивалирудина экономические издержки сократятся на 24,83% (5.698 руб.); в целом за 3 года использование бивалирудина увеличит суммарные затраты лишь на 7.647 руб. в сравнении с НФГ + ингибиторы гликопротеиновых рецепторов IIb/IIIa, обеспечивая достоверно меньше количеств ближайших госпитализаций, отдаленных осложнений и смертности из-за развития больших кровотечений [13].
Если учитывать возможные отдаленные последствия использования комбинации НФГ + ингибиторы гликопротеиновых рецепторов IIb/IIIa в виде кровотечений, повторных госпитализаций в стационар и другие, еще рано говорить об их фармако-экономической выгоде, оценить ситуацию представляется возможным лишь при дальнейшем динамическом наблюдении за данными пациентами.
Заключение:
Ишемическая болезнь сердца, и в частности острый инфаркт миокарда, является основной причиной сердечно-сосудистых заболеваний, приводящей к высокой летальности и инвалидизации населения. Широкое внедрение таких технологий как тромболизис и ЧКВ, как свидетельствует опыт отечественного здравоохранения и зарубежных стран, приводит к существенному сокращению смертности от ОИМ. Появление новых лекарственных препаратов, последовательное совершенствование антитромботического лечения в острый период заболевания существенно снизили риск неблагоприятных исходов у больных острой формой ИБС.
В данной работе ретроспективно были изучены 60 историй болезни больных с ОИМ, которым по экстренным показаниям было проведено ЧКВ с использованием антритромботического препарата, и в зависимости от использованного препарата все 60 пациентов были разделены на 3 равные группы: 1 группа (20 человек) – использовался прямой ингибитор тромбина Бивалирудин (Ангиокс), 2 группа (20 человек) - использовался ингибитор гликопротеиновых IIb/IIIa рецепторов тромбоцитов Монафрам и 3 группа (20 человек) - использовался ингибитор гликопротеиновых IIb/IIIa рецепторов тромбоцитов Эптифибатид (Интегрилин). Пациенты трех групп по возрастным критериям, показателям ОХС, САД, ДАД, ИМТ и факторам риска ССЗ не различались.
Из трех групп с Q-позитивным инфарктом миокарда было больше пациентов в 1 группе (Бивалирудин) – 85% (17 больных), с Q-негативным инфарктом миокарда – в 3 группе (Эптифибатид) 40% (8 больных). ПИКС в анамнезе был зарегистрирован чаще в 3 группе (Эптифибатид) - 30% и 1 группе (Бивалирудин) – 25%.
Пациентам 2 группы – Монафрам и 3 группы - Эптифибатид (во 2 группе – 75%, в 3 группе – 90%) вводился нефракционированный гепарин в дозе 24 тыс. ЕД в/в до и после проведения ЧКВ в течении 24 часов.
В 1 группе, где применялся Бивалирудин, у 50% больных НФГ был использован только до проведения ЧКВ в дозе 5-7 тыс. ЕД.
Во всех трех группах всем пациентам были назначены двойная антитромбоцитарная терапия (Ацетилсалициловая кислота в дозе 75-125 мг + Клопидогрель 75 мг или Ацетилсалициловая кислота в дозе 75-125 мг + Тикагрелор 180 мг/сут). Из антикоагулянтов практически во всех случаях ( у 55 пациентов из 60) использовался Фондапаринукс натрия (Арикстра) в дозе 2,5 мг/сут п/к, и у 5 пациентов из 60, особенно в 3 группе (Эптифибатид) – 20%, был использован низкомолекулярный гепарин - Клексан в суточной дозе 80 мг п/к (по 40 мг 2 раза в сутки). НМГ и Фондапаринукс натрия применяли в течении 7-8 суток.
По исходному гематокриту, уровню СКФ, ЧСС, показателям САД, половой принадлежности, наличию признаков застойной сердечной недостаточности, сахарного диабета 2 типа, наличию в анамнезе предшествующих ССЗ проведен расчет риска кровотечения для каждого пациента до операции по шкале CRUSADE.
- В 1 группе (Бивалирудин) пациентов с очень высоким риском кровотечения по шкале CRUSADE (19,5%) не было, а высокий риск кровотечения (11,9%) зарегистрирован лишь у 15% пациентов, несмотря на доказанную эффективность бивалирудина при проведении ЧКВ у больных с ОИМ именно с очень высоким и высоким риском кровотечения. Пациентов со средним риском кровотечения (8,6%) в данной группе было 4 человека (20%). И большинство пациентов – 13 человек (65%) были с низким (5,5%) и очень низким (3,1%) риском кровотечения.
- Во 2 группе (Монафрам) очень высокий риск кровотечения по шкале CRUSADE (19,5%) зарегистрирован у 20% пациентов, высокий риск (11,9%) – у 15%. Средний риск кровотечения (8,6%) в данной группе отмечался у 3 пациентов (15%). И половина пациентов – 10 человек (50%) были с низким (5,5%) и очень низким (3,1%) риском кровотечения.
- В 3 группе (Эптифибатид) у 35% пациентов зарегистрирован очень высокий и высокий риск кровотечения по шкале CRUSADE: у 10% пациентов очень высокий риск (19,5%) и у 25% - высокий риск (11,9%). Пациентов со средним риском кровотечения (8,6%) было 30%, то есть у 6 пациентов из 20. Низкий (5,5%) и очень низкий (3,1%) риск кровотечения был зарегистрирован лишь у 7 пациентов (35%).
Повышенный риск кровотечения из-за приобретенных нарушений
гемостаза в виде тромбоцитопении до проведения ЧКВ имели в 1 группе (Бивалирудин) - 10% пациентов, во 2 (Монафрам) и 3 (Эптифибатид) группах – по 5% пациентов. Соответственно, у данных пациентов после проведения ЧКВ, также регистрировалась тромбоцитопения. Тяжелая неконтролируемая артериальная гипертензия до проведения ЧКВ отмечена по 1 пациенту (5%) в каждой исследуемой группе. Язвенная болезнь желудка в анамнезе была зарегистрирована у 2 пациентов (10%) в 1 группе (Бивалирудин) и 3 группе (Эптифибатид); во 2 группе (Монафрам) была отмечена у 1 пациента (5%). Тяжелая почечная недостаточность (СКФ <30 мл/мин), в том числе у пациентов находящихся на гемодиализе, не была зарегистрирована ни в одной из исследуемых групп.
По данным анализа геморрагических осложнений в 1 группе пациентов, получавших Бивалирудин, после проведения ЧКВ у 60% пациентов отсутствовали геморрагические осложнения, у 15% пациентов имело место наличие осложнений в виде тромбоцитопении в диапазоне 100-140*109/л, причем у 2 пациентов (10%) регистрировалась тромбоцитопения до проведения ЧКВ в диапазоне 140-180*109/л; гипокоагуляционный синдром и наличие подкожной гематомы на месте пункции в послеоперационном периоде была отмечена у 15% пациентов, при этом гипокоагуляционный синдром у 1 пациента (5%) был отмечен до проведения операции, и в 1 случае (5%) гипокоагуляционный синдром и подкожная гематома имели место у одного и того же пациента.
Во 2 группе пациентов, получавших Монафрам, после проведения ЧКВ у 35% пациентов отсутствовали геморрагические осложнения; у 50% пациентов зарегистрирована тромбоцитопения: в диапазоне >100*109/л и 100-140*109/л по 3 пациента (15%) и 140-180*109/л - у 4 пациентов (20%), причем у 1 пациента была отмечена тромбоцитопения до проведения ЧКВ в диапазоне 140-180*109/л; гипокоагуляционный синдром выявлен лишь у 5% пациентов, подкожная гематома на месте пункции в послеоперационном периоде – у 20%. Кроме вышеперечисленного во 2 группе имелись и другие осложнения в послеоперационном периоде: тромбоз стента – 1 случай (5%), дистальный тромбоз берцовых артерий и постгеморрагическая анемия – 1 случай (5%), дистальная тромботическая эмболизация ЗБВ ПКА – 1 случай (5%), при этом надо отметить, что у 1 больного выявлены тромбоцитопения, подкожная гематома на месте пункции, постгеморрагическая анемия и при этом дистальный тромбоз берцовых артерий; у пациента с дистальной тромботической эмболизацией ЗБВ ПКА была отмечена тромбоцитопения.
В 3 группе пациентов, получавших Эптифибатид после проведения ЧКВ у 50% пациентов отсутствовали геморрагические осложнения; у 15% пациентов зарегистрирован гипокоагуляционный синдром и тромбоцитопения в диапазоне 140-180*109/л, причем у 1 пациента – 5% тромбоцитопения была отмечена до проведения ЧКВ в диапазоне 140-180*109/л ); у 20% - определялась подкожная гематома на месте пункции в послеоперационном периоде. Определяются другие осложнения в послеоперационном периоде: желудочное кровотечение – 2 случая (10%), частично тромбированная псевдоаневризма ОБА – 1 случай (5%), при этом стоит отметить, что желудочное кровотечение в обеих случаях произошла у пациентов с язвенной болезнью желудка в анамнезе на фоне гипокоагуляционного синдрома и оба пациента имели очень высокий риск
кровотечения по шкале CRUSADE; у пациента с частично тромбированной псевдоаневризмой ОБА была отмечена тромбоцитопения до и после операции.
Оценка риска кровотечений по шкале CRUSADE у пациентов, у которых в послеоперационном периоде отмечались осложнения в виде тромбоцитопении, гипокоагуляционного синдрома, подкожной гематомы на месте пункции и других в среднем составила: в 1 группе (Бивалирудин) – 7,6% (соответственно относится к низкому риску по шкале CRUSADE), во 2 группе (Монафрам) – 7,7% (низкий риск), в 3 группе (Эптифибатид) – 9,2% (средний риск кровотечения).
При оценке изначального риска кровотечения у пациентов, имевших более серьезные осложнения после ЧКВ во 2 группе (Монафрам), выяснилось, что пациент с острым тромбозом стента и пациент с дистальным тромбозом берцовых артерий и постгеморрагической анемией имели низкий риск кровотечения по шкале CRUSADE (5,5%); пациент с дистальной тромботической эмболизацией ЗБВ ПКА имел высокий риск кровотечения (11,9%).
В 3 группе (Эптифибатид) изначальный риск кровотечения у пациентов, имевших более серьезные осложнения после ЧКВ, выглядит таким образом: пациент с частично тромбированной псевдоаневризмой ОБА имел низкий риск кровотечения по шкале CRUSADE (5,5%); 2 пациента с желудочным кровотечением имели высокий риск (11,9%) и очень высокий риск кровотечения (19,5%) по шкале CRUSADE.
По результатам проведенного фармако-экономического расчета выявлено: в 1 группе (Бивалирудин) – общий расход на лечение 1 пациента в среднем составил 208436,60 руб, во 2 группе (Монафрам) - 226609,56 руб, в 3 группе (Эптифибатид) - 183874,38 руб. Из полученных данных оказалось, что Эптифибатид, в качестве лекарственного прикрытия при проведении экстренного ЧКВ, является из данных трех препаратов самым
экономически выгодным, так как расходы на лечение с его применением меньше, чем при использовании других антитромботических препаратов – Бивалирудина на 24562,22 руб и Монафрама на 42735,18 руб. На втором месте по фармако-экономической выгоде стоит Бивалирудин: лечение данным препаратом на 18172,96 руб оказалось выгоднее лечения с использованием в качестве антитромбоцитарного прикрытия при ЧКВ Монафрама, хотя сам препарат «Монафрам» на 5185,58 руб дешевле, чем препарат «Ангиокс» (Бивалирудин).
Выводы:
- Антитромботическая терапия у всех проанализированных 60 пациентов была проведена в 100% случаев согласно стандарту лечения больных с ОИМ. НФГ в 1 группе пациентов (Бивалирудин) был использован у 50% больных только до проведения ЧКВ в дозе 5-7 тыс. ЕД.
- Риск кровотечения по шкале CRUSADE у большинства пациентов всех трех групп соответствовал очень низкому, низкому и среднему. В 1 группе (Бивалирудин) превалировали пациенты с очень низким риском кровотечения.
- Большинство пациентов с высоким и очень высоким риском по шкале CRUSADE были зарегистрированы во 2 (Монафрам) и 3 (Эптифибатид) группах.
- По наличию факторов риска геморрагических осложнений пациенты всех трех групп до проведения ЧКВ не отличались.
- Геморрагические осложнения в послеоперационном периоде в целом из 60 пациентов были зарегистрированы у 31 чел.: тромбоцитопения чаще встречалась во 2 группе (Монафрам) – у 50% пациентов (10 чел.), гипокоагуляционный синдром – у 15% пациентов (3 чел.) в 1 (Бивалирудин) и 3 (Эптифибатид) группах, подкожная гематома чаще во 2 (Монафрам) и 3 (Эптифибатид) группах – у 20% (4 чел.) больных.
- Во 2 группе (Монафрам) у 3 пациентов были зарегистрированы серьезные осложнения в послеоперационном периоде в виде: тромбоза стента – 1 случай (5%), дистального тромбоза берцовых артерий и постгеморрагической анемии – 1 случай (5%), дистальной тромботической эмболизации ЗБВ ПКА – 1 случай (5%).
- У большинства пациентов группы Монафрама (у 65%) в послеоперационном периоде имелись геморрагические осложнения, несмотря на то, что до проведения ЧКВ у пациентов данной группы риск кровотечения по шкале CRUSADE был ближе к среднему (7,7%).
- В 3 группе (Эптифибатид) большинство пациентов до проведения ЧКВ имели средний риск кровотечения (9,2%) по шкале CRUSADE, и геморрагические осложнения в послеоперационном периоде зарегистрированы у 50% пациентов.
- В 3 группе (Эптифибатид) в 2 случаях (10%) зарегистрировано желудочное кровотечение у больных с язвенной болезнью в анамнезе и с высоким риском кровотечения по шкале CRUSADE, и 1 случай (5%) частично тромбированной псевдоаневризмы ОБА.
- В 1 группе (Бивалирудин) со стороны ЖКТ геморрагических осложнений не вявлено, несмотря на то, что у 2 пациентов в анамнезе имелась язвенная болезнь желудка.
- Эптифибатид, в качестве лекарственного прикрытия при проведении экстренного ЧКВ, является экономически выгодным при сравнении с Бивалирудином и Монафрамом. На втором месте экономически выгодным оказался Бивалирудин.
Практические рекомендации:
- При оценке риска кровотечений по шкале CRUSADE необходим учет факторов риска геморрагических осложнений: язвенная болезнь желудка в анамнезе, повышенный риск кровотечения из-за врожденных или приобретенных нарушений гемостаза в виде тромбоцитопении, тяжелая неконтролируемая артериальная гипертензия, тяжелая хроническая почечная недостаточность (скорость клубочковой фильтрации <30 мл/мин).
- Пациентам с высоким и очень высоким кровотечения по шкале CRUSADE при проведении экстренного ЧКВ предпочтительнее использование препарата Бивалирудин.
Список использованной литературы:
- Козлов С.В. Эффективность и безопасность проведения чрескожных вмешательств после успешной догоспитальной тромболитической терапии при инфаркте миокарда с подъемом сегмента ST. – диссертация к.м.н Екатеринбург, 2010г. с.3
- Аверков О.В., Атарщикова М.В. Антитромботические средства и чрескожные коронарные вмешательства: спорные вопросы применения клопидогреля. – Фарматека, Выпуск №14, 2004г. с.32
- Аверков О.В. Теоретическое обоснование и практические аспекты использования бивалирудина при чрескожных внутрикоронарных вмешательствах у больных с острым коронарным синдромом. – Российский кардиологический журнал №3 (95), 2012г.с.102.
- Сторожакова Г.И., Горбаченкова А.А. Руководство по кардиологии: учебное пособие в 3 т. / под ред. - 2009. - Т. 3. с. 350-370.
- Регистр лекартсвенных средств России ® РЛС ®.
- М.А.Чарная, Ю.А.Морозов. Современные антиагрегантные препараты и их применение в клинике (обзор литературы). Болезни аорты и ее путей, 2009. с.34-40;
- www.rosmedic.ru
- В.И. Волков, О.Е. Запровальная. Антитромбоцитарная терапия ишемической болезни сердца: проблемы и перспективы. Газета «Новости медицины и фармации» № 368, 2011г. с. 10-15.
- Рекомендации 2007 г. Американской коллегии кардиологов и Американской ассоциации сердца по ведению пациентов с инфарктом миокарда с подъемом сегмента ST. с.70.
- М.И. Лутай, А.Н. Пархоменко, В.А. Шумаков, И.К. Следзевская Ишемическая болезнь сердца. Сердечно-сосудистая хирургия. М., -2013г. с.25-30.
- Певзнер Д.В.и соавторы. Применение антагониста гликопротеинов IIb-IIIa Монафрама при первичной ангиопластике у больных с острым коронарным синдромом без подъема сегмента ST. Журнал «Кардиология», М., - 2010г. с.37-40.
- Сулимов В.А. Антитромботическая терапия при чрескожных коронарных вмешательствах. Журнал «Рациональная фармакотерапия в кардиологии», выпуск № 3 / том 4 / М., - 2008г. 91-100с.
- Омельяновский В.В. Отчет о научно-исследовательской работе «Сравнительная клинико-экономическая оценка сопроводительной антитромбоцитарной терапии при проведении ЧКВ с использованием Бивалирудина и комбинации НФГ + с ингибиторами рецепторов IIb/IIIa. – М., 2012г. с.2-3.
PAGE \* MERGEFORMAT 1
СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА ПРИМЕНЕНИЯ АНТИТРОМБОТИЧЕСКИХ ПРЕПАРАТОВ У БОЛЬНЫХ С ИНФАРКТОМ МИОКАРДА ПРИ ПРОВЕДЕНИИ ЭКСТРЕННОГО ЧРЕСКОЖНОГО ВМЕШАТЕЛЬСТВА