Определение массовой доли тяжелых металлов в пробах почв Тульской области
Министерство образования и науки Российской Федерации
Тульский государственный университет
Кафедра Биотехнологии
дипломнАЯ работа
специальность 240901
Биотехнология
(наименование)
Определение массовой доли тяжелых металлов
в пробах почв Тульской области
Студент группы 430801 Кубышкина В.А.
(подпись, дата)
Руководитель работы к.б.н., доц. Нечаева И.А.
(подпись, дата)
Заведующий кафедрой д. х. н., доц. Понаморева О.Н.
(подпись, дата)
Тула 2015
Оглавление
Введение
Состояние окружающей природной среды является важнейшим фактором, определяющим жизнедеятельность человека и общества. Высокие концентрации многих химических элементов и соединений, обусловленные техногенными процессами, обнаружены в настоящее время во всех природных средах: атмосфере, воде, почве, растениях.
Почва - особое природное образование, обладающее рядом свойств, присущих живой и неживой природе; состоит из генетически связанных горизонтов (образуют почвенный профиль), возникающих в результате преобразования поверхностных слоев литосферы под совместным воздействием воды, воздуха и организмов; характеризуется плодородием [1]. Почва играет важную роль в круговороте тяжелых металлов, они представляют собой гетерогенные смеси разных органических и органо-минеральных составляющих глинистых минералов, оксидов железа (Fe), алюминия (Al) и марганца (Mn) и других твердых частиц, а также различных растворимых соединений. Вследствие разнообразия типов почв, их окислительно-восстановительных условий и реакционной способности, механизмы и способы связывания тяжелых металлов в почвах разнообразны. Тяжелые металлы, в почвах содержаться в различных формах: в кристаллической решетке минералов в виде изоморфной подмеси, в солевой и окисной форме, в составе разных органических веществ, в ионообменном состоянии и в растворимой форме в почвенном растворе. Следует отметить, что, тяжелые металлы, поступая из почвы в растения и затем в организмы животных и человека, обладают способностью постепенно накапливаться. Наиболее токсичны ртуть, кадмий, свинец, мышьяк, отравление ими вызывает тяжелые последствия. Менее токсичны: цинк и медь, однако загрязнение ими почв подавляет микробиологическую деятельность и снижает биологическую продуктивность.
Тяжёлые металлы уже сейчас занимают второе место по степени опасности, уступая пестицидам и значительно опережая такие известные загрязнители, как двуокись углерода и серы. В перспективе они могут стать более опасными, чем отходы атомных электростанций и твёрдые отходы. Загрязнение тяжёлыми металлами связано их широким использованием в промышленном производстве. В связи с несовершенными системами очистки тяжёлые металлы попадают в окружающую среду, в том числе в почву, загрязняя и отравляя её. Тяжёлые металлы относятся к особым загрязняющим веществам, наблюдения за которыми обязательны во всех средах.
В настоящее время в России для оценки загрязнения почв тяжелыми металлами используется как официально одобренные, так и не имеющие официального статуса нормативы. Основное их назначение – не допустить поступления в избыточном количестве антропогенно накапливающихся в почве твердых металлов в организм человека и тем самым избежать их негативного влияния [6].
При определении тяжелых металлов в почвах и почвенных компонентах применяется атомно-абсорбционный анализ почв и различных вытяжек (например, экстрагирование Zn, Си, РЬ,Fe,Ni, которая извлекает из образцов загрязненных почв 70—90 % от валового содержания тяжелых металлов). Метод обладает целым рядом достоинств: хорошая чувствительность, избирательность, достаточно хорошая воспроизводимость результатов, простота выполнения анализов. Он позволяет определить до 70 элементов, обеспечивает предел обнаружения многих элементов на уровне 0,1—0,01 мкг/мл, что во многих случаях дает возможность анализировать почвы и растения без предварительного концентрирования элементов.
Целью данной работы является определение содержания кислоторастворимых форм металлов (свинец, медь, цинк, никель, железо) в пробах почв Тульской области методом атомно-абсорбционной спектроскопии.
Для выполнения поставленной цели необходимо было решить следующие задачи:
- Изучить принцип работы атомно-абсорбционного спектрометра с электротермической атомизацией «МГА-915М».
- Определить концентрацию каждого тяжёлого металла в образцах почв.
- Оценить степень загрязнённости выбранных объектов.
1. Литературный обзор
1.1. Загрязнение почв
Загрязнителем может быть любой физический агент, химическое вещество и биологический вид, попадающие в окружающую среду или возникающие в ней в количествах, выходящих в рамки своей обычной концентрации, предельных количествах, предельных естественных колебаний или среднего природного фона в рассматриваемое время [2].
Основным показателем, характеризующим воздействие загрязняющих веществ на окружающую природную среду, являются предельно допустимая концентрация (ПДК). С позиции экологии предельно допустимые концентрации конкретного вещества представляют собой верхние пределы лимитирующих факторов среды (в частности, химических соединений), при которых их содержание не выходит за допустимые границы экологической ниши человека [6].
В соответствии со степенью устойчивости против загрязняющих веществ
выделяются почвы:
1. очень устойчивые;
2. устойчивые;
3. среднеустойчивые;
4. малоустойчивые;
5. очень малоустойчивые.
Чувствительность, или устойчивость почв по отношению к загрязняющим
веществам, целесообразно определять в соответствии с:
1) содержанием гумуса;
2) его качеством;
3) биологической активностью;
4) глубиной гумусового горизонта;
5) содержанием фракции < 0,01 мм и учетом содержания фракции <0,001 мм
(механический состав почвы);
6) глинистых минералов;
7) глубиной почвенного профиля.
Почвы загрязняются различными химическими веществами, пестицидами, отходами сельского хозяйства, промышленного производства и коммунально-бытовых предприятий. Поступающие в почву химические соединения накапливаются и приводят к постепенному изменению химических и физических свойств почвы, снижают численность живых организмов, ухудшают ее плодородие [2].
Загрязнение почв и нарушение нормального круговорота веществ происходит в результате недозированного применения минеральных удобрений и пестицидов. В ряде отраслей сельского хозяйства пестициды применяют в больших количествах для защиты растений и борьбы с сорняками. Ежегодное их применение, часто по несколько раз в сезон, приводит к их накоплению в почве и ее отравлению [6].
Вместе с навозом и фекалиями в почву нередко попадают болезнетворные бактерии, яйца гельминтов и другие вредные организмы, которые через продукты питания попадают в организм человека.
Почву загрязняют нефтепродуктами при заправке машин на полях и в лесах, на лесосеках и т.д. [6].
Поступающие тяжелые металлы в почву в ходе работы автотранспорта, а также при истирании дорожных покрытий, поступают: железо, никель, цинк, свинец и другие элементы.
Окружающие промышленные предприятия различного профиля, почвы, содержат токсичные элементы в количествах, превышающих допустимые нормы, в десятки и сотни раз
Наибольшей трансформацией подвергается самый верхний, поверхностный горизонт литосферы. Суша занимает 29,2% поверхности земного шара и включает земли различной категории, из которых важнейшее значение имеет плодородная почва. При неправильной эксплуатации почвы безвозвратно уничтожаются в результате эрозии, засоления, загрязнения промышленными и иными отходами.
Под влиянием деятельности людей возникает ускоренная эрозия, когда почвы разрушаются в 100 – 1000 раз быстрее, чем в естественных условиях. В результате такой эрозии за последнее столетие утрачено 2 млрд. га плодородных земельных угодий, или 27% земель сельскохозяйственного использования [2].
Поступающие в почву химические соединения накапливаются и приводят к постепенному изменению химических и физических свойств почвы, снижают численность живых организмов, ухудшают ее плодородие.
Загрязнение почв связано с загрязнением атмосферы и воды. В почву попадают различные твердые и жидкие отходы промышленного производства, сельского хозяйства и коммунально-бытовых предприятий. Основными загрязняющими почву веществами являются металлы и их соединения [6].
Интенсивное развитие промышленности, энергетики, транспорта, а также интенсификация сельскохозяйственного производства способствуют возрастанию антропогенной нагрузки на аграрные экосистемы и, прежде всего, на почвенный покров. В результате этого происходит загрязнение почв тяжелыми металлами. Тяжелые металлы, попадающие в биосферу главным образом в результате промышленных и транспортных выбросов, являются одним из самых опасных ее загрязнителей. Поэтому изучение их поведения в почвах и защитных возможностей почв является важной экологической проблемой.
Тяжелые металлы накапливаются в почве и способствуют постепенному изменению ее химического состава, нарушению жизнедеятельности растений и живых организмов. Из почвы тяжелые металлы могут попасть в организм людей и животных и вызывать нежелательные последствия. В организме человека тяжелые металлы участвую в жизненно важных биохимических процессах. Превышение допустимых концентраций приводит к серьезным заболеваниям.
Таким образом, загрязнение почв тяжелыми металлами имеет следующие источники:
1.Автомобильные выхлопы отработанных газов отходы
2.Продукты сгорания топлива
3.Промышленные выбросы
4.Металообрабатывающей промышленности
5.Средство химизации сельского хозяйства.
1.2.Тяжелые металлы в почве
В настоящее время в России для оценки загрязнения почв тяжелыми металлами используется как официально одобренные, так и не имеющие официального статуса нормативы. Основное их назначение – не допустить поступления в избыточном количестве антропогенно накапливающихся в почве тяжелые металлы в организм человека и тем самым избежать их негативного влияния. Почва в отличие от гомогенных водной и воздушной сред является сложной гетерогенной системой, меняющей поведение токсикантов в зависимости от её свойств [1]. Трудности обоснованной оценки почвенно-экологического состояния – одна из причин различного уровня фитотоксичности почв [8].
Важную роль в круговороте тяжелых металлов и остальных микроэлементов играют почвы. Они представляют собой гетерогенные смеси разных органических и органо-минеральных составляющих глинистых минералов, оксидов железа, алюминия и марганца и других твердых частиц, а также различных растворимых соединений. Вследствие разнообразия типов почв, их окислительно-восстановительных условий и реакционной способности, механизмы и способы связывания тяжелых металлов в почвах разнообразны [7]. На поглощение микроэлементов почвами при техногенном загрязнении оказывают влияние механический состав, реакция, содержание гумуса и карбонатов, емкость поглощения и условия водного режима. Микроэлементы, в том числе тяжелые металлы, в почвах содержаться в различных формах: в кристаллической решетке минералов в виде изоморфной подмеси, в солевой и окисной форме, в составе разных органических веществ, в ионообменном состоянии и в растворимой форме в почвенном растворе [8]. На поведение микроэлементов в почвах влияют окислительно-восстановительные условия, реакция среды, концентрация углекислого газа и наличие органического вещества. Изменение окислительно-восстановительного состояния почв существенно сказывается на поведении микроэлементов с переменной валентностью. Так, марганец при окислении переходит в нерастворимые формы, а хром и ванадий, наоборот, приобретают подвижность и мигрируют. При кислой реакции почвы увеличивается подвижность меди, марганца, цинка, кобальта и уменьшается подвижность Mолибдена. Бор, фтор и йод подвижны в кислой и щелочной средах [6].
Подвижность химических элементов в почве изменяется в результате смещения равновесия между соединениями элемента в твердой и жидкой фазах. Поступающие в почву загрязняющие вещества могут переходить в прочнофиксированное состояние, труднодоступное для растений. Более высокую устойчивость почв к загрязнению обуславливают те свойства почв, которые способствуют прочному закреплению загрязняющих веществ. Увеличение концентрации СО2 в почвенном растворе приводит к увеличению подвижности марганца, никеля, бария в результате перехода карбонатов этих элементов в бикарбонаты. Гумусовые и органические вещества неспецифической природы (муравьиная, лимонная, щавелевая и др. кислоты) могут связывать микроэлементы, образуя как растворимые, так и труднорастворимые растениям соединения [1].
Водорастворимые соединения металлов быстро мигрируют по почвенному профилю. Действие органических веществ на миграцию металлов в почве двоякое. В процессе минерализации органических веществ в почве образуются низкомолекулярные водорастворимые минеральные соединения, мигрирующие в нижнюю часть профиля. Тяжелые металлы образуют с этими веществами низкомолекулярные комплексы. По мере более глубокой трансформации органических веществ происходит образование высокомолекулярных гумусовых кислот, причем их действие на миграцию металлов различно. Фульвокислоты, соединяясь с металлами, образуют хелатные соединения, растворимые при широком диапазоне рН, мигрирующие вниз по профилю почвы. Металлы образуют комплексы с гуминовыми кислотами, характеризующиеся инертностью, нерастворимы в кислой среде, что способствует накапливанию тяжелых металлов в органогенном горизонте. Комплексы металлов с фульвокислотами и гуминовыми кислотами наиболее устойчивы при рН от 3 до 7.
Примером трансформации в почвах цинка и кадмия является их переход в жидкую фазу за счет процессов растворения (Алексеенко и др., 1992).Кадмий обладает большой токсичностью и относительно большой мобильностью в почве и доступностью для растений. Поскольку техногенные соединения этих металлов термодинамически не устойчивы в почвенных условиях, их переход в жидкую фазу почв необратим. Дальнейшая трансформация цинка и кадмия в почвах связана с обратимыми процессами, протекающими между почвенным раствором и почвенным поглощающим комплексом, устойчивыми осадками малорастворимых солей цинка и кадмия, высшими растениями и микроорганизмами [6].
1.3. Источники поступление тяжелых металлов в объекты окружающей среды
К тяжелым металлам относятся более сорока химических элементов периодической системы Д.И. Менделеева, масса атомов которых составляет свыше пятидесяти атомных единиц.
Эта группа элементов активно участвует в биологических процессах, входя в состав многих ферментов. Группа "тяжелых металлов" во многом совпадает с понятием "микроэлементы". Отсюда: свинец, цинк, кадмий, ртуть, молибден, хром, марганец, никель, олово, кобальт, титан, медь, ванадий являются тяжелыми металлами [9].
Источники поступления тяжелых металлов делятся, на природные (выветривание горных пород и минералов, эрозийные процессы, вулканическая деятельность) и техногенные (добыча и переработка полезных ископаемых, сжигание топлива, движение транспорта, деятельность сельского хозяйства). Часть техногенных выбросов, поступающих в природную среду в виде тонких аэрозолей, переносится на значительные расстояния и вызывает глобальное загрязнение. Другая часть поступает в бессточные водоемы, где тяжелые металлы накапливаются и становятся источником вторичного загрязнения, т.е. образования опасных загрязнений в ходе физико-химических процессов, идущих непосредственно в среде (например, образование из нетоксичных веществ ядовитого газа фосгена) [8].
Тяжелые металлы накапливаются в почве, особенно в верхних гумусовых горизонтах, и медленно удаляются при выщелачивании, потреблении растениями, эрозии и дефляции - выдувании почв. Период полуудаления или удаления половины от начальной концентрации составляет продолжительное время: для цинка - от 70 до 510 лет, для кадмия - от 13 до 110 лет, для меди - от 310 до 1500 лет и для свинца - от 740 до 5900 лет.
В гумусовой части почвы происходит первичная трансформация попавших в нее соединений.
Тяжелые металлы обладают высокой способностью к многообразным химическим, физико-химическим и биологическим реакциям. Многие из них имеют переменную валентность и участвуют в окислительно-восстановительных процессах. Тяжелые металлы и их соединения, как и другие химические соединения, способны перемещаться и перераспределяться в средах жизни, т.е. мигрировать [7]. Миграция соединений тяжелых металлов происходит в значительной степени в виде органо-минеральной составляющей. Часть органических соединений, с которыми связываются металлы, представлена продуктами микробиологической деятельности. Ртуть характеризуется способностью аккумулироваться в звеньях "пищевой цепи" (об этом шла речь ранее). Микроорганизмы почвы могут давать устойчивые к ртути популяции, которые превращают металлическую ртуть в токсические для высших организмов вещества. Некоторые водоросли, грибы и бактерии способны аккумулировать ртуть в клетках. Ртуть, свинец, кадмий входят в общий перечень наиболее важных загрязняющих веществ окружающей среды, согласованный странами, входящими в ООН. Остановимся подробнее на этих веществах и добавим к ним железо и никель [9].
Ртуть.
Ртуть крайне слабо распространена в земной коре (-0,1 х 10-4 %), однако удобна для добычи, так как концентрируется в сульфидных остатках, например, в виде киновари (НgS). В этом виде ртуть относительно безвредна, но атмосферные процессы, вулканическая и человеческая деятельность привели к тому, что в мировом океане накопилось около 50 млн.т этого металла. Естественный вынос ртути в океан в результате эрозии 5000 т/год, еще 5000 т/год ртути выносится в результате человеческой деятельности [10].
Первоначально ртуть попадает в океан в виде Нg2+ , затем она взаимодействует с органическими веществами и с помощью анаэробных организмов переходит в токсичные вещества метилртуть (СН3 Нg )+ и диметилртуть (СН3 -Нg-СН3 ),
Ртуть присутствует не только в гидросфере, но и в атмосфере, так как имеет относительно высокое давление паров. Природное содержание ртути составляет ~0,003-0,009 мкг/м3 .
Ртуть характеризуется малым временем пребывания в воде и быстро переходит в отложения в виде соединений с органическими веществами, находящимися в них. Поскольку ртуть адсорбируется отложениями, она может медленно освобождаться и растворяться в воде, что приводит к образованию источника хронического загрязнения, действующего длительное время после того, как исчезнет первоначальный источник загрязнения [2].
Мировое производство ртути в настоящее время составляет более 10000 т в год, большая часть этого количества используется в производстве хлора. Ртуть проникает в воздух в результате сжигания ископаемого топлива. Анализ льда Гренландского ледяного купола показал, что, начиная с 800 г. н.э. до 1950-х гг., содержание ртути оставалось постоянным, но уже с 50-х гг. нашего столетия количество ртути удвоилось.
Ртуть и ее соединения опасны для жизни. Метилртуть особенно опасна для животных и человека, так как она быстро переходит из крови в мозговую ткань, разрушая мозжечок и кору головного мозга. Клинические симптомы такого поражения - оцепенение, потеря ориентации в пространстве, потеря зрения. Симптомы ртутного отравления проявляются не сразу. Другим неприятным последствием отравления метилртутью является проникновение ртути в плаценту и накапливание ее в плоде, причем мать не испытывает при этом болезненных ощущений. Метилртуть оказывает тератогенное воздействие на человека. Ртуть относится к I классу опасности [6].
Металлическая ртуть опасна, если ее проглотить и вдыхать ее пары. При этом у человека появляется металлический вкус во рту, тошнота, рвота, колики в животе, зубы чернеют и начинают крошиться. Пролитая ртуть разлетается на капельки и, если это произошло, ртуть должна быть тщательно собрана. Неорганические соединения ртути практически нелетучи, поэтому опасность представляет попадание ртути внутрь организма через рот и кожу. Соли ртути разъедают кожу и слизистые оболочки тела. Попадание солей ртути внутрь организма вызывает воспаление зева, затрудненное глотание, оцепенение, рвоту, боли в животе. У взрослого человека при попадании внутрь около 350 мг ртути может наступить смерть [10].
Загрязнение ртутью может быть уменьшено в результате запрещения производства и применения ряда продуктов. Нет сомнения, что загрязнение ртутью всегда будет острой проблемой. Но с введением строгого контроля за отходами производства, содержащими ртуть, а также за пищевыми продуктами можно уменьшить опасность отравления ртутью [6].
Свинец.
Содержание свинца в магматических породах позволяет отнести его к категории редких металлов. Он концентрируется в сульфидных породах, которые встречаются во многих местах в мире. Свинец легко выделить путем выплавки из руды. В природном состоянии он обнаруживается в основном в виде галенита (РbS).Свинец, содержащийся в земной коре, может вымываться под воздействием атмосферных процессов, переходя постепенно в океаны. Ионы Рb2+ довольно нестабильны, и содержание свинца в ионной форме составляет всего 10 –8 %. Однако он накапливается в океанских осадках в виде сульфитов или сульфатов. В пресной воде содержание свинца гораздо выше и может достигать 2 х 10 –6 %, а в почве примерно такое же количество, что и в земной коре (1,5 х 10 –3 %) из-за нестабильности этого элемента в геохимическом цикле [10].
Свинцовые руды содержат 2-20 % свинца. Концентрат, получаемый флотационным способом, содержит 60-80 % Рb. Его нагревают для удаления серы и выплавляют свинец. Такие первичные процессы крупномасштабны. Если же для получения свинца используют отходы, процессы выплавки называют вторичными. Ежегодное мировое потребление свинца составляет более 3 млн. т, из них 40 % используют для производства аккумуляторных батарей, 20% -для производства алкила свинца - присадки к бензину, 12% применяют в строительстве, 28 % для других целей [11].
Ежегодно в мире в результате воздействия атмосферных процессов мигрирует около 180 тыс. т свинца. При добыче и переработке свинцовых руд теряется более 20 % свинца. Даже на этих стадиях выделение свинца в среду обитания равно его количеству, попадающему в окружающую среду в результате воздействия на магматические породы атмосферных процессов.
Наиболее серьезным источником загрязнения среды обитания организмов свинцом являются выхлопы автомобильных двигателей. Антидетонатор тетраметил - или тетраэтилсвинеп - прибавляют к большинству бензинов, начиная с 1923 г., в количестве около 80 мг/л.
В бензине может содержаться 380 мг свинца, а общее содержание тетраэтилсвинца достигает 1г/л. При сгорании бензина около 75% содержащегося в нем свинца выделяется в виде аэрозоля и рассеивается в воздухе, в дальнейшем перераспределяясь на различном расстоянии от дорожного полотна. При движении автомобиля от 25 до 75% этого свинца в зависимости от условий движения выбрасывается в атмосферу. Основная его масса осаждается на землю, но и в воздухе остается заметная ее часть.
Свинцовая пыль не только покрывает обочины шоссейных дорог и почву внутри и вокруг промышленных городов, она найдена и во льду Северной Гренландии, причем в 1756 г. содержание свинца во льду составляло 20 мкг/т, в 1860 г. уже 50 мкг/т, а в 1965 г. - 210 мкг/т. Активными источниками загрязнения свинцом являются электростанции и бытовые печи, работающие на угле. Источниками загрязнения свинцом в быту могут быть глиняная посуда, покрытая глазурью; свинец, содержащийся в красящих пигментах.
Свинец не является жизненно необходимым элементом. Он токсичен и относится к I классу опасности. Неорганические его соединения нарушают обмен веществ и являются ингибиторами ферментов (подобно большинству тяжелых металлов). Одним из наиболее коварных последствий действия неорганических соединений свинца считается его способность заменять кальций в костях и быть постоянным источником отравления в течение длительного времени. Биологический период полураспада свинца в костях - около 10 лет. Количество свинца, накопленного в костях, с возрастом увеличивается, и в 30-40 лет у лиц, по роду занятий не связанных с загрязнением свинца, составляет 80-200 мг.
Органические соединение свинца считаются ещё более токсичными, чем неорганические. Главным источником, из которого свинец попадает в организм человека, является пища, наряду с эти важную роль играет вдыхаемый воздух, а у детей – и заглатываемая ими свинецсодержащая пыль и краски. Вдыхаемая пыль примерно на 30-35 % задерживается в легких, значительная доля её всасывается потоком крови. Всасывания в желудочно-кишечном тракте составляют в целом 5-10 %, у детей – 50 %. Дефицит кальция и витамина Д усиливает всасывание свинца. Острые свинцовые отравления встречаются редко. Их симптомы – слюнотечение, рвота, кишечные колики, острая форма отказа почек, поражение мозга. В тяжёлых случаях – смерть через несколько дней. Ранние симптомы отравления свинцом проявляются в виде повышенной возбудимости, депрессии и раздражительности. При отравлении органическими соединениями свинца его повышенное содержание обнаруживают в крови.
Вследствие глобального загрязнения окружающей среды свинцом он стал вездесущим компонентом любой пищи и кормов. Растительные продукты в целом содержат больше свинца, чем животные [1].
Кадмий и цинк.
Кадмий, цинк а также медь, являются наиболее важными металлами при изучении проблемы загрязнений, так они широко распространены в мире и обладают токсичными свойствами. Кадмий и цинк (так же как: свинец и ртуть) обнаружены в основном в сульфидных осадках. В результате атмосферных процессов эти элементы легко попадают в океаны. В почвах содержится приблизительно 4,5х10 –4 %. Растительность содержит различное количество обоих элементов, но содержание цинка в золе растений относительно высоко –0,14; так как этот элемент играет существенную роль в питании растений. Около 1 млн. кг кадмия попадает в атмосферу ежегодно в результате деятельности заводов по его выплавке, что составляет около 45 % общего загрязнения этим элементом. 52 % загрязнений попадают в результате сжигания или переработки изделий, содержащих кадмий. Кадмий обладает относительно высокой летучестью, поэтому он легко проникает в атмосферу. Источники загрязнения атмосферы цинком те же, что и кадмием [1].
Попадание кадмия в природные воды происходит в результате применения его в гальванических процессах и техники. Наиболее серьёзные источники загрязнения воды цинком – заводы по выплавке цинка и гальванические производства [2].
Потенциальным источником загрязнением кадмием являются удобрения. При этом кадмий внедряется в растения, употребляемые человеком в пищу, и в конце цепочки переходят в организм человека. Цинк наименее токсичен из всех вышеперечисленных тяжёлых металлов. Тем не менее все элементы становятся токсичными, если попадаются в избытке; цинк не является исключением. Физиологическое воздействие цинка заключается в действии его как активатора ферментов. В больших количествах он вызывает рвоту, эта доза составляет примерно 150 мг для взрослого человека [6].
Кадмий намного токсичнее цинка. Он и его соединения относятся к I классу опасности. Он проникает в человеческий организм в течение продолжительного периода. Вдыхание воздуха в течение 8 часов при концентрации кадмия 5 мг/м3 может привести к смерти. При хроническом отравлении кадмием в моче появляется белок, повышается кровяное давление.
При исследовании присутствия кадмия в продуктах питания было выявлено, что выделения человеческого организма редко содержат столько же кадмия, сколько было поглощено. Единого мирового мнения относительно приемлемого безопасного содержания кадмия в пище сейчас нет.
Одним их эффективных путей предотвращения поступления кадмия и цинка в виде загрязнений состоит в введении контроля за содержанием этих металлов в выбросах плавильных заводов и других промышленных предприятий.
Сурьма, Мышьяк, Кобальт.
Сурьма присутствует вместе с мышьяком в рудах, содержащих сульфиды металлов. Мировое производство сурьмы составляет около 70 т в год. Сурьма является компонентом сплавов, используется в производстве спичек, в чистом виде применяется в полупроводниках .Токсическое действие сурьмы подобно мышьяку. Большие количества сурьмы вызывают рвоту, при хроническом отравлении сурьмой наступает расстройство пищеварительного тракта, сопровождаемое рвотой и понижением температуры. Мышьяк в природе присутствует в виде сульфатов. Его содержание в свинцово-цинковых концентратах около 1 %. Вследствие летучести он легко попадает в атмосферу.
Самыми сильными источниками загрязнения этим металлом являются гербициды (химические вещества для борьбы с сорными растениями), фунгициды (вещества для борьбы с грибными болезнями растений) и инсектициды (вещества для борьбы с вредными насекомыми) [6].
По токсическим свойствам мышьяк относится к накапливающимся ядам. По степени токсичности следует различать элементарный мышьяк и его соединения. Элементарный мышьяк сравнительно мало ядовит, но обладает тератогенными свойствами. Вредное воздействие на наследственный материал (мутагенность) оспаривается. [2]
Соединения мышьяка медленно поглощаются через кожу, быстро всасываются через лёгкие и желудочно-кишечный тракт. Смертельная доза для человека – 0,15-0,3 г.
Хроническое отравление вызывает нервные заболевания, слабость, онемение конечностей, зуд, потемнение кожи, атрофию костного мозга, изменения печени. Соединения мышьяка являются канцерогенными для человека. Мышьяк и его соединения относятся ко II классу опасности.
Кобальт не является широко применяемым. Так, например, его используют в сталелитейной промышленности, в производстве полимеров. При попадании внутрь больших количеств кобальт отрицательно влияет на содержание гемоглобина в крови человека и может вызвать заболевания крови. Предполагают, что кобальт вызывает базедову болезнь. Этот элемент опасен для жизни организмов ввиду его чрезвычайно высокой реакционной способности и относится к I классу опасности.
Медь и Марганец.
Медь обнаруживают в сульфидных осадках вместе со свинцом, камдием и цинком. Она присутствует в небольших количествах в цинковых концентратах и может переноситься на большие расстояния с воздухом и водой. Аномальное содержание меди обнаруживается в растениях с воздухом и водой. Аномальное содержание меди обнаруживается в растениях и почвах на расстоянии более 8 км от плавильного завода. Соли меди относятся ко II классу опасности. Токсические свойства меди изучены гораздо меньше, чем те же свойства других элементов. Поглощение больших количеств меди человеком приводит к болезни Вильсона, при этом избыток меди откладывается в мозговой ткани, коже, печени, поджелудочной железе [10].
Природное содержание марганца в растениях, животных и почвах очень высоко. Основные области производства марганца – производство легированных сталей, сплавов, электрических батарей и других химических источников тока. Присутствие марганца в воздухе сверх нормы (среднесуточная ПКД марганца в атмосфере – воздухе населённых мест – составляет 0,01 мг/м3) вредно влияет на организм человека, что выражается в прогрессирующем разрушении центральной нервной системы. Марганец относится ко II классу опасности [7].
В настоящее время в России для оценки загрязнения почв тяжелыми металлами используется как официально одобренные, так и не имеющие официального статуса нормативы. Основное их назначение – не допустить поступления в избыточном количестве антропогенно накапливающихся в почве ТМ в организм человека и тем самым избежать их негативного влияния. Почва в отличие от гомогенных водной и воздушной сред является сложной гетерогенной системой, меняющей поведение токсикантов в зависимости от её свойств . трудности обоснованной оценки почвенно-экологического состояния – одна из причин различного уровня фитотоксичности почв, установленного разными исследователями [10].
Железо.
Техногенные источники поступления железа в окружающую среду. В зонах металлургических комбинатов в твердых выбросах содержится от 22000 до 31000 мг/кг железа.
Вследствие этого железо накапливается в огородных культурах. Много железа поступает в сточные воды и шламы от производств металлургического, химического, машиностроительного,металлообрабатывающего,нефтехимического,химико-фармацевтического, лакокрасочного, текстильного. Содержание железа в составе сырого осадка, выпадающего в первичных отстойниках крупного промышленного города, может достигать 1428 мг/кг. Дым, пыль промышленных производств могут содержать большие количества железа в виде аэрозолей железа, его оксидов, руд. Пыль железа или его оксидов образуется при заточке металлического инструмента, очистке деталей от ржавчины, прокате железных листов, электросварке и при других производственных процессах, в которых имеют место железо или его соединения.
Железо может накапливаться в почвах, водоемах, воздухе, живых организмах. Основные минералы железа подвергаются в природе фотохимическому разрушению, комплексообразованию, микробиологическому выщелачиванию, в результате чего, железо из труднорастворимых минералов переходит в водные объекты.
Железосодержащие минералы окисляются бактериями типа Th. Ferrooxidans. Окисление сульфидов можно описать в общем виде на примере пирита следующими микробиологическими и химическими процессами. Как видно, при этом образуется еще один загрязняющий поверхностные воды компонент серная кислота. О масштабах ее микробиологического образования можно судить по такому примеру. Пирит обычный примесный компонент угольных месторождений, и его выщелачивание приводит к закислению шахтных вод. По одной из оценок, в 1932г. в реку Огайо США с шахтными водами поступило около 3 млн. тонн H2SO4. Микробиологическое выщелачивание железа осуществляется не только за счет окисления, но и при восстановлении окисленных руд. В нем принимают участие микроорганизмы, относящиеся к разным группам.
В частности, восстановление Fe3 до Fe2 осуществляют представители родов Bacillus и Pseudomonas, а так же некоторые грибы.
Упомянутые здесь широко распространенные в природе процессы протекают так же в отвалах горнорудных предприятий, металлургических комбинатов, производящих большое количество отходов шлаки, огарки и т.п. С дождевыми, паводковыми и грунтовыми водами высвобождающиеся из твердых матриц металлы переносятся в реки и водоемы. Железо находится в природных водах в разных состояниях и формах в истинно растворенной форме входят в состав донных отложений и гетерогенных систем взвеси и коллоиды. Донные отложения рек и водоемов выступают в качестве накопителя железа. Высокое содержание железа обусловлено геохимическими особенностями образования почвенных горизонтов. Его повышенное содержание в почвенном покрове может быть обусловлено использованием для полива вод с природным повышенным содержанием железа [7].
Класс опасности - не предусмотрено разделение на классы опасности.
Лимитирующий показатель вредности - вредность не определена. [10]
Никель.
Никель наряду с Mn, Fe, Co и Cu относится к так называемым переходным металлам, соединения которых обладают высокой биологической активностью. Вследствие особенностей строения электронных орбиталей вышеуказанные металлы, в том числе и никель, обладают хорошо выраженной способностью к комплексообразованию. Никель способен формировать стабильные комплексы, например, с цистеином и цитратом, а также со многими органическими и неорганическими лигандами. Геохимический состав материнских пород во многом определяет содержание никеля в почвах. Наибольшее количество никеля содержат почвы, образовавшиеся из основных и ультраосновных пород. По данным некоторых авторов, границы избыточного и токсичного уровней никеля для большинства видов изменяются от 10 до 100 мг/кг. Основная масса никеля закреплена в почве неподвижно, а очень слабая миграция в коллоидном состоянии и в составе механических взвесей не влияет на распределение их по вертикальному профилю и вполне равномерна [6].
Присутствие никеля в природных водах обусловлено составом пород, через которые проходит вода: он обнаруживается в местах месторождений сульфидных медно-никелевых руд и железо-никелевых руд. В воду попадает из почв и из растительных и животных организмов при их распаде. Повышенное по сравнению с другими типами водорослей содержание никеля обнаружено в сине-зеленых водорослях. Соединения никеля в водные объекты поступают также со сточными водами цехов никелирования, заводов синтетического каучука, никелевых обогатительных фабрик. Огромные выбросы никеля сопровождают сжигание ископаемого топлива.
Концентрация его может понижаться в результате выпадения в осадок таких соединений, как: сульфиды, цианиды, карбонаты или гидроксиды (при повышении значений рН), за счет потребления его водными организмами и процессов адсорбции.
В поверхностных водах соединения никеля находятся в растворенном, взвешенном и коллоидном состоянии, количественное соотношение между которыми зависит от состава воды, температуры и значений рН. Сорбентами соединений никеля могут быть гидроксид железа, органические вещества, высокодисперсный карбонат кальция, глины. Растворенные формы представляют собой главным образом комплексные ионы, наиболее часто с аминокислотами, гуминовыми и фульвокислотами, а также в виде прочного цианидного комплекса. Наиболее распространены в природных водах соединения никеля, в которых он находится в степени окисления +2. Соединения Ni3+ образуются обычно в щелочной среде.
Соединения никеля играют важную роль в кроветворных процессах, являясь катализаторами. Повышенное его содержание оказывает специфическое действие на сердечно-сосудистую систему. Никель принадлежит к числу канцерогенных элементов. Он способен вызывать респираторные заболевания. Считается, что свободные ионы никеля (Ni2+) примерно в 2 раза более токсичны, чем его комплексные соединения.
Металлургические предприятия ежегодно выбрасывают на поверхность земли более 150 тыс. тонн меди, 120 тыс. тонн цинка, около 90 тыс. тонн свинца, 12 тыс. тонн никеля, 1,5 тыс. тoнн молибдена, около 800 тонн кобальта и около 30 тонн ртути. На 1 грамм черновой меди отходы медеплавильной промышленности содержат 2,09 тонн пыли, в составе которой содержится до 15% меди, 60% окиси железа и по 4% мышьяка, ртути, цинка и свинца. Отходы машиностроительных и химических производств содержат до 1 тыс. мг/кг свинца, до 3 тыс. мг/кг меди, до 10 тыс. мг/кг хрома и железа, до 100 г/кг фосфора и до 10 г/кг марганца и никеля. В Силезии вокруг цинковых заводов громоздятся отвалы с содержанием цинка от 2 до 12% и свинца от 0,5 до 3%.
С выхлопными газами на поверхность почв попадает более 250 тыс. тонн свинца в год; это главный загрязнитель почв свинцом.
1.4. Методы определения тяжелых металлов
На сегодняшний день существуют две группы основных аналитических методов, определяющие наличие тяжелых металлов в почве:
1. Электрохимические
Электрохимические методы классифицируют по природе аналитического сигнала. Так, в ходе анализа можно измерять потенциал одного из электродов (потенциометрия), сопротивление ячейки или электропроводность раствора (кондуктометрия). Во многих случаях на электроды накладывают внешнее напряжение, после чего измеряют силу тока, проходящего через раствор (вольтамперометрические методы, в частности полярография). При этом на поверхности электродов протекают окислительно-восстановительные реакции, то есть идет электролиз раствора. Если провести электролиз до конца и измерить количество электричества, пошедшего на окисление (или на восстановление) определяемого вещества, можно рассчитать массу этого вещества. Такой метод называют кулонометрией. Иногда содержание определяемого вещества рассчитывают по привесу электрода, т. е. по массе выделившегося на нем продукта электролиза (электрогравиметрия). [3]
Электрохимические методы довольно селективны (кроме кондуктометрии), поэтому с их помощью количественно определяют одни элементы в присутствии других, раздельно определяют разные формы одного элемента, делят сложные смеси и идентифицируют их компоненты, а также концентрируют некоторые микропримеси. Электрохимические методы широко применяют для контроля состава природных и сточных вод, почв и пищевых продуктов, технологических растворов и биологических жидкостей. Соответствующие методики не требуют сложного оборудования, в них не используются высокие температуры и давления. Разные электрохимические методы различаются по чувствительности, точности, экспрессности и другим показателям, а потому хорошо дополняют друг друга [5].
Рассмотрим методы электрохимической группы:
вольтамперометрии:
Вольтамперометрическими называют методы анализа, основанные на регистрации и изучении зависимости тока, протекающего через электролитическую ячейку, от внешнего наложенного напряжения. Графическое изображение этой зависимости называют вольтамперограммой. Анализ вольтамперограммы даёт информацию о качественном и количественном составах анализируемого вещества.
Для регистрации вольтамперограмм нужна электролитическая ячейка, состоящая из индикаторного электрода и электрода сравнения. Электродом сравнения обычно служит насыщенный каломельный электрод или слой ртути на дне электролизёра. В качестве индикаторного используют ртутный капающий электрод, микродисковые платиновый или графитовый электроды.
В зависимости от типа индикаторного электрода вольтамперометрические методы принято делить на полярографию и собственно вольтамперометрию. Если в качестве индикаторного электрода используют ртутный капающий электрод, то полученные зависимости силы тока от напряжения называют полярограммами и соответственно метод анализа – полярографией. Метод был создан выдающимся чешским электрохимиком лауреатом Нобелевской премии Яр. Гейровским (1922). При работе с любым другим индикаторным электродом, в том числе и со стационарным ртутным, дело имеют с вольтамперометрией.
потенциометрии:
Потенциометрический анализ – это измерение показателей тех веществ, которые находятся в ионном состоянии. Иными словами, под объектами исследования выступают растворы, практически всегда водные, хотя анализ твердых веществ также осуществляется в случае, если есть наличие растворимых элементов. Для того чтобы исследовать некоторые частицы, может потребоваться электрод с чувствительной мембраной определенной формы, что поможет произвести анализ вязких веществ или гелей [3].
Потенциометрический анализ проводиться несколькими вариантами. Первый – это прямая потенциометрия. Чаще всего такой метод проводят для измерения уровня pH и зависит он от самого типа измерительного электрода. Этот метод самый простой. Второй метод – это потенциометрическое титрование, который осуществляется во множестве вариантов. Его суть состоит в том, что для вычисления показателей осуществляют ряд химических реакций под контролем ионоселективного электрода. Этот метод отличается от предыдущего большими трудозатратами, но и более точным результатом. И третий метод – метод добавок – родственный вышеописанному. Его проводят во множестве вариантов, которые и позволяют сделать анализ малых концентраций [4].
кулонометрии:
Кулонометрия - электрохимический метод анализа, основанный на измерении количества электричества, необходимого для электрохимического превращения определяемого вещества. В кулонометрии различают два вида анализа:
прямую кулонометрию;
кулонометрическое титрование.
кондуктометрии:
Кондуктометрические методы анализа основаны на измерении электропроводности исследуемых растворов. Существует несколько методов кондуктометрического анализа:
· прямая кондуктометрия – метод , позволяющий непосредственно определять концентрацию электролита путем измерения электропроводности раствора с известным качественным составом;
· кондуктометрическое титрование– метод анализа, основанный на определении содержания вещества по излому кривойтитрования. Кривую строят по измерениям удельной электропроводности анализируемого раствора, меняющейся в результате химических реакций в процессе титрования;
· хронокондуктометрическое титрование – основано на определении содержания вещества по затраченному натитрование времени, автоматически фиксируемого на диаграммной лентерегистратора кривой титрования.
Таким образом, можно найти и вычислить содержание тяжёлых металлов с низким пределом обнаружения в почвенном образце.
2.Экстракционно-фотометрические методы
Эти методы применяют в аналитической химии очень даже широко, причем определение анализируемого компонента в экстракте может производиться как фотометрическим, так и другим методом: полярографическим, спектральным.
Вместе с тем существуют некоторые группы экстракционных методов, в которых фотометрическое окончание является наиболее эффективным, обеспечивая необходимую быстроту и точность определения. Эти методы называются экстракционно-фотометрическими. Весьма распространенной является методика, по которой определенный микроэлемент переводят в растворимое в воде окрашенное соединение, экстрагируют его и экстракт фотомоделируют. Такая методика позволяет устранить мешающее влияние посторонних компонентов и увеличивает чувствительность определения, так как при экстракции происходит концентрирование микропримесей. Например, определение примесей железа в солях кобальта или никеля проводят экстракцией его тиоцаинатных комплексов амиловым спиртом [3].
Спектрофотометрия
Спектрофотометрический метод анализа основан на спектрально-избирательном поглощении монохроматического потока световой энергии при прохождении его через исследуемый раствор. Метод позволяет определять концентрации отдельных компонентов смесей окрашенных веществ, имеющих максимум поглощения при различных длинах волн, он более чувствителен и точен, чем фотоэлектроколориметрический метод. Известно, что фотоколориметрический метод анализа применим только для анализа окрашенных растворов, бесцветные растворы в видимой области спектра обладают незначительным коэффициентом поглощения. Однако многие бесцветные и слабо окрашенные соединения (особенно органические) обладают характерными полосами поглощения в ультрафиолетовой и инфракрасной областях спектра, что используют для их количественного определения. Спектрофотометрический метод анализа применим для измерения светопоглощения в различных областях видимого спектра, в ультрафиолетовой и инфракрасной областях спектра, что значительно расширяет аналитические возможности метода.
Спектрофотометрический метод в ультрафиолетовой области спектра позволяет индивидуально определять двух- и трехкомпонентные смеси веществ. Количественное определение компонентов смеси основано на том, что оптическая плотность любой смеси равна сумме оптических плотностей отдельных компонентов.
Атомно – абсорционной спектроскопии
Метод атомно-абсорбционной спектроскопии в настоящее время является самым удобным для определения содержания металлов в объектах окружающей среды, пищевых продуктах, почвах, различных сплавах. Также метод используется в геологии для анализа состава горных пород, металлургии для определения состава сталей.
Метод атомно-абсорбционной спектроскопии рекомендуется большей частью государственных стандартов для определения подвижного цинка в почве, природных и водах, а также во множестве цветных сплавов [5].
Метод основан на поглощении электромагнитного излучения свободными атомами в стационарном (невозбужденном) состоянии. При длине волны, соответствующей переходу атома из основного в возбужденное электронное состояние, заселенность основного уровня уменьшается. Аналитический сигнал зависит от числа невозбужденных частиц в анализируемом образце (т.е. от концентрации определяемого элемента), следовательно, измеряя количество поглощенного электромагнитного излучения можно определить концентрацию определяемого элемента в исходном образце [4].
Метод основан на поглощении ультрафиолетового или видимого излучения атомами газов. Чтобы провести пробу в газообразное атомное состояние, ее впрыскивают в пламя. В качестве источника излучения применяют лампу с полым катодом из определяемого металла. Интервал длин волн спектральной линии, испускаемой источником света, и линии поглощения того же самого элемента в пламени очень узок, поэтому мешающее поглощение других элементов практически не сказывается на результатах анализа. Метод атомно-абсорбционного спектрального анализа отличается высокой абсолютной и относительной чувствительностью. Метод позволяет с большой точностью определять в растворах около восьмидесяти элементов в малых концентрациях, поэтому он широко применяется в биологии, медицине (для анализа органических жидкостей), в геологии, почвоведении (для определения микроэлементов в почвах) и других областях науки, а также в металлургии для исследований и контроля технологических процессов.
Через слой атомных паров пробы, получаемых с помощью атомизатора пропускают излучение в диапазоне 190-850 нм. В результате поглощения квантов света атомы переходят в возбужденные энергетические состояния. Этим переходам в атомных спектрах соответствуют т. наз. резонансные линии, характерные для данного элемента. Согласно закону Бугера-Ламберта-Бера, мерой концентрации элемента служит оптическая плотность A = lg(I0/I), где I0 и I-интенсивности излучения от источника соответственно до и после прохождения через поглощающий слой.
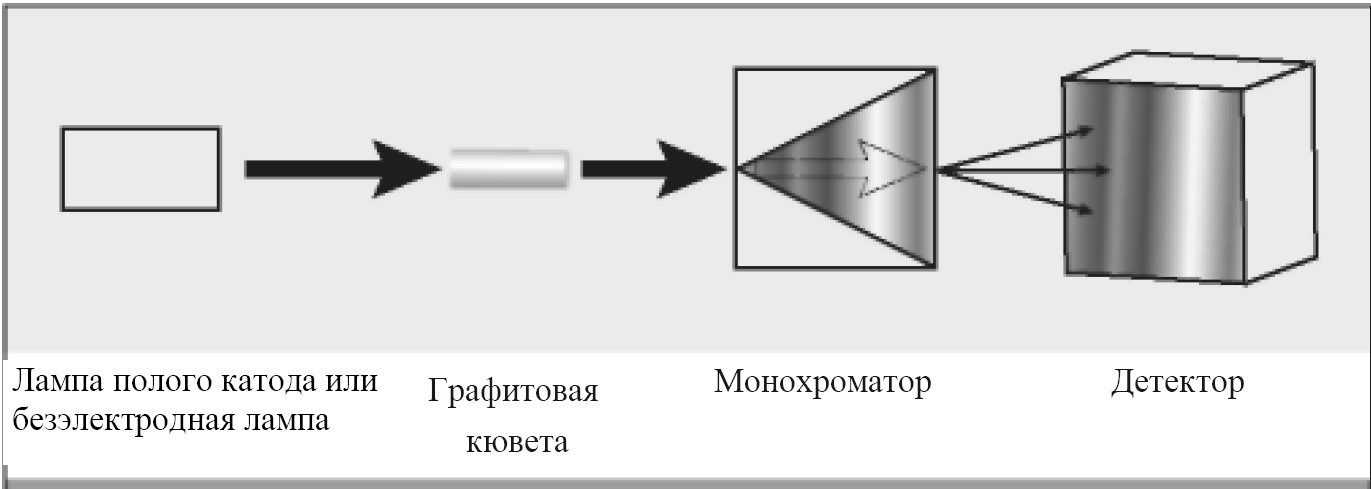
Рисунок 1.1. Принципиальная схема атомно-абсорбционного спектрометра: 1-лампа полого катода или безэлектродная лампа; 2-графитовая кювета; 3-монохроматор; 4-детектор
По точности и чувствительности этот метод превосходит многие другие; поэтому его применяют при аттестации эталонных сплавов и геологических пород (путем перевода в раствор).
Существенным отличием атомной абсорбции от пламенно-эмиссионной спектрометрии является то, что в последнем методе измеряется излучение, испускаемое атомами в возбужденном состоянии в пламени, а атомная абсорбция основана на измерении излучения, поглощенного нейтральными, невозбужденными атомами, находящимися в пламени, которых в пламени во много раз больше, чем возбужденных. Этим объясняется высокая чувствительность метода при определении элементов, имеющих высокую энергию возбуждения, т. е. трудно возбуждающихся [4].
Источником света в ААС служит лампа с полым катодом, испускающая свет, имеющий очень узкий интервал длин волн, порядка 0, 001нм. Линия поглощения определяемого элемента несколько шире испускаемой полосы, что позволяет измерять линию поглощения в ее максимуме. Прибор содержит необходимый набор ламп, каждая лампа предназначается для определения только одного какого-либо элемента.
«Кюветой» в ААС служит само пламя. Поскольку в ААС соблюдается закон Бэра, чувствительность метода зависит от длины поглощающего слоя пламени, которая должна быть постоянной и достаточно большой.
Применяют пламя, для получения которого в качестве горючего используют ацетилен, пропан или водород, а в качестве окислителя - воздух, кислород или оксид азота (1). Выбранная газовая смесь определяет температуру пламени. Воздушно-ацетиленовое пламя и воздушно-пропановое имеют низкую температуру (2200-2400 °С). Такое пламя используют для определения элементов, соединения которых легко разлагаются при этих температурах. Воздушно-пропановое пламя используют тогда, когда имеются затруднения в получении ацетилена; такая замена осложняет работу, поскольку в техническом пропане имеются примеси, загрязняющие пламя. При определении элементов, образующих труднодиссоциирующие соединения используют высокотемпературное пламя (3000-3200 ОС, создаваемое смесью оксид азота (1) - ацетилен. Такое пламя необходимо при определении алюминия, бериллия, кремния, ванадия и молибдена. Для определения мышьяка и селена, превращенных в их гидриды, требуется восстановительное пламя, образующееся сжиганием водорода в аргоно-воздушной смеси. Ртуть определяют (беспламенным методом» , поскольку она может существовать в парообразном состоянии и при комнатной температуре.
Сравнительная оценка возможностей и характеристик различных оптических методов не может носить абсолютного характера в связи с большим разнообразием и спецификой задач анализа. Различными могут быть требования к концентрационному диапазону, точности и нижним границам количественных определений. В зависимости от массы анализируемой пробы существенно различны требования к характеристике пределов обнаружения, достигаемых применяемым методом анализа. Так, располагая большой массой пробы, можно решить задачу определения микропримесей с помощью методов анализа, характеризуемых низкими относительными пределами обнаружения. Если же в распоряжении аналитика имеется лишь малая масса пробы, метод анализа должен характеризоваться низкими абсолютными пределами обнаружения интересующих элементов-примесей. Не последнюю роль в оценке недостатков и достоинств различных методов играет экономичность этих методов: стоимость аппаратуры, расход энергии, трудовые затраты, продолжительность анализа [5].
Атомно-эмиссионный спектральный анализ - практически самый распространенный экспрессный высокочувствительный метод идентификации и количественного определения малых содержаний элементов. Важным достоинством метода по сравнению с другими оптическими спектральными, а также многими химическими и физико-химическими методами анализа является возможность одновременного количественного определения большого числа элементов в широком интервале концентраций с приемлемой точностью при использовании малой массы пробы [4].
Достоинствами метода атомно-флуоресцентного анализа являются сравнительно низкий уровень фона, высокая селективность измерений, малые спектральные помехи, что позволяет детектировать слабые аналитические сигналы и соответственно очень малые абсолютные количества элементов. К недостаткам метода атомно-абсорбционной и в определенной мере атомно-флуоресцентной спектрометрии следует отнести затруднительность одновременного определения нескольких элементов [3].
С точки зрения возможности определения ультрамалых абсолютных содержаний элементов-примесей (#10-11-10-12 г) из оптических атомно-спектральных методов заслуживают особого внимания новые атомно-флуоресцентные и атомно-ионизационные методы с возбуждением и ионизацией атомов с помощью перестраиваемых лазеров на красителях, а также некоторые современные варианты оптических атомно-эмиссионного и атомно-абсорбционного методов анализа. В последнее время широкое распространение получил атомно-эмиссионный анализ с возбуждением спектров в высокостабильной индуктивно-связанной плазме (ИСП-АЭС). Современные анализаторы на основе этого метода обычно включают полихроматор с решеткой и приемники с зарядовой связью. Такая оптическая схема позволяет одновременно регистрировать все спектральные линии в ультрафиолетовом и видимом диапазонах. Программное обеспечение современных ИСП-АЭС-анализаторов способно автоматически рассчитывать концентрацию определяемых элементов по интенсивности их спектральных линий с коррекцией фона и возможных спектральных наложений. Соответственно такие анализаторы отличаются высокой точностью и продуктивностью [4].
Основными особенностями МГА-915-М является: универсальность и селективность. Анализатор МГА-915М, благодаря своей высокой селективности, позволяет определять содержание широкого круга элементов в пробах самого разного состава – без или с минимальной пробоподготовкой. ААС с ЭТА и зеемановским корректором неселективного поглощения во всем мире признан в качестве референтного метода при определении малых содержаний элементах в пробах сложного состава [5].
Пределы обнаружения элементов на уровне лучших атомно-абсорбционных спектрометров, предлагаемых на рынке аналитического оборудования.
Автоматизация измерений. МГА-915М является полным автоматом с автоматической сменой источников излучения и установкой соответствующих резонансных линий, присутствует турель на 6 ламп (компьютерная перестройка с одного элемента на другой без необходимости ручной юстировки). Для ввода проб в МГА-915М используется автосемплер с 55 ячейками для проб. Полученные данные могут непрерывно передаваться в АСУ для управления технологическим процессом. Анализ воздуха - с электростатическим осаждением аэрозолей воздуха непосредственно в графитовом атомизаторе. Анализ низких содержаний гидридообразующих элементов (в частности Se, As, и др.) и ртути в природных водах с помощью ртутно-гидридной приставки. Возможно проведение прямого анализа питьевых, сточных и морских вод и биожидкостей (без предварительной пробоподготовки). Прибор имеет автономную систему охлаждения. Спектрометр «МГА-915М» может применяться в экологии, геологоразведке, контроле технологических процессов, производственной санитарии, научных исследованиях [5].
Экологический контроль:
- измерение содержания различных элементов в воде, почве, донных отложениях, атмосферном воздухе, а также тканях растительного и животного происхождения.
Технологический контроль:
- экспресс-анализ и непрерывный контроль состава веществ в технологических процессах;
- входной контроль, контроль готовой продукции.
Медицина:
- анализ тканей и жидкостей биологического происхождения (кровь, моча, волосы и т.д.)
Криминалистика:
- идентификация примесей и следовых количеств элементов.
Ветеринарные лаборатории:
- корма, кровь, продукты животноводства.
Контролирующие и сертифицирующие лаборатории:
- анализ пищевых продуктов и кормов, анализ сточных, природных, питьевых вод и воздуха.
Контроль качества вин и крепких напитков:
- содержание широкого круга элементов в ликероводочной продукции;
- определение подлинности напитков.
Спектрометр измеряет концентрацию элементов, аналитические линии которых лежат в рабочей области спектра спектрометра, методом атомно-абсорбционного (АА) анализа с электротермической атомизацией. Управление процессом измерения и обработка полученной информации производится с помощью компьютера с установленным программным обеспечением. Дозирование жидкой пробы в печи атомизатора может проводиться либо ручным микродозатором объемом 5...50 мкл, либо с помощью автодозатора (автосемплера).

Рисунок 1.2. Атомно-абсорбционный спектрометр «МГА-915М»
«МГА-915» предназначен для измерения содержания элементов (Ag, Al, As, Au, Ba, Be, Bi, Cd, Co, Cr, Cu, Fe, Hg, Mn, Mo, Ni, Pb, Pd, Pt, Rh, Ru, Se, Sn, Sb, Sr, Ti, V, Zn и др.) в широком круге объектов: различных типах вод (питьевые, природные, сточные, морские), атмосферном воздухе, почвах, донных отложениях и осадках сточных вод, пищевых продуктах и сырье (в том числе в напитках), биологических тканях и жидкостях (кровь, моча), продуктах нефтехимического производства, а также металлах и сплавах и иных объектах.
2. Экспериментальная часть
Определение содержания тяжёлых металлов в пробах почв проводили согласно ПНД Ф 16.1:2:2.2.63-09 [12].
2.1. Приготовление раствора
Все растворы готовят с использованием бидистиллированной (деионизованной) воды.
Раствор азотной кислоты, объемная доля 0,3%
В коническую колбу помещают 300-400 см3 бидистиллированной (деионизованной) воды, осторожно, при перемешивании вливают 3см3 концентрированной азотной кислоты квалификации оч.ч., доводят до 1000 см3 бидистиллированной водой и перемешивают. Срок хранения в сосуде из полиэтилена, полипропилена или фторопласта не ограничен.
Раствор нитрата палладия, массовая концентрация 0,5 г/дм3
В мерную колбу вместимостью 25 см3 помещают 1,25 см3раствора исходного реактива (массовая концентрация 10 г/дм3) и доводят до метки бидистиллированной водой.
Срок хранения в закрытом сосуде из полиэтилена , полипропилена или фторопласта в темном месте-6 месяцев.
Раствор нитрата магния, массовая концентрация 0,5 г/дм3
В мерную колбу вместимостью 25 см3 помещают 1,25 см3 раствора исходного реактива (массовая концентрация 10 г/дм3) и доводят до метки бидистиллированной (деионизованной ) водой. Срок хранения в закрытом сосуде из полиэтилена ,полипропилена или фторопласта в темном месте-6 месяцев.
Приготовление раствора азотной кислоты молярной концентрации 5 моль/дм 3
В стакан из термостойкого стекла помещают 400-500 см3бидистиллированной воды, приливают 310 см3 концентрированной азотной кислоты квалификации ос.ч., тщательно перемешивают стеклянной палочкой, а затем доводят объем бидистиллированной водой до 1000 см3.Срок хранения не ограничен.
Приготовление раствора азотной кислоты , объемное соотношение 1:1
100 см3 концентрированной азотной кислоты разбавляют равным объемом бидистиллированной воды при перемешивании. Срок хранения не ограничен.
Приготовление рабочих растворов элементов массовой концентрации 100 мг/дм3
В мерную колбу вместимостью 50 см3 помещают при помощи пипетки 5 см3 государственного стандартного образца состава раствора соответсвующего иона, доводят до метки раствором азотной кислоты объемной доли 0,3% и перемешивают. Раствор устойчив при хранение в полиэтиленовой, пропиленовой или фторопластовой посуде в течение 3 месяцев.
Приготовление рабочих растворов элементов массовой концентрации 1мг/дм3
В мерную колбу вместимостью 100 см3помещают при помощи пипетки 1см3 рабочего раствора соответствующего иона массовой концентрации 100 мг/дм3,доводят до метки раствором азотной кислоты объемной доли 0,3% и перемешивают. Раствор устойчив при хранении в полиэтиленовой ,полипропиленовой или фторопластовой посуде в течение 1 недели.
2.2. Методика определения
Подготовка проб к анализу.
Для измерения проб на приборе «МГА 915М» провели подготовку проб к анализу. Для этого, навеску почвы массой 2,00 г поместили в коническую термостойкую колбу вместимостью 100 см3,прилили 10 см3 раствора азотной кислоты молярной концентрации 5 моль/дм3и тщательно перемешали. Колбу закрыли стеклянной воронкой и поместили в кипящую водяную баню на 3 часа. Каждый час пробу перемешивали.
После остывания раствор фильтровали через фильтр в мерную колбу вместимостью 50см3,промывая пробу на фильтре и в исходной колбе бидистиллированной водой (приблизительно 30 см3). Полученный фильтрат довели до метки бидистиллированной водой. Далее, подготовили холостую пробу. Пробу готовили и анализировали одновременно с каждой партией рабочих проб, используя те же реактивы и в тех же количествах, что и при анализе проб, но без навески анализируемого объекта.
Градуировка спектрометра
Градуировочная характеристика спектрометра представляет собой сигнал от массы элемента.
В графитовую кювету атомизатора вводят последовательно дозатором или при помощи автосемплера 10,20,40 мм2 градуировочного раствора. Рекомендуемые значения массовой концентрации градуировочных растворов для каждого элемента при градуировке и при анализе проб.
Каждый из рекомендуемых объемов градуировочного раствора последовательно вводили в графитовую кювету по 5 раз и измеряли величины аналитического сигнала, используя программное обеспечение к спектрометру. Затем рассчитывали среднее арифметическое значение сигнала для всех вводов и его СКО, которое не должно превышать 6%.
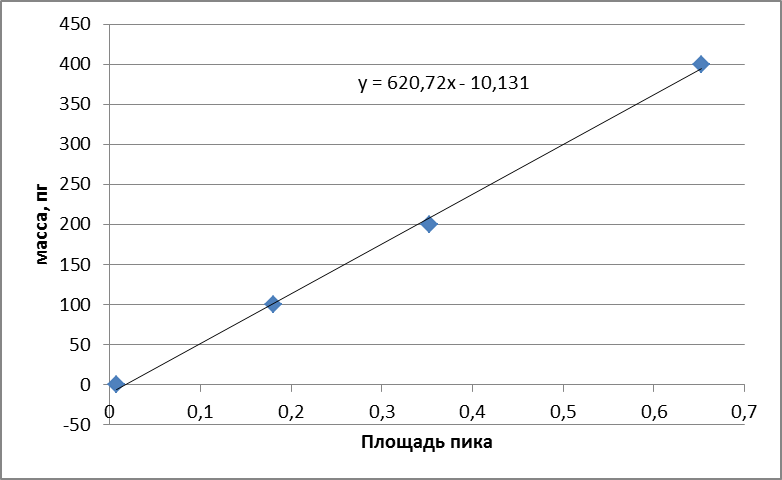
Рисунок 2.1. Градуировочная зависимость для меди
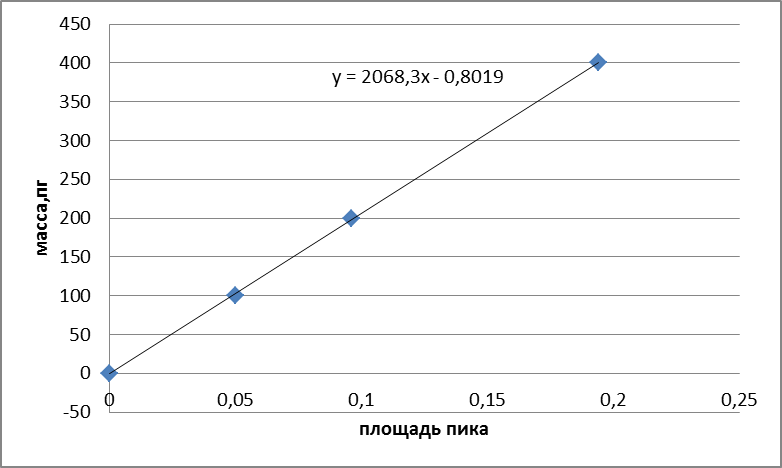
Рисунок 2.2. Градуировочная зависимость для свинца
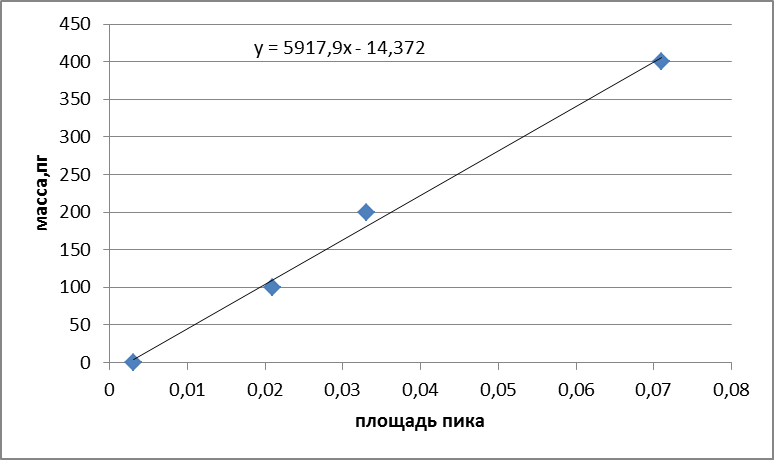
Рисунок 2.3. Градуировочная зависимость для никеля
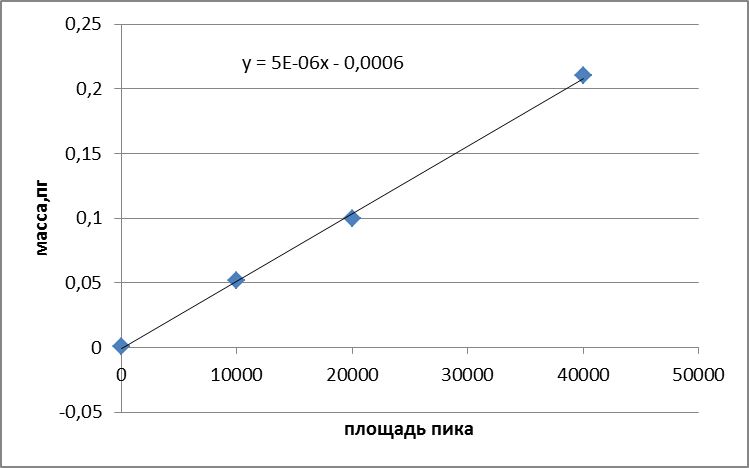
Рисунок 2.4. Градуировочная зависимость для цинка
Измерение массовой концентрации элементов в рабочей пробе
Перед началом измерений содержания определенного элемента в пробах, провели «холостую атомизацию» Пробы, подготовленные, анализируют в соответствии с РЭ спектрометра с обязательным предварительным отжигом графитовой кюветы.
Начинать анализ рекомендуется с ввода графитовую кювету минимально возможного объема пробы (10 мм3). В зависимости от полученной величины аналитического сигнала поступают следующим образом:
- если величина сигнала мала (менее половины величины сигнала от первой градуировочной точки), то увеличивают объем дозируемой пробы, но не более чем до 40мм3;
- если в окне результатов вместо значения концентрации появляется пометка »> калибр.» или «некорректное значение», то пробу разбавляют таким образом, чтобы сигнал от разбавленной пробы при дозировании от 10 до 40 мм3соответствовал примерно середине диапазона градуировочной характеристики.
2.3. Обработка результатов измерений
Массовую долю определяемого элемента в пробе (X,млн-1)
Вычисляют по формуле:
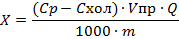
где Ср - массовая концентрация элемента в растворе пробы, мкг/дм3
Cхол - массовая концентрация элемента в растворе холостой пробы, мкг/дм3
Vпр – объем раствора пробы
Q – коэффициент разбавления раствора пробы
1000 – коэффициент согласования размерности единиц измерения объема
M – масса навески пробы, г
Результат измерения в документах, предусматривающих его использование, может быть представлен в виде:
Х±х, млн-1,р=0,95,
где Х - единичный результат измерений, млн-1;
х - показатель точности методики (границы абсолютной погрешности при вероятности p=0,95 для n=1),млн-1;
х – граница относительной погрешности единичного результата измерений
х=
3. Обсуждение результатов
Среди множества проблем, стоящих в настоящее время перед человечеством одно из первых мест занимает проблема загрязнения окружающей среды различными химическими веществами - продуктами техногенеза, большая часть которых накапливается в почве. Среди загрязнителей значительное место занимают тяжелые металлы. Основным фактором остроты этой экологической ситуации остается высокая концентрация природозагрязняющих и природоразрушающих производств, преобладание таких экологически опасных отраслей промышленности, как черная и цветная металлургия, химическая и горнодобывающая промышленность, машиностроение и другие. Антропогенные почвы отличны от естественных почв по химическим и водно-физическим свойствам. Они переуплотнены, почвенные горизонты перемешаны и обогащены строительным мусором, бытовыми отходами, из-за чего имеют более высокую щелочность, чем природные их аналоги. Основная часть загрязняющих веществ поступает в городские почвы с атмосферными осадками, с мест промышленных и бытовых отходов. Oсобую опасность представляет загрязнение почв тяжелыми металлами. Для оценки содержания тяжелых металлов меди, никеля, цинка, свинца в естественных и антропогенных почвах Тульской области проводили измерение содержания их кислоторастворимых форм методом атомно-абсорбционной спектроскопии. Данный метод основан на извлечении элементов из проб почв с последующим измерением их массовой концентрации с использованием атомно-абсорбционного спектрометра с электротермической атомизацией модификации МГА-915М.
Из результатов измерений, представленных в таблице 1, видно, что наибольшее содержание тяжёлых металлов в почве наблюдается непосредственно в городах. Неравномерное распределение происходит из-за разной интенсивности антропогенного фактора в местах производимых замеров. Именно в городах и ближайших к ним территориях сосредоточены промышленные производства и сельскохозяйственные зоны.
Наиболее явным загрязнение обнаруживается в антропогенных почвах городов Плавска, Суворова и Новомосковска, что связанно с развитой в этих районах промышленностью (химической, энергетической, горнодобывающей, машиностроительной и др.), интенсивным сельским хозяйством и обширной развитой сетью дорог.
Таблица 3.1. Содержание массовой доли кислоторастворимых форм металлов (меди, никеля, цинка, свинца) в поверхностных пробах загрязненных почв
|
Определяемый
металл
Пробы почв
|
Zn
|
Cu
|
Ni
|
Pb
|
|
г.Плавск мг/кг
|
58±11
|
280±60
|
45±9
|
830±160
|
|
г.Плавск «Белая гора» мг/кг
|
30 ± 6
|
5 ± 1
|
7 ± 1
|
3 ± 1
|
|
г.Плавск « Белая гора» (рядом луговой склон) мг/кг
|
23 ± 5
|
61 ± 13
|
22 ± 5
|
32 ± 7
|
|
г.Суворов мг/кг
|
43 ± 9
|
640±130
|
1500±300
|
315±60
|
|
д.Варушицы, (хвойный лес) мг/кг
|
45 ± 9
|
1.4 ± 0.3
|
1 ± 0.2
|
4 ± 1
|
|
д.Варушицы, (степной склон) мг/кг
|
72 ± 15
|
23 ± 5
|
3 ± 1
|
48 ± 10
|
|
п. Шилово (лес) мг/кг
|
176 ± 40
|
12 ± 2
|
394 ± 90
|
12 ± 2
|
|
п.Шилово(степной склон) мг/кг
|
39 ± 10
|
68 ± 20
|
25 ± 5
|
187 ± 39
|
|
г.Новомосковск мг/кг
|
46 ± 10
|
850±170
|
200±40
|
750±150
|
|
с.Быковка мг/кг
|
8 ± 2
|
7 ± 2
|
6 ± 1
|
95 ± 20
|
|
ОДК мг/кг
|
80
|
220
|
132
|
130
|
В городе Плавске наблюдается сильное загрязнение медью и свинцом, что связано с наличием в черте города крупного машиностроительного завода "Смычка" (ОАО Плавский машиностроительный завод «Плава») и Плавского авторемонтного завода. В результате их деятельности образуется большое количество отходов в виде металлической пыли, амортизационного лома, металлические стружки и опилки, шлаки, золы, шламы и др. Безвозвратные потери металла вследствие трения и коррозии составляют примерно 25 % от общего количества амортизационного лома. Шламы из отстойников очистных сооружений и прокатных цехов содержат большое количество твердых материалов, концентрация которых составляет от 20 до 300 г/л. После обезвреживания и сушки шламы используют в качестве добавки к агломерационной шихте и удаляют в отвалы. Шламы термических литейных и других цехов содержат токсичные соединения свинца, хрома, меди, цинка. Повышенное содержание тяжёлых металлов и их солей может наблюдаться в радиусе 5 км (иногда до 10 км) от предприятия.
Обнажение «Белая гора» – это действующий геологический памятник природы регионального значения. Расположен в Плавском районе, на северо-западной окраине Плавска, на левом берегу Плавы. Хотя «Белая гора» находится в непосредственной близости от самого Плавска, содержание тяжёлых металлов здесь не превышает ориентировочно допустимых концентраций. Здесь проводят постоянный мониторинг экологической обстановки и следят за состоянием воды, воздуха и почвы. На территории памятника природы запрещено вести камнеразработки; изменять гидрологический режим реки Плава, который может угрожать затоплению обнажения; устраивать загоны для скота. Однако из-за общего ухудшения экологии в Тульской области в скором времени может пострадать и природный памятник «Белая гора», что скажется на редких видах растений и животных, некоторые из которых занесены в Красную книгу.
По нашим измерениям, в Суворове наблюдается существенное превышения допустимых значений содержания тяжёлых металлов в почве. Большие объёмы загрязняющих среду выбросов были зафиксированы ещё в 2000-ом году в Государственном (национальном) докладе. Особо отмечается влияние Черепецкой ГРЭС, работающей с 1953 года в черте города. При сжигании топлива в окружающую среду попадает множество токсичных веществ, среди которых и оксиды тяжёлых металлов. Именно при горении угля и нефти отмечают наиболее интенсивные выбросы никеля, а Черепетская ГРЭС работает на угле. Установлено, что в образцах летучей золы от предприятий, работающих на угле содержали 20-80 % компонентов никеля.
Деревня Варушицы находится в 18 км от г. Суворова, содержание тяжёлых металлов в почве по нашим измерениям здесь не превышают допустимые нормы. Это может быть связанно с отсутствием промышленных производств и менее интенсивным развитием хозяйства и системы дорог.
Посёлок Шилово находится в 32 км на восток от города Ефремов. На равнинной территории содержание тяжёлых металлов ниже допустимых норм. На территории леса видно повышенное содержание в почве цинка и никеля, при отсутствии поблизости локальных источников загрязнений. Это объясняется аккумуляцией тяжёлых металлов деревьями обширного лесного массива в окрестностях посёлка Шилово. Поступление тяжёлых металлов происходит за счёт атмосферных выпадений и протекающей здесь реки Красивая меча, на берегах которой часто фиксируются несанкционированные свалки. Именно лиственные леса особенно сильно подвержены аккумуляции тяжёлых металлов, которые затем попадают в почву.
В Новомосковском районе развита химическая, энергетическая и пищевая промышленность, строительная индустрия, сельское хозяйство, железнодорожный и автомобильный транспорт. По нашим исследованиям в Новомосковске выявлено серьёзное превышение ОДК тяжёлых металлов в почве, особенно меди и свинца. Город занимает одно из ведущих мест в стране по производству минеральных удобрений и ряда других видов химической продукции (79 % отгруженных товаров). В городе и округе работают более 100 промышленных предприятий и строительных организаций. Наиболее крупными в промышленности являются ОАО «Новомосковская акционерная компания «Азот», ООО «Проктер энд Гэмбл-Новомосковск», ОАО «Оргсинтез», ООО «Полипласт Новомосковск», ОАО «Полимерконтейнер», ОАО «Кнауф-Гипс», ГРЭС филиала Квадра-«Тульская региональная генерация», «Аэрозоль Новомосковск», «Новомосковский завод керамических материалов — Центргаз», «Новомосковский огнеупорный завод», «ГОТЭК-центр», «ЖБИ», ОАО «НМУ Центрэлектромонтаж», ООО «ОВК — Новомосковск», ОАО «Новомосковский авторемонтный завод» и другие. В Новомосковском городском округе находятся самое крупное в Европе месторождение каменного гипса, месторождения угля, пирита, глины для кирпичного и керамического производства, а также известняка и суглинков. В качестве топлива на Новомосковской ГРЭС используют природный газ, при горении которого происходит намного меньшее количество выбросов загрязняющих окружающую среду веществ, что объясняет относительно невысокое содержание никеля. Новомосковская акционерная компания "Азот" является крупнейшим отечественным производителем аммиака и азотных удобрений, а также одним из ведущих в отрасли по видам и количеству производимой продукции. Предприятием выпускаются минеральные удобрения, аммиак, органические пластмассы и смолы, хлор, каустическая сода, хлористый кальций, концентрированная и особой чистоты азотная кислота, аргон, метанол. Многие минеральные удобрения, а также некоторые бытовые и промышленные отходы, относятся к группе агрохимикатов, в их примесях часто обнаруживают высокое содержание меди. Большие выбросы меди происходят от «НМУ Центрэлектромонтаж», ООО «ОВК — Новомосковск», ОАО «Новомосковский авторемонтный завод», приуроченные, в основном, к гальваническим производствам. Особую роль в загрязнении свинцом в Новомосковске играет транспорт, потому что здесь данная отрасль наиболее интенсивно развита. Тяжелые металлы поступают в окружающую среду в ходе работы самого автотранспорта, а также при истирании дорожных покрытий. В результате в почву участков вблизи автотрасс поступают свинец, кадмий, алюминий, железо, никель, цинк, марганец и другие элементы. В первую очередь при рассмотрении влияния транспорта на экологическое состояние почв обращают внимание на свинец. Данный факт обусловлен широким использованием в качестве добавки к бензину тетраэтилсвинца. При сгорании бензина около 75% содержащегося в нем свинца выделяется в виде аэрозоля и рассеивается в воздухе, в дальнейшем перераспределяясь на различном расстоянии от дорожного полотна.
Село Быковка, расположенное в Киреевском районе, удалено примерно на 30 км от г. Тулы и г. Новомосковска. По нашим исследованиям содержание цинка, меди, никеля и свинца не превышает ОДК. Это может свидетельствовать о локальных загрязнениях почв в крупных промышленных центрах Тульской области. Большее содержание свинца по отношению к другим металлам, в пределах ориентировочно допустимой концентрации, связано, очевидно, в расположении в селе автотранспортной дороги.
Таким образом, по нашим исследованиям заметно повышенное содержание тяжёлых металлов в почве во многих районах Тульской области. Однако значительное превышение допустимых норм наблюдается в непосредственной близости с крупными промышленными предприятиями, на основании чего можно сделать вывод об узкой локализации загрязнений. В основном на территории Тульской области содержание тяжёлых металлов в почве находится в пределах нормы. Но по прогнозам, с учётом постоянного роста темпов промышленности и увеличением загруженности дорог, ситуация может меняться в худшую сторону.
На сайте Кадастра недвижимости и мониторинга природных ресурсов Тульской области представлены результаты исследования, проведённого в 2011 году Медведевым А.В., аспирантом Тульского государственного университета, в рамках Всероссийской научно-технической интернет-конференции. В результатах его работы приводится Картограмма загрязнения почвы тяжёлыми металлами по муниципальным районам Тульской области.
Из рисунка 3.1 видно, что загрязнение Суворовского и Новомосковского районов существовало уже в 2011 году. Однако в общем по Тульской области наблюдается стабильное содержание тяжёлых металлов в почве, не превышающие ОДК. Таким образом на основании данной картограммы и полученных нами результатов можно сказать, что загрязнения почвы тяжелыми металлами Тульской области: Плавский , Киреевский, Ефремовский районы относятся к зоне среднего загрязнения, а Суворовский и Новомосковский районы-к зоне высокого загрязнения… .
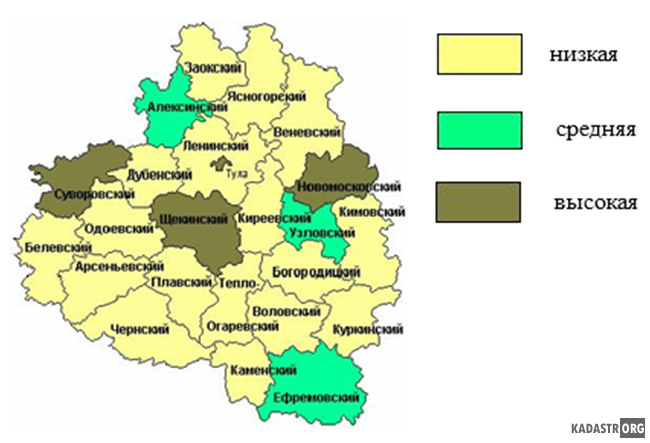
Рисунок 3.1. Картограмма загрязнения почвы тяжёлыми металлами
4. Экономическое обоснование исследования
4.1. Технико-экономическое обоснование исследование дипломной работы
Почва играет важную роль в круговороте тяжелых металлов, они представляют собой гетерогенные смеси разных органических и органо-минеральных составляющих глинистых минералов, оксидов железа, алюминия и марганца и других твердых частиц, а также различных растворимых соединений. Вследствие разнообразия типов почв, их окислительно-восстановительных условий и реакционной способности, механизмы и способы связывания тяжелых металлов в почвах разнообразны. Тяжелые металлы, в почвах содержаться в различных формах: в кристаллической решетке минералов в виде изоморфной подмеси, в солевой и окисной форме, в составе разных органических веществ, в ионообменном состоянии и в растворимой форме в почвенном растворе. Следует отметить, что, тяжелые металлы, поступая из почвы в растения и затем в организмы животных и человека, обладают способностью постепенно накапливаться. Наиболее токсичны ртуть, кадмий, свинец, мышьяк, отравление ими вызывает тяжелые последствия. Менее токсичны: цинк и медь, однако загрязнение ими почв подавляет микробиологическую деятельность и снижает биологическую продуктивность.
Тяжёлые металлы уже сейчас занимают второе место по степени опасности, уступая пестицидам и значительно опережая такие известные загрязнители, как двуокись углерода и серы. В перспективе они могут стать более опасными, чем отходы атомных электростанций и твёрдые отходы. Загрязнение тяжёлыми металлами связано их широким использованием в промышленном производстве. В связи с несовершенными системами очистки тяжёлые металлы попадают в окружающую среду, в том числе в почву, загрязняя и отравляя её. Тяжёлые металлы относятся к особым загрязняющим веществам, наблюдения за которыми обязательны во всех средах.
В настоящее время в России для оценки загрязнения почв тяжелыми металлами используется как официально одобренные, так и не имеющие официального статуса нормативы. Основное их назначение – не допустить поступления в избыточном количестве антропогенно накапливающихся в почве твердых металлов в организм человека и тем самым избежать их негативного влияния.
4.2. Расчет стоимости сырья и материалов
Таблица 4.1. Затраты на сырье и материалы
|
№№ П/П
|
Наименование сырья и материалов
|
Единица имзмерения
|
количество
|
Цена руб/ед.изм
|
Сумма,руб
|
|
1
|
Азотная кислота
|
250
|
20
|
1560
|
124,8
|
|
2
|
дионизированная вода
|
|
2
|
|
0
|
|
3
|
дистиллиров.вода
|
|
2
|
|
0
|
|
|
|
|
|
|
0
|
|
|
|
|
|
|
|
|
|
итого мат.затраты
|
|
|
|
124,8
|
|
|
транвспорт.затраты
|
|
|
|
1,248
|
|
|
всего
|
|
|
|
126,048
|
|
Таблица4.2. Расчет затрат на электроэнергию
|
|
№№ П/П
|
Наименование прибора
|
Мощность прибора
|
Время работы,час
|
Сумма,руб
|
|
1
|
весы аналитические
|
0,5
|
1,5
|
1,8
|
|
2
|
дистиллятор
|
1
|
10
|
24,1
|
|
3
|
компьютер
|
0,4
|
120
|
115,6
|
|
4
|
спектрометр
|
0,2
|
50
|
24,1
|
|
|
итого
|
|
|
165,6
|
|
Таблица 4.3. Расчет амортизации приборов и оборудования
|
|
№№ П/П
|
Наименование прибора
|
стоимость прибора,руб
|
время использования прибора,дн
|
норма амортизации %/год
|
|
1
|
весы аналитические
|
7202
|
1
|
10
|
|
2
|
дистиллятор
|
15780
|
1
|
5
|
|
3
|
компьютер
|
15000
|
5
|
9
|
|
4
|
спектрометр
|
88140
|
2
|
8
|
|
|
|
|
|
|
|
|
итого
|
|
|
|
|
Таблица 4.4. Расчет затрат на приобретение стеклянной посуды
|
|
№№ П/П
|
Наименование посуды
|
Количество, шт
|
Стоимость единицы, руб
|
Сумма,руб
|
|
1
|
цилиндр мерный,50мл
|
1
|
145
|
145
|
|
2
|
колба по 5мм
|
1
|
90
|
90
|
|
3
|
колба по 50мм
|
11
|
150
|
1650
|
|
4
|
колба круглодонная
|
1
|
250
|
250
|
|
5
|
кювета
|
2
|
150
|
300
|
|
6
|
наконечники пласт
|
4
|
85
|
340
|
|
|
итого
|
|
|
2775
|
|
Таблица 4.5. Расчет затрат на воду
|
|
№№ П/П
|
Наименование
|
расход воды,м3/ч
|
время работы
|
Сумма,руб
|
|
1
|
вода для получения дистилята
|
0,5
|
30
|
134,6
|
|
2
|
мытье посуды
|
0,3
|
20
|
53,82
|
|
3
|
|
|
|
0
|
|
|
|
|
|
188,42
|
|
4.3. Расчет накладных расходов
Накладные расходы принимаются в размере 150% от суммы основной
и дополнительной заработной платы без начислений в социальные фонды:
(20850+2085)*1,5=34402,5
|
|
|
Таблица 4.6 Смета затрат на проведение исследований
|
|
наименование
|
сумма,руб
|
доля в общих затратах,%
|
|
затраты на сырье и материалы
|
|
0
|
|
энергозатраты
|
165,6
|
0,25
|
|
затраты на воду
|
188,42
|
0,29
|
|
заработная плата с начислениями
|
30778,8
|
46,9
|
|
амортизация
|
61,26
|
0,09
|
|
накладные
|
34402,5
|
52,4
|
|
|
|
|
|
итого
|
65596,58
|
100
|
4.4. Расчет заработной платы и начислений на социальные нужды
4.4.1. Основная заработная плата
Исполнитель: лаборант
Время работы:4месяца
Основная заработная плата исполнителя: 4500*4=18000р
Заработная плата руководителя:15*190=2850руб
(15час.-общее число часов работы руководителя,190руб/час)
4.4.2 Дополнительная заработная плата
Дополнительная заработная плата принята в размере 10% от основной.
Доп.заработная плата: 0,1*(1800+2850)=2085
4.4.3 Начисления на социальные нужды
Начисления на социальные нужды составляет 34,2% от суммы основной
и дополнительной заработной платы.
Начисления: 0,342*(18000+2850+2085)=7843,8 руб.
заработная плата с начислениями на социальные нужды составит:
18000+2850+2085+7843,8=30778,8
Среди множества проблем, стоящих в настоящее время перед человечеством одно из первых мест занимает проблема загрязнения окружающей среды различными химическими веществами - продуктами техногенеза, большая часть которых накапливается в почве. Среди загрязнителей значительное место занимают тяжелые металлы. Основным фактором остроты этой экологической ситуации остается высокая концентрация природозагрязняющих и природоразрушающих производств, преобладание таких экологически опасных отраслей промышленности, как черная и цветная металлургия, химическая и горнодобывающая промышленность, машиностроение и другие. Антропогенные почвы отличны от естественных почв по химическим и водно-физическим свойствам. Они переуплотнены, почвенные горизонты перемешаны и обогащены строительным мусором, бытовыми отходами, из-за чего имеют более высокую щелочность, чем природные их аналоги. Основная часть загрязняющих веществ поступает в городские почвы с атмосферными осадками, с мест промышленных и бытовых отходов. Oсобую опасность представляет загрязнение почв тяжелыми металлами. Для оценки содержания тяжелых металлов меди, никеля, цинка, свинца в естественных и антропогенных почвах Тульской области проводили измерение содержания их кислоторастворимых форм методом атомно-абсорбционной спектроскопии. Данный метод основан на извлечении элементов из проб почв с последующим измерением их массовой концентрации с использованием атомно-абсорбционного спектрометра с электротермической атомизацией модификации МГА-915М.
5.Требования к охране труда
5.1 Общие сведения
1. Лаборатория должна быть обеспечена водопроводом, канализацией, электричеством, боксами с приточно-вытяжной вентиляцией с механическим побуждением, центральным отоплением и горячим водоснабжением, газифицирована.
2.В лаборатории должны быть оборудованы водопроводные раковины для мытья рук персонала и раковины, предназначенные для мытья инвентаря. Высушивание рук производится электрополотенцами.
3. Помещения должны оборудоваться легко открываемыми фрамугами и форточками, обеспеченными в летнее время мелкими сетками, и вытяжными шкафами с побудительной вентиляцией (скорость движения воздуха при открытых створках не менее 1 м/сек.).
4. Створки вытяжных шкафов во время работы должны быть максимально закрыты (опущенными с небольшим зазором внизу для тяги), открывать их надо только во время обслуживания приборов и установок. Приподнятые створки должны прочно укрепляться приспособлениями, исключающими неожиданное падение этих створок.
Выключатели вентиляции вытяжных шкафов должны располагаться вблизи их, а розетки для включения приборов, располагающихся в шкафах, следует выносить на их наружные панели.
5. Газовые краны вытяжных шкафов должны быть расположены у передних бортов (краев) с учетом устранения возможности случайного их открывания. Штепсельные розетки должны размещаться на торцевой стороне рабочего стола вне вытяжного шкафа.
6. Вентиляция помещений лабораторий должна оборудоваться в соответствии со СНиП-69-78 "Нормы проектирования лечебнопрофилактических учреждений". При эксплуатации вентиляционных устройств, помимо выполнения положений "Инструкции по эксплуатации и контролю эффективности вентиляционных устройств на объектах здравоохранения" от 20.03.75 г. "1231-75 и ГОСТа 12.3.018-79 ССТБ, необходимо приказом руководителя (главного врача санэпидстанции) назначить лицо, непосредственно отвечающее за эксплуатацию систем вентиляции.
7. Принцип устройства вентиляции должен быть построен так, чтобы давление в коридорах было несколько выше, чем в лабораторных комнатах и боксах. Воздух из коридора в боксы должен проходить через верхнее отверстие, оборудованное фильтрованием (фильтровальными установками).
8. Все помещения лабораторий должны иметь естественное и искусственное освещение, отвечающее требованиям, предусмотренным строительными нормами и правилами. Для отдельных комнат (термальная комната, фотолаборатория и др.) допускается отсутствие естественного освещения. В каждой комнате должен быть общий выключатель.
9. Температура воздуха в лабораторных помещениях должна поддерживаться в пределах 18-21°. Для районов III и IV климатических зон в летний период устанавливаются кондиционеры с охлаждением воздуха.
10. Стены в лабораторных помещениях должны быть облицованы глазурованной плиткой на высоту 1,5 м или выкрашены масляной краской светлых тонов; в боксах, операционных и манипуляционных комнатах, в виварии - белой плиткой или плиткой из гладких синтетических материалов. Ширина основных проходов к рабочим местам или между двумя рядами оборудования должна быть не менее 1,5 метров с учетом выступающих конструкций.
11. Столы, на которых проводятся микроскопические исследования при дневном свете, должны размещаться у окон.
Рабочие поверхности столов следует изготавливать из водонепроницаемого, кислото-щелочеустойчивого, несгораемого материала, не портящегося от обработки кипятком и дезинфицирующими растворами.
12. Лабораторная мебель должна быть окрашена масляной или эмалевой краской светлых тонов. Внутренние и наружные поверхности мебели не должны иметь щелей и пазов, затрудняющих обработку обеззараживающими веществами.
13. Помещения лабораторий должны располагаться по ходу производства анализов и обеспечиваться рациональным размещением в отношении основных потоков технологического процесса.
14. В коридорах или на хорошо доступных местах должны быть размещены щиты с набором противопожарного инвентаря и установлены пожарный гидрант и огнетушитель. Огнетушители следует размещать в помещениях, где проводится работа с огне- или взрывоопасными реактивами и опасными в пожарном отношении нагревательными приборами.
15.Аппаратура и оборудование должны размещаться в каждой лаборатории таким образом, чтобы обеспечивалось наибольшее удобство в работе и наименьшие затраты времени на переходы.
Необходимо учесть, что умелая эксплуатация помещений, бережное отношение к оборудованию, инвентарю, аппаратуре, забота о содержании в чистоте и порядке рабочего места - необходимые элементы производственной эстетики, санитарии и гигиены.
В помещении лаборатории запрещается:
а) оставлять без присмотра зажженные горелки и другие нагревательные приборы, работать на горелках с неисправными кранами, держать вблизи горящих горелок вату, марлю, спирт и другие воспламеняющиеся вещества;
б) убирать случайно пролитые огнеопасные жидкости при зажженных горелках и включенных электронагревательных приборах;
в) зажигать огонь и включать ток, если в лаборатории пахнет газом. Предварительно необходимо определить и ликвидировать утечку газа и проветрить помещение. Место утечки газа определяется с помощью мыльной воды. Все мероприятия по устранению утечки газа должны проводиться аварийной службой Гор.газа;
г) проводить работы, связанные с перегонкой, экстрагированием, растиранием вредных веществ и т.д., при неисправной вентиляции;
д) при работе в вытяжном шкафу держать голову под вытяжным отверстием;
е) пробовать на вкус и вдыхать неизвестные вещества;
ж) наклонять голову над сосудом, в котором кипит или в который налита быстро испаряющаяся жидкость;
з) хранить запасы ядовитых, сильнодействующих, взрывоопасных веществ и растворов на рабочих столах и стеллажах;
и) хранить и применять реактивы без этикеток;
к) хранить в рабочих помещениях какие-либо вещества неизвестного происхождения;
л) курить, хранить и принимать пищу, а также в боксах и комнатах, предназначенных для работы с инфекционным материалом, выращивать цветы в вазонах;
м) работать без специальной или санитарной одежды и предохранительных приспособлений;
н) выполнять работы, не связанные с заданием;
о) сушить что-либо на отопительных приборах;
п) загромождать и захламлять проходы и коридоры, а также проходы к средствам пожаротушения.
В целях исключения поражений электрическим током запрещается:
- переносить включенные приборы и ремонтировать оборудование, находящееся под током;
- вешать на электрические приборы, штепсельные розетки, выключатели и электропровода различные вещи и предметы, укреплять провода веревкой или проволокой.
5.2.Характеристика условий работы в лаборатории
5.2.1.Техника безопасности при работе в лаборатории
1.Особая опасность кислот и щелочей заключается в возможности поражения ими глаз, поэтому для предупреждения ожогов при любых работах с едкими веществами все работающие в лаборатории обязаны пользоваться очками. Выполнение работ с кислотами и щелочами без предохранительных очков запрещается.
2. При работе с концентрированными кислотами и щелочами соблюдают следующие меры предосторожности:
- всю работу проводят в вытяжном шкафу;
- кроме очков во время работы надевают резиновые перчатки, нарукавники и резиновый фартук;
- работающим желательно иметь костюмы по ГОСТам: 12.4.036-78; 12.4.037-78; 12.4.038-78; 12.4.039-78;
- для переливания из бутылей кислот, щелочей и других агрессивных жидкостей пользуются специальными сифонами;
- концентрированную кислоту отбирают из сосуда только при помощи специальной пипетки с грушей или сифоном;
- при приготовлении разведенных растворов кислот вначале в сосуд наливают необходимое количество воды, а затем понемногу приливают кислоту. Запрещается приливать воду в кислоту;
- при приготовлении растворов щелочей определенную навеску щелочи опускают в большой сосуд с широким горлом, заливают необходимым количеством воды и тщательно перемешивают. Куски щелочи следует брать только щипцами;
- разбивание больших кусков едкой щелочи на мелкие производят в специально отведенном месте, при этом разбиваемые куски накрывают бельтингом или другим материалом. При выполнении этой работы пользуются защитными очками, фартуком и перчатками;
- концентрированные кислоты и щелочи выливают, в раковину после предварительной их нейтрализации;
- большие количества кислот и щелочей хранят в специальных складских помещениях, оборудованных вентиляцией;
- концентрированные кислоты и щелочи хранят в специально отведенном месте в исправных корзинах или обрешетке, выложенных минеральной ватой или стружкой;
- бутылки с кислотами, щелочами и другими едкими веществами переносят вдвоем в специальных ящиках или корзинах или перевозят на специальной тележке. Перед транспортировкой кислот, щелочей и других агрессивных жидкостей проверяют исправность тары;
- чтобы предотвратить разогревание раствора, при приготовлении растворов щелочей посуду предварительно помещают в водяную баню.
3. Отработанные кислоты, щелочи следует собирать раздельно в специальную посуду, в которой проводят последующую нейтрализацию.
4. При мойке посуды хромовой смесью необходимо остерегаться попадания смеси на кожу, одежду, обувь.
5. Пролитую щелочь надо засыпать песком, затем удалить песок, залить это место сильно разбавленной соляной кислотой или уксусом. После этого удалить кислоту тряпкой, вымыть стол и перчатки.
6. Если пролита кислота, то ее надо засыпать песком, затем удалить пропитанный песок лопаткой и засыпать содой, затем соду также удалить и промыть это место большим количеством воды.
7. При проливании неядовитых растворов достаточно вытереть поверхность стола тряпкой, держа ее в резиновой перчатке, после чего хорошо прополоскать тряпку, вымыть водой стол и перчатки.
8. При кипячении кислотных и щелочных растворов и до полного их остывания нельзя плотно закрывать посуду (пробирки и колбы) пробкой.
9. Запрещается выливать горючие жидкости в канализацию. Их следует собирать в герметичную тару, которую (в конце рабочего дня) удаляют из лаборатории.
10. При случайных проливах огнеопасных жидкостей необходимо немедленно выключить все газовые горелки и нагревательные приборы. Место пролива жидкости следует засыпать песком. Загрязненный песок собирают неметаллическими совками.
18. Все работы, связанные даже с небольшим испарением в атмосферу лаборатории сильно пахнущих вредных веществ, таких - как бензол, нитробензол, толуол, ксилол, хлороформ, диэтиловый эфир, спирты, эфиры органических кислот, сероуглерод - необходимо проводить только в вытяжном шкафу.
5.2.2. Производственное освещение
Освещение – это такая система естественного и искусственного освещения, которая позволяет работающим осуществлять производственный процесс. Рациональное освещение – один из показателей высокого уровня труда, эргономики и производственной этики.
при освещении помещений используется естественное, искусственное и смешанное освещение. Естественное освещение подразделяется на боковое (одно-, двухстороннее), осуществляемое через проёмы в наружных стенах, верхнее – осуществляемое через проёмы а перекрытиях, а также комбинированное – сочетание верхнего и бокового освещения.
Искусственное освещение может быть общим (равномерным и локализованным) и комбинированным.
Большую роль играет рациональное направление световых потоков: на рабочих поверхностях должны отсутствовать резкие тени и полностью рассеянное освещение. Равномерное распределение яркости способствует светлая окраска потолка, ст5ен и оборудования.
Характеризуя освещённость лаборатории необходимо описать тип освещения, постоянство освещённости во времени, безопасность осветительных устройств.
5.2.3. Вентиляция – это комплекс взаимосвязанных процессов, предназначенных для создания организованного воздухообмена, то есть удаления из производственного помещения загрязненного или перегретого воздуха и подачи вместо него чистого и охлаждённого воздуха, что позволяет создать в рабочей зоне благоприятные условия воздушной среды.
Системы вентиляции делятся на механическую и естественную. Возможно сочетание этих двух видов вентиляций. В случае механической вентиляции воздухообмен осуществляется с помощью специальных побудителей движения – вентиляторов; в случае естественной – за счёт разности плотностей воздуха снаружи и внутри здания.
По месту действия различают: общеобменную вентиляцию, когда воздухообмен осуществляется в масштабах всего помещения; местную – воздухообмен осуществляется только в пределах рабочей зоны.
Общеобменные системы могут быть: приточными – организуется только приток воздуха, а вытяжка происходит естественным путём из-за повышения давления в помещении; вытяжным – организуется только вытяжка, а приток воздуха происходит путём его подсоса извне из-за его разряжения в помещении; приточно-вытяжными – организуется как приток, так и отток воздуха. Местные системы могут быть также приточными и вытяжными.
Характеризуя вентиляцию в лаборатории необходимо описать её вид, способность обеспечить требуемую чистоту воздуха, безопасность в эксплуатации.
Выводы
1. Изучен принцип работы атомно-абсорбционного спектрометра с электротермической атомизацией «МГА-915М».
2. Выявлено повышенное содержание тяжелых металлов (меди, никеля, свинца)в образцах почв г.Плавска, г.Суворова и г.Новомосковска, что связано с расположением в этих районах крупных промышленных предприятий.
3. На основании картограммы загрязнения почвы тяжелыми металлами Тульской области: Плавский , Киреевский, Ефремовский районы относятся к зоне среднего загрязнения, а Суворовский и Новомосковский районы-к зоне высокого загрязнения.
Список литературы
- Абашеева Н.Е. Агрохимия почв Забайкалья. – Новосибирск: Наука, 1992. – 213 с.
- Добровольский Г.В. Тяжелые металлы: загрязнение окружающей среды и глобальная геохимия //Тяжелые металлы в окружающей среде. – М.: Изд-во МГУ, 1980. – С.3-12.
- Основы аналитической химии. Практическое руководство / Под ред. Ю.А. Золотова. М.: Высш. шк., 2001.
- Пилипенко А.Т., Пятницкий И.В. Аналитическая химия. В 2-х т. М.: Химия, 1990.
- Основы аналитической химии / Под ред. Ю.А. Золотова. В 2-х т. М.: Высш. шк., 2000.
- Буренков Э.К., Гинзбург Л.Н., Грибанова Н.К. и др. Комплексная эколого-геохимическая оценка техногенного загрязнения окружающей природной среды. – М.: «Прима-Пресс», 1997. – 72 с.
- Природопользование. Учебник. Арустамов Э.А. Издательский дом "Дашков и Ко". М – 2000.
- Основы экологии. В.Д. Валова. Издательский дом "Дашков и Ко". М – 2001.
- Миркин Б.М., Наумова Л.Г. Экология России. М.: 1995. - 232 с.
- Уильямс Д. Металлы жизни. М.: Мир, 1975. - 236 с.
- Майстренко В.Н., Хамитов Р.З., Будников Г.К. Экологический мониторинг суперэкотоксикантов. М.: Химия, 1996. - 320 с.
- ПНД Ф 16.1:2:2.2:2.3.63-09 (2014) Методика измерений массовой доли ванадия, кадмия, кобальта, марганца, меди, мышьяка, никеля, ртути, свинца, хрома и цинка в пробах почв, грунтов, донных отложений, осадков сточных вод атомно-абсорбционным методом с электротермической атомизацией с использованием атомно-абсорбционных спектрометров модификаций МГА-915, МГА-915М, МГА-915МД (М 03-07-2014) . ООО "Люмэкс-маркетинг
PAGE \* MERGEFORMAT 1
Определение массовой доли тяжелых металлов в пробах почв Тульской области