Люминофоры на основе сульфида цинка
Оглавление
Введение
- Литературный обзор
- Электролюминофоры. Общие сведения
- Методы получения и обработки
- Люминесценция
- Основные понятия и виды
- Общие представления
- Классификация люминесценции
- Механизм протекания фотолюминесценции
- Механизм возбуждения электролюминесценции
- Спектры поглощения, спектры возбуждения, спектры фотолюминесценции
- Методика синтеза люминофоров
- Кислотно-основное состояние поверхности твердых тел
- Кислотно-основные центры разной природы
- Методы исследования кислотно-основных свойств
- Экспериментальная часть
- Объекты исследования
- Методы и методика исследований
- Общие требования техники безопасности в лаборатории
- Растровая электронная микроскопия (РЭМ)
- Рентгено-фазовый анализ (РФА)
- ИК-спектроскопия
- рН-метрия
- кинетический метод
- потенциометрический метод
2.2.6. Индикаторный метод
2.2.7. Спектрально-люминесцентный анализ
3. Результаты и их обсуждения
Вывод
Список использованной литературы
Введение
Люминофоры на основе сульфида цинка широко используются в современных средствах отображения информации, в частности в электролюминесцентных источниках света. Однако до сих пор актуальной задачей является повышение яркости их люминесценции. В случае электролюминофоров для обеспечения эффективного преобразования электрической энергии в свет в качестве активатора в ZnS вводят медь. В электролюминофорах медь находится по крайней мере в двух состояниях: в виде преципитатов фазы CuxS, обеспечивающих генерацию носителей заряда при возбуждении
электролюминесценции внешним электрическим полем в гетеропереходах ZnSCuxS, а также в составе центров люминесценции, обеспечивающих излучательную рекомбинацию носителей (свечение синего цвета дают ассоциаты медь в узле цинка — медь в междоузлии, а зеленое — ассоциаты медь в узле цинка — хлор в узле серы) [неорг люмин].
Увеличение яркости электролюминесценции достигается, например, путем увеличения концентрации активатора, что способствует увеличению концентрации центров свечения. Однако существует оптимальная концентрация, определяемая растворимостью активатора в сульфиде цинка, так как при сильном избытке меди формируется большое количество преципитатов сульфида меди, приводящее к снижению напряженности поля на отдельном гетеропереходе. Также это приводит к поглощению света, поскольку сульфид меди непрозрачен. Для увеличения растворимости меди в сульфиде цинка было предложено проводить различные предварительные обработки ZnS перед синтезом люминофора для создания в нем дополнительных дефектов. Это должно способствовать равномерному за счет диффузии распределению ионов меди и их встраиванию в решетку ZnS в процессе высокотемпературного синтеза люминофора. Тем самым это должно было приводить к повышению числа центров свечения. При этом предполагается, что созданные обработкой дефекты должны устраняться в процессе высокотемпературного_отжига.
- Литературный обзор
- Общие сведения
В связи с развитием мобильной электроники в настоящее время наблюдается активное расширение сферы практического применения электролюминесцентных источников света (ЭЛИС) на основе порошковых электролюминофоров переменного тока. ЭЛИС применяются для подсветки жидкокристаллических дисплеев в различных электронных приборах: мобильных телефонах, карманных персональных компьютерах и др.
Среди электролюминофоров (ЭЛФ), выпускаемых российской и зарубежной промышленностью, наиболее высокой яркостью и стабильностью обладают цинк-сульфидные люминофоры зеленого цвета свечения. В то же время в связи с появлением мобильной электроники с электролюминесцентной подсветкой экрана появилась потребность в расширении гаммы цветов ЭЛИС, в частности, разработки устройств синего цвета свечения повышенной яркости и стабильности, работающих при пониженных напряжениях. Однако при синтезе электролюминофоров, удовлетворяющих современным требованиям, возникает ряд проблем, которые связаны с недостаточностью данных о влиянии таких параметров, как температурный режим, атмосфера синтеза, и др. на электрооптические свойства люминофоров, их эффективность и дефектную структуру.
Кроме того, для дальнейшего совершенствования технологии электролюминофоров и изделий на их основе большое значение имеет исследование поверхностных свойств люминофора, которые во многом определяют электрофизические процессы в твердом теле, включая перенос заряда и люминесценцию. Поиск закономерностей изменения поверхностных свойств люминофора в зависимости от условий синтеза и корреляций этих свойств с электрооптическими характеристиками ЭЛФ позволит существенно повысить эффективность люминесценции и даст дополнительный метод контроля качества.
Важной задачей также является поиск новых нетепловых методов энергетического воздействия на электролюминофор, являющийся вследствие условий синтеза неравновесной системой. Уменьшение степени неравновесности позволит повысит яркость и стабильность электролюминесценции. Перспективным направлением в этом отношении является использование современных радиационных технологий.
Таким образом, актуальным является исследование влияния различных факторов на электрооптические и поверхностные характеристики цинк-сульфидных электролюминофоров, разработка методов направленного регулирования поверхностных и объемных свойств люминофоров и оптимизация условий синтеза.
- Методы получения и обработки цинксульфидных электролюминофоров
Сульфиды цинка получают путем осаждения сероводородом из водных растворов сульфатов [книга дома]. При этом образуются тонкодисперсные порошки. Последние состоят из агломератов, содержащих еще более мелкие частицы. Размер первичных частиц составляет десятки нм, а агломератов - единицы и десятки мкм. Размер частиц исходных сульфидов цинка во многом определяет гранулометрический состав порошков люминофоров. Содержание микропримесей в продуктах удовлетворяет люминофорным требованиям (<10-5% тяжелых металлов), но содержание основного вещества значительно меньше 100%. Основные примеси - вода, окиси сульфата цинка.
Селениды цинка синтезируют из сульфидов по реакции, которая в упрощенном виде может быть записана следующим образом:
МеS+H2SeO3 MeSe+SO2+H2O
Побочные продукты в этой реакции – окислы металлов и селенов, а также непрореагировавший исходный сульфид. Для удаления примесей окислов продукты обрабатывают уксусной кислотой. Известны и способы получения селенидов из водных растворов путем восстановления селенидов гидрозином или другими восстановителями, а также селеносульфатный метод. Сульфиды щелочноземельных металлов получают сульфированием карбонатов металлов смесью серы и крахмала в присутствии различных солевых смесей или сульфинированием окислов сероуглеродом. Теллурид цинка синтезируют в основном методом сплавления компонентов. Этим методом можно синтезировать сульфиды и селениды цинка, но дорого и малопроизводительно. Известен способ получения бинарных соединений из паров компонентов, пригодные для всех халькогенидов элементов второй группы, но он еще не нашел широкого применения.
- Люминесценция:
- Основные понятия и виды
Люминесценция – это спонтанное излучение, представляющее собой избыток над тепловым излучением и характеризующееся длительностью, существенно превышающей период световых колебаний. Большая длительность люминесцентных процессов показывает, что между атаками поглощения и излучения протекает определенное время, соответствующее времени переноса энергии от мест поглощения к местам излучения [5]. Люминесценция в твердых телах сильно зависит от наличия в них собственных дефектов и примесей, определяющих как цвет свечения, так и способность к люминесценции. Такие примеси называются активаторами, а содержащие их люминофоры рассматриваются как твердые растворы активатора в основном веществе – в основании люминофора. Акт излучения происходит в субмикроскопических образованиях, связанных с атомами активатора и получивших название центров свечения. Примеси, которые сильно уменьшают интенсивность свечения, называются тушители.
Первая половина этого определения, была предложенная Видеманом, отделяют люминесценцию от равновесного теплового излучения, а вторая введенная С. И. Вавиловым – от различных видов рассеяния, а также от вынужденного излучения, излучения Вавилова – Черенкова.
В зависимости от того в каком виде энергия подводится к люминесцирующему телу (люминофору), различают фото -, катодо -, рентгено -, электро -, и т.д. люминесценцию.
Таблица 1 – Разные виды люминесценции
|
Виды люминесценции
|
Механизм возбуждения
|
Пример
|
|
Радиолюминесценция
|
Воздействие высокоэнергетических
частиц или гамма-
излучения радиоактивных процессов
|
Самосветящиеся цифры на циферблатах часов
|
|
Электролюминесценция
|
Воздействие электрических полей
|
Свечение газоразрядных ламп
|
|
Хемилюминесценция
|
Излучение, возбужденное химическими реакциями
|
Окисление белого
фосфора на воздухе
|
|
Биолюминесценция
|
Биохимические процессы
|
Светящиеся рыбы, жуки, бактерии
|
|
Триболюминесценция
|
Механическое воздействие
|
Растирание или разбивка кристаллов сахара
|
|
Кристалло-люминесценция
|
Кристаллизация
|
Оксиды мышьяка
|
- Общие представления
Цинк-сулфидные люминофоры обладают высокой яркостью и наиболее широко употребляются сейчас на практике. Хотя свечение электролюминофоров, активированных медью, серебром, марганцем или другими примесями при возбуждении переменным электрическим полем почти не отличается по спектру от свечения соответствующих фотолюминофоров, приготовление образцов, способных светиться в поле, имеет свои особенности. Основной из них является введение повышенного количества меди (порядка 10-3 г Сu на 1 г ZnS) по сравнению с фотолюминофорами. Обычно это связано с необходимостью получения в кристаллах вкраплений второго вещества (сульфида меди), которые создают условия концентрации поля в тонких слоях образца.
Таким образом, в отличие от фотолюминофоров, представляющих собой однофазную систему, люминофоры, возбуждаемые электрическим полем представляют собой двухфазную систему, образованную сульфидом цинка ZnS n-типа проводимости (основа) и сульфидом меди CuxS p-типа проводимости.
Принято разделять все явления электролюминесценции на два класса: относящиеся к эффекту Лосева и относящиеся к эффекту Дестрио. В первом случае кристаллы электролюминофора непосредственно соприкасаются с электродами, и таким образом носители заряда могут непосредственно проникать в кристаллы. Впервые такого рода свечение твердых веществ в электрическом поле наблюдал в 1923 г. Лосев на карбиде кремния, который использовался в качестве кристаллического детектора, причем люминесценция наблюдалась всегда непосредственно, вблизи контактов. Второй вид электролюминесценции – электролюминесценцию порошкообразных фосфоров, которым посвящена данная глава, наблюдал впервые в 1936 г. Дестрио. Это явление по целому ряду свойств отличается от свечения карбида кремния. Вещества, которым оно свойственно, имеют гораздо большее удельное сопротивление, чем карбид кремния, причем свечение может происходить и в том случае, когда люминофор помещен в диэлектрик. При этом свечение, как правило, можно получить только при возбуждении люминофоров переменным электрическим полeм. Первое объяснение явлений электролюминесценции было предложено Дестрио [17], который предположил, что центры люминесценции могут возбуждаться благодаря соударениям с электронами, ускоряемыми полем. Теория этого явления была подробно развита Кюри [18], но она не могла объяснить, почему явления электролюминесценции имеют место уже при сравнительно небольших напряженностях поля (порядка десятков киловольт на 1 см). В работах Пайпера и Вильямса [19] предполагается, что ударная ионизация центров люминесценции происходит около барьера обеднения вблизи отрицательного электрода, где обеспечивается большая величина напряженности поля, необходимая для этого процесса. Электроны, участвующие в процессе ударной ионизации, освобождаются полем с уровней захвата.
Эта теория рассматривает явления, происходящие в монокристаллах. Для объяснения процессов, происходящих в порошкообразных люминофорах, помещенных в диэлектрик, Залм [20] предположил, что источником электронов является поверхностный слой Сu2S, покрывающий кристаллы электролюминофоров. При возбуждении электрическим полем электроны переходят из Cu2S к положительному концу кристалла и при соударении с центрами люминесценции ионизуют их. При этом часть электронов может отгоняться полем из области ионизации и захватываться на ловушках. Выключение поля или перемена знака приводит к возврату электронов и рекомбинации их с центрами люминесценции, в результате чего происходит излучение. В работах [21, 22] механизм электролюминесценции связывается с процессом туннельного проникновения электронов при ионизации полем, которое осуществляется из фазы Cu2S, находящейся на поверхности кристаллов. Торнтон [23] высказал предположение, что электролюминесценция в сульфидных электролюминофорах обусловлена инжекцией неосновных носителей, а не ускорением и соударениями с центрами люминесценции основных носителей. Дальнейшие исследования, связанные с наблюдением свечения кристаллов электролюминофоров под микроскопом, по-видимому, подтверждают точку зрения Торнтона. Как следует из ряда работ, в которых исследовалось свечение отдельных кристаллов под микроскопом [24, 25], свечение сосредоточено в отдельных пятнах, точках или светящихся линиях.
Джилсон и Дарнелл [24] предполагают, что светящиеся линии, которые видны под микроскопом, связаны с особыми линейными дефектами в кристаллах ZnS. Так как свечение по длине линии неравномерно, ярче всего светится «голова» линии, то можно предположить, что начало линии находится в плоскости р-n-перехода. Механизм электролюминесценции, согласно представлениям авторов, определяется двумя стадиями. На первой стадии, или стадии активации, положительное напряжение приложено к n-области, а отрицательное - к р-области. Это приводит к тому, что электроны и дырки начинают двигаться из области р-n-перехода. Вторая стадия начинается тогда, когда знак напряжения изменяется и дырки инжектируются в n-область. Здесь они захватываются на линейных дефектах и переносятся к центрам люминесценции. При рекомбинации электронов с дырками происходит излучение.
- Классификация люминесценции:
В зависимости от характера элементарных процессов, приводящих к люминесцентному излучению, различают:
1.Спонтанная люминесценция – состоит в том, что под воздействием источника люминесценции вначале происходит возбуждение атомов (молекул или ионов) на промежуточные возбужденные энергетические уровни – далее с этих уровней происходят излучательные, а чаще безызлучательные переходы на уровни, с которых излучается люминесцентное свечение. Такой вид люминесценции наблюдается у сложных молекул в парах и растворах.
2. Вынужденная (метастабильная) люминесценция характерна тем, что под действием источника люминесценции происходит переход на метастабильный уровень, а затем следует переход на уровень люминесцентного излучения. Примером является фосфоресценция органических веществ.
3.Рекомбинационная люминесценция происходит в результате воссоединения частиц, разделившихся при поглощении возбуждающей энергии. В газах может происходить рекомбинация радикалов или ионов, в результате которой возникает молекула в возбужденном состоянии. Последующий переход в основное состояние может сопровождаться люминесценцией. В твердых кристаллических телах рекомбинационная люминесценция возникает в результате появления неравновесных носителей заряда (электронов или дырок) под действием какого-либо источника энергии. Различают рекомбинационную люминесценцию при переходах «зона – зона». Во всех случаях процесс люминесценции может включать захват носителей на ловушках с их последующим освобождением тепловым или оптическим путем, т. Е. включать элементарный процесс, характерный для метастабильной люминесценции. В случае люминесценции центров, рекомбинация состоит в захвате дырок на основной уровень центра и электронов на возбуждённый уровень. Излучение происходит в результате перехода центра из возбуждённого состояния в основное. Рекомбинационная люминесценция наблюдается в кристаллофосфорах и типичных полупроводниках, например германии и кремнии. Независимо от механизма элементарного процесса, ведущего к люминесценции, излучение, в конечном случае, происходит при спонтанном переходе из одного энергетического состояния в другое.
4. Резонансная флуоресценция наблюдается в парах атомов и состоит в спонтанном высвечивании с того же энергетического уровня, на котором оказался излучающий атом при поглощении энергии от источника люминесценции. При возбуждении резонансной флуоресценции светом имеет место резонансное излучение, переходящее в резонансное рассеяние при увеличении плотности паров.
По типу возбуждения различают:
1. Ионолюминесценция – свечение при прохождении ультразвуковых волн через растворы некоторых веществ.
2. Кандолюминесценции – для неё необходим контакт пламени с люминофором, при этом он не должен сильно нагреваться [10].
3. Катодолюминесценция – люминесценция, возникающая при возбуждении люминофора электронным пучком; один из видов радиолюминесценции. Первоначальное название пучка электронов — катодные лучи, отсюда термин «Катодолюминесценция». Способностью к катодолюминесценции обладают газы, молекулярные кристаллы, органические люминофоры, кристаллофосфоры, однако только кристаллофосфоры стойки к действию электронного пучка и дают достаточную яркость свечения. Именно они и применяются в качестве катодолюминофоров.
Ей обусловлено свечение экранов черно-белых и цветных телевизоров, различных осциллографов, электронно-оптических преобразователей и т.д.
4.Радиотермолюминесценция. Оказалось, что если сильно охлажденный образец вещества, предварительно облученный гамма-лучами, альфа-частицами или электронами, постепенно нагревать, то он начинает интенсивно светиться. Практически все вещества могут таким образом «накапливать» в себе свет и долго сохранять его. И лишь при нагреве свет как бы «оттаивает», - начинается рекомбинация «замороженных» электронов, сопровождаемая световым излучением. Цвет свечения постепенно меняется, изменяется также и его интенсивность. При этом пики интенсивности соответствуют температурам структурных переходов, что особенно заметно у различных полимеров. Даже незначительные изменения структуры вещества: повышение степени кристалличности, изменение взаимного расположения макромолекул, существенно влияют на характер свечения. Радиотермолюминесценция весьма чувствительна к механическим напряжениям в полимере.
5.Фотолюминесценция, возбуждаемая светом. Простейший случай фотолюминесценции – резонансное излучение атомных паров, когда испускается электромагнитное излучение такой же частоты, какую имеет возбуждающее излучение. При фотолюминесценции молекул и других сложных систем, согласно правилу Стокса, излучение фотолюминесценции имеет меньшую частоту, чем возбуждающий свет. Это правило часто нарушается и наряду со стоксовой наблюдается антистоксовая часть спектра – излучение частоты, большей, чем частота возбуждающего света. В более сложных молекулах после поглощения света происходит перераспределение энергии между молекулами, вследствие чего спектр излучения не зависит (или слабо зависит) от возбуждающей частоты.
В результате межмолекулярных взаимодействий, а в сложных молекулах и вследствие внутримолекулярных процессов может происходить переход электронной энергии возбуждения в энергию колебательного, вращательного и поступательного движения молекул, т.е. в тепловую энергию. Такие процессы называются тушением фотолюминесценции, они приводят к тому, что квантовый выход (отношение числа испускаемых квантов к числу возбуждающих квантов) фотолюминесценции оказывается меньше единицы. Выход фотолюминесценции, вообще говоря, сложным образом зависит от длины волны возбуждающего света.
6. Рентгенолюминесценция. Специфика возбуждения рентгеновскими лучами, по сравнению с фотовозбуждением, состоит в том, что на люминофор воздействуют фотоны со значительно большей энергией [5]. При этом свечение люминофора вызывается не непосредственным действием самих рентгеновских лучей, а воздействием электронов, вырываемых из основы люминофора рентгеновскими лучами. Вследствие этого рентгенолюминесценция имеет многие общие черты с катодолюминесценцией.
7. Электролюминесценция возбуждается электрическим полем.
8.Хемилюминесценция возникает под действием химических превращений. При хемилюминесценции излучают продукты реакции или другие компоненты, возбуждаемые в результате переноса энергии к ним от продуктов реакции. Частный случай хемилюминесценции — биолюминесценция. Хемилюминесценция сопровождает газофазные, жидкофазные, гетерогенные реакции, её спектр может лежать в ИК -, видимой или УФ-областях.
Хемилюминесценция является примером прямого преобразования химической энергии в световую. Для обнаружения хемилюминесценции (особенно в медленных реакциях) применяют высокочувствительную фотоэлектронную аппаратуру. Исследование хемилюминесценции позволяет решать тонкие вопросы теории элементарного акта химического превращения, перераспределения энергии в продуктах реакции, строения молекул, измерять скорости реакций или концентрации веществ – хемилюминесцентный анализ. Хемилюминесценция лежит в основе действия химических лазеров.
Весь процесс хемилюминесценции можно разделить на три стадии:
- Восстановление одного из участников реакции.
- Перенос электрона (окислительно-восстановительная реакция).
-Высвечивание фотона при переходе молекулы из электронно-возбужденного в основное состояние (люминесценция).
9. Биолюминесценция – видимое свечение организмов, связанное с процессами их жизнедеятельности; являет собой результат биохимической реакции, в которой химическая энергия возбуждает специфическую молекулу, и та излучает свет. Некоторые физические и химические особенности являются общими для всех биолюминесцентных реакций. Излучаемый свет не зависит от света или другой энергии, непосредственно поглощаемой организмом. Он также не связан с термическим возбуждением при высокой температуре.
10. Триболюминесценция – свечение при трении некоторых веществ.
11.Кристаллолюминесценция – свечение, возникающее при механическом сжатии кристаллов.
- Механизм протекания фотолюминесценции
Механизм люминесценции протекает с привлечением основных представлений зонной теории твердого тела.
В кристаллической решетки твердого тела вследствие взаимодействия электронные уровни атомов расщеплены на столько близко расположенных подуровней, столько атомов вступает во взаимодействие. Совокупность таких подуровней образует энергетическую зонную [3].
В 1928 г. Блох показал, что периодическом поле идеальной кристаллической решетки перемещающиеся электроны можно рассматривать как свободные, но не с любым значением энергии. Зоны разрешенных энергетических состояний, которые определяются энергетическими уровнями атомов, входящих в кристаллическую решетку, разделяются запрещенными зонами. Каждая зона разрешенных энергетических состояний имеет N уровней. Согласно принципу Паули, размещается 2N электронов. Для люминофоров предполагается существования двух зон – заполненной электронами (валентная зона) и незаполненной, в которой электроны могут свободно перемещаться (зона проводимости). Зоны разделены промежутками – запрещенной энергетической областью (запрещенная зона). Ширина запрещенной зоны у сульфидных люминофоров составляет несколько электрон – вольт. Введение примесей (активаторов), а также наличие примесей и дефектов в решетке создают условия для образования энергетических уровней, которые располагаются в запрещенной зоне.
Простейшая зонная схема для люминофоров полупроводникового типа показана на рисунке 1. Энергетические уровни А1 и А2 , возникающие при введении активатора, располагаются в запрещенной зоне II. Наряду с уровнями активатора в запрещенной зоне существуют уровни захвата электронов (Л), обусловленные различными дефектами (в частности, примесями). Так как природа ловушек различна, то уровни захвата могут иметь различную глубину. Уровень А1 соответствует невозбужденному состоянию активатора (основной уровень) и в этом состоянии заполнен, а уровни А2 (возбужденный уровень) и уровень Л свободны.
При возбуждении люминофора светом энергия может поглощаться как на уровнях активатора, и так и в основном веществе. В первом случае поглощение света сопровождается переходом электрона с основного уровня активатора А1 на возбужденный уровень А2 1, а излучение света возникает при переходе 2, который соответствует возвращения электрона на основной уровень. В этом случаи возникает флуоресценция, длительность которой составляет 10-8 - 10-9 с.
Электроны, вырванные возбуждающим светом, могут перейти в зону проводимости 3 и локализоваться на ловушках 4. С ловушек 5 электроны могут освободиться только в том случаи, если им будет сообщена, необходима энергия (например, нагревания люминофора). При этом электроны либо повторно захватятся ловушками, либо через зону проводимости перейдут на уровень активатора 6 и рекомбинируют с центром свечения (фосфоресценция), которое продолжается до тех пор, пока все электроны, захваченные ловушками, не освободятся и не прорекомбинируют с ионизованными центрами.
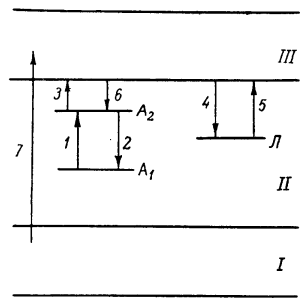
Рисунок 1 – Зонная схема для люминофоров полупроводникового типа.
При поглощении света в основе люминофора электроны переходят из валентной зоны в зону проводимости 7. Образовавшиеся в валентной зоне дырки мигрируют и могут локализоваться на уровнях активатора. В этом случае излучение происходит в результате рекомбинации электронов из зоны проводимости с дырками на уровнях активатора. Помимо образования электронно-дырочных пар при поглощении света в основе люминофора, могут образовываться экситоны (при поглощении света возможно также возбуждение электрона валентной зоны, при котором он не переходит в зону проводимости, а образует с дыркой связанную систему, получившие название экситона), способные ионизировать центры свечения и привести к возникновению люминесценции.
Следует отметить, что энергия, поглощенная другими примесями в решетке, может передаваться активатору, например, в том случаи, если спектр излучения примеси совпадает со спектром поглощения активатора.
Помимо рассмотренной классической модели процесса люминесценции следует остановиться на модели, предложенной Пренером и Вильямсом.
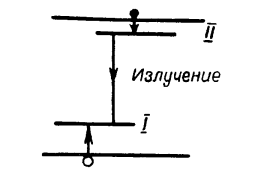
Рисунок 1.1 Зонная схема по Пренеру и Вильямсу
Согласно этой модели (рис 1.1), основной уровень I располагается вблизи валентной полосы, а возбужденный уровень II – ниже зоны проводимости.
После возбуждения светом и образования электронов и дырок для уровня I более вероятен захват электрона из полосы проводимости, а для уровня II – захват дырки из валентной полосы. Люминесценция возникает в результате перехода электрона с уровня II на уровень I. Такая модель называется донорно-акцепторная; ее применяют в ряде случаев для объяснения процессов люминесценции. В люминофоре ZnS-Cu, согласно этой модели, медь создает акцепторный уровень, а хлор – донорный.
Для характеристических люминофоров, когда электронные переходы совершаются внутри самого центра свечения, энергетическое состояние центра и его свойства могут быть описаны двухмерной энергетической моделью. В этом случае невозбужденное состояние центра описывается потенциальной кривой а1 (рис 1.2), показывающей зависимость его энергии от конфигурационного параметра, который в случаи двухатомной молекулы есть расстояние между двумя ядрами. Кривая а2 характеризует возбужденное состояние. Точки Е10 и Е20 принадлежат невозбужденному и возбужденному состояниям центра при ОК, а горизонтальные отрезки соответствуют температуре выше нуля, когда ядра совершают колебания относительно положения равновесия. Возбуждение системы опишется переходом Е10 Е2.
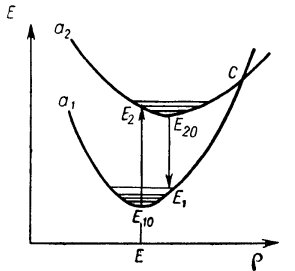
Рисунок 1.2 Двухмерная энергетическая модель для характеристических люминофоров.
Переход в равновесное состояние Е20 сопровождается передачей части энергии в виде фотонов решетке, а излучение описывается переходом Е20 Е1. При этом: Е2 Е10 › Е20 Е1. Последнее характеризует стоксовские потери, обусловливающие смещение спектра излучения в длинноволновую область по отношению к спектру поглощения.
Если температура настолько велика, что в возбужденном состоянии система оказывается вблизи точки пересечения кривых С, то она может, спустится по кривой а без излучения. Такое тушение, при котором поглощенная энергия внутри центра превращается в тепло, называется внутренним.
- Механизм возбуждения электролюминесценции
Образование свободных носителей (электронов и дырок) в порошковых электролюминофорах осуществляется за счет сильного электрического поля, возникающего в p-n-переходе, включенном в обратном направлении. Возникающее при этом излучение носит название предпробойной электролюминесценции [1, 5].
Сильное электрическое поле, близкое к пробивному, может возбуждать полупроводниковые кристаллы как благодаря туннельному переходу электронов из валентной зоны и центров люминесценции в зону проводимости, так и посредством разгона электронов до энергий, достаточных для ионизации кристаллической решетки и центров люминесценции (ударная ионизация). Рекомбинация электронов с дырками как непосредственно, так и через центры люминесценции, а также возвращение в исходное состояние возбужденных центров люминесценции приводят к излучению света.
Механизм перевода электронов из валентной зоны в зону проводимости путем туннельного проникновения через потенциальный барьер, сужаемый при наклоне энергетических зон в электрическом поле (рисунок 2, переход 1), был впервые рассмотрен Зинером [1]. Если электрон при туннельном переходе поглощает фонон, то он приобретает его энергию, что эквивалентно понижению на эту энергию высоты потенциального барьера. Чем больше поглощается фононов, тем сильнее это понижение барьера. Поэтому, несмотря на то, что вероятность поглощения нескольких фононов меньше, чем одного, эффективнее могут оказаться туннельные переходы с участием многих фононов. Туннельный переход с участием многих фононов теоретически исследован Л.В. Келдышем. В однородных широкозонных полупроводниках межзонного туннелирования, как чистого, так и с участием фононов, не наблюдается. Оно имеет место в структурах с потенциальными барьерами, например в p-n-переходах [1].
Рисунок 2. Возможные электронные переходы, происходящие под действием сильного электрического поля в p-n-переходе, включенном в обратном направлении
На рисунке 2 также схематически показаны процессы ударной ионизации и ударного возбуждения в p-n-переходе, включенном в обратном направлении. В сильном электрическом поле электроны зоны проводимости ускоряются (переход 2), приобретая энергии, достаточные для выбивания электронов из валентной зоны в зону проводимости (переход 3). Наряду с этим происходят также возбуждение или ионизация центров люминесценции (переходы 4 и 5 соответственно). Аналогичные переходы происходят под действием ускоряемых дырок. Излучение возникает при переходах, обратных 4 (внутрицентровая люминесценция), а также 3 и 5 (межзонная рекомбинация электронов с дырками и рекомбинация через центры люминесценции соответственно). При некотором критическом значении напряженности электрического поля процесс ударной ионизации приводит к столь резкому увеличению плотности тока, что происходит электрический пробой полупроводника [1].
Известно, что хорошим электролюминофором является сульфид цинка, сильно легированный медью. В таком случае в объеме и на поверхности его кристалликов образуются преципитаты (островки) фазы CuXS (где X = 1,8…2) с проводимостью p-типа. Фок предположил, что эта фаза образует с полупроводником n-типа ZnS:Cu гетеропереход, который при обратном смещении является областью концентрации поля [1, 5].
При наложении напряжения порядка 100 В прикатодный гетеропереход смещается в обратном направлении и зона проводимости ZnS опускается ниже валентной зоны CuXS (рисунок 2.1). В таком случае электроны из валентной зоны CuXS и с поверхностных примесных центров (рисунок 2.1, переходы 1 и 2 соответственно) способны туннелировать в зону проводимости кристаллика ZnS:Cu и затем разгоняться в сильном электрическом поле до энергий, необходимых для ударной ионизации кристаллической решетки или центров свечения. Возникающие при этом дырки захватываются центрами свечения, а электроны движутся к противоположному концу кристаллика, где происходит их рекомбинация с центрами свечения, ионизованными в предшествующий полупериод переменного напряжения, когда там было сильное поле. Здесь предполагается наличие двух гетеропереходов, включенных так, что в каждый полупериод переменного напряжения возбуждение электролюминесценции происходит только в одном из них. Одновременно у противоположного гетероперехода происходит рекомбинационное излучение, реализующее светосумму, запасенную в предыдущий полупериод.
Таким образом, свечение осуществляется по двухстадийной модели: генерация свободных электронов и ионизация центров свечения в области сильного поля в прикатодной области и излучательная рекомбинация центров свечения в прианодной области, где напряженность поля мала [1].
Первичные электроны для ударной ионизации могут возникать также при туннелировании с электронных состояний, имеющихся на поверхности раздела кристалликов люминофора с диэлектриком.
Рисунок 2.1 Зонная структура гетероперехода CuXS – ZnS:Cu:
а) при нулевом напряжении; б) при наложении напряжения U
в обратном направлении; EF – уровень Ферми
- Спектры поглощения, спектры возбуждения
Важная характеристика люминофоров – спектры поглощения, отражающие зависимость величины поглощаемой энергии от длины волны падающего на люминофор света.
Свет может поглащаться как решеткой основы (полоса поглощенияв этом случае называется основной или фундаментальной), так и центрами люминесценции (примесное поглощение). Поэтому поглащение и спектральная область, в которой оно происходит, определяется свойствами активатора и кристаллической решетки. У большенства люминофоров осмновная полоса поглощения расположена в УФ-области спектра. Поглощение может быть обусловлено вакансиями в решетке основы люминофора, которые образуются в процессе его формирования.
Область поглощения люминофора характеризуют спектрами отражения. Величину поглощения рассчитывают по соотношению:
Кпогл=1-Котр
Кроме спектров поглощения одной из важных характеристик люминофора являются спектры возбуждения, определяющие, в отличие от спктров поглощения, только область активного поглощения энергии. Спектры возбуждения показывают зависимости свечения люминофора от длины волны возбуждающего света.
- Методика синтеза электролюминофоров
Технология синтеза электролюминофоров включает в себя следующие стадии:
1) приготовление шихты;
2) прокаливание шихты;
3) разбраковка люминофора;
4) низкотемпературный отжиг люминофора;
5) отмывка люминофора от поверхностного слоя сульфида меди;
6) сушка и просев люминофора.
Приготовление шихты:
Шихта для синтеза электролюминофоров состояла из сульфида цинка, веществ, содержащих легирующие примеси – медь и алюминий, а также плавней, необходимых для создания минерализующей атмосферы. В качестве плавней использовались сера и бромид аммония. Количества серы, меди и алюминия, вводимые в шихту, в разных экспериментах были различными. Содержание этих веществ в каждом конкретном образце указано в экспериментальной части в главах 3...5. Все исходные компоненты шихты размалывались и просеивались через сито с размером ячеек 0,04 мм, после чего навески исходных веществ в необходимом соотношении смешивались на валках в течении 3 ч.
Прокаливание шихты:
После перемешивания готовую шихту засыпали в кварцевый тигель примерно до половины объема, утрамбовывали, после чего закрывали углеграфитовой тканью и промежуточной кварцевой крышкой. Поверх промежуточной крышки для создания восстановительной атмосферы засыпался активированный уголь БАУ, после чего тигель закрывался внешней крышкой. В некоторых случаях синтез образцов проводился в открытом тигле, о чем отдельно сказано в главе 3. Тигель помещали в муфельную печь и прокаливали шихту в течение 1,5 часов при различной температуре. После прокаливания люминофор охлаждался до комнатной температуры вместе с печью.
Разбраковка люминофора:
После охлаждения до комнатной температуры из тигля удаляли уголь, промежуточную крышку и углеграфитовую ткань. Люминофор высыпали в чашку Петри и при облучении ультрафиолетовой лампой удаляли несветящиеся примеси. Очищенный таким образом люминофор размалывали и просеивали через сито.
Низкотемпературный отжиг люминофора:
Для дополнительного распада образовавшегося при синтезе пересыщенного твердого раствора меди в сульфиде цинка и образования гетеропереходов ZnS-CuXS, являющихся источниками электронов при возбуждении люминесценции переменным электрическим полем, проводился низкотемпературный отжиг электролюминофора. Для этого очищенный и просеянный люминофор загружали в фарфоровые чашки и распределяли его равномерным слоем. Чашки с люминофором помещали в муфельную печь и отжигали при температуре 650 С. Длительность отжига различных образцов различалась. После отжига люминофор остывал до комнатной температуры вместе с печью. Остывший отожженный люминофор размалывали и просеивали через сито.
Отмывка люминофора от поверхностного слоя сульфида меди:
В процессе низкотемпературного отжига избыточный сульфид меди выделяется на поверхности частиц люминофора. За счет шунтирующего действия и поглощения света, излучаемого электролюминофором, поверхностный слой CuXS снижает яркость свечения и пробивное напряжение источника. Чтобы повысить яркость свечения и пробивное напряжение, после отжига проводится отмывка электролюминофора от поверхностного слоя CuXS. Отмывка проводилась аммиачным способом, описанным в [7, 12]. Для отмывки люминофора готовили раствор, состоящий из компонентов (NH4)2CO3, NH4OH, (NH4)2S2O8 и бидистиллированной воды. После окончания отмывки суспензию отстаивали, промывочный раствор декантировали, люминофор заливали бидистиллированной водой и тщательно перемешивали. Полученную суспензию выливали на воронку Бюхнера, заправленную фильтрами, отсасывали раствор и промывали люминофор до исчезновения щелочной реакции, что контролировалось с помощью универсальной индикаторной бумаги.
Сушка люминофора:
Отмытый люминофор загружали в чашку Петри и сушили в течение двух часов при температуре 120 С. Высушенный люминофор просеивали через сито с размером ячеек 0,04 мм. Готовый люминофор помещали для хранения в полиэтиленовые емкости, которые хранили в эксикаторе.
При изготовлении источников света на основе порошковых электролюминофоров важную роль играют поверхностные свойства. Активные центры поверхности частиц являются решающим фактором взаимодействия на поверхности раздела фаз между люминофором и связующим и, следовательно, структурообразования в полимерном композиционном материале.
С другой стороны, поверхностные свойства во многом определяют электрофизические процессы, протекающие в зерне люминофора, включая перенос заряда и люминесценцию. Донорно-акцепторные активные центры на поверхности частиц электролюминофора могут являться центрами безизлучательной рекомбинации электронов и дырок, снижая тем самым выход электролюминесценции.
Поверхностные свойства исходного сульфида цинка могут влиять на процессы активации люминофора при его синтезе и образование гетеропереходов при распаде твердого раствора ZnS-CuXS в процессе остывания и отжига синтезированного электролюминофора. Кроме того, поверхностные свойства ZnS могут служить критерием, определяющим его пригодность для синтеза электролюминофора.
Исходя из всего вышесказанного можно утверждать, что качественная идентификация и количественная оценка содержания активных центров поверхности твёрдых фаз важны с точки зрения возможности прогнозирования свойств электролюминофоров.
- Кислотно-основное состояние поверхности твердых тел
Идеальная поверхность твёрдого тела представляет собой периодическое расположение атомов в двух измерениях, простирающееся в бесконечность без каких-либо нарушений. Реальная же поверхность отличается от идеальной нарушением периодичности и наличием таких дефектов, как адсорбированные атомы и функциональные группы [66, 67, 68, 69]. Состав и реакционная способность поверхности твердого вещества зависит от формы и размера частиц образца, пористости, структурной и кристаллографической модификации, природы и содержания примесей в объеме и на поверхности, температуры активации, способа производства, условий хранения, степени гидратации, и т.п. Однако во всех случаях энергетические свойства поверхности можно рассматривать в ее взаимодействия со средой, которая и формирует новую поверхность, изменяя состав и структуру поверхностных центров.
Свойства твёрдых веществ в значительной мере определяются наличием на их поверхности как протонодонорных групп (гидроксильных групп и координационно связанной воды), так и электроноакцепторных и электронодонорных центров, образующихся при дегидратации, в процессе которой происходит конденсация гидроксилов, деформация поверхностных структур, изменение длин и углов связей, поворот элементарных ячеек и др. [22].
- Кислотно-основные центры разной природы
Согласно современным представлениям поверхность твёрдого вещества содержит совокупность центров Льюиса и Бренстеда как кислотного, так и основного типа. Принадлежность к льюисовскому (апротонному) типу определяется наличием акцепторного или донорного поверхностного состояния, локализованного на не полностью координированных атомах. Льюисовский кислотный центр представляет собой вакантный уровень металла (Me+), способный акцептировать электронную пару. Основные центры Льюиса образованы двухэлектронными орбиталями атома кислорода (MeО–) и могут вступать в химическое взаимодействие по донорно-акцепторному механизму с передачей электронной пары на вакантный энергетический уровень адсорбированной молекулы. Кислоты и основания Бренстеда образуются в результате адсорбции молекул воды или её фрагментов на соответствующих центрах Льюиса (MeO–H+ и Me–OH–) [70, 71, 72]. Твёрдой кислотой по Бренстеду может быть названо твердое тело, обладающее способностью отдавать протон, а бренстедовским основанием твердое тело – акцептор протонов. Для более полной характеристики кислотно-основных свойств твёрдой поверхности необходимо знать количество активных центров, приходящихся на единицу массы или поверхности исследуемого вещества, распределение этих центров по силе и типу. Количество центров кислотной и основной природы на поверхности сульфидов и изготовленных на их основе электролюминофоров в значительной степени определяет закономерности межфазных взаимодействий и процессов структурообразования в дисперсных системах [22].
Кислотная сила центров Льюиса и Бренстеда, а также концентрация могут являться характеристикой реакционной способности поверхности. Кривые распределения центров адсорбции (РЦА) на поверхности позволяет установить, на которых из них протекают те или иные физико-химические процессы, ответственные за проявление конкретных свойств. Направленное изменение кислотной силы и концентрации активных центров может приводить к различному поведению, как исходного сырья, так и готовых продуктов.
- Методика исследования кислотно-основных свойств
Существует несколько различных методов исследования поверхностной кислотности твердых тел, однако, большинство из них связано в той или иной форме с адсорбцией (ионный обмен, потенциометрическое титрование, адсорбция газообразных реагентов, методы оптической и ИК – спектроскопии, индикаторный метод).
В общем случае, все методы определения кислотности и основности поверхности можно разделить на три большие группы. Первая включает в себя методы, основанные на ионном обмене и адсорбции из водных сред. Вторая группа методов основана на адсорбции на поверхности твердого тела слабых кислот и оснований из неводных сред. Третья группа методов – адсорбция кислот и оснований из газовой среды.
Нами в работе применены методы pH – метрии и адсорбции индикаторов Гамета. При исследовании общей кислотности поверхности была использована следующая методика pH – метрического изучения порошков оксидов и фторидов ЩЗМ.
2 Экспериментальная часть
2.1 Объекты исследования
В дипломной работе были исследованы нанолюминофоры ZnS:Cu,Cl. Образцы для исследований были предоставлены кафедрой Теоретических основ материаловедения Санкт-Петербургского государственного технологического института (технического университета)
Цинксульфидные люминофоры относятся к полупроводниковым соединениям 2-6 групп таблицы Менделеева, которые занимают видное место в современной физике и технике полупроводников, являясь одними из наиболее важных и перспективных материалов для ряда быстроразвивающихся областей науки и техники, в особенности фото- и опто электроник, квантовой радиофизике, акустоэлектронике. Это связано главным образом с тем, что соединения этого класса обладают различными значениями ширины запрещенной зоны, что позволяет в весьма широких пределах варьировать их электрические, фотоэлектрические и оптические свойства.
Для преобразования подводимой энергии в свет в качестве активатора в люминофоры добавляют медь. В электролюминофорах медь находится как минимум в двух видах: в виде преципиатов CuxS, обеспечивающих генерацию носителей заряда при возбуждении электролюминесценции внешним электрическим полем в гетеропереходах ZnS-CuxS, и в составе центров люминесценции (свечение синего цвета дает ассоциат меди в узле цинк-медь, а зеленого - ассоциат меди в узле цинк-хлор), обеспечивающих рекомбинацию носителя.
- Состав ZnS:Cu,Cl(Cu=0.3%) синтезирован обычным методом:
- 158-1 – без отмывки
- 158-2 – отмывка (1 раз)
- 158-3 – отмывка (2 раза)
- 158-4 – отмывка (4 раза)
Отмывка люминофора от поверхностного слоя сульфида меди.
В процессе низкотемпературного отжига избыточный сульфид меди выделяется на поверхности частиц люминофора. За счет шунтирующего действия и поглощения света, излучаемого электролюминофором, поверхностный слой CuXS снижает яркость свечения и пробивное напряжение источника. Чтобы повысить яркость свечения и пробивное напряжение, после отжига проводится отмывка электролюминофора от поверхностного слоя CuXS. Отмывка проводилась аммиачным способом, описанным в [7, 12]. Для отмывки люминофора готовили раствор, состоящий из компонентов (NH4)2CO3, NH4OH, (NH4)2S2O8 и бидистиллированной воды.
Около 30 г люминофора засыпали в стеклянную емкость(стаканчик), заливали 100-150 мл отмывочного раствора, ставили на водяную баню при t = 60±5 С и в течение 10 минут помешивали стеклянной палочкой. После суспензию отстаивали (5 минут), промывочный раствор выливали. На этом заканчивалась одна стадия отмывки. Затем заливался свежий отмывочный раствор и аналогичным способом повторялась вторая стадия отмывки. И т.д. (до 4 раз).
После чего люминофор заливали бидистиллированной водой и тщательно перемешивали. Полученную суспензию выливали на воронку Бюхнера, заправленную фильтрами, процеживали раствор (подливая дистиллированную воду) и промывали люминофор до исчезновения щелочной реакции, что контролировалось с помощью универсальной индикаторной бумаги.
Сушка люминофора
Отмытый люминофор загружали в чашку Петри и сушили в течение двух часов при температуре 120 С. Высушенный люминофор просеивали через сито с размером ячеек 0,04 мм. Готовый люминофор помещали для хранения в полиэтиленовые емкости.
Таблица 2 Синтез образцов люминофоров серии 158
|
№ образца (серии)
|
Состав
|
Температура синтеза, С
|
время синтеза, мин.
|
Тигель
|
Отжиг
|
Примечание
|
|
158
|
ZnS = 117,5; (S+ZnS) = 6,625; NH4Cl = 0,546; CuCl = 0,546 (0,3%Cu) + различная отмывка
|
950
|
90 мин
|
кварцевый
|
650 С - 60 мин
|
ZnS (2008)
|
|
158-1
|
без отмывки
|
|
|
|
|
|
|
158-2
|
1 отмывка
|
|
|
|
|
|
|
158-3
|
2 отмывки
|
|
|
|
|
|
|
158-4
|
4 отмывки
|
|
|
|
|
|
2) Состав ZnS:Cu,Cl(Cu=0.3%) синтез + закалка в жидком азоте
- 159-1 – без отжига
- 159-2 – температурный отжиг
- 159-3(1) – радиационный отжиг электронами (доза 10 Мрад)
- 159-3(2) – радиационный отжиг электронами (доза 20 Мрад)
Была приготовлена шихта следующего состава (серия 159):
ZnS(2008 г.) = 58.75 г
(S+ZnS) = 3.3125 г
NH4Cl = 0.273 г
CuCl = 0.282 г (0.3 %)
Синтез люминофора (ЛФ) проводился в корундовом тигле 950 С – 90 минут. Сразу после синтеза (не дав остыть печи) провели закалку ЛФ в жидком азоте, опустив горячий тигель в ванну с N2 на 15-20 минут с последующим доведением до комнатной температуры на воздухе. Затем ЛФ просеяли через сито 40 мкм и перемешивали в стеклянной баночке на валках 1 час.
Низкотемпературный отжиг люминофора
Для дополнительного распада образовавшегося при синтезе пересыщенного твердого раствора меди в сульфиде цинка и образования гетеропереходов ZnS-CuXS, являющихся источниками электронов при возбуждении люминесценции переменным электрическим полем, проводился низкотемпературный отжиг электролюминофора. Для этого очищенный и просеянный люминофор загружали в фарфоровые чашки и распределяли его равномерным слоем. Чашки с люминофором помещали в муфельную печь и отжигали при температуре 650 С – 1 час. После отжига люминофор остывал до комнатной температуры вместе с печью. Остывший отожженный люминофор размалывали и просеивали через сито.
2.2 Методы и методики исследований
2.2.1 Общие требования техники безопасности в лаборатории
Химические лаборатории относятся к категории опасных рабочих помещений, т.к. в них содержатся химические реактивы, некоторые из которых попадают в категорию опасных отравляющих веществ. Приступать к работе с вредными веществами необходимо, только при включении вытяжной системы. Работники должны иметь средства индивидуальной защиты.
К работе в химической лаборатории допускаются лица прошедшие инструктаж и обязующиеся выполнять все требования техники безопасности, среди которых выделяются требования по химической и электротехнической безопасности.
Техника безопасности при работе в химической лаборатории. При работе в химической лаборатории необходимо строго соблюдать технику безопасности в соответствии с правилами и инструкциями по охране труда и безопасности.
Необходимо помнить:
- Категорически запрещается работать в лаборатории одному.
- В лаборатории запрещается курить, готовить и принимать пищу.
- Запрещается пробовать химические вещества на вкус. Определять запах следует очень осторожно, не вдыхая полной грудью и не наклоняясь над сосудом, а направляя к себе пары вещества движением руки.
- Нельзя работать в загрязненной посуде. Ее следует мыть сразу после использования.
- На любой посуде, в которой хранятся химические вещества или растворы, обязательно должны быть надписи с наименованием содержимого.
- При работе с легко воспламеняющимися жидкостями, такими как спирты, эфиры, бензол и др., не должно быть по близости огня и включенных плиток.
- Органические соединения в той или иной степени ядовиты, многие из них огнеопасны и взрывоопасны. Поэтому в процессе работы нужно соблюдать чистоту, быть аккуратным и внимательным, следить за тем, чтобы вещества не попадали на кожу, во время работы не трогать лицо и глаза руками, не принимать пищу, по окончании работы тщательно мыть руки.
Все работы с летучими токсичными веществами, кислотами, щелочами и др., следует проводить в вытяжном шкафу и в резиновых перчатках.
Электротехническая безопасность. При работе с электрическими приборами нужно соблюдать следующие правила безопасности:
- Приборы должны быть заземлены;
- Изоляционная оболочка провода прибора и вилка должны быть целыми, без трещин и разрывов;
- На токоведущие части прибора не должна попадать вода, что может привести к короткому замыканию и пожару;
- Обо всех неисправностях электроприборов нужно немедленно доложить заведующему лабораторией или преподавателю и немедленно отключить электропитание.
2.2.2 Растровая электронная микроскопия
Сущность метода состоит в том, что поверхность массивного образца облучается тонко сфокусированным (диаметром до 5-10 нм) пучком электронов - так называемым электронным зондом. Пучок электронов совершает возвратно-поступательное движение по линии или развертывается в растр - совокупность близко расположенных параллельных линий, вдоль которых пучок электронов обегает выбранный для исследования участок поверхности.
В каждой точке облучаемой поверхности происходит взаимодействие электронов пучка 1 с веществом, в результате чего возникает ряд эффектов: образуются отраженные электроны 3, вторичные электроны 4, рентгеновское 7 и другие излучения (см. рис. 3, где 1 - электронный пучок; 2 - образец; 3 - отраженные электроны; 4 - вторичные электроны; 5 - ток поглощенных электронов; 6 - катодолюмине-сценция; 7 - рентгеновское излучение; 8 - Оже-электроны; 9 - наведенный ток; 10 - прошедшие электроны). Эти эффекты служат основой для получения разнообразной информации: о рельефе поверхности образца 2, химическом составе и кристаллографической ориентации объемов, прилегающих к поверхности. Электроны, испускаемые веществом, различного рода излучения, улавливаются специальными датчиками и после усиления используются для управления яркостью электронно-лучевой трубки, на экране которой формируется изображение. При этом каждой точке на поверхности образца 2 соответствует определенная точка на экране электронно-лучевой трубки. Яркость каждой точки на экране определяется интенсивностью сигнала из соответствующей точки образца. Интенсивность сигналов изменяется при пробегании электронного зонда по поверхности образца. Это обеспечивает контраст в изображении разных участков поверхности на экране электронно-лучевой трубки.
Растровый электронный микроскоп (РЭМ) является одним из наиболее универсальных приборов для исследования и анализа микроструктурных характеристик твердых тел. Основной причиной широкого использования РЭМ является высокое разрешение при исследовании массивных объектов, достигаемое в серийных приборах 10 нм. На лучших лабораторных приборах реализуется разрешение 2.5 нм [19]. Другой важной чертой полученных с помощью РЭМ изображений, является их объемность, обусловленная большой глубиной фокуса прибора.
Принципиальная схема РЭМа представлена на рисунке 3.1. На ней можно выделить следующие основные системы: электроннооптическую 1-10, предназначенную для формирования электронного зонда и его сканирования (пробегания) по поверхности образца 14; систему, формирующую изображение 11-18. РЭМ снабжен вакуумной автоматизированной системой и устройствами точной механики (шлюзы, держатели образцов и пр.). Основная область применения РЭМа - анализ рельефа поверхности, в особенности изломов (фрактография). Преимущества РЭМ по сравнению с другими микроскопами здесь наиболее заметны. В связи с тем, что изображение обычно формируется с помощью вторичных электронов, зона выхода которых ограничена малой областью вокруг места падения зонда, достигается высокая разрешающая способность. Это позволяет исследовать мельчайшие детали рельефа поверхности. РЭМ обеспечивает также большую резкость в сочетании с наглядностью изображения. Это дает возможность исследовать объекты с сильно развитой поверхностью.
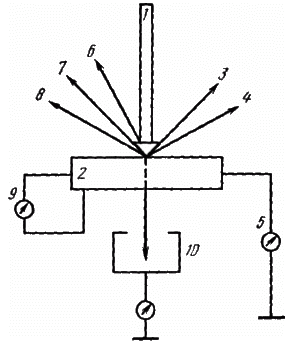
Рисунок 3 Эффекты, возникающие при взаимодействии пучка электронов с веществом: 1 - электронный пучок; 2 - образец; 3 - отраженные электроны; 4 - вторичные электроны; 5 - ток поглощенных электронов; 6 - катодолюминесценция; 7 - рентгеновское излучение; 8 - Оже-электроны; 9-наведенный ток; 10 - прошедшие электроны.
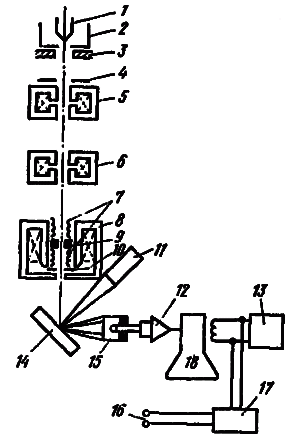
Рисунок 3.1 Принципиальная схема растрового электронного микроскопа (РЭМ): 1 - катод; 2 - фокусирующий электрод; 3 - анод; 4 - ограничивающая диафрагма; 5 - первая кондесорная линза; 6 - вторая конденсорная линза; 7 - отклоняющие катушки; 8 - стигматор; 9 - конечная (объективная) линза; 10 - диафрагма, ограничивающая размер пучка; 11 - детектор рентгеновского излучения; 12 - усилитель фотоумножителя; 13 - генераторы развертки; 14 - образец; 15 - детектор вторичных электронов; 16 - к отклоняющим катушкам; 17 - управление увеличением; 18 - ЭЛТ.
В работе изображения микроструктуры образцов получали с использованием растрового электронного микроскопа Hitachi TM-1000.
2.2.3 Рентгенофазовый анализ
Исследования кристаллической структуры проводились на 48-детекторном суперпозиционном нейтронном дифрактометре, установленном на пучке № 9 реактора ВВР-М ПИЯФ РАН (длины волн 1=1.752_A, 2 = 0.876_A, отношение интенсивностей I(2)/I(1) = 0.003). Обработка результатов проводилась методом Ритвельда и при помощи программного комплекса полнопрофильного анализа FullProfSuite . Исследовалась кристаллическая структура образцов люминофоров ZnS : Cu,Cl (Cu=0.3%), с различной обработкой сульфида цинка. Типичный измеренный дифракционный профиль и результаты обработки приведены на рис. 1.
2.2.4 ИК-Спектроскопия
Поверхность полученных образцов исследовали с применением метода ИК-спектроскопии с Фурье преобразованием в области 400-4000 см-1 с разрешением 2 см-1 на приборе Nicolet 6700, Thermo Fisher Scientific. Материалы были исследованы методом диффузного отражения при этом готовилась смесь состава: 95% KBr и 5% исследуемого материала. Полученные данные обработаны с использованием программного обеспечения OMNIC.
2.2.5 рН-метрия
-кинетический метод
Известно, что, если порошкообразное твердое вещество привести в соприкосновение с водой или раствором электролита, происходит изменение рН суспензии (рНсусп.) во времени [44]. Это изменение протекает для каждого твердого вещества с характерным ходом кинетических кривых, с различным расположением их относительно уровня кислотности исходного электролита (рНо), с разным временем установления равновесия. Индивидуальность кинетических кривых рНсусп. = f() является отражением кислотно-основных свойств поверхности твердого тела и используется для приближенной оценки интегральной кислотности поверхности, как по общему ходу кривых, так и по значению рН в экстремальных точках (рНэкстр.) или в момент равновесия (рН). При сравнении нескольких образцов используют величины рН после 5 секунд (рН5’’), 10 секунд (рН10’’), 15 секунд (рН15’’), 2 минут (рН2’), или какого-либо другого времени с момента образования суспензии [45–48].
Гидратация твёрдых поверхностей возможна по двум типам: кислотному и основному. Известно, что результаты по исследованию адсорбции воды всесторонне характеризуют физико – химические свойства поверхности твёрдых веществ и могут быть использованы для целей рационального выбора материалов. Считается, что рН – метрические измерения в водной среде отражают также и кислотно – основные свойства поверхности этих материалов.
При изучении адсорбции красителей из водных растворов на поверхности твёрдых веществ различного происхождения наблюдалось выделение водорода и определённое изменение рН раствора. Были исследованы, в частности, Al2O3, высокодисперсный металлический алюминий и оксиды: MgO, NiO, TiO2, SiO2, CuO, WO3. Все образцы авторы данной методики отмывали водой для удаления сорбированных на них веществ, а затем высушивали в токе сухого воздуха при комнатной температуре. Были получены кинетические кривые изменения величинырН суспензий после внесения в воду навесок образцов исследуемых оксидов. Кривые различались по ходу, характеру, времени стабилизации величины рН раствора и расположению относительно линии нейтральности. В большинстве случаев наиболее резкое изменение значения рН наблюдалось в начальный период контакта воды с поверхностью образца. Последующий ход кривой характеризовался плавным изменением кислотности раствора или прохождением ее через экстремум. Кривые, полученные для основных оксидов лежат в основной области шкалы рН, для кислотных – в кислотной области.
Наблюдалось несоответствие характера кинетических кривых растворимости вещества и изменения величины рН суспензии при контакте воды с его поверхностью. Это позволило высказать предположение, что растворимость вещества в воде не является определяющим фактором в изменении значений рН среды, а играет, по-видимому, второстепенную роль. Главным фактором, очевидно, будет процесс взаимодействия воды с поверхностью образца и её диссоциация под воздействием напряжённости поля центров адсорбции по тому или иному типу в зависимости от того, какой вид апротонных центров на поверхности преобладает.
Мнение о возможности диссоциации молекул координационно-связанной воды на кислотных центрах Льюиса по основному механизму Э+…ОН/Н+, а на основных центрах Льюиса по кислотному ЭО…Н+/ ОН широко известно в литературе. В таком случае при диссоциации по гетеролитическому механизму в раствор должны перейти ионы Н+ и ОН. Изменение величины рН в соответствующем направлении укажет тип апротонных центров, преобладающих на поверхности.
Таким образом, можно предположить, что ход кинетической зависимости изменения рН в процессе взаимодействия воды с поверхностью отражает кинетику изменения энергетического состояния последней под воздействием растворителя.
Полученные результаты дали возможность по характеру рН-метрических кривых проследить изменение характера кислотности. Если исходить из представлений, что вода производит минимальные изменения в энергетическом состоянии образца в первый момент контакта, то рН раствора за это время должно в максимальном приближении отразить реальную ситуацию на его исходной поверхности. Так как в большинстве случаев наиболее резкое изменение рН происходит именно в начальный период контакта, то можно предположить, что разложение воды по гетеролитическому механизму происходит на первичных центрах Льюиса. Изменение хода кинетической кривой свидетельствует об участии в процессе взаимодействия с водой вторичных по типу центров – вторичных.
Время стабилизации рН системы образец – вода после внесения навески вещества связано с изменениями в поверхностной кислотности и указывает, очевидно, на возможные структурные преобразования, имеющие место, как на поверхности, так и в объёме образца.
Таким образом, изменение величины рН водной среды отражает характер изменения поверхностной кислотности как единичного образца в процессе взаимодействия с водой, так и соответствующей серии с каким – либо переменным параметром по изменению рН раствора в начальный период контакта. И данная методика исследования, обработки полученных данных и их интерпретация рекомендованы для отбраковки оксидного сырья, оценки и контроля качества материалов, изготовленных на его основе. [43]
Для подтверждения полученных результатов был использован другой вариант метода рН-метрии – потенциометрический [40]. Для этого готовили серию растворов KCl с различными значениями рН в интервале 49 ед. рН. Для каждого образца взяли по 4 навески по 0,1г и поместили в 20 мл раствора KCl с соответствующим значением рН. После установления равновесия (2 часа) раствор фильтровали и фиксировали значение рН фильтрата.
2.2.6 Индикаторный метод оценки кислотно-основных свойств поверхности
Значительный прогресс в современных взглядах на природу и химию поверхности твёрдого тела, а также возможность успешно применять для изучения её реакционной способности такие информативные и высокочувствительные методы анализа малых концентраций, как спектроскопические, объясняют возросший интерес к методу цветных индикаторов – одному из самых распространенных и простых методов исследования адсорбционных свойств поверхности [43, 44, 52–55].
В работе [52] описана методика исследования кислотно-основных свойств поверхности твёрдых веществ индикаторным методом в жидких средах. В отличие от известных методов [43, 53], в неё вводятся поправки, учитывающие эффекты взаимодействия поверхности исследуемого образца с растворителем, что повышает правильность и точность количественного определения.
Описание донорно-акцепторных свойств поверхности твердого тела позволяет получить индикаторный метод К. Танабе [40], усовершенствованный А.П. Нечипоренко[41]. Индикаторный метод основан на селективной адсорбции кислотно-основных индикаторов с заданными значениями рКа кислотно-основного перехода и спектрофотометрическом определении изменения оптической плотности их растворов. Главными преимуществами индикаторного метода перед другими методами исследования поверхностных свойств твердых тел являются простота, доступность и возможность изучения всего комплекса характеристик поверхности и их изменений под влиянием разного вида воздействий. При этом силу кислотно-основных центров поверхности характеризуют рКа индикатора, адсорбирующегося в сопряженной форме, а количество адсорбированного индикатора определяет количество центров данной силы.
Рисунок 4 - Модель кислотно-основного спектра частично дегидратированной поверхности оксида
Значению рКа = +7 отвечают центры нейтрального характера. Уменьшение величины рКа ведёт к повышению акцепторных свойств энергетических уровней граничных орбиталей. Соответственно с увеличением значения рКа повышается их донорная способность. Возрастание акцепторной способности атома Э приведёт к повышению кислотности поверхностного центра по Бренстеду. При переходе электрона от атома водорода на орбиталь атома кислорода происходит отрыв протона и образуется щелочной центр Льюиса, который в области значений рК -1,7 способен адсорбировать молекулы воды – акцепторы по кислотному механизму. О наличии на поверхности оксидов таких центров говорит подъём левой ветви кривых адсорбции. С усилением донорных свойств атома Э щелочные центры Бренстеда в результате отрыва ОН- группы дадут кислотный центр Льюиса (рК +15,7), на котором при определённых условиях может происходить адсорбция молекул воды – доноров по основному механизму.
Из электронной теории известно, что адсорбция на поверхности твёрдого тела молекул – доноров приводит к понижению энергии Ферми, усилению её акцепторных свойств, увеличению количества центров – акцепторов и повышению кислотности. Напротив, адсорбция молекул – акцепторов вызывает смещение уровня Ферми по шкале энергий вверх и повышение донорных свойств поверхности с увеличением количества центров – доноров.
В результате термоактивации происходит десорбция молекул воды. Согласно схеме, если при дегидратации имеет место преимущественно удаление молекул воды – доноров, этот процесс должен сопровождаться повышением уровня Ферми и основности поверхности (сдвиг спектра вправо). Напротив, при десорбции молекул воды – акцепторов происходит снижение уровня Ферми и увеличение количества акцепторных центров (сдвиг влево). В чистом виде тот или иной механизм адсорбции воды, очевидно, не реализуется (или очень редко), но в большинстве случаев доминанта принадлежит какому – либо одному типу.
Данный метод исследования позволяет не только установить концентрацию центров, но и получить картину распределения их на поверхности с дифференциацией по типу и силе. Предлагаемая методика была применена на широком круге неорганических материалов (оксиды, металлы, пористые стёкла, керамика и др.). Методика также пригодна для исследования кислотности поверхности твёрдых веществ независимо от их природы, в том числе животного и растительного происхождения (мех, кожа, шерсть, шелк). Ограничивают применимость метода те случаи, когда в результате контакта поверхности твёрдого тела с растворителем фотометрируемый раствор по тем или иным причинам получается непрозрачным (мутным), и предварительное отмывание, например от высокодисперсных и лёгких фракций или от сорбированных на поверхности компонентов, с последующим высушиванием нежелательно. [42]
Точную навеску образца (m1 0,02 г) помещали в калиброванные пробирки емкостью 5 мл, приливали нужный объем стандартного раствора индикатора с определенным значением pKa, разбавляли водой до метки, тщательно перемешивали и выдерживали в течение 2 ч (до установления равновесия), периодически перемешивая. Затем измеряли при длине волны, соответствующей максимуму поглощения каждого индикатора, значение оптической плотности, соответствующей остаточной концентрации реагента (D1). Одновременно проводили холостой опыт, учитывающий влияние взаимодействия образца с растворителем на изменение оптической плотности в процессе адсорбции красителя. Для этого навески образца (m1m2) заливали 3 мл воды, через два часа декантировали раствор в другую пробирку, добавляли необходимый объем индикатора, разбавляли водой до 5 мл, перемешивали и измеряли D2 – значение оптической плотности, соответствующее изменению окраски индикатора за счет изменения pH среды при контакте образца с растворителем.
Изменение оптической плотности в результате адсорбции (D) на поверхности образца находили из разности D1 и D2.
D =D0 -D1D0 -D2, (1)
где D0 – оптическая плотность раствора индикатора.
Количество центров данной силы, эквивалентное количеству адсорбированного на поверхности образца индикатора, рассчитывали по формуле:
qpKa = СindVind /D0(D0 -D1/m1D0 -D2/m2), (2)
где Сind – концентрация стандартного раствора индикатора, мг-моль/мл;
Vind – объем стандартного раствора индикатора, мл;
Знак «–» в формуле (2) соответствует однонаправленному изменению D1 и D2 относительно D0. Знак «+» – разнонаправленному.
Кривые распределения строили в координатах:
qpKa= f(pKa), (3)
где pKa = – lgКа – показатель кислотности (характеризует кислотную силу индикаторов, являющихся слабыми кислотами или основаниями).
Функцию кислотности поверхности твердого вещества Н0 определяли из спектров распределения центров адсорбции по следующей формуле:
, (4)
Чувствительность методики составляет 1%. Воспроизводимость 310-4 мг-экв/г. Погрешность измерения массы навески на аналитических весах составляла 0,1 мг, погрешность измерения коэффициента пропускания – 0,05%.
2.2.7 Спектрально-люминесцентный анализ
Спектрофотометрия — физико-химический метод исследования растворов и твёрдых веществ, основанный на изучении спектров поглощения в ультрафиолетовой (200—400 нм), видимой (400—760 нм) и инфракрасной (>760 нм) областях спектра. Основная зависимость, изучаемая в спектрофотометрии, — зависимость интенсивности поглощения падающего света от длины волны. Спектрофотометрия широко применяется при изучении строения и состава различных соединений для качественного и количественного определения .
Спектрофлуориметр СМ 2203 обеспечивает высокочувствительные и стабильные измерения в ультрафиолетовой и видимой областях спектра. Измеренные спектры отображаются в истинном виде в относительных квантовых единицах, предназначен для проведения количественного и качественного анализов методом измерения флюоресценции.
Явление флуоресценции характеризуется свойствами, определяющими его аналитические возможности. Под действием коротковолнового излучения возбуждаются электронные оболочки люминесцентных молекул, присутствующих в веществе пробы; необ�ходимо поэтому, чтобы возбуждающее излучение находилось внутри полосы поглощения исследуемых молекул. Возбужденные молекулы начинают излучать свет, максимум спектра которого сдвинут в сторо�ну длинных волн по отношению к максимуму спектра поглощения; вследствие этого обычно длины волн спектра люминесценции больше, чем длина волны возбуждающего света. Однако часть энергии, поглощенной молекулами вещества, при некоторых условиях может до излучения распределиться по другим степеням свободы молекул, при этом происходит тушение флуоресцен�ции. Оно связано как со свойствами самого люминесцентного веще�ства, так и со свойствами растворителя и особенно сильно развивается при больших концентрациях люминесцентного вещества в растворе. .
Люминесцентный анализ по спектрам флуоресценции обладает исключительно высокой чувствительностью, однако столь высокая чувствительность люминесцент�ного анализа приводит к серьезным трудностям: достаточно незначи�тельной примеси постороннего вещества, также способного люминесцировать, чтобы его свечение обнаруживалось в наблюдаемом спектре и искажало результаты визуального определения, когда анализ прово�дится без спектрального разложения, излучаемым веществом, облученным источником света.
Таблица 3 Технические характеристики спектрофлуориметра СМ 2203
|
Чувствительность
|
Отношение сигнал/шум - не менее 160 для Рамановского спектра воды (при выделяемой спектральной полосе пропускания монохроматоров 5 нм и времени усреднения сигнала 2 сек.)
|
|
Монохроматор
|
двойные со сложением дисперсии
|
|
Выделяемый спектральный интервал
|
произвольный: 0...15 нм
|
|
Точность установки длины волны
|
± 0,4 нм
|
|
Спектральный диапазон
|
200...820 нм
|
|
Кюветное отделение
|
однопозиционный термоэлектрически термостатируемый в
диапазоне температур 10...60 °С кюветодержатель с управляемой магнитной мешалкой
|
|
Минимальный объём образца
|
1 мл в стандартной 10 мм кювете
|
|
Режим спектрофотометра:
|
Спектральный диапазон: 200...1100 нм
Фотометрический диапазон: - 0,3...3 Б
Точность фотометрирования: < 3% (в зависимости от величины поглощения)
|
|
Интерфейс
|
RS232
|
|
Габариты
|
500x400x230 мм
|
|
Вес
|
18 кг
|
|
Энергопотребление
|
220 (±10 %) В, 50Гц, 350 ВА
|
|
Вспомогательное оборудование
|
спектрофлуориметр для поляризационных измерений, держатель твёрдых образцов, оптоволоконный зонд для измерения люминесценции вне кюветного отделения, "стандартный" люминесцирующий образец с широкодиапазонным спектром люминесценции.
|
Рисунок 4.1 - Схема спектрофлуориметра
1 – монохроматор возбуждения; 2 – держатель кюветы; 3 – монохроматор эмиссии; 4 – фотоэлектронный умножитель со стороны возбуждения; 5 – фотоэлектронный умножитель со стороны эмиссии; 6 – ксеноновая лампа 150 Вт.
Монохроматор возбуждения (1) выделяет из света ксеноновой лампы заданный диапазон длин волн, чтобы получить возбуждающее излучение. Так как, чем ярче возбуждающий свет, тем выше чувствительность спектрофлюорофотометра, то монохроматор возбуждения снабжен дифракционной решеткой с большой апертурой, чтобы сохранить как можно больше света.
Держатель кюветы (2) удерживает кювету, заполненную образцом.
Монохроматор эмиссии (3) селективно принимает флюоресценцию, изучаемую образцом, а его фотоэлектронный умножитель измеряет интенсивность флюоресценции. Этот монохроматор имеет дифракционную решетку таких размеров, что и решетка монохроматора возбуждения, чтобы собрать наибольшее возможное количество света.
Фотоэлектронный умножитель (4) предназначен для наблюдения. Обычно ксеноновые лампы (6), используемые в спектрофлуориметрах, обладают очень высокой интенсивность излучения и не прерывным спектром излучения. Однако их тенденции к нестабильному световому излучению может привести к увеличению величины шума, если не предпринимать соответствующих мер. Кроме того, неидентичность спектра излучения ксеноновой лампы и спектральной чувствительности фотоэлектронного умножителя приводит к искажению спектра. Чтобы преодолеть эти факторы, фотоэлектронный умножитель (4) при сканировании флюоресценции принимает часть возбуждающего света и направляет результирующий сигнал на фотоэлектронный умножитель (5).
Для синтезированных люминофоров были исследованы спектры фото- люминесценции. Спектры фотолюминесценции получали на спектрофлюориметре СМ 2203 (Solar, Беларусь). Для этого образцы люминофоров помещали в держатель для твердых образцов с применением двух кварцевых стекол. Возбуждающий свет источника излучения падал на образец перпендикулярно его поверхности, а люминесценция регистрировалась под углом 450, что уменьшало вклад отраженного света от источника излучения. Погрешность измерения составляла ± 2 нм.
- Результаты и обсуждения
На первом этапе работы проводились исследования первой и второй серий образцов люминофоров состава Состав ZnS:Cu,Cl(Cu=0.3%) синтезирован обычным методом и различающихся видом отжига. Сведения о данных образцах указаны в таблице 2.
Исследование морфологии поверхности.
Исследование поверхности проводилось методом растровой электронной микроскопии. Фотографии поверхности образцов серии 158 представлены на рисунке 5.


А) ZnS: Cu, Cl(158-1) Б) ZnS: Cu, Cl(158-2)


В) ZnS: Cu, Cl(158-3) Г) ZnS: Cu, Cl(158-4)
Рисунок 5. Микрофотографии поверхности образца люминофора серии 158, состава ZnS: Cu, Cl. (А-без отмывки, Б-отмывка 1 раз, В-отмывка 3 раза, Г-отмывка 4 раза).
Анализ микрофотографий поверхности (рисунок 5) показал, что образец ZnS:Cu,Cl (158-1) состоит из агломератов частиц различного размера (от 3 до 18,4 мкм). Отдельные частицы различимы, имеют четкую огранку, что свидетельствует о высокой степени совершенства их кристаллической структуры.
По сравнению с образцом ZnS:Cu,Cl (158-1) частицы образца ZnS:Cu,Cl (158-2) имеют более четкую огранку, то есть лучше сформированы, различимы отдельные частицы.
Частицы образца ZnS:Cu,Cl (158-3)имеют четкую огранку, различимы отдельные частицы. Анализ микрофотографий поверхности показал, что образец ZnS:Cu,Cl (158-4) состоит из агломератов частиц неправильной формы различного размера. Отдельные частицы различимы, имеют четкую огранку. В образце также присутствуют частицы мелкого размера.
Фотографии поверхности образцов серии 158 представлены на рисунке 6


Д) ZnS: Cu, Cl(159-1) Е) ZnS: Cu, Cl(159-2)


Ж) ZnS: Cu, Cl(159-3.1) З) ZnS: Cu, Cl(159-3.2)
Рисунок 6. Микрофотографии поверхности образца люминофора серии 159, состава ZnS: Cu, Cl. (Д-без отжига, Е-температурный отжиг, Ж-отжиг электронами доза 10 Мрад, З- отжиг электронами доза 10 Мрад).
Анализ микрофотографий поверхности (рисунок 6) показал, что образец ZnS:Cu,Cl (159-1) состоит из агломератов частиц неправильной формы различного размера. Частицы различимы, имеют четкую огранку, что свидетельствует о высокой степени совершенства их кристаллической структуры. Частицы образца ZnS:Cu,Cl (159-2) имеют нечеткую огранку, различимы отдельные частицы, составные части достаточно больших агломератов размером, более крупные, чем в образце ZnS:Cu,Cl (159-1) . Анализ микрофотографий поверхности показал, что образец ZnS:Cu,Cl (159-3,1) состоит из агломератов частиц неправильной формы различного размера(от 3 до 11мкм). Отдельные частицы различимы, имеют четкую огранку. Частицы образца ZnS:Cu,Cl (159-3,2) имеют четкую огранку, различимы отдельные частицы, составные части достаточно больших агломератов размером(от 2 до 11мкм).
Размеры и форма кристаллов исследуемых порошков разнообразны, что является следствием различия химической природы, кристаллохимического строения и технологии синтеза образцов.
- Типичный измеренный дифракционный профиль и результаты обработки приведены на рисунке 7. Согласно этим данным, образец 159-1 сформировался в кубической модификации ZnS (сфалерит, пространственная группа 216). Ширина пиков во всех случаях соответствует приборному разрешению, что свидетельствует об отсутствии значимых искажений решетки.
Рисунок 7. Спектр рентгеновской дифракции порошкообразного ZnS:Cu,Сl, без отжига
Рисунок 8. Спектр рентгеновской дифракции порошкообразного ZnS:Cu,Сl, темп.отжиг
Термический отжиг образца ЭЛФ приводит к образованию на поверхности частиц оксида цинка, что показано на рисунке 8. Использование термического воздействия приводит к увеличению постоянной решетки синтезированных люминофоров с 5.411782 до 5.412168 A, так как медь имеет больший ионный радиус, чем цинк (0.77 и 0.74 А., соответственно).
Кроме этого косвенного показателя, данным методом не было обнаружено ни замещение атомами меди узлов цинка, ни появление новых фаз, которые можно было бы связать с преципитатами. Формируемые дефекты не устраняются полностью в процессе термической обработки (образец 159-2), что приводит к увеличению числа безызлучательных центров рекомбинации носителей и снижению яркости
люминесценции.
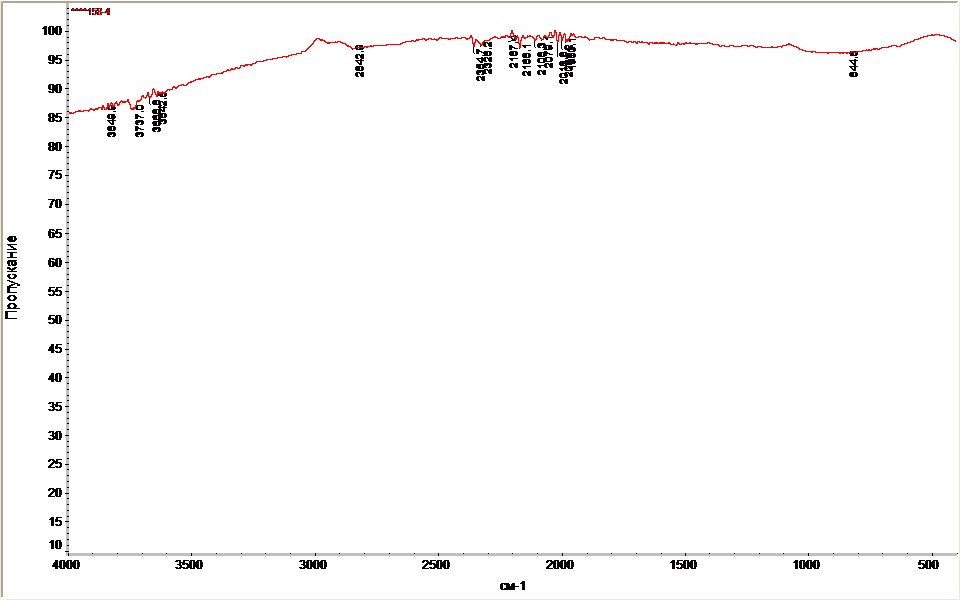
Рисунок 9.
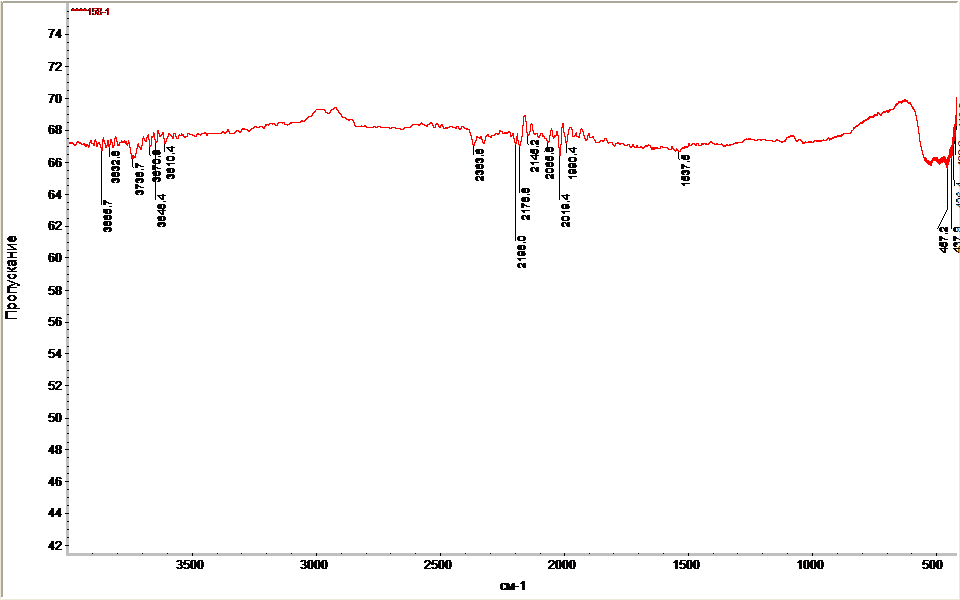
Рисунок 10.
Исследование кислотно-основных свойств поверхности изучались тремя методами
-Кинетический метод рН-метрии
-Потенциометрический метод рН-метрии
- Метод адсорбции индикаторов Гаммета
Известно, что при контакте твёрдого тела с жидкостью имеют место диссоциативные и адсорбционно – десорбционные процессы, а также явления смачивания, растворения и гидролиза. Изменение рН среды вследствие протекания этих процессов зависит, в частности, от времени контакта в системе жидкость – твёрдое тело. Изменение рН растворов при суспензировании в них порошков сульфида цинка, легированного медью представлены на рисунках 11-13 и в таблицах 4,5 в виде кинетических кривых изменения рН суспензии от времени.
Вода производит минимальное изменение в энергетическом состоянии образца в первый момент контакта. Поэтому изменение рН раствора за это время должно в максимальном приближении отразить реальную ситуацию на его исходной поверхности, что является следствием диссоциации поверхностных гидроксильных групп и молекул воды.
Кинетический метод: Контроль за изменением pH среды во времени, начиная с первых 5 – 10 секунд контакта твердого тела с растворителем. Для чего в потенциометрическую ячейку вводили 15 мл бидистиллированной воды и после стабилизации потенциала стеклянного электрода одновременно с включением секундомера высыпали навеску (0,1 г) образца. Суспензия непрерывно перемешивалась с помощью магнитной мешалки, использовали pH-метр / иономер ИТАН со стеклянным и хлорсеребряными электродами.
Результаты представлены в таблице 4 и на рисунках 11-13.
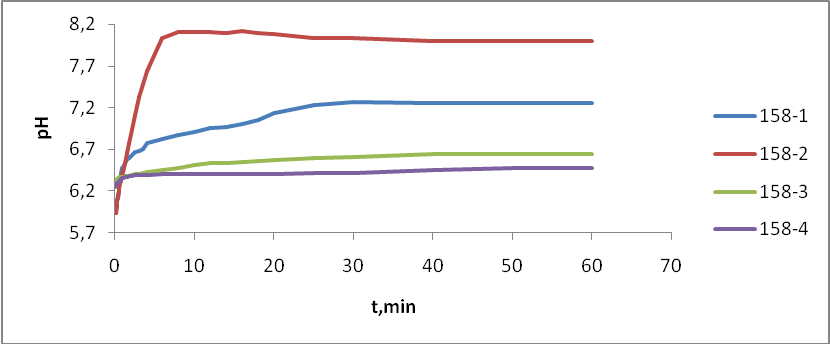
Рисунок 11 Изменения рН водных суспензий люминофоров серии 158,1-158,4 состава ZnS:Cu,Cl
Таблица 4 – Результаты изучения кислотно-основных свойств люминофоров ZnS:Cu,Cl, синтезированных обычным методом (отмывки от 1 до 4 раз).
|
|
Данные для кинетического варианта метода рН-метрии
|
|
Образец
|
pH 5"
|
pH 20"
|
pH 20'
|
pHиис
|
|
158-1 (б. отм.)
|
6,00
|
6,10
|
7,10
|
7,25
|
|
158-2 (отм.1 раз)
|
5,90
|
6,10
|
8,10
|
8,00
|
|
158-3 (отм. 2 раза)
|
6,30
|
6,30
|
6,60
|
6,60
|
|
158-4 (отм.4 раза)
|
6,30
|
6,3
|
6,40
|
6,50
|
Таблица 5. Экспериментальные данные по рН-метрии для люминофоров состава ZnS:Cu,Cl, серия 158
|
t,min
|
рН
|
|
|
158-1
|
158-2
|
158-3
|
158-4
|
|
0
|
6,00
|
6,00
|
6,30
|
6,25
|
|
0,08
|
6,01
|
5,93
|
6,31
|
6,26
|
|
0,17
|
6,03
|
5,94
|
6,32
|
6,27
|
|
0,25
|
6,06
|
6,02
|
6,32
|
6,28
|
|
0,33
|
6,09
|
6,08
|
6,34
|
6,29
|
|
0,42
|
6,11
|
6,15
|
6,35
|
6,30
|
|
0,50
|
6,20
|
6,20
|
6,36
|
6,31
|
|
0,58
|
6,27
|
6,23
|
6,37
|
6,32
|
|
0,67
|
6,32
|
6,29
|
6,37
|
6,33
|
|
0,75
|
6,38
|
6,32
|
6,37
|
6,34
|
|
0,83
|
6,42
|
6,36
|
6,37
|
6,34
|
|
0,92
|
6,47
|
6,40
|
6,37
|
6,35
|
|
1,00
|
6,49
|
6,43
|
6,37
|
6,36
|
|
1,25
|
6,54
|
6,54
|
6,38
|
6,37
|
|
1,50
|
6,58
|
6,65
|
6,38
|
6,37
|
|
1,75
|
6,59
|
6,78
|
6,38
|
6,38
|
|
2,00
|
6,62
|
6,88
|
6,39
|
6,38
|
|
2,50
|
6,67
|
7,11
|
6,40
|
6,39
|
|
3,00
|
6,68
|
7,32
|
6,40
|
6,39
|
|
3,50
|
6,70
|
7,48
|
6,42
|
6,39
|
|
4,00
|
6,78
|
7,64
|
6,43
|
6,39
|
|
6,00
|
6,82
|
8,03
|
6,45
|
6,40
|
|
8,00
|
6,87
|
8,11
|
6,48
|
6,40
|
|
10,00
|
6,91
|
8,11
|
6,51
|
6,40
|
|
12,00
|
6,95
|
8,11
|
6,53
|
6,40
|
|
14,00
|
6,97
|
8,09
|
6,54
|
6,40
|
|
16,00
|
7,00
|
8,12
|
6,55
|
6,40
|
|
18,00
|
7,05
|
8,09
|
6,56
|
6,40
|
|
20,00
|
7,14
|
8,08
|
6,57
|
6,40
|
|
25,00
|
7,23
|
8,03
|
6,59
|
6,41
|
|
30,00
|
7,26
|
8,03
|
6,61
|
6,42
|
|
40,00
|
7,25
|
8,00
|
6,64
|
6,45
|
|
50,00
|
7,25
|
8,00
|
6,64
|
6,48
|
|
60,00
|
7,25
|
8,00
|
6,64
|
6,48
|
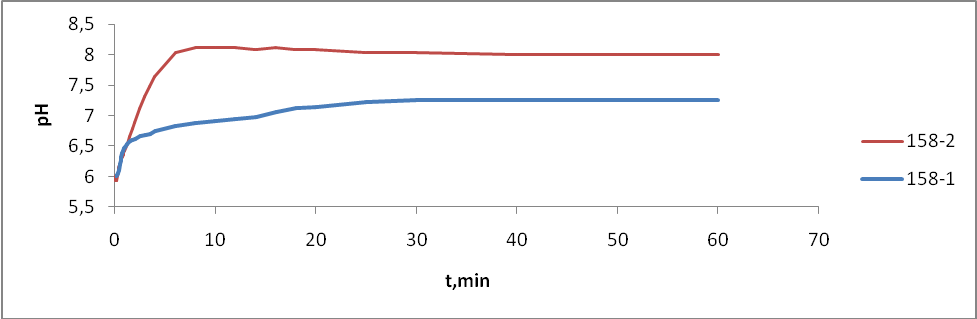
Рисунок 12 Изменения рН водных суспензий люминофоров серии 158 состава ZnS:Cu,Cl (без отмывки, отмывка 1 раз)

Рисунок 13 Изменения рН водных суспензий люминофоров серии 158 состава ZnS:Cu,Cl (отмывка 2 раза, отмывка 4 раза)
Результаты рН-метрического исследования кислотно-основных свойств электролюминофоров представлены на рисунках 11-13. Из хода кривых (рис.12,13) следует, что образцы отличаются по кислотно-основному состоянию поверхности, а именно, поверхность образца 158-2 является слабо-основной, в то время как поверхность остальных люминофоров состава ZnS:Cu,Cl слабокислотной (для образца 158-3,158-4) или нейтральной (для 158-1). . На рисунке 11 приведены данные, характеризующие кислотно-основные свойства серии образцов 158-1-158-4. Из которых виден довольно большой разброс значений рНиис (6,00-8,2) и медленный (пологий) рост значений рН в начальные моменты контакта поверхности образцов с водой, что может быть связано с плохой смешиваемостью образца с водой. Анализ спектров распределения центров адсорбции показывает (рисунок 12), что на образцах 158-1 и 158-2 цинксульфидного люминофора, присутствуют льюисовские основные центры в разных количествах, а так же бренстедовские основные и кислотные центры разной силы. Н образцах 158-3 и 158-4 преобладают Бренстедовкские кислотные центры. При этом основность поверхности возрастает в ряду 158-4< 158-3.
Исследование кислотно-основных свойств выявило, что количество отмывок оказывает влияние на характер поверхности исследуемых веществ. Так, из таблиц 4,5 и рисунков 11-13 видно, что наиболее основным является образец люминофора без отмывки.
Из представленных рисунков и таблиц для исследуемых люминофоров мы наблюдаем нейтральное или слабо кислое состояние поверхности.
Потенциометрический метод
Таблица 6. Экспериментальные данные по рН-метрии для люминофоров состава ZnS:Cu,Cl
|
158-1
|
158-2
|
158-3
|
158-4
|
|
рН0
|
рН
|
рНравн
|
рН0
|
рН
|
рНравн
|
рН0
|
рН
|
рНравн
|
рН0
|
рН
|
рНравн
|
|
4,05
|
-2,89
|
6,94
|
4,05
|
-3,03
|
7,08
|
4,07
|
-2,05
|
6,12
|
4,07
|
-2,5
|
6,61
|
|
5,27
|
-1,6
|
6,85
|
5,27
|
-1,75
|
7
|
5,25
|
-1,15
|
6,4
|
5,25
|
-1,07
|
6,32
|
|
6,1
|
-0,7
|
6,8
|
6,1
|
-1,13
|
7,23
|
6,1
|
-0,51
|
6,61
|
6,1
|
-0,5
|
6,62
|
|
9,13
|
1,95
|
7,18
|
9,13
|
0,89
|
8,24
|
9,1
|
1,9
|
7,13
|
9,1
|
1,88
|
7,22
|
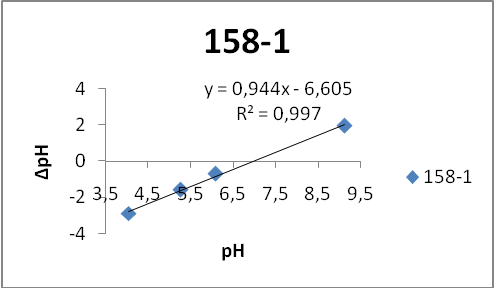
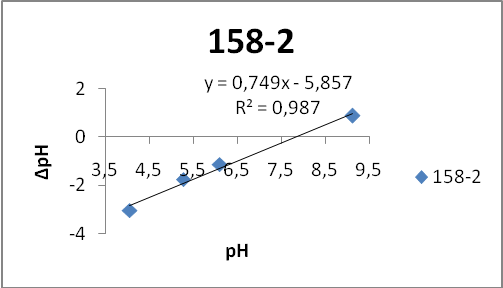
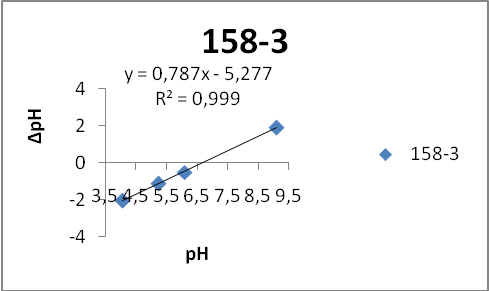
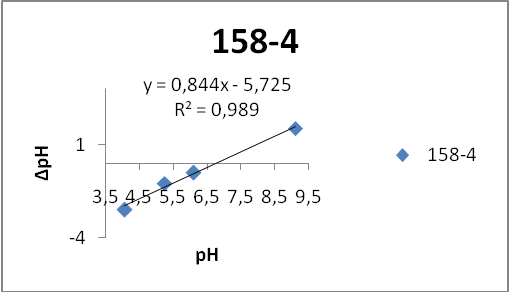
Рисунок 14. Зависимость рН от рН0 для сульфидов цинка, активированных медью, серия 159
Кинетический метод: Результаты изучения кислотно-основных свойств образцов серии 159 представлены на рисунках 15-17 и в таблицах 7-8.
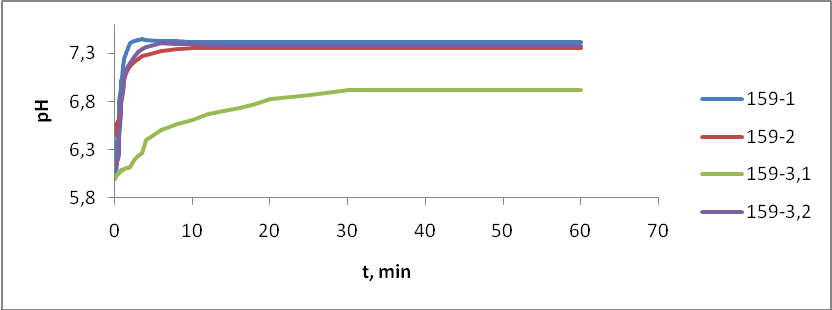
Рисунок 15. Изменения рН водных суспензий люминофоров серии 159,1-159,3(2) состава ZnS:Cu,Cl
Таблица 7. – Результаты изучения кислотно-основных свойств люминофоров ZnS:Cu,Cl, синтез+закалка в жидком азоте.
|
|
Данные для кинетического варианта метода рН-метрии
|
|
Образец
|
pH 5"
|
pH 20"
|
pH 20'
|
pHиис
|
|
159-1 (б. отжига)
|
6,00
|
6,40
|
7,40
|
7,40
|
|
159-2 (термический отжиг)
|
6,00
|
6,00
|
6,80
|
6,90
|
|
159-3.1 (отжиг электронами, 10Мрад)
|
6,50
|
6,60
|
7,35
|
7,35
|
|
159-3.2 (отжиг электронами, 20Мрад)
|
6,10
|
6,20
|
7,40
|
7,40
|
Таблица 8. Экспериментальные данные по рН-метрии для люминофоров состава ZnS:Cu,Cl, серия 159
|
t,min
|
рН
|
|
|
159-1
|
159-2
|
159-3,1
|
159-3,2
|
|
0
|
6,05
|
6,00
|
6,45
|
6,11
|
|
0,08
|
6,03
|
6,00
|
6,48
|
6,12
|
|
0,17
|
6,04
|
6,03
|
6,53
|
6,14
|
|
0,25
|
6,20
|
6,04
|
6,54
|
6,15
|
|
0,33
|
6,39
|
6,04
|
6,58
|
6,18
|
|
0,42
|
6,52
|
6,05
|
6,60
|
6,20
|
|
0,50
|
6,66
|
6,06
|
6,60
|
6,25
|
|
0,58
|
6,79
|
6,07
|
6,64
|
6,42
|
|
0,67
|
6,88
|
6,07
|
6,68
|
6,56
|
|
0,75
|
6,95
|
6,08
|
6,74
|
6,68
|
|
0,83
|
7,01
|
6,09
|
6,80
|
6,77
|
|
0,92
|
7,05
|
6,09
|
6,84
|
6,86
|
|
1,00
|
7,17
|
6,09
|
6,91
|
6,90
|
|
1,25
|
7,24
|
6,10
|
7,02
|
7,04
|
|
1,50
|
7,30
|
6,11
|
7,09
|
7,12
|
|
1,75
|
7,35
|
6,11
|
7,14
|
7,17
|
|
2,00
|
7,40
|
6,12
|
7,17
|
7,20
|
|
2,50
|
7,43
|
6,19
|
7,21
|
7,26
|
|
3,00
|
7,44
|
6,23
|
7,24
|
7,31
|
|
3,50
|
7,45
|
6,27
|
7,27
|
7,34
|
|
4,00
|
7,44
|
6,40
|
7,28
|
7,36
|
|
6,00
|
7,43
|
6,50
|
7,32
|
7,40
|
|
8,00
|
7,43
|
6,57
|
7,34
|
7,39
|
|
10,00
|
7,42
|
6,61
|
7,35
|
7,39
|
|
12,00
|
7,42
|
6,67
|
7,35
|
7,38
|
|
14,00
|
7,42
|
6,70
|
7,35
|
7,37
|
|
16,00
|
7,42
|
6,73
|
7,35
|
7,37
|
|
18,00
|
7,42
|
6,77
|
7,35
|
7,37
|
|
20,00
|
7,42
|
6,82
|
7,35
|
7,37
|
|
25,00
|
7,42
|
6,87
|
7,35
|
7,37
|
|
30,00
|
7,42
|
6,92
|
7,35
|
7,37
|
|
40,00
|
7,42
|
6,92
|
7,35
|
7,37
|
|
50,00
|
7,42
|
6,92
|
7,35
|
7,37
|
|
60,00
|
7,42
|
6,92
|
7,35
|
7,37
|
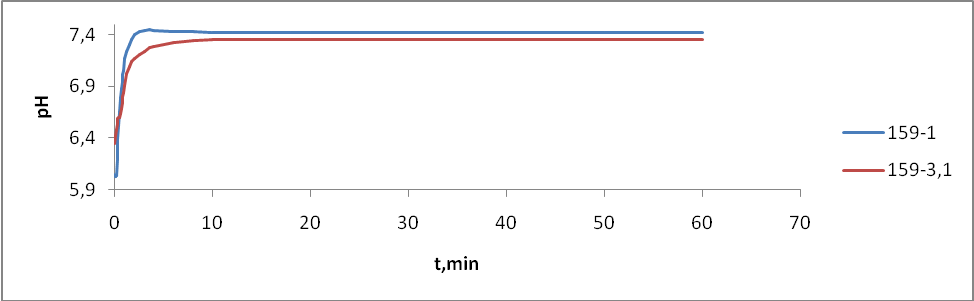
Рисунок 16. Изменения рН водных суспензий люминофоров серии 159 состава ZnS:Cu,Cl (без отжига, доза 10 мРад)

Рисунок 17. Изменения рН водных суспензий люминофоров серии 159 состава ZnS:Cu, (температурный отжиг, доза 20 мРад)
Кинетические кривые порошков электролюминофоров представленные на рисунке 15 практически совпадают, за исключением образца люминофора 159-2. Обладают плавным контуром с небольшим изменением кислотности суспензии и стабилизацией ее через 20-30 минут а области рН 6.8-7.4. Величина навески не оказывает влияния на положение кривой по шкале рН. На характер начальной ветви кинетической кривой (первые минуты контакта образца ЭЛФ с водой) оказывает влияние рНН2О, однако величина рНрра по прежнему близка к области нейтральных значений, хотя в более кислой воде состояние равновесия достигается несколько медленнее. Для ЭЛФ переменного тока характерно: существенное различие, нестабильность и высокая интенсивность полос в области низких значений рКа.
Для люминофоров состава ZnS:Cu,Cl 159(1)-159(3).2, минимум на кривых (рисунок 16,17) в первые секунды соприкосновения с водой и дальнейшее поднятие кривых со значительной скоростью указывает на наличие центров Льюиса и Бренстеда. Характер изменения кислотных свойств отражает активное участие поверхности образца в обменных сорбционных процессах в системе люминофор-вода. Полученные зависимости показывают, что исходное кислотно-основное состояние поверхности электролюминофора имеет слабокислотный (159-3.1) или основный характер: рНиис в зависимости от содержания меди изменяется в пределах 5.9-7.5.. При этом основность поверхности возрастает в ряду 159-3(1)< 159-2 < 159-3(2)< 159-1.
Исследование кислотно-основных свойств выявило, что способ обработки оказывает влияние на характер поверхности исследуемых веществ. Так, из таблиц 7,8 видно, что наиболее основным является образец люминофора без отжига.
Из представленных рисунков и таблиц для исследуемых люминофоров мы наблюдаем нейтральное или слабо основное состояние поверхности.
Потенциометрический метод
Таблица 9 Экспериментальные данные по рН-метрии для люминофоров состава ZnS:Cu,Cl, серия 159
|
159-1
|
159-2
|
159-3(1)
|
159-3(2)
|
|
рН0
|
рН
|
рН равн
|
рН0
|
рН
|
рН равн
|
рН0
|
рН
|
рН равн
|
рН0
|
рН
|
рН равн
|
|
4,1
|
-2,83
|
6,93
|
4,1
|
-2,69
|
6,79
|
4,1
|
-2,8
|
6,9
|
4,1
|
-2,87
|
6,97
|
|
5,26
|
-1,87
|
7,13
|
5,26
|
-1,77
|
6,9
|
5,27
|
-1,75
|
7,02
|
5,27
|
-1,69
|
6,96
|
|
6,1
|
-1,04
|
7,14
|
6,1
|
-0,88
|
6,98
|
6,1
|
-0,9
|
7
|
6,1
|
-0,88
|
6,98
|
|
9,1
|
1,47
|
7,66
|
9,1
|
1,82
|
7,28
|
9,1
|
1,78
|
7,31
|
9,1
|
1,81
|
7,32
|
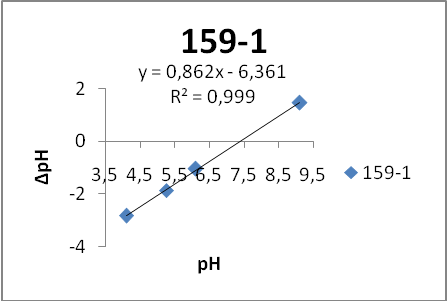
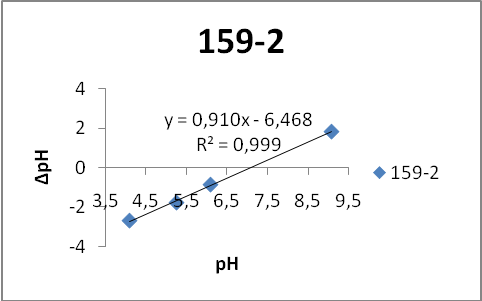

 м
м
Рисунок 18. Зависимость рН от рН0 для сульфидов цинка, активированных медью, серия 159
Для оценки концентрации кислотно-основных центров и дифференциации их по силе на поверхности был использован метод адсорбции индикаторов Гаммета
На рисунках 21 и 22 в координатах qpKa =f (рKа) и в таблице 9 представлены спектры распределения центров адсорбции (РЦА) на поверхности цинксульфидных люминофоров (различающихся количеством отмывок).
Серия 158 ZnS:Cu,Cl.
Таблица 9 Результаты исследования кислотно-основных свойств образцов 158(1)-158(4) индикаторным методом.
|
№
|
Название индикатора
|
pKa
|
qpKa
|
|
|
|
|
158-1
|
158-2
|
158-3
|
158-4
|
|
1
|
о-нитроанилин
|
-0,29
|
18,96
|
1,69
|
19,80
|
4,21
|
|
2
|
крист. фиолетовый
|
0,80
|
0,25
|
0,15
|
3,93
|
1,83
|
|
3
|
брилл. зеленый
|
1,30
|
3,96
|
7,56
|
7,34
|
2,14
|
|
4
|
фуксин (осн.)
|
2,10
|
10,80
|
0,39
|
6,88
|
1,16
|
|
5
|
м-нитроанилин
|
2,60
|
19,19
|
3,49
|
5,23
|
24,42
|
|
6
|
метил. оранжевый
|
3,46
|
5,81
|
9,40
|
44,23
|
9,68
|
|
7
|
бромфеноловый синий
|
4,10
|
7,38
|
5,26
|
1,95
|
4,92
|
|
8
|
метиловый красный
|
5,06
|
1,61
|
4,29
|
9,11
|
12,86
|
|
9
|
бромкрезоловый пурпурный
|
6,40
|
18,11
|
17,32
|
2,09
|
3,66
|
|
10
|
п-нитрофенол
|
7,15
|
0,74
|
17,46
|
11,07
|
0,38
|
|
11
|
бромтимоловый синий
|
7,30
|
15,69
|
2,85
|
7,34
|
0
|
|
12
|
феноловый красный
|
8,00
|
1,48
|
9,60
|
10,78
|
2,95
|
|
13
|
тимоловый синий
|
8,80
|
0,13
|
2,27
|
0,63
|
5,79
|
|
14
|
нильский голубой
|
10,50
|
14,72
|
6,12
|
6,12
|
5,89
|
|
15
|
индигокармин
|
12,80
|
2,07
|
1,15
|
2,76
|
46,93
|
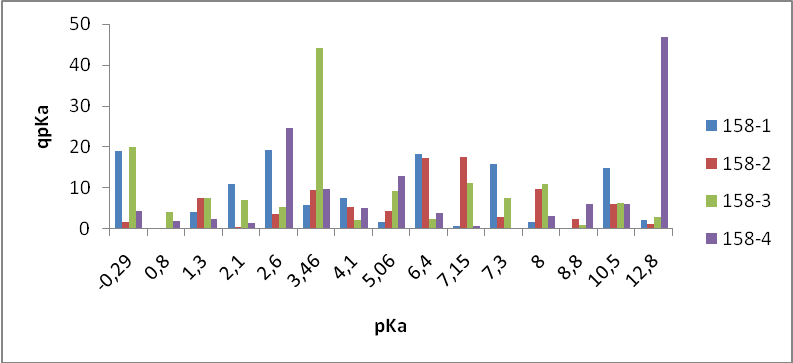
Рисунок 19 Спектры распределения центров адсорбции на поверхности образцов 158(1)-158(4).
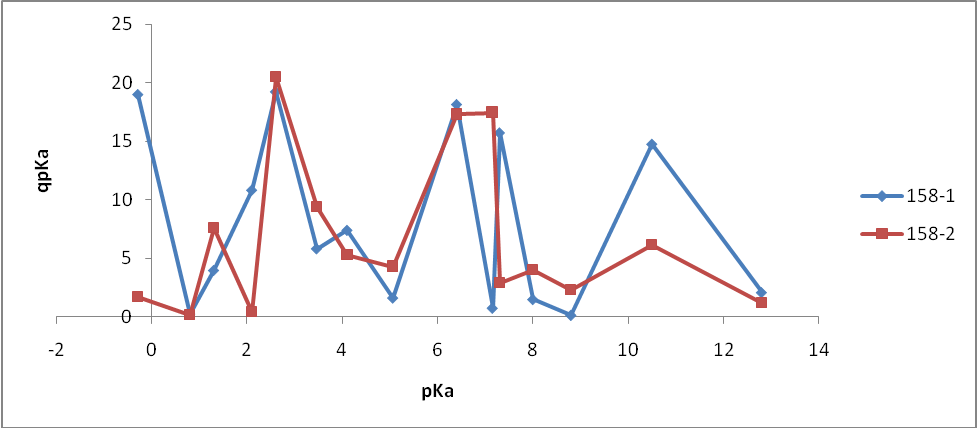
Рисунок 20 спектры РЦА образцов, различающихся количеством отмывок (без отмывки, отмывка 1 раз)
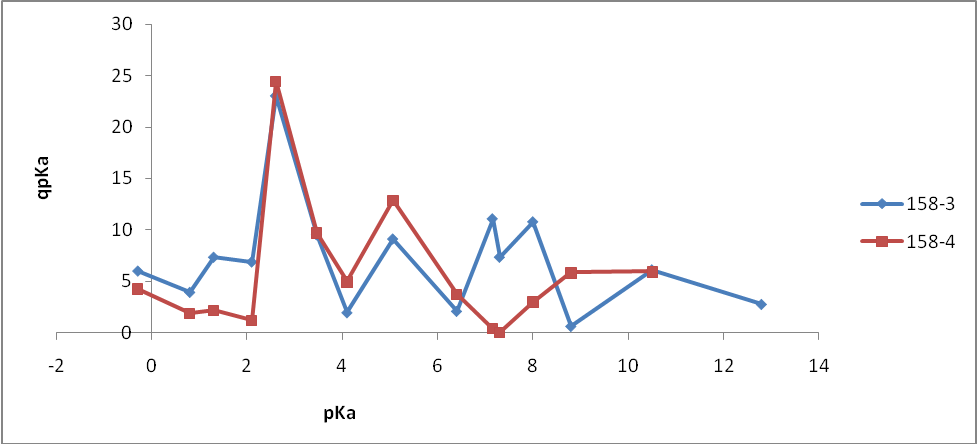
Рисунок 21 спектры РЦА образцов, различающихся количеством отмывок (отмывка 2 раза, отмывка 4 раза)
Из рисунка 20 видно что на поверхности образца ЭЛФ 158-1 наблюдаются бренстедовские основные центры с рКа 10.5, также льюисовские основные с рКа -0.29, бренстедовские кислотные с рКа 2.5. В спектрах РЦА полученных образцов преобладают центры в области льюисовских оснований (рКа -0.29), бренстедовских оснований (рКа 10.5). Увеличение количества отмывок (рисунок 21) приводит к значительному уменьшению содержания этих центров, что сопровождается соответствующим повышением яркости электролюминесценции. Так как центры с рКа 10.5 лежат в области бренстедовских оснований и их количество уменьшается, одновременно с уменьшением вакансий серы Vs*, скорее всего эти центры являются ОН-группами, связанными с поверхностными атомами цинка Zn-OH.
Главной особенностью ЭЛФ является присутствие включений фазы CuxS как в объеме частиц, так и на их поверхности, что должно отражаться на составе донорно-акцепторных поверхностных центров. Также видно, что на поверхности образцов преобладают центры с рКа 2.5…5.0 в области бренстедовских кислотных центров. Увеличение количества отмывок приводит к увеличению количества центров с рКа 5 и 2.5, что сопровождается уменьшением количества центров с рКа 10.5.
Серия 159 ZnS:Cu,Cl.
Таблица 10 Результаты исследования кислотно-основных свойств образцов 159(1)-159-3(2) индикаторным методом
|
№
|
Название индикатора
|
pKa
|
qpKa
|
|
|
|
|
159-1
|
159-2
|
159-3.1
|
159-3.2
|
|
1
|
о-нитроанилин
|
-0,29
|
8,01
|
9,69
|
1,26
|
1,69
|
|
2
|
крист. фиолетовый
|
0,80
|
2,40
|
3,86
|
3.00
|
3,11
|
|
3
|
брилл. зеленый
|
1,30
|
3,34
|
2,73
|
4,30
|
4,96
|
|
4
|
фуксин (осн.)
|
2,10
|
6,58
|
6,02
|
5,34
|
3,40
|
|
5
|
м-нитроанилин
|
2,60
|
6,98
|
13,95
|
26,16
|
17,44
|
|
6
|
метил. оранжевый
|
3,46
|
0,83
|
7,74
|
12,99
|
7,05
|
|
7
|
бромфеноловый синий
|
4,10
|
6,11
|
10,05
|
3,99
|
1,65
|
|
8
|
метиловый красный
|
5,06
|
5,89
|
4,29
|
2,68
|
10,18
|
|
9
|
бромкрезоловый пурпурный
|
6,40
|
13,67
|
9,53
|
7,15
|
12,55
|
|
10
|
п-нитрофенол
|
7,15
|
6,89
|
14,02
|
11,31
|
18,93
|
|
11
|
бромтимоловый синий
|
7,30
|
6,93
|
40,08
|
6,92
|
2,04
|
|
12
|
феноловый красный
|
8.00
|
0,59
|
0,15
|
6,94
|
0,74
|
|
13
|
тимоловый синий
|
8,80
|
10,57
|
0,13
|
3,15
|
0,13
|
|
14
|
нильский голубой
|
10,5
|
25,03
|
11,54
|
11,47
|
13,02
|
|
15
|
индигокармин
|
12,8
|
5,52
|
13,11
|
4,14
|
15,41
|
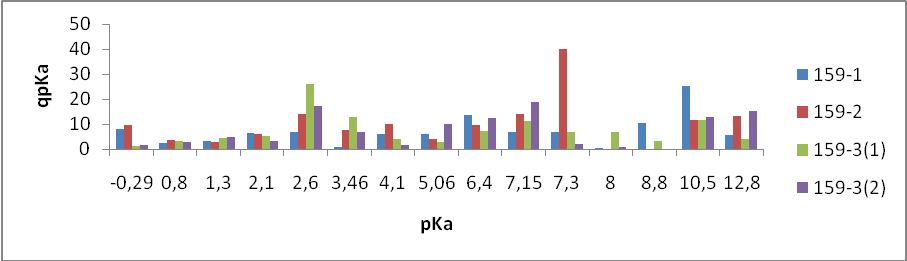
Рисунок 22. Спектры распределения центров адсорбции на поверхности образцов 159(1)-159-3(2).
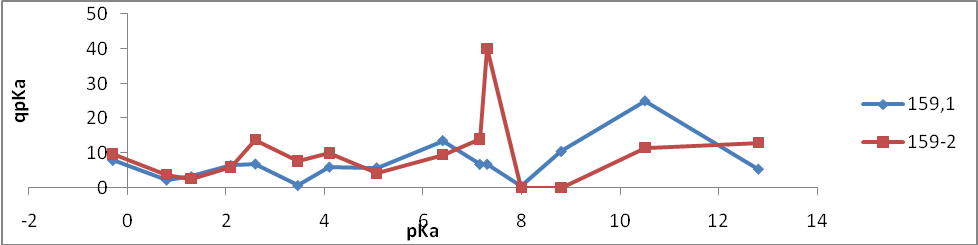
Рисунок 23 спектры РЦА образцов, различающихся способом отжига (без отжига, температурный отжиг)
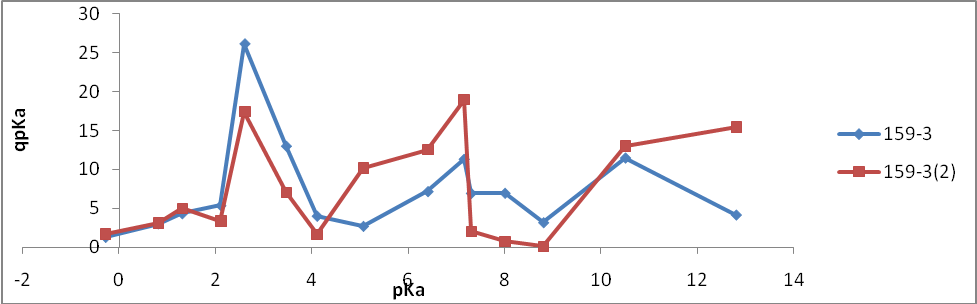
Рисунок 24 спектры РЦА образцов, различающихся способом отжига (доза 10 мРад, доза 20 мРад)
Как видно из рисунка 23, в спектрах РЦА полученных образцов цинк-сульфидных ЭЛФ преобладают центры в области бренстедовских оснований (рКа 10.5), а также кислот Бренстеда (рКа 2.5). Использование температурного отжига приводит к небольшому росту бренстедовских кислотных центров и к значительному увеличению бренстедовских основных центров, что в свою очередь приводит к уменьшению яркости электролюминесценции. Центры с рКа 10.8 лежат в области б.о. и их количество уменьшается с уменьшением содержания вакансий серы Vs, вероятно эти центры представляют собой ОН-группы, связанные с поверхностными атомами цинка Zn-OH. Причиной разброса значений рКа центров Zn-OH в области бренстедовских оснований, вероятно, может быть различие в кристаллическом окружении атомов цинка на поверхности кристаллов ЭЛФ.
На рисунке 24 представлены спектры РЦА ZnS:Cu, различающихся дозой радиационного отжига электронами. Видно, что на поверхности образцов этих ЭЛФ преобладают центры с рКа 2.5 и 10.5. Присутствуют также центры с рКа 7.0. С увеличением дозы радиационного отжига, количество центров с рКа 2.5 уменьшается, а с рКа 10.5 (область бренстедовских оснований) увеличивается. Содержание активных центров адсорбции на поверхности ЭЛФ состава ZnS:Cu видно, что радиационный отжиг приводит к увеличению содержания бренстедовских кислотных центров, относительно образца без отжига CuxS-H в области рКа 2.5…5.0, относящихся к поверхностной фазе сульфида меди. Это связано с перераспределением фазы CuxS вглубь кристаллов. Одновременно с этим, количество бренстедовских основных центров Zn-OH в области рКа 10.5, содержание которых связано с наличием в частицах люминофора вакансий серы Vs*, уменьшается. Можно предположить, что в результате облучения люминофора и распада твердого раствора ZnS:Cu, атомы меди находятся в твердом растворе в узлах цинка, переходит в фазу сульфида меди.
- Фотолюминесценция образцов люминофоров ZnS:Cu,Cl
Спектры возбуждения записывали на длинах волн, равных максимуму испускания (=612 нм). Для образцов 158-2, 158-3, 158-4 по характеру спектры возбуждения совпадают. На рисунке 25 приведены спектры возбуждения образцов люминофоров серии 158 (различающихся количеством отмывок).
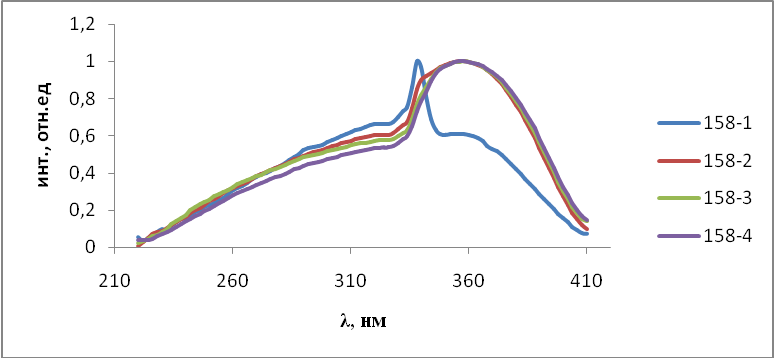
Рисунок 25 Нормированные спектры возбуждения люминофоров серии 158
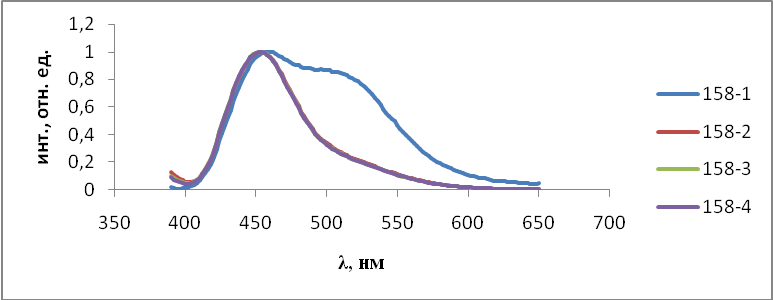
Рисунок 26 Нормированные спектры излучения люминофоров серии 158 от длины волны возбуждения
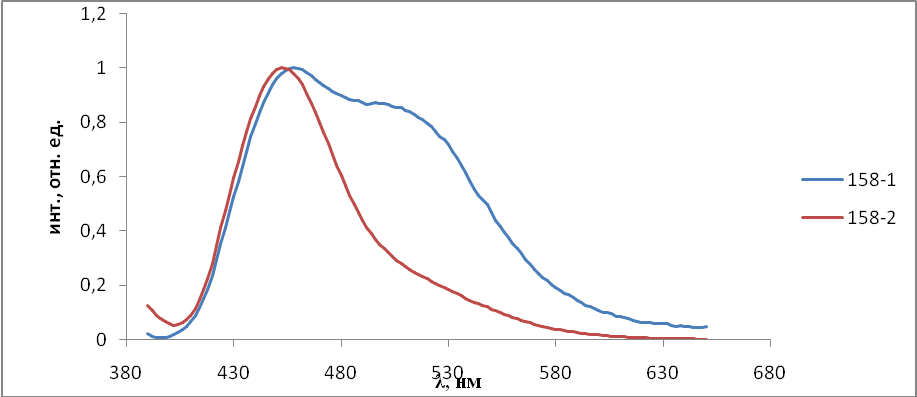
Рисунок 27 Спектры возбуждения ZnS:Cu,Cl с различным количеством отмывок (158-1 без отмывки, 158-2 отмывка 1 раз).
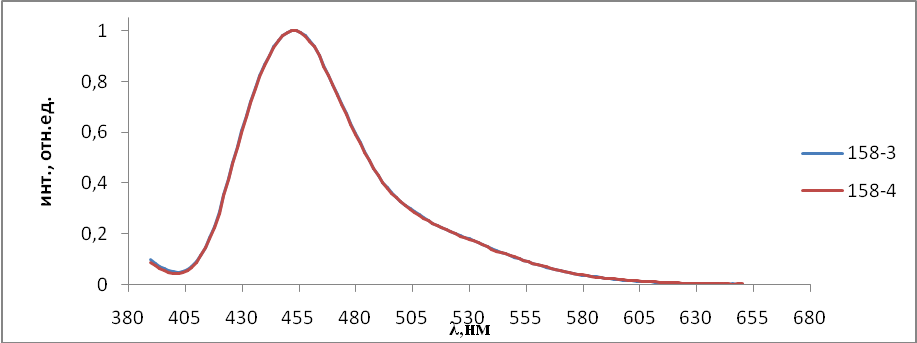
Рисунок 28 Спектры возбуждения ZnS:Cu,Cl с различным количеством отмывок (158-3 отмывка 2 раза, 158-4 отмывка 4 раза)
На рисунках 27,28 в качестве примера приведены спектры возбуждения люминофоров ZnS:Cu,Cl серии 158 с разным количеством отмывок. Спектры возбуждения записывали на длинах волн, равных максимуму испускания. Видно, что по характеру спектры совпадают, однако максимум полосы возбуждения для ZnS, который не подвергался отмывке, сдвинут в длинноволновую область на 10 нм по сравнению с люминофорами состава ZnS:Cu,Cl (мак ZnS Cu,Cl =455 нм и ZnS Cu,Cl без отмывки = 465 нм). Возбуждение коротковолновым излучением (340 нм) позволяет получать более интенсивную люминесценцию, поэтому способность люминесцировать исследуемых веществ сравнивали при возбуждении длиной волны 340 нм.
Из рисунка 28 видно, что спектры люминесценции исследуемых люминофоров имеют идентичный характер не зависимо от количества отмывок. Спектр образца 158-2 (отмывка 1 раз) по положению максимума люминесценции (455 нм) совпадает со спектром 158-3 (отмывка 2 раза) и 158-4 (отмывка 4 раза). Для образца без отмывки спектр люминесценции имеет вид широкой полосы с максимумом на = 465 нм. Дальнейшее увеличение количества отмывок слабо влияет на характер спектра люминесценции, но вместе с тем увеличивает интенсивность свечения. Наличие второго максимума с Фотолюминесценция серия образцов люминофоров 159:
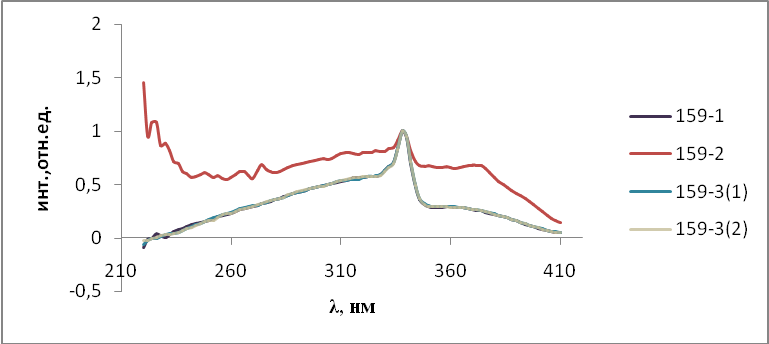
Рисунок 12.4 Спектры возбуждения люминофоров серии 159
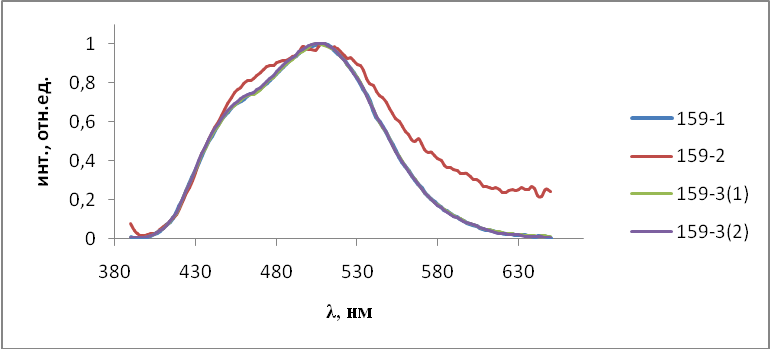
Рисунок 12.5 Спектры излучения люминофоров серии 159 от длины волны возбуждения
Сдвиг спектра фотолюминесценции образца после температурного отжига в длинноволновую область (рисунок 12.4-12.5), также видимо объясняется поглощением люминесценции (в большей степени «синей») выделившейся фазой Cu2-xS. Из рисунков 12.4-12.5 видно, что спектры люминесценции исследуемых люминофоров имеют различный характер в зависимости от вида отжига.
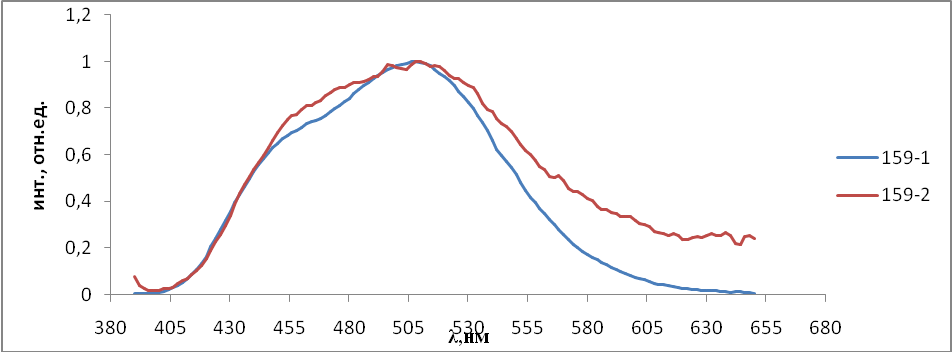

Рисунок 12.6 - Спектры возбуждения ZnS:Cu,Cl с различным типом отжига
На рисунке 12.6 приведены спектры возбуждения люминофоров ZnS:Cu,Cl с различными типами отжига. Спектры возбуждения записывали на длинах волн, равных максимуму испускания. Видно, что по характеру спектры образцов 159-1 (исходный без отжига), 159-3(1) и 159-3(2) (радиационный отжиг электронами доза 20 Мрад) совпадают, однако максимум полосы возбуждения для ZnS:Cu,Cl (159-2), подвергшегося температурному отжигу, сдвинут в длинноволновую область на 5 нм по сравнению с люминофорами состава ZnS : Cu, Cl (мак ZnS : Cu, Cl =505 нм и мак ZnS : Cu, Cl температурный отжиг = 510 нм).
Из рисунка 12.6 видно, что спектры люминесценции исследуемых люминофоров серии 159 имеют одинаковый характер не зависимо от способа отжига. Спектр образца без отжига по положению максимума люминесценции (505 нм) совпадает со спектрами образцов 159-3, с различной дозой облучения электронами. Для образца подвергшегося температурному отжигу спектр люминесценции имеет вид широкой размытой полосы с максимумом на = 510 нм. Увеличение дозы радиационного отжига фактически не влияет на характер спектра люминесценции. Следует отметить, что интенсивность люминесценции образца 159-2 сильно падает при тех же самых условиях измерения. Причиной снижения интенсивности свечения при термическом отжиге может быть связано с тушением люминесценции.
. После отмывки заметно изменился только спектр образца с температурным отжигом. У него наблюдалось значительное понижение интенсивности пиков 480 нм и 520 нм с возрастанием пика 450 нм
Вывод
- Размеры и форма кристаллов исследуемых порошков разнообразны, что является следствием различия в химической природе, кристаллохимического строения и технологий синтеза образцов.
- Методом малоуглового рассеяния нейтронов установлено, что при термическом отжиге ЭЛФ ZnS : Cu,Cl на поверхности образуется фаза оксида цинка ZnO, при этом размер приципитатов меди не меняется и составляет 22 нм. Показано, что предварительная термическая обработка сульфида цинка приводит к уменьшению интенсивности свечения синтезированного люминофора и длинноволновому смещению спектра люминесценции за счет более равномерного распределения активатора в матрице люминофора. Этот эффект достигается за счет образования фазы ZnO на стадии термического отжига. \
- ИК
- Результаты рН-метрического исследования кислотно-основных свойств электролюминофоров представлялись в виде зависимости рН водных суспензий от времени [3,4,5]. Из хода кривых рН = f(t) следует, что образцы отличаются по кислотно-основному состоянию поверхности. Полученные зависимости показывают, что исходное кислотно-основное состояние поверхности электролюминофора имеет слабокислотный, нейтральный или слабоосновный характер (6.5 – 8.0) ед. рН. Для образцов серии 159 рНиис меняется в пределах 6.9 – 7.4 а для образцов серии 158 – (6.5 – 8) ед. рН. Таким образом, наиболее заметное влияние на кислотно-основное состояние поверхности люминофоров оказывает применяемый способ отмывки люминофора от поверхностного слоя сульфида меди.
- На основании проведенных исследований влияния различных факторов на образцы цинк-сульфидных ЭЛФ может быть предложена модель активных кислотно-основных центров на поверхности данных образцов. На поверхности присутствуют центры трёх типов:
- Льюисовских основных с рКа -0.29-0
- Бренстедовских кислотных с рКа 0-7 (CuxS-H)
- Бренстедовских основных с рКа 7-14 (Zn-OH)
Количество льюисовских основных центров может характеризовать содержание вакансий цинка, а количество бренстедовских оснований вакансий серы, что позволяет оценивать совершенство кристаллической структуры ЭЛФ.
Бренстедовские основные центры с рКа 10.5…14 на поверхности цинк-сульфидных ЭЛФ имеют строение Zn-OH. Их количество характеризует содержание на поверхности ЭЛФ вакансий серы Vs. Бренстедовские кислотные центры с рКа 2.5…5.0 имеют строение CuxS-H и их количесвто может характеризовать содержание фазы сульфида меди на поверхности ЭЛФ.
- Таким образом, проведенное исследование люминофоров ZnS : Cu, Cl показало: все синтезированные вещества люминесцируют, положение максимума люминесценции не зависит от количества отмывок образца. Образцы, подверженные различным отжигам, характеризуются зеленой люминесценцией. Количество отмывок более двух раз, не оказывает заметного влияния на спектр люминесценции, однако интенсивность люминесценции имеет небольшой рост.
- Согласно литературным данным облучение цинк-сульфидных люминофоров различными видами излучений может приводить как к повышению, так и к снижению интенсивности люминесценции в зависимости от условий обработки и типа облучаемого люминофора. Можно ожидать, что при определенных условиях облучение цинк-сульфидных порошковых электролюминофоров может приводить к улучшению электрооптических характеристик. Механизм влияния облучения на изменение структуры цинк-сульфидных порошковых электролюминофоров также требует дальнейших исследований.
Список литературы
- Георгобиани А.Н. Электролюминесценция полупроводников и полупроводниковых структур // Соросовский образовательный журнал. – 2000. – Т. 6, № 3. – С. 105 – 111.
- Фок М.В. Прикладная электролюминесценция. – М.: Сов. радио, 1974. – 414 с. (5)
- 1. Фок М. В., Введеиие в кинетику люминесценции кристаллофосфоров, изд. «Наука», 1964. (23)
- 2. Верещагин И.К. Электролюминесценция кристаллов. М.: Наука. Главная редакция физико-математической литературы. 1974. 272 с.(24)
- 3. Верещагин И.К. Введение в оптоэлектронику: учебное пособие для ВТУЗов. – М.: Высшая школа, 1991. –200с.(25)
- 4. Павлов П.В., Хохлов А.Ф. Физика твердого тела. М.: Высшая школа. 2000. 494с.(26)
- . Дубина, Л.Ф. Повышение яркости свечения электролюминофоров, модифицированных редкоземельными элементами / Л.Ф. Дубина, Л.Д. Матизен, Н.П. Сощин, Э.К. Тальвисте, А.– А.А. Таммик / Сб. научн. тр. / Уч. зап.Тартуск ун-та. – Тарту. – 1976. – Вып. 379. – С. 112–119.(5)
- Казанкин О.Н. неорганические люминофоры/О.Н. Казанкин, Л.Я. Марковский, И.А. Миронов// Л: Химия – 1975. – 192 с.
- М.В. Власова, Н.Г. Каказей, А.М. Калинченко, А.С. Литовченко. Радиоспектроскопические свойства неорганических материалов (Киев, Наук. думка, 1987).
- 17. Destriau G.,Phil. Mag.,38, 700, 774,
- 18. Curie D., J. Phys. Radium, 14,
- 19. Piper W. W., Williams F. E., Brit. J. Appl. Phys., Suppl. № 4,
- 20. Zalm, Philips Res. Repts.,11,
- 21. Фок M. В., Георгобиани А. Н., УФН, 72,
- 22. Георгобиани A. Н., Труды ФИАН им. Лебедева т. 23, Изд. АН СССР, 1963.
- Электролюминесценция кристаллов. И.К. Верещагин. Монография. – М.: Наука, 1974 (1,3,3)
- Адирович Э. И., Некоторые вопросы теории люминесценции кристаллов, Гостехиздат, 1951 (1,3,4)
- Георгобиани А.Н. Электролюминесценция полупроводников и полупроводниковых структур // Соросовский образовательный журнал. – 2000. – Т. 6, № 3. – С. 105 – 111. (1,3,5)
- Фок М.В. Прикладная электролюминесценция. – М.: Сов. радио, 1974. – 414 с. (1,3,5)
- рН-метр/иономер ИТАН : руководство по эксплуатации ДПТА.25.0030.00 методика проверки ДПТА.25.0035.00 руководство использования программного обеспечения ТА-ион
- Танабе К. Твердые кислоты и основания. – М.: Мир, 1973. – 184 с. (1,5,1)
- Теория и практика рН-метрического определения кислотно-основных свойств поверхности твердых тел: учебное пособие / К.В. Иконникова, Л.Ф. Иконникова, Т.С. Минакова, Ю.С. Саркисов; Национальный исследовательский Томский политехнический университет. Томск: Изд-во Томского политехнического университета, 2011. – 85 с.
- Бундель А.А., Таушканова Л.Б., Гинзбург А.А. Исследование физико-химических процессов, происходящих при синтезе цинксульфидных люминофоров // Сборник рефератов научно-исследовательских работ ГИПХ по люминофорам за 1955–56 гг. / ГИПХ. – Л., 1957. – С. 7 – 9. (1,4)
- Электролюминофоры с зеленым цветом свечения с повышенной стабильностью / Ф.М.Пекерман, В.А.Осипов, М.А.Дихтер, Л.Н.Петошина // Сборник рефератов по химии и технологии люминофоров за 1967 г. / ГИПХ. – Л., 1969. – С. 22.
- Новые разработки в области цинксульфидных электролюминофоров / О.Н.Казанкин, В.А.Осипов, М.А.Дихтер и др. // Сборник рефератов по химии и технологии люминофоров за 1968 г. / ГИПХ. – Л., 1970. – С. 18 – 19.
- Ковалев Б.А., Данилов В.П., Тенякова Н.А. Современное состояние и перспективы разработок стабильных электролюминофоров на основе соединений A2B6: Обзор. инф. Сер. «Люминофоры и особо чистые вещества» / НИИТЭХИМ. – М., 1979. – 31 с.
- Черепин В.Т., Васильев М.А. Методы и приборы для анализа поверхности материалов. – Киев: Наукова думка, 1982. – 400 с.
- Верещагин И.К., Косяченко Л.А., Ковалев А.Б., Кокин С.М. Электролюминесцентные источники света / Под ред. Верещагина И.К. – М.: Энергоатомиздат, 1990. – 168 с.
- Бахметьев В.В., Сычев М.М., Корсаков В.Г. Модель активных кислотно-основных центров на поверхности цинк-сульфидных электролюминофоров // Журнал прикладной химии. - 2010. - Т. 83. № 11. - С. 1170-1177.
- Минакова Т.С. Адсорбционные процессы на поверхности твердых тел: Учебное пособие. – Томск: Изд-во Том. ун-та, 2007. – 284 с
- Бачериков Ю.Ю. Структурные превращения в ZnS : Cu в процессе термического отжига/ Ю.Ю. Бачериков, Н.Е. Корсунская, В.П. Кладько, Е.Ф. Венгер, Н.П. Баран, А.В. Кучук, А.Г. Жук// Институт физики полупроводников им. В.Е. Лашкарева Национальной академии наук Украины, 03028 Киев, Украина
- M. Warkentin, F. Bridges, S. A. Carter, and M. Anderson. Electroluminescence materials ZnS:Cu,Cl and ZnS:Cu,Mn,Cl studied by EXAFS spectroscopy// Physics Department, University of California, Santa Cruz, California 95064, USA
- This model would also describe the case in which CuCl nanocrystals form. Both ZnS and CuCl have a zinc-blende structure with lattice constants differing by less than 1%, and S and Cl are comparable scatterers.
- М.М. Сычев, К.А. Огурцов, В.Т. Лебедев, Ю.В. Кульвелис , Gy. Torok +, А.Е. Соколов, В.А. Трунов , В.В. Бахметьев, А.А. Котомин, С.А. Душенок, А.С. Козлов/ Влияние концентрации меди и обработки ZnS на характеристики синтезированных электролюминофоров ZnS:Cu,Cl// Санкт-Петербургский государственный технологический институт (Технический университет), 190013 Санкт-Петербург, Россия Петербургский институт ядерной физики им. Б.П. Константинова, 188300 Гатчина, Ленинградская обл., Россия
- Y.Y. Chena, J.G. Duh, B.S. Chiou, C.G. Peng: Luminescent mechanisms of ZnS:Cu:Cl and ZnS:Cu:Al phosphors. // aDepartment of Materials Science and Engineering, National Tsing Hua Uni_ersity, 101, Sec. 2 Kuang Fu Road, Hsinchu 30043, Taiwan
- (40) Минакова Т.С., Екимова И.А.:Фториды и оксиды щелочноземельных металлов и магния. Поверхностные свойства.// Томск: Издательский дом Томского государственного университета, 2014. – 148 с.
1
4
3
2
Анод
Катод
Eg
З.П.
В.З.
Область перехода
n-область
p-область
1,0…1,3 эВ
0,95…1,25 эВ
0,95 эВ
3,8 эВ
310-5см
eU
1
2
EF
0,2…0,25 эВ
ZnS:Cu
CuXS
Cu
«–»
«+»
а)
б)
З.П.
В.З.
Люминофоры на основе сульфида цинка