Оптическая активность кислых аминокислот
Содержание
Введение...................................................................................................................3
1. Структура и свойства кислых аминокислот.....................................................5
1.1. Вещества...........................................................................................................5
1.2. Органические вещества...................................................................................5
1.3. Функциональные производные углеводородов.............................................6
1.4. Аминокислоты..................................................................................................7
1.5. Глутаминовая кислота......................................................................................9
1.6 Биологические свойства..................................................................................11
2.Оптическая активность кислых аминокислот.................................................12
2.1 Хиральная молекула........................................................................................13
2.2 Характеристика оптического вращения.......................................................15
2.3 Измерение оптического вращения.................................................................17
2.4 Известные данные об оптическом вращении кислых аминокислот...........18
Заключение.............................................................................................................21
Литература.............................................................................................................22
Введение
Открытие аминокислоты, обычно связывают с тремя открытиями:
В 1806 г. открыто первое аминокислотное производное — амид аспарагин.
В 1810 г. открыта первая аминокислота — цистин, которая была выделена из объекта небелковой природы — мочевых камней.
В 1820 г. аминокислота глицин впервые выделена из белкового гидролизата и более или менее тщательно очищена [1].
Но вот открытие глутаминовой кислоты произошло довольно тихо. Немецкий химик Генрих Риттхаузен в 1866 году выделил ее из растительного белка, в частности из клейковины пшеницы. По традиции название новому веществу дал его источник: das Gluten в переводе с немецкого – клейковина.
Возможный путь получения глутаминовой кислоты, применяемый в Европе и США - гидролиз белков, например той же клейковины, из которой это вещество впервые было получено. Обычно использовали пшеничную или кукурузную клейковину, в СССР - свекловичную мелассу. Технология достаточно проста: сырье очищают от углеводов, гидролизуют 20%-ной соляной кислотой, нейтрализуют, отделяют гуминовые вещества, концентрируют и осаждают прочие аминокислоты. Оставшуюся в растворе глутаминовую кислоту снова концентрируют и кристаллизуют. В зависимости от назначения, пищевого или медицинского, проводят дополнительную очистку и перекристаллизацию. Выход глутаминовой кислоты при этом – около 5% от веса клейковины, или 6% от веса непосредственно белка.
Целью настоящей работы является изучения оптической активности кислых аминокислот.
Для реализации данной цели поставлены задачи:
1. Изучить свойства, строение и биологическое значение кислых аминокислот, на примере глутаминовой кислоты и подготовить обзор литературы.
2. Изучить оптическую активность в аминокислотах и подготовить обзор литературы по их исследованию.
Глава 1. Структура и свойства кислых аминокислот
Для изучения аминокислот , необходимо изучить основные свойства, строение и применение, поэтому в настоящей главе мы рассмотрим основные типы функциональных производных углеродов и рассмотрим глутаминовую кислоту.
1.1. Вещества
Все вещества делятся на простые (элементарные) и сложные. Простые вещества состоят из одного элемента, в состав сложных входит два или более элементов.
Простые вещества, в свою очередь, разделяются на металлы и неметаллы или металлоиды. Сложные вещества делят на органические и неорганические: органическими принято называть соединения углерода, все остальные вещества называются неорганическими (иногда минеральными) [2].
Неорганические вещества разделяются на классы либо по составу (двухэлементные, или бинарные, соединения и многоэлементные соединения; кислородсодержащие, азотсодержащие и т. д.), либо по химическим свойствам, т. е. по функциям (кислотно-основным, окислительно-восстановительным и т. д.), которые эти вещества осуществляют в химических реакциях, — по их функциональным признакам. Далее будут рассмотрены органические вещества, так как в них входят аминокислоты.
1.2. Органические вещества
Органические вещества - класс соединений, в состав которых входит углерод (за исключением карбидов, угольной кислоты, карбонатов, оксидов углерода и цианидов) [3].
Органические соединения обычно построены из цепочек атомов углерода, связанных между собой ковалентными связями, и различных заместителей, присоединенных к этим углеродным атомам. Для систематизации и для того, чтобы органические вещества было удобно называть, их делят на классы в соответствии с тем, какие характеристические группы имеются в молекулах. На углеводороды и функциональные производные углеводородов. Соединения, состоящие только из углерода и водорода, называются углеводородами.
Углеводороды могут быть алифатическими, алициклическими и ароматическими[4].
1)Ароматические углеводороды иначе называют аренами.
2)Алифатические углеводороды в свою очередь подразделяются на несколько более узких классов, важнейшими из которых являются:
- алканы (атомы углерода соединены между собой только простыми ковалентными связями);
- алкены(содержат двойную углерод-углеродную связь);
- алкины(содержат тройную связь, например ацетилен).
3) Циклические углеводороды — углеводороды с замкнутой углеродной цепью. В свою очередь делятся:
-карбоциклические ( цикл состоит только из атомов углерода)
- гетероциклические ( цикл состоит из атомов углерода и других элементов)
1.3. Функциональные производные углеводородов
Так же существуют производные углеводородов. Это соединений, состоящих из атомов углерода и водорода. Скелет углеводородов построен из атомов углерода, соединенных ковалентными связями; остальные связи атомов углерода используются для связывания их с атомами водорода. Скелеты углеводородов очень устойчивы, поскольку электронные пары в одинарных и двойных углерод-углеродных связях в равной мере принадлежат обоим соседним атомам углерода [5] .
Один или более атомов водорода в углеводородах могут быть замещены различными функциональными группами. При этом образуются различные семейства органических соединений.
К типичным семействам органических соединений с характерными функциональными группами относятся спирты, в молекулах которых имеется одна или несколько гидроксильных групп, амины и аминокислоты, содержащие аминогруппы; кетоны, содержащие карбонильные группы и кислоты с карбоксильными группами.
Многие физические и химические свойства производных углеводородов больше зависят от какой-либо группы, присоединенной к основной углеводородной цепи, чем от самой этой цепи.
Так как целью моей курсовой является изучение аминокислот, остановимся на ней.
1.4. Аминокислоты
Аминокислотами называются соединения содержащие одновременно амино- и карбоксильную группу [6]:
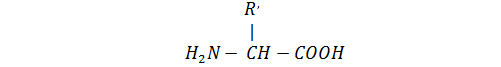
Обычно аминокислоты растворимы в воде и нерастворимы в органических растворителя. В нейтральных водных растворах аминокислоты существуют в виде биполярных ионов и ведут себя как амфотерные соединения, т.е. проявляются свойства и кислот, и оснований.
В природе существует свыше 150 аминокислот, но только около 20 важнейших аминокислот служат мономерами для построения белковых молекул. Порядок включения аминокислот в белки определяется генетическим кодом.
По классификации, каждая аминокислота содержит как минимум одну кислотную и одну основную группы. Аминокислоты отличаются друг от друга химической природой радикала R, представляющего группу атомов в молекуле аминокислоты, связанную с -углеродным атомом и не участвующую в образовании пептидной связи при синтезе белка. Почти все -амино- и -карбоксильные группы участвуют в образовании пептидных связей белковой молекулы, теряя при этом свои специфические для свободных аминокислот кислотно-основные свойства. Поэтому все разнообразие особенностей структуры и функции белковых молекул связано с химической природой и физико-химическими свойствами радикалов аминокислот [7] .
По химической структуре группы R аминокислоты подразделяются на:
1)алифатические (глицин, аланин, валин, лейцин, изолейцин);
2)гидроксилсодержащие (серин, треонин);
3) серусодержащие ( цистеин, метионин);
4) ароматические (фенилаланин, тирозин ,тритрофан);
5) кислые и амиды (аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин);
6) основные (аргинин, гистидин, лизин);
7) иминокислоты (пролин).
По полярности R-группы:
1) Полярные (глицин, серин, треонин, цистеин, тирозин, аспарагиновая кислота, глутаминовая кислота, аспарагин, глутамин, аргинин, лизин, гистидин);
2) Неполярные (аланин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан, пролин).
По ионным свойствам R-группы:
1) Кислые (аспарагиновая кислота, глутаминовая кислота, цистеин, тирозин);
2) Основные (аргинин, лизин, гистидин);
3) Нейтральные (глицин, аланин, валин, лейцин, изолейцин, метионин, фенилаланин, серин, треонин, аспарагин, глутамин, пролин, триптофан).
По питательной ценности:
1) Заменимые (треонин, метионин, валин, лейцин, изолейцин, фенилаланин, триптофан, лизин, аргинин, гистидин);
2) Незаменимые (глицин, аланин, серин, цистеин, пролин, аспарагиновая кислота, глутаминовая кислота, аспарагин, глутамин, тирозин).
Рассмотрим более подробно свойства глутаминовой кислоты.
1.5. Глутаминовая кислота
Глутаминовая кислота — одна из самых распространенных в составе белков, более того, среди оставшихся 19 белковых аминокислот есть и ее производное глутамин, который отличается от нее лишь дополнительной аминогруппой.
Глутаминовую кислоту иногда называют еще и глютаминовой, реже — альфа-аминоглутаровой. Совсем редко, хотя и химически правильно —
2-аминопентандиовой.
Глутаминовая кислота также является нейромедиаторной аминокислотой, одним из важных представителей класса « возбуждающих аминокислот» [8] .
Структура представлена на рис.1.
Рис.1 Структурная формула глутаминовой кислоты
Физико-химические свойства
Вещество, в чистом виде представляющее собой непримечательные бесцветные кристаллы, плохо растворимые в воде. Полярность гидроксилсодержащих аминокислот обусловлена наличием в них большого дипольного момента и способностью ОН-групп образовывать водородные связи, поэтому глутаминовая кислота мало растворима в холодной воде, растворима в горячей воде. Так на 100 г воды при 25°С предельная растворимость составляет 0,89 г, а при температуре 75°С - 5,24 г. Практически нерастворима в спирте [9].
Глутаминовая кислота и её анион глутаминат в живых организмах встречается в свободном виде, а так же в ряде низкомолекулярных веществ. В организме декарбоксилируется до аминомасляной кислоты, а через цикл трикарбоновых кислот превращается в янтарную кислоту.
Типичная алифатическая -аминокислота. При нагревании образует 2-пирролидон-5-карбоновую, или пироглутаминовую, кислоту, с Си и Zn-нерастворимые соли. В образовании пептидных связей участвует главным образом -карбоксильная группа, в некоторых случаях, например у природные трипептида глутатиона,-аминогруппа. В синтезе пептидов из L-изомера наряду с -NН2-группой защищают -карбоксильную группу, для чего ее этерифицируют бензиловым спиртом или получают трет-бутиловый эфир действием изобутилена в присутствии кислот [10].
Химический состав глутаминовой кислоты представлен в таблице 1 [11] .
|
Таблица 1. Химический состав глутаминовой кислоты
Символ
Элемент
Атомный вес, г/моль
Число атомов
Процентное
содержание
массы
С
Углерод
12,011
5
40,8 %
Н
Водород
1,008
9
6,2 %
N
Азот
14,007
1
9,5%
О
Кислород
15,999
4
43,5%
|
1.6 Биологические свойства
Глутаминовая кислота находит применение при лечении заболеваний ЦНС шизофрения, психозы (соматогенные, интоксикационные, инволюционные), реактивные состояния, протекающие с явлениями истощения, депрессия, последствия менингита и энцефалита, токсическая нейропатия на фоне применения гидразидов изоникотиновой кислоты (в сочетании с тиамином и пиридоксином), печеночная кома. В педиатрии — задержка психического развития, церебральный паралич, последствия внутричерепной родовой травмы, болезнь Дауна, полиомиелит (острый и восстановительный периоды). Ее натриевая соль используется как вкусовая и консервирующая добавка в пищевые продукты [12] .
Имеет ряд противопоказаний, таких как гиперчувствительность, лихорадка, печеночная и/или почечная недостаточность, нефротический синдром, язвенная болезнь желудка и двенадцатиперстной кишки, заболевания кроветворных органов, анемия, лейкопения, повышенная возбудимость, бурно протекающие психотические реакции, ожирение. Повышенная возбудимость, бессонница, боль в животе, тошнота, рвота - так отражаются побочные действия при лечении. Может вызвать диарею, аллергическую реакцию, озноб, кратковременную гипертермию; анемию, лейкопению, раздражение слизистой полости рта.
Глава 2.Оптическая активность кислых аминокислот
Для того чтобы выполнить поставленную задачу, необходимо подробно рассмотреть оптическую активность.
Свет - это электромагнитное излучение, которое воспринимается человеческим глазом. Можно разделить на естественный и поляризованный. В естественном свете колебания направлены в различных направлениях, быстро и беспорядочно сменят друг друга (рис.2.а). А свет, в котором направления колебаний будут каким-то образом упорядочены или в одной плоскости называется поляризованным(рис.2.б).
При прохождении поляризованного света через некоторые вещества происходит интересное явление: плоскость, в которой расположены линии колеблющегося электрического поля, постепенно поворачивается вокруг оси, вдоль которой идет луч.
Плоскость, проходящая через направление колебаний светового вектора плоскополяризованной волны и направление распространения этой волны, называется плоскость поляризации.
Среди органических соединений встречаются вещества, способные вращать плоскость поляризации света. Это явление называют оптической активностью, а соответствующие вещества - оптически активными.
Оптически активные вещества встречаются в виде пар оптических
антиподов - изомеров, физические и химические свойства которых в основном в обычных условиях одинаковы, за исключением одного - направления вращения плоскости поляризации [13] .
2.1 Хиральная молекула
Все аминокислоты, за исключение глицина, оптически активные, благодаря хиральному строению [14] .
Молекула, показанная на рис.3, 1-бром-1-иодэтан, имеет тетраэдрический атом углерода, соединенный с четырьмя различными заместителями. Поэтому молекула не имеет никаких элементов симметрии. Такие молекулы называются асимметрическими или хиральными [15].
Глутаминовая кислота имеет аксиальную хиральность. Она возникает в результате неплоского расположения заместителей относительно некоторой оси — оси хиральности. Ось хиральности существует в несимметрично замещённых алленах. sp-Гибридный атом углерода в аллене имеет две взаимно перпендикулярные p-орбитали. Их перекрывание с p-орбиталями соседних атомов углерода приводит к тому, что заместители в аллене лежат во взаимно перпендикулярных плоскостях. Подобная ситуация наблюдается также в замещённых бифенилах, в которых вращение вокруг связи, соединяющей ароматические кольца, затруднено, а также в спироциклических соединениях.
Если пропускать плоскополяризованный свет через раствор хирального вещества, плоскость, в которой происходят колебания, начинает вращаться. Вещества, которые вызывают такое вращение, называются оптически активными. Угол вращения измеряют прибором, который называется поляриметр (рис.4). Способность какого-либо вещества вращать плоскость поляризации света характеризуют удельным вращением.
|
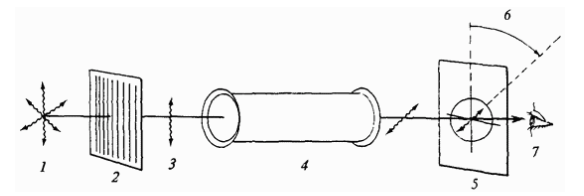
Рис.4.
Принципиальная схема поляриметра: 1 — источник света; 2 — поляризатор; 3 — плоскополяризованный свет; 4 — трубка с раствором оптически активного вещества; 5 — измеритель угла вращения; 6 — угол вращения;
7 — наблюдатель
|
Посмотрим, как связана оптическая активность с молекулярным строением вещества. Ниже приведено пространственное изображение хиральной молекулы и ее зеркального отражения(Рис.5).
|
Рис. 5
Зеркальная плоскость
|
На первый взгляд может показаться, что это одна и та же молекула, изображенная по-разному. Однако, если собрать модели обеих форм и попытаетесь совместить их так, чтобы все атомы совпали друг с другом, можно быстро убедиться, что это невозможно, т.е. оказывается, что молекула несовместима со своим зеркальным отражением.
Таким образом, две хиральные молекулы, относящиеся друг к другу как предмет и его зеркальное изображение, не тождественны. Эти молекулы (вещества) являются изомерами, получившими название энантиомеров. Энантиомерные формы, или оптически антиподы, имеют различные показатели преломления (круговое двулучепреломление) и различные коэффициенты молярно экстинкции (круговой дихроизм) для лево- и право- циркулярно поляризованных компонент линейно-поляризованного света [14, с.40].
2.2 Характеристика оптического вращения
Оптическим вращением называют способность вещества, отклонять плоскость поляризации при прохождении через него плоскополяризованного света.
Оптическое вращение возникает вследствие неодинакового преломления света с левой и правой круговой поляризацией. Вращение плоскополяризованного светового луча возникает вследствие того, что асимметричные молекулы среды имеют различные показатели преломления, и , для света с левой и правой круговой поляризацией [16].
Если плоскость поляризации вращается вправо (по часовой стрелке) от наблюдателя, соединение называют - правовращающим, а удельное вращение записывают со знаком плюс. При вращении влево (против часовой стрелки) соединение называют левовращающим, а удельное вращение записывают со знаком минус.
Величину отклонения плоскости поляризации от начального положения, выраженную в угловых градусах, называют углом вращения и обозначают .
Величина угла зависит от природы оптически активного вещества, толщины слоя вещества, температуры и длины волны света. Величина угла вращения прямо пропорциональна толщине слоя. Для сравнительной оценки способности различных веществ вращать плоскость поляризации вычисляют так называемое удельное вращение. Удельным вращением называют вращение плоскости поляризации, вызванное слоем вещества толщиной 1 дм при пересчете на содержание 1 г вещества в 1 мл объема.
Для жидких веществ удельное вращение определяют по формуле:
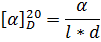
Для растворов веществ:
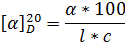
(где - измеренный угол вращения в градусах; l - толщина слоя жидкости, дм; с - концентрация раствора, выраженная в граммах на 100 мл раствора; d - плотность жидкости)
Величина удельного вращения зависит также от природы кислой аминокислоты и её концентрации. Во многих случаях удельное вращение постоянно лишь в определенном интервале концентраций. В интервале концентраций, при которых удельное вращение постоянно, можно по углу вращения рассчитать концентрацию:
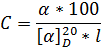
Ряд оптически активных веществ изменяет угол вращения до определяемой постоянной величины. Это объясняется наличием смеси стереоизомерных форм, имеющих различные значения угла вращения. Только через некоторое время устанавливается равновесие. Свойство в течение некоторого времени изменять величину угла вращения называется мутаротацией.
Определение угла вращения плоскости поляризации проводят в приборах, как было сказано выше, так называемыми поляриметрами (рис.4).
2.3 Измерение оптического вращения
Определение угла вращения плоскости поляризации проводят в приборах, называемых поляриметрами. Правила пользования данной моделью поляриметра изложены в инструкции к прибору. Определение, как правило, проводят для D - линии натрия при 20 С.
Общий принцип устройства и работы поляриметров заключается в следующем. Луч от источника света направляется через желтый светофильтр в призму-поляризатор. Проходя через призму Николя, луч света поляризуется, колебания его совершаются только в одной плоскости. Плоскополяризованный свет пропускают через кювету с раствором оптически активного вещества. При этом отклонение плоскости поляризации света определяют с помощью второй, вращающейся, призмы Николя (анализатора), которая жестко связана с градуированной шкалой. Наблюдаемое через окуляр значительное поле, разделенное на две или три части различной яркости, следует сделать равномерно освещенным, поворачивая анализатор. Величину поворота считывают со шкалы. Для проверки нулевой точки прибора проводят аналогичные измерения без исследуемого раствора. Направление плоскости поляризации, как правило, устанавливают направлением поворота анализатора. Конструкция отечественных поляриметров такова, что если для получения однородного' освещенного поля зрения приходится повернуть анализатор вправо, т. е. по часовой стрелке, то исследуемое вещество было правовращающим, что обозначается знаком + (плюс) или d. При повороте анализатора против часовой стрелки получаем левое вращение, обозначаемое знаком - (минус) или I.
В других приборах точное направление вращения определяют при помощи повторного измерения, которое проводят либо с половинной толщиной слоя жидкости либо с половинной концентрацией. Если при этом получают угол вращения или , то можно считать, что вещество является правовращающим. Если новый угол вращения равен 90 - или 180 -, то вещество обладает левым вращением. Удельное вращение не очень сильно зависит от температуры, однако для точных измерений термостатирование кюветы необходимо. При данных по оптическому вращению необходимо указывать применяемый растворитель и концентрацию вещества в растворе, например []о = 27,3 в воде (С=0,15 г/мл) [17] .
Поляриметрические определения применяют как для установления количественного содержания оптически активных веществ в растворах, так и для проверки их чистоты.
2.4 Известные данные об оптическом вращении кислых аминокислот
На основании общего правила, что соединения с одинаковой конфигурацией обнаруживают одинаковые изменения вращения при одинаковых воздействиях, был создан и ряд более конкретных правил, касающихся отдельных групп соединений. Одно из этих правил относится к аминокислотам и оно гласит, что оптическое вращение всех природных аминокислот (L-ряда) в кислых растворах сдвигается вправо. Напомним еще раз: это правило не следует понимать так, что обязательно происходит рост правого вращения: «сдвиг вправо» может означать и уменьшение левого вращения. Данные о вращениях некоторых аминокислот в кислых растворах приведены ниже в таб. 2 [18] .
|
Таблица2. Вращение аминокислот
Аминокислота
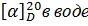
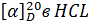
Глутаминовая кислота
+9,9°
+30,8°
Валин
+6,4°
+28,7°
Лейцин
-10,3°
+ 15,6°
Аспарагиновая кислота
+4,3°
+25,7°
|
В исследовании оптического вращения было установлено, что при переходе молекулы из газовой фазы в раствор, длины волн переходов существенно изменяются (в среднем ~ 5 нм), а в исследуемых растворах различаются не значительно ( ~ 0.5 нм). Показано, что с уменьшением изменения дипольного момента молекул изомеров в растворах уменьшается смещение длин волн основного электронного перехода, а с ростом поляризуемостей увеличивается. Рассчитаны вращательные силы переходов молекул изомеров в различных растворах. Показано, что значения вращательных сил переходов сильно изменяется при переходе от изолированной молекулы к раствору. Построены спектральные зависимости удельного вращения плоскости поляризации в различных растворах. Так же в диапазоне 100-300 нм наблюдаются резонансы при совпадении длин волн переходов с длинами волн излучения. Удельное вращение плоскости поляризации излучения в растворах L - изомера уменьшается с ростом длины волны от ~ 50 град*м2/кг при 240 нм до 1 град*м /кг при 650 нм, а в растворах D изомера от ~ 5 град*м2/кг при 360 нм и до ~ 2 град*м2/кг при 650 нм. Подтверждено, что угол поворота линейно возрастает с ростом концентрации растворов. Показано, что с ростом поляризуемостей молекул растворителей, величины удельного вращения плоскости поляризации возрастают, а с увеличением изменения поляризуемостей молекул в растворах обоих изомеров уменьшаются [19].
В исследование оптического вращения L и DL изомеров глутаминовой кислоты было показано, что в диапазоне от 4000 до 5000 угол поворота плоскости поляризации некогерентного излучения максимален при длине волны 4280 и уменьшается с ростом длины волны излучения. Так же, что угол поворота плоскости поляризации лазерного излучения увеличивается до -5° при концентрации 1,6% для излучения с длинной волны А, = 650 нм и до -9° для X = 532 нм при той же концентрации. Найдено, что оптическая активность максимальна в нейтральном (pH = 7) растворе глутаминовой кислоты и уменьшается с увеличением кислотности и щелочности растворов. Продемонстрировано отсутствие вращательной способности у водных растворов рацемической формы глутаминовой кислоты [20].
Заключение
В ходе выполнения работы был подготовлен обзор литературы, посвящённый свойствам кислых аминокислот, по механизмам и характеристикам оптического вращения глутаминовой кислоты.
Таким образом, цель поставленной курсовой работы достигнута полностью.
Литература
1. Интернет ресурс. URL: http://redreferat.ru/Otkritie-aminokislot-art2411.html
2. Глинка Н.Л. Общая химия. 24-е изд. - Л. Химия, 1985. 37 с.
3. Хомченко Г. П. Пособие по химии для поступающих в вузы. 2002. 57 с.
4. Фримантл М. Химия в действии. В 2-х ч. Ч. 1: Пер. с англ. — М.: Мир, 1998 . 311 с.
5. Ленинджер А. Основы биохимии: В 3-х т. Т. 1. Мир, 62 с.
6. В. Г. Жиряков. Органическая химия. — 6-е изд., стереотипное. — М. Химия 194 c.
7. Шендрик А.Н. Химия белка. Структура, свойства, методы исследования 22 c.
8. Молони М. Г. Возбуждающие аминокислоты. Отчеты продукции. 2002. 99 с.
9. Химия и токсикология. Базы данных. Базы данных свойств веществ.
URL: http://chemister.ru/Database/properties.php?dbid=1&id=1841
10. Кнунянц И.Л. Химическая энциклопедия г.р. Том 1. 163с.
11. Е.А. Вялых, С.А. Иларионов, А.В. Жданова. «Исследование аминокислотного состава» Опубликовано в журнале «Вода: химия и экология» № 2 за 2012 год, стр. 76-82.
12. Фармакологический справочник «Регистр лекарственных средств России® РЛС®»
13. Фримантл М. Химия в действии. В 2-х ч. Ч. 2: Пер. с англ. — М. Мир.
350 с.
14. Х.-Д. Якубке, Х. Ешкайт. Аминокислоты, Пептиды, Белки. Москва "Мир" 1985. 23 с.
15. Вайзман Ф. Л. Основы органической химии: Учебное пособие для вузов: Пер. с англ. / Под ред. А. А. Потехина. - СПб: Химия 103 с.
16. Выдержка из книги Хьюи Д.N. «Неорганическая химия» 202 c.
17. Пассет Б. В., Антипов М. А. - Практикум по техническому анализу и контролю в производстве химико-фармацевтических препаратов и антибиотиков. 54 с.
18. Потапов В.М. Стереохимия 1976год 211с.
19. Носаченко В.С. Магистерская диссертация «Численное исследование оптического вращения растворов изомеров глутаминовой кислоты» Волгоград 2013. 39 с.
20. Аспидова М.А. Дипломная работа «Экспериментальное исследование спектральных характеристик оптического вращения водных растворов глутаминовой кислоты» Волгоград 2013.
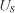
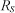
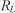
Оптическая активность кислых аминокислот