ГИДРОБИОЛОГИЧЕСКИЕ МЕТОДЫ РЫБОХОЗЯЙСТВЕННЫХ ИССЛЕДОВАНИЙ
ГИДРОБИОЛОГИЧЕСКИЕ МЕТОДЫ РЫБОХОЗЯЙСТВЕННЫХ ИССЛЕДОВАНИЙ
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
1. Гидробиологические методы изучения структуры водных сообществ
2. Методы изучения фитопланктона
2.1. Выбор станции исследования и горизонты отбора проб
2.2.Место отбора и орудие лова
2.3. Методы сгущения и консервации фитопланктона
2.4. Методы обработки фитопланктона
2.4.1. Количественные методы. Методы подсчета водорослей
2.4.2. Методы вычисления биомассы
3. Методы изучения зоопланктона
3.1 Методы сбора зоопланктона
3.1.1. Орудия для сбора зоопланктона
3.1.1.1. Орудия для качественного сбора зоопланктона
3.1.1.2. Орудия для количественного сбора зоопланктона и методы работы с ними
3.1.2. Консервация и этикетирование планктонных проб
3.1.3. Место и периодичность сбора проб
3.2. Методы обработки зоопланктона
3.2.1. Качественная обработка проб
3.2.2. Количественная обработка проб
4. Методы изучения макрозообентоса
4.1. Методы отбора проб
4.1.1. Фауна грунта
4.1.2. Фауна камней
4.1.3. Использование искусственно помещенных в воду субстратов для отлова бентосных беспозвоночных
4.2. Фиксирование и хранение проб бентоса
4.3. Разборка бентосных проб, расчет численности и биомассы
5. Методы изучения перифитона
5.1 Методика отбора проб перифитона с естественных субстратов
5.2 Методика отбора проб перифитона с помощью искусственных субстратов
5.3. Этикетирование проб
5.4. Обработка проб
6. Методы определения первичной продукции и деструкции органического вещества
6.1. Скляночный метод измерения первичной продукции и деструкции
6.1.1. Общие положения
6.1.2. Продукционные склянки
6.1.3. Техника экспонирования склянок
6.1.4. Время экспозиции
6.1.5. Выбор горизонтов экспонирования
6.2. Кислородная модификация скляночного методы
6.2.1. Приготовление реактивов
6.2.2. Подготовка к отбору проб
6.2.3. Отбор, экспонирование и фиксация проб
6.2.4. Титрование проб и расчет содержания кислорода в пробе
6.2.5. Определение поправочного коэффициента нормальности Na2S2O3
6.2.6. Расчет первичной продукции
6.3. Радиоуглеродная модификация скляночного метода
6.3.1. Приготовление раствора изотопа
6.3.2. Добавление изотопа в продукционные склянки, экспонирование, фиксация
6.3.3. Фильтрование проб, обработка и хранение фильтров
6.4. Определение общего содержания углекислоты в воде
6.4.1. Титириметрический метод определения общего содержания углекислоты в воде
6.4.2. Определение общего содержания углерода в воде по pH, температуре и карбонатной щелочи
6.5 Расчет первичной продукции
6.6. Расчет первичной продукции за день и под 1 м2 водной поверхности
6.7. Сравнение результатов кислородного и радиоуглеродного методов
6.8 Хлорофилльный метод определения первичной продукции и биомассы фитопланктона
6.8.1. Расчет первичной продукции
6.8.2. Расчет биомассы фитопланктона
7. Оценка качества воды
7.1. Метод Пантле и Букка для оценки качества вод по фитопланктону
7.2. Оценка качества воды по показателям зоопланктона.
ЗАКЛЮЧЕНИЕ
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
ПРИЛОЖЕНИЯ
ВВЕДЕНИЕ
Вода – основная среда обитания многочисленных систематических групп фауны и флоры земли.
К основным гидробиологическим методам относятся учет количества (концентрации) различных групп гидробионтов в пределах своего местообитания, оценка функциональной роли этих групп в экосистемах и моделирование экосистем с целью прогноза их состояния и управления ими. Данные о количестве тех или иных организмов необходимы для суммарной оценки и их роли в различных экосистемных процессах. Из задач гидробиологии, прежде всего можно назвать ту, которая связана с повышением биологической продуктивности водоемов, получением из них наибольшего количества биологического сырья.
Гидробиологические методы применяют для изучения распределения ихтиофауны. Рыбы отдают предпочтение определенным кормовым объектам, поэтому их распределение зависит в первую очередь от места обитания объектов их питания. Так например, планктофаги держатся в толще воды, где наибольшая концентрация планктона (сельдь, ряпушка, сайка), они плавают с открытым ртом и планктон поступает в их жаберную полость вместе с водой, где отфильтровывается многочисленными жаберными тычинками; бентофаги – обитают в придонных слоях воды (бычки, стерлядь, вобла), имеют выдвижной рот, который позволяет им находить в грунте донных беспозвоночных.
Водная растительность является не только кормом, но так же это убежище для водных обитателей, а для некоторых видов рыб наоборот, служат для засады. К примеру – щука и судак маскируются при помощи густых зарослей рдеста или элодеи, поджидая зазевавшегося карпа, а мальки карпа и другие мирные обитатели водоемов пытаются укрыться в тени камыша или тростника. Многие виды растений являются местом для нереста рыб, укрытием отложенной икры от хищников [1]. При цветении водорослей содержание кислорода в воде падает до нуля, в результате чего возникают локальные заморы рыбы, поэтому применение методики определения первичной продукции позволяет определить количество кислорода в водоеме и своевременно устранить цветение. Наиболее часто, чтобы избежать подобных явлений в водоемы запускают рыб питающихся фитопланктоном.
Целью данной работы является изучение гидробиологических методик и основных направлений применения гидробиологических данных в рыбохозяйственных исследованиях, в связи с этим были поставлены следующие задачи:
- Ознакомиться с методиками сбора и обработки планктонных проб,
- Ознакомится с методиками сбора и обработки бентосных проб,
- Ознакомится с методиками сбора и обработки проб перифитона,
- Ознакомится с методиками определения первичной продукции.
1. История гидробиологических исследований
Первые более или менее систематические исследования водных обитателей относятся к XVII-XIX вв., в России они связаны, в частности, с именами П.С. Палласа и К.Ф. Рулье. В основном эти работы имели натуралистический (описание отдельных водоемов или животных) или фаунистический (поиск и описание новых видов) характер. Наиболее зрелые и интересные работы этого периода относятся уже к XX веку; это, в частности «Животные сообщества умеренной зоны Северной Америки» ( Шелфорд, 1913) и «Очерки из жизни пресноводных животных» ( Павловский, Лепнева, 1948). В первой из этих работ Виктор Шелфорд, один из крупных американских экологов, автор известного в общей экологии «принципа толерантности») на основе своих наблюдений дал описание и первую (и весьма удачную) классификацию всех основных типов природных сообществ умеренного пояса (в том числе пресноводных). Можно сказать, что вся экология пресноводных и наземных сообществ с тех пор уточняет и дополняет описания Шелфорда. Для отечественных водоемов сходные описания даны В.И. Жадиным в монографии «Жизнь пресных вод СССР» (1940-1959). Вторая из упомянутых выше работ (Павловский, Лепнева, 1948) – классическая монография с описанием образа жизни наиболее массовых и интересных водных организмов (из тех, которые доступны прямому наблюдению в аквариуме). В настоящее время натуралистический подход мало распространен среди профессионалов, хотя возможности его далеко не исчерпаны.
Современный этап развития гидробиологии связан с внедрением в нее количественных исследований, при которых выявляется абсолютное и относительное обилие организмов в сообществах. При этом многократно увеличивается разрешающая способность описания и сравнения разных сообществ гидробионтов, а также появляется возможность изучать продуктивность экосистем и другие проблемы, связанные с изменением обилия организмов. Помимо сбора и анализа количественных данных, примерно с середины XX века гидробиология взяла на вооружение обширный арсенал физико-химических методов анализа, статистический аппарат обработки данных и методы математического моделирования [2].
2. Методы изучения фитопланктона
Микроскопические организмы, свободно парящие в толще воды и осуществляющие фотосинтез, объединяются термином фитопланктон. Фитопланктон является одним из важнейших элементов водных экосистем, участвующих в формировании качества вод.
Ассоциации реофильного планктона представлены главным образом диатомовыми и зелеными протококковыми водорослями. В составе лимнофильных комплексов наиболее массовыми, вызывающими «цветение» водоемов, являются цианобактерии.
Индикаторные свойства фитопланктона определяются не только фактом нахождения или отсутствия определенных видов, но и степенью их количественного развития.
2.1. Выбор станции исследования и горизонты отбора проб
Станция контроля за состоянием растительного планктона должны быть приурочены к станциям проведения гидрохимического контроля, поскольку комплекс гидрохимических показателей характеризует: а) условия существования гидробионтов, б) степень загрязнения водоема по основным типам загрязнителей. Местоположение станций должно быть обосновано интересами контроля за санитарно – эпидемиологическим состоянием водоема.
При работе на водохранилищах, озерах, глубоководных прудах отбор проб проводят по специально разработанной гидрологической сетке. На каждой станции отбирают батометром серию проб с пропуском по глубине в 1м до глубины утроенной прозрачности, измеренной по белому диску. При прозрачности 3 м пробы отбираются до глубины 10 м, при прозрачности 5 м – до 15 м и т. д. Поскольку в реках вертикальное распределение фитопланктона относительно равномерное, отбор проб обычно производят с горизонта 0,2 – 1 м батометром или простым зачерпыванием определенного объема воды.
2.2. Методы отбора и орудия лова
Наиболее надежным методом отбора проб фитопланктона считается батометрический метод. Пробы отобранные батометром, используют как для
количественного учета фитопланктона, так и для качественной характеристики пробы. Системы батометров весьма разнообразны. Описание почти всех существующих конструкций батометров приведены в монографии И. А. Киселева [3].
В системе Госкомгидромета для отбора проб воды на гидрохимический анализ обычно используют батометры типа Рутнера, которые вполне могут быть пригодны для отбора фитопланктонных проб.
Для более полного выявления флористического состава фитопланктона используют пробы, отобранные планктонной сетью ( рис.1)
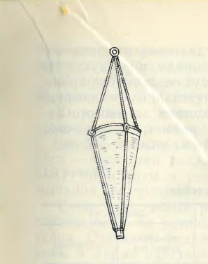
Рис.1. Качественная сеть Апштейна
Наиболее просты и удобны в изготовлении планктонные сетки конической формы. Для их изготовления лучше использовать самое мелкое ( не ниже № 70) мельничное сито из шелковой или капроновой нити.
2.3. Методы сгущения и консервация фитопланктона
Наиболее распространенными методами концентрирования фитопланктона являются седиментация и фильтрация через мелкопористые мембранные фильтры.
Сущность седиментационного метода заключается в том, что пробой воды, предназначенной для сгущения, заполняют пол- литровые бутыли и консервируют фиксатором. Через 3 – 4 дня после отстаивания в темноте воду над осевшими водорослями можно осторожно отсосать сифоном, оставив приблизительно 100 см3 пробы. За 2 – 3 дня до количественной обработки пробы разливают по мерным цилиндрам и после отстаивания в темноте их объем доводится до 5 – 10 см3. Затем они переносятся без потерь в склянки из – под пенициллина и дополнительно консервируются одной – двумя каплями 40% -ного формалина [4].
При проведении гидробиологических работ в системе Госкомгидромета рекомендуется концентрировать пробы фитопланктона методом мембранной фильтрации. Основным достоинством этого метода являются, прежде всего быстрота консервирования в экспедиционных условиях, а так же просматривать живой материал.
Фильтрация воды осуществляется под вакуумом в специальной воронке, укрепленной на колбе Бунзепа, которая соединяется с насосом Камовского.
Отечественная промышленность выпускает мембранные фильтры шести номеров, из которых для сгущения фитопланктона пригодны два: № 5 и 6 с диаметром пор 1,2 и 2 – 5 мкм.
В настоящее время в нашей стране получили распространение чешские фильтры марки «Сынпор-2» с диаметром пор 1,2 мкм. Они как нельзя лучше удовлетворяют целям количественного учета фитопланктона, так как имеют гладкую поверхность, с которой хорошо счищается осадок, а скорость фильтрации не меньше, чем у отечественных фильтров № 6 [4].
2.4. Методы обработки фитопланктона
Для видовой идентификации следует пользоваться наиболее широко применяемыми определителями. Необходимо отметить, что при проведении гидробиологического контроля за состоянием поверхностных вод суши определение качественного состава основной массы организмов фитопланктона нужно проводить до вида. Это необходимо для выявления организмов – индикаторов, развитие которых, прежде всего позволяет судить о качестве исследуемых вод.
2.4.1. Количественные методы. Методы подсчета водорослей
Для подсчета численности водорослей используют счетные камеры Нажотта, «Учинская», Горяева. Перед счетом пробу тщательно перемешивают и одну каплю вносят в камеру. Очень важно хорошо перемешать пробу, та как этим достигается равномерное распределение водорослей. Это необходимо для уменьшения ошибки выборки, обусловленной тем, что просчитывается не вся проба, а ее часть. Камеру закрывают покровным стеклом и после оседания водорослей на дно проводят определение и подсчет всех встреченных видов, кроме того, производят замеры необходимых параметров для последующего вычисления объема клеток.
В каждой пробе необходимо определить и просчитать все виды как минимум в трех камерах объемом 0,9 мм3 (Горяева) с последующим вычислением среднего арифметического. Каждую камеру следует просматривать при двух различных увеличениях – большом и малом – для учета крупных и мелких форм.
Для статистической достоверности подсчета и установления биомассы доминирующих видов необходимо, чтобы каждый из них был встречен не менее 100 раз [4]. Пересчет общей численности производится по формуле
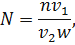
Где – число клеток в 1 см3 воды, – число клеток в камере объемом 1 мм3, – объем концентрата пробы, – объем камеры, – объем профильтрованной воды, если объем профильтрованной воды и концентрата пробы постоянны (=500 см3, = 5 см3), то формула принимает вид
.
Для достоверной оценки общей численности фитопланктона плотность его в пробе должна быть не менее 3 тыс. кл./мл. Степень концентрации исходной пробы необходимо устанавливать, принимая во внимание это условие.
2.4.2. Методы вычисления биомассы
Вычисление биомассы фитопланктона производится наиболее общепринятым в пресноводной гидробиологии методом суммирования биомасс отдельных популяция, для чего требуется установление средней массы (объема) клеток водорослей, составляющих популяции в пробе.
Определение объема отдельных клеток водорослей обычно осуществляется следующим образом. Каждую из встреченных особей измеряют, используя для этого окуляр – микрометр или специальную сеточку, вставленную в окуляр. На основании многочисленных промеров для дальнейшего вычисления биомассы, особенно доминирующих видов, получают средние значения всех необходимых параметров. Найденный для каждой клетки объем (в мкм3) умножается на ее численность, и получают значение биомассы в мг/л или г/м3 с точностью до 0,01.
3. Методы изучения зоопланктона
Состав и уровень количественного развития водных беспозвоночных организмов является высокочувствительным показателем степени загрязнения водоема и нарушения чистоты его вод.
Одним из компонентов биологического анализа водоема является изучение зоопланктонного сообщества.
Зоопланктонное сообщество, как и любое другое сообщество экосистемы, характеризуется постоянством видового состава, динамической устойчивостью, определенной, присущей ему организацией. Изменение условий сущестования организмов отражается на видовом составе, количественных показателях, соотношении отдельных таксономических групп, структуре популяции зоопланктона.
В зависимости от линейных размеров пресноводный планктон принято делить на следующие группы:
- мезопланктон – крупные организмы, видимые невооруженным глазом, их размеры достигают нескольких миллиметров (большинство представителей подотряда Cyclopoida, крупные представители подотряда Cladocera, некоторые виды из р.р. Daphnia, Bythotrephes и др.;
- микропланктон – микроскопические организмы, их размеры от 50 до 100 мкм (Mesocyclops oithonoides, науплиальные стадии отряда Copepoda, многие представители подотряда Cladocera.
- наннопланктон – организмы, длина тела которых меньше 50 мкм ( мелкие формы класса Rotatoria
- ультрапланктон – крайне мелкие организмы, их размеры менее 20 мкм.
3.1. Методы сбора зоопланктона
3.1.1. Орудия для сбора зоопланктона
Все разнообразие методов сбора зоопланктона сводится к двум вариантам:
- методы , представляющие комбинацию раздельного водозачерпывания и одновременного отделения планктона от воды в самой воде, что осуществляется с помощью планктонных сетей, планктоночерпателей;
- методы, представляющие комбинацию раздельного водозачерпывания и последующего отделения планктона от воды, что осуществляется или с помощью фильтрации доставленной на поверхность воды через сетку, или посредством отстаивания [5].
Метод отбора проб зависит от типа водоема, его глубины, размеров. В крупных и средних водоемах с замедленным водообменном (озерах, водохранилищах) пробы зоопланктона отбирают количественной сетью Джеди фракционно, в мелководных водоемах (прудах, малых лесных озерах, лагунах), глубина которых не превышает 3 – 4 м, - так же качественной сетью Джеди, тотально.
В водотоках, главным образом реках для сбора качественных проб используется цилиндрическая сеть Лангганса («Цеппелин»), а количественных – батометр Жуковского [6]. Наиболее простым и доступным способом, не требующим сложного оборудования, является способ отбора проб путем процеживания 50 – 100 л воды, взятой ведром или другим сосудом, через качественную сеть Апштейна.
3.1.1.1. Орудия для качественного сбора зоопланктона
Классическим орудием сбора зоопланктона является коническая планктонная сеть (сеть Апштейна), состоящая из шелкового или капронового конуса, широким основанием нашитая на металлическое кольцо, а в узком основании имеющая стаканчик, в котором концентрируется собираемый планктон.
Для изготовления планктонной сети употребляется мельничное, шелковое или капроновое сито или газ, отличающиеся большой прочностью и равномерностью распределения нитей. Номер сита соответствует числу ячей в 1 см2 ткани. Наиболее частый газ № 77, наиболее редкий № 7. Для улавливания микропланктона применяется газ № 64 – 77, для улавливания мезопланктона - № 38 – 64. Нанно- и ультрапланктон планктонной сетью не улавливаются.
При изготовлении сетного конуса необходимо:
- шелковое или капроновое сито перед шитьем смочить губкой и слегка прогладить негорячим утюгом;
- плотный хлопчатобумажный или льняной материал перед шитьем вымочить, высушить и прогладить;
- веревки предварительно намочить и высушить в натянутом виде.
Для планктонных сетей применяются металлические и стеклянные стаканчики разной конструкции. Особенно удобны металлические стаканчики с краном (рис.2). Их размеры: высота 40 мм, диаметр 28 мм, для средней модели сети соответственно 80 и 55 мм. Вместо крана на стаканчике может быть патрубок, на который насаживается резиновая трубка соответствующего диаметра, запирающаяся зажимом Мора. Такой стаканчик наиболее удобен для работы в зимний период. Когда поворот крана затруднен в связи с низкими температурами воды и воздуха. Не менее удобен металлический стаканчик с глухим дном без крана, состоящий из двух половин – короткой верхней и более длинной нижней, соединенных друг с другом посредством штыкового затвора или винтовой нарезки. Внутренний диаметр стаканчика 3,5 см. Высота верхней части стаканчика 3 см, нижней – 7 см.
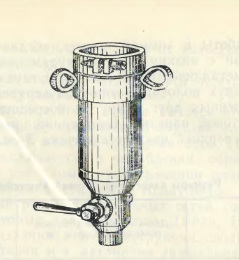
Рис. 2. Металлический стакан с краном для планктонных сеток [7].
Таблица 1
Размеры качественных сетей Апштейна
|
Модель
|
Длина образующей боковой поверхности конуса, см
|
Диаметр, см
|
|
|
|
Входного отверстия
|
стаканчика
|
|
Малая
|
55
|
25
|
3,5 – 4,0
|
|
Средняя
|
100
|
40
|
6
|
Качественные ловы зоопланктона производят с целью выявления его видового состава. Установление видового состава зоопланктона следует проводить в течение вегетационного периода, когда основная масса организмов присутствует в планктоне и активно размножается.
Качественными сетями работают с лодки, плота, судна. Их опускают в воду по возможности вертикально вручную или с помощью лебедки. Маленкие планктонные сети можно забрасывать с берега, не допуская зачерпывания ими грунта.
Для сбора планктона в реке или при движении судна на озерах и водохранилищах рекомендуется цилиндрическая сеть Лангганса («Цеппелин»), состоящая из двух, сшитых из шелка или капрона цилиндров и одного шелкового или капронового конуса с планктонным стаканчиком на конце. Сеть с помощью кусков полотна нашивается на три металлических кольца. К переднему кольцу привязывается уздечка с кольцом для крепления к тросу (рис 3). Сеть может быть разных размеров (табл.2)
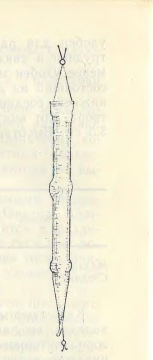
Рис. 3. Цилиндрическая сеть «Цеппелин».
Таблица 2
Размеры моделей сетей Лангганса («Цеппелинов»)
|
Модель
|
Диаметр, см
|
Длина, см
|
|
|
входного отверстия
|
стаканчика
|
цилиндрического отдела сети
|
конического отдела сети
|
всей сети
|
|
Большая
|
22
|
6,5
|
98
|
50
|
148
|
|
Средняя
|
15
|
4,5
|
97
|
42
|
138
|
|
Малая
|
9,5
|
4,5
|
96
|
23
|
120
|
3.1.1.2. Орудия для количественного сбора зоопланктона и методы работы с ними
Количественные сети требуют более тщательного изготовления. Они отличаются от качественных следующими особенностями конструкции:
- присутствием в переднем отделе сети конуса – надставки из плотного хлопчатобумажного материала;
- в связи с наличием этого конуса имеется второе металлическое кольцо, к которому пришивается верхний конец надставки и которое представляет входное отверстие сети. Назначение конуса – надставки заключается в ослаблении обратных (вихревых) токов воды и тем самым предохранении планктона от вымывания при протягивании сети сквозь толщу воды.
Существует целый ряд количественных сетей, самыми распространенными из которых являются сети Джеди, Нансена, Апштейна. Основные различия в их конструкции сводятся к различиям в форме надставки и в механизме замыкания сети при ловах по горизонтам. В качестве основного орудия лова мезопланктона можно рекомендовать сеть Джеди как более уловистую по сравнению с другими сетями [5].
Сеть Джеди (рис. 4) состоит из фильтрующего или капронового конуса, как и в качественной сети Апштейна, и верхнего обратного усеченного конуса из плотного белого материала. По верхнему и нижнему краю обратного конуса пришивают металлические обручи ( диаметр 0,5 – 1,0 см), к которым на равном расстоянии друг от друга из плотной ткани крепятся три боковые стропы сети. Свободные концы строп связывают петлей над входным отверстием сети. К нижнему концу фильтрующего конуса пришивается манжета, с помощью которой к сети прикрепляется стакан с краном для сливания пробы .
Замыкающая сеть Джеди, по описанию В. И. Жадина [6], приводится в рабочее положение с помощью специального замыкателя, состоящего из обоймы, внутри которой на оси свободно двигается крючок с противовесом, служащий для закрепления кольца уздечки сети (рис. 5). Через верхнюю часть обоймы пропущен винт, за который крепится спускной трос. Перед началом работы сеть вывешивается в открытом состоянии: кольцо уздечи зажато крючком замыкателя. Кран для сливания пробы на стаканчике закрыт. В таком виде сеть опускается в воду, затем поднимается до нужного горизонта, и к этому моменту по спускному тросу пускается посыльный груз, который, ударяя по головке спускного механизма, освобождает кольцо уздечки – сеть закрывается и повисает на тросе, прикрепленном к большому кольцу. Закрытая сеть поднимается на поверхность. Сети придается первоначальное положение, т. е. кольцо уздечки зажимается крючком замыкателя. Кран стакана открывается и проба, сконцентрированная в нем, переливается в подготовленную заранее чистую посуду. Затем кран стакана закрывают и сеть в расправленном виде вновь погружают в водоем до уровня входного отверстия для того, чтобы смыть со стенок сети оставшиеся организмы. Смытые со стенок остатки пробы сливают в ту же посуду. Нельзя допустить, чтобы при споласкивании сети в нее попала чрез входное отверстие новая порция воды. После облова каждого горизонта сеть споласкивают.
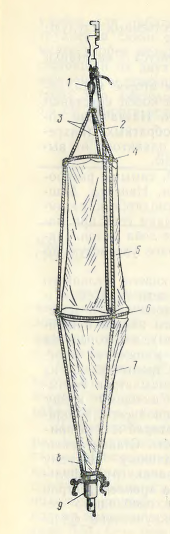
Рис. 4. Замыкающая количественная сеть Джеди
1 – петля на шнуре; 2 – шнур, связывающий сетку с замыкателем; 3 – шнуры на верхнем кольце; 4 – верхнее кольцо; 5 – матерчатый конус; 6 – нижнее кольцо; 7 – шелковая сеть; 8 – шнур, удерживающий стаканчик; 9 – стаканчик.
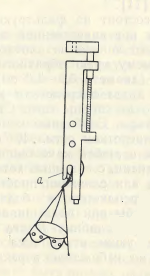
Рис. 5. Замыкатель для планктонной сети.
а – рабочий крючок замыкателя.
Для установления видового состава зоопланктона производится тотальный лов от дна до поверхности.
Сетной метод сбора зоопланктона, является комбинацией водозачерпывания и одновременного отделения планктона в самой воде.
Другим вариантом являются методы, представляющие комбинацию раздельного водозачерпывания и последующего отделения планктона от воды. Этот способ применим на малых и средних реках, а так же в прибрежной зоне любых водоемов и прежде всего в зарослях высшей водной растительности. Принцип метода заключается в следующем: сосудом определенной вместимости (литровая кружка, полиэтиленовое 5-литровое ведро) берется определенный объем воды (50 – 100 л) и выливается в планктонную качественную сеть Апштейна (газ № 64 – 77), через котрую происходит фильтрация воды. Планктон концентрируется в стаканчике. Зачерпывание следует производить быстро, не допуская перемешивания воды. Зачерпыванием вручную отбирается проба лишь с поверхности. Для взятия пробы с глубины удобны любого рода батометры, применяемые для отбора гидрохимических проб, например батометр Руттнера. Объем воды (от 50 до 100 л) с помощью батометра определенного объема (1, 2, 3 л) с нужного горизонта фильтруется через качественную сеть Апштейна.
Кроме указанного выше метода, существует отстойный метод, который обычно применяется ля выявления видового состава и количественного распределения мелких коловраток. Вода с поверхности или определенного горизонта, взятая кружкой, ведром, батометром, выливается в сосуд определенного объема, фиксируется и отстаивается 7 – 10 сут. По истечении указанного времени вода над осадком выливается с помощью сифона (резиновой трубки, затянутой снизу мельничным газом № 77). Осадок обрабатывается под микроскопом.
Отобранные различными способами пробы переливаются из стаканчика в обычные стеклянные банки, бутылки, хлорвиниловые банки (объем 100, 150, 200, 300 см3 в зависимости от размера стаканчика).
3.1.2. . Консервация и этикетирование планктонных проб
Фиксируют зоопланктонную пробу обычно 40%-ным формалином. Формалин приливают таким образом чтобы получился его 4%-ный раствор (1 часть формалина на 9 частей воды). Применяемый формалин не должен иметь осадка. Если нельзя обеспечить хранение проб в теплом месте (зимний перилд, полярные ксловия), то пробы зоопланктона фиксируют спиртом. С этой целью объем воды в пробе доводится до возможного минимума и в банку наливается 96-градусный этиловый спирт с таким расчетом, чтобы его концентрацию довести до 70°.
Каждая проба зоопланктона должна быть тщательно этикетирована и записана в специальный журнал или полевой дневник (см. приложение 1).
Этикетка пишется на пергаментной бумаге карандашом или тушью. Этикетка вкладывается под прокладку крышки. Иногда проба снабжается второй этикеткой которая опускается внутрь сосуда. На пробке банки или на ее стенке ставится номер пробы. Номер на пробе соответствует номеру, записанному в полевом дневнике.
3.1.3. Место и периодичность отбора проб
Сборы зоопланктона с целью контроля качества вод осуществляются в местах постоянных гидробиологических наблюдений и обычно приурочены к стандартным гидрохимическим створам. Выбор станции наблюдения на водном объекте зависит прежде всего от местоположения источников загрязнения (промышленные предприятия, бытовые стоки, сельскохозяйственные угодья).Необходимо установить биологический фон данного водного объекта, для чего следует выбрать ряд станций в незагрязненных участках, например выше источника загрязнения.
Наблюдениями следует охватить все биологические сезоны. Поскольку видовой состав и уровень количественного развития зоопланктона испытывают значительные сезонные колебания, при изучении влияния загрязнения на основании анализа зоопланктонного сообщества желательно производить отбор проб один раз в зимний, весенний и осенний периоды и три раза в летний.
3.2. Методы обработки зоопланктона
3.2.1. Качественная обработка проб
Задача качественной обработки зоопланктона сводится к точному определению видовой принадлежности входящих в его состав организмов. При этом рекомендуется обирать и качественные пробы – дублеры, которые не фиксируют. Живые пробы обрабатываются по возможности немедленно после сбора. Если время не позволяет сделать это, то пробы сохраняются до обработки в прохладном месте, защищенном от солнца, причем банки, где содержатся пробы, плотно не закрываются.
Непосредственно перед обработкой нефиксированной пробы ее следует сконцентрировать путем, например, центрифугирования или удаления большей части воды с помощью сифона. Далее чистой пипеткой берется капля осадка, которая переносится на предметное стекло и просматривается вначале под бинокуляром, а затем под микроскопом. При микроскопировании рекомендуется пользоваться покровным стеклом, так как накрывание им капли с планктоном отчасти замедляет движение некоторых планктеров. В живом состоянии главным образом определяются мелкие формы беспанцирных коловраток. Для замедления движения животных под покровное стекло помещают каплю наркотизирующего вещества – раствора хлоралгидрата, кокаина, хлороформа и .т. п. Приостановку движения планктеров можно достигнуть так же очень осторожным нагреванием препарата до 35 - 40°С, прибавлением вишневого клея или другого вязкого вещества.
Виды не требующие определения в живом состоянии, исследуются из фиксированных качественных проб. Из осадка сконцентрированных проб пипеткой планктон переносится на предметное стекло и обрабатывается. При обработке фиксированного материала готовят препараты в капле воды, в водном глицерине – формалине (1 часть глицерина на 1 часть формалина). Чтобы среда не подсыхала, препарат по краю покровного стекла окружают лаком. Для сохранения препарата на длительное время материал заключают в твердую среду: глицерин – желатин, канадский бальзам.
Определение организмов зоопланктона производится до вида по определителям.
3.2.2. Количественная обработка проб
Далее следует количественная обработка проб, которая заключается в подсчете количества организмов каждого вида по возможности по возрастным стадиям или размерным группам. Счетный метод довольно трудоемкий, но пока еще самый точный [8]. При других методах (объемный, весовой, химический и т. д.) получаемые оценки носят суммарный характер. При относительно «бедных» планктоном водах организмы зоопланктона подсчитываются целиком во всей пробе. Удобно использовать для этого камеру Богорова или кристаллизатор Цееба. Камера Богорова имеет вид стеклянной пластинки с желобом или с сообщающимися канавками, разделенными призматическими перегородками (рис. 6). Кристаллизатор Цееба представляет прямоугольную ванночку с бортиками. Дно ванночки с нижней стороны разграфлено параллельными линиями на полоски. Каждая полоска умещается в поле зрения бинокуляра с увеличением 48. В большинстве случаев приходится иметь дело с большим количеством организмов. Поэтому подсчет всех организмов в исследуемой пробе технически невозможен. Следует ограничится подсчетом небольшой порции планктона с последующим пересчетом на всю пробу. Пробу доводят до определенного объема (25, 50, 100 см3) в зависимости от обилия планктона. Чем чаще встречается организм в данной пробе, тем больше разбавление нужно применять для его подсчета. И. А. Киселев [9] предложил разбавлять пробу в том случае, если количество просчитываемых организмов в порции более 1000, или сгущать ее, если количество организмов менее 100. Проба зоопланктона вылавливается в мерный цилиндр. Если ее объем меньше нужного для подсчета, то пробу доливают чистой профильтрованной ( лучше дистиллированной) водой. Если требуется меньший объем, чем данная проба, то ее концентрируют. Производится это следующим образом. Пробу отстаивают до тех пор, пока практически весь планктон не осядет на дне сосуда, в течение 15 – 20 мин. Затем осторожно, чтобы не взмутить осадка, оттягивают с помощью резиновой груши излишек воды сифоном в виде стеклянной изогнутой трубки, входное отверстие которой (опущенное в пробу) затягивается частым газом (№ 70 – 77). Приставшие к газу организмы смываются дистиллированной водой с помощью пипетки. Приведенная к известному объему проба, выливается в колбу и равномерно взбалтывается. С помощью штемпель – пипеток разных объемов (от 0,1 до 5 мл), не дав осесть организмам на дно, отбирают порцию пробы. Часть пробы, взятую штемпель – пипеткой, выливают в камеру Богорова и в ней просчитывают число организмов каждого вида. Эта операция проводится дважды, после чего всю пробу просматривают под бинокуляром в кристаллизаторе Цееба для определения и подсчета редких и крупных видов. Число организмов в порциях пересчитывается на весь обем пробы и записывается в специальную карточку (см. приложение 2). От определения количества организмов в пробе переходят к определению численности ( количество организмов в 1 м3) зоопланктона. Если проба отобрана путем процеживания объема воды через сеть Апштейна, то расчет производится следующим образом:
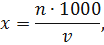
где - количество организмов в 1 м3 воды, экз./м3; - количество организмов в пробе, экз; - объем воды, процеженной через сеть, л.
Если отбор проб произведен количественной сетью Джеди, то прежде всего рассчитывают коэффициент планктонной сети (или множитель перевода на 1 м3) исходя из радиуса ее входного отверстия. Коэффициент сети рассчитывается следующим образом:
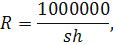
где, - площадь входного отверстия сети, см2; - горизонт, слой облова, см.
Вычислив коэффициент сети при горизонте 0 – 1 м, находим коэффициентв при горизонтах 0 – 2, 2 – 5, 5 – 10 м и т. д. простым делением значения при горизонте облова 1 м соответственно на 2, 3, и 5.
Численность организмов N находится умножение количества организмов в пробе на коэффициент сети .
Следующим этапом количественной обработки является получение данных по биомассе. Биомасса зоопланктона определяется умножением индивидуальной массы (веса) каждого организма на его численность. Однако следует учитывать, что длина и масса зоопланктеров одного и того же вида может значительно изменяться в разных водоемах, различных климатических зонах, а так же в зависимости от сезона. Е. В. Балушкина и Г. Г. Винберг [10, 11] сопоставили и оценили все содержащиеся в литературе уравнения и материалы, позволяющие по измерениям длины тела находить массу планктонных животных. В результате было предложено в качестве общего способа выражения зависимости между длинной и массой тела особи степенное уравнение
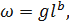
где - длина тела организма, мм; – масса тела, мг; - масса тела, мг сырой массы при длине тела равной 1 мм; - показатель степени.
Промеры организмов осуществляются под бинокуляром по возрастным стадиям: взрослые формы, молодь, яйценосные самки. Измеряются не менее 30 экземпляров каждого вида определенной стадии.
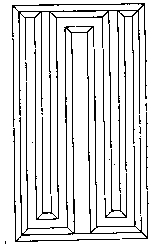
Рис. 6. Камера Богорова.
4. Методы изучения макрозообентоса
Организмы зообентоса занимают в водоеме два основных биотопа: грунт (поверхность и толщу) и растительность. Подвижные организмы могут отрываться от поверхности субстрата и плавать в воде, занимая таким образом третий биотоп – водную толщу в пределах придонного слоя воды или водного пространства в зарослях макрофитов.
Зообентос условно делят на три группы, основываясь на размерах животных: 1) макробентос – более 2-3 мм, 2) мезобентос – 0,5-3 мм, 3) микробентос – менее 0,5 мм. В макробентос попадают крупные организмы, например двустворчатые моллюски, личинки хирономид последних возрастов, половозрелые особи олигохет. Мезобентос объединяет животных, которые с ростом переходят в состав макрофауны, а так же размеры которых и во взрослом состоянии не превышают 2 мм.
Сбор организмов макро- и мезобентоса осуществляется одними орудиями лова, а обработка проб производится однотипными методами.
Микробентос включает мелкие организмы, представленные главным образом простейшими, коловратками, турбелляриями. Полноценный учет этой фауны требует специальной методики сбора и, главное, обработки «живых» (не зафиксированных) проб, так как многие организмы после фиксации деформируются настолько, что затрудняется их определение.
4.1. Методы отбора проб
4.1.1. Фауна грунта
Основными орудиями сбора на количественный анализ донных беспозвоночных являются дночерпатели различных систем. Универсального дночерпателя, пригодного для работы на всех типах грунта, нет.
На мягких илистых грунтах применяется коробочный дночерпатель Экмана – Берджа (рис. 7) на тросе или облегченная модель ковшевого дночерпателя Петерсена (рис. 8). На очень мягких илах дночерпатель Экмана – Берджа опускают очень медленно, контролируя по натяжению троса достижение дна, с тем чтобы прибор не зарывался в грунт.
На песчаных грунтах отбор проб осуществляется дночерпателем Петерсена с малой площадью захвата.
На плотных грунтах следует применять дночерпатель «Океан» (рис. 9)
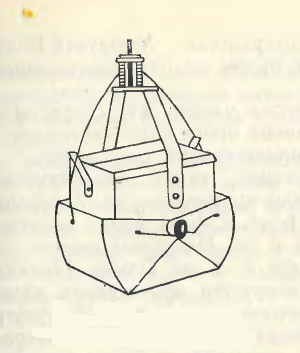
Рис. 7. Дночерпатель Экмана – Берджа.
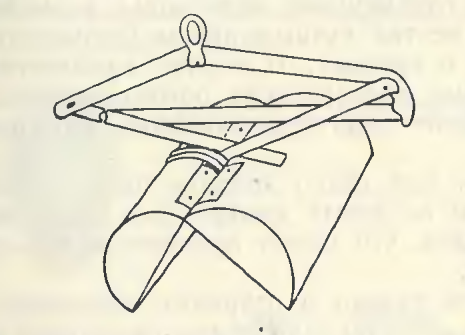
Рис. 8. Дночерпатель Петерсена.

Рис. 9. Дночерпатель «Океан».
Перечисленные виды дночерпателей применяют для отбора проб с лодки или катера.
В прибрежной зоне на глубинах до 2,5 м для отбора бентосных проб применяют дночерпатели, опускаемые на штанге. Это коробочный дночерпатель Заболоцкого с площадью захвата 1/40 м2, работающий на относительно мягких грунтах, и трубчаты дночерпатель Мордухай – Болтовского (1/250 м2), которым отбирают пробы на твердых грунтах.
Для сбора крупных организмов, таких, как двустворчатые моллюски, на мелководье можно применять рамку, ограничивающую участок дна, площадью 1 м2. Рамка накладывается на грунт, и ее положение фиксируется при помощи вдавленных в грунт шипов. В пределах ограниченного рамкой пространства крупных животных выбирают вручную, полученный материал просчитывают на месте, несколько экземпляров фиксируют формалином для уточнения видового состава, а остальных моллюсков возвращают в водоем.
На глубинах, недоступных для сбора вручную, крупных беспозвоночных отлавливают дночерпателями большой площади сечения (0,1 м2) или берут большее число проб, а промывку грунта проводят через сита с крупной ячеей ( не менее 5 мм).
Отбор проб дночепателем проводят с заякоренной лодки или судна. Сначала измеряют глубину: на мелководье размеченным шестом, в более глубоких местах ручным лотом.
При отборе проб лодка или судно должны быть ориентированы таким образом, чтобы во время дрейфа трос дночерпателя не заносило под корпус судна, что может привести к преждевременному закрытию прибора.
Дночерпатель опускается плавно в открытом состоянии. Достижение им дна обнаруживается по ослаблению натяжения троса. В зависимости от конструкции дночерпателя производится закрытие прибора и захват определенного объема грунта. Затем начинают подъем прибора. Дночерпатель с отобранным грунтом помещают в таз, кювету или на промывательный станок, открывают его, и грунт либо смывают струей воды в отверстие крышки на сито промывательного стакана, либо слегка приподнимают над приемной емкостью, освобождая дночерпатель от грунта. Остатки грунта на стенках прибора смывают в основную пробу.
Если отобранный грунт заполняет дночерпатель не полностью, то пробу не учитывают и отбор повторяют. Из забракованной пробы можно отобрать образец грунта для проведения анализа донных отложений.
Характер грунта определяется на каждой станции, где производится сбор донной фауны. Тип донных отложений определяется специалистами в аналитических лабораториях. Для этих целей грунт высушивают на воздухе или в любом теплом месте.
Непосредственно на водоеме можно приблизительно определить тип донных отложений по следующей шкале
- каменистый – дно покрывают преимущественно камни,
- каменисто-песчанный – среди отдельных камней есть участки открытого песчаного грунта,
- песчаный – преобладает песок, изредка встречаются камни,
- песчанно-илистый – песок частично или полностью покрыт илом,
- илисто-песчанный – ил является преобладающей фракцией, пр растирании между пальцами ощущается присутствие песка,
- илистый – при растирании между пальцами не ощущается присутствие песка,
- глинистый – при растирании ощущается пластичность,
- задернованные почвы – в искусственных водоемах.
Отбор проб для качественного анализа можно производить дночерпателями, а так же скребками (рис. 10), драгами и тралами различной конструкции, причем скребком облавливаются только мелководные участки водоема, а драгами как мелководные, так и глубоководные участки.

Рис. 10. Скребок.
Отбор бентосных проб драгами и тралами следует ограничивать, особенно на некоторых водных объектах, с целью сохранения биоценозов водных беспозвоночных. Лучше по возможности применять дночерпатели и скребки.
Промывка добытого дночерпателем грунта проводится на водоеме сразу после отбора проб. На практике используют несколько методов разделения грунта и организмов. При работе с большими объемами пробы промывку грунта осуществляют на станке, который состоит из деревянного корпуса с набором ящиков – сит. Сверху на станке помещается съемная крышка с бортиками по краю для приема грунта из дночерпателя и с отверстием в середине крышки, через которое грунт смывается на верхнее сито. После смыва грунта с крышки на сито, крышку снимают и из содержимого на верхнем сите выбирают крупных животных, а так же камни, остатки растительности и другие крупные объекты, которые сохраняются для последующего осмотра. Оставшийся грунт промывают несильной струей воды из шланга во избежании порчи организмов таким образом, чтобы через отверстия верхнего сита на второе попали организмы макробентоса, на нижележащее сито организмы мезобентоса, а остаток пробы смывается в приемный ящик или за борт. Таким образом происходит разделение бентосных организмов по размерным грунтам. Такой способ промывки можно проводить на крупных водных объектах, где отбор проб осуществляется с судна большими дночерпателями, а бентофауна представлена в основном моллюсками, раковины которых не повреждаются при промывке через металлические сита. На тех участках крупных водных объектов, где бентофауна состоит в основном из олигохет и личинок хирономид, а отбор проводится также с судна большими дночерпателями, рекомендуется на промывочном станке промывать грунт лишь на первом сите с крупной ячеей для отделения крупных животных и других объектов, а остаток промывать весь сразу или частями на ситах из мельничного газа № 23. Сито в виде мешка прикрепляется к четырехугольной раме, которая удерживается веревками за бортом судна и может быть поднято до уровня борта для приема грунта или опущено в воду не менее чем до половины мешка для промывки. Необходимо следить за уровнем погружения сита в воду и избегать заплескивания оды сверху, чтобы животные не были вымыты из мешка. Сито следует слегка приподнимать и опускать, чтобы ускорить и улучшить процесс разделения грунта и организмов.
Через такое же сито промывается за бортом грунт при отборе проб малыми дночепателями с лодки. При этом сито можно держать в руках.
Для промывки небольших количеств грунта используют небольшие сачки – промывалки (рис. 11), состоящее из металлического обруча диаметром 20 – 30 см, к которому пришивается такой же мешок, как у скребка

Рис. 11. Сачок
Для выборки фауны из песчаного грунта пробу перед промывкой подвергают отмучиванию. Для этого пробу помещают из дночерпателя в таз, сверху наливают воду до половины глубины таза. Рукой вода с грунтом производится в состояние движения так, чтобы поднять в воду животных. Не давая мути и организмам сесть на дно, воду из таза выливают в сачок – промывалку с мешком из газа соответствующего номера для макро- и мезобентоса. Процесс отмучивания повторяют до тех пор, пока промывные воды не становятся чистыми. После этого остаток грунта в тазу просматривают, всех оставшихся животных выбирают, а грунт выбрасывают.
Сбор организмов с промывных сит проводят сразу после промывки проб. Тщательно осматривают крупные объекты, отобранные на верхнем сите промывочного станка, и собирают обнаруженные на них организмы. Из отмытой пробы макробентоса животных лучше выбирать сразу на водоеме, так как живые формы заметнее и их легче собирать. При этом грунт помещают маленькими порциями в металлические или пластмассовые кюветы и приливают небольшое количество воды.
Для разделения грунта с примесью значительного количества растительного субстрата и организмов можно применять метод флотации. При этом небольшие порции грунта из пробы помещают в насыщенный раствор поваренной соли, всплывающие организмы быстро, пока они не осели вновь, собирают небольшим сачком или ложкой. Затем грунт тщательно посматривают для сбора моллюсков и других не всплывающих организмов. Пробы с организмами мезобентоса фиксируют целиком в 4 – 10% растворе формалина, а выбор животных проводят в стационарных условиях.
4.1.2. Фауна камней
В особую группу можно выделить обитателей каменистого субстрата. Это своеобразная фауна камней, которая развивается на каменистых отложениях в условиях быстрого течения рек. Животные, обитающие здесь, приспособились противостоять течению – одни из них прикреплены к камням (моллюски, личинки ручейников), другие имеют уплощенную форму тела ( личинки поденок, пиявки).
Камни с животными собирают вручную на доступной глубине. Для количественных сборов применяют рамку, ограничивающую площадь дна 0,25 м3. Выбираются все камни в пределах площади, ограниченной рамкой. Камни осторожно отделяют от грунта, так как подвижные животные быстро убегают , и помещают в таз с водой либо все сразу, если их немного, либо порциями по мере осмотра предыдущих.
Камни из таза по одному тщательно осматривают, и всех обнаруженных животных помещают в банку с формалином. Внимательно исследуются все наросты, которые могут оказаться домиками личинок ручейников или личинок хирономид. Вода из таза с подвижными животными, покинувшими камни, профильтровывается через сачок-промывалку из газа № 23. Остаток из сачка переносится в банку с формалином. Каждая банка снабжается этикеткой.
4.1.3. Использование искусственно помещенных в воду субстратов для отлова бентосных беспозвоночных
В практике гидробиологических работ все более широкое применение находит полуэкспериментальный метод установки в водоемах искусственных субстратов. Применяются деревянные пластинки, предметные стекла, полиэтиленовые плавающие плитки, хворостяные ящики, заполненные камнями и т.д. Фауна, развивающаяся на плотных субстратах, состоит из форм, живущих на поверхности субстратов и неспособных зарываться в грунт. Они образуют особый комплекс, отличающийся прикрепленными формами, строящими на субстрате неподвижные домики или обладающими другими средствами прикрепления. Среди них находят убежище и пищу ползающие и бегающие формы беспозвоночных.
По имеющимся данным, результаты, полученные с искусственных субстратов, довольно полно отражают фауну макробеспозвоночных конкретного участка водоема [12]. Достоинством метода искусственных субстратов является, прежде всего то, что субстраты могут быть установлены и извлечены не только биологами.
В качестве искусственных субстратов можно использовать куски оплавившейся пустой породы и каменноугольного шлака, материал, выбрасываемый из топок котельных, встречающихся повсеместно. Выбирают куски с гладкой поверхностью, на которой допускается наличие крупной пористости и неровности. В «рукав» длинной 25 см из безузловой полиэтиленовой ориентированной сетки, используемой для расфасовки фруктов, помещают 15 кусков субстрата размером 7х6х3 см. Концы сеточки завязывают рыболовной леской или мягкой алюминиевой проволокой.
Искусственные субстраты могут быть использованы для исследования на малых глубинах и в прибрежных участках на песчаных, песчанно-илистых, каменисто-песчанных и каменистых грунтах. Устанавливать субстраты следует в конце весны на глубину не более 0,5 м.
Наиболее оптимальным сроком нахождении субстрата в воде является 1 – 1,5 месяца. Для удовлетворительных результатов на каждой станции необходимо ставить не менее трех субстратов.
Субстрат в воде отыскивают осторожным ощупыванием ногой отмеченного на плане участка. Поднимать субстрат следует рукой, подставив под него сачок из капронового газа № 23 для того, чтобы животные не смывались водой. Потом сеточку с субстратом переносят в пластмассовое ведро, заполненное водой. Сачок промывают в ведре, а оставшихся животных выбирают пинцетом. Ведра с пробами отправляют в лабораторию.
В лаборатории сеточку разрезают. Куски субстрата обмывают сильной струей воды на двух металлических решетках, вставленных одна в другую. Прикрепившихся животных снимают пинцетом.
Сбор макробезпозвоночных с помощью искусственных субстратов можно считать не только методом качественного, но и полуколичественного сбора, так как в данном случае мы имеем дело с приблизительно однородной и разновеликой поверхностью, доступной для организмов, и одинаковым временем колонизации субстратов последними.
4.2 Фиксирование и хранение проб бентоса
Отобранных живых беспозвоночных сразу помещают в 4 – 10%-ный раствор формалина.
Формалина перед употреблением нейтрализуют, так как он имеет кислую реакцию и разрушает известковые раковины моллюсков, панцири ракообразных. Формалин для фиксации должен быть без осадка.
Для хранения бентосных проб используют широкогорлые стеклянные или полиэтиленовые банки преимущественно объемом 100, 250, 500 мл с завинчивающими крышками. Для герметизации в крышки вставляется резиновая прокладка из тонкого резинового листа толщиной 2 мм.
Консервирование животных можно проводить двумя способами. Собранный материал переносят в банки с небольшим количеством 4 – 10%-ного раствора формалина. Затем банку доливают до полного объема этим же фиксатором. Можно переносить материал в банки с некоторым количеством воды: после заполнения банки материалом добавляется вода, а для консервации – 40%-ный раствор формалина из расчета 1:9 для получения 4%-ного раствора или из расчета 1:3 для получения 10%-ного раствора формалина.
Пробы большого объема или небольшие пробы при отсутствии банок можно хранить в мешочках из ткани, помещенных в большие емкости с 4 – 10%-ным раствором формалина. В каждую банку или мешочек с пробой обязательно вкладывается этикетка.
4.3. Разборка бентосных проб, расчет численности и биомассы
Дночерпательные пробы обычно содержат некоторое количество постороннего материала. Целесообразно сначала выбрать животных из грунта, а затем производить их разборку по систематическим группам. Зафиксированный материал промывают водой для уменьшения неприятного запаха формалина. Выборку крупных животных производят визуально прямо из кюветы, затем материал порциями переносят в чашку Петри (диаметр 80 – 100 мм) и просматривают под бинокуляром для выборки мелких организмов. Животных помещают в банки с 4%-ным раствором формалина.
При большом объеме пробы донной фауны допускается частичная разборка для количественного учета массовых форм с пересчетом полученных данных на весь объем пробы.
В лаборатории выбранные животные из дночерпательных проб подвергаются разборке по систематическим группам до уровней типа, класса или отряда с последующим более детальным определением систематического положения животных до уровня рода и вида, за исключением трудноопределяемых групп организмов.
При разборке количественных проб представители каждой группы просчитываются, а затем в зависимости от их количества помещаются в банки или маленькие пробирки, снабженные этикетками, кратко повторяющими этикетки, которые были вложены на месте сбора материала.
При пересчете животных за единицу принимается целое животное. У двустворчатых моллюсков за целый экземпляр следует считать обломки обеих половин раковины с кусочками тканей на них у замкового края раковины.
Определение постоянного веса зафиксированного в формалине материала обычно производят через четыре месяца после момента фиксации.
Взвешивание следует проводить после одноминутной обсушки маленьких навесок материала на фильтровальной бумаги. Животных после обсушки помещают в предварительно взвешенный бокс, и определяют вес на аналитических весах. При небольшом объеме материала удобно и быстро производить взвешивание без бюкса на торзионных весах с точностью до 1 мг.
5. Методы изучения перифитона
Под перифитоном понимают сообщества, обитающие на твердом субстрате за пределами специфического придонного слоя воды. Сюда входят как сообщества на предметах, введенных в воду человеком (суда, буи, свайные сооружения, трубопроводы, причалы и т. д.), так и сообщества на естественных субстратах: крупных камнях и корягах мелководья, сообщества на макрофитах [13].
Изучение перифитона при биологическом анализе имеет первостепенное значение [14]. Это объясняется тем, что организмы, его составляющие, характеризуют условия именно данного пункта, а не занесены случайно из других мест.
5.1. Методика отбора проб перифитона с естественных субстратов
На месте отбора проб отмечается характер обрастания: цвет, пышность развития, характер субстрата, на котором развиваются организмы перифитона, расстояние места отбора проб от берега, глубина, на которой находится субстрат, температура воды, скорость течения.
На разных створах отбор проб желательно производить с одних и тех же субстратов для того, чтобы в дальнейшем получить сопоставимые результаты.
Наиболее пригодными для сбора перифитона являются нейтральные субстраты (камни, бетонные сооружения).
Сбор обрастаний с поверхности твердых предметов (плотин, камней, мостов и т. п.) производят с помощью скребка, ножа, скальпеля, пинцета или обычной столовой ложки с заточенным краем. Отбор необходимо производить очень осторожно, так как частицы бетона, камней, крупного минерального детрита могут затруднить дальнейший просмотр пробы.
Небольшое количество материала помещают в банку с водой с таким расчетом, чтобы количество воздуха над пробой составляло не менее половины объема сосуда.
Пробы обрастаний необходимо обрабатывать непосредственно после отбора или в срок, гарантирующий сохранность живого материала ( приблизительно в течение 6 ч после отбора проб, сохраняемых при температуре 5 - 10°С).
5.2. Методика отбора проб перифитона с помощью искусственных субстратов
В связи с чрезвычайной гетерогенностью распространения перифитона количественный учет на естественных субстратов очень затруднен. Поэтому для получения количественных характеристик обрастаний часто применяют искусственные субстраты, впервые введенные в гидробиологические исследования Гентшелем [15], а в СССР С. Н. Дуплаковым [16].
Искусственные субстраты используют при определении продуктивности перифитона, выяснении скорости заселения субстрата, изучении динамики популяции перифитона, установлении нижней границы его распространения, выяснении отдельных физико – химических факторов, лимитирующих развитие перифитона.
В качестве искусственных субстратов рекомендуется использовать предметные стекла из некоррозионного стекла. Стекла укрепляют вертикально, в текучих водоемах параллельно течению для того, чтобы избежать оседания на них детрита, грязи, мусора и пр. Укрепление стекол можно осуществлять разными способами. Удобно использовать для этих целей пенопластовые поплавки, резиновые пробки, в прорези которых вставляют стекла. Поплавки одевают на трос, несущий на нижнем конце груз для заякоривания, а на верхнем – поплавок, ограничивающий глубину погружения. Глубина погружения определяется в зависимости от прозрачности воды. Нижняя граница распространения перифитона совпадает со значением 1 – 1,5 прозрачностей. Оптимальным является горизонт 0,5 м от поверхности [17].
Длительность экспозиции стекол определяется географическим положением, качеством воды изучаемого водного объекта, сезоном года, целью исследования.
При исследовании качества воды установку с искусственным субстратом погружают в воду и начинают анализ приблизительно через две недели, т. е. когда сформируется сообщество. Если водоем сильно эвтрофирован или температура воды высока (выше 25°С), формирование сообщества может идти интенсивно и через 1 – 2 месяца количество аккумулированных веществ будет весьма значительно. В таком случае, чтобы избежать отслаивания оброста ставят новую установку.
При изучении биоценотических связей исследования начинают с первых же суток погружения стекол, прослеживая все стадии процесса сукцессии.
Извлекать стекло из установки следует очень осторожно, не вынимая всю установку из воды. Стекло помещают в банку с определенным количеством воды.
В лаборатории стекло просматривают под бинокуляром, поместив его в чашку Петри так, чтобы оно было покрыто водой. Крупные организмы (личинки насекомых, моллюски и пр.) просчитывают во всей пробе. Если оброст не очень густой, непосредственно на стекле просчитывают прикрепленные формы простейших. Затем оброст тщательно смывают кисточкой или зубной щеткой в определенный объем воды. Подвижные мелкие организмы (простейшие, коловратки) считают в камере Богорова. Если в пробе очень много организмов, для подсчета берут не всю пробу.
Для количественного учета водорослей взвесь смытного в определенный объем воды оброста тщательно перемешивают и берут из нее несколько миллилитров для последующего подсчета. Подсчет производят в счетных камерах (Нажотта, Горяева). В. Г. Девяткин [18] рекомендует применять поэтапную обработку проб в камерах разного объема для учета форм разного размера.
Численность водорослей подсчитывают по формуле:
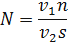
Где – объем воды со взвесью оброста, – объем просмотренной части пробы, в которой обнаружено n клеток водорослей, - площадь субстрата пробы.
Биомассу определяют «объемным» методом, так же как для фитопланктона (см. пункт 1.2).
Полученные данные по численности выражают в кл/мм2, по биомассе – в г/м2.
5.3. Этикетирование проб
Каждая проба перифитона должна быть этикетирована и записана в полевой дневник. На этикетке указывают название водоема, номер створа, дату отбора, местоположение створа, температуру воды, скорость течения, характер субстрата, глубину (м), на которой на которой находится субстрат, расстояние от берега.
В дальнейшем при обработке проб данные из полевого дневника переносят в рабочий журнал (см. приложение 3).
5.4. Обработка проб
В лаборатории отработанные пробы из банок переливают в кристаллизаторы или чашки Петри и производят разборку материала.
Если в пробе есть крупные организмы (личинки хирономид, пиявки, моллюски, олигохеты и т. д.), их отбирают в отдельную склянку и фиксируют, так же как бентосные пробы, 70% спиртом или 40% нейтрализованным формалином до концентрации 4%. Видовой состав определяют по различным определителям.
Определение видового состава микроскопических организмов начинают с простейших и коловраток (особенно панцирных), требующих прижизненного наблюдения. От действия консервирующих веществ они или совершенно разрушаются, или деформируются столь сильно, что определение их становится практически невозможно.
Материал, помещенный в чашку Петри, просматривают под бинокуляром. Простейших и коловраток отлавливают с помощью пипетки с оттянутым концом. Отловленный организм помещают на предметное стекло в небольшую каплю воды и покрывают покровным стеклом с пластилиновыми ножками. Чтобы приостановить или замедлить быстро двигающиеся организмы, к препарату добавляют каплю клея из айвовых косточек, либо наркотизирующего вещества – хлороформа или кокаина. Для лучшего наблюдения простейших и коловраток их окрашивают, добавляя витальные красители: метиленовый синий, нейтральный красный и другие.
Для идентификации коловраток используют определители составленные Л. А. Кутиковой [19], К. Вульфертом [20].
Растительный состав перифитона можно определять в фиксированной пробе, но желательно, особенно для первого ознакомления, смотреть нефиксированный материал, определяя вначале нежные формы (жгутиковые,вольвоксовые, эвгленовые и т. п.). В качестве консерванта применяют раствор Люголя в модификации Г. В. Кузьмина. В качестве консерванта можно применять и формалин, но действие его на клетку очень «жесткое» и приводит к ее деформации, затрудняя определение [21].
Для определения видового состава рекомендуется использовать определители, составленные О. А. Коршиковым [22], Е. К. Косинской [23], Л. И. Курсановым [24] и др.
Определение бактерий ввиду чрезвычайной трудности не входит в задачу исследователя перифитона. Однако такие виды, как Sphaerotilus natans, Zoogloea ramigera и некоторые другие образуют иногда крупные колонии, покрывая обширные площади, и в этом случае их можно идентифицировать и учитывать при определении видового состава перифитона.
Пробу просматривают до тех пор, пока перестанут встречаться новые виды. Обычно просмотреть 3 – 4 препарата. Параллельно с определением видового состава оценивают частоту встречаемости каждого вида по глазомерной шкале:
9 – очень часто ( в каждом поле зрения много),
7 – часто (в каждом поле зрения),
5 – нередко (не во всех полях зрения),
3 – редко (в немногих полях зрения),
2 – очень редко (в каждом препарате единично),
1 – единично (единичные экземпляры в пробе).
Все данные обработки проб заносят в рабочий журнал.
6. Методы определения первичной продукции и деструкции органического вещества
Первичная продукция – это продукция органического вещества, образованного растительными клетками в процессе фотосинтеза. Именно в результате фотосинтеза с использованием солнечной энергии и биогенных элементов растительные клетки синтезируют органическое вещество в водоемах, которое становится органической пищей для животных организмов разных трофических уровней. Таким образом, уровень первичной продукции определяет уровень биологической продуктивности водоема в целом.
Методы измерения первичной продукции в водоемах начали разрабатываться в начале ХХ в. Был предложен ряд методических разработок – измерение первичной продукции по изменению биомассы за определенный период времени, по изменению концентрации кислорода в воде [25], активной реакции среды – рН [26], по изменению концентрации биогенных элементов [27, 28], потребляемых в процессе фотосинтеза и др.
В настоящее время для определения первичной продукции фитопланктона относительно хорошо разработан скляночный метод в кислородной и радиоуглеродной модификации, а так же хлорофильный метод [29, 30, 31, 32].
6.1. Скляночный метод измерения первичной продукции и деструкции
1.6.1.1. Общие положения
Использование склянок для измерения фотосинтеза фитопланктона по разнице кислорода, образованного в результате фотосинтеза за определенный период времени, впервые было предложено Граном и Руудом [33] и детально разработано Г. Г. Винбергом [34]. Позже была разработана радиоуглеродная модификация скляночного метода [35], обладающая более высокой чувствительностью по сравнению с кислородной. Для измерения продукции макрофитобентоса был так же использован принцип склянок – изолированные емкости большого объема (до 30 – 50 л), в которые помещали экземпляры крупных талломных водорослей и высших водных растений [36, 37].
Кислородная и радиоуглеродная модификация скляночного метода основаны на валовом уравнении фотосинтеза
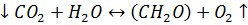
в котором количество потребленной углекислоты или количество выделившегося при фотосинтезе кислорода пропорционально количеству образованного органического вещества. При отсутствии света реакция идет в обратном направлении – процесс дыхания (деструкции), разложения органического вещества с потреблением кислорода и выделением углекислоты.
6.1.2. Продукционные склянки
Для кислородной и радиоуглеродной модификации используют одинаковые склянки из белого стекла с притертыми стеклянными пробками. Если имеется возможность, то лучше использовать склянки из кварцевого стекла, которое не влияет на проникающую солнечную радиацию. Удобно использовать в качетсве продукционных склянок плоские микробиологические матрицы, а так же стандартные химические склянки – кислотницы. Объем продукционных склянок составлет 100 – 500 мл в зависимости от продуктивности водоема. Обычно используют продукционные склянки следующих объемов: 100 мл для эвтрофных водоемов, 100 – 250 мл для мезотрофных водоемов, 250 – 500 мл для олиготрофных водоемов.
Перед измерением продукции все продукционные склянки должны быть точно оттарированы по объему. Для определения деструкции используются темные склянки. Для этого светлые склянки необходимо покрасить черной краской и обернуть фольгой.
6.1.3. Техника экспонирования склянок
Для измерения первичной продукции на различных горизонтах обычно ставят 2 – 3 светлых склянки и одну темную. Для крепления плоских склянок удобно использовать специальный плотик, изготовленный из прозрачного оргстекла (рис 12). Для крепления круглых продукционных склянок используют металлическую крестовину, на которой склянки крепят за горлышки в вертикальном положении. Плотики и крестовины со склянками крепят на тросе с помощью лебедки опускают на соответствующие горизонты. Экспонировать склянки можно и со специального буя, к которому прикрепляется трос с плотиками или крестовинами.
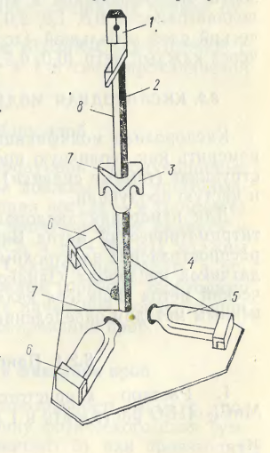
Рис. 12. Продукционный плот
1 – крепежный замок, 2 – металлическая штанга, 3 – пенопластовый фиксатор, 4 – основа плота, 5 – продукционная склянка, 6 – гнезда, 7 – вырез для троса, 8 – трос.
6.1.4. Время экспозиции
Длительность экспонирования продукционных склянок с фитопланктоном является важным методическим моментом при измерении первичной продукции. Фитопланктон в склянках находится в «изолированных условиях» и при длительном экспонировании происходят резкие изменения среды (повышение рН, пересыщение кислородом, потребление биогенных элементов и т. д.), которые будут существенно отличаться от естественной среды водоема. В этом случае может возникнуть большая ошибка в измерении первичной продукции и деструкции. В различных методических пособиях указывается разное время экспозиции – от нескольких часов до суток. Однако последние работы показывают, что оптимальное время экспонирования должно составлять 2 – 6 часов. Экспонировать склянки с пробами необходимо или в первую половину дня (до полудня) или во вторую половину дня (после полудня).
6.1.5. Выбор горизонтов экспонирования
Для расчета первичной продукции в столбе воды (под 1 м2) необходимо отбирать пробы и экспонировать их в продукционных склянках на нескольких глубинах фотического слоя. Нижняя граница фотического слоя, где первичная продукция равна деструкции (компенсационная точка), соответствует глубине, куда приникает 1% поверхностной солнечной радиации. Горизонты измерения первичной продукции должны соответствовать глубинам, куда проникает 100, 75, 50, 25, 10 и 1% поверхностной солнечной радиации. Если фотический слой небольшой (до 5 м), то склянки необходимо ставить через каждый метр (0,0, 0,5, 1,0, 2,0, 3,0, 4,0, 5,0 м).
6.2. Кислородная модификация скляночного метода
Кислородная модификация, или кислородный метод, позволяет измерить как первичную продукцию (светлые склянки), так и деструкцию (темные склянки) и таким образом рассчитать валовую и чистую продукции.
Для измерения кислорода, растворенного в воде, используют титриметрический метод Винклера [38].
6.2.1. Приготовление реактивов
- Раствор хлористого марганца (MnCb2 4H2O): 420 г хлористого марганца растворить в 1 л свежепрокипяченной дистиллированной воды. Соль должна быть ч. д. а. и не содержать примесей железа.
- Щелочной раствор иодида калия (KI): а) растворить 500 г аналитически чистого NaOH в 500 мл дистиллированной воды, б) растворить 500 г KI в 500 мл дистиллированной воды, в) смешать растворы NaOH и KI. При образовании осадка раствор отстаивают в течение суток, а затем осторожно сливают в другую склянку.
- Раствор тиосульфата натрия (0,01нNa2S2O3 5H2O). Растворяют 248 г кристаллического тиосульфата натрия ч. д. а. в 1 л свежепро -кипяченной дистиллированной воды. Раствор готовят в количестве 3 – 5 л и хранят в хорошо закрытых темных склянках.
- Индикаторный раствор крахмала. 2 г крахмала суспендируют в 300 – 400 мл дистиллированной воды. Добавляют 20%-ный растовр NaOH, осторожно перемешивая до тех пор, пока раствор не станет прозрачным. Отстаивают раствор 2 часа и добавляют концентрированную HCl до кислой реакции, 2 мл ледяной уксусной кислоты (CH3COOH) и доводят раствор до 1 л дистиллированной водой. Хороший раствор крахмала должен давать чистую синюю окраску.
- Раствор иодистого калия (KI). Готовят 10%-ный раствор KI из чистой соли, растворяя в свежепрокипяченной дистиллированной воде. Раствор KI хранят в склянке, обернутой черной бумагой или окрашенной черной краской.
- Раствор двухромовокислого калия (0,02HK2Cr2O7) 0,09808 г точно отвешенного K2Cr2O7 растворяют в 1 л свежепрокипяченной дистиллированной воде в мерной колбе.
1.6.2.2. Подготовка к отбору проб
Перед измерением первичной продукции продукционные склянки, батометр и посуда для анализа должны быть тщательно вымыты и высушены. Перед постановкой опыта продукционные склянки и реактивы для фиксации кислорода должны быть помещены в специальные ящики. Склянки расставить в порядке отбора проб с горизонтов. На каждый горизонт необходимо четыре склянки – одну для определения начальной концентрации О2, две светлые и одна темная для экспонирования проб.
6.2.3. Отбор, экспонирование и фиксация проб
а. В точке отбора проб измеряют прозрачность воды с помощью белого диска и определяют глубину фотического слоя или производят измерения количества проникающей солнечной радиации с помощью подводного пиранометра. При этом глубина, куда проникает 1% падающей солнечной радиации будет соответствовать нижней границе фотического слоя.
б. Отбор проб проводят с соответствующих горизонтов серией батометров объемом не менее 1 л. При этом из одного батометра одновременно отбирают пробы на гидрохимический анализ, а так же на качественный и количественный анализ фитопланктона.
в. Непосредственно после отбора проб батометры устанавливают в специальные держатели и немедленно начинают заполнять продукционные склянки. Перед заполнением каждая склянка споласкивается исследуемой пробой. Склянки заполняют доверху, переливая часть пробы. Склянку закрывают и помещают на соответствующий горизонт (две светлые и одну темную) и отмечают время начала экспозиции.
г. После того как склянки поставлены на экспонирование, сразу фиксируют все пробы для определения начальной концентрации О2 на всех горизонтах. После экспозиции фиксируют остальные пробы. Кислород фиксируют, добавляя в склянки поочередно 1 мл MnCl2 и 1 мл щелочного раствора KI. 2 мл потерянной пробы учитываются при последующем расчете. После фиксации склянку закрывают и энергично переворачивают несколько раз до тех пор, пока осадок не будет равномерно распределен по всему объему склянки. После этого пробы помещают в темное место для отстаивания осадка (от 3 ч до 1 суток).
6.2.4. Титрование проб и расчет содержания кислорода в пробе
После того как пробы отстоялись, осадок растворяют, добавляя 1- 3 мл концентрированной H2SO4. Закрывают склянку пробкой и перемешивают пробу до полного растворения осадка. Затем отбирают часть пробы из склянки (50 или 100 мл) в зависимости от объема склянки или берут всю пробу и переливают ее в коническую колбу. Титруют стандартным растовром тиосульфата до соломенно – желтой окраски. Затем добавляют 1 – 2 мл крахмала (появляется синяя окраска) и титруют тиосульфатом до полного обесцвечивания. Объем тиосульфата, пошедшего на титрование, записывают в соответствующую таблицу, (см приложение 4). Из одной склянки необходимо оттитровать по 2 – 3 повторности.
Количество кислорода (мгО2/л), растворенного в воде, рассчитывают по формуле
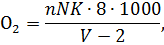
где - количество тиосульфата, ушедшего на титрование, - нормальность тиосульфата, – поправка на нормальность тиосульфата, 8 – эквивалентная масса кислорода, - объем титрованной пробы, 2 – количество утерянной пробы, 1000 – пересчет на 1 л пробы.
6.2.5. Определение поправочного коэффициента нормальности Na2S2O3
В коническую колбу объемом 100 – 150 мл добавляют 10 мл 10% иодистого калия, 35 – 50 мл дистиллированной воды, 15 мл 0,02HK2Cr2O7 и 10 мл HCl (2:1). Тщательно перемешивают и дают постоять 2 – 3 мин.
После этого раствор титрируют тиосульфатом до соломенно – желтой окраски. Затем добавляют 1 мл раствора крахмала и титруют до полного обесцвечивания. Поправочный коэффициент на нормальность тиосульфата рассчитывают по формуле
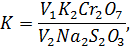
Где и – объемы тиосульфата и двухромовокислого калия. Определение поправочного коэффициента следует проводить перед каждой серией определений.
6.2.6. Расчет первичной продукции
Если - начальное содержание О2 в склянке перед экспонированием, - количество О2 в светлой склянке после экспонирования, – количество О2 в темной склянке после экспонирования, – время экспозиции (ч), то первичную продукцию [мгО2(лч)] вычисляют по следующим формулам:
- валовая продукция
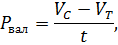
- чистая продукция
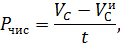
- деструкция
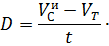
6.3. Радиоуглеродная модификация скляночного метода
Определение первичной продукции радиоуглеродным методом основано на включении в растительную клетку в процессе фотосинтеза углекислоты, меченной по углероду. Впервые для определения первичной продукции он был применен в морских исследованиях [35], а затем и на пресных водах [39,40]. Радиоуглеродный метод обладает высокой чувствительностью (в 100 раз чувствительнее кислородного метода), поэтому широко используется для измерения первичной продукции в водах с низкой продуктивностью – в океанических водах и олиготрофных водоемах суши. Существенными недостатками метода являются его относительно низкая точность (ошибка до 40%) и невозможность определения значений деструкции. Для определения первичной продукции радиоуглеродным методом используют светлые и темные склянки, как и для кислородного метода. Однако в отличие от кислородного метода, темные склянки в радиоуглеродном методе используют для определения нефотосинтетической фиксации изотопа углерода растительными клетками, которую вычитают из активности светлых склянок.
Выбор горизонтов для экспонирования проб и время экспонирования аналогичны скляночному методу в кислородной модификации.
6.3.1. Приготовление раствора изотопа
Заводская фасовка меченого углерода изготавливается в виде карбоната или бикарбоната натрия (реже калия). Раствор изотопа готовят в лаборатории непосредственно перед серией измерений первичной продукции в полевых условиях. Для растворения соли изотопа используют свежепрокипяченную и охлажденную дистиллированную воду. В мерную колбу непосредственно перед растворением изотопа добавляют несколько крупинок сухой щелочи для предупреждения потери изотопа из раствора. Приготовленный раствор изотопа разливают в стеклянные ампулы и запаивают с целью продолжительного хранения изотопа. Для последующего длительного хранения ампул с изотопом их необходимо простерилизовать. Для стерилизации ампулы помещают в сосуд с сильно окрашенным раствором метиленовой сини и автоклавируют при 50,5 кПа в течение 1 ч. При автоклавировании плохо запаянные ампулы окрашиваются в синий цвет и отбраковываются.
6.3.2. Добавление изотопа в продукционные склянки, экспонирование, фиксация
Для измерения первичной продукции на одном горизонте используют обычно две светлые и одну темную склянки.
Изотоп добавляют в склянки перед заполнением их пробами с фитопланктоном с помощью дозатора (рис. 13) или шприцем с пипеткой. Эту операцию следует проводить тщательно, поскольку на этом этапе возможна наибольшая ошибка. Количество добавляемого в банки изотопа должно соответствовать концентрации изотопа в склянке, равной (1,85 – 7,4)х105 Бк/л.
По окончании экспозиции пробы фиксируют 40%-ным формалином (0,5 – 1 мл на 100 – 250 мл пробы). Затем пробы отфильтровывают на мембранные фильтры.
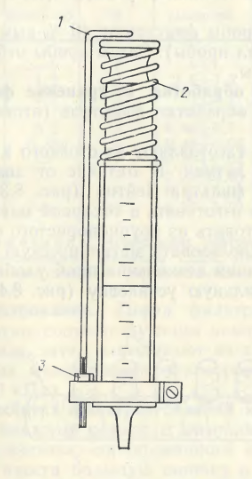
Рис. 13. Дозатор
1 – ограничитель, 2 – пружина, 3 – гайка, регулирующая объем пробы.
6.3.3. Фильтрование проб, обработка и хранение фильтров
Фильтр Зейтца изготавливают из стойкого к окислению материала – пластмассы, латуни. В отличие от заводского фильтра, данная конструкция фильтра Зейтца (рис. 14) более удобна для работы и его легко изготовить в токарной мастерской. Опорную подложку лучше изготовить из крупнопористого стеклянного фильтра, можно так же использовать металлическую сеточку. Для одновременного фильтрования нескольких проб удобно смонтировать вакуумную фильтровальную установку (рис. 15), которая состоит из цилиндра, на котором установлено 5 – 10 фильтров Зейтца. В стационарных условиях установка может работать с помощью водоструйного вакуумного или электрического вакуумного насоса. В полевых условиях рабочий вакуум создается с помощью ручного насоса Камовского.
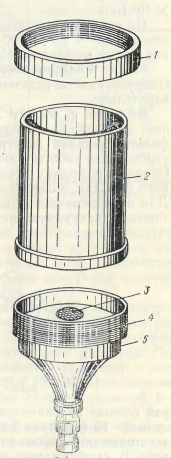
Рис. 14. Фильтр Зейтца
1 – прижимная шайба, 2 – стакан, 3 – подложка из металлической сетки, 4 – резьба для прижимной шайбы, 5 – основа фильтра.
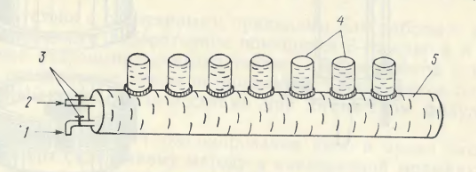
Рис.15. Фильтровальная установка
1 – слив, 2 – к вакууму, 3 – вакуумные краны, 4 – фильтры Зейтца, 5 – цилиндр – приемник.
Мембранные фильтры для фильтрования фитопланктона должны быть с определенным размером пор. Удобно использовать мембранные фильтры производства ЧССР (тип «Сынпор») или ультрафильтры Мытищинской фабрики. Для определения первичной продукции фильтрование проб проводят на фильтрах с размерами пор 0,5 – 1,0 мк, что соответствует № 4 и 5 фильтров типа «Сынпор». Перед использованием мембранные фильтры необходимо прокипятить в дистиллированной воде.
Перед фильтрованием мембранные фильтры маркируют соответствующим номером шариковой ручкой или карандашом, затем взвешивают на аналитических весах с точностью дл сотых миллиграмма. Фильтрование пробы ведут при вакууме (20 – 30 кПа).
После фильтрования влажный осадок с фитопланктоном содержит частицы раствора изотопа, сорбированного на поверхности клеток, который может внести большую ошибку в счет активности фильтров. Поэтому после фильтрования фильтры помещают в эксикатор с концентрированной соляной кислотой и сашки Петри, проложенные фильровальной бумагой. Время обработки соляной кислотой 1 – 4 мин.
После обработки кислотой фильтры помещают в эксикатор с высушивающей смесью следующего состава: нетронная известь+силикагель+щелочь (1:1:1). Щелочь помещают в эксикатор в чашке Петри и заменяют по мере ее оплывания. Время высушивания фильтров составляет, как правило,24 ч. После высушивания фильтры повторно взвешивают.
6.4. Определение общего содержания углекислоты в воде
Для расчета первичной продукции необходимо знать общее содержание минерального углерода по всех формах углекислоты. Существует несколько методов определения общего содержания углерода в воде. Наиболее простые из них – титриметрический метод и метод расчета по концентрации водородных ионов (рН), температуре и карбонатной щелочи.
6.4.1. Титриметрический метод определения общего содержания углекислоты в воде
Принцип метода. Углекислота в воде присутствует в трех формах: свободной (СО2), карбонатной () и бикарбонатной (НС). Соотношение этих трех форм в воде зависит от рН (табл. 3).
Таблица 3
Зависимость содержания различных форм производных угольной кислоты (%) от рН (при 25°С)
|
Форма
|
рН
|
|
|
4,0
|
5,0
|
6,0
|
7,0
|
8,0
|
9,0
|
10,0
|
11,0
|
|
Свободная
|
99,5
|
95,4
|
67,7
|
17,3
|
2,0
|
0,2
|
-
|
-
|
|
Карбонатная
|
0,5
|
4,6
|
32,3
|
82,7
|
97,4
|
62,5
|
62,5
|
14,3
|
|
Бикарбонатная
|
-
|
-
|
-
|
-
|
0,6
|
5,7
|
37,5
|
85,7
|
Как видно из табл. 3, рН=8,3 является границей существования свободной углекислоты и карбонатов, поэтому при доведении пробы воды до рН=8,3 все формы углекислоты переходят в бикарбонаты, которые и определяют прямым титрованием соляной кислотой.
0,1 н. раствор NaOH готовят на свежепрокипяченной и охлажденной дистиллированной воде. Так как щелочь содержит некоторое количество карбонатов, то после растворения необходимо ее декантировать в склянке с притертой пробкой в течение суток. После этого раствор осторожно перелить в другую склянку, не взмучивая осадок. Готовят 200 – 400 мл раствора NaOH.
0,05 н. раствор HCl готовят на 1 л свежепрокипяченной дистиллированной воды.
Раствор фенолфталеина готовят на свежеепрокипяченной дистиллированной воде и хранят в колбочке с пипеткой.
Смешанный индикатор получают (метилрот, метилоранж и мителенблау), приготавляя каждый индикатор отдельно, а затем сливают в пропорции 1:1:1.
Ход определения. В коническую колбу отбирают 100 мл исследуемой пробы и добавляют 2 – 3 капли фенолфталеина. Затем осторожно по капле добавляют 0,1 н. NaOH до появления розовой окраски. Если рН исследуемой пробы 8,3, то розовая окраска появляется непосредственно после добавления фенолфталенина. В этом случае щелочь в пробу не добавляют. После появления розовой окраски добавляют по каплям 0,05 н. HCl до исчезновения окраски, а затем 5 – 10 капель смешанного индикатора и оттитровывают с помощью бюретки 0,05 н. HСl до появления ярко – розовой устойчивой окраски. Расчет общего содержания углекислоты в пробе (мгС/л) проводят по формуле
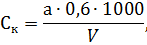
где а – объем 0,05 н. HCl, пошедший на титрование,мл; 0,6 – эквивалент углерода (при титровании 1мл 0,05 н. HCl соответствует 0,6 мгС/л); V – объем титруемой пробы, мл; 1000 – пересчет на 1 л.
6.4.2. Определение общего содержания углерода в воде по рН, температуре и карбонатной щелочи
Необходимыми характеристиками анализа вод являются рН, температура и щелочность, в частности карбонатная щелочь. Наличие таких данных позволяет расчетным путем определить содержание карбонатного углерода (Ск), растворенного в воде, по следующей формуле:
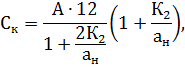
где А – карбонатная щелочь, мг-экв/л; ан – концентрация активных ионов водорода; К2 – вторая кажущаяся константа диссоциации углекислоты в воде при данной температуре [38] (табл. 4).
Таблица 4
|
t воды, °С
|
К210-9
|
t воды, °С
|
К210-9
|
|
0
|
0,023
|
16
|
0,038
|
|
2
|
0,025
|
18
|
0,040
|
|
4
|
0,027
|
20
|
0,042
|
|
6
|
0,029
|
22
|
0,044
|
|
8
|
0,030
|
24
|
0,046
|
|
10
|
0,032
|
26
|
0,048
|
|
12
|
0,034
|
28
|
0,050
|
|
14
|
0,036
|
30
|
0,051
|
6.5. Расчет первичной продукции
Расчет первичной продукции [мгС/(лч)] проводят по формуле
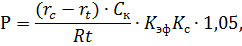
где – активность в светлых склянках за вычетом фона, имп/мин; - активность в темных склянках за вычетом фона, имп/мин; Ск – концентрация минерального углерода, мг С/л; R - исходная активность раствора изотопа имп/мин; Кс – коэффициент самопоглощения; 1,05 – дискриминационный коэффициент.
6.6. Расчет первичной продукции за день и под 1 м2 водной поверхности
Имея значения первичной продукции в мг О2/(лч), в мг/С(лч) или под 1 м2 водной поверхности и зная длину светового дня для исследуемого района (по актинометрическим таблицам, можно рассчитать величину первичной продукции за световой день:
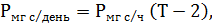
где – Т – дина светового дня, из которой вычитают 2 ч (исходя из положения, что в течение часа после восхода солнца и за 1 ч до захода солнца угол падения солнечных лучей на водную поверхность очень мал и количество проникающей в водную толщу солнечной радиации практически равно нулю и фотосинтез не происходит).
Первичная продукция под 1 м2 водной поверхности служит характеристикой продуктивности всего столба воды в исследуемом районе водоема.
Рассматриваемую величину получают построением кривой вертикального распределения первичной продукции. Затем определяют площадь, которую очерчивает эта кривая и площадь, соответствующую продукции в 1 м3 столба воды. Находят отношение всей площади к площади 1 м3. Умножив продукцию, содержащуюся в 1 м3 столба воды, на полученное отношение, получим значение первичной продукции во всем исследованном столбе воды, т. е. под 1 м3 водной поверхности.
6.7. Сравнение результатов кислородного и радиоуглеродного методов
Первичная продукция может быть выражена различными единицами, в частности единицами О2 или С. Для сопоставления значений первичной продукции, измеренной разными методами, например количество О2 в единицах углерода, используют следующее выражение: 1 мг связанного С/м3 = 1 мг освобожденного О2/л = 0,375 мг О2/л. Для перевода в другие единицы, например в джоули, необходимо пользоваться табл. 5
Таблица 5
Взаимоэквивалентные величины, рассчитанные по балансовому уравнению
фотосинтеза [41]
|
Характе - ристика
|
О2
|
CO2
|
С, мг
|
Глюкоза, мг
|
Энергия, Дж
|
|
|
мг
|
мл
|
мг
|
мл
|
|
|
|
|
1 мг О2
|
-
|
0,6997
|
1,375
|
0,6997
|
0,3750
|
0,9375
|
14,71
|
|
1 мл О2
|
1,4292
|
-
|
1,9652
|
1,0000
|
0,5359
|
1,3399
|
21,02
|
|
1 мг CO2
|
0,7273
|
0,5089
|
-
|
0,5089
|
0,2727
|
0,6818
|
10,70
|
|
1 мл СО2
|
1,4292
|
1,0000
|
1,9652
|
-
|
0,5359
|
1,3399
|
21,02
|
|
1 мг С
|
2,6667
|
1,8660
|
3,6667
|
1,8660
|
-
|
2,5000
|
39,22
|
|
1 мг глюкозы
|
1,0667
|
0,9464
|
1,4667
|
0,7464
|
0,4000
|
-
|
15,69
|
|
1 Дж энергии
|
0,0680
|
0,0475
|
0,0934
|
0,0475
|
0,0255
|
0,0637
|
-
|
6.8. Хлорофилльный метод определения первичной продукции и биомассы фитопланктона
Наличие хлорофилла в клетках является необходимым условием фотосинтеза. Большое число работ показывает закономерную связь между количеством хлорофилла растительных клеток и их продукцией и биомассой [41].
Следует отметить, что хлорофильный метод измерения первичной продукции и определение биомассы фитопланктона является весьма приближенным. Поэтому его использование для определения первичной продукции рекомендуется только в том случае, если по каким-либо причинам невозможно измерение скляночным методом.
6.8.1. Расчет первичной продукции
Для расчета первичной продукции хлорофильным методом необходимо знать следующие величины:
- Z – Сz – концентрация хлорофилла «а» на определенной глубине;
- Зависимость интенсивности фотосинтеза от световых условий (относительный фотосинтез) (Rz);
- Распределение солнечной радиации по глубине ( коэффициент экстинкции) К;
- Ассимиляционное число (АЧ);
- I – количество дневной солнечной радиации, падающей на водную поверхность в течение светового дня.
Значение Rz находится из графика (рис. 16), рассчитанного Райтером и Енчем [42].
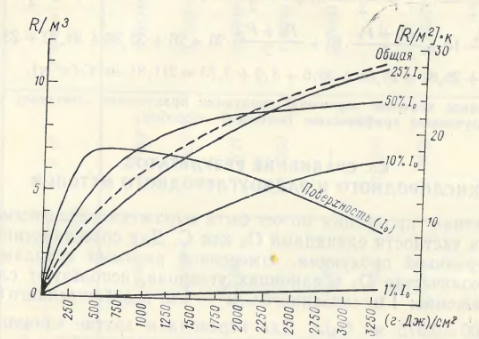
Рис. 16. Соотношение между общей дневной радиацией (I), падающей на поверхность, и дневным относительным фотосинтезом R на поверхности и на глубинах, где интенсивность света составляет соответствующий процент падающей радиации.
АЧ – это количество углекислоты, ассимилируемой в еденицу времени (в час, сутки и т. д.) в процессе фотосинтеза при световом насыщении одной весовой единицей хлорофилла, иначе говоря, АЧ – это отношение фотосинтеза при световом насыщении к количеству хлорофилла «а». Обычно АЧ выражают в г С/ч хлорофилла «а». Если нет возможности определить АЧ для исследуемого водоема, то можно использовать среднее значение АЧ = 3,7 гС/ч [43, 44].
Первая продукция [мг С/(м3день)] на каждом отдельном горизонте рассчитывается по формуле:
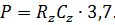
6.8.2. Расчет биомассы фитопланктона
Ориентировочный расчет биомассы фитопланктона по концентрации хлорофилла «а» проводят исходя из того, что, согласно Г. Г. Винберга, [41] хлорофилл «а» составляет 2,5% сухой биомассы или 6,75% содержания органического углерода. Поэтому при пересчете хлорофилла «а» в биомассу, выраженную в единицах углерода (мкг С/л), используют формулу
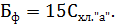
Принимая, что сухая биомасса составляет примерно 0,1 сырой массы фитопланктона, можно рассчитать по хлорофиллу «а» сырую массу фитопланктона (мкг/л) по формуле
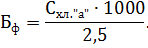
7. Оценка качества воды
7.1. Метод Пантле и Букка для оценки качества вод по фитопланктону
Одним из методом качества воды является метод индикаторных организмов Пантле и Букка в модификации Сладечека [45, 46]. Этот метод дает возможность представить результаты биологического анализа численными значениями и обеспечивает тем самым возможность сравнения состояния водоемов различных районо.
Индекс сапробности вычисляется по формуле
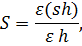
Где s – индикаторная значимость каждого вида (определяется по спискам сапробных организмов, h – величина, которая находится из шестиступенчатой шкалы значений частоты (табл. 6) и определяет относительное количество видов.
Перевод ценных данных абсолютной численности в частоту встречаемости h обусловлен трудоемкостью вычислений. В тех же случаях, когда работа с большими числами не представляет затруднений (наличие калькуляторов) следует использовать данные абсолютной численности фитопланктона.
Таким образом, для определения индекса сапробности необходимо знать значение индикаторной значимости каждого встреченного в пробе вида фитопланктона и его количественное развитие в данной пробе. Индекс сапробности вычисляют с точностью до 0,01. Для ксеносапробной зоны он находится в пределах 0 – 0,50, олигосапробной – 0,51 – 1,50, -мезосапробной – 1,51 – 2,50, -мезосапробной – 2,51 – 3,50, полисапробной – 3,51 – 4,00.
7.2. Оценка качества воды по показателям зоопланктона
Сообщество зоопланктонных организмов служит характеристикой состояния среды. Отдельные виды этих организмов используются для индикации качества воды. Прежде всего к индикаторам загрязнения следует отнести коловраток и простейших. Что касается группы ракообразных, то их довольно крупные размеры, значительная легкость при отборе проб и последующей обработки создают ряд преимуществ в использовании этих организмов в качестве непосредственных индикаторов загрязнения. Однако следует отметить, что большинство ракообразных приурочено не столько к разной степени загрязнения, сколько к трофическому типу водоемов.
Задачей первостепенной важности является уточнение списков видов – индикаторов зоопланктона для каждого региона Росии.
С помощью зоопланктеров, в частности веслоногих ракообразных, возможно определение последствий разового или прерывистого загрязнения.
Оценка качества воды или степень загрязнения вод по гидробиологическим показателям производится двумя путями:
- По результатам сравнения населения на участках загрязненных с участками контрольными, т. е. с теми, где загрязнение отсутствует;
- По индикаторным организмам.
Оба этих подхода используются при оценке качества воды по зоопланктонным организмам. Первый метод требует от исследователя четкости в выборе участков обследования. Необходимо, чтобы сопоставляемые участки водоема были достаточно сравнимы ( одинаковые биотопы, скорость течения и т. д.).
В первом случае оценка качества воды производится на основании анализа материала по качественному и количественному развитию зоопланктона. Учитывается численность, биомасса зоопланктеров, общее число видов, число видов в основных группах (ротатории, кладоцеры, копеподы), соотношение основных групп по численности, массовые виды и их процент общей численности. Принимается во внимание наличие того или иного вида или группы зоопланктона и в то же время, и даже в большей степени, отсутствие вида или группы. Учитывается изменение в структуре зоопланктонного сообщества, нарушение в соотношении между основными группами.
Сравнение исследованных участвок водоема можно производить по показателям, предложенным М. Б. Ивановой [47]:
- Отношение числа видов кладоцер к числу видов копепод;
- Соотношение численности (средних по всем пробам) этих групп.
Наиболее разработанной системой оценки степени загрязнения вод по индикаторным организмам является система сапробности Кольквитца – Марссона [48, 49]. Сущетвует ряд методов представления результатов биологического анализа, позволяющих оценить среднюю сапробность биоценоза. Одним из методов наиболее удобным при анализе зоопланктонного сообщества, является метод Пантле и Букка [50, 51]. Целью метода является обеспечение возможности сравнения результатов исследования состояния водоемов различных районов. Количественная оценка гидробионтов по методу Пантле и Букка учитывает относительную частоту встречаемости организмов h и отношение отдельных видов к пяти известным степеням системы сапрбности s. Обе эти величины входят в формулу для вычисления индекса сапробности
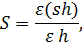
Величина h находится из шестиступенчатой шкалы значений частоты и определяет относительное количество видов ( табл. 6)
Таблица 6
Соотношение значений относительного обилия и частоты встречаемости организмов
|
Частота
|
Количество экземпляров одного вида, % общего количества экземпляров
|
h
|
|
Очень редко
|
<1
|
1
|
|
Редко
|
2 – 3
|
2
|
|
Нередко
|
4 – 10
|
3
|
|
Часто
|
10 – 20
|
5
|
|
Очень часто
|
20 – 40
|
7
|
|
Масса
|
40 – 100
|
9
|
Индекс сапрбности в олигосапробной зоне равен 0,50 – 1,50 (чистые воды), в -мезасапробной зоне – 1,51 – 2,50 (воды умеренного загрязнения), -мезосапробной зоне 2,51 – 3,50 (тяжело загрязненные), полисапробной зоне 3,51 – 4,50 (очень тяжело загрязненные).
По методу Пантле и Букка предполагается, что каждый индикаторный вид встречается лишь в одной зоне загрязнения, что не соответствует действительности. Сладечек [52] предложил модификацию этого метода, изменив значение индексов сапробности индикаторных видов, предложенных Пантле и Букком. Эти значения индекса сохраняются у тех видов, которые встречаются в одной зоне загрязнения. Если вид встречается в двух или большем числе зон, значение индекса изменяется на десятые, а иногда на сотые доли единицы.
Значение индексов сапробности животных и растений S опубликованы в книге Сладечека [52].
Метод Пантле и Букка в модификации Сладечека более универсален и прост, чем система Зелинки и Марвана [53] и Ротштайна [54], требующие громоздких расчетов. При использовании метода Пантле и Букка следует иметь ввиду, что индикаторное значение видов может быть разным в различных климатических зонах.
Все необходимые характеристики для оценки качества вод по зоопланктонному сообществу заложены в форме отчетности «Зоопланктон» (см. приложение 5).
ЗАКЛЮЧЕНИЕ
Применение гидробиологических методов позволяет непосредственно выяснить состав и структуру сообществ гидробионтов.
Использование методов изучения фитопланктона позволяет оценить качественный и количественный состав растительного планктона, а так же рассчитать количество первичной продукции потребляемой гетеротрофами. Наиболее простой и часто применяемый метод оценки количества первичной продукции считается «Скляночный метод в кислородной модификации», но так как он менее чувствителен, то в водоемах с низкой продуктивностью применяют «Скляночный метод в радиоуглеродной модификации». Так же, изучая количество растительного планктона и высшей водной растительности, определяют количество растворенного в воде кислорода. Как известно, кислород необходим для дыхания всех живых существ на земле. Наиболее применим этот метод для пресных водоемов, где содержание кислорода напрямую зависит от количества автотрофных организмов.
Методы для определения структуры и количества зообентосных и зоопланктонных организмов одинакового применимы как для пресных, так и для морских водоемов. Для изучения зообентоса пресных водоемов применяются упрощенные конструкции по сбору проб, это объясняется тем что, такие водоемы имеют более однородную структуру рельефа дна, происхождения грунта и т. д., по сравнению с морскими водоемами. Преимуществом пресных водоемов считается так же меньшее количество отбора проб при исследовании зоопланктона.
Гидробиологические методы применяемые при рыбохозяйственных исследованиях позволяют оценить качественный и количественны состав водных организмов, оценивать качество вод и донных отложений, как среды их обитания. Сравнив качественный состав и количественную структуру сообществ донных организмов, можно сделать выводы о качестве водной среды. Если в водоеме много чувствительных к загрязнению организмов и они разнообразны – водоем чист, и – наоборот, присутствие большого числа толерантных организмов свидетельствует о неблагоприятной экологической обстановке. Так как основной поток энергии в водной экосистеме идет через планктонную сеть пелагиали, в которой трансформируется до 99% энергии, гидробиологические исследования позволяют определить трофические связи гидробионтов и устанавливать направление изменения водных биоценозов. Гидробиологические методики позволяют определить совокупный эффект комбинированного воздействия загрязняющих веществ и определять экологическое состояние водных объектов и экологические последствия их загрязнения. Загрязняющие вещества накапливаются как в самой воде, так и в донных отложениях, телах гидробионтов и других водных организмов. Совместное нахождение нескольких вредных веществ способно усилить или ослабить пагубное воздействие на организмы и экосистему в целом.
СПИСОК ИСПОЛЬЗОВАНЫХ ИСТОЧНИКОВ
1. Константинов А. С. Общая гидробиология. М., 1986
2. Биология океана. Под ред. М. Е. Виноградова в 2х томах. М.: Наука, 1977
3. Киселев И. А. Планктон морей и континентальных водоемов. – Л.: Наука, 1969. – 657 с.
4. Кузьмин Г. В. Фитопланктон. – В кН: Методика изучения биогеоценоза внутренних водоемов. М., Наука, 1975, с. 73 – 87.
5. Киселев И. А. Планктон морей и континентальных водоемов. – Л.: Наука, 1969, т. 1, с. 658.
6. Жадин В. И. Методы гидробиологического исследования. – М.: Высшая школа, 1960, с. 189.
7. Киселев И. А. Методы исследования планктона. – В кН.: Жизнь пресных вод СССР. – М. – Л.: Изд-во АН СССР, 1956, Т. 4, вып. 1, 183 – 265.
8. Кожова О. М., Мельник Н. Г. Инструкция по обработке проб планктона счетным методом. – Иркутск; 1978, с. 3 – 18.
9.Киселев. И. А. Изучение планктона водоемов. – В кн.: В помощь работающим на полезащитных лесных полосах. М. – Л. Изд. АН СССР, 1950, с. 40.
10. Балушкина Е. В., Винберг Г. Г. Зависимость между массой тела планктонных ракообразных. В кн.: Экспериментальные и полевые исследования биологических основ продуктивности водоемов. Л., Изд. АН СССР. 1979, с. 58 – 72.
11. Балушкина Е. В., Винберг Г. Г. Зависимость между массой тела планктонных ракообразных. В кн.: Общие основы изучения водных экосистем. Л., Наука, 1979, с. 169 – 172.
12. Вудивисс Ф. Совместные англо-советские биологические исследования в Ноттингеме в 1977 г. – В кн.: Научные основы контроля качества поверхностных вод по гидробиологическим показателям. Труды советско-английского семинара. Л.: Гидрометеоиздат, 1977. с. 132 – 161.
13. Дуплаков С. Н. Материалы к изучению перефитона. – Труды Лимнологической станции в Косине, 1933, вып 16. – 160 с.
14. Абакумов В. А. Контроль качества вод по гидробиологическим показателям в системе гидрометеорологической службы СССР. – В кн.: Научные основы контроля качества поверхностных вод по гидробиологическим показателям. Труды советско-английского семинара. – Л.: Гидрометиоиздат, 1977, с. 93 – 100.
15. Hentschel A. Biologische Untersuchungen uber den tierischen und pilanzlichen Bewuchs in Hamburger Hafen. – Mitt. aus dem Zoologishen Museum. Hamburg, 1916 Bd 30, S 111.
16. Дуплаков С. Н. Исследование процесса обрастания в Глубоком озере. – Труды гидробиологической станции на Глубоком озере. 1925, т. 6, вып. 2, 3, с. 20 – 35.
17. Дуплаков С. Н. Некоторые наблюдения над вертикальным распределением обрастания в глубоком озере. – Труды гидробиологической станции на Глубоком озере, 1928, т. 6, вып. 4, с. 20 – 40.
18.Девяткин. В. Г. Динамика развития альгофлоры обрастаний в Рыбинском водохранилище. – Труды ИБВВ АН СССР. Рыбинск, 1979, № 42/45, с. 78 – 108.
19. Кутикова Л. А. Коловратка фауны СССР (L.) Rotatoria. – Л.: Наука, 1970, - 744 с.
20. Wulfert K. Die Radertiere (Rotatoria). Wittenberg, 1969. – 112 S.
21. Кузьмин Г. В. Фитопланктон
22. Коршиков О. А. Визначник прiсноводных водоростей. УРСР. – Киев. Изд. АН УССР, 1953, т. 5 . – 437 с.
23. Косипская Е. К. Десмидиевые водоросли. – В кн.: Флора споровых растений СССР . М. – Изд. АН СССР, 1960, вып. 1. – 706 с.
24. Курсанов Л. И., Наумов Н. А. Определитель низших растений. М.: Изд. АН СССР, 1953, т. 1. - 396 с.; т. 2. – 310 с.
25. Бруевич С. В. Определение продукции органического вещества в море. – В кн.: Акад. Вернадскому к 50-летию научн. Деятельности. 1936, с. 281 – 300.
26. Verduin J. Photosynthesis in naturally reared aquatic communities. – Plant Physiol., 1951, N 26, p. 45 – 48.
27. Ketchum B. H., Redfield A. C. Some physical and chemical characteristics of alga growth in mass culture. – J. Cellul. and Compar. Physiol., 1949, vol. 3, p. 281 – 299.
28. Riley G. A. Plankton studies. – Long Island Bull. Bingham Oceanogr. Collect., 1941, vol. 7, N 3, p. 1 – 93.
29. Методическое пособие по определению первичной продукции органического вещества в водоемах радиоуглеродным методом/ Под ред. Г. Г. Винберга и др. – Минск. Изд. БГУ, 1969, с. 1 – 26.
30. Руководство по методам биологического анализа морской воды и донных отложений/ Под ред. А. В. Цыбань. – Л.: Гидрометеоиздат, 1980, с. 106 – 121.
31. Федоров В. Д. О методах изучения фитопланктона и его активности. – М., Изд. МГУ, 1979, с. 62 – 129.
32. Хромов В. М., Семин В. А. Методы определения первичной продукции в водоемах. – М., Изд. МГУ, 1975, с. 1 – 123.
33. Gran H. H., Ruud B. Untersuchungen uber die im MMeerwasser gelosten organischen Stoffe und ihr Verhallnis zur Planctonproduction. – Avhandlutg. Norske vid.-acad. Oslo. Mat.-naturvid. 1926, KI. 6, N 1, p. 1 – 14.
34. Винберг Г. Г. К вопросу о балансе органического вещества в водоемах. – Труды Лимнологической станции в Косине, 1934, вып. 18, с. 5 – 24.
35. Steemann-Nielsen E. Measurement of the production of organic matter in the sea by means of carbon-14. – Nature,1951, 4252, p. 1 – 310.
36. Westlake D. F. Comparisons of plant productivity. – Biol. Rev., 1963, N 38, p. 385 – 425.
37. Wetzel R. G. A comparative study of the primary productivity of higher aquatie plants, periphyton and phytoplankton in a large Shallow Lake. – Int. Revue ges. Hydrobiol., 1964, vol 49, p. 1 – 61.
38. Руководство по химическому анализу поверхностных вод суши. – Л.: Гидрометеоиздат, 1977, с. 41 – 125.
39. Кузнецов С. И. Использование радиоактивной углекислоты 14С для определения сравнительной величины фотосинтеза и хемосинтеза. – В кн.: Изотопы в микробиологии. – М.: Изд. АН СССР, 1955, с. 126 – 135.
40. Сорокин Ю. И. О применении радиоуглерода для изучения первичной продукции водоемов. – Труды Всесоюзного гидробиол. об-ва. 1956, вып 7, с. 271 – 286.
41. Винберг Г. Г. Первичная продукция водоемов. – Минск. 1960. – 329 с.
42. Ryther J. H., Yentsch C. S. The estimation of phytoplankton production in the ocean from chlorophyll and light data. – Limnol. And Oceanogr., 1957, vol 2, N 3, 281 – 286.
43. Yentsch C. S. The relationship between chlorophyll and photosynthetie carbon production with referents to the measurement of decomposition products chloroplastic pigment. – Proc. J. B. Symposium Primary Productivity Aquatic Environments, Pallanza, Italy. Cr. Goldman Memoric dell instituto Italiano di Idrobiologia, 1965, vol 18, S. Uppl., p. 323 – 346.
44. Yentsch C. S., Byther G. H. Short-term variations in phytoplankton chlorophyll and their significance. – Limnol. and Oceanogr., 1957, vol. 11, N 2, p. 140 – 142.
45. Pantlie R., Buck H. Die biologishe Uberwachung der Gewasser und die Darstellung der Ergebnisse. – Gas und Wasserfach, 1955, Bd 96, N 18, S. 604.
46. Sladecek V. System of water quality from biological point of view. – Arch. Hydrobiol. Ergebnisse der Limnologie, 1973, Bd 7. – 218 S.
47. Иванова М. Б. Влияние загрязнения на планктонных ракообразных и возможность их использования для определения степени загрязнения рек. – В кн.: Методы биологического анализа пресных вод. Л., Изд. ЗИН АН СССР, 1976, с. 68 – 80.
48. Kolkwitz R., Marsson M. Okologie der pflanzlichen Sapribien. – Berichte der deutchen botanischen geselschaft, 1908, Bd, 26, S. 505 – 519.
49. . Kolkwitz R., Marsson M. Okologie der tierischen Sapribien. – Intern. Revue Ges. Hydrobiol., 1909, vol. 2, p. 126 – 152.
50. Pantle R., Buck H. Die biologische Uberwachung der Gawasswe und die Darstellung der Ergebnisse. – Gas. Und Wasserfach, 1955, Bd. 96, N. 18, S. 604.
51. Pantle R. Biologicke Flussuberwachung. – Wasserwirtschaft, 1956, Bd. 46. N 8, S. 206 – 209.
52. Sladecek V. System of water quality from the biological point of view. – Arch. Hydrobiol, 1973, Bd. 7. – 218 S.
53. Zelinka M., Marwan P. Zur Prazisierung der biologischen Klassification der Reinheit fliessender Gewasser. – Arch. Hydrobiol., 1961, Bd 57, N3, S. 389 – 407.
54. Rothschein J. Biologicke hodnotenie cistoty tokov’a jeho graficke znazornenic. – Biologia, 1959, vol. 14, p. 833 – 842.
Приложение 1
Форма записи пробы зоопланктона в рабочем журнале
Учреждение____________________________________
Водоем__________________________ № створа (станции______________
Местонахождение створа (станции)____________________
Дата_____________________ Время_________________________
|
№ пробы
|
Система сети
|
№ газа
|
Диам. Входного отверстия
|
Горизонт или облавливаемый слой
|
Объем профильтр. воды
|
Температура
|
Прозрачность
|
Визуальная оценка лова
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Форма этикетки пробы зоопланктона
Водоем_______________________ Дата____________________
№ створа (станции)_____________________
Местонахождение створа (станции)________________________
Глубина______________________
Горизонт (облавливаемый слой) или объем профильтрованной (отстойной) воды_________________________
Орудие лова___________________
Приложение 2
Форма записи результатов обработки количественных проб зоопланктона
Учреждение_______________________________
Водоем__________________ № створа (станции)_____________________
Местонахождение створа (станции)_________________________________
Горизонт________________ Количество профильтрованной воды_______
___________ Орудие лова________________ Дата____________________
Прозрачность________________________ Температура_______________
Глубина______________ Множитель перевода на 1 м3_________________
|
№ п/п
|
Вид
|
В порционной пипетке
|
Число экземпляров в пробе
|
Размер, мм
|
В 1 м3
|
Сапробность
|
Примечания
|
|
|
|
I
|
II
|
|
|
Числен-ность
|
биомасса
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Приложение 3
Форма записи результатов обработки проб перифитона в рабочем журнале
Номер пробы_________________
Название водоема___________ Номер свтора__________________
Местоположение створа_________ Дата_________ Субстрат____________
Глубина расположения субстрата (м)_________________________
Расстояние от берега (м)_________________ Температура воды__________
Скорость течения_________________
|
№
|
Видовой состав
|
Зона сапробности
|
h
|
s
|
sh
|
|
|
|
|
|
|
|
Индекс сапробности_______________
Заключение об уровне загрязнения_________________
Примечание. s – сапрбная валентность вида, h – частота встречаемости вида.
Приложение 4
Форма записи при определении первичной продукции и деструкции кислородным методом
Объем титруемой пробы_________мл
|
Примечания
|
|
|
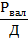
|
|
|
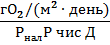
|
|
|
Длина светового дня, ч
|
|
|
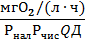
|
|
|
мг О2/л
|
|
|
Количество Na2S4О3 идущее на титрование, мл
|
|
|
Время экспозиции
|
конец
|
|
|
|
начало
|
|
|
№ склянки
|
|
|
Горизонт отбора пробы
|
|
|
Прозрачность по белому диску, м
|
|
|
Местоположение
|
|
|
№ станции
|
|
|
Дата
|
|
Приложение 5
Форма отчетности «Зоопланктон»
|
Оценка качества воды на створе
|
14
|
|
|
|
Индекс сапробности по Пантле и Буку
|
13
|
|
|
|
Массовые виды и выды индикаторы (название, % общей численности
|
12
|
|
|
|
Численность основных групп экз/м3
|
Другие группы
|
11
|
|
|
|
|
веслоногие
|
циклопоиды
|
10
|
|
|
|
|
|
каляпоиды
|
9
|
|
|
|
|
ветвистоусые
|
8
|
|
|
|
|
коловратки
|
7
|
|
|
|
Общая биомасса, мг/м3
|
6
|
|
|
|
Общая численность, тыс. экз./м3
|
5
|
|
|
|
Характристика мета отбора проб
|
Горизонт или облавливаемый слой, м
|
4
|
|
|
|
|
R, км
|
3
|
|
|
|
|
Дата, время отбора
|
2
|
|
|
|
|
№ створа на схеме
|
1
|
|
|
PAGE \* MERGEFORMAT 5
ГИДРОБИОЛОГИЧЕСКИЕ МЕТОДЫ РЫБОХОЗЯЙСТВЕННЫХ ИССЛЕДОВАНИЙ