Парообразование и конденсация. Кипение. Зависимость температуры кипения жидкости от давления. Точка росы
Лекция №
ТЕМА: Парообразование и конденсация. Кипение. Зависимость
температуры кипения жидкости от давления. Точка росы.
План
1. Парообразование и конденсация.
2. Испарение.
3. Насыщенный пар и его свойства.
4. Кипение. Зависимость tкип от давления.
5. Перегретый пар и его применение. Критическое состояние вещества.
6. Влажность воздуха.
1. XIX в. называют «веком пара», так как в это время широкое распространение получили тепловые машины, рабочим веществом которых был пар. В наше время паровые турбины находят применение на теплоэлектростанциях. Для того, чтобы построить такие машины и повысить их ККД необходимо знать свойства рабочего вещества – пара.
Свойства пара используются в разных приборах. Изучение свойств пара привело к возможности получить сжиженные газы и их широкому применению.
Знания о свойствах паров необходимы и в метеорологии.
Таким образом, изучение данного материала имеет большое практическое значение.
Парообразование и конденсация.
Переход вещества из жидкого состояния в газообразное называется парообразованием, а переход вещества из газообразного состояния в жидкое называется – конденсацией.
Парообразование сопровождается U; конденсация сопровождается U
испарения
Парообразование
происходит в виде кипения
2. Парообразование, которое происходит только со свободной поверхности жидкости, которая является границей с газообразной средой или с вакуумом, называется испарением.
Испарение происходит при любой температуре; со свободной поверхности жидкости отлетают молекулы, кинетическая энергия которых больше потенциальной энергии взаимодействия.
Ек< Ек2> Ек1
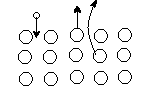
Чтобы выйти из жидкости, молекула должна выполнить работу за счет уменьшения своей Ек . Покинуть жидкость могут лишь молекулы, у которых Ек > Авыхода (работа, которая выполняется из преодоления сил притяжения между молекулами). Так как жидкость покидают лишь молекулы с большой Ек, а остаются с малой Ек, то среднее значение энергии Е для молекул, которые остаются уменьшается, то есть жидкость охлаждается. Например: этим объясняется холод при выходе из воды; если дуть на ладонь.
Наряду с этим существуют молекулы, которые возвращаются в жидкость, передавая ей часть своей кинетической энергии – Ек , при этом внутренняя энергия жидкости увеличивается (жидкость нагревается).
ИСПАРЕНИЕ КОНДЕНСАЦИЯ ПРОИСХОДЯТ ОДНОВРЕМЕННО.
- Если преобладает испарение – жидкость охлаждается.
- Если преобладает конденсация – жидкость нагревается.
Скорость испарения зависит:
1. От рода жидкости (эфир, вода).
2. От площади свободной поверхности.
3. С Т скорость испарения возрастает.
4. Чем меньше плотность пара жидкости над ее поверхностью, тем больше скорость испарения.
3. Пары, которые насыщают и не насыщают пространство.
а). В открытом сосуде преобладает процесс испарения,
так как пар относится движением воздуха.
б). В герметично закрытом сосуде количество
молекул, которые покидают жидкость за единицу
времени = количеству молекул, которые
возвращаются в жидкость за то же самое время
(конденсация), то есть наступает динамическое
равновесие. при Т = const
Пар, который находится в состоянии подвижного (динамического) равновесия со своей жидкостью, называется паром, насыщающим пространство, или насыщенным паром.
Именно такой пар содержится над поверхностью жидкости в закрытом сосуде. Давление насыщенного пара зависит только от температуры.
Пар, который находится над поверхностью жидкости, когда процесс испарения преобладает над процессом конденсации, и пар при отсутствии жидкости называется ненасыщенным паром.
Свойства паров, насыщающих пространство: ЕПОС, рпара
1. Давление и плотность насыщенного пара зависит от его Т.
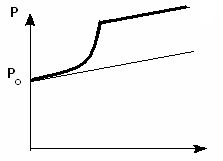
2. Не подчиняется закону Шарля (так как mconst, V = const) и масса насыщенного пара при изохоричном процессе изменяются.
3. Не выполняется закон Бойля - Мариотта (Т = const), при Т = cons рнас пара не зависит от объема, плотность насыщенного пара не изменяется (так как масса газа насыщенного пара изменяется).
Свойства паров, ненасыщающих пространство.
К ненасыщенному пару можно применить законы идеального газа лишь в тех случаях, когда пар далек от насыщенности.
Насыщенный пар возможно превратить в ненасыщенный – изохоричным нагревом (изотермическое расшрение).
Ненасыщенный насыщенный – путем изохоричного охлаждения (изотермическое сжатие).
Опыты показывают, если пар не сталкивается с жидкостью, его можно охладить ниже температуры, при которой он становится насыщенным, а жидкость при этом так и не образуется. Такой пар называется перенасыщенным. Объясняется это тем, что для образования пара в жидкости необходимы центры конденсации. Обычно, то пылинки или «+» ионы, которые притягивают к себе молекулы пара, что ведет к образованию маленьких капелек.
4. ПРОЦЕСС КИПЕНИЯ.
Парообразование, которое происходит в объеме всей жидкости при постоянной температуре, называется кипением.
При кипении во всем объеме жидкости образуются быстро растущие пузырьки пара, которые всплывают на поверхность. Температура остается неизменной (Т=const).
Условие кипения – кипение начинается при температуре, при которой давление насыщенного пара в пузырьках сравнивается с давлением в жидкости.
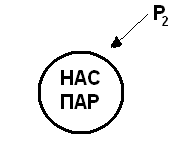
В жидкости всегда существует растворимый газ, который выделяется на дне и стенках сосуда.
С повышением температуры, давление насыщенного пара возрастает, пузырек растет в объеме и под действием Fарх всплывает, если t поверхностного слоя жидкости ниже, в пузырьке газ конденсируется, давление падает, пузырек захлопывается (микровзрыв). Этим поясняется шум воды, перед тем как она начинает закипать.
Когда температура жидкости сравнивается, пузырек всплывает на поверхность.
ЗАВИСИМОСТЬ Ткип ОТ ДАВЛЕНИЯ:
1. Чем выше внешнее давление, тем выше Т кипения.
Например. Паровой котел: р = 1,6 · 106 Па, а вода не кипит даже при 200°С (автоклав).
2. Уменьшение внешнего давления ведет к снижению Ткип.
Например. Горы: h = 7134 м ; р = 4·104 Па; tводы = 70°С
3. У каждой жидкости своя Ткип , которая зависит от давления насыщенного пара. Чем выше давление насыщенного пара, тем ниже Ткип соответствующей жидкости.
Температура кипения жидкости при нормальном атмосферном давлении наз. точкой кипения (норм условия : t = 0°С , р = 760 мм рт ст. = 101300 Па, Мвозд = 0,029 кг/моль).
? Как рассчитать количество теплоты, необходимой для превращения жидкости в пар?
Qжид = сm (tкип – t1); Qпар = m·r ; Q = Qжид + Qп = сm (tкип – t1) + m·r
r- Количество теплоты, которая необходима для превращения 1кг жидкости в пар (или пара в жидкость), при постоянной температуре, которая равна температуре кипения называется удельной теплотой парообразования. (Qпар = m·r)
r – Зависит: 1. От рода вещества.
2. От внешних условий.
отдан = получ уравнение теплового баланса
Перегретый пар и его применение.
Пар, который получают „в чане”, потом нагревают до высокой температуры, а потом уже направляют в паровую турбину, называют сухим или перегретым. Так как вместе с температурой увеличивается давление пара, то сильно перегретый пар называют паром высокого давления.
После того, как пар выполнит работу в турбине, он еще имеет высокую температуру и большой запас энергии. Поэтому с (ТЭЦ) отработанный пар передается на предприятия и жилые дома для отопления.
Критическое состояние вещества.
Чтобы перевести пар в жидкость, необходимо повысить давление и снизить его температуру.
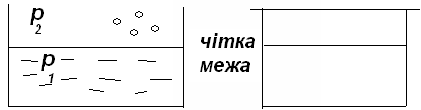 грани не видно
грани не видно
Так как 1> 2
При увеличении температуры плотность уменьшается для жидкости, а плотность пара возрастает, и различие между ними становится менее заметным. Если температура будет очень высокой, грань исчезнет.
Критической температурой (tкр) вещества называется такая температура, при которой плотность жидкости и плотность насыщенного пара становятся одинаковыми.
Давление насыщенного пара какого-либо вещества при его tкр наз. критическим давлением. 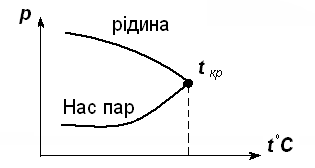
При критической температуре свойства жидкости и насыщенного пара становятся неразличимыми, это означает, что при tкр вещество может существовать только в одном состоянии, которое называют газообразным и в этом случае никаким увеличением давления превратить его в жидкость невозможно. Если вещество находится при tкр и ркр, то ее состояние называют критическим состоянием.
СЖАТИЕ ГАЗОВ И ИХ ПРИМЕНЕНИЕ В ТЕХНИКЕ.
Газ возможно перевести в жидкое состояние, если его температура ниже критической (Остан 1908- гелий).
В машинах для сжатия газов используются охлажденные газы в процессе их адиабатического расширения. Предварительно газ сильно сжимают компрессором, теплота отводится. В процессе адиабатического расширения сам газ выполняет работу и еще больше охлаждается. Превращается в жидкость. Сжатые газы сохраняют в сосудах Дьюара. Это сосуд с двойными стенками, между которыми – вакуум, для уменьшения теплопроводности стенки покрыты ртутной амальгамой. Жидкие газы широко применяют в промышленности и научных опытах.
Свойства вещества изменяются при низких температурах:
- свинец становится упругим;
- резина – хрупкой.
Изучение свойств вещества при низких температурах привело к открытию сверхпроводимости.
ВЛАЖНОСТЬ ВОЗДУХА.
В воздухе всегда содержится определенное количество водяного пара. Если водяного пара много, мы говорим, что воздух влажный, если мало – сухой.
Величина, характеризующая содержание водяных паров в разных частях атмосферы Земли называется влажностью воздуха.
Давление, которое оказывал бы водяной пар, если бы остальные газы отсутствовали, наз. парциальным давлением водяного пара.
Для количественной оценки влажности воздуха используют абсолютную и относительную влажность воздуха.
Абсолютной влажностью воздуха называется плотность водяного пара или давление пара, который находится в воздухе /1м/при данной температуре.
Относительной влажностью воздуха называется отношение парциального давления водяного пара, который содержится в воздухе, к давлению насыщенного водяного пара при той же температуре.
- Относительная влажность воздуха показывает, сколько % составляет абсолютная влажность а от плотности водяного пара н, насыщенного воздуха при данной температуре.
а - плотность водяного пара
н - плотность насыщенного пара
Температура, при которой воздух в процессе своего охлаждения, становится насыщенным водяным паром, называют точкой росы.
Приборы для определения влажности воздуха: гигрометр и психрометр.
Вопросы для самоконтроля:
1. Дайте определение процессов парообразования и конденсации?
2. Какими путями происходит процесс парообразования?
3. Поясните принцип охлаждения и нагрева жидкости.
4. От чего зависит скорость испарения жидкости?
5. Что такое динамическое равновесие?
6. Кипение – это ….?
7. При каком условии какая-либо жидкость начинает кипеть?
8. Как зависит температура кипения вещества от давления?
9. Как рассчитать количество теплоты, необходимой для преобразования жидкости в пар?
10. Влажность воздуха - это …
11. Как рассчитать относительную влажность воздуха?
12. Дайте определение точки росы.
Литература
1. Дмитрієва В.Ф. Фізика: Навч. посіб..- К.: Техніка, 2008.-648 с.: іл..( §63 -§67, §69-70)
2. Владкова Р.А., Добронравов В.Є., Збірник задач і питань з фізики: Навч. посіб.- М.: Наука, 1988.-384 с.
Вопросы для закрепления темы.(ответить усно)
1. Почему мокрое белье, скошенная трава высыхают быстрее в ветреную погоду
2. Почему температура воды в открытых водоемах летом всегда ниже
температуры окружающей среды?
3. Почему человек, который вышел из воды, ощущает холод, и в ветреную погоду
это ощущение сильнее?
4. Чем объяснить, что в резиновой одежде тяжело переносить жару?
Такая одежда не дает влаге, которая образовалась под ней, испаряться в
окружающий воздух, организм человека перегревается.
5. Может ли испаряться твердое тело?
6. Почему вода тушит огонь? Что быстрее потушит пламя – кипяток или
холодная вода?
7. Почему барометр «падает» перед дождем
8. Как изменяется абсолютная и относительная влажность воздуха при его
нагреве?
Парообразование и конденсация. Кипение. Зависимость температуры кипения жидкости от давления. Точка росы