Химическая связь. Характеристики химической связи: энергия, длина, валентный угол. Типы химической связи. Полярность связи
PAGE 13
Лебедев Ю.А. Лекция 02
Лекция №02
Химическая связь. Характеристики химической связи: энергия, длина, валентный угол. Типы химической связи. Полярность связи. Квантово-механические представления о природе ковалентной связи. Понятие о методе валентных связей. Гибридизация атомных орбиталей.  - (cигма) и
- (cигма) и  (пи)-связи. Геометрическая конфигурация молекул. Электрический момент диполя молекулы. Понятие о методе молекулярных орбиталей. Энергетические диаграммы образования молекулярных орбиталей для бинарных гомоядерных молекул. Сигма (
(пи)-связи. Геометрическая конфигурация молекул. Электрический момент диполя молекулы. Понятие о методе молекулярных орбиталей. Энергетические диаграммы образования молекулярных орбиталей для бинарных гомоядерных молекул. Сигма ( ) и Пи(
) и Пи( )-молекулярные орбитали. Диа- и парамагнитные молекулы.
)-молекулярные орбитали. Диа- и парамагнитные молекулы.
НАПОМИНАНИЕ
- Уравнение Шредингера. - волновая функция.
Е=f(n,l,m,s).
Химическая связь. Характеристики химической связи: энергия, длина, валентный угол.
Мы рассмотрели структуру электронных уровней изолированных атомов. Это – весьма редкие в практике объекты. Единственное исключение – это инертный газ аргон с электронной формулой 1s22s22p63s23p6. И хотя его в атмосфере «только» 0,93% об, каждый из вас за один вдох буквально «заглатывает» около трехсот квинтиллионов штук атомов аргона.
Все остальные вещества и материалы, с которыми мы имеем дело, содержат химически связанные атомы. Взаимодействие свободных атомов друг с другом приводит к образованию молекул, ионов и кристаллов. Это – «классические» химические объекты. Однако в последнее время важную роль приобрели такие объекты, как наноструктуры, поверхностные соединения, бертоллиды и ряд других, практически важных «неклассических» химическх объектов.
Химическая связь обусловлена взаимодействием электронов внешних электронных оболочек атомов. Те орбитали, которые принимают участие в образовании химической связи, называются валентными орбиталями, а находящиеся на нах электроны – валентными электронами.
При образовании химической связи изменяются свойства взаимодействующих атомов и, прежде всего, энергия и заполненность их внешних орбиталей.
При образовании химической связи суммарная энергия электронов на валентных орбиталях меньше, чем их энергия в свободных атомах. Эта разница в энергиях называется энергией химической связи.
Типичная величина энергии химической связи – это сотни кДж/моль.
Важной количественной характеристикой химической связи является ее длина. Длина связи – это расстояние между ядрами химически связанных атомов в стабильном состоянии молекулы.
Типичная длина химической связи – это десятые доли нанометра.1
Если в образовании молекулы при взаимодействии с данным атомом принимают участие два и более других атомов, то возникает вопрос о её геометрической структуре или химическом строении. Основы теории химического строения молекул положил А.М.Бутлеров 2
Одной из важнейших количественных характеристик строения сложных молекул является валентный угол - угол, образованный двумя направлениями химических связей, исходящими из одного атома.
Типы химической связи. Полярность связи.
По характеру взаимодействия валентных электронов и типу образующихся в ходе взаимодействия орбиталей, химические связи подразделяются на следующие основные типы: ковалентные (полярные и неполярные), ионные, донорно-акцепторные, водородные и межмолекулярные (называемые также ван-дер-ваальсовскими).
Ещё в 1916 году американский химик Г.Н.Льюис 3 высказал идею о том, что химическая связь образуется электронной парой, которая графически изображается валентной чертой:
F + F = F2 (F-F).
Если электроотрицательности атомов равны, то такая связь называется неполярной. Если различны – полярной.
При образовании полярной ковалентной связи атомы приобретают дополнительный заряд – отрицательный у атома с большей электроотрицательностью и положительный – у атома с меньшей электроотрицательностью:
H+Cl = HCl (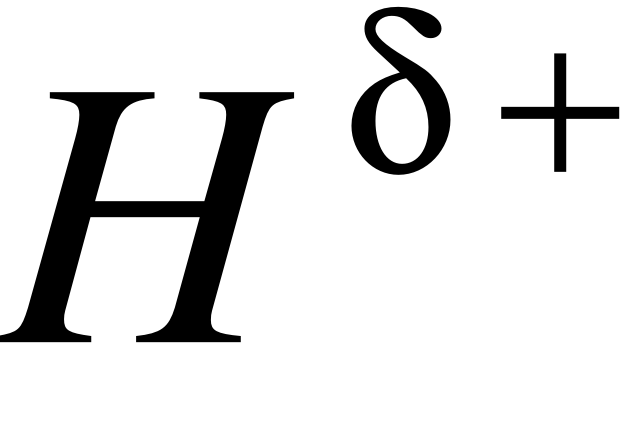 –
– 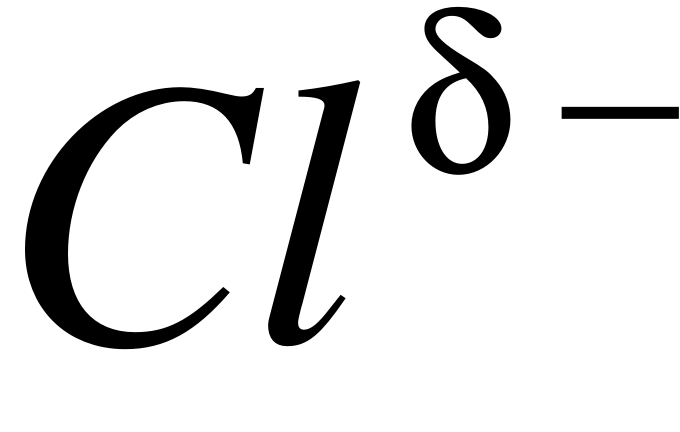 )
)
В случае, когда разница электроотрицательностей взаимодействующих атомов велика, связь считается ионной:
Na + Cl = NaCl (Na+Cl-).
Если электронная пара, образующая связь, до взаимодействия принадлежала одному из атомов, то такая связь называется донорно-акцепторной. Атом, который предоставил электронную пару называется донором, а принявший ее на свободную орбиталь – акцептором.
Особенно характерно возникновение донорно-акцепторных связей d- металлами, имеющими свободные или частично заполненные d-орбитали с образованием комплексных соединений.
О других видах связи мы поговорим позже.
Квантово-механические представления о природе ковалентной связи.
С современной точки зрения ковалентная связь возникает при квантово-механическом взаимодействии всех электронов всех взаимодействующих атомов. Но, как мы уже говорили на лекции №1, точного решения уравнения Шредингера, описывающего орбитали многих электронов в молекулах, нет. Облегчает задачу квантово-механического описания химической связи то, что при ее образовании роль электронов, находящихся на внутренних и внешних электронных оболочках, существенно различна.
Поэтому удалось создать различные приближенные методы описания химической связи.
Квантовая химия имеет богатый арсенал прикладных программ, позволяющих проводить расчеты с большой точностью для широкого класса молекул и ионов.4
Однако универсального и достаточно точного квантово-химического алгоритма пока нет.
Для качественного понимания структуры химических соединений используются два метода – метод валентных связей (МВС) и метод молекулярных орбиталей (МО).
Понятие о методе валентных связей. Геометрическая конфигурация молекул. Электрический момент диполя молекулы.
Основными постулатами метода валентных связей являются:
1. Одинарная ковалентная химическая связь осуществляется двумя валентными электронами, которые занимают две орбитали – по одной от каждого из взаимодействующих атомов. При этом у образующих валентную пару электронов спины должны быть противоположными (связь образуют электроны с антипараллельными спинами).
2. Исходные атомные орбитали (АО) сохраняют свой абрис и в составе молекулы.
3.Связь образуется за счет перекрытия орбиталей, приводящего к увеличению электронной плотности между ядрами взаимодействующих атомов в направлении, обеспечивающем максимальное перекрытие.
Рассмотрим образование химической связи по МВС в молекуле водяного пара – H2O.
Молекула состоит из одного атома кислорода O и двух атомов водорода H. Электронная формула атома кислорода 1s22s22p4. На внешнем энергетическом уровне находятся 6 электронов. Подуровень 2s является заполненным. На подуровне 2p на одной из p-орбиталей (положим, py,) находится электронная пара, а на двух других (px и pz) – по одному неспаренному электрону. Именно они и будут участвовать в образовании химической связи.
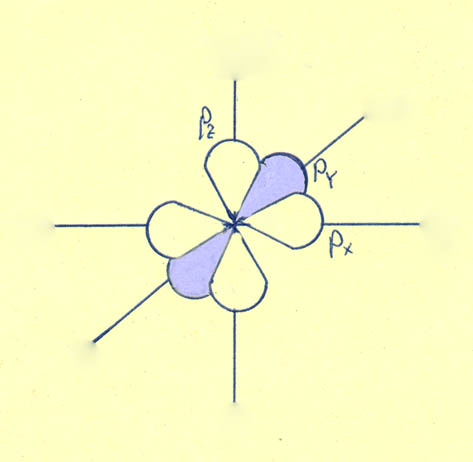
Электронная формула атома водорода 1s1. У водорода один s-электрон, абрис орбитали которого сфера, и он будет участвовать в перекрытии с p-орбиталью кислорода, образуя химическую связь. Всего таких sp-перекрытий в молекуле воды будет два. И структура молекулы будет выглядеть так:
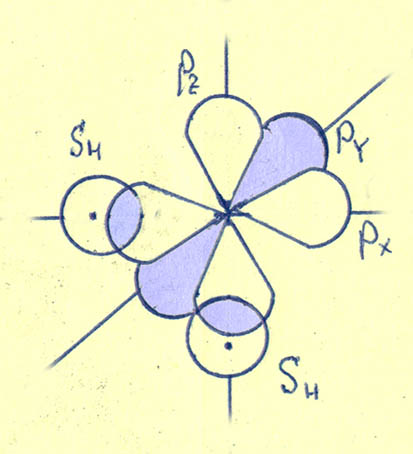
Как видно из рисунка, в молекуле воды имеется две ковалентные химические связи, направленные по осям Z и X. Следовательно, валентный угол в этой модели равен 90о. Эксперимент свидетельствует – этот угол равен 104,5o.
Совсем неплохое совпадение для простейшей качественной модели без всяких расчетов!
Электроотрицательность кислорода по Малликену – 3,5, а водорода – 2,1. Следовательно, каждая из связей будет полярной, причем заряд 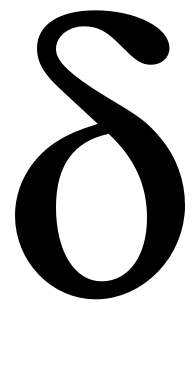 - будет на кислороде, а
- будет на кислороде, а 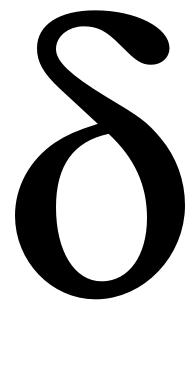 + - на водороде, т.е. образуются три центра электрического заряда. В молекуле образуются два электрических диполя.
+ - на водороде, т.е. образуются три центра электрического заряда. В молекуле образуются два электрических диполя.
Диполь – это два равных по величине заряда, расположенные на конечном расстоянии l друг от друга. Диполь характеризуется дипольным моментом 
 =
= 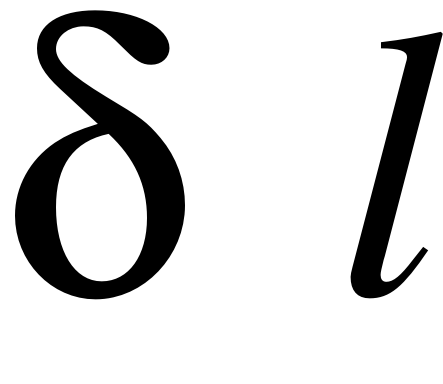
Диполь является вектором, направленным от отрицательного полюса к положительному. В молекуле воды образуются два дипольных момента связей, которые при сложении дают общий дипольный момент молекулы. Схема дипольных моментов молекулы воды по модели МВС имеет вид:
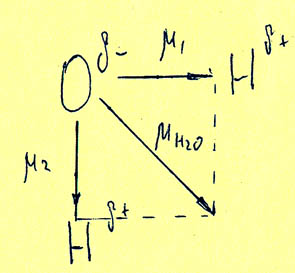
Важно подчеркнуть, что дипольные моменты связей складываются векторно и суммарный дипольный момент зависит от геометрии молекулы. Как видим, в данном случае, из-за того, что связи направлены под прямым углом друг к другу, молекула в целом оказывается полярной. И эксперимент подтверждает это – дипольный момент молекулы воды равен 1,84 Дебая. (1 Дебай равен 0,33*10-29Кл*м)
Геометрическая структура связей в молекулах может быть весьма разнообразной. Связи могут располагаться как на плоскости, так и в пространстве, образуя молекулы в виде объемных тел различной конфигурации (тригональные, тетрагональные, гексагональные пирамиды, бипирамиды, кольца, составленные из пирамид и т.д.)
Подробнее о взаимосвязи структуры химических связей и геометрией молекул нужно прочитать в учебнике [1] на стр. 119 –128).
 - (cигма) и
- (cигма) и  (пи)-связи.
(пи)-связи.
Вернемся к перекрытию орбиталей при образовании связей. В нашем примере область максимального перекрытия s и p-орбиталей лежит на линии, соединяющей центры атомов. Такой вид перекрытия получил название  -связи.
-связи.
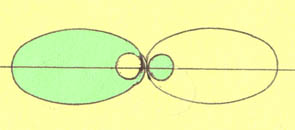
Рассмотрим другой случай – молекулу кислорода O2. Как мы уже видели, атом кислорода имеет две p-орбитали, на которых находятся электроны, способные образовать химическую связь. Хорошо известная структурная формула кислорода O=O. В молекуле кислорода – двойная связь. Одна из них – это только что рассмотренная  -связь. А вторая? Оказывается, что вторая связь образуется за счет другого типа перекрытия орбиталей, которое называется
-связь. А вторая? Оказывается, что вторая связь образуется за счет другого типа перекрытия орбиталей, которое называется  -связью.
-связью.
Понятие о  и
и  связях выдвинул Ф.Хунд.
связях выдвинул Ф.Хунд.
При образовании  -связи орбитали перекрываются таким образом, что образуются две области перекрытия, причем располагаются они симметрично относительно плоскости, на которой лежат ядра взаимодействующих атомов.
-связи орбитали перекрываются таким образом, что образуются две области перекрытия, причем располагаются они симметрично относительно плоскости, на которой лежат ядра взаимодействующих атомов.
Геометрически это выглядит так:
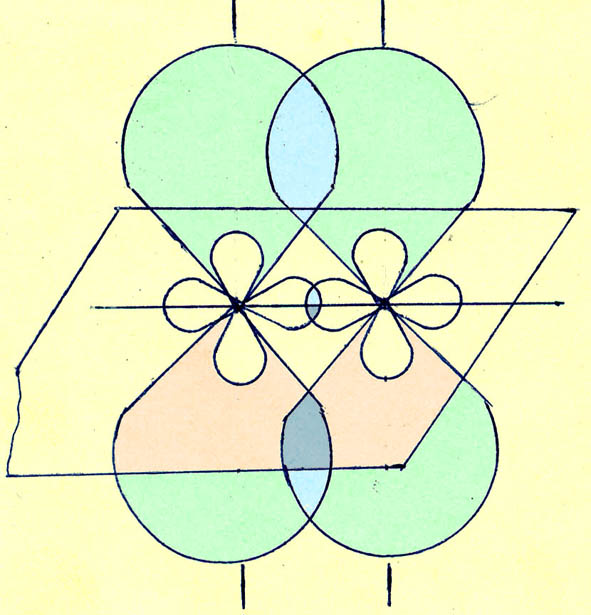
Обратите внимание на то, что  -связь образована меньшими по объему частями p-орбиталей, в которых плотность «электронного облака» больше, а потому эта связь прочнее
-связь образована меньшими по объему частями p-орбиталей, в которых плотность «электронного облака» больше, а потому эта связь прочнее  -связи. Действительно, эксперимент показывает, что в соединениях углерода этане С2H6 (CH3-CH3 – одна
-связи. Действительно, эксперимент показывает, что в соединениях углерода этане С2H6 (CH3-CH3 – одна  -связь), этилене C2H4 (CH2= CH2 - одна
-связь), этилене C2H4 (CH2= CH2 - одна  -связь и одна
-связь и одна  -связь) и ацетилене С2H2 (CНСH - одна
-связь) и ацетилене С2H2 (CНСH - одна  -связь и две
-связь и две  -связи) энергия их разрыва соответственно равна 247, 419 и 515 кДж/моль.
-связи) энергия их разрыва соответственно равна 247, 419 и 515 кДж/моль.
Теперь мы можем дополнить список постулатов МВС:
4. Если в молекуле образуются кратные (двойные и тройные) связи, то одна из них будет  -связью, а другие -
-связью, а другие -  -связями).
-связями).
Отметим, что в соединениях d- и f-металлов возможно образование ещё одного типа связей -  -связей, когда перекрытие происходит в четырех пространственных областях и плоскость симметрии перпендикулярна линии, соединяющей ядра атомов.
-связей, когда перекрытие происходит в четырех пространственных областях и плоскость симметрии перпендикулярна линии, соединяющей ядра атомов.
Гибридизация атомных орбиталей.
При образовании химических связей может происходить важное явление, которое называется гибридизацией орбиталей.
Рассмотрим атом бериллия Be. Его электронная формула – 1s22s2. Судя по тому, что все электроны бериллия являются спаренными, такой атом должен вести себя химически подобно инертным газам – не вступать в химические взаимодействия.
Однако, посмотрим внимательно на электронографическую диаграмму атома бериллия:
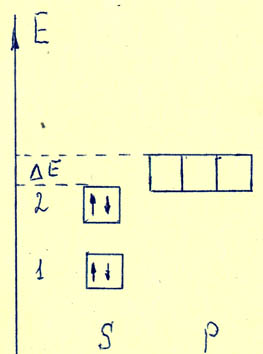
Из диаграммы видно, что атом бериллия имеет кроме заполненной 2s-орбитали ещё три свободных 2p-орбитали! Правда, энергия этих орбиталей больше, чем энергия 2s-орбитали на величину  E. Но эта энергия невелика и меньше той, которая высвобождается при образовании химической связи. Поэтому атом стремится перестроить свои орбитали в ходе взаимодействия для достижения энергетически выгодного конечного состояния. Для такой перестройки используется кинетическая энергия взаимодействующих с данным атомом частиц. Подробнее об этом источнике энергии мы будем говорить при обсуждении вопросов химической кинетики.5
E. Но эта энергия невелика и меньше той, которая высвобождается при образовании химической связи. Поэтому атом стремится перестроить свои орбитали в ходе взаимодействия для достижения энергетически выгодного конечного состояния. Для такой перестройки используется кинетическая энергия взаимодействующих с данным атомом частиц. Подробнее об этом источнике энергии мы будем говорить при обсуждении вопросов химической кинетики.5
Такая перестройка получила название гибридизации орбиталей, поскольку в ходе этого процесса из «двух сортов» орбиталей возникает новый.
На языке волновых функций это описывается уравнением, связывающим гибридную волновую функцию получившихся орбиталей с исходными волновыми функциями.
Количество образовавшихся гибридных орбиталей равно количеству орбиталей, принявших участие в процессе гибридизации.
Графически этот процесс может быть изображен следующей диаграммой:
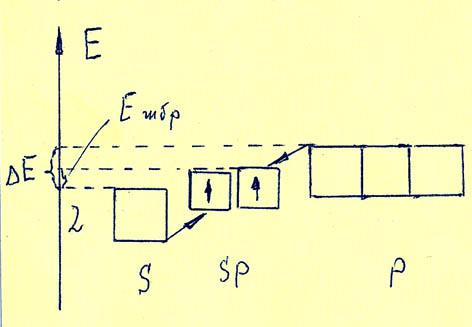
Отметим, что энергия, необходимая для гибридизации Eгибр меньше, чем разница энергий гибридизирующихся орбиталей E.
В обозначении гибридных орбиталей сохраняются обозначения исходных орбиталей. Так, в данном случае (атом Be), гибридизируются одна s и одна p-орбиталь, и обе гибридные орбитали обозначаются как sp-орбитали. Необходимость гибридизации только двух орбиталей связана с тем, что у атома бериллия на внешнем энергетическом уровне только два электрона.
В других случаях, когда в гибридизации участвуют несколько одинаковых орбиталей, их количества отмечаются показателем степени. Например, при гибридизации одной s и двух p-орбиталей получаются три sp2-орбитали, а при гибридизации одной s и трех p-орбиталей – четыре sp3 орбитали.
В рассматриваемом случае в соответствии с правилом Хунда атом бериллия получает два неспаренных электрона и способность образовать две ковалентные химические связи.
Гибридные орбитали, образованные s, p и даже d-орбиталями мало отличаются по форме и выглядят так («несимметричная гантель»):
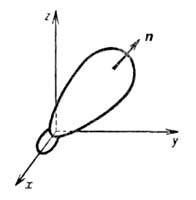
Отметим, что количество гибридных орбиталей равно количеству орбиталей, участвующих в их создании вне зависимости от количества и типа гибридизирующихся орбиталей.
Расположение гибридных орбиталей в пространстве определяется их количеством.
Конкретно у атома бериллия две гибридные sp-орбитали расположены вдоль одной прямой (под углом 180o), что соответствует стремлению занимающих их одноименно заряженных электронов максимально удалиться друг от друга:
Подробнее о методе валентных связей и гибридизации можно прочесть здесь:
http://center.fio.ru/method/resources/Alikberovalyu/2004/stroenie/gl_10.html#104
Часто в молекулах имеются орбитали, занятые электронной парой («неподеленная электронная пара»). Такие орбитали не принимают участия в образовании химических связей, но влияют на геометрическую структуру молекулы.
Модификация МВС, учитывающая влияние таких орбиталей, называется теорией отталкивания электронных пар валентных орбиталей (ОЭПВО) и познакомиться с ней можно по учебнику [1] на стр.124 – 128.
Понятие о методе молекулярных орбиталей.
Мы рассмотрели явление гибридизации АО в рамках МВС. Оказалось, что идея гибридизации является плодотворной и при более глубоком моделировании химических связей. Она является основой второго метода их описания, который рассматривается в нашем курсе – метода молекулярных орбиталей (МО).
Главным постулатом этого метода является утверждение о том, что АО взаимодействующих друг с другом атомов утрачивают свою индивидуальность и образуют обобщенные МО, т.е. что электроны в молекулах «принадлежат» не какому-то конкретному атому, а квантово-механически движутся по всей молекулярной структуре.
Существует несколько разновидностей метода МО, учитывающих большее или меньшее число факторов и, соответственно, более или менее сложных математически. Наиболее простым является приближение, которое учитывает только линейные эффекты взаимодействия электронов. Это приближение называется методом МО ЛКАО (линейной комбинации атомных орбиталей).
На языке квантовой механики это утверждение для простейшего случая взаимодействия двух орбиталей записывается так:
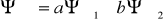
где  - волновая функция МО,
- волновая функция МО, 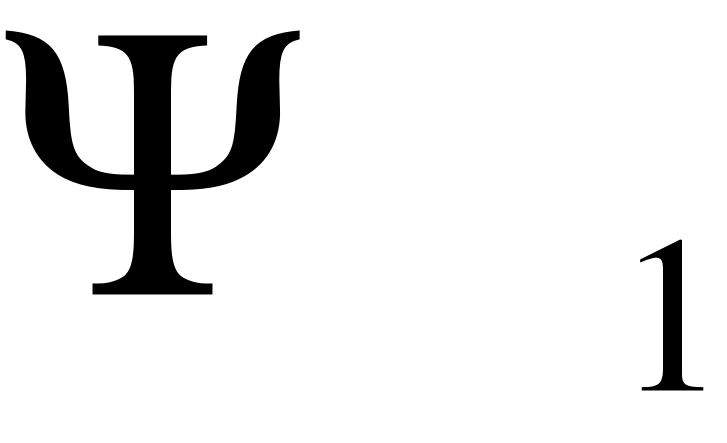 - волновая функция АО первого атома,
- волновая функция АО первого атома, 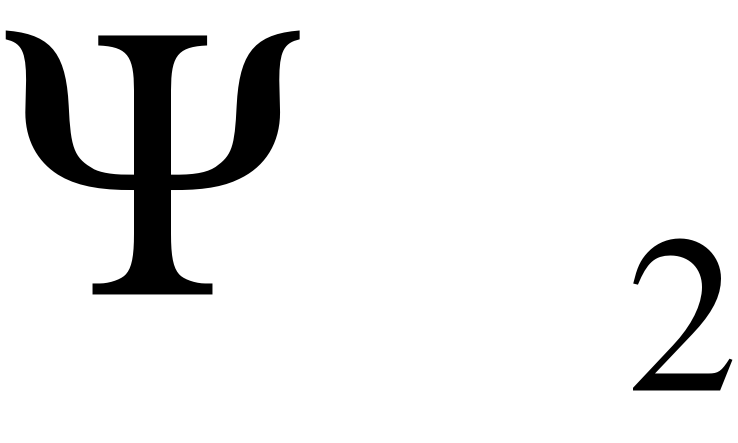 - волновая функция АО второго атома, a и b – численные коэффициенты, характеризующие вклад данной АО в общую структуру МО.
- волновая функция АО второго атома, a и b – численные коэффициенты, характеризующие вклад данной АО в общую структуру МО.
Поскольку в правой части записан линейный многочлен, эта модификация метода МО и получила название ЛКАО.
Из уравнения видно, что при взаимодействии двух АО получаются две МО. Одна из них называется связывающей МО, а другая – разрыхляющей МО.
Почему они получили такое название, ясно из рисунка, на котором изображена энергетическая диаграмма орбиталей в молекуле:
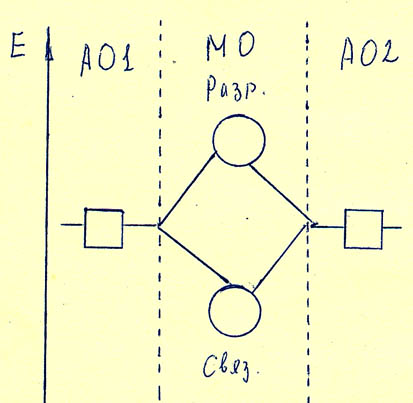
Как видно из рисунка, связывающая МО имеет энергию меньшую, чем энергии исходных АО, а разрыхляющая – большую. (Соответственно, ). Естественно, в соответствии с принципом минимальной энергии электроны в молекуле будут при образовании связи в первую очередь занимать связывающую орбиталь.
В общем случае, при взаимодействии N AO получается N MO.
Сигма ( ) и пи(
) и пи( )-молекулярные орбитали.
)-молекулярные орбитали.
В результате количественных расчетов по методу МО ЛКАО выяснилось, что введенные в методе МВС понятия о  и
и  видах симметрии орбиталей сохраняются и в методе МО ЛКАО.
видах симметрии орбиталей сохраняются и в методе МО ЛКАО.
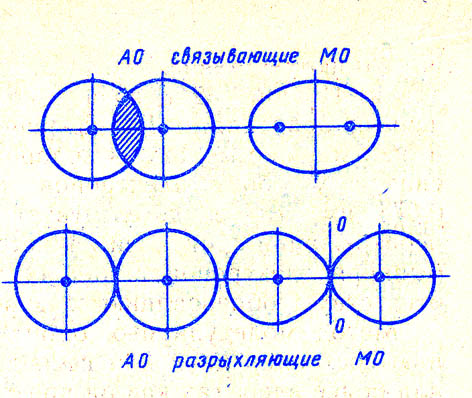
Вот как выглядят абрисы  -связывающих (обозначаются как
-связывающих (обозначаются как  или ) и
или ) и  -разрыхляющих (обозначаются как или ) орбиталей в методе МО ЛКАО:
-разрыхляющих (обозначаются как или ) орбиталей в методе МО ЛКАО:
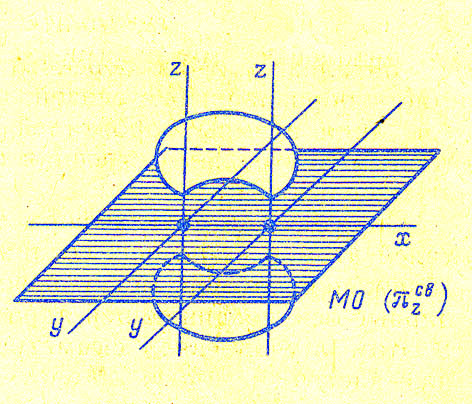
А вот как выглядят абрисы  - связывающих (
- связывающих ( ) и
) и  -разрыхляющих (
-разрыхляющих ( *) орбиталей методе МО ЛКАО:
*) орбиталей методе МО ЛКАО:
Энергетические диаграммы образования молекулярных орбиталей для бинарных гомоядерных молекул.
Расчет энергии молекулярных орбиталей для сложных молекул, в состав которых входят ядра различных элементов (гетероядерных молекул) является сложной вычислительной задачей даже для современных компьютеров. Поэтому каждый расчет индивидуальных молекул является отдельной творческой работой.
Тем не менее оказалось, что энергетическая диаграмма для бинарных гомоядерных молекул элементов второго периода Периодической системы Д.И.Менделеева является универсальной и имеет вид:
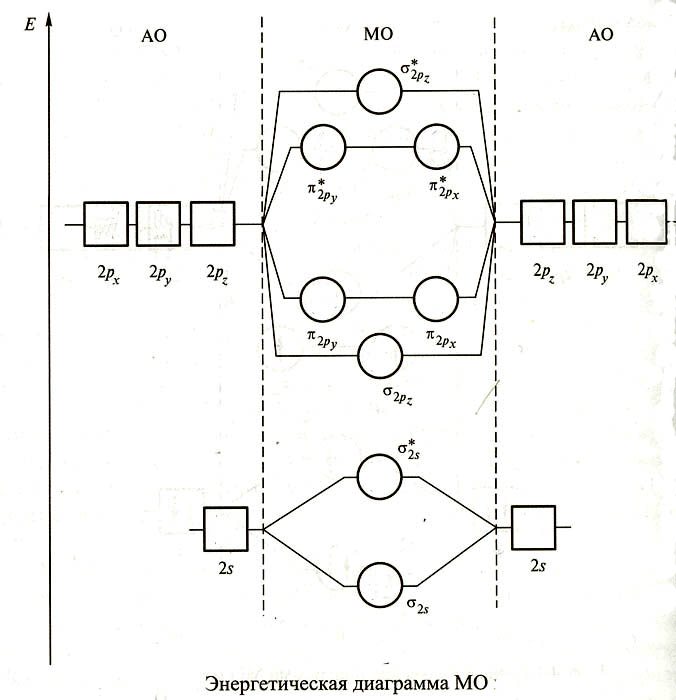
Иногда в литературе приводятся разные диаграммы для элементов B,C,N и последующих O,F,Ne, однако исследования магнитных свойств молекулы B2 при сверхнизких температурах не подтверждают однозначно необходимости усложнения вида энергетических диаграмм для B,C,N.
Диа- и парамагнитные молекулы. Кратность связей по МО ЛКАО.
Одним из серьезных преимуществ метода МО ЛКАО по сравнению с методом ВС является более правильное описание магнитных свойств молекул и, в частности, объяснение парамагнетизма молекулярного кислорода.6
Вспомним структуру молекулы кислорода по МВС, рассмотренную нами ранее. В соответствии с этой структурой все валентные электроны и  и
и  -связей в молекуле O2 образуют электронные пары и суммарный спин молекулы равен нулю.
-связей в молекуле O2 образуют электронные пары и суммарный спин молекулы равен нулю.
Структура орбиталей этой молекулы по методу МО ЛКАО, полученная заполнением электронами МО в соответствии с приведенной выше энергетической диаграммой имеет вид:
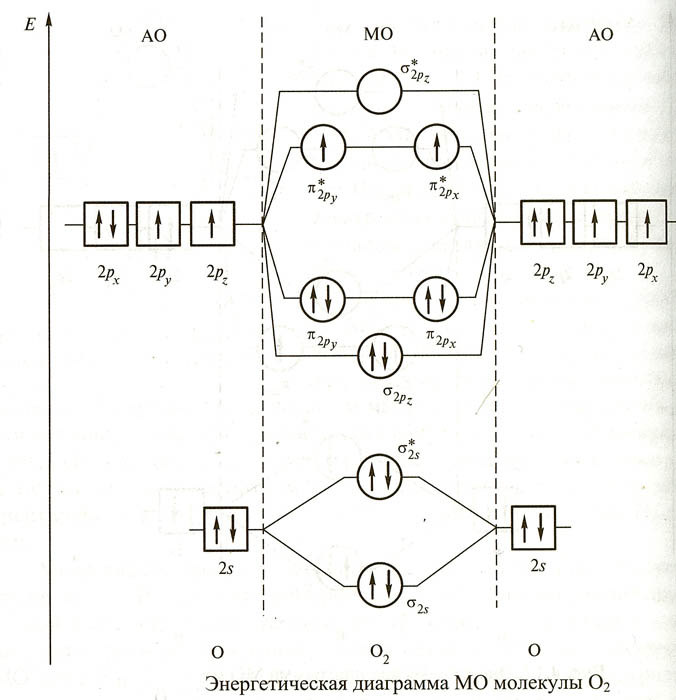
Как видно из этой диаграммы, в молекуле кислорода присутствуют два неспаренных электрона на разрыхляющих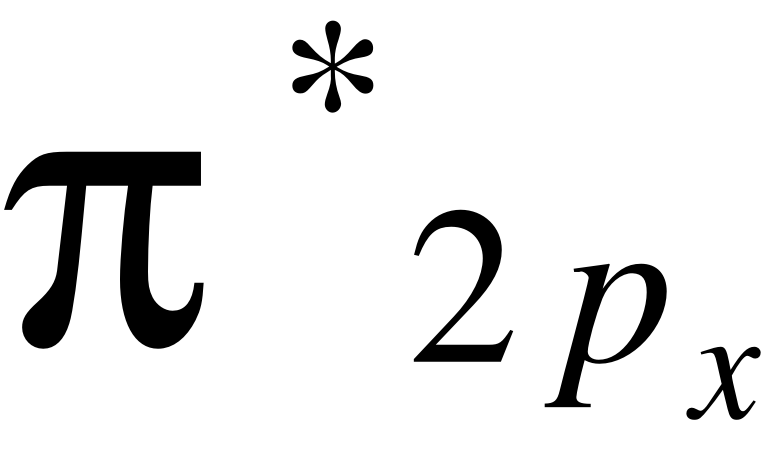 и
и 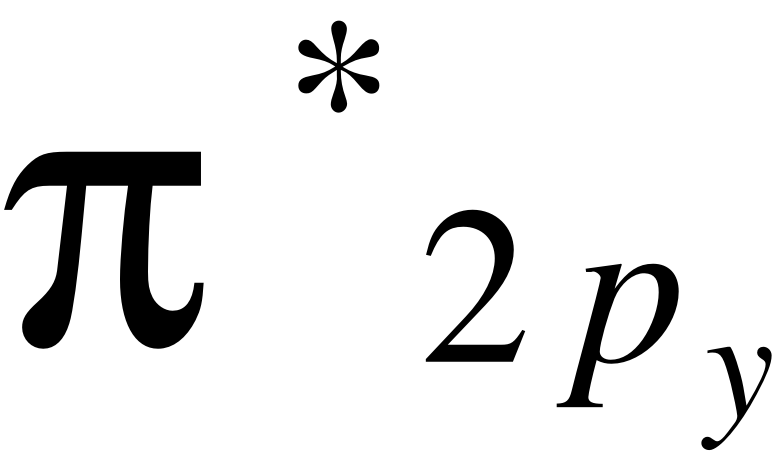 орбиталях. Их магнитные моменты складываются и дают суммарный магнитный момент молекулы. Эксперимент показывает, что магнитный момент молекулы кислорода равен 2,8
орбиталях. Их магнитные моменты складываются и дают суммарный магнитный момент молекулы. Эксперимент показывает, что магнитный момент молекулы кислорода равен 2,8  (Собственный магнитный момент электрона – 1
(Собственный магнитный момент электрона – 1  ). Учитывая, что полный магнитный момент кроме собственного электронного включает в себя и орбитальный, количественное совпадение весьма убедительно свидетельствует в пользу справедливости именно метода МО.
). Учитывая, что полный магнитный момент кроме собственного электронного включает в себя и орбитальный, количественное совпадение весьма убедительно свидетельствует в пользу справедливости именно метода МО.
При наличии магнитного момента вещество становится парамагнетиком – оно «притягивается магнитом».7 При отсутствии магнитного момента вещество диамагнитно – оно «выталкивается» магнитным полем.8
Кроме магнитных свойств анализ энергетических диаграмм МО ЛКАО дает возможность определить кратность (или порядок) химической связи (КС или ПС).
КС= (Nсвяз – Nразр)
где Nсвяз – общее число электронов на связывающих орбиталях; Nразр – общее число электронов на разрыхляющих орбиталях).
Мы рассмотрели различные случаи проявления и описания ковалентных химических связей. Это основной вид химической связи, поскольку причина ее возникновения – наличие валентных электронов – есть у подавляющего большинства химических элементов.
Однако в некоторых случаях взаимодействия атомов возникают особые условия, которые порождают особые виды связи, которые мы рассмотрим на следующей лекции.
Дополнительные материалы
1 Одним из парадоксов процессов образования химических связей является обнаруженное экспериментально возникновение более длинных, чем при обычных условиях, химических связей при пониженных температурах. Это явление объясняется тем, что при низких температурах возможно существование электронов на орбиталях с большим значением n. Энергия связи таких электронов с атомом очень мала и при повышенных температурах электроны легко покидают эти орбитали, а при низких температурах могут существовать на них и образовывать химическую связь. Об экспериментах в этой области можно прочесть здесь http://www.ng.ru/science/2007-02-14/13_atoms.html.
2 Александр Михайлович Бутлеров
О нем см. http://ru.wikipedia.org/wiki/%D0%91%D1%83%D1%82%D0%BB%D0%B5%D1%80%D0%BE%D0%B2_%D0%90%D0%BB%D0%B5%D0%BA%D1%81%D0%B0%D0%BD%D0%B4%D1%80_%D0%9C%D0%B8%D1%85%D0%B0%D0%B9%D0%BB%D0%BE%D0%B2%D0%B8%D1%87
3 Гилбер Ньютон Льюис
О нем см. http://ru.wikipedia.org/wiki/%D0%9B%D1%8C%D1%8E%D0%B8%D1%81_%D0%93%D0%B8%D0%BB%D0%B1%D0%B5%D1%80%D1%82_%D0%9D%D1%8C%D1%8E%D1%82%D0%BE%D0%BD
4 В интернете существуют специальные сайты, где можно получить расчетные программы для решения конкретных квантово-химических задач. Список сайтов – здесь http://www.mavicanet.com/directory/rus/4159.html
5 В случае свободного атома эта энергия может быть «занята» и у равновесного теплового излучения (если атом находится в среде с достаточно высокой температурой), и у физического вакуума в соответствии с соотношением неопределенностей Гейзенберга для энергии и времени. Расчеты показывают, что равновесное тепловое излучение комнатной температуры способно обеспечить необходимую для гибридизации атома бериллия энергию.
6 Интересная информация о других необычных свойствах кислорода – здесь http://perst.isssph.kiae.ru/Inform/perst/2006/6_19/n.asp?file=perst.htm&label=D_6_19_4
7 Точнее, втягивается в область большей напряженности неоднородного магнитного поля.
8 Перемещается из области с высокой напряженностью неоднородного магнитного поля в область низкой напряженности.
Химическая связь. Характеристики химической связи: энергия, длина, валентный угол. Типы химической связи. Полярность связи