Определение фурацилина методом йодометрического титрования и спектрофотометрии
КУРСОВАЯ РАБОТА
по дисциплине «Аналитическая химия и ФХМА»
на тему:
Определение фурацилина методом йодометрического титрования и спектрофотометрии
ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ……………………………………………………………………….3
ОБЩИЕ СВЕДЕНИЯ…………………………………………………….5
Гетероциклические соединения……………………………………………5
Фуран как простейший представитель гетероциклов……………..6
ИССЛЕДУЕМЫЙ ПРЕПАРАТ………………………………………………..8
Общая характеристика…………………………………………………..8
Лекарственные формы…………………………………………………….8
Фармакологическое действие…………………………………………….8
Показания к применению…………………………………………………..9
Способ применения и дозы………………………………………………..9
Противопоказания………………………………………………………….9
Побочное действие…………………………………………………………9
Передозировка……………………………………………………………….9
Взаимодействие с другими лекарственными средставми……….9
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ ПРЕПАРАТА МЕТОДОМ ЙОДОМЕТРИЧЕСКОГО ТИТРОВАНИЯ………………………………….10
Теоретические основы метода…………………………………………10
Методика выполнения анализа………………………………………….14
Экспериментальные данные и математическая обработка результатов………………………………………………………………………………16
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ФУРАЦИЛИНА МЕТОДОМ СПЕКТРОФОТОМЕТРИИ……………………………………18
Теоретические основы метода…………………………………………18
Методика выполнения анализа………………………………………….19
Экспериментальные данные и математическая обработка результатов………………………………………………………………………………20
ВЫВОДЫ………………………………………………………………..23
БИБЛИОГРАФИЧЕСКИЙ СПИСОК………………………………24
ВВЕДЕНИЕ
Фурацилин, или нитрофурал – антисептическое средство местного действия, является производным 5-нитрофурана. Противомикробная активность этого класса химических соединений впервые была замечена в 1944 г. и сразу привлекла внимание медиков.
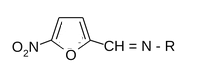
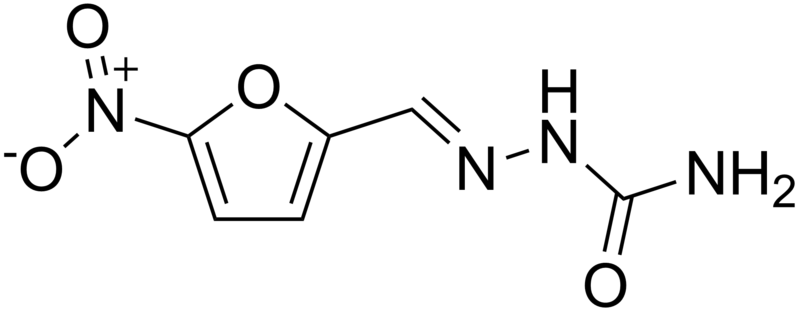
Химическое название фурацилина: семикарбазон 5-нитрофурфурола
Актуальность исследования. Фурацилин по-прежнему представляет практический интерес в медицине. Препарат используется как жидкость для промывания и очищения ран, благодаря своим антисептическим свойствам замедляет или останавливает рост микробной флоры. Используется также при ожогах, пролежнях и мелких повреждениях кожи. Назначается как для приёма внутрь, так и для наружного применения.
Объектом исследования данной работы является количественный анализ препарата.
Предметом исследования является фурацилин.
Цель исследования: определить содержание фурацилина в растворе методом йодометрического титрования и спектрофотометрии.
Задачи:
- описание исследуемого препарата;
- изложение сущности методов определения;
- получение экспериментальных данных и их математическая обработка.
- ОБЩИЕ СВЕДЕНИЯ
- Гетероциклические соединения
Гетероциклические соединения (гетероциклы) — органические соединения, содержащие циклы, в состав которых наряду с углеродом входят и атомы других элементов.
Особенности реакционной способности гетероциклических соединений обуславливается именно гетерозаместителями. В качестве гетероатомов чаще всего выступают элементы второго периода (N, O) и S, реже — Se, P, Si и др. элементы. Наиболее специфические свойства гетероциклических соединений проявляют ароматические гетероциклические соединения В отличие от атомов углерода карбоциклических ароматических соединений, гетероатомы могут отдавать в ароматическую систему не только один (гетероатомы пиридинового типа), но и два (гетероатомы пиррольного типа) электрона. Гетероатомы пиррольного типа обычно входят в состав пятичленных циклов (пиррол, фуран, тиофен). В одном гетероцикле могут сочетаться оба типа гетероатомов (имидазол, оксазол). Особенности реакционной способности гетероароматических соединений определяются распределением электронной плотности в цикле, которая, в свою очередь, зависит от типов гетероатомов и их электроотрицательности.
Гетероциклические соединения широко распространены в живой природе и играют важную роль в химии природных соединений и биохимии. Функции, выполняемые этими соединениями весьма широки — от структурообразующих полимеров (производные целлюлозы и других циклических полисахаридов) до коферментов и алкалоидов.
Некоторые гетероциклические соединения получают из каменноугольной смолы (пиридин, хинолин, акридин и пр.) и при переработке растительного сырья (фурфурол). Многие природные и синтетические гетероциклические соединения — ценные красители (индиго), лекарственные вещества (хинин, морфин, акрихин, пирамидон). Гетероциклические соединения используют в производстве пластмасс, как ускорители вулканизации каучука, в кинофотопромышленности.
- Фуран как простейший представитель гетероциклов
Фуран – простейший представитель пятичленного гетероцикла с формулой . Представляет собой бесцветную горючую жидкость, нерастворимую в воду, с неприятным специфическим запахом.
Фуран в первый раз искусственно был получен Лимприхтом в 1870 г. сухой перегонкой бариевой соли пирослизевой кислоты. Найден он также в первых погонах при сухой перегонке сосновой древесины. Название свое он получил от слова furfur — отруби, при перегонке которых в 1849 г. Фаунес выделил вещество, названное им фурфуролом и оказавшееся впоследствии альдегидом фуранкарбоновой или пирослизевой кислоты.
1.2.1 Получение фурана.
В последние годы широкое распространение получила реакция декарбонилирования фурфурола, пригодная не только для лабораторного, но и для промышленного получения фурана. Декарбонилирование производится путем приливания фурфурола к расплавленной смеси едкого натра и едкого калия или пропусканием его паров над нагретой натронной известью. Удобные лабораторные методы получения фурана основаны на декарбоксилировании фуран-2-карбоновой кислоты. Декарбоксилирование производится сухой перегонкой бариевой соли или же нагреванием этой соли с натронной известью.
1.2.2 Химические свойства фурана
На фуран не действует металлический натрий и с ним не соединяется, что указывает на отсутствие в его частице гидроксилов. С фенилгидразином он также не соединяется. С соляной кислотой очень энергично реагирует с образованием бурого вещества, строение которого ближе не установлено. Отличным реагентом на фуран может служить сосновая лучинка, смоченная соляной кислотой, которая от паров фурана окрашивается в зеленый цвет.
Свойства фурана определяются наличием кольцевого секстета p-электронов, образованных 4 p-электронами двух связей С = С и неподеленной электронной пары гетероатома; другая неподеленная пара электронов атома кислорода остается свободной и может участвовать в образовании оксониевых соединений. Для фурана характерны р-ции электроф. замещения: галогенирование, нитрование, сульфирование, ацилирование, причем низкая устойчивость цикла требует проведения этих р-ций в "мягких" условиях, например:
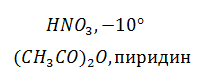
Формилирование фурана приводит к образованию фурфурола – буреющей на воздухе жидкости со всеми свойствами ароматических альдегидов, из которого в дальнейшем можно получить нитрофурал, или фурацилин.
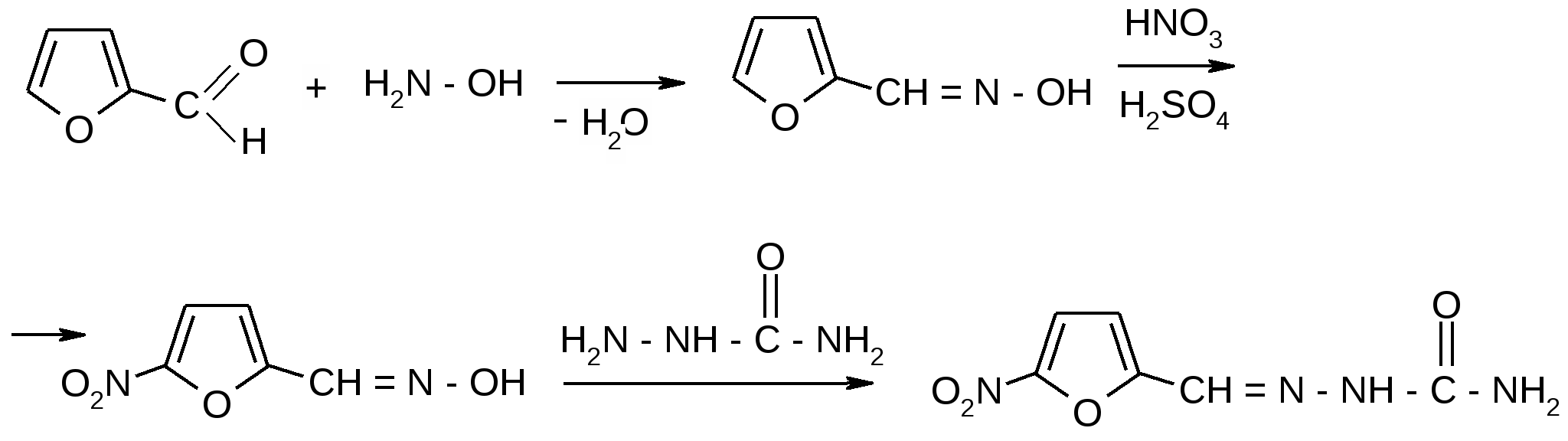
Схема получения нитрофурала из фурфурола:
- ИССЛЕДУЕМЫЙ ПРЕПАРАТ
- Общая характеристика
Фурацилин представляет собой мелкокристаллический порошок жёлтого или жёлто-зелёного цвета горького вкуса. Очень мало растворим в воде (при нагревании растворимость повышается), мало растворим в спирте, растворим в щелочах, практически нерастворим в эфире. Нитрофурановые соединения чувствительны к свету, поэтому разбавленные растворы следует оберегать от дневного света, особенно сильное влияние оказывает ультрафиолетовое излучение, приводящее к глубокому и необратимому разрушению молекулы.
- Лекарственные формы
- Аэрозоль.
- Раствор для наружного применения (водный).
- Раствор для наружного применения (спиртовой).
- Мазь.
- Таблетки по 0,02 г. для приготовления раствора для наружного применения.
- Таблетки по 0,1 г. для приёма внутрь.
- Фармакологическое действие
Является противомикробным средством. Воздействует путем формирования из белков микробной клетки высокоактивных аминопроизводных, в результате чего разрушается или деформируется четвертичная и третичная структура белка, нарушаются обменные процессы и клетка погибает. Препарат эффективен в отношении как грамположительных, так и грамотрицательныхбактерий, а также против некоторых вирусов и простейших . Действие нитрофуранов связано с наличием в молекуле ароматической нитрогруппы, имеющейся и в молекуле левомицетина (хлорамфеникола). Устойчивость микроорганизмов к препарату развивается медленно и не достигает высокой степени.
- Показания к применению
Хронический гнойный отит, инфицированные раны, язвы, ожоги, пролежни; стоматиты, ангины; конъюнктивит.
- Способ применения и дозы
Местно наружно в виде водного 0,02 % (1:5000) или спиртового 0,066 % (1:1500) растворов. Раствором орошать раневую поверхность или смачивать повязку. Также применяется для промывания полостей. В виде мази накладывать на раневую поверхность. В виде аэрозоля орошать раневую поверхность или полость.
Высшая разовая доза 0,1 г. Высшая суточная доза 0,5 г.
- Противопоказания
Дерматозы, индивидуальная непереносимость, кровотечение.
- Побочные действия
Дерматит, аллергические реакции, , тошнота.
- Передозировка
Не выявлена.
- Взаимодействие с другими лекарственными средствами.
Негативные взаимодействия с другими лекарственными средствами не описаны.
- КОЛИЧЕСТВЕННЫЙ АНАЛИЗ ПРЕПАРАТА МЕТОДОМ ЙОДОМЕТРИЧЕСКОГО ТИТРОВАНИЯ.
- Теоретические основы метода.
Йодометрическое титрование является одним из методов окислительно-восстановительного титрования.
Йод имеет несколько степеней окисления и в растворе может существовать в виде нескольких частиц: I-, I2, IO32-.
Йод кристаллический плохо растворим в воде и хорошо растворим
в спирте. Для увеличения его растворимости в воде растворение ведут в йодиде калия, где он образует комплексное соединение – трийодид-ион I- I2 = I3- , проявляющее окислительные свойства:
I3- + 2e 3I- .
Эту реакцию чаще всего пишут в упрошенном виде, а именно:
I2 +2e 2I- ; = +0,54 В.
Раствор йода обычно готовят приблизительной концентрации
(0,05–0,1 моль/дм3), а затем перед использованием его концентрацию устанавливают по подходящему стандартному раствору (тиосульфат натрия, оксид мышьяка (III)). Растворы йода неустойчивы, так как йод – это летучее вещество, а также действует на резиновые и корковые пробки. Йодид–ионы легко окисляются кислородом воздуха:
4I- + O2 + 4H+ 2I2 + 2H2O.
Эта реакция ускоряется на свету, при нагревании и в присутствии кислот, поэтому раствор йода хранят «на холоду» и в темных бутылях с притертой стеклянной пробкой.
Определение восстановителей (SO32-, S2O32-, S2-, SCN-, AsO33-, Cr2+, HCHO, N2H2) проводят методом прямого титрования раствором I2 (йодиметрия).
Na2SO3 + I2 + 2 NaOH = Na2SO4 + 2NaI + H2O
H2S + I2 = S + 2HI
Для случаев, когда вещество реагирует с раствором йода медленно, используют метод обратного титрования (по остатку): вводят фиксированный избыток йода в раствор, оставляют его на 5–7 минут (закрытый часовым стеклом), а затем остаток йода оттитровывают раствором тиосульфата натрия.
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
Для определения окислителей (Cu2+, Fe3+, Mn3+, Mn (IV), Pb (IV), As (V)) применяют титрование по замещению (йодометрия): к анализируемому раствору приливают раствор KI и выделившийся I2 титруют раствором тиосульфата натрия. Количество образовавшегося йода химически эквивалентно количеству окислителя:
2Cu2+ + 4I- = 2CuI + I2
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
Раствор тиосульфата натрия в иодометрическом методе является титрантом. Он проявляет свойства восстановителя:
2S2O32- - 2e S4O62- , = +0,09 В.
Тиосульфат натрия не является первичным стандартом в силу того,
что его растворы неустойчивы при хранении, мутнеют за счет поглощения CO2 из воздуха (выделяется элементарная сера):
S2O32- + H2O+CO2 HCO3- + HS2O3– HCO3– + HSO3– + S
В присутствии сильных кислот, на свету и при уменьшении концентрации тиосульфата натрия разложение ускоряется:
S2O32- + H+ HS2O3– HSO3– + S
В присутствии серобактерий тиосульфат натрия разлагается на сульфит, сульфат и элементарную серу, поэтому его раствор с молярной концентрацией эквивалента ~ 0,1 хранят в темных, закрытых бутылях.
Стандартизуют раствор тиосульфата натрия с использованием первичных стандартов (KIO3, КВrO3, K2Cr2O7), выделяющих при взаимодействии с избытком йодид-ионов известное количество йода, которое титруют раствором Na2S2O3.
K2Cr2O7 + 6KI + 7H2SO4 = 3I2 + Cr2(SO4)3 + 4K2SO4 + 7H2O
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
Концентрацию тиосульфата рассчитываем по закону эквивалентов:
.
Существует несколько способов определения конечной точки при титровании йодом. При титровании бесцветных растворов достаточно интенсивной является собственная окраска трийодид-иона: 1 капля раствора йода молярной концентрации эквивалента 0,1 моль/дм3 окрашивает 100 см3 раствора в желтый цвет.
Наиболее широко используемым индикатором в йодметрии является свежеприготовленный 0,1– ный % раствор крахмала, придающий раствору, содержащему следы йода, интенсивную синюю окраску. Раствор крахмала при прямом титровании йодом добавляют в начале, а в остальных методах – в конце титрования, т.е. когда йода в растворе осталось малое количество (раствор из бурого стал бледно-желтым), так как крахмал, добавленный в раствор с высокой концентрацией йода, разрушатся с образованием продуктов, являющихся не полностью обратимыми индикаторами. Титрование продолжают до исчезновения синей окраски крахмала.
Источники ошибок в йодометрических методах
- Окисление йодид-иона кислородом воздуха:
4I- + O2 + 4H+ 2I2 + 2H2O
скорость этой реакции очень мала, поэтому при титровании удалять растворенный кислород из всех растворов не обязательно. Для удаления растворенного кислорода из растворов к ним добавляют бикарбонат натрия или продувают углекислый газ.
- Летучесть выделившегося йода. Для того чтобы избежать ошибок
за счет летучести йода, растворы хранят в закрытых сосудах и избегают
их нагревания, а при косвенном титровании после добавления KI колбы
с раствором закрывают часовым стеклом и оставляют в темноте на 5–7 минут,
а затем быстро титруют.
- Разложение растворов тиосульфата натрия.
- Щелочные растворы. В щелочных растворах происходит образование гипоиодита:
I2 + OH- HOI + I-
3HOI+ 3OH- IO3- + 2I- +3H2O
В связи с этим титрование тиосульфатом натрия необходимо вести при
рН=7–10, а если необходимо титрование в кислой среде, то титрование ведут очень медленно при тщательном перемешивании.
- Преждевременное добавление крахмала. Правильный способ применения крахмала в качестве индикатора описан выше.
- Методика выполнения анализа.
Приготовление и стандартизация раствора тиосульфата натрия ().
Раствор тиосульфата натрия готовят объёмом ~ 250 см3 с молярной концентрацией эквивалента ~ 0,05 моль/дм3 из раствора с молярной концентрацией эквивалента ~ 0,1 моль/дм3 путем разбавления дистиллированной водой в соотношении 1:1.
Стандартизацию раствора Na2S2O3 проводят по первичному стандарту дихромата калия титрованием по замещению, методом пипетирования.
В коническую колбу для титрования вместимостью 250 см3 помещают
15 см3 H2SO4 , добавляют 25 см3 KI, если раствор приобрел слабо-желтую окраску, его обесцвечивают, добавляя 1 каплю тиосульфата натрия, затем добавляют аликвоту 10,00 см3 стандартного раствора K2Cr2O7 с молярной концентрацией эквивалента 0,1000 моль/дм3. Колбу для титрования закрывают часовым стеклом и выдерживают в темном месте в течение 5–7 минут. Затем обмывают часовое стекло небольшим количеством дистиллированной воды и титруют выделившийся йод раствором тиосульфата натрия без индикатора
от бурой до зеленовато-желтой окраски раствора. Далее к раствору приливают 2 см3 раствора крахмала и продолжают титрование до исчезновения сине-фиолетовой окраски. Результаты титрования заносят в таблицу 1
Реакция: K2Cr2O7+6KJ+7H2SO4=4K2SO4+Cr2(SO4)3+6J+7H2O
Приготовление и стандартизация раствора йода (.
Раствор тиосульфата натрия готовят объёмом ~ 250 см3 с молярной концентрацией эквивалента ~ 0,05 моль/дм3 из раствора с молярной концентрацией эквивалента ~ 0,1 моль/дм3 путем разбавления дистиллированной водой в соотношении 1:1. Результаты титрования приведены в таблице 2.
Схема титрования:
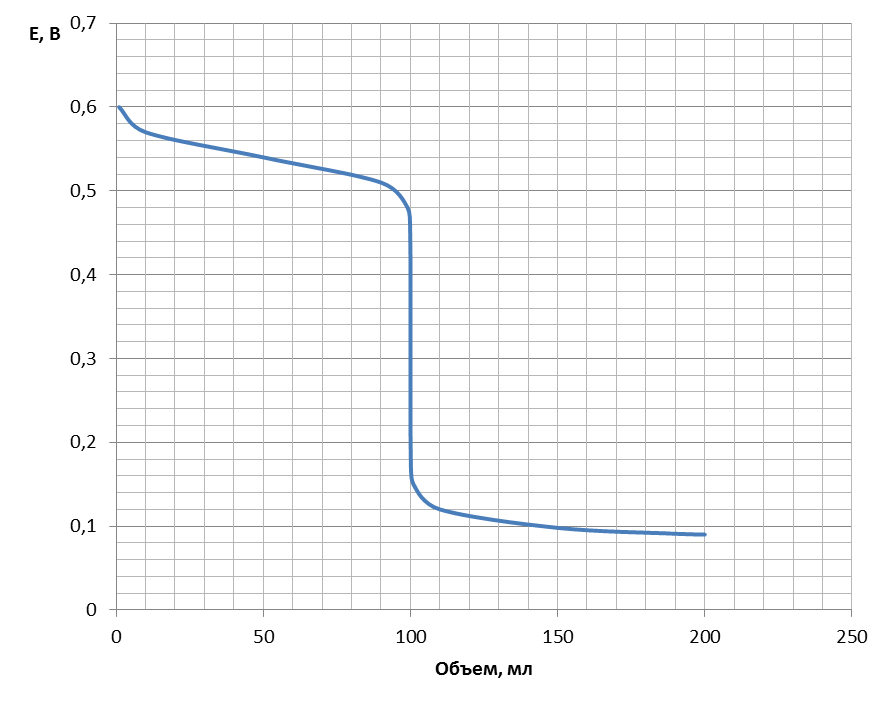
Кривая титрования приведена в приложении 1.
Для анализа необходим раствор йода с концентрацией . Для этого берем 50 мл (аликвоту) раствора йода с концентрацией 0,04475 , переносим в мерную колбу вместимостью 250 мл и доводим водой до метки. Аналогично готовим раствор тиосульфата натрия
Приготовление раствора фурацилина.
С помощью аналитических весов звешиваем 10 таблеток фурацилина и определяем среднюю массу одной таблетки (. Растираем 10 таблеток фурацилина и берем точную навеску 0,8000 г порошка. В мерную колбу на 100,00 мл количественно переносим навеску и добавляем 70 мл воды. Нагреваем раствор на водяной бане при температуре 70-80 С до полного растворения фурацилина. Полученный раствор охлаждаем и доводим водой до метки.
Практическая масса навески:
Определение содержания фурацилина в исследуемом препарате.
В колбу для титрования вместимостью 150,00 мл вносят 5 мл раствора йода, прибавляют 2 капли NaOH (0,1Н) и 5 мл приготовленного раствора фурацилина. Оставляют на 1-2 минуты в темном месте. Затем к раствору прибавляют 2 мл разведенной серной кислоты и выделившийся йод титруют раствором тиосульфата натрия. Индикатор-крахмал. Данные заносят в таблицу 3.
3.3 Экспериментальные данные и математическая обработка результатов.
Таблица 1
|
№ опыта
|
V, мл
J2
|
V, мл
Na2S2O3
|
Концентрация йода
|
|
1
|
10,00
|
8,3
|
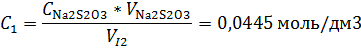
|
|
2
|
10,00
|
8,4
|
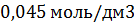
|
|
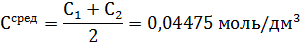
|
|
№ опыта
|
V, мл
K2Cr2O7
|
V, мл
Na2S2O3
|
Концентрация тиосульфата
|
|
1
|
10,00
|
9,3
|
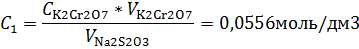
|
|
2
|
10,00
|
9,2
|
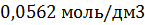
|
|
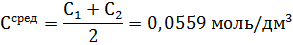
|
Таблица 2
Таблица 3
|
№ опыта
|
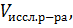
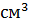
|
,
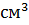
|
m фурацилина, г
|
|
1
|
5,00
|
1,6
|
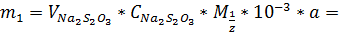
г
|
|
2
|
5,00
|
1,8
|
0,01786 г
|
|
3
|
5,00
|
1,7
|
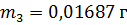
|
|
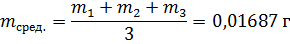
|
Математическая обработка
Количество препарата на среднюю массу таблетки.
Таблица 4
|
Масса фурацилина по результатам титрования, г
|
0,01587
|
0,01786
|
0,01687
|
|
Содержание препарата на среднюю массу таблетки, г
|
0,0195
|
0,0219
|
0,0207
|
Среднее арифметическое:
Рассчитываем погрешность
- КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ФУРАЦИЛИНА МЕТОДОМ СПЕКТРОФОТОМЕТРИИ.
- Теоретические основы метода.
Фотометрический метод анализа основан на способности определяемого вещества поглощатьэлектромагнитное излучение оптического диапазона. Концентрацию поглощающего вещества определяют, измеряя интенсивность поглощения. Поглощение при определенной длине волны является информацией о качественном и количественном составе определяемого вещества и составляет аналитический сигнал. Фотометрический анализ относится к молекулярному абсорбционному анализу, т. е. анализу основанному на поглощении света молекулами анализируемого вещества и сложными ионами в ультрафиолетовой (УФ), видимой и инфракрасной (ИК) областях спектра. В настоящих указаниях рассматриваются метода анализа, основанные на избирательном поглощении электромагнитного излучения в видимой и ультрафиолетовой областях спектра: фотоколориметрия и спектрофотометрия.
Спектрофотометрический метод анализа — основан на поглощении монохроматического излучения, т. е. излучения с одной длиной волны в видимой и УФ областях спектра.
Фотоколориметрический метод анализа — основан на поглощении полихроматического (немонохроматического) излучения, т. е. пучка лучей с близкими длинами волны в видимой области спектра. Фотоколориметрию используют в основном для анализа окрашенных растворов.
Оба метода основаны на общем принципе — пропорциональной зависимости между светопоглощением и концентрацией определяемых веществ.
Фотометрические методы определения концентрации веществ в растворах основаны на сравнении поглощения или пропускания света стандартными и исследуемыми растворами. Степень поглощения света фотометрируемых раствором измеряют с помощью фотоэлектроколориметров и спектрофотометров. Измерение оптической плотности производят по отношению к раствору сравнения(нулевого раствора). В качестве раствора сравнения чаще всего используют растворитель.
Схема прибора.
1-источник света;
2-монохроматизатор;
3-кюветы с анализируемым раствором и раствором сравнения;
4-фотоэлемент;
5-регестрирующее устройство.
- Методика выполнения анализа.
- Приготовление нулевого раствора.
В колбу на 50,00 мл добавляем 2,00 мл 2,5Н раствора NaOH, доводим водой до метки.
- Приготовление стандартных растворов.
Берем точную навеску чистого фурацилина (субстанция) с помощью аналитических весов, теоретическая =0,0400 г. Точную навеску количественно переносим в мерную колбу емкостью 200 мл, добавляем воду и нагреваем на водяной бане до тех пор, пока раствор не станет прозрачным. Затем охлаждаем и доводим раствор до метки водой.
Практическая
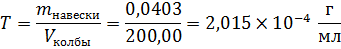
В мерные колбы емкостью 50,00 мл приливаем соответственно 0,50; 1,00; 1,50; 2,00; 2,50 мл стандартного раствора фурацилина, добавляем 2,00 мл 2,5Н раствора NaOH, доводим водой до метки и тщательно перемешиваем.
- Приготовление исследуемого раствора фурацилина.
Берем 0,8000 г (точная навеска) порошка растертых таблеток фурацилина, количественно переносим в мерную колбу емкостью 100 мл, прибавляем воду, растворяем на водяной бане при до получения прозрачного раствора. Охлажденный раствор доводим водой до метки и хорошо перемешиваем. В три мерные колбы емкостью 50,00 мл вносим аликвоту 2,00 мл исследуемого раствора фурацилина, добавляем 2,00 мл 2,5Н раствора NaOH, доводим водой до метки и тщательно перемешиваем.
- Определение активного вещества в препарате.
За раствор сравнения принимаем нулевой раствор, не содержащий фурацилин. Определяем оптические плотности и заносим данные в таблицу.
*Фурацилина в пробе должно быть не менее 98%.
4.3 Экспериментальные данные и математическая обработка результатов.
Таблица 5
Результаты измерения оптических плотностей стандартных растворов.
|
№ раствора
|
Объем стандартного раствора фурацилина, мл
|
Содержание фурацилина растворе m, мг
|
Оптическая плотность, A
|
|
1
|
0,5
|
0,0001
|
0,123
|
|
2
|
1,0
|
0,0002
|
0,160
|
|
3
|
1,5
|
0,0003
|
0,225
|
|
4
|
2,0
|
0,0004
|
0,323
|
|
5
|
2,5
|
0,0005
|
0,380
|
По данным из таблицы 5 построили градуировочный график.
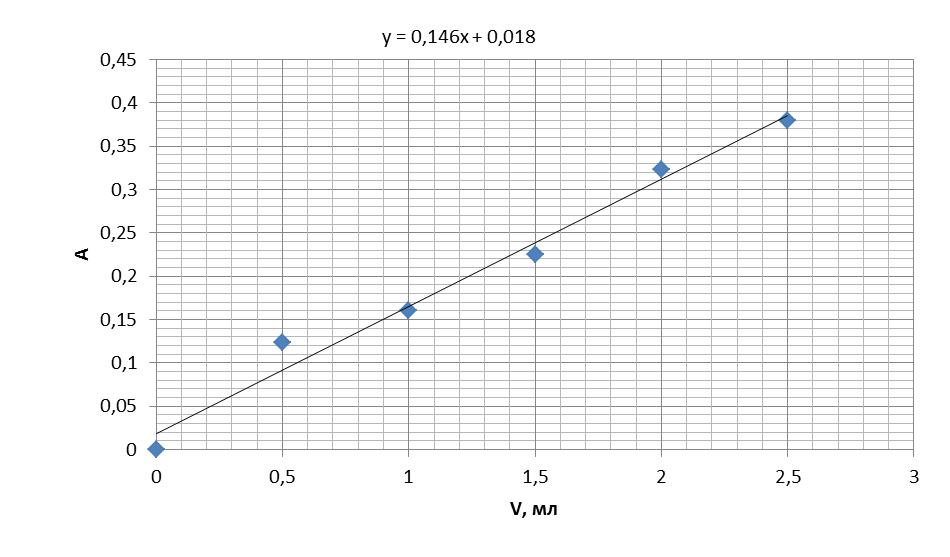
Определили оптические плотности исследуемых растворов (таблица 6) и определили по графику содержание фурацилина в образце.
|
№ образца раствора
|
Объем образца раствора фурацилина, мл
|
Содержание фурацилина в исследуемом растворе m, мг
|
Оптическая плотность эталонных растворов, A
|
|
1
|
2,0
|
0,0004
|
0,295
|
|
2
|
2,0
|
0,0004
|
0,307
|
|
3
|
2,0
|
0,0004
|
0,298
|
Из уравнения прямой y = 0,146x + 0,018 нашли х(объем), подставляя в уравнение у(оптическую плотность исследуемых растворов).
Пример расчета: 0,295=0,146х+0,018, отсюда
Аналогично находим
Массу фурацилина находим по формуле:
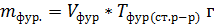
Пример расчета:
0, 000383 г
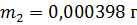
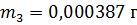
Расчет массовой доли фурацилина в образце выполняется по формуле:
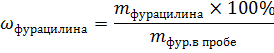
Пример расчета:
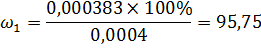
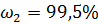
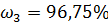
Найдем среднее значение: = ==97,3%
Вычисляем выборочную дисперсию:
== = 3,7725
Вычисляем выборочное стандартное отклонение:
S==1,94
Вычисляем интервал значений массовой доли:
=
Таким образом, получен результат:
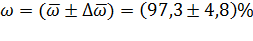
ВЫВОДЫ
В ходе выполнения курсовой работы была подробно рассмотрена необходимая литература, изучены теоретические основы йодометрического и спектрофотометрического методов определения. С помощью данных методов определили содержание активного вещества – фурацилина в препарате.
Методом йодометрии получили результат с погрешностью 3,5%.
Методом спектрофотометрии определили: содержание фурацилина составляет , что соответствует значениям, приведенным в ГОСфармакопее.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
- http://www.xumuk.ru/
- http://enc-dic.com/enc_chemistry
- http://window.edu.ru/resource/557/65557/files/m08-191.pdf
Приложение 1
PAGE \* MERGEFORMAT 1
Определение фурацилина методом йодометрического титрования и спектрофотометрии