Технологія отримання титанового шлаку
PAGE \* MERGEFORMAT3
РЕФЕРАТ
Курсова робота: 37 с., 2 рис., 10 табл., 7 джерел.
Обєкт дослідження – металургія титана.
Предмет роботи – технологія отримання титанового шлаку.
Мета роботи: вивчити властивості титана, його практичне застосування, магнієтермічне виробництво титанової губки. технологічний процес виробництва титанового шлаку та обладнання для його отримання. Зробити розрахунок матеріального балансу для одержання титанових шлаків.
У першому розділі розглянуто властивості титана, області застосування титана і сплавів на його основі, технологію отримання губчастого титана магнієтермічним способом, технологію отримання титанової губки.
У другому розділі розраховано склад шихти для виплавки титанового шлаку, складено матеріальний баланс виплавки 1 т титанового шлаку. Складено зведений матеріальний баланс одержання титанового шлаку, визначена витрата сировини, матеріалів на 1 т ільменітового концентрату на 1 т шлаку.
ТИТАН, МАГНІЙ, ТИТАНОВА ГУБКА, ТИТАНОВИЙ ШЛАК, МАГНІЄТЕРМІЯ, ІЛЬМЕНІТОВИЙ КОНЦЕНТРАТ, ВИПЛАВКА ШЛАКУ.
ЗМІСТ
|
Вступ………………………………………………………………..………...
|
5
|
|
1 Виплавка титанового шлаку..……………..………………………..……..
|
6
|
|
1.1 Властивості та застосування титана…………………………………….
|
6
|
|
1.2 Магнієтермічний спосіб отримання титанової губки.….……………...
|
9
|
|
1.3 Технологія отримання титанового шлаку..……………………….…….
|
12
|
|
1.4 Обладнання для отримання титанового шлаку...………………………
|
16
|
|
2 Матеріальний баланс одержання титанових шлаків……………………..
|
19
|
|
2.1 Розрахунок складу шихти для плавки …..……………..…..…………...
|
19
|
|
2.2 Зведений матеріальний баланс одержання титанистого шлаку…...….
|
31
|
|
2.3 Витрата сировини, матеріалів на 1 т ільменітового концентрату та титанистого шлаку…………..………………………………….………...
|
31
|
|
Висновок…………………………………………………………….………..
|
33
|
|
Література…………………………………………………………….………
|
34
|
|
|
|
ВСТУП
На сьогодні титан – один з найважливіших конструкційних матеріалів. Для цього йому на протязі 200 років довелося пройти шлях від визнання його непридатним у конструкційних цілях до загального поклоніння як перед одним з найперспективніших і вічних металів.
Однак промисловий спосіб добування титану був розроблений лише у 40-х рр. ХХ століття. Завдяки прогресу у сфері авіа- та ракетобудування виробництво титану та його сплавів інтенсивно розвивалося. Це пояснюється сполученням таких цінних властивостей титану, як: мала щільність, висока міцність, корозійна стійкість, технологічність при обробці тиском та зварюваність, холодостійкість, немагнітність та інші цінні фізико-механічні характеристики.
Титан отримують магнієтермічним, натрійтермічним та електрохімічним методами з титанової губки, яка є напівфабрикатом. Найбільш освоєним та експлуатованим в промислових умовах є магнієтермічне відновлення TiСl4. Сутність його полягає в збагаченні титанових руд, виплавки з них титанового шлаку з подальшим отриманням з нього тетрахлориду титану і відновленні з останнього металевого титану магнієм.
Незважаючи на порівняно високу вартість, застосування його все більш поширюється у різних галузях промисловості. Відкриваються нові можливості. Так, наприклад, таку дивну властивість, як «пам'ять» стали використовувати медики для безкровних операцій на судинах. Ця ж властивість титану широко використовується в космічній техніці (на кораблі розвертаються винесені в космічний простір великі антени, до цього компактно складені).
1 ВИПЛАВКА ТИТАНОВОГО ШЛАКУ
1.1 Властивості та застосування титана
Титан – Ti, хімічний елемент IV групи періодичної системи Менделєєва; атомний номер 22, атомна маса 47,90; має сріблясто-білий колір, відноситься до легким металів. Природний титан складається з суміші п'яти стабільних ізотопів: 46Ti (7,95 %), 47Ti (7,75 %), 48Ti (73,45 %), 49Ti (5,51 %), 50Ti (5,34 %). Відомі штучні радіоактивні ізотопи 45Ti (T = 3,09 год), 51Ti (Т = 5,79 хв) та інші.
Фізичні властивості титана. Титан існує у вигляді двох алотропічних модифікаціях: нижче температури 882,5 °С стійка -форма з гексагональною щільноупакованою решіткою (а = 2,951 нм, с = 4,679 нм), a вище цієї температури перетворюється у -форму з кубічною об’ємоцентрованою граткою а = 3,269 нм. Домішки і легуючі добавки можуть істотно змінювати температуру / перетворення.
Щільність -форми при 20 °С 4,505 г/см3, a при 870 °С 4,35 г/см3;
-форми при 900 °С 4,32 г/см3; атомний радіус Ti 1,46 нм, Тпл 1668 °С,
Ткип 3227 °С; титан є парамагнетиком, питома магнітна сприйнятливість
3,2 · 10-6 при 20 ° С.
Хімічні властивості титана. Титан – хімічно активний перехідний елемент, в з'єднаннях має ступені окислення + 4, рідше + 3 і + 2. При звичайній температурі і аж до 500...550 °С корозійно стійкий, що пояснюється наявністю на його поверхні тонкої, але міцної оксидної плівки.
З киснем повітря помітно взаємодіє при температурі вище 600 °С з утворенням ТiO2. Титан має здатність поглинати атмосферні гази і водень, при наявності активованої поверхні поглинання водню відбувається вже при кімнатній температурі з невеликою швидкістю, яка значно зростає при 400 °С і вище. Розчинність водню в титані є оборотною, і цей газ можна видалити майже повністю відпалом у вакуумі. З азотом титан реагує при температурі вище 700 °С, утворюються нітриди типу TiN; у вигляді тонкого порошку або дроту титан може горіти в атмосфері азоту.
Метал стійкий в азотній кислоті всіх концентрацій, в слабких розчинах сірчаної кислоти (до 5 % по масі). Соляна, плавикова, концентрована сірчана, а також гарячі органічні кислоти: щавлева, мурашина і трихлоруксусна реагують з титаном.
Титан корозійно стійкий в атмосферному повітрі, морській воді і морській атмосфері. Титан утворює з С, В, Se, Si металоподібні з'єднання, що відрізняються тугоплавкістю і високою твердістю. При температуpax 400...600 °C титан поглинає водень з утворенням твердих розчинів і гідридів (TiH, TiH2). Всі титанати малорозчинні у воді. Оксид титана (IV), титанові кислоти (опади), а також титанати розчиняються в сірчаній кислоті з утворенням розчинів, що містять титанілсульфат TiOSO4 [1].
Механічні властивості титану характеризуються хорошим поєднанням міцності і пластичності. Наприклад, технічно чистий титан марки ВТ 1-0 має: в = 375...540 МПа, 0,2 = 295...410 МПа, 20 %, і за цими характеристиками не поступається ряду вуглецевих і Сr-Ni корозійностійких сталей.
Висока пластичність титану в порівнянні з іншими металами, що мають ГЩУ-решітку (Zn, Mg, Cd), пояснюється великою кількістю систем ковзання і двійникування завдяки малому співвідношенню с/а = 1,587. Мабуть, з цим пов'язана висока холодостійкість титану і його сплавів.
При підвищенні температури до 250 °С міцність титану знижується майже в 2 рази. Однак жароміцні Ti-сплави за питомою міцністю в інтервалі температур 300…600 °С не мають рівних; при температурах вище 600 °С сплави титану поступаються сплавам на основі заліза і нікелю.
Титан добре обробляється тиском в гарячому стані і задовільно в холодному. Він легко прокочується, кується, штампується. Титан і його сплави добре зварюються контактною і аргонодуговою зваркою, забезпечуючи високу міцність і пластичність зварного з'єднання. Недоліком титану є погана оброблюваність різанням через схильність до налипання, низької теплопровідності і поганих антифрикційних властивостей [2].
Основна частина титану витрачається на потреби авіаційної та ракетної техніки і морського суднобудування. Титан (феротитан) використовують як леговані добавки до якісних сталей і як розкислювач. Технічний титан йде на виготовлення ємностей, хімічних реакторів, трубопроводів, арматури, насосів, клапанів та інших виробів, що працюють в агресивних середовищах.
За використанням в якості конструкційного матеріалу титан знаходиться на четвертому місці, поступаючись лише Al, Fe і Mg. Біологічна нешкідливість титану робить його чудовим матеріалом для харчової промисловості і відновної хірургії. Титан і його сплави знайшли широке застосування в техніці. Висока вартість титану і його сплавів в багатьох випадках компенсується їх більшою працездатністю, а в деяких випадках вони є єдиним матеріалом, з якого можна виготовити обладнання або конструкції, здатні працювати в даних конкретних умовах.
Титанові сплави відіграють велику роль в авіаційній техніці, де прагнуть отримати найбільш легку конструкцію в поєднанні з необхідною міцністю. Титан легкий в порівнянні з іншими металами, але в той же час може працювати при високих температурах, використання в конструкціях авіаційних реактивних двигунів дозволяє зменшити їхню масу на 10…25 %. У ракетобудуванні через короткочасну роботу двигунів і швидкого проходження щільних шарів атмосфери значною мірою знімаються проблеми втомної міцності, статичної витривалості і почасти повзучості.
Технічний титан завдяки виключно високому опору корозії в ряді випадків незамінний у хімічній промисловості та суднобудуванні. Так його застосовують при виготовленні компресорів і насосів для перекачування таких агресивних середовищ, як сірчана і соляна кислота та їх солі, різного роду ємностей, фільтрів і т. п. З титану роблять теплообмінники, що працюють в корозійно активних середовищах, наприклад в азотній кислоті (не димить). У судновиробництві титан використовується для виготовлення гребних гвинтів, обшивки морських суден, підводних човнів, торпед і т.д. [3].
1.2 Магнієтермічний спосіб отримання титанової губки
Проводити відновлення титану вуглецем не можна, через утворення міцних з'єднань металу з вуглецем – карбіду титану. Тому доводиться переводити титан з його оксидів в хлориди, очищати від домішок і відновлювати іншим елементом. Титанову губку отримують декількома способами: магнієтермічним (відновлення TiСl4 магнієм), натрійтермічним (відновлення TiСl4 натрієм) і електрохімічним методами. Найбільш поширеним є магнієтермічне відновлення TiСl4. Титан випускають у вигляді губки або злитків, які потім на інших заводах переробляють на лист, профілі, труби, поковки та інші напівфабрикати.
Технологічна схема виробництва титанової губки включає наступні операції:
– виробництво титанового шлаку методом плавки ільменітового концентрату в рудно-термічних печах;
– отримання титановмісного шлаку;
– отримання тетрахлориду титана технічного;
– ректифікаційна очистка тетрахлориду титану технічного;
– відновлення титану із тетрахлориду титану технічного;
– вакуумна сепарація;
– переробка блоків титану губчатого.
Виробничий процес складається з окремих операцій, які періодично повторюються для кожного циклу. Закриту кришкою і перевірену на герметичність реторту встановлюють в розігріту піч, відкачують і заповнюють аргоном. До реторти під’єднують вузол живлення тетрахлориду титана і вузол управління зливом хлориду магнію. Після заливки магнію і розігріву його до 800…850 °С в реторту подають тетрахлорид титана.
Взаємодія тетрахлориду титана з магнієм починається при 300 °С, але при цій температурі реакція протікає з невеликою швидкістю. Прийнятною для промислових умов є така швидкість початку процесу, яка розвивається
Рисунок 1.1 – Технологічна схема магнієтермічного виробництва титана
при температурах > 800 °С. При таких температурах магній і утворений хлорид магнію протягом всього процесу знаходяться в рідкому стані, в цьому випадку можливий поділ цих речовин і нормальне проведення процесу.
Процес протікає по реакції:
ТiСl4 + 2Мg Тi + 2МgСl2. (1.1)
Проведення процесу у великій ванні розплаву, в якій встигають відновлюватися нижчі хлориди титана, сприяє протіканню реакції до кінця, металевий титан виходить з майже стехіометричним виходом. Звідси випливають переваги періодичного способу, реалізованого на практиці.
Механізм формування блоку реакційної маси можна представити таким чином. У перший період титанова губка утворюється в основному на поверхні розплаву і опускається на дно разом з хлоридом магнію. Утворюючись на поверхні, губка «вбирає» в себе і магній, і хлорид магнію, конденсується внаслідок інтенсивного відводу тепла губкою в розплав. Тепло конденсації витрачається на випаровування магнію. Потрапляючи під верхні шари реакційної маси, губка зустрічає потік магнію, спрямований в зону реакції. Магній відновлює дихлорид титана і витісняє хлорид магнію з дрібних пір губки. Таким чином формується дрібнопориста губка. Незважаючи на наявність дрібних пор, реакційна маса із середньої зони сепарується швидше, ніж з верхньої зони. Дрібні пори в середній зоні заповнені в основному магнієм, а у верхній зоні хлоридом магнію.
При ущільненні губки в результаті вторинної реакції доступ магнію в зону реакції утруднюється, і процес поступово сповільнюється, переходячи в другу стадію. Крім того, на затухання впливає ще й та обставина, що до кінця процесу майже весь магній знаходиться в порах губки і утримується в ній силами змочування.
Блок губки займає майже весь перетин реактора. У центрі – це монолітна маса, біля стінок – більш рихла, шарувата. Це означає, що процес протікає не тільки в центрі, а по всьому перетину. Периферійні зони блоку формуються за тією ж схемою, що і центральні, тільки магнію сюди надходить зазвичай менше. У цих зонах розташовані основні русла, по яких стікає хлорид магнію [4]. Після закінчення процесу відновлення реакційну масу встановлюють в холодильник для охолодження. Блок витягують цілком. У центральній його частині висвердлюють 4...5 отворів на всю висоту блоку. У такому вигляді він надходить до відділення сепарації.
Процес вакуумної сепарації здійснюється наступним чином. Реакційну масу нагрівають в герметичному апараті, в якому був створений вакуум. Хлорид магнію і магній випаровуються й осаджуються в конденсаторі. Реактор з реакційною масою стикується безпосередньо з конденсатором. Змінюючи інтенсивність його зовнішньої теплопередачі, можна управляти процесом конденсації. Регульованим параметром зазвичай є температура стінки конденсатора, характер зміни якої подібний до зміни швидкості конденсації [4].
Титанову губку в чистому вигляді або змішану з легуючими добавками використовують як готову продукцію або переплавляють у злитки.
1.3 Технологія отримання титанового шлаку
Найважливішою умовою успішного проведення процесу плавки залізо-титанових концентратів при будь-яких способах підготовки шихти є вибір відновника і його правильна дозування. Основний відновник при виробництві титанових шлаків – антрацит.
Процес плавки залізотитанових концентратів дуже чутливий до змісту вуглецю в шихті. Зазвичай кількість вуглецю, що вводиться в шихту, розраховують, виходячи з отримання після розплавлення шихти первинного шлаку з концентрацією 8...10 % FеО і у кінці плавки додають решту вуглецю (доведення шлаку) для отримання шлаку, що містить < 5 % FеО.
При виробництві титанового шлаку використовують зазвичай порошкову шихту, але придатна і попередньо брикетована або гранульована.
В даний час виплавку титанових шлаків виробляють у відкритих і закритих руднотермічних печах періодичним способом, тобто шляхом проплавлення всієї завантаженої в піч шихти і наступного випуску продуктів плавки. Періодичність процесу обумовлена необхідністю отримання титанових шлаків з мінімальним вмістом оксидів заліза, для чого в кінці плавки у ванну печі занурюють відновник (операція доведення шлаку).
Використання закритих склепінь руднотермічних печей для виплавки шлаків дозволяє значно поліпшити техніко-економічні показники процесу, оскільки підвищується продуктивність печі, знижується питома витрата електроенергії, зменшуються втрати концентрату (пилевинос) з газами внаслідок значно меншого (у кілька разів) кількості утворюються відхідних газів, знижуються втрати тепла.
При відновленні метатитаната заліза вуглецем в різних температурних інтервалах протікають наступні основні реакції:
при < 1270 °С FеО · ТiO2 + С = Fе + ТiO2 + СО; 3ТiO2 + С = Тi3O5 + СО; (1.2)
при 1270…1400 °С 2Тi3O5 + С = 3Тi2O3 + СО; (1.3)
при 1400…1600 °С Ті2O3 + С = 2ТiO + СО. (1.4)
Оксиди Тi3O5 і Тi2O3 здатні розчиняти монооксид заліза і ільменіт, а також утворювати розчини з ТiO2 і монооксидом титану ТiO. В результаті утворюються складні з'єднання, що кристалізуються при затвердінні шлаків. Однак основою шлаку є Тi3O5 [4].
У ході відновних реакцій в титановий шлак поряд з оксидами титану переходять оксиди інших металів, що містяться в концентраті: СаО, А12O3, МgО, Сr2O3, МnО і частково SiO2.
Процес виплавки шлаку включає наступні операції:
– завантаження шихти;
– одержування первинного шлаку;
– доводка шлаку;
– відстоювання шлаку і його перегрів;
– випуск розплаву;
– охолодження та дроблення шлаку.
Завантаження шихти. Шихту з пічних кишень завантажують у ванну печі рівномірно по всьому її об'єму. Піч при завантаженні шихти, як правило, відключають. На початку завантаження шихту подають невеликими порціями з одної пічної кишені, щоб уникнути викиду розплаву і шихти з ванни. Завантаження виробляють лише на застиглу кірку шлаку, який майже завжди залишається в печі після випуску.
Включення печі і набір навантаження. Перед вмиканням печі ретельно оглядають все обладнання та вузли печі. Щоб уникнути різких поштовхів струму і викиду шихти з ванни електроди безпосередньо перед вмиканням печі піднімають від вихідного положення при завантаженні печі на висоту 100…200 мм.
Після набору повного струмового навантаження на електродах піч переводять на автоматичне регулювання струму. Такий електричний режим витримують до операції відстоювання шлаку. Стан і поведінку розплаву контролюють візуально. Кипіння розплаву ліквідують закиданням у ванну печі злегка зволоженого концентрату або шлаку.
Період розплавлення шихти і утворення рідкої ванни закінчується до моменту коли вміст закису заліза в розплаві складає 8...12 %. Воно визначається з проби, відібраної поблизу електродів на глибині 500...800 мм, яка піддається спектральному аналізу.
Потім починається процес доведення шлаку шляхом подачі в піч антрациту з періодичним відбором проб шлаку. У цей період у зв'язку з високою електропровідністю шлаку електроди піднімаються і процес протікає при відкритому дуговому режимі. Антрацит для доведення шлаку подають порціями по 10...50 кг, щоб не викликати сильного скипання шлаку і вихлюпування розплаву на колошникову площадку. Після відбору проб антрацит подають малими порціями – по 10...12 кг. Доведення шлаку закінчують при досягненні вмісту в ньому FеО, як правило, не більше 5 %.
Після закінчення доведення шлаку розплав відстоюється протягом 20...30 хв для розділення шлаку і металу у ванні за питомою масою.
Продукти плавки випускаються з печі через одну льотку в каскадно встановлені виливниці. Розділ шлаку і металу здійснюють за питомою масою в першій по ходу каскаду виливниці, для чого вона обладнана двома зливними носками, розташованими на різній висоті. Шлак витікає через верхній носок, а метал – через нижній.
Присутні в титановому шлаку нижчі оксиди титану, особливо Ті2О3, є гарними розчинниками ільменіту і FеО.
Частка діоксиду титану в молотому шлаці знижується в порівнянні зі шлаком на випуску з печі більш ніж на 2...5%. Характерною особливістю титанового шлаку, зумовленою його мінералогічним складом, є здатність саморозсипатися. Вона пов'язана з окисленням нижчих оксидів титану киснем повітря, які перетворюються на діоксид титану, тобто саморозсипаємість шлаку пов'язана з його рутілізацією. Це окислення шлаку відбувається із зменшенням його об'ємної маси, внаслідок чого відбувається декріптація: розтріскування злитка від зовнішньої поверхні до серцевини.
Найважливішими властивостями титанових шлаків, які визначають процес відновної плавки, а також можливість повного поділу чавуну і шлаку і випуску їх з печі, є плавкість, в'язкість і електрична провідність.
Плавкість титанового шлаку визначається головними чином концентрацією оксидів титану і співвідношенням Ті2О3 і ТіО2. Присутні в невеликих кількостях оксиди інших металів знижують температуру плавлення і в'язкість шлаку. На практиці, залежно від складу виплавленого титанового шлаку, температура його плавлення коливається в межах 1550…1750 °С. У процесі відновлювальної плавки, тобто зі зменшенням концентрації FеO та підвищенням Ti2О3 в шлаку, його плавкість і в'язкість збільшуються. За своєю природою титанові шлаки відносяться до числа характерних «коротких» металургійних шлаків, тобто таких, які в розплавленому стані мають малі значення в'язкості (0,1…0,3 Па·с) і кристалізуються в дуже вузькому температурному інтервалі.
Охолодження і дроблення шлаку. Після випуску розплаву виливниці зі шлаком через 20…40 хв перевозяться на майданчик для охолодження, де вони знаходяться близько 6…8 ч. Остиглі злитки шлаку витягуються з виливниць мостовим краном і доставляються на склад гарячого шлаку, де за рахунок взаємодії шлаку з киснем повітря відбувається часткове окислення нижчих оксидів титану, внаслідок чого злитки шлаку розсипаються. Охолоджений і розтрісканий шлак надходить на дроблення і подрібнення.
Весь шлак піддають магнітній сепарації, в результаті якої з нього виділяються корольки металу.
Після 2…3 год остигання злитки металу витягуються з піщаних форм мостовим краном і перевозяться на спеціально відведену площадку, де піддаються дробленню [5].
Чавун,отриманий при плавці, використовують у чорній металургії.
1.4 Обладнання для отримання титанового шлаку
Виплавку титанових шлаків виробляють на трьохфазній електродуговій печі потужністю 5 МВт, схема якої показана на рис. 1.2. Ванна печі представляє собою ємність, футеровану зсередини вогнетривкою цеглою. Кожух ванни – конструкція циліндричної форми виконана з листового прокату товщиною 25 мм з компенсаторами теплового розширення футеровки. Кожух служить для утримання футеровки ванни і прийняття навантажень на футеровку від розплаву і температурних деформацій у процесі проплавлення шихти.
Футеровка ванни печі утворює теплоізоляційний простір, в якому відбуваються процеси: нагрівання, плавлення і відновлення титановмісних матеріалів. Футеровка ванни виконана в нижній частині кожуха з переклазової цегли, а верхня частина (під склепінням печі) – футерована шамотною цеглою.
Водоохолоджуваний звід складається зі сводового кільця, трубчастого каркаса і трубчастих водоохолоджуваних панелей. У зводі передбачені: отвір для відведення газів, патрубки для подачі шихти, оглядові люки, вибухові клапани, патрубки для термопар і датчиків для виміру підсводового тиску.
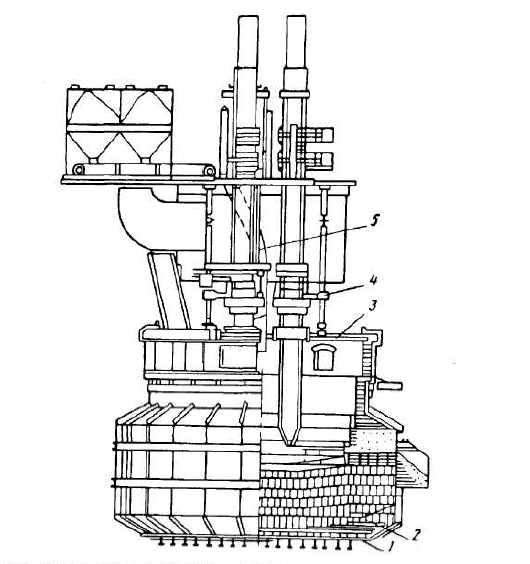
1 – металевий кожух: 2 – магнезитова футеровка; 3 – водоохолоджуваний звід; 4 – система підвіски і перепуску електродів; 5 – система токопідводу
Рисунок 1.2 – Конструкція печі для виплавки титанових шлаків
Система водоохолодження зводу складається з напірного колектора, роль якого виконує кільце каркаса зводу, розташованого півкільцем навколо кожуха ванни, напірних трубопроводів, що підводять воду до секцій зводу.
Токопідвод служить для підведення електричного струму від шинопровода короткої мережі до графітованих електродів. Він складається з траверсу з кронштейнами, кріплення струмоведучих труб, підвісного кожуха, контактних щік, кільця гідроприжиму, струмоведучих труб і труб водоохолодження. Кільце гідроприжиму служить для притиску контактних щік до електрода і складається з двох півкілець з немагнітної сталі, з'єднаних між собою осями. Натискні пристрої складаються з гідравлічних натискних компенсаторів, які дозволяють регулювати зусилля притиснення контактних щік до електрода дистанційно, зберігаючи рівномірність притиску всіх щік.
Шинопровід призначений для підведення електричного струму від електропічних трансформаторів до електротримачів і складається з шихтованих пакетів мідних труб, гнучких токопідводів, стрічкових компенсаторів, деталей кріплення і підвіски.
Гідропідйомник призначений для переміщення токопідводів.
Пристрій призначений для утримання електрода та пропуску його при спрацьовуванні в процесі плавки. Пристрій складається з двох затискних кілець – нижнього на траверсі гідропідйомника і верхнього, встановленого на майданчику над першим колом.
Система гідроприводу служить для подачі масла в пристрої для перепуску електродів, гідравлічні підйомники переміщення електродів.
Установка направляючих роликів переміщення токопідводу дозволяє здійснювати центрування електроду в отворі зводу, що підвищує надійність роботи печі.
Обладнання електропечі працює у важких температурних умовах. Для забезпечення надійної роботи елементів електропечі (контактних вузлів, клапанів) передбачено їх охолодження водою. Система водоохолодження складається з напірних колекторів та зливних корит, напірних і зливних трубопроводів. Вона служить для охолодження вузлів зводу [6].
Для захисту футеровки стін від швидкого роз'їдання агресивним титанистим шлаком на них попередньо нарощують гарнісаж – шар застиглого тугоплавкого шлаку ( ~ 0,5 м). Щоб шлак не роз'їв подину, на ній постійно підтримують високий шар чавуну ( 0,5 м).
2 МАТЕРІАЛЬНИЙ БАЛАНС ОДЕРЖАННЯ ТИТАНОВИХ ШЛАКІВ
2.1 Розрахунок складу шихти для плавки
Відновлюваній електроплавці піддається шихта, що складається з концентрату і твердого відновника (антрациту).
Склад концентрату (Малишевського), що надходить на плавку, приведений у таблиці 2.1
Таблиця 2.1 – Хімічний склад концентрату, %
|
Компоненти
|
TiO2
|
Fe2O3
|
FeO
|
SiO2
|
Al2O3
|
MgO
|
MnO
|
V2O5
|
Cr2O3
|
Р2О5
|
CaO
|
|
Вміст
|
45,0
|
12,5
|
32,93
|
3,5
|
3,0
|
0,6
|
0,75
|
0,17
|
0,02
|
0,03
|
1,5
|
Склад антрациту приведений у таблиці 2.2.
Таблиця 2.2 – Склад антрациту, %
|
Компоненти
|
С
|
Н2O
|
Летучі (СН4)
|
Зола
|
|
Вміст
|
88,0
|
1,5
|
2,5
|
8,0
|
Зола антрациту містить, %: Fe2O3 – 35,0; SiO2 – 45,0; Al2O3 – 20,0.
Розрахунок матеріального балансу проводимо на 1000 кг концентрату. Діоксин титану відновлюється до Ti3O5, оксиди алюмінію, магнію, кальцію цілком переходять у шлак, інші елементи відновлюються, %: SiO2 до 7,5; Cr2O3 до 21; V2О5 до 30; МnО до 6; Р2О5 до 46 та усі переходять у чавун, інше – у шлак. У пил газів, що відходять – 2,6 %, механічні втрати – 2,5 %, інше переходить у шлак.
На підставі досліджень перехід титану в чавун складає 0,01…0,06 %; утрати з пилом газів, що відходять – 2,3…5,45 %; механічні втрати й нев’язання балансу 3,7…2,15 %. При розрахунку матеріального балансу приймаємо, %: 0,05; 2,6; 2,5.
Склад пилу газів, що відходять, і механічні утрати відповідають складу концентрату.
Таким чином, кількість пилу дорівнює: (1000 · 2,6) / 100 = 26 кг;
механічні втрати: (1000 · 2,5) / 100 = 25 кг.
Склад компонентів пилу газів, що відходять, і механічних утри пропорційний їхній кількості в концентраті:
ТіО2 = (26 · 45,0) / 100 = 11,700 кг і т.д.
Результати розрахунку приведені в таблиці 2.3.
Таблиця 2.3 – Кількість і склад пилу газів, що відходять та механічні втрати, кг
|
З’єднання
|
Пил газів
|
Механічні
|
Сума
|
На плавку
|
|
ТіО2
|
11,700
|
11,250
|
22,950
|
427,050
|
|
Fe2О3
|
3,250
|
3,125
|
6,375
|
118,625
|
|
FeО
|
8,562
|
8,232
|
16,794
|
312,506
|
|
SiО2
|
0,910
|
0,875
|
1,785
|
33,215
|
|
А12О3
|
0,780
|
0,750
|
1,530
|
28,470
|
|
MgO
|
0,156
|
0,150
|
0,306
|
5,594
|
|
МnО
|
0,195
|
0,187
|
0,382
|
7,118
|
|
V2О5
|
0,044
|
0,043
|
0,087
|
1,613
|
|
Cr2О3
|
0,005
|
0,005
|
0,010
|
0,190
|
|
Р2О5
|
0,008
|
0,008
|
0,016
|
0,284
|
|
СаО
|
0,390
|
0,375
|
1,305
|
13,695
|
|
Разом:
|
26,000
|
25,000
|
51,000
|
949,000
|
У процесі плавки беруть участь компоненти концентрату, кг:
|
ТіО2
|
450
|
– 22,950
|
= 427,050
|
|
Fe2О3
|
125
|
– 6,375
|
= 118,625
|
|
FeО
|
329,3
|
– 16,794
|
= 312,506
|
|
SiО2
|
35
|
– 1,785
|
= 33,215
|
|
А12О3
|
30
|
– 1,530
|
= 28,470
|
|
MgO
|
6
|
– 0,306
|
= 5,594
|
|
МnО
|
7,5
|
– 0,382
|
= 7,118
|
|
V2О5
|
1,7
|
– 0,087
|
= 1,613
|
|
Cr2О3
|
0,2
|
– 0,010
|
= 0,190
|
|
Р2О5
|
0,3
|
– 0,016
|
= 0,284
|
|
СаО
|
15
|
– 1,305
|
= 13,695
|
|
Разом
|
1000
|
– 51,000
|
= 949,000
|
При руднотермічній плавці Fe2О3 відновлюється до FeO:
|
|
|
|
Fe2О3
|
+ С
|
= FeO
|
+ СО
|
|
|
|
|
(2.1)
|
|
|
|
|
160
|
12
|
144
|
28
|
|
|
|
|
|
|
|
|
|
118,625
|
а
|
б
|
в
|
|
|
|
|
|
|
|
|
|
|
а = 8,897 кг
|
б = 106,763 кг
|
в = 20,759 кг
|
|
|
|
|
|
При плавці шлаку протікають реакції:
|
|
|
ТіО2
|
+ 2 С
|
= Ті
|
+ 2 СО
|
(2.2)
|
|
|
|
МnО
|
+ С
|
= Мn
|
+ СО
|
(2.3)
|
|
|
|
SiО2
|
+ 2 С
|
= Si
|
+ 2 СО
|
(2.4)
|
|
|
|
V2О5
|
+ 5 С
|
= V
|
+ 5 СО
|
(2.5)
|
|
|
|
3ТіО2
|
+ С
|
= Ті3О5
|
+ СО
|
(2.6)
|
|
|
|
Cr2О3
|
+ 3 С
|
= 2 Cr
|
+ 3 СО
|
(2.7)
|
|
|
|
Р2О5
|
+ 5 С
|
= 2 Р
|
+ 5 СО
|
(2.8)
|
|
|
|
FeО
|
+ С
|
= Fe
|
+ СО
|
(2.9)
|
|
|
|
Fe2О3
|
+ 3 С
|
= 2 Fe
|
+ 3 СО
|
(2.10)
|
Кількість компонентів, що вступають у хімічні реакції, кг:
ТіО2 = (427,050 · 0,05) / 100 = 0,214;
МnО = (7,118 · 6) / 100 = 0,427;
SiО2 = (33,215 · 7,5) / 100 = 2,491;
V2О5 = (1,613 · 30) / 100 = 0,484;
Cr2О3 = (0,190 · 21) / 100 = 0,040;
Р2О5 = (0,284 · 46) / 100 = 0,131.
Визначаємо витрату вуглецю й кількість одержуваних продуктів по реакції (2.2), кг:
|
|
|
|
ТіО2
|
+ 2 С
|
= Ті
|
+ 2 СО
|
|
|
|
|
|
80
|
24
|
48
|
56
|
|
|
|
|
|
0,214
|
а
|
б
|
в
|
|
|
|
|
|
|
а = 0,064 кг C
|
б = 0,128 кг Ti
|
в = 0,150 кг CO
|
|
Вступить у реакцію (2.2) 427,050 – 0,214 = 426,836 кг.
По реакції (2.3):
|
|
|
|
МnО
|
+ С
|
= Мn
|
+ СО
|
|
|
|
|
|
71
|
12
|
55
|
28
|
|
|
|
|
|
0,427
|
а
|
б
|
в
|
|
|
|
|
|
|
а = 0,072 кг C
|
б = 0,331 кг Mn
|
в = 0,168 кг CO
|
|
У шлак перейде 7,118 – 0,427 = 6,753 кг МnO.
По реакції (2.4):
|
|
|
|
SiО2
|
+ 2 С
|
= Si
|
+ 2 СО
|
|
|
|
|
|
60
|
24
|
28
|
56
|
|
|
|
|
|
2,491
|
а
|
б
|
в
|
|
|
|
|
|
|
а = 0,996 кг C
|
б = 1,162 кг Si
|
в = 2,325 кг CO
|
|
У шлак перейде 33,215 – 2,491 = 30,724 кг SiO2.
По реакції (2.5):
|
|
|
|
V2О5
|
+ 5 С
|
= 2 V
|
+ 5 СО
|
|
|
|
|
|
182
|
60
|
102
|
140
|
|
|
|
|
|
0,484
|
а
|
б
|
в
|
|
|
|
|
|
|
а = 0,160 кг C
|
б = 0,271 кг V
|
в = 0,372 кг CO
|
|
У шлак перейде 1,613 – 0,484 = 1,129 кг V2O5.
По реакції (2.6):
|
|
|
|
3TiО2
|
+ С
|
= Ti3O5
|
+ СО
|
|
|
|
|
|
240
|
12
|
224
|
28
|
|
|
|
|
|
426,836
|
а
|
б
|
в
|
|
|
|
|
|
|
а = 21,342 кг C
|
б = 398,380 кг Ti3O5
|
в = 49,798 кг CO
|
|
У шлак перейде 398,380 Ti3O5.
По реакції (2.7):
|
|
|
|
Cr2О3
|
+ 3 С
|
= 2 Cr
|
+ 3 СО
|
|
|
|
|
|
152
|
36
|
104
|
84
|
|
|
|
|
|
0,040
|
а
|
б
|
в
|
|
|
|
|
|
|
а = 0,010 кг C
|
б = 0,027 кг Cr
|
в = 0,022 кг CO
|
|
У шлак перейде 0,190 – 0,040 = 0,150 кг Cr2О3.
По реакції (2.8):
|
|
|
|
Р2О5
|
+ 5 С
|
= 2 Р
|
+ 5 СО
|
|
|
|
|
|
142
|
60
|
62
|
140
|
|
|
|
|
|
0,131
|
а
|
б
|
в
|
|
|
|
|
|
|
а = 0,055 кг C
|
б = 0,057 кг Р
|
в = 0,129 кг CO
|
|
У шлак перейде 0,284 – 0,131 = 0,153 кг Р2O5.
У шлаку залишається, кг: Аl2O3, MgO, CaO.
Таким чином, склад шлаку, кг: Ті3О5 398,380; SiО2 30,724;
А12О3 28,470; MgO 5,594; Сr2О3 0,150; МnО 6,753; V2O5 1,129;
Р2O5 0,153; CaO 13,695; Разом 485,048.
Якщо плавку проводити до одержання в шлаку 5 % FeO, то його кількість складе:
FeO = 485,048 5 / 95 = 25,529 кг.
Кількість FeO, що вступає в реакцію (2.9):
312,506 + 106,763 – 25,529 = 393,740 кг.
|
|
|
|
FeО
|
+ С
|
= Fe
|
+ СО
|
|
|
|
|
|
72
|
12
|
56
|
28
|
|
|
|
|
|
393,740
|
а
|
б
|
в
|
|
|
|
|
|
|
а = 65,623 кг С
|
б =306,242 кг Fe
|
в = 153,121 кг СО
|
|
Кількість компонентів чавуна, кг: Ті 0,128; Мn 0,331; Sі 1,162;
V 0,271; Сr 0,027; Р 0,057; Fe 306,242; Разом 308,218.
Вміст вуглецю в чавуні складає 2 %:
(308,218 0,02) / 0,98 = 6,290 кг.
Загальна витрата вуглецю складе:
8,897 + 0,064 + 0,072 + 0,996 + 0,160 + 21,342 + 0,010 +
+ 0,055 + 65,623 + 6,290 = 103,509 кг.
Визначаємо кількість активного вуглецю в 100 кг антрациту.
Оксид Fe2О3 золи антрациту цілком відновлюється до металу, Аl2O3 цілком переходить у шлак, SiO2 на 75 % відновлюється до Si переходить у чавун.
По реакції (2.10):
|
|
|
|
Fe2О3
|
+ 3 С
|
= 2 Fe
|
+ 3 СО
|
|
|
|
|
|
|
160
|
36
|
112
|
84
|
|
|
|
|
|
|
8,0 0,35=
|
а
|
б
|
в
|
|
|
|
|
|
|
=2,80
|
а = 0,630 кг
|
б = 1,960 кг
|
в = 1,470 кг
|
|
|
По реакції (2.4):
|
|
|
|
SiО2
|
+ 2 С
|
= Si
|
+ 2 СО
|
|
|
|
|
|
60
|
24
|
28
|
56
|
|
|
|
|
|
8,0 0,45 0,75 =
|
а
|
б
|
в
|
|
|
|
|
|
=2,70
|
а = 1,080 кг C
|
б = 1,260 кг Si
|
в = 2,520 кг CO
|
|
Загальна витрата вуглецю на відновлення складових золи:
0,630 + 1,080 = 1,710 кг.
У 100 кг антрациту залишається активного вуглецю:
88,0 1,710 = 86,29 кг.
Таким чином, для відновлення концентрату необхідно антрациту:
103,509 / 0,8629 = 119,955 кг.
З обліком пиловиносу антрациту 1,43 % витрата його складе:
119,955 / 0,9857 = 121,695 кг.
Пиловинос антрациту складе
121,695 – 119,955 =1,740 кг.
У ньому:
1,740 0,880 = 1,531 кг С;
1,740 0,025 = 0,044 кг летких;
1,740 0,015 = 0,026 кг вологи;
1,740 0,080 = 0,139 кг золи.
В антрациті міститься:
121,695 0,880 = 107,092 кг С;
121,695 0,025 = 3,042 кг летких;
121,695 0,015 = 1,825 кг вологи;
121,695 0,080 = 9,736 кг золи.
Пішло на реакції:
107,092 1,531 = 105,561 кг С;
3,042 0,044 = 2,998 кг летких;
1,825 0,026 = 1,799 кг вологи;
9,736 0,139 = 9,597 кг золи.
У 9,597 кг золи міститься:
9,597 0,35 = 3,359 кг Fe2O3;
9,597 0,45 = 4,319 кг SiO2;
9,597 0,20 = 1,919 кг Al2O3.
Кількість SiО2 золи антрациту по реакції (2.4):
4,319 · 0,75 = 3,239 кг.
Перейшло у шлак 4,319 – 3,239 = 1,080 кг.
Утвориться Si (3,239 · 28) / 60 = 1,512 кг;
СО (3,239 · 56) / 60 = 3,023 кг.
По реакції (2.10) утвориться:
Fe (3,359 · 112) / 160 = 2,351 кг;
СО (3,359 · 84) / 160 = 1,763 кг.
Леткі антрациту взаємодіють із киснем повітря по реакції (2.11):
|
|
|
|
СН4
|
+ 1,5 О2
|
= СО
|
+ 2Н2О
|
|
|
|
|
|
16
|
48
|
28
|
36
|
|
|
|
|
|
2,998
|
а
|
б
|
в
|
|
|
|
|
|
|
а = 8,994 кг О2
|
б = 5,247 кг СО
|
в = 6,746 кг Н2О
|
|
Кількість і склад товарного чавуну приведений у таблиці 2.4.
Таблиця 2.4 – Кількість і склад товарного чавуна
|
Елемент
|
Кількість, кг
|
Склад, %
|
|
Ті
|
0,128
|
0,04
|
|
Мn
|
0,331
|
0,10
|
|
Si
|
1,162 + 1,512 = 2,674
|
0,84
|
|
V
|
0,271
|
0,09
|
|
Сr
|
0,027
|
0,01
|
|
Р
|
0,057
|
0,02
|
|
Fe
|
306,242 + 2,351 = 308,593
|
96,93
|
|
С
|
6,290
|
1,97
|
|
Разом
|
318,371
|
100,00
|
Кількість і склад шлаку представлені в таблиці 2.5.
Таблиця 2.5 – Кількість і склад шлаку
|
Сполуки
|
Кількість, кг
|
Склад, %
|
|
Ті3О5
|
398,380
|
77,57
|
|
МnО
|
6,753
|
1,31
|
|
SiO2
|
30,724 + 1,080 = 31,804
|
6,19
|
|
V2O5
|
1,129
|
0,22
|
|
Аl2O3
|
28,470 + 1,919 = 30,389
|
5,92
|
|
MgO
|
5,594
|
1,09
|
|
Cr2O3
|
0,150
|
0,03
|
|
Р2O5
|
0,153
|
0,03
|
|
СаО
|
13,695
|
2,67
|
|
FeO
|
25,529
|
4,97
|
|
Разом:
|
513,576
|
100,00
|
Витрату електродів приймаємо рівною 25 кг на 1 т шлаку. Отже, витрата електродів на процес складе:
513,576 · 0,025 = 12,839 кг.
Вуглець електрода згоряє по реакції (2.12):
|
|
|
|
2 С
|
+ О2
|
= 2 СО
|
|
|
|
|
|
|
24
|
32
|
56
|
|
|
|
|
|
|
12,839
|
а
|
б
|
|
|
|
|
|
|
|
а = 17,119 кг О2
|
б = 29,959 кг СО
|
|
|
Витрата кисню на реакції (2.11), (2.12):
8,994 + 17,119 = 26,113 кг.
З киснем повітря надходить азот
26,113 · 77 / 23 = 87,422 кг,
де 77 та 23 – склад повітря (азот і кисень).
Витрата повітря:
26,113 + 87,422 = 113,535 кг.
Склад газів:
CO = 20,759 + 0,150 + 0,168 + 2,325 + 0,372 + 49,798 + 0,022 + 0,129 +
+ 153,121 + 3,023 + 1,763 + 5,247 + 29,959 = 266,836 кг;
Н2О = 1,825 + 6,746 = 8,571 кг;
N2 = 87,422 кг;
Усього: 362,829 кг.
За результатами розрахунку складаємо матеріальний баланс плавки ільменітових концентратів у таблиці 2.6.
Таблиця 2.6 – Матеріальний баланс плавки ільменітового концентрату
|
Завантажено
|
Отримано
|
|
Продукт
|
кг
|
Продукт
|
кг
|
|
1
|
2
|
3
|
4
|
|
Концентрат, в
|
1000,000
|
Шлак, в
|
513,576
|
|
т.ч.: TiO2
|
450
|
т.ч. Ті3О5
|
398,380
|
|
Fe2O3
|
125
|
МnО
|
6,753
|
|
FeO
|
329,3
|
SiO2
|
31,804
|
|
SiO2
|
35
|
V2O5
|
1,129
|
|
Al2O3
|
30
|
Аl2O3
|
30,389
|
|
MgO
|
6
|
MgO
|
5,594
|
|
Cr2O3
|
0,2
|
Cr2O3
|
0,146
|
|
MnO
|
7,5
|
Р2O5
|
0,153
|
|
V2O5
|
1,7
|
СаО
|
13,695
|
|
Р2O5
|
0,3
|
FeO
|
25,529
|
|
CaO
|
15
|
Чавун, в
|
318,371
|
|
Антрацит, в
|
121,695
|
т.в. Ті
|
0,128
|
|
т.ч.: С
|
107,092
|
Мn
|
0,331
|
|
Леткі (СН4)
|
3,042
|
Si
|
2,674
|
|
Н2O
|
1,825
|
V
|
0,271
|
|
Зола
|
9,736
|
Сr
|
0,029
|
|
Електроди
|
12,839
|
Р
|
0,057
|
|
Повітря, в
|
113,535
|
Fe
|
308,593
|
|
т.ч.: О2
|
26,113
|
С
|
6,290
|
|
N2
|
87,422
|
Пил газів, в
|
27,740
|
|
|
|
т.ч.: TiO2
|
11,700
|
|
|
|
Fe2O3
|
3,250
|
|
|
|
FeO
|
8,562
|
Продовження таблиці 2.6
|
1
|
2
|
3
|
4
|
|
|
|
SiO2
|
0,910
|
|
|
|
Al2O3
|
0,780
|
|
|
|
MgO
|
0,156
|
|
|
|
Cr2O3
|
0,195
|
|
|
|
MnO
|
0,044
|
|
|
|
V2O5
|
0,005
|
|
|
|
Р2O5
|
0,008
|
|
|
|
CaO
|
0,390
|
|
|
|
С
|
1,531
|
|
|
|
Леткі (СН4)
|
0,044
|
|
|
|
Н2O
|
0,026
|
|
|
|
Зола
|
0,139
|
|
|
|
Мех. утрати, в
|
25,000
|
|
|
|
т.ч.: TiO2
|
11,250
|
|
|
|
Fe2O3
|
3,125
|
|
|
|
FeO
|
8,232
|
|
|
|
SiO2
|
0,875
|
|
|
|
Al2O3
|
0,750
|
|
|
|
MgO
|
0,150
|
|
|
|
Cr2O3
|
0,187
|
|
|
|
MnO
|
0,043
|
|
|
|
V2O5
|
0,005
|
|
|
|
Р2O5
|
0,008
|
|
|
|
CaO
|
0,375
|
|
|
|
Гази, в
|
362,829
|
|
|
|
т.ч.: CO
|
266,836
|
|
|
|
Н2О
|
8,571
|
|
Нев’язка
|
– 0,553
|
N2
|
87,422
|
|
Разом
|
1248,069
|
Разом
|
1247,516
|
Нев’язка балансу складає – 0,04 %, що допускається при розрахунках. При контакті шлаку з повітрям після випуску з печі відбувається окислювання Ті3О5 до ТіО2 по реакції (2.12):
|
|
|
|
Ti3O5
|
+ 0,5 О2
|
= 3TiО2
|
|
(2,12)
|
|
|
|
|
224
|
16
|
240
|
|
|
|
|
|
|
398,380
|
а
|
б
|
|
|
|
|
|
|
|
а = 28,456 кг О2
|
б = 426,836 кг TiO2
|
|
|
Товарний шлак має складу, що представлений у таблиці 2.7.
Таблиця 2.7 – Кількість і склад товарного шлаку
|
З’єднання
|
Кількість, кг
|
Склад, %
|
|
ТіО2
|
426,836
|
78,75
|
|
МnО
|
6,753
|
1,24
|
|
SiO2
|
31,804
|
5,87
|
|
V2O5
|
1,129
|
0,21
|
|
Аl2O3
|
30,389
|
5,61
|
|
MgO
|
5,594
|
1,03
|
|
Cr2O3
|
0,146
|
0,03
|
|
Р2O5
|
0,153
|
0,03
|
|
СаО
|
13,695
|
2,52
|
|
FeO
|
25,529
|
4,71
|
|
Разом
|
542,032
|
100,00
|
Матеріальний баланс окислювання шлаку при обробленні наданий у таблиці 2.8.
Таблиця 2.8 – Матеріальний баланс окислювання шлаку при обробленні
|
Завантажено
|
Отримано
|
|
Продукт
|
кг
|
Продукт
|
кг
|
|
Шлак
|
513,576
|
Шлак
|
542,032
|
|
Ті3О5
|
398,380
|
ТІіО2
|
426,836
|
|
МnО
|
6,753
|
МnО
|
6,753
|
|
SiO2
|
31,804
|
SiO2
|
31,804
|
|
V2O5
|
1,129
|
V2O5
|
1,129
|
|
Аl2O3
|
30,389
|
Аl2O3
|
30,389
|
|
MgO
|
5,594
|
MgO
|
5,594
|
|
Cr2O3
|
0,146
|
Cr2O3
|
0,146
|
|
Р2O5
|
0,153
|
Р2O5
|
0,153
|
|
СаО
|
13,695
|
СаО
|
13,695
|
|
FeO
|
25,529
|
FeO
|
25,529
|
|
Кисень повітря
|
28,456
|
|
|
|
Разом
|
542,032
|
Разом
|
542,032
|
2.2 Зведений матеріальний баланс одержання титанистого шлаку
На основі даних, наданих у таблицях 2.6, 2.7, 2.8, представляємо зведений матеріальний баланс одержання титанистого шлаку в таблиці 2.9.
Таблиця 2.9 – Зведений матеріальний баланс одержання титанистих шлаків
|
Завантажено
|
Отримано
|
|
Продукт
|
кг
|
Продукт
|
кг
|
|
Концентрат
|
1000,000
|
Шлак
|
542,032
|
|
Антрацит
|
121,695
|
Чавун
|
318,371
|
|
Електроди
|
12,839
|
Гази
|
362,829
|
|
Повітря
|
141,991
|
Пил газів
|
27,740
|
|
|
|
Мех. утрати
|
25,000
|
|
Разом
|
1276,525
|
Разом
|
1275,972
|
Нев’язання складає: (1275,972 · 100) / 1276,525 = 99,96, тобто
– 0,04 %, що цілком припустимо при ручному рахуванні (припускаючи округлення).
2.3 Витрата сировини, матеріалів на 1 т ільменітового концентрату та титанистого шлаку
Витрата сировини, матеріалів на 1 т (1000 кг) ільменітового концентрату шлаку знаходимо з таблиці 2.9.
Витрата сировини й матеріалів на 1 т (1000 кг) титанистого шлаку визначаємо у відповідності з формулою:
X = (А · Б) / Y, (2.13)
де А – кількість сировини чи матеріалу, що витрачається на 1 т концентрату, таблиця 2.9;
Б – кількість шлаку, 1 т;
В – кількість шлаку, що утвориться з 1 т шлаку, таблиця 2.9.
На 1 т шлаку витрата концентрату й матеріалів складає:
(1 · 1) / 0,542032 = 1,845 т;
антрациту – (0,121695 · 1) / 0,542032 = 0,225 т;
електродів – (0,012839 · 1) / 0,542032 = 0,024 т;
повітря – (0,141991 · 1) / 0,542032 = 0,262 т.
Утвориться:
механічні втрати (у виді пилу)
– (0,02500 · 1) / 0,542032 = 0,046 т;
газів – (0,362829 · 1) / 0,542032 = 0,669 т.
пилу – (0,027740 · 1) / 0,542032 = 0,051 т;
Результати розрахунку представляємо у зведеній таблиці 2.10.
Таблиця 2.10 – Витрата сировини та матеріалів на 1 т концентрату, а також продуктів, що утворяться на 1 т шлаку
|
На 1 т концентрату, т
|
На 1 т шлаку, т
|
|
Антрацита
|
0,121695
|
Концентрату
|
1,845
|
|
Електродів
|
0,012938
|
Антрацита
|
0,225
|
|
Повітря
|
0,141991
|
Повітря
|
0,262
|
|
|
|
Утвориться:
|
|
|
|
|
Газів
|
0,669
|
|
|
|
Пилу
|
0,051
|
|
|
|
Механічних утрат
|
0,046
|
ВИСНОВОК
В першому розділі курсової роботи були розглянуті: титан – його властивості та застосування; магнієтермічним методом отримання титану з тетрахлориду титану; утворення титанового шлаку та обладнання для його отримання.
У другому розділі курсової роботи був проведений розрахунок матеріального балансу, до якого входило розрахунок складу шихти для плавки, розрахунок зведеного матеріального балансу та витрати сировини і матеріалів, у результаті отримано матеріальний баланс у кількості 1275,972 г.
На 1 т концентрату, т: 0,121695 антрациту; 0,012938 електродів; 0,141991 повітря.
На 1 т шлаку, т: 1,845 концентрату; 0,225 антрациту; 0,262 повітря; 0,669 газів; 0,051 пилу; 0,046 механічних утрат.
ЛІТЕРАТУРА
1 Титан - Свойства химических элементов [Электронная версия]. Режим доступа: http://chem100.ru/elem.php?n=22 – Дата обращения: 17.10.2015г.
2 17. титаны и титановые сплавы [Электронная версия]. Режим доступа: http://www.naukaspb.ru/spravochniki/Demo%20Metall/3_17.htm – Дата обращения: 17.10.2015г.
3 Титан. Свойства титана. Применение титана. [Электронная версия]. Режим доступа: http://www.metotech.ru/titan-opisanie.htm – Дата обращения: 17.10.2015г.
4 Тарасов, A. B. Металлургия титана [Текст] / A. B. Тарасов – М.: ИКЦ «Академкнига», 2003. – 328 с. ISBN 5-94628-041-4
5 Гармата, В. А. Титан [Текст] / В. А. Гармата, А. Н. Петрунько,
Н. В. Галицкий, Ю. Г. Олесов, Р. А. Сандлер – М.: Металлургия, 1983. – 559 с.
6 Кривандин, В. А. Металлургические печи [Текст]: [учебник для металлург. техникумов] / В.А. Кривандин, Н.Г. Молчанов, С.Л. Соломенцев ; под общ. ред. инж. И.Н. Сушкина. – [2-е изд., перераб. ] – М.: Металлургия, 1969. – 615 с.
7. Іващенко, В. І. Металургія рідкісних металів [Текст]: Навчальний посібник для студентів ЗДІА / В. І. Іващенко, О. В. Іващенко, В. В. Лебедєв – Запоріжжя, 2005. – 168 с.
Технологія отримання титанового шлаку