БИОЛОГИЧЕСКИЕ ЭФФЕКТЫ ВОЗДЕЙСТВИЯ НИЗКОИНТЕНСИВНОГО ИЗЛУЧЕНИЯ НА ВОДНЫЕ РАСВОРЫ
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
(ФГБОУ ВПО «КубГУ»)
Физико-технический факультет
Кафедра радиофизики и нанотехнологий
Допустить к защите в ГАК
_____ . ____ . 2015 г.
Заведующий кафедрой
д-р физ-мат. наук, профессор
_______________ Копытов Г.Ф.
ВЫПУСКНАЯ КВАЛИФИКАЦИОННАЯ РАБОТА
БАКАЛАВРА
БИОЛОГИЧЕСКИЕ ЭФФЕКТЫ ВОЗДЕЙСТВИЯ НИЗКОИНТЕНСИВНОГО ИЗЛУЧЕНИЯ НА ВОДНЫЕ РАСВОРЫ
ДНК
Работу выполнил ________________________Ерицян Алексей Мартиросович
Направление подготовки 11.03.04 Электроника и Наноэлектроника
Научный руководитель
канд. хим. наук ________________________________________ Текуцкая Е. Е.
Нормоконтролер
канд. хим. наук _________________________________________ Соколов М.Е.
Краснодар 2015
РЕФЕРАТ
Выпускная квалификационная работа 51 с., 16 рис., 2 табл., 51 источник.
Магнитное поле, ДНК, воздействие, излучение, поглощение, ИК – спектроскопия, флуоресценция.
Объектом изучения в данной дипломной работе были растворы ДНК, обработанные низкочастотным магнитным полем.
Целью данной работы было изучение влияния электромагнитного поля низкой частоты на водные растворы макромолекул ДНК.
В ходе выполнения работы были получены ИК – спектры и спектры флюоресценции водных растворов ДНК, и проанализировано изменение интенсивности адсорбции под действием комбинированных магнитных полей слабой частоты. Установлено, что у молекул ДНК также как и у аминокислот есть резонансная ионно-циклотронная частота.
СОДЕРЖАНИЕ
Обозначения и сокращения……………………………......…….....…….…………4
Введение…………………………………………………...…….....…….……..……5
1 Литературный обзор.……………………………………………………………...7
1.1 Структура ДНК………………….………..…………….………….......…....7
1.2 Катализирующее действие магнитных полей в физико-химических
процессах в микробиологии……………………………..…..……..………..8
1.2.1 ДНК и электромагнитное облучение…………………………….…..8
1.2.2 Изменение флюоресценции в растворах белков…..………..…...…15
1.2.3 Действие СМП на белки и аминокислоты………………..………...18
1.2.4 Образование радикальных пар под действием МП...……….....…..20
1.2.5 Воздействие статических МП на образование радикалов................22
1.3 Методы исследования водных растворов аминокислот и ДНК.……..…24
1.3.1 ИК-спектроскопия.……………..……..………………....………...…24
1.3.2 Флюоресценция …………………………....………….…………..…30
2 Экспериментальная часть………………………….………………………....….36
2.1 Материалы и методы исследования………………...……….....................36
2.2 Объекты исследования…………………………...……………...……..….37
2.3 Результаты проведенного исследования………………………………….38
2.4 Обсуждение результатов…………………………………………...……...43
Заключение……………………………………………………….…..……………..45
Список использованных источников………...……………………..……………..46
Обозначения и сокращения
|
ЭМП
|
электромагнитное поле
|
|
НЧ
|
низкая частота
|
|
ДНК
|
дезоксирибонуклеиновая кислота
|
|
ИКС
|
инфракрасный спектр
|
|
СКМП
|
слабые комбинированные магнитные поля
|
|
АФК
|
активная форма кислорода
|
|
РП
|
радикальная пара
|
|
СМП
|
слабое магнитное поле
|
|
ЯМР
|
ядерный магнитный резонанс
|
|
БСА
|
бычий сывороточный альбумин
|
|
АКЭ
|
асцитная карцинома Элриха
|
|
ДНКаза 1
|
дезоксирибонуклеаза 1
|
|
СОД
|
супероксиддисмутазная активность
|
|
ВЭЖХ
|
Высокоэффективная жидкостная хромотаграфия
|
|
B
|
переменное магнитное поле
|
|
B
|
постоянное магнитное поле
|
ВВЕДЕНИЕ
Актуальность темы состоит в том, что электромагнитные поля являются экологически значимым фактором внешней среды, влияющим на многие биологические процессы в живых организмах на планете постоянно находятся под воздействием повсеместно присутствующих естественного геомагнитного и искусственных слабых магнитных полей исходящих от различного рода технических устройств. К настоящему времени в области исследования биологического действия слабых МП накоплен огромный экспериментальный материал, свидетельствующий о высокой чувствительности живых систем к их воздействию.
Существенный прогресс в понимании процессов, лежащих в основе механизмов биологического действия слабых МП, таких как определение пороговых значений МП, частотно – амплитудных диапазонов биологической активности, определение мишеней и молекулярных механизмов биологического действия слабых МП обозначен в работах, показавших возможность выраженного избирательного действия очень слабых (порядка сотых долей мкТл) переменных компонент МП на фоне более сильного постоянного МП (десятки – мкТл) обусловленную, прежде всего, кооперативными эффектами на циклотронных частотах ряда макромолекул в водных растворах.
Целью данной работы было изучение влияния электромагнитного поля низкой частоты на водные растворы макромолекул ДНК.
Для выполнения поставленной цели решались следующие задачи:
– изучение преимуществ и недостатков ИК – спектроскопии и флуоресценции при анализе биологических объектов;
– анализ имеющихся литературных данных в области изучения структуры ДНК и современных теорий влияния магнитных полей на водные растворы ДНК и аминокислот;
– выделение нуклеиновых кислот из периферической цельной крови человека;
– изучение зависимости отклика водных растворов ДНК на действие электромагнитного поля с различными заданными параметрами облучения (частота, амплитуда);
– анализ полученных ИК – спектров и спектров флуоресценции водных растворов ампликонов ДНК;
– изучение зависимостей, изменения ИК – спектров и спектров флуоресценции после воздействия ЭПМ различных частот;
1 Литературный обзор
1.1 Структура ДНК
ДНК - макромолекула обеспечивающая хранение, и передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов. ДНК содержит информацию о структуре различных видов РНК и белков [1].
Дезоксирибонуклеиновая (ДНК) кислота является биополимером, мономером которого является нуклеотид. Двойная спираль ДНК образована двумя правозакрученными вокруг общей оси полинуклеотидными цепями и имеет диаметр 1,8 – 2,0 нм. Эти цепи не идентичны, но комплементарны друг другу. Плоскости гетероциклических азотистых оснований расположены внутри двойной спирали перпендикулярно ее общей оси. Каждая цепь состоит из последовательно соединенных нуклеотидов. Каждый нуклеотид ДНК содержит одно из четырёх азотистых оснований (рис. 1), каждое из которых связанно с дезоксирибозой, к которой в свою очередь присоединена фосфатная группа. Между собой соседние нуклеотиды соединены в цепи фосфодиэфирной связью, образованной 3’– гидроксильной (3’– ОН) и 5’– фосфатной группами (5’– РО3). Это свойство обуславливает наличие полярности в ДНК, т. е. противоположной направленности, а именно 5’– и 3’– концов: 5’– концу одной нити соответствует 3’– конец второй нити (рис. 2).
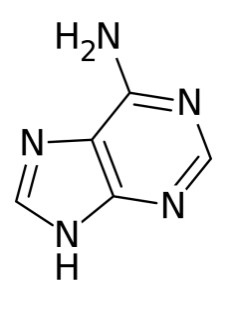

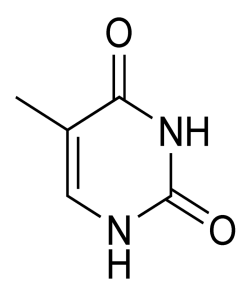
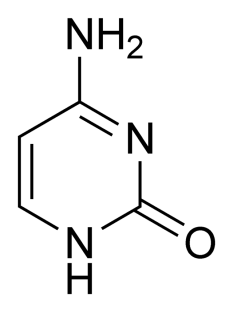
G A T C
Рисунок 1 – Азотистые основания: гуанин (G), аденин (A), тимин (T), цитозин (C).
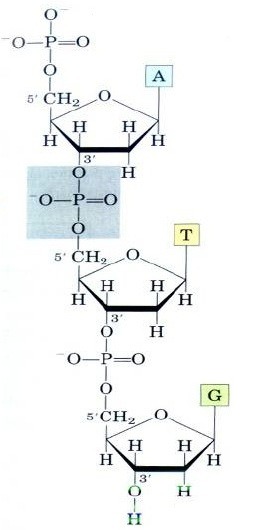
Рисунок 2 – Фосфодиэфирная связь в молекуле ДНК
1.2 Катализирующее действие магнитных полей в физико-химических процессах в микробиологии
1.2.1 ДНК и электромагнитное облучение
С момента открытия нуклеиновых кислот ученые разных стран интенсивно изучали строение и свойства этого биоорганического соединения. Был накоплен огромный фактический материал, послуживший основой, как для последующего исследования нуклеиновых кислот, так и для практического применения результатов полученных при их изучении.
В литературе имеется большое количество работ по оценке влияния факторов электромагнитной природы на живые системы и нуклеиновые кислоты.
В ряде работ [2 – 3] рассмотрено новое свойство молекул ДНК, заключающееся в способности водных растворов некоторых бактериальных и вирусных ДНК высокой степени разведения до 10 – 15 М излучать низкочастотные электромагнитные волны, причем для их индукции, по мнению авторов, достаточно иметь специфически короткую последовательность ДНК. Это явление запускается фоновым электромагнитным полем ультранизкой частоты. Облученные таким образом растворы приобретают способность переносить информацию о ДНК от исходного организма на другие [3].
В качестве источника ДНК в работе [2] использовались фрагменты ДНК ВИЧ – 487 нуклеотидных пар. Растворы помещались внутрь обмотки соленоида, в котором протекал ток низкой интенсивности, осциллирующий на частоте 7 Гц, выдаваемой внешним генератором в течение 18 часов. Затем с каждого раствора снимались показания электромагнитных сигналов. Детектор электромагнитных сигналов состоял из соленоида, реагирующего на магнитную компоненту излучения ДНК и конвертирующего его в электрические сигналы.
Авторы [2, 3] полагают, что полученный эффект связан с изменениями наноструктуры воды, окружающей ампликоны ДНК. Начальным пунктом является допущение того, что молекулы воды в жидком состоянии взаимодействуют друг с другом не только статически (водородные связи, электрические диполь-дипольные взаимодействия и др.).
Особый интерес представляет изучение влияния совместного действия постоянного и переменного магнитных полей на ионный ток через водные растворы аминокислот. Реакция тока на воздействие имеет тонкую структуру, содержащую колебательные компоненты, характеризуется определенными особенностями динамики и ограниченным временем жизни. В работах В.В. Новикова и соавторов [4 – 7] экспериментально было подтверждено новое явление, заключающееся в том, что слабое низкочастотное магнитное поле становится биологически активным в присутствии параллельного ему постоянного магнитного поля. Также было показано, что комбинированное действие слабых электрических и магнитных полей, в случае соответствия частот переменного магнитного поля циклотронным частотам ионизированных форм молекул аминокислот, способствует образованию устойчивых индивидуальных продуктов поликонденсации аминокислот, содержащих пептидные связи (аспарагин, глутаминовая кислота, аргинин и тирозин). На кривой зависимости тока от частоты переменного поля, параллельного постоянному, наблюдались отчетливые (30 – 50 % от фонового тока) узкополосные пики на частотах, близких к циклотронной частоте ионизированной молекулы соответствующей аминокислоты. Воспроизводимость эффекта 100 %. Эффект наблюдается только при очень слабом (0.05 мкТл) переменном поле, не имеет места при взаимной перпендикулярности прилагаемых полей, и исчезает с увеличением амплитуды переменного поля. Особый интерес вызывает то, что эффект проявляется лишь на определенных частотах переменного поля, прямо пропорциональных величине постоянного поля и связанных с ним формулой циклотронной частоты для того или иного биологически активного иона.
Несмотря на хорошее совпадение теоретических и экспериментальных величин, выше описанная теория не может быть применена к случаю чистого водного раствора ионизированных молекул, рассматриваемых как целостные заряженные частицы. Авторы [7] затрудняются сказать, на что действуют прилагаемые поля, меняющие ионную проводимость в исследуемых растворах аминокислот – на подвижность ионизированных молекул, или на константу диссоциации неионизированных, или на что-либо еще.
До настоящего времени строгая теория, объясняющая эффекты комбинированного действия слабых магнитных полей на молекулярные ионы в растворе отсутствует. Эффекты резонансного поглощения энергии на циклотронной частоте отдельными ионами в растворе теоретически исключаются, так как время жизни отдельного иона значительно меньше циклотронного периода. Одна гипотеза позволяет качественно рассмотреть наблюдаемое явление. Авторы [6] полагают, что в диссипативной системе раствора в результате действия группы ионов аминокислоты электрических и магнитных полей образуется коллективное полиионное молекулярное образование – кластер, который взаимодействует с внешними полями как отдельная структура. С увеличением числа ионов в кластере его суммарная энергетика превысит уровень kT, необходимый для стабилизации структуры. В результате время жизни кластера превысит циклотронный период. Электрическая энергия, аккумулируемая в кластерах, обеспечивает образование межмолекулярных связей. Циклотронная частота кластера равна циклотронной частоте отдельного иона.
Описанные результаты показывают возможность избирательного действия слабых магнитных полей на отдельные типы молекул в растворах с сохранением эффекта действия поля в устойчивой молекулярной структуре. Медицинские аспекты сверхслабых воздействий состоят в формировании внешних полей, импульсных сигналов или химических агентов, направленно влияющих на изменение межмолекулярной водной среды и приводящих на молекулярном уровне к нарушению функций органов.
Описанный выше эффект проводился и на более сложных системах, чем мономолекулярные растворы аминокислот (табл. 1). Известны работы[8, 9], по изучению устойчивости хроматина клеток АКЭ и мозга мышей к ДНКАЗА –1 при комбинированном действии на организм слабых постоянного и низкочастотного переменного магнитных полей, настроенных на циклотронный резонанс ионов полярных аминокислот. Показано, что данное воздействие приводит к утрате устойчивости ДНК хроматина клеток АКЭ и мозга мышей к ДНКАЗА – 1. Комбинированное действие полями с переменной компонентой не входящей в диапазон резонансных частот ионов аминокислот, не оказывает какое-либо заметное влияние на излучательные характеристики, что подтверждает концепцию избирательного резонансного действия слабых магнитных полей и зависимости эффектов от настройки поля на резонансные частоты определенных молекул [10]. Данное явление открывает принципиальную возможность регуляции ДНК белковых взаимодействий в системах ДНК – ингибиторы ферменты с помощью резонансного действия на организм слабых электромагнитных полей.
Наибольшей противоопухолевой активностью обладал суммарный пятичастотный сигнал. В органах носителей опухолей (печень, надпочечники) обнаружены структурные изменения (участки дегенерации).
Таблица 1 – Эффекты действие СКМП на различные белки, аминокислоты, а также АКЭ и планарий Dugesia Tigrina.
|
Постоянное МП
|
Переменное МП
|
Эффект
|
|
B, мкТл
|
B, мкТл
|
Частота, Гц
|
|
|
42
|
1; 40; 100; 120; 160; 640
|
1; 3,7; 32
|
Активация деления и регенерации планарий Dugesia Tigrina
|
|
30-49
|
50-300
|
3,5-5 (сумма); 1; 4,4; 16,5
|
Торможение развития АКЭ у крыс
|
|
40
|
40
|
3,5-5 (сумма)
|
Снижение устойчивости Днк хроматина к ДНКазе 1
|
|
40
|
40
|
3,5-5 (сумма)
|
Снижение функциональной активности гистоновых белков
|
|
40
|
40
|
3,5-5 (сумма)
|
Снижение активности рекомбинантных белков
|
|
25-100
|
20-200
|
3-10; 3,5-5 (сумма)
|
Стимуляция гидролиза белков
|
Исследование взаимодействия структурных белков ядер с ДНК очень важно для ее матричной функции в клетке, поскольку данные взаимодействия играют ключевую роль в экспрессии генетической информации в клетке. Связь гистонов и негистоновых белков с хроматином не только определяет нативную конформацию ДНК, но и степень экспрессии тех или иных генов. В ходе экспериментов, описанных в работах [6 – 7] по изучению молекулярных механизмов воздействия слабых комбинированного и постоянного и переменного низкочастотного магнитных полей, настроенных на циклотронный резонанс ионов заряженных в естественных условиях аминокислот, наблюдалось существенное снижение функциональной активности ряда белков (гистоновых и негистоновых) – ингибиторов ДНКАЗА – 1 (рис. 3). Было отмечено, что данное воздействие не затрагивает сами молекулы ДНК.
Рисунок 3 – Влияние СКМП (B0 = 42 мкТл, B = 0,05 мкТл) на гидролиз различных пептидов и белков (С = 30мкг/мл)
Для проведения эксперимента использовались следующие реактивы: полиагринин, гистон H3, ДНК из спермы лосося, протаминсульфат. Магнитная обработка растворов указанных реактивов проводилась посредством магнитных катушек, формирующих коллинеарное постоянное (42 мкТл) и переменное (60 нТл) магнитные поля. Обработку магнитными полями растворов белков и полиаминокислот проводили в течение 6 ч.
Результаты исследований показали, что предварительная обработка магнитным полем белкового компонента комплекса ДНК приводит к существенному изменению комплексообразования и образованию комплексов иного типа, чем без обработки. Таким образом, обработка магнитным полем водных растворов ДНК и белка приводит к существенным изменениям микроокружения белковых макромолекул, а также способствует ускорению процессов гидролиза белков и пептидов. По мнению авторов, обнаруженные эффекты обусловлены, по крайней мере, частично, изменением свойств водной фазы в результате действия слабых магнитных полей, по – видимому, те же механизмы лежат и в основе данных о существенном изменении свойства комплексообразования с ДНК структурных положительно заряженных белков хроматина и полиагринина. На этом основании строится предположение о том, что воздействие слабых магнитных полей на белок-нуклеиновые взаимодействия в клетке будет влиять на экспрессию генома и такие процессы, как канцерогенез, старение, процессы радиационного повреждения и репарации клеток.
Известен также ряд работ по изучению ЭМП миллиметрового диапазона слабой мощности на солевые растворы молекул ДНК [11 – 13]. В работах Ю. С. Бабаяна и соавторов исследованы плотность и термостабильность водно-солевых растворов ДНК, облученных не тепловыми миллиметровыми электромагнитными волнами с резонансными и не резонансными частотами. Показано, что на частоте резонанса увеличивается термостабильность молекул ДНК. Авторы объясняют наблюдаемый эффект дегидратацией молекул ДНК.
Исследование волокон ДНК показали, что ДНК гидратирована и ее конформации зависят от содержания воды в образце. Не только общее водное окружение, но и отдельные молекулы воды важны для конформационного состояния и функционирования ДНК. Гидратация оснований нуклеиновых кислот, т.е. взаимодействие оснований с отдельными молекулами воды, играет важную роль в стабилизации двойной спирали. Доказательством данного предположения служит расчеты по вычислению минимумов энергии взаимодействия азотистых оснований ДНК с молекулами воды, произведенные в работе [14]. Данные расчеты гидратированных комплексных оснований ДНК показали, что геометрия этих комплексов очень чувствительна к взаимодействиям с одной или несколькими молекулами воды. Так, одной молекулы воды достаточно, чтобы изменить структуру комплекса оснований ДНК. Для аденина – одного из азотистых оснований – приведенные расчеты хорошо согласуются с экспериментальными данными для моно и триметилированных производных.
Последние данные, опубликованные в работе [15], свидетельствуют о том, что ЭМП НЧ вмешиваются в процесс репарации ДНК, приводя к образованию повреждений (разрывов) ДНК в клетках. Одновременно с этим увеличение количества разрывов ДНК при экспозиции клеток в ЭМП НЧ может быть объяснено активацией свободно радикальных процессов [16].
Однако есть и противоположные сообщения в литературе [17, 18], указывающие на отсутствие воздействия электромагнитных полей низких частот на клеточную ДНК. Исследования, проведенные с бесклеточной ДНК при нарушении репарации показали, что основные процессы, связанные с передачей генетической информации (активность ДНК-полимеразы, транскрипция и репарация) устойчивы к воздействию ЭМП НЧ (60 Гц, на 0,25 – 0,5 Тл) [19]. Точно так же, магнитные поля экологического уровня (10, 50 и 100 мкТл) не оказывали влияния на транскрипцию в бесклеточной системе [20].
Несмотря на многочисленные исследования, посвященные воздействию электромагнитных излучений различной частоты на биообъекты, до сих пор остается до конца не изученным механизм взаимодействия ЭМП НЧ на нуклеиновые кислоты, не решен вопрос, является ли ЭМП НЧ нетеплового уровня воздействия стрессором для биологических систем, и соответственно, может ли такое воздействие запускать адаптивные реакции в клетках. Нет четкой математической модели, описывающей процессы, происходящие в ДНК при таком воздействии. В связи с этим данный вопрос представляет большой интерес для нашего исследования.
1.2.2 Изменение флюоресценции в растворах белков
В работе [21] исследовали конформационные состояния белков, под действием слабых комбинированных постоянного и переменного магнитных полей при помощи спектрофлуориметрического анализа, а также была дана попытка объяснить процессы изменения в структуре воды.
Индукция B = 42мкТл, B = 40 нТл При обработке образцов суммарным сигналом, формально соответствующим циклотронным частотам ионных форм свободных молекул аминокислот: тирозина, аспаргина, глутаминовой кислоты, лизина и аспаргиновой кислоты. Также обработка растворов на моночастотах из суммарного сигнала, и на частотах 1, 3, 5, 10 Гц, и при отсутствии постоянного магнитного поля, и воздействии на образцы только переменной компонентой поля, при температуре 18 – 22 °C.
Цитохром C имеет слабую триптофановую флуоресценцию, как полагают, вследствие тушащего эффекта со стороны гематопорфирина, ковалентно прикрепленного к белковой части молекулы. После обработки магнитными полями, с суммарной переменной компонентой водного раствора цитохрома C, с концентрацией белка 100 мкг/мл собственная флуоресценция белка возрастает приблизительно в два раза [21]. Известно, что при денатурации гуанидинхлоридом в концентрации выше 6 М наблюдается возрастание собственной флюоресценции цитохрома С в 5 – 6 раз.
При обработке МП раствора БСА с концентрацией 30 мкг/мл происходит уменьшение собственной флуоресценции белка, что также можно объяснить его частичной денатурацией, поскольку гуанидинхлорид при концентрации выше 2 М вызывает снижение интенсивности флюоресценции.
Таким образом, при анализе действия МП на водные растворы двух белков, отмечены разнонаправленные изменения их собственной флуоресценции. Эти изменения совпадают с изменениями флуоресценции при действии хорошо изученного денатурирующего агента гуанидинхлорида, в частности, с изменениями, сопровождающими переход от нативного состояния белка к состоянию расплавленной глобулы. Величина эффекта действия магнитных полей на собственную флуоресценцию БСА зависит от концентрации белка в растворе. Зависимость интенсивности собственной флуоресценции БСА от времени его обработки магнитным полем носит нелинейный характер.
Зависимость спектральных характеристик раствора БСА от частоты пере-менного магнитного поля при фиксированной величине постоянного магнитного поля показывает наличие максимума изменения интенсивности флуоресценции, по сравнению с контролем частоты 3,7 Гц, входящей в диапазон поличастотного сигнала. Воздействие суммарным сигналом, в котором присутствует данная частотная гармоника, дает такой же эффект, как и одна частота 3,7 Гц. Действие магнитного поля на водный раствор БСА является обратимым.
Магнитная обработка водных растворов ферментов (щелочная фосфатаза, пероксидаза хрена), и добавление к маточному раствору этих белков обработанных полем растворителя, также приводит к структурным изменениям этих белков (увеличение флюоресценции на 3 – 5%), которые сопровождаются изменениями их ферментативной активности. Следовательно, можно говорить об универсальном биологическом действии слабого переменного и постоянного магнитных полей, регулирующих функциональную активность белковых макромолекул, через структурные изменения.
В зависимости от времени обработки растворителя магнитными полями возможно как усиление, так и ослабление флуоресценции. В течение нескольких часов после смешивания растворов, интенсивность флуоресценции снижается. Происходит постепенное накопление конформационных изменений в белках. Подобное усиление флуоресценции БСА и последующее её ослабление наблюдается при последовательных добавках к раствору гуанидинхлорида в зоне низких концентраций, подобные эффекты при действии гуанидинхлорида были описаны на растворах пероксидазы хрена [22].
В качестве критерия оценки измерений в структуре растворителя при маг-нитной обработке можно использовать собственную флуоресценцию воды [23]. После относительно длительной (2 – 4 ч) обработки растворителя магнитными полями, интенсивность как коротко волновой, так и длинно волновой флуорес-ценции возрастает в 2 – 4 раза по сравнению с исходным фоном и с контрольным образцом.
Изменения флуоресценции воды при обработке магнитными полями, можно объяснить появлением в воде свободных радикалов или перекиси водорода. Перекись водорода снижает интенсивность флуоресценции БСА на 2 –3%
Перекись водорода снижает интенсивность флуоресценции БСА на 2 – 3%, при концентрации порядка 10 М. Процесс образования перикиси в растворах БСА и цитохрома С ничтожно мал. Изменение конформации белков под влиянием магнитных полей, также связано с процессом формирования водных кластеров, которые приводят к изменению микроокружения белковой молекулы [24].
1.2.3 Действие СМП на белки и аминокислоты
В работе [25] обнаружено при действие на растворы аминокислот определенного переменного магнитного поля параллельного постоянному магнитному полю оказывает значительное влияние на силу ионного тока, при определенной частоте для раствора каждой аминокислоты. В итоге [26 – 29] была получена формула в какой-то степени объясняющая закономерности наблюдаемого явления, как циклотронную частоту, вычисляемую по формуле:
V ц = q B / 2 m, (1)
где Vц – циклотронная частота;
q – заряд иона кальция;
m – масса иона кальция;
B – переменное МП.
В результате действия на группы ионов аминокислоты электрических и магнитных полей образуется коллективное полиионное молекулярное образование – кластер [30], который взаимодействует с внешними полями как отдельная структура. С увеличением числа ионов в кластере его суммарная энергетика превышает уровень kT, необходимый для стабилизации структуры. В результате время жизни кластера превысит циклотронный период. Электрическая энергия, аккумулирующаяся в кластерах, обеспечит образование межмолекулярных связей. Циклотронная частота кластера равна циклотронной частоте отдельного иона.
Первичной мишенью сверхслабого магнитного поля могут служить магнитные моменты [31], создаваемые ядерными спинами атомов. В рамках предложенной модели внешнее магнитное поле вызывает намагниченность среды, состоящей из частиц, обладающих ненулевым ядерным спином.
Намагниченность среды может влиять на ход ряда биохимических реакций, в том числе на реакцию кислорода c различными радикалами. Это существенно (на 30 – 60 %) увеличивает скорость реакций. Действие слабых комбинированных магнитных полей объяснено в работе [32]. В ней было рассмотрение водной среды как комплекса когерентных и некогерентных доменов. В этом случае слабые комбинированные магнитные поля в когерентных доменах воды, включающих молекулы аминокислот, могут оказывать эффекты по типу циклотронного резонанса, так как трение внутри этих доменов на порядок меньше, чем в неструктурированной водной фазе. В [33] биологическая активность переменного магнитного поля равного 50 мкТл в составе СКМП замечена на плантациях, диатомовых водорослях, лимфоцитах и т.д. Подобные явления связывают с действием слабых магнитных полей на ионы Са 2+. Это казалось вполне очевидным в связи с тем, что ион кальция участвует во многих биохимических реакциях и обладает магнито – чувствительностью.
Отсутствует строгая зависимости локализации сайтов гидролиза белков от частоты переменного магнитного поля, и непосредственное участие водной фазы в реализации эффекта. При действии слабых магнитных полей водная среда изменяет свои свойства, что приводит к изменению гидратных оболочек белков и/или генерации перекисей. В этих условиях пептидные связи в большей степени становятся подверженными атакам окружающих белков молекул воды или перекисей.
Универсальный механизм, который объясняет действие слабых магнитных полей возможно связан c продукцией АФК. Также возникновение эффектов слабых комбинированных магнитных полей вполне может быть связано с увеличением генерации перекисных радикалов [34].
C другой стороны, известно, что даже высокоочищенная вода содержит фоновые концентрации (десятки нм) перекисей. Эти обстоятельства затрудняют экспериментальный анализ данной ситуации.
Другая теория взаимодействия магнитных полей объясняется посредством намагниченности среды, окружающей реакционный комплекс [35], показано что низкочастотное слабое МП может влиять на вероятность образования пероксирадикалов в биологических системах. Теоретически обоснована связь между экспериментально наблюдаемыми эффектами и параметрами внешнего поля. Найдены оптимальные параметры магнитного поля, приводящие к повышению концентрации пеpокcиpадикалов.
1.2.4 Образование радикальных пар под действием МП
На протяжении многих лет, эффекты магнитного поля в химических системах были исследованы [21 – 23], и была создана теория радикального механизма образования пар. В частности, исследования птичьей магниторецепции стимулировало большой интерес в прошлом десятилетии, Ritz и др. [36], доказал что роль биологического рецептора может исполнять фоторецептор криптохрома. Было установлено, что криптохром и фотолиаза белки обладают необходимыми физическими свойствами, и могут участвовать в физико-химических процессах. [37].
Исследование криптохромных белков, показало, что магнитные поля могут изменять скорость и выход химических реакций с участием спин-коррелированных радикальных пар в качестве промежуточных ступеней взаимодействия. Такие эффекты были подробно исследованы экспериментально и теоретически в различных химических системах. Однако возможность протекания таких процессов в биологических системах еще не определена. В частности синий свет фоторецепторов криптохрома и фото возбуждение его связанного флавиным кофактором, действительно было показано, что приводит к образованию РП.
Процесс образования РП состоит в том, что распад электронно-возбужденных молекул происходит достаточно быстро, так что спины электронов не успевают изменить свое состояние, они наследуют то состояние, которое они имели в молекуле – предшественнице. Следовательно, если молекула распадается из электронно – возбужденного синглетного состояния на два свободных радикала, то рождается пара радикалов, у которой неспаренные электроны находятся в синглетном состоянии. Если же молекула распадается из электронно-возбужденного триплетного состояния на два свободных радикала, то рождается пара радикалов, у которой неспаренные электроны находятся в триплетном состоянии. В обоих случаях оказывается, что радикальные пары образуется в квантовом когерентном состоянии. Радикальные пары образованные с поверхностей подвергшихся воздействию остатков белка, как правило, используются чтобы дать избирательные улучшения сигнала ЯМР. Первое более детальное исследование использования такого белка поверхности опубликовал Mohtat и др. [38], они показали действие МП на бычий сывороточный альбумин, человеческий сывороточный альбумин и ДНК тимуса теленка, с образованием РП. Изменение скоростей рекомбинации радикальных пар является одним из нескольких механизмов, посредством которых статистические магнитные поля могут взаимодействовать с биологическими системами.
Условия, при которых возникает спиновая когерентность в элементарном химическом акте:
1. Процесс должен быть неадиабатическим с точки зрения спинов, т.е. это означает, что за время движения атомов вдоль координаты реакции на расстояние порядка 0.1 нм, т.е. время порядка 10–12 секунды, магнитные взаимодействия не должны успеть заметно, изменить состояние спинов.
2. Спин-гамильтонианы системы в состоянии реагентов и в состоянии продуктов, т.е. в начале и в конце элементарного химического акта не должны коммутировать. В общем случае эти операторы могут коммутировать только в результате случайного стечения обстоятельств.
1.2.5 Воздействие статических МП на образование радикалов
Взаимодействие СМП с живыми организмами быстро развивающейся области исследований. Воздействие СМП может повысить активность, концентрацию и время жизни парамагнитных свободных радикалов, которые могут вызвать окислительный стресс, генетические мутации, а также раковые опухоли. Есть четыре параметра СМП соответствующие взаимодействия с биологической системой: ткань-мишень, магнитные характеристики, доза облучения, и градиент поля , все четыре параметра играют важную роль в изучении биологических эффектов СМП [39]. Генотоксические последствия воздействия статических магнитных полей были в основном рассмотрены в клеточных культурах. Биологически свободные радикалы обычно кислород или азот с неспаренным электроном, что приводит к образованию АФК, таких как супероксид-аниона (O2-), гидроксильных радикалов и синглетного кислорода, или оксид азота (NO). Активные формы азота и кислорода играют важную роль в иммунологической защиты, внутриклеточной сигнализации, и межклеточной коммуникации [40, 41]. Предполагается, что СМП может изменить жизни радикальных пар. СМП влияет на спин электронов у свободных радикалов, которые могут привести к изменениям в химической кинетики реакции [42].
Amara и др. [43] исследовали влияние облучения СМП на функции яичек и антиоксидантного порога у крыс. Воздействие СМП (128 мТл; 1 ч / день в течение 30 дней) не имеет никакого влияния на количество придатка спермы, подвижности сперматозоидов и половых веса органов, но вызывает увеличение малонового диальдегида в семенниках. В гонадах, СМП уменьшает каталазу, глутатионпероксидазу, и митохондриальную Mn – СОД активность, и не влияет, на цитозольную Cu Zn – СОД активность. Активность Cu Zn – СОД, каталазы, и малонового диальдегида, в лобной коре мозга крысы уменьшается под действием СМП. Такие же воздействия СМП уменьшили Cu Zn – СОД и Mn – СОД активность в гиппокампе, т.е. создали окислительный стресс. СМП повышает концентрацию и время жизни свободных радикалов что в последствии вызывает повреждение мембраны и лизис клеток. Таким образом, существует возможность повреждения ДНК свободными радикалами, которые образуются внутри клеток. M. Berk, S. Dodd, и др. [44] показали, что СМП повышает активности свободных радикалов в клетках с помощью реакции Фентона. Реакция Фентона - это процесс катализации железа, в котором пероксид водорода, продукт окисления в митохондриях, преобразуется в гидроксильные свободные радикалы, которые являются сильными цитотоксическими молекулами.
Влияния облучения СМП на повреждение ДНК в Thp1 клетках (линии моноцитов). Клеточные культуры в пробирке подвергали воздействию СМП (250 МТ) в течение 1 ч, 2 ч, 3 ч и. Результаты показали, что жизнеспособность облученных клеток была несколько ниже контрольной группы. Анализ ДНК с помощью электрофореза отдельных клеток (кометный анализ) показал, что воздействие СМП не оказывает какого-либо повреждения ДНК облученных в течение 1 и 2 ч., однако наблюдались разрывы одноцепочечной ДНК в клетках после 3 ч облучения Для дальнейшего изучения окислительного повреждения ДНК, клеточную ДНК выделили, гидролизовали и анализировали с помощью ВЭЖХ. Уровень 8 – оксо – 7,8 – дигидро – 2' – дезоксигуанозина осталась неизменным по сравнению с контрольной группой (+ 6,5%,). Результаты показали, что воздействие СМП (250 мТл, при 3 ч) не вызывает окислительный стресс и повреждение ДНК в клетках Thp1 [45].
Hassan Sahebjamei и др [46]. проводили исследование, в котором изучалось действие СМП на ферментативную активность клеток табака в растворе суспензии. В результате активность СОД в суспензиальной культуре клеток табака после действия МП в 10мТ и 30мT была значительно выше, чем в контрольной группе, однако происходит снижение активности каталазы. Причем уменьшение активности больше при индукции в 10мТ, чем при индукции в 30мТ.
1.3 Методы исследования водных растворов аминокислот и ДНК
1.3.1 ИК – спектроскопия
Метод ИК – спектроскопии дает возможность получить сведения об относительных положениях молекул в течение очень коротких промежутков времени, а также оценить характер связи между ними, что является принципиально важным при изучении структурно – информационных свойств водных систем [47, 48].
Известно, что ядра молекул вдали от фиксированных положений по отношению друг к другу находятся в непрерывном колебательном состоянии. Важная особенность этих колебаний в том, что они могут быть описаны ограниченным числом основных колебаний (нормальные моды). Нормальной модой называется колебание, при котором ядра осциллируют с одинаковой частотой и в одной фазе. Молекулы воды имеют три нормальные моды (рис. 4).
симметричное деформационное асимметричное
O O O
H H H H H H
1 2 3
3656,65см-1 1594,59 см-1 3755,79 см-1
Рисунок 4 – Формы колебаний молекул воды и их частоты.
Движения ядер при колебаниях 1 и 3 происходят почти вдоль направления связей О – Н, эти моды обычно называют колебаниями растяжения связи (или ОН) или валентными колебаниями связи О – Н. При колебаниях 2 ядра Н движутся в направлении почти перпендикулярных связям О – Н, мода 2 называется деформационным колебанием связи Н – О – Н или колебанием изгиба водородной связи. Мода 3 называется ассиметричным валентным колебанием в отличие от симметричного валентного колебания 1.Переход молекулы воды из ее основного колебательного состояния в возбужденное описываемое с помощью моды 2 соответствует инфракрасной полосе 1594,59 см-1 (табл. 2).
Таблица 2 – Сопоставление основных полос поглощения молекулы HO в ИК - спектрах.
|
Типы колебания
|
Положения максимума полос поглощения, см-1
|
|
Крутильное L
|
780
|
|
Деформационная 2
|
1645
|
|
Составная L + 2
|
2150
|
|
Валентное симметричное 1
|
3450
|
|
Валентное симметричное 3
|
3600
|
|
Обертоны 22
|
3290
|
Гидроксильная группа – ОН способна сильно поглощать спектр в ИК области спектра. Вследствие своей полярности эти группы обычно взаимодействуют друг с другом или с другими полярными группами, образуя внутри- и межмолекулярные водородные связи. Гидроксильные группы, не участвующие в образовании водородных связей обычно дают в спектре узкие полосы, а связанные группы интенсивные широкие полосы поглощения при более низких частотах. Величина сдвига частот определяется прочность водородной связи. Наиболее изучена область основных частот. Для мономерной воды полосы 3725 и 3627 см-1 отнесены к симметричному и антисимметричному колебаниям ОН-группы, а полосы 1600 см-1 – к деформационному колебанию.
Для жидкой воды наблюдаются полосы поглощения и в других областях спектра. В табл. 2 приведены волновые числа и длины волн, а также типы колебаний. При переходе от мономеров воды к димерам и тримерам максимум поглощения валентных колебаний связи О – Н сдвигается в сторону меньших частот. Напротив, для деформационных колебаний Н – О – Н наблюдается смещение в сторону более высоких частот.
Полосы поглощения 3546 и 3691 см-1 были отнесены к валентным модам димеров (Н2О)2. Эти частоты значительно ниже, чем валентные моду 1 и 3 изолированных молекул воды (3657 и 3756 см-1 соответственно). Полоса 3250см-1 представляет собой обертоны деформационных колебаний. Между частотами 3250 и 3420 см-1 возможен Ферми-резонанс (этот резонанс представляет собой заем интенсивности одного колебания у другого при их случайном перекрывании).
Важной характеристикой поглощения, является также его интенсивность. Поглощение ИК излучения наблюдается только тогда, когда колебание приводит к изменению распределения заряда внутри молекул, чем больше это изменение, тем сильнее поглощение, т.е. тем выше интенсивность полосы поглощения. Следовательно, чем более полярна группа или связь, тем больше интенсивность соответствующей полосы поглощения, и наоборот – интенсивность неполярной связи равна нулю, т.е. данное колебание в ИК области неактивно и не проявляется. Кроме этого, интенсивность полосы поглощения зависит от других факторов: от концентрации данного вещества; инструментальных причин (ширина щели прибора) и др.
В настоящее время еще не найдено универсальной постоянной для выражения интенсивности ИК поглощения. В качестве определения она обозначается: о.с. – очень сильная, с. – сильная, ср. – средняя, сл. – слабая, о. сл. – очень слабая.
Поглощение ИК-излучения веществом. В двухатомной молекуле АВ атомы А и В удерживаются в определенном положении весьма прочно, однако не совсем жестко. В молекуле могут происходить следующие типы движений 1) поступательное движение молекулы как целого, которое может рассматриваться как движение центра масс; 2) вращение молекулы вокруг центра масс; 3) колебание отдельных атомов, происходящие таким образом, что положение центра масс не изменяется и молекула не вращается; 4) движение электронов в молекуле; 5) вращение электронов и ядер атомов вокруг своих осей (спины электронов и ядер). Таким образом, полная энергия молекулы является суммой поступательной, вращательной, колебательной и электронной энергий. Поступательная энергия мало влияет на молекулярные спектры. Относительные энергии трех различных молекулярных состояний для двухатомной молекулы представлены на Разница между вращательными уровнями составляет сотые доли эВ, между колебательными уровнями – десятые доли эВ и между электронными уровнями – единицы эВ. Колебательные движения в молекуле называются нормальными (собственными или фундаментальными) колебаниями или нормальными модами. Эти колебания совершаются при отсутствии внешнего воздействия за счёт первоначально накопленной энергии (вследствие наличия начального смещения или начальной скорости). Они представляют собой независимые повторяющиеся смещения атомов, при которых положение центра масс не меняется, причем все атомы колеблются в фазе с одной и той же частотой.
Нормальные колебания совершаются с некоторой частотой v, определяемой массами обоих атомов и упругими силами связей. Амплитуда колебаний увеличивается при поглощении молекулой энергии. ИК – излучение, вследствие малой энергоемкости, не затрагивает электроны в молекуле, поэтому с ИК – спектроскопией напрямую связаны случаи вращательного и колебательного движения. Причем чисто колебательных спектров не существует, так как молекулы в основном и возбужденном колебательном состояниях распределены по ряду вращательных состояний, и при переходе молекулы из одного колебательного состояния в другое одновременно происходит изменение их вращательных состояний. Поэтому при рассмотрении колебательных переходов необходимо учитывать вращательные состояния.
Способность вещества поглощать энергию ИК – излучения зависит от суммарного изменения дипольного момента молекулы при вращении и колебании, т.е. поглощать ИК – излучение может лишь молекула, обладающая электрическим дипольным моментом, величина или направление которого изменяется в процессе колебания и вращения. Дипольный момент означает несовпадение центров тяжести положительных и отрицательных зарядов в молекуле, т. е. электрическую асимметрию молекулы. Энергетические уровни молекулы строго квантованы (т.е. имеют определенные дискретные значения, соответствующие устойчивым (стационарным) состояниям системы) и поэтому молекула поглощает только те частоты ИК–излучения, энергия которых соответствует разностям между двумя уровнями энергии связи. Следовательно, возрастание амплитуды колебания происходит не постепенно, а скачкообразно. Колебательно-вращательный спектр определяется строением молекулы и состоит из отдельных полос. Число и частоты полос в спектре зависят: а) от числа образующих молекулу атомов; б) масс атомных ядер; в) геометрии и симметрии равновесной ядерной конфигурации; г) потенциального поля внутри молекулярных сил. Интенсивность полос в спектре определяется электрическими свойствами молекулы: электрическим дипольным моментом и поляризуемостью, а также их изменением в процессе колебаний.
Экспериментальные исследования большого числа молекул, обладающих одними и теми же химическими группами, показали, что, независимо от изменений в остальной части молекулы, эти одинаковые группы поглощают в узком интервале частот. Такие частоты получили название характеристических или групповых.
Существование характеристических частот можно объяснить следующим образом. Колебания определенной группы атомов или связей могут быть слабо связаны с колебаниями атомов остальной части молекулы. В этом случае частота колебаний этой группы или связи зависит только от их строения и мало зависит от окружающих атомов и связей. Вследствие этого различные молекулы, содержащие данную группу атомов или связей, будут характеризоваться различными колебательными спектрами, однако в каждом из них будет присутствовать одна или несколько одинаковых или почти одинаковых частот.
Установление характеристических частот позволяет, не производя никаких расчетов, определять по спектру присутствие в молекуле различных групп и связей и тем самым установить строение молекулы.
Спектры с помощью Фурье – спектрометров получают в два этапа. Сначала регистрируется интерферограмма т.е. выходной световой поток в зависимости от разности хода разделенной на когерентные пучки входной волны от источника. Затем путём обратного преобразования Фурье (по разности хода) вычисляется спектр. Вторая часть требует относительно большого объема вычислений, поэтому метод получил широкое распространение только с появлением современных компьютеров. Однако сложность получения спектров с помощью Фурье – спектрометров значительно перекрывается преимуществами над другими спектральными приборами:
1) С помощью Фурье-спектрометров можно регистрировать одновременно весь спектр; 2) Благодаря тому, что в интерферометре входное отверстие больших размеров, чем щель спектральных приборов с диспергирующим элементом такого же разрешения, то Фурье-спектрометры по сравнению с ними имеют выигрыш в светосиле. Это позволяет: а) уменьшить время регистрации спектров; б) уменьшить отношение сигнал – шум; в) повысить разрешение; г) уменьшить габариты прибора; 3) Фурье – спектрометры выигрывают также в точности отсчета длины волны. В дифракционных приборах длину волны можно определить только косвенно, а в Фурье-спектрометрах она определяется непосредственно.
Рассмотрим основные принципы работы ИК – Фурье спектрометров и технику ИК – спектроскопии, с помощью которой исследуются ИК спектры молекул на примере ИК-Фурье спектрометра Tensor 27 Bruker. (рис. 5)
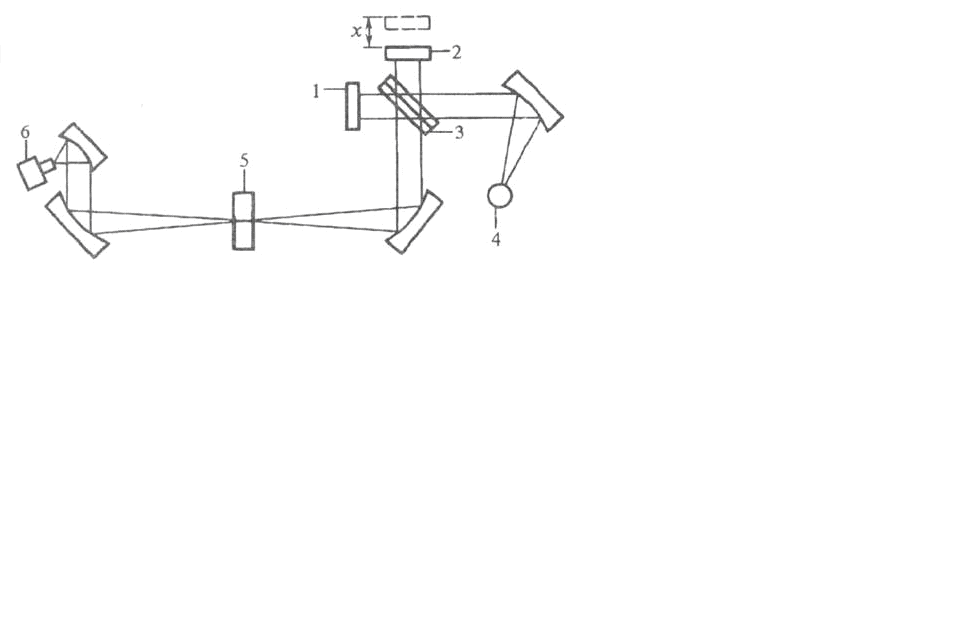
1 – неподвижное зеркало интерферометра, 2 – подвижное зеркало, 3 – светоделительная пластина (светоделитель), 4 – источник излучения, 5 – исследуемый образец, 6 – детектор излучения
Рис. 5. Оптическая схема ИК – фурье спектрометра Tensor 27 Bruker
Интерферометр содержит два взаимно перпендикулярных зеркала - неподвижное 1 и подвижное 2 и полупрозрачную светоделительную пластину 3, расположенную в месте пересечения падающих пучков излучения и пучков, отраженных от обоих зеркал. Пучок излучения от источника 4, попадая на пластину 3, разделяется на два пучка. Один из них направляется на неподвижное зеркало 1, второй – на подвижное зеркало 2; затем оба пучка, отразившись от зеркал, выходят через светоделитель из интерферометра в одном и том же направлении. Далее излучение фокусируется на образце 5 и поступает на детектор излучения 6. Два пучка отличаются друг от друга оптической разностью хода, величина которой меняется в зависимости от положения подвижного зеркала. В результате интерференции пучков интенсивность результирующего потока I (х) периодически меняется (модулируется). Частота модуляции зависит от частоты падающего излучения и смещения подвижного зеркала х. В результирующей интерферограмме выделяется так называемая точка нулевой разности хода, или точка белого
1.3.2 Флюоресценция
Флуоресценция – это одно из явлений, которые могут происходить во время взаимодействия электромагнитного излучения с веществом.
При нормальных условиях подавляющее большинство молекул находится в основном электронном состоянии. Молекулы могут поглощать кванты электромагнитного излучения определённой энергии и переходить в возбуждённое состояние. Это соответствует переходу одного электрона с высшей занятой на самую низкую свободную молекулярную орбиталь. Согласно их мультиплетности, основное и возбуждённое электронные состояния обозначают S0 и S1. Возбуждение большинства флюорофоров S0 S1 происходит под действием коротковолнового ультрафиолетового (длина волны 300 – 400 нм) или видимого (длина волны 400 – 800 нм) света. После перехода флюорофора в возбуждённое состояние происходит релаксация – процесс, при котором молекула теряет часть энергии; при этом она опускается до самого низкого колебательного подуровня электронного уровня S1 (рис. 5). В жидкой среде при нормальных условиях этот процесс происходит за время порядка нескольких пикосекунд (1012 с). Согласно правилу Коши именно с самого низкого колебательного подуровня электронного уровня, S1 происходит переход в основное электронное состояние, что сопровождается флуоресценцией. Из – за потери энергии во время релаксации и по некоторым другим причинам флуоресцентное излучение имеет меньшую энергию (и соответственно большую длину волны) по сравнению со светом, который поглощается во время возбуждения. Флуоресценция стала быстрым и чувствительным методом исследования структуры, динамики и функций биологических макромолекул - нуклеиновых кислот и белков [49, 50].
Квантовый выход флуоресценции показывает, с какой эффективностью проходит данный процесс. Он определяется как отношение количества испускаемых и поглощаемых фотонов. Квантовый выход флуоресценции может быть рассчитан по формуле 2.
Ф = N исп / N погл , (2)
где Nисп – количество испускаемых фотонов;
Nпогл – общее количество поглощенных фотонов.
Чем больше квантовый выход флуорофора, тем интенсивнее его флуоресценция. Квантовый выход можно также определить с помощью упрощенной диаграммы Яблонского [51] (рис. 6).
�
Рисунок 6 – Схематическое изображение флюоресценции.
Тогда доля флуорофоров, возвращающихся в основное состояние с испусканием фотона, и следовательно, квантовый выход:
Ф = Г / Г + knr, (3)
где Г – константа скорости излучательной дезактивации возбужденного состояния,
knr – константа скорости безызлучательной дезактивации возбужденного состояния.
Из формулы следует, что Ф 1 если Кnr / Г 0 , то есть если скорость безызлучательного перехода значительно меньше скорости излучательного перехода. Стоит отметить, что квантовый выход всегда меньше единицы из-за стоксовых потерь. Энергия кванта света, поглощенного при переходе из основного состояния в возбужденное, и из возбуждённого состояния в основное:
Е погл = Е0 + 1 / 2 ms 2s q2s (4)
Е изл = Е0 – 1 / 2 ms 2s q2s (5)
Средняя энергия, выделяемая при переходе называется стоксовыми потерями:
P S = 1 / 2 (Е погл – Е изл) (6)
Природа люминесцентного излучения может быть рассмотрена на простейшей энергетической модели молекулы (рис. 7)
Перераспределение электронов после поглощения света при флюоресценции происходит в очень короткий период времени (10–8 – 10–9с).
Переходы «г» соответствуют процессу колебательной дезактивации молекул и происходят во время столкновения с молекулами других веществ или растворителями. Они не сопровождаются излучением лучистой энергии.
С выделением лучистой энергии происходит только переход «д». При этом энергия переходов:
Ед = Еа < Еб < Ев , (7)
Е =h (v0b – v0н) (8)
или другими словами:
Е изл Е погл (9)
погл > изл; (10)
погл < изл.. (11)
Спектр излучения при этом сдвигается в сторону более длинных волн. Это положение формируется правилом Стокса: люминесцентное свечение находится в более длинноволновой части спектра, чем поглощённый свет (рис. 8).
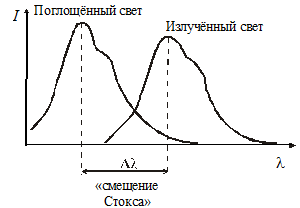
Рисунок 8 – Схематическое изображение закона Стокса – Ломмеля
Закон Стокса – Ломмеля более чётко формулирует это положение спектр флюоресценции, и его максимум всегда сдвинут по сравнению со спектром поглощения и его максимумом в сторону боле длинных волн.
Флюоресценция характеризуется четырьмя основными свойствами:
- спектром поглощения и флюоресценции;
- выходом флюоресценции;
- длительностью флюоресценции;
- поляризацией флюоресцентного излучения.
Одной из важных характеристик люминесценции является ее выход. Различают выход люминесценции энергетический Вэн, равный отношению излучаемой энергии к поглощенной и квантовый Вкв, равный отношению числа квантов излучаемых к числу поглощенных квантов светового потока:
, (12)
. (13)
Исходя из закона Стокса – Ломмеля, можно сделать заключение, что интенсивность флюоресценции Iфл пропорциональна числу квантов Nфл вторичного излучения:
, (15)
где I0 – интенсивность входящего пучка,
Bкв – квантовый выход флюоресцении
– показатель поглощения
c – концентрация растворенного вещества
l – толщина слоя излучающего вещества
К – концентрация излучающего вещества
При достаточно малых концентрациях вещества в растворе, когда квантовый выход В кв постоянный, и при стандартных условиях анализа (I0, , l = const) получаем, что интенсивность люминесценции пропорциональна концентрации флюоресцирующего вещества.
2 Экспериментальная часть
2.1 Материалы и методы исследования
Для обработки плазмы крови ЭМП НЧ, была использована следующая установка, блок-схема которой представлена на рис. 9. Она состояла из генератора ГЗ – 118, катушки индуктивности, имеющей 1200 витков и экранированной камеры. Интенсивность магнитной индукции ЭМП, создаваемого катушкой, составляет 4,8 млТл, удельное сопротивление катушки 320 Ом, и напряжение на катушке равно 14 В. Катушка индуктивности находилась в экранированной камере, и была подключена к генератору ГЗ – 118, на котором и выставлялась необходимая частота подачи сигнала на катушку индуктивности.
Генератор ГЗ – 118 низкочастотных сигналов представляет собой источник синусоидального сигнала прецизионной формы волны и предназначен для исследования, настройки и испытаний систем и приборов. Отличительной чертой этого генератора является - очень низкий коэффициент нелинейных искажений.
1– генератор ГЗ – 118, 2 – экранированная камера,
3 – катушка индуктивности, 4 – исследуемый образец
Рисунок 9 – Блок – схема установки для воздействия
ЭМП НЧ на плазму крови клетки (ДНК).
Толщина слоя при снятии ИК – спектров 5мм, при получении спектров флуоресценции 9мм. Время обработки от 3 до 15мин и амплитуда 80мкТл являются константами в ходе работы.
Для получения ИК спектров использовался Фурье ИК – спектрометр Tensor 27 Bruker (Германия). Спектральный диапазон 370 – 7500 см-1, разрешение 1 см-1, скорость сканирования 6 мм/с, соотношение сигнал-шум (пик к пику) 8,000 : 1 (5 сек, разрешение 4 см-1).
Для получения Спектров флуоресценции использовался Спектрофотометр FL – 2700 FL. Спектральный диапазон испускания 220 – 740 нм, длина волны возбуждения 300 нм, скорость сканирования 1500 нм/ с, ширина шили испускания и поглощения 10 нм.
Аминокислота триптофан является химически чистой. Взвешивание происходило при помощи весов Ohaus Pioneer PA214C, которые по ГОСТ 24104-2001 имеют I, специальный класс точности.
2.2 Объекты исследования
Объектом исследования были водные растворы плазмы ДНК, c концентрацией 30 мг/л. Растворы плазмы крови готовились с использованием в качестве растворителя дистиллированной воды, так как данный растворитель создает в пространстве вокруг молекулы среду схожую с условиями существования ДНК в биологических системах.
Кроме того были отдельно обработаны две аминокислоты составляющих структуру ДНК, а именно триптофан (C11 H12 N2 O2), и глицин (NH CH COOH) c концентрацией 0,01 М. Растворы аминокислот готовились с использованием в качестве растворителя 0,1 М NaCl.
2.3 Результаты проведенного исследования
На ИК – спектрах водных растворов ДНК, выделенных из цельной крови человека, после их облучения ЭМП НЧ наблюдали появление новых пиков в спектральной области 460 – 450 см-1(1 – й пик) и 1100 – 1000 см-1 (2 – й пик), величины которых зависели от частоты применяемого для облучения ЭМП НЧ (рисунки 10 – 11).
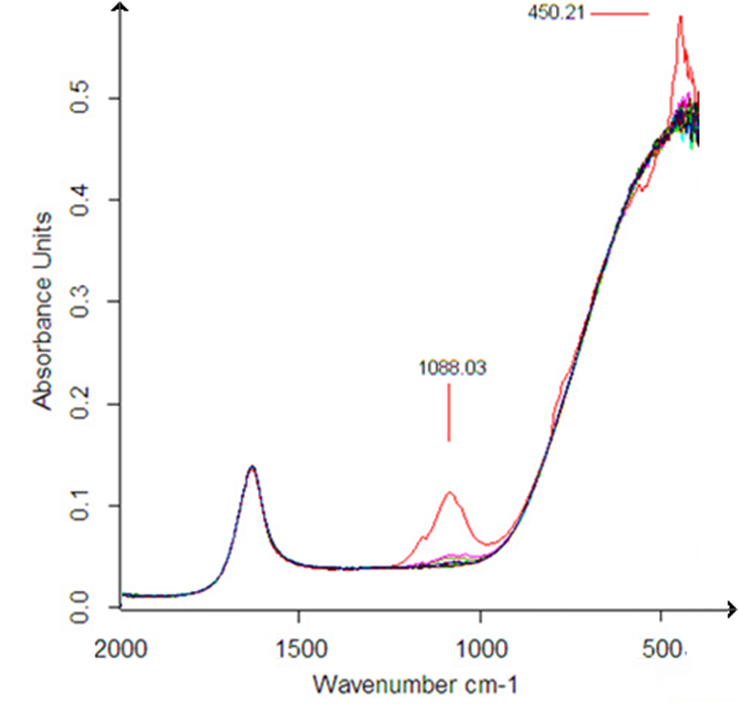
Рисунок 10 – ИК – спектры водных растворов ДНК, выделенной из цельной крови человека, облученные ЭМП НЧ, при 4 С
Как видно из рисунка 7, величины пиков поглощения ДНК, выделенной из цельной крови человека, находятся на частотах 450 см-1 (1 пик) и 1088 см-1 (2 пик), что соответствует областям крутильных и деформационных колебаний молекул воды.
Следует отметить, что величины пиков поглощения зависят не только от частоты облучения ЭМП, но также и от температуры. При комнатных температурах наблюдается большая дестабилизация водных растворов ДНК. Поэтому эффект зависимости адсорбции исследуемого образца от частоты ЭМП выражен не так отчетливо. На рисунке 8 представлены ИК – спектры водных растворов ДНК, выделенной из цельной крови человека и обработанные на частотах от 7 до 9,2 Гц, с шагом 0,2 Гц, при 23 С.
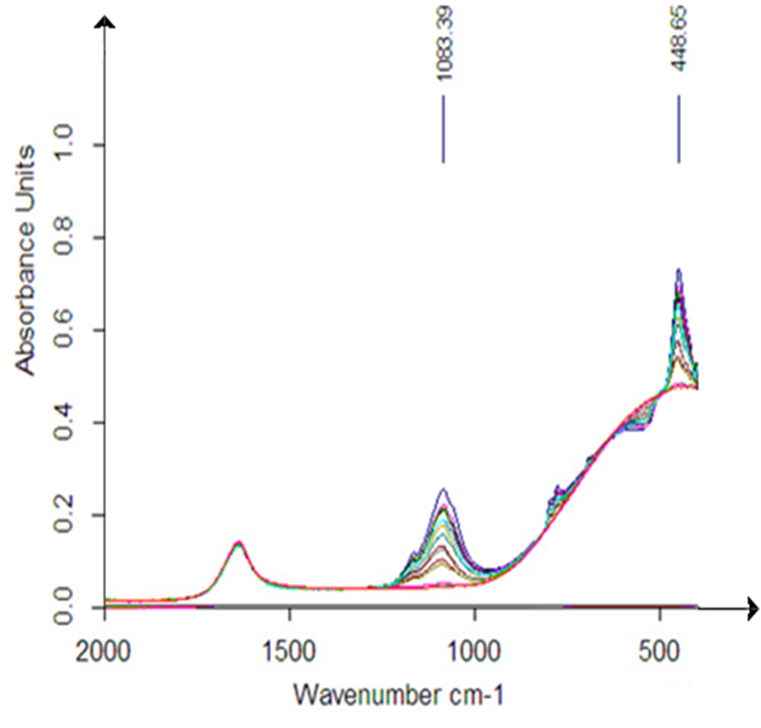
Рисунок 11 – ИК – спектры водных растворов ДНК, выделенной из цельной крови человека, облученные ЭМП (красным цветом без облучения) на частотах от 7 до 9,2 Гц.
На рисунке 11 построены зависимости высот данных пиков при частоте облучения 450 см-1 и частоте 1088 см-1 растворов ДНК, выделенной из цельной крови человека от частоты воздействующего ЭМП.
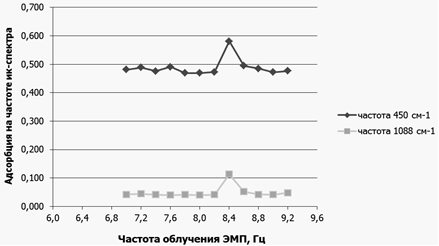
Рисунок 12 – Зависимость величин адсорбции пиков ИК-спектра раствора ДНК, выделенной из цельной крови человека, от частоты ЭМП
Из рисунка 11 видно, что наибольшее влияние на растворы ДНК, выделенные из цельной крови человека, оказывает ЭМП с частотой 8,4 Гц.
В ходе анализа ИК – спектров растворов триптофана с концентрацией 0,01М, взятых при различных температурах, и облученных ЭМП НЧ (рис. 10) с B = 80 мкТл и v = 8,4 Гц, была получена зависимость (рис. 11) . Из полученной зависимости видно, что интенсивность адсорбции увеличивается с ростом температуры.
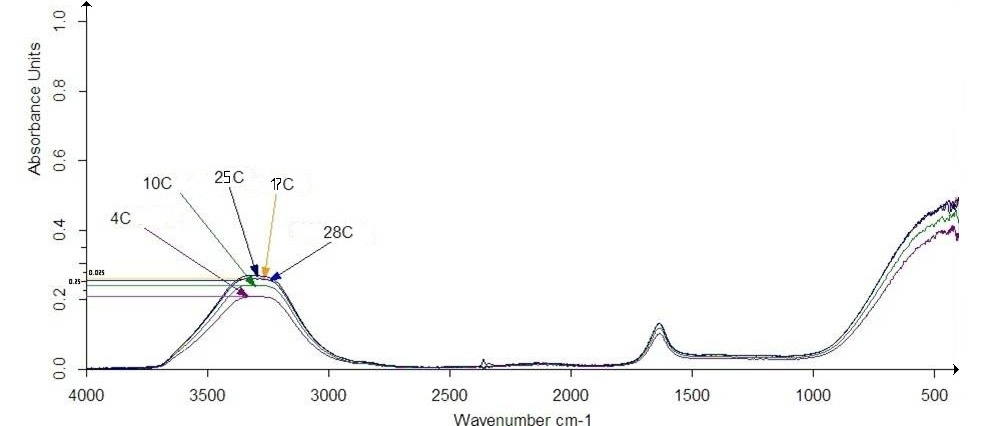
Рисунок 13 – ИК – спектр растворов триптофана (С = 0,01 М) в растворе 0,1 М Na Cl, полученный после облучения ЭМП НЧ (B = 80 мкТл, v = 8,4 Гц).
Рисунок 14 – Зависимость интенсивности полосы поглощения с максимумом при 3300 см-1 от температуры при действии ЭМП НЧ на раствор триптофана
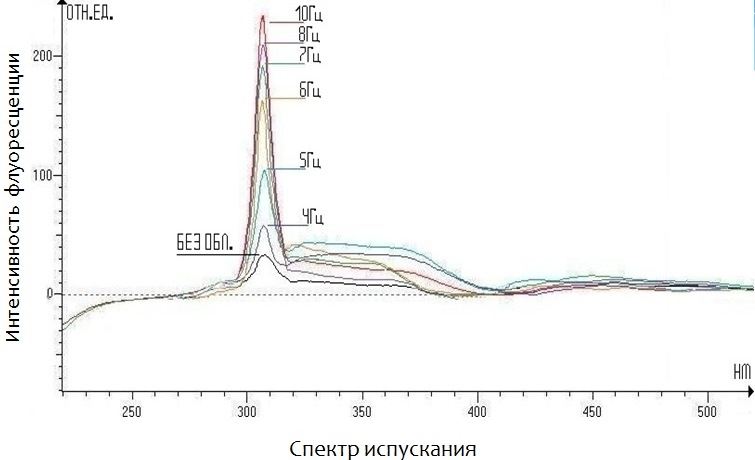
Рисунок 15 – Интенсивность флуоресценции растворов ДНК, после обработки ЭМП различной частоты возб = 300 нм
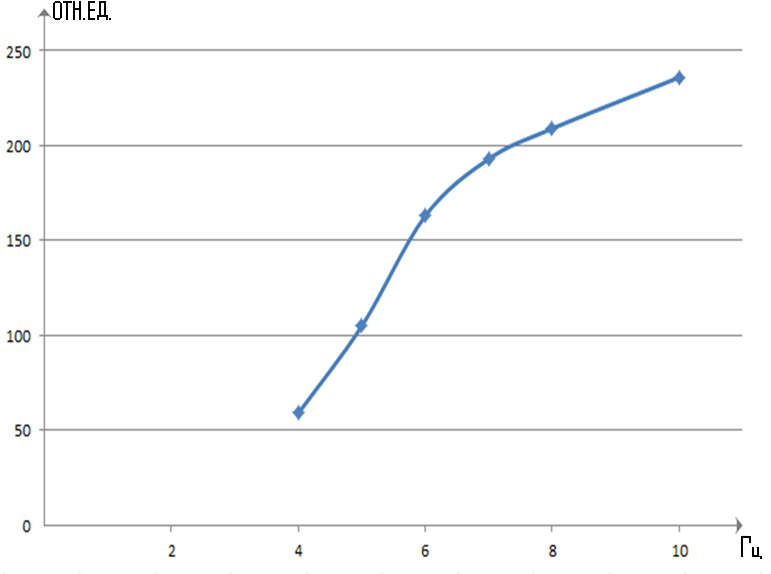
Рисунок 16 – График зависимости интенсивности флуоресценции ( возб = 300нм) от частоты ЭМП
2.4 Обсуждение результатов
В ходе проведенных исследований выяснено, что на ИК-спектрах растворов триптофана с концентрацией 0.01 M, полученных после облучения ЭМП НЧ наблюдается изменение полос поглощения в интервалах от 3000 до 3625, от 1575 до 1625, и от 500 до 800, что может быть связано с изменением состояния молекул аминокислоты в растворе.
При облучении ЭМП различной частоты раствора глицина с концентрацией, не влияло на вид ИК-спектров, что свидетельствует о невосприимчивости растворов глицина к данным параметрам МП. Механизмы действия слабых МП на аминокислоты в настоящее время мало изучены. Предложенная кластерная гипотеза механизма действия слабых ЭМП в водных растворах аминокислот предусматривает вероятность реализации динамических состояний типа «кластерного взрыва». Выброс энергии в диссипативной системе раствора, наступающий при согласованной потери устойчивости полиионных кластеров, может являться следствием резонансного действия слабого переменного поля. В этих условиях вероятность преобразования электрической энергии, аккумулированной в кластерах, в энергию устойчивых межмолекулярных связей.
Время обработки растворов было в диапазоне от 3 до 15 мин в результате было обнаружено что ярко выраженные пики появляются при времени обработки от 7 до 11 мин этот факт говорит в пользу теории об образовании полиионных кластеров в структуре растворителя. Эти кластеры имеют неустойчивую структуру и распадаются в течении небольшого промежутка времени тем самым создавая огромное количество свободных радикалов, которые в дальнейшем благодаря неспаренному электрону способны вступать во взаимодействие с молекулой ДНК и вследствие чего разрушать ее как было показано в работах ранее. В экспериментах при анализе изменений в растворах ДНК с помощью спектрофотометра были получены несколько спектров флюоресценции при частотах облучения растворов от 4 до 10 Гц наблюдался почти прямолинейный рост интенсивности флуоресценции от температуры, однако дальнейшее увеличение частоты приводило к потери прямолинейной зависимости.
Длина волны испускания 310 нм отличалась от длины волны возбуждения что вполне ожидаемо так как основным очагом флуоресцентных процессов является дистиллированная вода, а ее длина волны испускания равна 310 нм при длине волны возбуждения 300 нм. Таким образом методом флюоресценции с раствором ДНК начали происходить излучательные процессы максимум интенсивности которых наблюдался при частоте облучения раствора 10 Гц. Можно предположить, что пик интенсивности появляется в результате возбуждения уровней электронных орбиталей ДНК и появлении резонанса на частоте 10 Гц.
На ИК – спектрах растворов ДНК облученных на частотах от 7 до 9,2 Гц с шагом 0,2 Гц при температуре 4 °С можно наблюдать только два сильно выраженных пика в на частотах 450 см-1 и 1088 см-1, что соответствует областям крутильных и деформационных колебаний молекул воды. Кроме того оба пика были получены при спектроскопии раствора облученного на частоте 8,4 Гц. Ранее в самых первых работах в области изучения действия СМП на аминокислоты Новиковым, Либовым и д.р. была предложена модель ионноциклотронного резонанса в своих экспериментах они установили частоту ионноциклотронного резонанса. Для аминокислот эта частота была 8,4 Гц. Тот же основной пик при частоте 8,4 Гц можно наблюдать и при температуре в 23 °С, но уже с большей интенсивностью. Также уширение пиков на всех остальных частотах.
ЗАКЛЮЧЕНИЕ
Основные результаты дипломной работы состоят в следующем:
1 Изучены достоинства и недостатки ИК – спектроскопии и флюоресценции при анализе биологических объектов. При ИК – спектроскопии происходят тепловые колебания молекул (вращательные деформационные и крутильные), при флуоресцентном анализе происходит переизлучательные с атомных орбиталей.
2 Изучены четыре основные теории влияния ЭМП НЧ на объекты белковых структур и ДНК, а именно: формирование водных кластеров,
ионно-циклотронный резонанс, образование свободных радикалов или перекиси водорода, образование активных форм кислорода.
3 Исследованы зависимости отклика водных растворов ДНК на действие электромагнитного поля с различными заданными параметрами облучения (частота, амплитуда). Получены ИК – спектры доказывающие существование резонансной ионноциклотронной частоты в растворах ДНК. На спектрах флуоресценции растворов обработанных ЭМП НЧ наблюдается почти линейная зависимость с максимумом при частоте 10 Гц, что связано скорее всего связано с накопление энергии в кластерных полиионных образований в структуре растворителя.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1 Молекулярная биология клетки в 3 – х томах / Б. Альбертс, Д. Брей, Дж. Льюис и др. – М.: Мир, 1994. – 517 c.
2 DNA waves and water / L. Montagnier, J. Aissa, E. Del Giudice etc. // Journal of Physics: Conference Series. – 2011. – Vol. 306. – P. 1 – 10.
3 Electromagnetic Signals Are Produced by Aqueous Nanostructures Derived from Bacterial DNA Sequences / L. Montagnier, J. Aissa, S. Ferris etc. // Interdiscip Sci Comput Life Sci. – 2009. – Vol. 1. – P. 81 – 90.
4 Новиков В. В. Конденсация аминокислот в водных растворах при действии слабых электромагнитных полей / В. В. Новиков, А. С. Лисицын // Биофизика. – 1996. – Т. 41. – № 6. – С. 1163 – 1167.
5 Новиков В. В. Комбинированное действие слабых постоянного и переменного низкочастотного магнитных полей на ионные токи в водных растворах аминокислот / В. В. Новиков, М. Н. Жадин // Биофизика. – 1994. – Т. 39. – № 1. – С. 49 – 50.
6 Новиков В. В. Индуцирующее действие слабых магнитных полей на образование межмолекулярных связей в водных растворах аминокислот / В. В. Новиков // Биофизика. – 1994. – Т. 39. – № 5. – С. 825–830.
7 Влияние слабых магнитных полей на свойство ряда белков и полиаминокислот образовывать комплексы с ДНК / В. В Новиков, В. В. Кувичкин, Н. И. Новиков и др.// Биофизика. – 2000. – Т. 45. – № 2. – С. 240 – 244.
8 Молекулярные механизмы биологического действия слабых магнитных полей. II. Выделение и характеристика ингибирующего ДНКАЗУ I белка хроматина мозга крыс / Ю. П. Щвецов, Г. Н. Смирнова, В. В. Новиков и др. // Биофизика. – 1997. – Т. 42. – № 3. – 738 – 741.
9 Молекулярные механизмы биологического действия слабых магнитных полей. I. Устойчивость хроматина клеток асцитной карциномы Эрлиха и мозга мышей к ДНКазе 1 при комбинированном действии на организм слабых постоянного и низкочастотного переменного магнитных полей, настроенных на циклотронный резонанс ионов полярных аминокислот / В. В. Новиков, Ю. П. Швецов, Е. Е. Фесенко и др. // Биофизика. – 1997. – Т. 42. – № 3. – С. 733 – 737.
10 Novikov V. V. Mechanism of action of week electromagnetic field on ionic currents in aqueous solution of amino acids / V. V. Novikov, A. V. Karnaoukhov // Bioelectromagnetics. – 1997. – Vol. 18. – P. 25 – 27.
11 Влияние когерентного электромагнитного излучения миллиметрового диапазона на некоторые свойства растворов ДНК / Ю. С. Бабаян, А. А. Тадевосян, Г. Л. Канарян и др. // Биомедицинская радиоэлектроника. – 2009. – № 2. – С. 52 – 56.
12 Некоторые физико – химические свойства ДНК, облученной низкоэнергетическими миллиметровыми когерентными электромагнитными волнами / Ю. С. Бабаян, С. Н. Акопян, Р. С. Казарян и др. // Биомедицинские технологии и радиоэлектроника. – 2006. – № 11. – С. 64 – 68.
13 Воздействие низкоэнергетического миллиметрового электро- магнитного излучения на стабильность молекул ДНК в растворе / Ю. С. Бабаян, А. Ш. Маркарян, В. П. Калантарян и др. // Биофизика. – 2007. – Т. 52. – № 2. – С. 382 – 384.
14 Взаимодействие оснований ДНК с молекулами воды. Сравнение результатов расчетов методами молекулярной механики и квантовой механики с экспериментальными данными / Э. Гонсалес, Х. Лино, А. Дерябина и др. // Биофизика. – 2013. – Т. 58. – № 5. – С. 748 – 757.
15 DNA fragmentation in human fibroblasts under extremely low frequency electromagnetic field exposure / F. Focke, D. Schuermann, N. Kuster etc. // Mutat Res. – 2010. – Vol. 683. – P. 74 – 83.
16 Evaluation of genitoxoc effect of low level 50 Hz magnetic fields on human blood cells using different cytogenetic assays. / A. Testa, E. Codelli, L. Stronati etc. // Bioelectromagnetics. – 2004. – Vol. 25. – № 8. – P. 613 – 619.
17 Chromosomal aberrations in human amniotic cells after intermittent exposure to fifty hertz magnetic fields. / I. Nordenson, K. Mild, G. Anderson etc. // Bioelectromagnetics. – 1994. – Vol. 15. – P. 293 – 301.
18 Hardell L. Biological effects from electromagnetic field exposure and public exposure standards. / L. Hardell, C. Sage. // Biomed Pharmacotherapy. – 2008. – Vol. 62. – P. 104 – 109.
19 Effects of high ELF magnetic fields on enzyme catalyzed DNA and RNA synthesis in vitro and on a cell– free DNA mismatch repairs. / S. Harada, S. Yamada, O. Kuramata etc. // Bioelectromagnetics. – 2001. – Vol. 22. – P. 260 – 266.
20 Effects of environmental level magnetic field exposures on transcription of CMV immediate early promoter DNA in a cell free in vitro transcription system. / H. Miki, M. Ohmori, E. Hrakawa etc. // Bioelectromagnetics. – 1999. – Vol. 20.
– P. 519 – 521.
21 Новиков В.В. Влияние слабых комбинированных постоянного переменного низкочастотного магнитных полей на собственную флуоресценцию ряда белков в водных растворах / В.В. Новиков, В.В. Кувичкин, Е.Е. Фесенко // Биофизика. – 1999. – Т. 44. – В. 2. – С. 224 – 230.
22 Лобышев В.И. Спонтанные и индуцированные внешними электромагнитными полями долговременные переходные процессы в разбавленных водных растворах глицилтриптофана и воде / В.И. Лобышев, Б.Д. Рыжков, Р.Э. Шихлинская // Биофизика. – 1998. – T. 43. – В. 4. – С. 710 – 716.
23 Novikov V.V. Биологические эффекты и возможные мехнизмы биологического действия слабых и сверх слабых магнитных полей / V. V. Novikov, I. M. Sheiman, and E. E. Fesenko // Bioelectromagnetics. – 2008 – Т. 29. – В. 5. – Р. 387 – 393.
24 Blackman C.F The influence of 1.2 mT, 60 Hz magnetic fields onmelatonin and tamoxifen – induced inhibition of MCF – 7 cell growth / S.G. Benane, D.E. House // Bioelectromagnetics. – 2001. – Vol. 22. – B. 2. – P. 122 – 128.
25 Пономаpев В.О. Влияние низкочастотных переменных магнитных полей на скорость биохимических реакций, образующих активные формы кислорода / В.О. Пономаpев, В.В. Новиков // Биофизика. – 2009. –Т. 54. – В. 2. – P. 235 – 241.
26 Бучаченко А.Л. Новые механизмы биологических эффектов магнитных полей / А.Л. Бучаченко, Д.А. Кузнецов и В.Л. Бердинский // Биофизика. – 2006. – Т. 51. – С. 545 – 552.
27 The bioeffects of extremely weak alternating magnetic fields. / N.A. Belova, O.N. Ermakova, A.M. Ermakov, Z.Y. Rojdestvenskaya, V.V. Lednev// Environmentalist. – 2007. – Vol. 27. – B. 4. – P. 411 – 416.
28 Giudice E. On the “unreasonable” effects of ELF magnetic fields upon a system ofions / E. Giudice, M. Fleischmann, G. Preparata, G. Talpo, // Bioelectromagnetics. – 2002. – T. 23. – P. 522 – 530.
29 Lednev V.V. Possible mechanism for the influence of weak magnetic fields on biological systems / V.V. Lednev // Bioelectromagnetics. – 1991. – Vol. 12. – Р. 71 – 75.
30 Эффекты и молекулярные механизмы действия слабых и сверхслабых магнитных полей / В.В. Новиков, В.В. Кувичкин, Е.Е. Фесенко, В.О. Пономарев, Г.В. Новиков, Е.В. Яблокова // Биофизика. – 2010. – Т.55. – В. 4. – С. 631 – 639.
31 Бучаченко А.Л. Новые механизмы биологических эффектов магнитных полей / А.Л. Бучаченко, Д.А. Кузнецов и В.Л. Бердинский // Биофизика. – 2006. – Т. 51. – С. 545 – 552.
32 Giudice E. On the “unreasonable” effects of ELF magnetic fields upon a system ofions / E. Giudice, M. Fleischmann, G. Preparata, G. Talpo, // Bioelectromagnetics. – 2002. – T. 23. – P. 522 – 530.
33 Effects of ELF (1-120 Hz) and modulated (50 Hz) RF fields on the efflux of calcium ions from tissue in vitro / C.F. Blackman, S.G. Benane, D. E. House, W. T. Joines // Bioelectromagnetics. – 1985. – Vol. 6. – P. 327 – 337.
34 Бурлакова Е.Б. Сверхслабые воздействия химических соединений и физических факторов на биологические системы / Е.Б. Бурлакова, A.A. Конрадов, E.Л. Мальцева // Биофизика. – 2004. – Т. 49. – В. 3. – С. 551 – 564.
35 Эффекты и молекулярные механизмы действия слабых и сверхслабых магнитных полей / В.В. Новиков, В.В. Кувичкин, Е.Е. Фесенко, В.О. Пономарев, Г.В. Новиков, Е.В. Яблокова // Биофизика. – 2010. – Т.55. – В. 4. – С. 631– 639.
36 Ritz T. A model for photoreceptor-based magnetoreception in birds / T. Ritz, S. Adem, K. Schulten // Biophys. J. – 2000. – № 78. – P. 707 – 718.
37 Rodgers CT. Chemical magnetoreception in birds: the radicalpair mechanism / CT. Rodgers, PJ. Hore // Proc. Natl Acad. Sci. USA. – 2009. – № 106. – P. 353 – 360.
38 Magnetic field effects on the behaviour of radicals in protein and DNA environments / N. Mohtat , FL. Cozens, T. Hancock-Chen et al. // Photochemistry and Photobiology – 1998. – № 67. P. 111 – 118.
39 Blockade of sensory neuron action potentials by a static magnetic field in the 10mT range / M. J. McLean, R. R. Holcomb, A. W. Wamil et al. // Bioelectromagnetics. – 1995. – Vol. 16. – № 1. – P. 20 – 32.
40 Thannickal V.J. Reactive oxygen species in cell signaling / V. J. Thannickal, B. L. Fanburg // American Journal of Physiology. – 2000. – Vol. 279. – № 6. – P. 1005 – 1028.
41 Okano H. Effects of static magnetic fields in biology: role of free radicals / H.Okano // Frontiers in Bioscience. – 2008. – Vol. 13. – № 16. – P. 6106 – 6125.
42 Brocklehurst B. Free radical mechanism for the effects of environmental electromagnetic fields on biological systems / B. Brocklehurst, K. A. McLauchlan // International Journal of Radiation Biology. – 1996. – Vol. 69. – № 1. – P. 3 – 24.
43 Effects of subchronic exposure to static magnetic field on testicular function in rats / S. Amara, H. Abdelmelek, C. Garrel et al. // Archives of Medical Research. – 2006. – Vol. 37. – № 8. – P. 947 – 952.
44 Berk M. Do ambient electromagnetic fields affect behaviour? A demonstration of the relationship between geomagnetic storm activity and suicide / M. Berk, S. Dodd, M. Henry. // Bioelectromagnetics. – 2006. – Vol. 27. – № 2. – P. 151 – 155.
45 Influence of a static magnetic field (250mT) on the antioxidant response and DNA integrity in THP1 cells / S. Amara, T. Douki, J. L. Ravanat et al. // Physics in Medicine and Biology. – 2007. – Vol. 52. – № 4. P. 889 – 898.
46 Hassan S. Effects of Magnetic Field on the Antioxidant Enzyme Activities of Suspension-Cultured Tobacco Cells / S. Hassan, A. Parviz, G. Faezeh // Bioelectromagnetics. – 2007. – Vol. 28. – № 1. – P. 42 – 47.
47 Юхневич Г.В. Инфракрасная спектроскопия воды / Г.В. Юхневич // –М.: Наука, 1973. – 207 с.
49 Lakowicz J. R. Principles of Fluorescence Spectroscopy / J. R. Lakowicz. – N.Y.: Springer Science. 2006. – 960 p.
50 Лозовская Е. Почему они светятся / Е. Лозовская. – АНО «Редакция журнала «Наука и жизнь». Наука и жизнь. – 2004. – №8. – С. 58 – 62.
51 Мельников М.Я. Экспериментальные методы химической кинетики / М.Я. Мельников, В.Л. Иванов. – М.: Изд – во Моск. Ун – та, 2004. – 125 c.
PAGE \* MERGEFORMAT 1
Рис. 7 Энергетическая модель люминесценции
г
д
а
б
в
г
Ен – основное (нормальное)
энергетическое состояние
Ев – возбуждённое энергетическое состояние
2 подуровни
1 основного уровня
0
Ев0 Ев1 Ев2
2
1
3
4
БИОЛОГИЧЕСКИЕ ЭФФЕКТЫ ВОЗДЕЙСТВИЯ НИЗКОИНТЕНСИВНОГО ИЗЛУЧЕНИЯ НА ВОДНЫЕ РАСВОРЫ