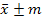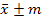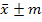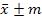Генетические маркеры функционального долголетия крупного рогатого скота
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
(ФГБОУ ВПО «КубГУ»)
Кафедра биохимии и физиологии
ДОПУСТИТЬ К ЗАЩИТЕ В ГАК
Заведующий кафедрой – канд. биол.
наук, доцент ________ В. В. Хаблюк
«___»______________ 2015 г.
ВЫПУСКНАЯ КВАЛИФИКАЦИОННАЯ РАБОТА
БАКАЛАВРА
генетические маркеры функционального долголетия крупного рогатого скота
Работу выполнил _______________________________________ Е. А. Гырнец
(подпись, дата)
Факультет биологический
Направление 06.03.01 Биология
Научный руководитель,
д-р биол. наук,
проф._ _______________________________________________ Н. В. Ковалюк
(подпись, дата)
Нормоконтролёр,
доцент, канд. биол.
наук _________________________________________________ Н. Н. Улитина
(подпись, дата)
Краснодар 2015
РЕФЕРАТ
Данная работа выполнена на 53 листах машинописного текста. Содержит 13 таблиц и шесть рисунков. Для выполнения данного исследования было использовано 44 литературных источника.
КРУПНЫЙ РОГАТЫЙ СКОТ, ФУНКЦИОНАЛЬНОЕ ДОЛГОЛЕТИЕ, ПОЛИМОРФИЗМ, ЧАСТОТА ВСТРЕЧАЕМОСТИ, ЛЕПТИН, СЦЕПЛЕНИЕ
Цель данного исследования на примере айрширской и голштинской пород молочного скота – проследить влияние полиморфизмов LEP-R25C, LEP-A80V, LEP-Y7F на функциональное долголетие коров.
Исследования, проведенные методом ПЦР-ПДРФ, позволили выявить сцепленное наследование генотипов СС и YY; RR и FF (айрширский скот); RR и AA (голштинский скот); низкий уровень полиморфизма локусов A80V (айрширский скот) и Y7F (голштинский скот), низкую частоту встречаемости FF гомозиготных вариантов локуса LEP-Y7F (айршисркий скот) и низкую частоту встречаемости VV локуса LEP-A80V (голштинский скот). Установлено некоторое преимущество коров с генотипом RCYY над коровами с другими генотипами.
СОДЕРЖАНИЕ
Введение……………………………………………………………………………...6
1 Аналитический обзор……………………………………………………………...8
1.1 Характеристика проблемы функционального долголетия крупного
рогатого скота……………………………………………………………….....8
- Характеристика крупного рогатого скота айрширской породы…...10
- Характеристика крупного рогатого скота голштинской породы....11
1.2 Молекулярно-генетические маркеры…………………………………….....12
1.2.1 Характеристика некоторых видов молекулярно-генетических
маркеров…….……………………………………………………….....13
1.3 Методы исследования SNP-маркеров. Полимеразная цепная реакция
(ПЦР) и полиморфизм длин рестрикционных фрагментов (ПДРФ)….......15
1.4 Генетические маркеры функционального долголетия крупного
рогатого скота…………………………………………………………..…….18
1.4.1 Характеристика гена лептина……………………………………....…..21
1.4.2 Структура белка лептина и его физиологические функции у
крупного рогатого скота…………………………………………....…..23
2 Материалы и методы исследования………………………………….……...…..24
2.1 Материал исследования………………………………………….……...…...24
2.2 Выделение ДНК…………………………………………………………...….24
2.3 Анализ полиморфизмов гена LEP методом ПЦР/ПДРФ……………....…..26
2.3.1 Амплификация фрагментов гена LEP методом ПЦР…………....…..26
2.3.2 Рестрикционный анализ…………………………………………..……29
2.4 Электрофорез……………………………………………………………...….30
2.5 Статистическая обработка данных…………………………………….…....33
3 Использование полиморфизмов гена лептина в качестве генетических
маркеров функционального долголетия в селекции крупного рогатого
скота…………………………………………………………………………….…34
3.1 Частоты встречаемости генотипов LEP………………………………….…34
3.2 Сцепленное наследование LEP-генотипов………………………………..39
3.3 Функциональное долголетие и обильномолочность коров различных
LEP- генотипов………………………………………………..……………...42
Заключение………………………………………………………….………………43
Библиографический список…………………………………………..…………....44
Приложение А Таблицы расчета критерия для быков и телок (потомков
быка с генотипом RRFFAA) по полиморфизмам LEP-R25C и
LEP-Y7F……………………………………………….…………..49
Приложение Б Таблицы расчета критерия для быков и телок (потомков
быка с генотипом RRFFAA) по полиморфизмам LEP-R25C и
LEP-A80V.…………………………………………….…………..50
Приложение В Таблица расчета критерия для коров хозяйств ЗАО
АФП «Нива» и ОАО «ПЗ «им. Чапаева В.И.»» по
полиморфизму LEP-Y7F……………………………....…………..51
Приложение Г Таблица расчета критерия для коров хозяйств ЗАО
АФП «Нива» и ОАО «ПЗ «им. Чапаева В.И.»» по
полиморфизму LEP-A80V.………………………....…………..52
Приложение Д Таблица расчета критерия для коров хозяйства ЗАО «Агрофирма Кухаривская» по полиморфизмам LEP-R25C, LEP- Y7F, LEP-A80V……………………………………………………..53
ОПРЕДЕЛЕНИЯ, ОБОЗНАЧЕНИЯ И СОКРАЩЕНИЯ
QTL – локусы количественного признака;
SNP – однонуклеотидные замены;
SINE (short interspersed nuclear elements) – короткие нуклеотидные мобильные элементы, содержащие ретроэлементы;
LINE (long interspersed nuclear elements) – длинные нуклеотидные элементы, содержащие ретроэлементы;
LTR (long terminal repeats) – длинные концевые повторы, содержащие ретропозоны;
ПЦР – полимеразная цепная реакция;
ПДРФ – полиморфизм длин рестрикционных объектов;
П.н. – пар нуклеотидов;
Да – единица измерения массы молекулы. Дальтон.
ВВЕДЕНИЕ
Молочное скотоводство является важной отраслью современного мирового сельского хозяйства. В мире насчитывается около полутора миллиарда голов крупного рогатого скота. Поэтому поиск решения проблемы, связанной с повышением рентабельности и производства, является приоритетом для работников сельского хозяйства.
Продолжительность жизни – это период от рождения животного до его естественной смерти. Однако период продуктивного использования маточного поголовья намного меньше. Отсюда, маточное поголовье напрямую определяет эффективность молочного скотоводства. При этом лимитирующим фактором является его функциональное долголетие, так как оно непосредственно влияет на пожизненный надой молока, количество приплода и, в конечном счете, на совершенствование пород и стада. Так же оно позволяет проводить выбраковку низкопродуктивного поголовья и реализацию племенных животных. Поэтому в современном животноводстве чрезвычайно важную роль играют высокопродуктивные коровы с продолжительным сроком их использования.
Перевод животноводства на промышленную технологию в конце двадцатого века обусловил более жесткие требования к животным. К тому же интенсивное использование молочного скота значительно снизило срок его эксплуатации, т.е. с повышением продуктивности стада происходит уменьшение периода его использования. Если в стаде с удоем в три тысячи кг до пятой лактации доживает каждая четвертая корова, то в стаде с удоем более пяти тысяч кг доживает только каждая десятая – двенадцатая. Там, где надои около четырех тысяч кг, коровы старше третьей лактации составляют не больше двадцати процентов от маточного поголовья. В связи с этим средний срок использования коров на молочных фермах составляет две – три лактации, что не позволяет провести адекватную оценку их племенных качеств, продуктивную селекционно-племенную работу, как в рамках стада, так и в популяции в целом, и не способствует накоплению желательного генофонда.
Проблемой снижения функционального долголетия в последние десятилетия заинтересовались многие исследователи, однако, в их исследованиях часто не рассматривается, либо рассматривается фрагментарно, влияние молекулярно-генетических факторов. Изучение генетических маркеров, определяющих эти факторы, позволит, во-первых, понять степень их влияние на функциональное долголетие, а, во-вторых, путем усиления или ослабления этих факторов, улучшить показатели признака.
Таким образом, цель данного исследования –поиск маркеров функционального долголетия крупного рогатого скота и проведение исследований на базе айрширской и голштинской пород крупного рогатого скота по оценке связи между SNP-маркерами, локализованными в выбранных генах и функциональным долголетием молочных коров.
В задачи исследования входило:
- выявление генетических маркеров функционального долголетия;
- генотипирование выборок животных айрширской и голштинской пород, принадлежащих хозяйствам Краснодарского края, и выявление частот встречаемости аллелей;
- выявление генетических особенностей пород в рамках выбранных SNP-маркеров;
- оценка связи выбранных SNP-маркеров с функциональным долголетием крупного рогатого скота;
- выявление особенностей селекции крупного рогатого скота по признаку функционального долголетия и выбранным маркерам.
1 Аналитический обзор
1.1 Характеристика проблемы функционального долголетия крупного рогатого скота
Современные данные исследований, проведенных в нашей стране и за рубежом, показывают, что за последнее время произошло значительное сокращение срока продуктивного использования крупного рогатого скота. К примеру, в Российской Федерации средний возраст коров всех пород во всех категориях хозяйств в 2011 г. составил 2,92 отёла, а возраст выбытия в среднем равнялся 3,30-4,30 отёла [Петрова, 2011]. В племзаводах и в племрепродукторах продуктивное долголетие коров составило только 2,73 и 2,93 отёла соответственно.
По последним данным в Краснодарском крае в 2013 году средний возраст коров всех пород составил 2,26 отела, что гораздо ниже общероссийских показателей 2011 года. Это говорит о том, что показатель продуктивного долголетия коров в нашем крае продолжает снижаться. Кроме того коровы выбывают из стада в свой самый продуктивный период – продуктивный пик в среднем приходится на возраст коровы, совпадающий с четвертой по шестую лактации [Скотоводство, 1977].
Среди факторов, оказывающих наибольшее влияние на снижение функционального долголетия крупного рогатого скота, отмечают генетический прогресс роста продуктивности. Он стал причиной перевода отрасли на промышленную технологию, предъявившей к животным новые жесткие требования. Это сказалось на сроках использования коров на молочных фермах и комплексах. В нашей стране они составили две – три лактации. При этом рентабельность использования коров в десять процентов при удоях в 8000 кг наступает только при пятой лактации [Суровцев, Никулина, 2014]. Из-за этого выбраковка из стада коров, доживающих до возраста три – четыре лактации, составляет 30-34 %. В итоге стада состоят на 70-75 % из коров одного – двух отелов и только на два процента из шести и более отелов [Грачев, Шуклина, 2005]. В тоже время в таких европейских странах как в Финляндии срок выбраковки коров составляет пять отелов [Heikkila, 2013].
Таким образом, экономическая эффективность содержания коров с продолжительным сроком функционального долголетия обуславливается меньшими затратами на обновление состава стада. Это объясняется тем, что при приведенных выше объемах выбраковки коров резко снижаются селекционные и воспроизводственные возможности. Помимо этого, создание условий для быстрого и продуктивного роста ремонтного молодняка требует значительных затрат, что негативно сказывается на всей экономике производства. Известный факт, что затраты на репродукцию стада из всего объема расходов стоят на втором месте, сразу после затрат на корма.
Это означает, что длительность продуктивной жизни животных напрямую влияет на рентабельность производства молока [Повторяемость молочной …, 2007; Опыт разведения …, 2011]. Повысив срок функционального долголетия поголовья, финское сельское хозяйство смогло снизить количество ферм с 25 тысяч до десяти тысяч и при этом увеличить поголовье в оставшихся, что несомненно является показателем высокой рентабельности молочного животноводства [Санисало, 2014].
В таблице 1 приведены данные зависимости средней пожизненной про-
Таблица 1 – Зависимость средней пожизненной продуктивности от функционального долголетия коров
|
Средняя пожизненная продуктивность, кг |
Средний период производственного использования, лактаций |
|
5247,6 |
1,3 |
|
12735,3 |
2,7 |
|
27378,1 |
5,2 |
|
27508,1 |
5,6 |
|
36848,5 |
7,0 |
дуктивности от функционального долголетия коров. Данные были получены в 2011 году на базе племенного репродуктора по разведению айрширской породы – СПК «Коммунар».
Таким образом, можно сделать вывод о положительной корреляции функционального долголетия и пожизненных надоев. В совокупности, приведенные выше факторы экономической выгоды говорят о целесообразности поиска решения проблемы повышения функционального долголетия крупного рогатого скота.
- Характеристика крупного рогатого скота айрширской породы
По относительной доле скота, разводимого в племенных хозяйствах Российской Федерации лидирующее положение занимает красно-пестрая, на втором месте айрширская и голштинская породы [Сивкин, Стрекозов, Чинаров, 2011].
По данным Головного информационного центра животноводства в России (ВНИИплем) в 2012 году в Российской Федерации численность айрширского стада составляет 93 410 голов, что составляет 2,9 % от подконтрольного поголовья молочного скота РФ [Ежегодник по племенной …, 2012]. При этом около 25 процентов айрширского поголовья находится в хозяйствах Краснодарского края [Тулинова, 2014]. Самая большая популяция айрширов насчитывается в Финляндии – более 60 % молочного поголовья или около 140 тысяч коров [Dairy cattle…, 2014].
Средняя масса айрширской коровы составляет около 590 кг. Внешний вид изящный. Широкое и несколько короткое туловище, прямая спина, голова легкая, рога тонкие, лирообразные, симметрично вместительное вымя.
Средняя продуктивность айрширских коров в Краснодарском крае (по данным бонитировки СЕЛЭКС в 2012 году) составляет 5202 кг молока. При этом содержание жира и белка в молоке составляет 3,83 и 3,82 % соответственно [Кузнецов, Щепкин, 2013].
Айрширская корова отличается постоянством удоев и способна к двукратному доению, что очень ценится в хозяйствах. Порода характеризуется низким содержанием соматических клеток в молоке, продуктивным долголетием, легкостью отелов, активным темпераментом. Данная порода легко осваивается с переменой обстановки, адаптируется к новым условиям, хорошо усваивает грубые корма.
Таким образом, в виду широкого использования данной породы в молочном скотоводстве Краснодарского края, мы считаем, что она в большой степени подходит в качестве объекта исследования функционального долголетия крупного рогатого скота.
- Характеристика крупного рогатого скота голштинской породы
Данная порода была выведена в США и Канаде из голландского черно-пестрого скота. Селекция проводилась в сторону повышения удоев и живой массы, при этом жирномолочности уделялась меньше внимания. В результате появился молочный тип черно-пестрого скота, живая масса которых сейчас составляет 650-700 кг (коровы), у быков – 900-1200 кг. [Основы животноводства, 1988].
Сейчас данная порода имеет глубокое туловище, крепкую конституцию, тонкий костяк. Коровы в возрасте около пяти лет имеют высоту в холке 140-145 см [Самые популярные…, 2014].
В пользу использования голштинов говорит тот факт, что 91% отелов нетелей относится к категории «легкий отел», происходящий без помощи человека.
Показатели продуктивности голштинской породы различны в разных странах, в зависимости от цели их содержания, климатических и кормовых условий. В среднем эти показатели колеблются от 7000 кг до 10000 кг. Наибольших показателей удоев добились в Израиле – свыше 10000 кг. Так же у данной породы много коров рекордисток: корова Бичер Арманда Эллен (США), имевшая удой 25248 кг, и корова Бризвуд Патен (США) с удоем 21546 кг [Ижболдина, Ефремова, 2005].
Однако у данной породы содержание жира в молоке не превышает 3,2 %, а содержание белка – трех процентов.
Ввиду полезных для сельского хозяйства породных особенностей голштинский скот получил широкое использование в Краснодарском крае и стал объектом нашего исследования.
1.2 Молекулярно-генетические маркеры
Молекулярно-генетический маркер – это сложная система, представленная двумя факторами. Первый из них – это уникальная последовательность нуклеотидов, дающая возможность точно картировать требуемый участок хромосомы. Второй фактор – наличие вблизи от заданного участка хромосомы какого либо элемента внутривидового (или межвидового) полиморфизма.
Генетический полиморфизм – это изменения в нуклеотидной последовательности ДНК маркера, обусловленные различными типами мутаций (точечные мутации, инсерции, делеции и или какие-либо другие перестройки хромосом). Формы проявления генетического полиморфизма получили название аллелей. Полиморфный характер конкретного локуса возрастает с увеличением числа аллелей. Наличие двух и более аллелей является необходимой предпосылкой для использования локуса в качестве возможного генетического маркера.
Одним из важных условий использования молекулярно-генетических маркеров при селекции крупного рогатого скота с нужными нам признаками и свойствами является знание генетической зависимости признака. Это нужно в тех случаях, когда интересующий нас признак определяется не одним геном, а группой генов. При этом, если эти гены не находятся в тесной генетической связи друг с другом, то использование одного из них в качестве молекулярно-генетического маркера становится весьма затруднительно. Однако, известно, что такие количественные гены часто связаны в так называемых «локусах количественного признака» (QTL) и наследуются совместно, что делает возможным использование молекулярно-генетических маркеров.
Молекулярно-генетические маркеры нашли широкое применение в таких областях науки, как генетика, селекция, картирование хромосом, изучение механизмов эволюции, животноводстве и других [Хавкин, 1997].
К тому же использование молекулярно-генетических маркеров развило методы локализации и контроля локусов, определяющих качественные и количественные признаки [Xueyi, Ribaut, Gjnzalez-de-Leon, 1997].
Таким образом, на большом количестве типов полиморфизма ДНК построено постоянно пополняющееся огромное количество молекулярных маркеров для генетических исследований [Алтухов, Салменкова, 2002].
1.2.1 Характеристика некоторых видов молекулярно-генетических маркеров
Однонуклеотидные замены или SNP (от английского Single Nucleotide Polymorphism). SNP точечные нуклеотидные замены (мутации) являются наиболее распространенным типом полиморфных маркеров и представляют собой замену одного нуклеотида на другой. Частота встречаемости – один на тысячу пар оснований, а их суммарное число в геноме коров достигает трех миллионов (по некоторым данным до десяти миллионов). Соотношение биаллельных и триаллельных однонуклеотидных замен сильно сдвинуто в сторону биаллельных, так как в процентах доля триалельных составляет одну десятую процента. Поэтому SNP маркеры обладают низким уровнем полиморфизма и высоким эволюционным консерватизмом.
Однонуклеотидные замены локализованные в кодирующих областях делятся на две категории:
- синонимичные – не несут за собой замены аминокислотного состава в кодируемых белках
- несинонимичные – изменяют аминокислотный состав кодируемых белков.
Однонуклеотидные замены могут изменять промоутерную активность, влиять на конформацию ДНК и пре-мРНК, определяя уровень транскрипции генов и эффективность сплайсинга.
Другим типом маркеров являются повторяющиеся последовательности, обладающие высокой степенью полиморфизма. Такие повторяющиеся последовательности могут быть подразделены на два класса: диспергированные повторы и тандемные повторы [Зиновьева, Эрнст, 2008]. К первым относятся такие мобильные элементы как рэтроэлементы SINE (short interspersed nuclear elements; 90–500 п.н.), LINE (long interspersed nuclear elements; до 7000 п.н.) и LTR (long terminal repeats) содержащие ретропозоны.
Тандемные повторы – это повторения определённых последовательностей в ориентации «голова к хвосту». Поскольку в них в одном локусе повторяется один и тот же мотив, эти последовательности получили названия сателлитов.
Тандемные повторы стали одними из самых высокоинформативных генетических маркеров у сельскохозяйственных животных, так как число тандемных повторов у различных животных в сателлитах сильно варьирует.
В зависимости от длины повторяющихся участков их подразделяют на несколько классов: максисателлиты, минисателлиты и микросателлиты [Georges, Massey, 1991].
Максисателлиты – общая длина повторяющихся последовательностей больше п.н.
Минисателлиты – общая длина фрагментов составляет от нескольких тысяч до 30 тысяч п.н. При этом длина мотивов варьирует от десяти до шестидесяти п.н. [Jeffreys, 1985].
Микросателлиты – общая длина фрагмента, как правило, не превышает 350 п.н, а длина мотива составляет обычно от двух до шести п.н. [Tautz, 1989]. Микросателлиты находятся как в транскрибируемых, так и нетранскрибируемых участках ДНК.
С точки зрения информативности можно разделить полиморфные маркеры на биаллельные (однонуклеотидные замены) и мультиаллельные (тандемные повторы и диспергированные системы).
В нашем исследовании особое внимание уделено однонуклеотидным заменам, так как именно к ним относятся генетические маркеры долголетия крупного рогатого скота.
1.3 Методы исследования SNP-маркеров. Полимеразная цепная реакция и полиморфизм длин рестрикционных фрагментов
Метод полимеразной цепной реакции был разработан Кэри Мюллисом (фирма “Cetus”, США) в 1983 году [Mullis, Faloona, Scharf, 1986]. Данный метод позволяет добиться значительного увеличения концетрации малых фрагментов ДНК в биологическом материале (амплификация), а так же дает возможность вводить мутации, клонировать гены, сращивать фрагменты ДНК и так далее.
Сущность метода заключается в стандартном биологическом процессе, проходящем во всех клетках – репликация – комплементарное достраивание ДНК на матрице материнской ДНК при помощи специфического класса фер-ментов ДНК-зависимых ДНК-полимераз [Engelke, Krikos, Bruck, 1990].
Для реализации данного метода необходимы следующие компоненты:
- ДНК-матрица (ДНК или её часть, содержащая искомый специфический фрагмент);
- праймеры (синтетические олигонуклеотиды, включающие 20-30 п.н., комплементарные последовательностям ДНК на границах определённого специфического фрагмента);
- смесь дезоксинуклеотидтрифосфатов (dNTP), т. е. смесь четырёх dNTP, являющихся материалом для синтеза новых комплементарных цепей ДНК;
- фермент Taq-полимераза (термостабильная ДНК-полимераза, выделенная из термофильных бактерий Thermis aquaticus, катализирующая удлинение цепей праймеров путём последовательного присоединения нуклеотидных оснований к растущей цепи синтезируемой ДНК);
- буферный раствор (реакционная среда, содержащая ионы магния (Mg2+), необходимые для поддержания активности фермента);
ПЦР представляет собой многократное увеличение числа копий (амплификация) специфического участка ДНК, катализируемое ферментом Tag-полимеразой (рисунок 1). Каждый цикл амплификации включает три этапа, протекающих в различных температурных режимах:
- Денатурация – нагревание двухцепочечной молекулы (при температуре 98 ). Приводит к расхождению цепей.
- Отжиг – праймеры связываются с комплементарными участками на одноцепочечных молекулах ДНК.
- Элонгация – работа Тaq-полимеразы, которая в течении этой стадии достраивает вторую цепь ДНК на одноцепочечной матрице используя праймер как стартовую площадку.
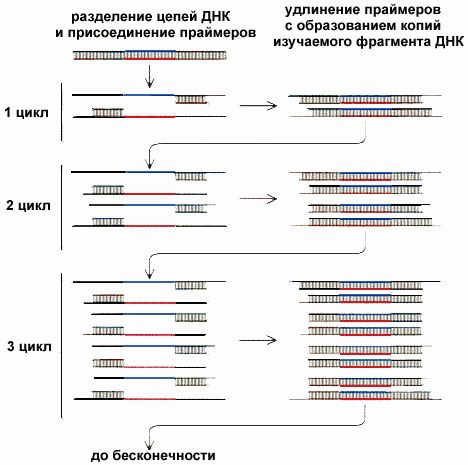
Рисунок 1 – Схема полимеразной цепной реакции (ПЦР)
Условно ПЦР метод можно разделить на два класса: амплификация с использованием неспецифических праймеров (RAPD-анализ или Random Amplified Polymorphic DNA) [Williams, Kubelic, Livak, 1990; Caetano-Anolles, Bassam, Gresshoff, 1991] и амплификация с использованием специфических маркеров.
ПЦР имеет ряд преимуществ. К ним относятся экономность в использовании ДНК, легкость в выполнении, автоматичность процесса, а также не требует радиоактивных меток для визуализации полиморфизмов [Кожухова, 1998].
Полиморфизм длин рестрикционных фрагментов. Мутации, возникающие в участках узнавания определённых рестриктаз, делают эти участки ДНК нечувствительными к действию ферментов. Обнаруживается это по изменению длины рестрикционных фрагментов [Никишина, 2007]. ПДРФ-анализ включает в себя следующие стадии:
- выделение геномной ДНК;
- рестрикция выделеной ДНК спецефической эндонуклеазой;
- электрофоретическое разделение образовавшихся фрагментов;
- идентификация этих фрагментов
На электрофореграмме при отсутстии рестрикции выявляют один крупный фрагмент, соответствующий по длине последовательности ДНК между двумя соседними участками рестрикции для той же эндонуклеазы. При наличии рестрикции в полиморфном участке на электрофореграмме будет присутствовать меньший по размерам фрагмент, равный расстоянию между полиморфным участком рестрикции и одним из ближайших постоянных участков рестрикции.
Изучить состояние полиморфного локуса можно, проведя ПЦР и затем рестрикцию амплифицированного фрагмента. При обработки рестриктазой амплифицированного фрагмента его длина не изменится, если в исследуемой области ДНК отсутствует сайт узнавания. В том случае, когда участок узнавания не изменён, обработка рестриктазой создаст два фрагмента с общей длиной равной длине исходного фрагмента.
Таким образом, ПЦР-ПДРФ является наиболее удобным методом и дает хорошие результаты при изучении генетических маркеров функционального долголетия крупного рогатого скота.
1.4 Генетические маркеры функционального долголетия крупного рогатого скота
Введение в линии животных желательных генотипов за счет особей, обладающих повышенным функциональным долголетием, является одним из главных подходов повышения функционального долголетия. Однако, функциональное долголетие относится к количественным признакам (QTL), т.е. его обуславливают целый комплекс генов, каждый из которых оказывает незначительный эффект на проявление признака. Вместе с тем, можно предположить, что лишь некоторые из них (главные гены) оказывают наибольшее влияние на проявление признака. Отсюда вытекает, что поиск и последующее использование предпочтительных аллелей главных генов приобретает большое значение в селекции [Зиновьева, 2008]. В данном случае в селекции коров с наибольшим продуктивным долголетием.
Поиском главных генов функционального долголетия занимаются многие исследователи. Однако наибольших успехов добилась группа польских ученых возглавляемая Д. Сцида [Evaluating markers … , 2011]. Ими были взяты образцы у 567 польских коров голштинской породы, для которых были идентифицированы генотипы с девятью однонуклеотидными полиморфизмами, локализованными в пяти генах:
- бутирофилин (butyrophilin) подсемейство 1, член (BTN1A1, база данных GeneBank – GeneID: 282157), расположенный на BTA23: P35Q [Seyfert, Lthen, 1998] и K468R [Taylor, Everest, Smith, 1996];
- ацил-КоА: диацилглицерин ацилтрансфераза, 1 ген (DGAT1, база данных GeneBank – GeneID: 282609) на BTA14: K232A [Positional candidate…, 2002; Association of a lysine-232/alanine … , 2002];
- ген рецептора лептина (LEPR, база данных GeneBank – GeneID: 497205) на BTA3: T945M [A missense mutation …, 2004];
- ген лептина (LEP, база данных GeneBank – GeneID: 280836) на BTA4: Y7F [A new mutation …, 2003], R25C и A80V [Konfortov, Licence, Miller, 1999], а также замена С/Т в позиции 963 [Leptin promoter …, 2005];
- АТФ-связывающий транспортер, подсемейство G, член 2 (ABCG2, база данных GeneBank – GeneID: 536203) на BTA6: Y581S [Identification of…, 2005].
Также было выяснено влияние этих генов на молочные характеристики коров: DGAT1 и ABCG2 существенно влияют на молочные характеристики, LEP и LEPR дают противоречивые результаты, а об эффекте BTN1A1 не сообщается.
Распределение генотипов среди коров приведено в таблице 2.
Таблица 2 – Количество коров, приходящееся на каждый класс генотипа
|
BTN1A1 |
DGAT1 |
LEPR |
LEP |
ABCG2 |
||||
|
P35Q |
K468R |
K232A |
T945M |
Y7F |
R25C |
A80V |
С/Т |
Y581S |
|
QQ=168 |
KK=411 |
KK = 80 |
MM = 5 |
YY=523 |
CC=133 |
AA=283 |
CC=157 |
YY=552 |
|
QP=280 |
KR=146 |
KA= 282 |
MT=106 |
YF = 43 |
CR=280 |
AV=231 |
CT=287 |
YS = 15 |
|
PP=119 |
RR = 10 |
AA= 205 |
TT=456 |
FF = 1 |
RR=154 |
VV = 53 |
TT=123 |
SS = 0 |
Генотипы были определены с помощью метода ПЦР – ПДРФ. Генотипы BTN1A1, DGAT1, LEP, LEPR определены Д. Сцида и И. Комисарек. Генотип ABCG2 определен И. Комисарек и А. Зарнецки.
Результатами их исследований стали данные, свидетельствующие о том, что полиморфизмом с самым высокой степенью влияния на функциональное долголетие крупного рогатого скота является LEP-R25C, расположенный внутри гена лептина. Для него относительный риск выбраковки животных с генотипом СС в 3,14 раз выше, чем для гетерозиготных животных.
Помимо LEP-R25C, также у FF гомозигот по полиморфизму LEP-Y7F риск выбраковки в 3,64 раза больше, чем у YY гомозигот. Риск выбраковки VV гомозигот в LEP-A80V в 1,83 раза больше чем АА гомозигот. Различия рисков между другими генотипами полиморфизмов в пределах других генов гораздо меньше (рисунок 2).
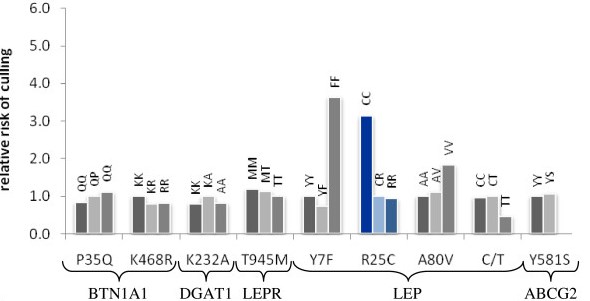
Примечание – Relative risk of culling – относительный риск выбраковки
Рисунок 2 – Различия рисков выбраковки между генотипами полиморфизмов в пределах исследуемых генов
Эти результаты указывают на связь LEP с функциональной долговечностью и хорошо подтверждаются другими исследованиями в области здоровья пищевого поведения и воспроизводства молочного скота, которые также определяют функциональное долголетие. Ввиду растущей важности функциональных признаков молочного скота, LEP полиморфизмы следует рассматривать в качестве маркеров, определяющих решение в пользу того или иного выбора при селекции крупного рогатого скота.
Также была зарегистрирована корреляция гена лептина и его белка с долголетием у людей. Отмечено, что лептин способен снижать уровень висцерального жира, глюкозы в крови, инсулина и одновременно повышать уровень грилина ( «гормон голода» ).
На основе этих данных, можно с уверенностью сказать, что крупный рогатый скот является хорошей примером для изучения долголетия у людей.
1.4.1 Характеристика гена лептина
У крупного рогатого скота ген лептина расположен в четвертой хромосоме. Он состоит из трех экзонов и двух интронов. Только два экзона кодируют последовательность аминокислот лептина. Кодирующая область гена лептина (ее длина составляет 501 п.н.) входит в состав второго и третьего экзонов, которые разделены интроном с длиной примерно 2 тыс. п.н. Область промоутера охватывает около 3 тыс. п.н. [Sharifzadeh, Doosti, 2012].
Интересующие однонуклеотидные полиморфизмы расположены в разных зонах гена лептина. Их местоположение приведено в таблице 3 [Komisarek, 2012].
Таблица 3 – Описание отдельных полиморфизмов гена LEP, приведенных в этом исследовании
|
Наименование SNP (и другие наименования, используемы в литературе |
Нуклеотидные замены |
Область гена |
Область белка лептина |
|
C(-963)T |
C/T |
промоутер |
- |
|
Y7F (A252T) |
A/T |
2 экзон |
Сигнльная последовательность |
|
R25C (C305T, R4C, C73T, LepKpn2I) |
T/C |
2 экзон |
-спираль А |
|
A80V (LepHphI, A59V) |
C/T |
3 экзон |
-спираль B |
Ген лептина – высокополиморфный ген. В нем, помимо интересующих нас SNP-полиморфизмов, расположены еще около шестидесяти однонуклеотидных замен (рисунок 3). Причем, большинство из них расположено в интронных областях, что снижает их влияние на конформацию, аминокислотный состав и функцию белка лептина. Однако, рассматриваемы нами SNP-полиморфизмы расположены в кодирующих областях гена.
Рисунок 3 – SNP-полиморфизмы и структура гена лептина
Было установлено, полиморфизм R25C помимо влияния на функциональное долголетие также влияет на содержание жира и белка в молоке, на легкость отелов и гестацию [All Association of bovine…, 2010].
Была показана связь между полиморфизмом A80V и функциональным долголетием и рентабельностью животных [Szyda, Komisarek, 2007].
Таким образом, для исследования SNP полиморфизмов гена лептина методом ПЦР-ПДРФ необходимо знать его структуру (LEP состоит из трех экзонов и двух интронов), а также место локализации полиморфизмов (промоутер, второй и третий экзоны).
1.4.2 Структура белка лептина и его физиологические функции у крупного рогатого скота
Лептин является глобулярным белком, синтезируемым жировой тканью. Молекула лептина (16 кДа) состоит из 167 аминокислот с N-концевой секреторной сигнальной последовательностью из 21 аминокислот [Leptin, the obese…, 1996]. Относится к цитокинам – сигнальным белкам. Молекула лептина имеет четыре спиральные цепи с пятью – шестью полными оборотами. Основная физиологическая роль лептина проявляется снижением синтеза макроэргов и повышением затрат энергии [Agarwal, Rout, Singh, 2009]. Его механизм действия заключается в передаче в гипоталамус информации о массе тела и жировом обмене. Взаимодействие лептина со специфическими рецепторами, расположенными в гипоталамической области активирует выработку нервных импульсов, направленных в участки головного мозга, ответственные за регуляцию аппетита. Кроме того, действие лептина стимулирует симпатическую нервную систему, что в свою очередь ведёт к повышению артериального давления, частоты сердечных сокращений и процессов термогенеза, путём разобщения процессов окисления (клеточного дыхания) и фосфорилирования (синтез молекул АТФ) в митохондриях белой жировой ткани. В результате этих процессов большое количество энергии, которое запасается в жировой ткани в виде липидов, может быть преобразовано в тепло. Лептин часто называют гормоном насыщения. Считается, что он действует на гипоталамус, блокируя синтез и высвобождение нейропептида Y, вызывающего чувство голода.
Также при выращивании молодых коров было показано, что лептин играет важную роль в инициации половой зрелости.
Лептин может действовать как на уровне гипоталамуса, так и на уровне периферических тканей, например, гонадные ткани. Так было показано, что у крупного рогатого скота лептин непосредственно повлиял на стероидогенез яичников.
Таким образом, лептин – регулятор энергетического баланса.
2 Материалы и методы исследования
2.1 Материал исследования
Исследование проводилось в 2014 году в период с 17.06.14 по 27.07.14 и с 02.09.14 по 12.10.14. в хозяйствах ЗАО АФП «Нива» Каневского раойна, ОАО «ПЗ «им. Чапаева В.И.»» Динского района Краснодарского края, ОАО «ПЗ «Дружба»» Калининского района Краснодарского края и ЗАО «Агрофирма Кухаривская» Ейского района Краснодарского края. Объектом исследования явились быки-производители и коровы айрширской породы, а также коровы голштинской породы. Материалом исследования являлись сперма быков-производителей, кровь молодых коров и коров пятой – девятой лактации хозяйств ЗАО АФП «Нива», ОАО «ПЗ «им. Чапаева В.И.» и ЗАО «Агрофирма Кухаривская», а также кровь телок, потомков одного из генотипированнных быков, принадлежащих ОАО «ПЗ «Дружба». Всего было проанализировано 349 образца, из них принадлежащих: сперме быков-производителей (n–32), крови коров (n–283) и крови телок, потомков генотипированного быка (n–34).
В стадах крупного рогатого скота айрширской и голштинской породы этих хозяйств, а также среди быков-производителей айрширской породы выполнен ПЦР/ПДРФ-анализ образцов крови и спермы на наличие полиморфизмов R25C, A80V, Y7F в гене LEP. По результатам анализа определена частота встречаемости генотипов гена LEP по полиморфизму R25C: RR, RC и CC; по полиморфизму A80V: AA, AV и VV; и по полиморфизму Y7F6: YY, YF и FF; а также была установлена связь между генотипами LEP и функциональным долголетием крупного рогатого скота.
2.2 Выделение ДНК
При выделении ДНК из спермы и крови следующим образом нами использовались наборы реагентов Diatom™ DNA Prep 100 ООО Лаборатория «Изоген» г. Москва :
1. Первичная обработка образцов.
- Семя размораживаем. 100 мкл переносим в чистую пробирку, добавляем 240 мкл лизирующего раствора (Lysisreagent), 20 мкл ДДТ на каждые 10 проб, термостатируем смесь при 65 40 минут. Центрифугируем десять секунд при 5000 об/мин. Переносим супернатант в чистую пробирку.
- К 100 мкл крови добавляем 400 мкл лизирующего раствора (Lysisreagent). Приступаем к выделению без термостатирования.
2. В пробирку с лизатом добавляем 20 мкл суспензии сорбента (диатомовые водоросли). Перед этим сорбент встряхиваем на вортексе. Ротируем 10 мин.
3. Центрифугируем десять секунд при 5000 об/мин.
4. Осторожно, не задевая осадка, удаляем супернатант с помощью водоструйного насоса. К осадку прибавляем 200 мкл лизирующего раствора.
5. Центрифугируем десять секунд при 5000 об/мин.
6. Удаляем супернатант. К осадку добавляем 1 мл рабочего однократного раствора солевого буфера (десятикратный солевой буфер (1М хлорид натрия (NaCl) и 1M хлорид калия (KCl)) разводим водой до 100 мл, а затем 96 % этиловым спиртом до 300 мл и перемешиваем).
7. Центрифугируем десять секунд при 5000 об/мин.
8. Удаляем супернатант, к осадку добавляем 1 мл рабочего раствора солевого буфера, перемешиваем, центрифугируем десять секунд при 5000 об.
9. Удаляем супернатант. Убираем полосками фильтровальной бумаги остатки жидкости над сорбентом, меняя полоски от пробы к пробе.
10. Осадок сушим в термостате при температуре 65 пять минут.
11. К осадку добавляем 100 мкл ЭкстраГена (10 прцентная смесь ионообменников (типа Chelex), и 0,01процентный тритон X-100). Пробирку с ЭкстраГеном хорошо перемешать. Ресуспендируем на вортексе и термостатируем пять минут при температуре 65 .
12. Центрифугируем при 12000 об/мин
13. Перенести содержащую ДНК надосадочную жидкость (80 мкл) в чистую пробирку.
Выход ДНК составлял 3-5 мгк/100 мкл с OD 260/280 от 1,6 до 2,0.
2.3 Анализ полиморфизмов гена LEP методом ПЦР/ПДРФ
2.3.1 Амплификация фрагментов гена LEP методом ПЦР
Полиморфизмы гена лептина (LEP) определяли с помощью полимеразной цепной реакции (ПЦР) по методике Л.А. Клашниковой, Н.А. Зиновьевой, используя соответствующие праймеры.
Амплификация проводилась набором реагентов для ПЦР амплификации ДНК произведенным фирмой НПО "СибЭнзим", г. Новосибирск.
Для амплификации участков гена использовались следующие последовательности праймеров:
- для участка R25C гена LEP:
F:CCAGGGAGTGCCTTTCATTA
R:GGTGTCATCCTGGACCTTCC
- для участка A80V гена LEP:
F:CAAGCAGGAAATAGGGAGTCATGG
R:CTGGTGAGGATCTGTTGGTAGGTC
- для участка Y7F гена LEP:
F:CTGCGTGGTCTACAGCACACCTC
R:AGGGCCAAAGCCACAGGATTCG
ПЦР проводили с 3 мкл ДНК в конечном объеме 25 мкл. Состав реакционной смеси приведен в таблице 4.
Состав ПЦР-буфера:
SE-буфер для ДНК полимеразы Taq, (60 мМ Трис-HCl (pH 8.5 при 25°C); 1.5 мМ хлорида магния (MgCl2); 25 мM хлорида калия (KCl); 10 мM 2-меркаптоэтанол; 0.1 прцентный Тритон X-100.)
В пробирки с реакционной смесью добавляли минеральное масло (НПФ «Литех») для предотвращения испарения жидкости и помещали в амплификатор «Терцик МС-2», разработанный ОАО «ДНК-Технология» (Москва) для проведения ПЦР. В каждом из режимов ПЦР для амплификации фрагментов гена лептина в первом цикле денатурация была удлинена до трех минут, последний цикл проходил при температуре 72 в течение трех минут сорока секунд для полной достройки матрично-праймерных комплексов.
|
Название компонента |
Объем компонентов, мкл |
||
|
R25C |
Y7F |
A80V |
|
|
Вода |
16,2 |
16.2 |
16.2 |
|
Праймер 1 |
1 |
0.8 |
0.8 |
|
Праймер 2 |
1 |
0.8 |
0.8 |
|
Хлористый магний (Mg) 25 мМ |
0,6 |
0.6 |
0.6 |
|
Дезоксирибонуклеотидтрифосфаты, 2,5 мМ |
0,4 |
0.4 |
0.4 |
|
10х SE буфер |
2,5 |
2.5 |
2.5 |
|
Taq-полимераза |
0,3 |
0.2 |
0.2 |
|
ДНК |
3 |
3 |
3 |
Таблица 4 – Состав реакционной смеси для амплификации фрагментов LEP, содержащих полиморфизмы R25C, Y7F и A80V
Учитывая особенности амплифицируемых участков, а также технические характеристики амплификатора, нами были подобраны различные режимы амплификаци для трех полиморфизмов. Режим амплификации для участка, содержащего полиморфизм A80V, представлен в таблице 5.
Таблица 5 – Режимы амплификации участка с полиморфизмом A80V
|
Стадия ПЦР |
Количество циклов |
Температура, |
Длительность стадии |
|
Первоначальная денатурация ДНК |
1 |
95 |
3 мин |
Продолжение таблицы 5
|
Стадия ПЦР |
Количество циклов |
Температура, |
Длительность стадии |
|
Денатурация ДНК Отжиг праймеров Синтез ДНК |
1 |
95 67 72 |
30 сек 30 сек 30 сек |
|
Денатурация ДНК Отжиг праймеров Синтез ДНК |
32 |
95 65 72 |
20 сек 20 сек 30 сек |
|
Денатурация ДНК Отжиг праймеров Синнтез ДНК |
1 |
95 65 72 |
20 сек 20 сек 3 мин |
Для амплификации фрагментов гена LEP, содержащих полиморфизмы R25C и Y7F был выбран режим, представленный в таблице 6.
Таблица 6 – Режим амплификации участков гена LEP с полиморфизмами R25C и Y7F
|
Стадия ПЦР |
Количество циклов |
Температура, |
Длительность стадии |
|
Первоначальная денатурация ДНК |
1 |
95 |
3 мин |
|
Денатурация ДНК Отжиг праймеров Синтез ДНК |
1 |
95 67 72 |
30 сек 30 сек 30 сек |
|
Денатурация ДНК Отжиг праймеров Синтез ДНК |
27 |
95 65 72 |
20 сек 20 сек 30 сек |
|
Денатурация ДНК Отжиг праймеров Синнтез ДНК |
1 |
95 65 72 |
20 сек 20 сек 3 мин |
В результате полимеразной цепной реакции получаются ПЦР-продукты с размерами: 305 п.н. для R25C; 424 п.н. для A80V; 310 п.н. для Y7F.
Для контроля прохождения реакции и оценки качества и концентрации проводили электрофорез в 1.5% агарозном геле (таблица 8).
2.3.2 Рестрикционный анализ
Для проведения рестрикционного анализа фрагментов второго и третьего экзонов по полиморфизмам R25C, A80V и Y7F использовались соответсвующие эндонуклеазы рестрикции фирмы НПО «СибЭнзим», г. Новосибирск: Bsp 13 I, PspEI и Bpu 14 I, соответственно (таблица 7).
Таблица 7 – Характеристики эндонуклеаз рестрикции, использованных в работе
|
Эндонуклеаза |
Сайт рестрекции (5’-3’) |
Температура инкубации, |
SE- буфер |
|
Bsp 13 I (R25C) |
T^CCGGA AGGCC^T |
50 |
2К |
|
PspEI (A80V) |
G^GTNACC CCANG^G |
37 |
B |
|
Bpu 14 I (Y7F) |
TT^CGAA AACG^TT |
37 |
G |
Состав буфера для инкубации SE 2K (НПО «СибЭнзим», г. Новосибирск): 10 мМ Трис-НСl (pH 7.6 при С); 10 мМ хлористого магния (Мg; 200 мМ хлорида калия (КCl); 1 мМ DTT.
Состав буфера для инкубации SE B (НПО «СибЭнзим», г. Новосибирск):
10 мМ Трис-НСl (pH 7.6 при С); 10 мМ хлористого магния; 1 мМ DTT.
Состав буфера для инкубации SE G (НПО «СибЭнзим», г. Новосибирск): 10 мМ Трис-НСl (pH 7.6 при С); 10 мМ хлористого магния (Мg; 50 мМ хлорида натрия (NaCl); 1 мМ DTT.
Рестрикцию проводили в 20 мкл инкубационной смеси (15 мкл реакционной смеси и 5 мкл амплификата). К смеси рестрикции по полиморфизму R25C добавили минеральное масло (НПФ «Литех») для предотвращения испарения жидкости при инкубации в термостате.
Рестрикцию по полиморфизму R25C термостатировали при температуре 50 в течение 3-х часов. Рестрикции по полиморфизмам Y7F и A80V термостатировали при температуре 37 в течение 3-х часов.
После рестрикции амплификата гена LEP эндонуклеазой Bsp 13 I по полиморфному участку R25C гомозиготные животные по аллелю R (генотип RR) образуют один фрагмент величиной 305 п.н., гетерозиготные RC – три фрагмента: 305, 283, 22 п.н., а несущие генотип СС – два фрагмента: 283, 22 п.н.
После рестрикции амплификата гена LEP эндонуклеазой PspEI по полиморфизму A80V гомозиготные животные по аллею А образуют один фрагмент - 424 п.н, гетерозиготные AV – три фрагмента: 424, 398 и 26 п.н., гомозиготные по аллелю VV – два фрагмента: 398 и 26 п.н.
Рестрикция амплификата гена LEP эндонуклеазой Bpu 14 I по полиморфизму Y7F показала, что гомозиготные животные по аллелю Y образуют один фрагмент длиной 310 п.н., гетерозиготные YF – три фрагмента: 310, 288 и 22 п.н, гомозиготные по аллелю FF – два фрагмента: 288 и 22 п.н.
2.4 Электрофорез
Молекулярный вес продуктов ПЦР и их фрагментов, полученных после рестрикции, определяли с помощью горизонтального электрофореза в агаразном 1,5 – 2,5 % геле (таблица 8) с использованием пятикратного трис-боратного буфера (TBE имеет состав: 54 г Трис-НСl; 27,5 г борная кислота; 2 мл 0,5 M ЭДТА, рН 8,0 доводят дистиллированной водой до 1 литра) [Уильямс, Уилсон, 1978].
После смешивания компонентов гель нагревают до кипения и оставляют в термостате на два часа при температуре 50 , чтобы молекулы полисахарида сформировали однородную решетку геля.
Образцы ДНК смешивали с буфером для нанесения проб, содержащим 50 процентов глицерина, 50 % TBE-буфера и 0,025 % бромфенолового синего. Смешанные пробы вносили в лунки геля под электрофорезный буфер. Электрофорез обычно вели при постоянном напряжении 100 V [Мазин, Краев, Потапов, 1990]
.
Таблица 8 – Приготовление 1.5% и 2% агарозного геля
|
Гель |
Анализируемый фрагмент |
Название анализа |
Компоненты |
|
1.5% гель |
600-700 п.н. |
Контроль прохождения ПЦР |
- Агароза – 1.5 г - Доводим до 100мл 1% TBE-буфером - Бромистый этидий – 5мкл |
|
2% гель |
50-400 п.н. |
Прохождение рестрикции по LEP |
- Агароза – 2 г - Доводим до 100 мл 1% TBE-буфером - Бромистый этидий – 5 мкл |
Гель после электрофореза высушивали и просматривали в ультрафиолетовых лучах, при этом краситель, интеркалирующий в молекулу ДНК, испускал волны в красно-оранжевой области видимого спектра 590 нм. После визуального осмотра гель фотографировали в ультрафиолетовых лучах.
На рисунке 4 представлена электрофореграмма рестрикции амплификата гена LEP по полиморфизму R25C.
305 п.н.
283 п.н.
Рисунок 4 – Электрофореграмма продуктов рестрикции участка гена LEP по полиморфизму R25C
На шестой дорожке находится маркер молекулярных весов с шагом в 50 п.н. Животное с генотипом CC находится на четвертой дорожке; гомозиготные животные по аллелю R представлены на третьей и пятой дорожках. Генотип RC – на первой и второй и с седьмой по десятую.
На рисунке 5 представлена электрофореграмма рестрикции участка гена LEP по полиморфизму A80V.
424 п.н.
398 п.н.
Рисунок 5 – Электрофореграмма рестрикции гена LEP по полиморфизму A80V
310 п.н.
288 п.н.
Рисунок 6 – Электрофореграмма рестрикции участка гена LEP-Y7F
На пятой дорожке находится маркер молекулярных весов. Гомозиготные по аллелю АА животные показаны на второй, четвертой, седьмой, восьмой и десятой дорожках, а гетерозиготные (AV) на первой, третьей, шестой, девятой, одиннадцатой и тринадцатой дорожках. Гомозиготы VV на данном снимке отсутствуют.
На рисунке 6 изображена электрофореграмма рестрикции участка гена LEP по полиморфизму Y7F.
На четвертой дорожке находится маркер молекулярных весов. На пятой – минус-контроль. На восьмой дорожке представлена гетерозиготное животное (YF). На остальных – гомозиготные животные (YY). Гомозиготы по аллелю FF на данном снимке не представлены.
2.5 Статистическая обработка данных
Биометрическая обработка полученных материалов проводилась статистическими методами. Определение достоверности разницы между исследуемыми значениями проводились с помощью критерия и критерия Стьюдента при 5% и 1% уровне значимости на персональном компьютере при помощи пакета программ «Microsoft Office 2010», где – среднее арифметическое значение, ±m – стандартная ошибка среднего.
3 Использование полиморфизмов гена лептина в качестве генетических маркеров функционального долголетия в селекции крупного рогатого скота
В связи с растущими потребностями в продукции мясного и молочного скотоводства ДНК-технологии занимают все более важное место в ряду перспективных методик, используемых в животноводстве. К ним относится и маркер-зависимая селекция. Она использует ДНК-маркеры, которые непосредственно или опосредованно влияют на интересующие селекционеров хозяйственные полезные признаки.
В хозяйствах ЗАО АФП «Нива», ОАО «ПЗ «им. Чапаева В.И.»», ОАО «ПЗ «Дружба»», ЗАО «Агрофирма Кухаривская» в стадах коров, а также среди быков-производителей айрширской породы был проведен анализ высокополиморфного гена LEP по трем локусам: R25C, A80V, Y7F. Были установлены частоты встречаемости генотипов гена лептина и их влияние на функциональное долголетие. Также было выявлено сцепленное наследование генотипов LEP. Проведен анализ связи между генотипами LEP и обильномолочностью айрширской породы коров.
3.1 Частоты встречаемости генотипов LEP
В связи с результатами, полученными Д. Сцида, нами было решено проводить исследование по трем полиморфным локусам гена лептина: R25C, A80V и Y7F. По каждому из локусов ген LEP может быть представлен следующими генотипами:
- R25C: RR, RC, CC
- A80V: AA, AV, VV
- Y7F: YY, YF, FF
Для оценки степени влияния строения гена лептина по данным локусам на функциональное долголетие необходимо было установить частоту встречаемости каждого из генотипов и установить, в какой степени каждый из них влияет на функциональное долголетие. Поэтому объектом исследования мы выбрали, крупный рогатый скот айрширской и голштинской пород, т.к. эти породы одни из наиболее распространенных в Краснодарском крае.
Нами было проведено генотипирование в четырех стадах крупного рогатого скота (n–106, n–100, n–52 и n–34) и у быков-производителей айрширской породы, интенсивно используемых в искусственном осеменении Краснодарского края. Частоты встречаемости аллелей и генотипов представлены в таблице 9. Подсчет частот встречаемости аллелей проводился по формуле:
P(A)= (2+)/2n, (1)
где P – частота встречаемости аллели;
А – аллель;
– число гомозигот по исследуемому аллелю;
– число гетерозигот;
n – объем выборки.
В хозяйствах ЗАО АФП «Нива» и ОАО «ПЗ «им. Чапаева В.И.»» в одну выборку вошли коровы с максимальным сроком использования (пятой – девятой лактации), а в другую – коровы-рекордистки по первой законченной лактации (коровы с удоем свыше 7800 кг за первую законченную лактацию), т.к. обычно срок их функционального долголетия в среднем по стаду ниже.
В хозяйствах ОАО «ПЗ «им. Чапаева В.И.»» в первую выборку также вошли коровы-долгожительницы, а во вторую – молодняк данного хозяйства.
В хозяйстве ЗАО «Агрофирма Кухаривская» исследовались коровы голштинской породы и были распределены по тому же принципу.
Нами было установлено, что айрширская порода скота имеет ряд особенностей, отличных от закономерностей, выявленных зарубежными авторами. Например, частота встречаемости генотипов LEP-R25C (замена СТ в позиции 96590050 п.н. LEP), непосредственно влияющих на функциональное долголетие голштинского скота, значительных различий у коров-долгожительниц, коров-
рекордисток и молодняка не имеет. Обращает на себя внимание генотип RR, встречающийся у коров-долгожительниц чаще (0,24) чем у рекордисток (0,14).
Обратная закономерность наблюдается у коров голштинской породы. Здесь генотип RR у коров четвертой – шестой лактации встречаются реже(0,08) чем у рекордисток (0,17).
Расчет критерия для скота айрширской породы также показал, что предполагаемая нами гипотеза о случайном расхождении между эмпирическими и ожидаемыми частотами встречаемости генотипов (нулевая гипотеза) не опровергается (таблица 10). Значение меньше, чем стандартное значение равное 9,21 для однопроцентного уровня значимости. Это значит, что ни один
Таблица 10 – Расчет критерия для выборок коров по локусу R25C
|
Генотипы LEP-R25C; |
Коровы 5-9 лактации (n=55); ЗАО АФП «Нива» |
при а=0,01 |
|||||
|
распределение |
э-т |
(э-т)^2 |
(э-т)^2/э |
|
|||
|
эмпирические |
теоретическое |
||||||
|
RR |
13 |
13 |
0 |
0 |
0 |
0,46 |
9,21 |
|
RC |
27 |
29 |
-2 |
4 |
0,14 |
||
|
CC |
15 |
13 |
2 |
4 |
0,31 |
||
|
Генотипы LEP-R25C |
Коровы 1-3 лактации (n=51); ЗАО АФП «Нива» |
||||||
|
распределение |
э-т |
(э-т)^2 |
(э-т)^2/э |
|
|||
|
эмпирические |
теоретические |
||||||
|
RR |
7 |
12 |
-5 |
25 |
2,08 |
2,98 |
|
|
RC |
29 |
27 |
2 |
4 |
0,15 |
||
|
CC |
15 |
12 |
3 |
9 |
0,75 |
||
|
Генотипы LEP-R25C |
Коровы 5-9 лактации (n=49);«ПЗ «им. Чапаева В.И.»» |
при а=0,01 |
|||||
|
распределение |
э-т |
(э-т)^2 |
(э-т)^2/э |
|
|||
|
эмпирические |
теоретическое |
||||||
|
RR |
16 |
12 |
4 |
16 |
1,33 |
2,12 |
9,21 |
|
RC |
24 |
25 |
-1 |
1 |
0,04 |
||
|
CC |
9 |
12 |
-3 |
9 |
0,75 |
||
|
Генотипы LEP-R25C |
Коровы 1-3 лактации (n=51); «ПЗ «им. Чапаева В.И.»» |
||||||
|
распределение |
э-т |
(э-т)^2 |
(э-т)^2/э |
|
|||
|
эмпирические |
теоретические |
||||||
|
RR |
19 |
12 |
7 |
49 |
4,08 |
6,31 |
|
|
RC |
25 |
27 |
-2 |
4 |
0,15 |
||
|
CC |
7 |
12 |
-5 |
25 |
2,08 |
из генотипов селекционного преимущества не имеет. Критерий для быков и телят по трем полиморфизмам также рассчитан и представлен в приложениях А и Б.
Значение критерия для коров-долгожительниц голштинской породы больше чем критическое, т.е. нулевая гипотеза отклоняется. По нашему мнению, причиной является небольшой размер выборки, что подтверждается значением критерия для молодых коров, которое ниже критического (приложение Д).
Второй особенностью пород является отсутствие у большинства айрширов полиморфизма аллелей LEP-A80V (замена CT в позиции 95689996 п.н. LEP) и у большинства голштинов полиморфизма аллелей LEP-Y7F (АТ в позиции 95689996 п.н. LEP). Как мы видим, частота встречаемости аллели V у айрширов не превышает 0,03, а гомозиготный генотип по ней нами не был идентифицирован ни у одного животного. Сходная картина у голштинов. частота встречаемости аллели F у них не превышает 0,02. Гомозиготы по нему так же не были обнаружены (таблица 9).
Расчет критерия показал, что расхождения между эмпирическими и ожидаемыми частотами встречаемости генотипов LEP-A80V и LEP-Y7F не случайны. Причиной такого расхождения как раз и является практически полное отсутствие полиморфизма (приложение Г и Д).
При анализе частот встречаемости генотипов полиморфизма LEP-Y7F у айрширского скота нами было замечено, что во всех выборках очень низкая частота встречаемости гомозигот FF, несмотря на высокую частоту встречаемости YF в группах коров-долгожительниц и быков-производителей (0,41–0,47) и неоднородность происхождения (анализировались потомки 20 быков). Гетерозиготные животные (YF) среди молодняка и коров-рекордсменок встречались с частотой несколько меньшей (0,29–0,39) (таблица 9).
Аллель F достаточно распространен. Его частота встречаемости от 0,21 до 0,34. Однако частота встречаемости гомозигот FF не больше 0,10, что может свидетельствовать о сниженной жизнеспособности животных с таким генотипом. Однако это явление может быть результатом и других процессов, например, таких как дрейф генов.
Практически идентичное распределение генотипов и аллелей по LEP-A80V у голштинского скота. При высокой частоте генотипа AV (0,40 – 0,42) гомозиготы VV нами отмечены не были. Распространенность аллели V – 0.21.
Расчет критерия также указывает на то, что такое распределение генотипов не случайно. Возможная причина такого распределения была указана выше (приложение В и Г).
Для того, чтобы проверить, на каком из этапов онтогенеза животного аллель F может выбывать из стада нами было проведено генотипирование потомков быка-производителя с генотипом RRFFAA.Выяснилось, что частота аллеля F также достаточно высока (0,79), однако она встречается не только в гетерозиготном генотипе, но и в гомозиготном генотипе в 59 процентах случаев (таблица 9). Это говорит о том, что животные не выбывают в пренатальном периоде онтогенеза, т.к. , во всяком случае, в двух – трех месячном возрасте тёлки с генотипом FF встречаются c высокой частотой. За генотипированной выборкой телок будет установлено наблюдение с целью определения периода хозяйственного использования каждой из них.
Расчет критерия по локусу Y7F для дочерей быка с генотипом RRFFAA представлен в приложении А.
3.2 Сцепленное наследование LEP-генотипов
При анализе частот встречаемости генотипов мы обратили внимание на интересную закономерность. Из 272 генотипированных голов скота айрширской породы генотип СС встречается у 34 животных вместе с генотипом YY, в то время как генотип ССYF встретился только у четырех животных, а генотип ССFF не встретился ни у одного животного (таблица 11).
Исходя из полученных данных, мы можем утверждать, что в выборке животных (n–38) с генотипами ССYY, CCYF, CCFF в 90 % случаев встречается сочетание ССYY, 10 %– генотип ССYF.
Таблица 11 – Сцепленное наследование LEP-генотипов у животных айрширской породы
|
LEP генотип |
ЗАО АПФ «Нива» коров (n=106) |
ОАО «ПЗ «им. Чапаева В.И.», коров (n=100) |
быков – производителей (n=32) |
ОАО «ПЗ «Дружба», тёлок (n=34) |
||||
|
частота встречаемости |
количество |
частота встречаемости |
количество |
частота встречаемости |
количество |
частота встречаемости |
количество |
|
|
RRYY |
0.04 |
4 |
0,10 |
10 |
0.17 |
5 |
0.00 |
0 |
|
RRYF |
0.13 |
14 |
0.17 |
17 |
0.28 |
9 |
0.29 |
10 |
|
RRFF |
0.02 |
2 |
0.08 |
8 |
0.09 |
3 |
0.59 |
20 |
|
RCYY |
0.26 |
27 |
0.30 |
30 |
0.31 |
10 |
0.00 |
0 |
|
RCYF |
0.27 |
29 |
0.19 |
19 |
0.09 |
3 |
0.12 |
4 |
|
RCFF |
0.00 |
0 |
0.00 |
0 |
0.00 |
0 |
0.00 |
0 |
|
CCYY |
0.27 |
29 |
0.14 |
14 |
0.03 |
1 |
0.00 |
0 |
|
CCYF |
0.01 |
1 |
0.02 |
2 |
0.03 |
1 |
0.00 |
0 |
|
CCFF |
0.00 |
0 |
0.00 |
0 |
0,00 |
0 |
0.00 |
0 |
В то же время, генотипы RCYF и RRYF встречаются довольно часто (55 голов и 50 голов соответственно). То есть сочетания YF c отличными от СС генотипами (RR и RC) возможны и встречаются с высокой частотой.
Такую же тенденцию к сцеплению имеет и генотип FF. По полученным нами данным у 33 животных с генотипом FF он встречается в сочетании с генотипом RR в 100% случаев для возможных сочетаний генотипов ССFF, RCFF и RRFF (таблица 11).
В итоге мы пришли к выводу, генотипы сцеплены по принципу комбинации «слабый» плюс «сильный» и «сильный» плюс «слабый» в плане функционального долголетия (генотип СС хуже RR, а FF хуже YY). При этом такие «слабые» комбинации как ССFF не встречаются.
Сцепление у голштинской породы наблюдается в генотипе RRAA (таблица 12). Из трех возможных вариантов (RRAA, RRAV, RRVV) эта комбинация встречается в 86 % случаев.
Таблица 12 – Сцепленное наследование LEP-генотипов у животных голштинской породы
|
LEP генотип |
ЗАО «Агрофирма Кухаривская» (n=77) |
|
|
частота встречаемости |
количество |
|
|
RRAA |
0,15 |
12 |
|
RRAV |
0,02 |
2 |
|
RRVV |
0,00 |
0 |
|
RCAA |
0,25 |
19 |
|
RCAV |
0,19 |
15 |
|
RCVV |
0.00 |
0 |
|
CCAA |
0,17 |
13 |
|
CCAV |
0,21 |
16 |
|
CCVV |
0.00 |
0 |
Остальные комбинации генотипов достаточно распространены (кроме генотипов с гомозиготой VV, так как. полиморфизм по этому локусу у данной породы почти отсутсвует).
Таким образом, нами сделано заключение, что при подборе быков-производителей следует избегать генотипов, которые при скрещивании могут дать комбинации:
– для голштинов: RRAV, RRV, RCVV, CCVV;
– для айрширов: RRFF, RCFF, CCYF, CCFF.
3.3 Функциональное долголетие и обильномолочность коров различных LEP-генотипов
Нами был проведен анализ по направлению, какие из генотипов имеют преимущество при проведении селекционных работ в области функционального долголетия. Были выделены наиболее распространенные генотипы среди коров возрастом пять - девять лактаций и коров-рекордисток. Мы сравнили средний возраст в каждой группе, а также их обильномолочность (таблица 13).
Как видно из таблицы, некоторое превосходство над другими генотипами имеет генотип RCYY. В среднем продуктивное долголетие коров с таким генотипом выше, по сравнению функциональным долголетием коров с генотипами CCYY и RCYF. Расчет t-критерия Стьюдента для пятипроцентного уровня значимости показал, что полученная разница по обильномолочности и функциональному долголетию между группами не является достоверной. Однако следу-
Таблица 13 – Функциональное долголетие и обильномолочность коров
различных LEP-генотипов
|
LEP-генотип |
Коровы 5-9 лактации |
Коровы 1-3 лактации (n=43) |
В общем по группе (n=117) |
|||||
|
ЗАО АПФ «Нива» (n=41) |
ОАО «ПЗ «им. Чапаева В.И.» (n=33) |
|||||||
|
|
|
|
|
|||||
|
Возраст в отелах |
Удой, кг |
Возраст в отелах |
Удой, кг |
Возраст в отелах |
Удой, кг |
Возраст в отелах |
Удой, кг |
|
|
CC YY |
5.5±0.25 |
6306± 526 |
6.1±0.70 |
6351± 813 |
2.1±0.42 |
8473± 331 |
3.9±0.65 |
7352± 498 |
|
RC YY |
6.3±0.28 |
6492± 657 |
6.3±0.66 |
5885± 396 |
2.4±0.25 |
8538± 317 |
4.3±0.80 |
7553± 511 |
|
RC YF |
5.9±0.35 |
6236± 420 |
5.5±0.49 |
6493± 425 |
1.9±0.35 |
8206± 187 |
3.9±0.75 |
7255± 418 |
ет брать во внимание то, что выборки животных по каждому генотипу были небольшие (меньше 30 голов).
ЗАКЛЮЧЕНИЕ
По результатам исследования были сделаны следующие выводы:
1. Функциональное долголетие крупного рогатого скота является количественным признаком и определяется совокупностью генов и признаков. Также был определен главный ген и его SNP-полиморфизмы, влияющие на функциональное долголетие – ген белка лептина и LEP-R25C, LEP-Y7F, LEP-A80V.
2. По частотам генотипов выявлено, что полиморфизм LEP-R25C, описанный как определяющий функциональное долголетие, не имеет селекционного преимущества для айрширской и голштинской пород. Также практически отсутствует полиморфизм локуса A80V у айрширского скота и Y7F у голштинского скота. Для айрширов у LEP-Y7F наблюдается низкая встречаемость генотипа FF при высокой встречаемости аллели F в гетерозиготном генотипе. Аналогичен для голштинов полиморфизм A80V.
4. Телки с генотипом FF в двух – трех месячном возрасте встречаются довольно часто, что отклоняет теорию о раннем выбытии таких коров из стада.
5. У айрширскго скота наблюдается сцепление генотипов ССYY в 90 процентах случаев и генотипов RRFF в 100 процентах случаев. Таким образом, имеет место сочетание генотипов «сильный» плюс «слабый» в плане функционального долголетия. У голштинов сцепление генотипов RRAA в 86 процентах случаев по комбинации «сильный» плюс «сильный».
6. При рассмотрении функционального долголетия было замечено некоторое преимущество коров с генотипом RCYY над коровами CCYF и RCYF.
7. При проведении селекционных работ, рекомендуем предотвращать появление телят голштинской породы с генотипами RRAV, RRV, RCVV, CCVV и телят айрширской породы с генотипами RRFF, RCFF, CCYF, CCFF.
БИБЛИОГРАФИЧСЕКИЙ СПИСОК
1. Алтухов Ю. П., Салменкова Е. А. Полиморфизм ДНК в популяционной генетике // Генетика. 2002. Т. 38, № 9. С.1173–1195.
2. Грачев В. С., Шуклина А. Ю. Повышение продолжительности хозяйственного использования молочного скота // Milknet.ru. 2005. Режим доступа: http://milknet.ru/info/show?id=7 (дата обращения 18.02.2014).
3. Ежегодник по племенной работе в молочном скотоводстве в хозяйствах Российской Федерации / МСХ РФ, ВНИИплем. М., 2012. Вып. 13. 112 с.
4. Зиновьева Н. А., Эрнст Л. К. Биологические проблемы животноводства в ХХI веке. М., 2008. 229–230 с.
5. Ижболдина С. Н., Ефремова Е. Н. Интерьерные показатели голштинизированных коров черно-пестрой породы различных генотипов // Вестник Ижевской государственной сельскохозяйственной академии. 2005. № 2. С 12–13.
6. Кожухова Н. Э. Полимеразная цепная реакция и особенности ее применения для анализа полиморфизма // Использование ПЦР-анализа в генетико-селекционных исследованиях. Научно - методическое руководство. К.: Аграрна наука, 1998. С. 21–33.
7. Кузнецов А. В., Щепкин С. В. Особенности представления сведений о молочной продуктивности коров в системе СЭЛЕКС и их интерпретация // ej.kubagro.ru. Научный журнал КубГАУ. 2013. № 90. С. 2–3. Режим доступа: http://ej.kubagro.ru/2013/06/pdf/61.pdf (дата обращения: 18.11.2014).
8. Никишина М. В. Исследование полиморфизма генов ариламин N-ацетилтрансфераз и ассоциации полиморфных вариантов с раком легкого у европеоидов г. Новосибирска : диc. ... канд. биол. наук. Новосибирск, 2007. 205с.
9. Основы животноводства / А. И. Слабкина [и др.]. М., 1988. 287 с.
10. Опыт разведения шведской красной породы в Центральной России / Н. В. Сивкин // Зоотехнология. 2011. №2. С. 58–60.
11. Петрова А. С. Продуктивное долголетие коров айрширской породы и факторы, его определяющие: автореф. дис. … канд. биол. наук. Саранск, 2011. 20 с.
12. Повторяемость молочной продуктивности как критерий оценки состояния стада/ Н. В. Сивкин [и др.] // Современные методы селекции и генетики в животноводстве: матер. междунар. конф. СПб., 2007. С. 113–117.
13. Самые популярные породы коров / Н.Н. Резникова [и др.] // АГРОИНФО. Режим доступа: http://agroinfo.com/samye-populyarnye-porody-korov (дата обращения 14.03.14).
14. Санисало А., Структурные изменения молочных ферм, продуктивность коров // AgriTimes.ru. 2014. Режим доступа: http://fs-1.5mpublishing.com/agritimes/cowlongevity2014/Alina%20Sinisalo.
15. Скотоводство / под ред. Л. К. Эрнста, А. П. Бегучева, Д. Л. Левантина. М., 1977. 528 с.
16. Суровцев В. Н., Никулина Ю. Н. Экономические аспекты продуктивного долголетия коров // AgriTimes.ru. 2014. Режим доступа: http://fs-1.5mpublishing.com/agritimes/cowlongevity2014 (дата обращения 19.11.2014).
17. Тулинова О. А. Айрширская порода / Материалы всероссийская научная конференция по продуктивному долголетию коров. СПб. 2014. С. 7–8.
18. Хавкин Э. Е. Молекулярные маркеры в растениеводстве // С.-х. биология. 1997. № 5. С. 3–21 .
19. A missense mutation in the bovine leptin receptor gene is associated with leptin concentrations during late pregnancy / Liefers S.C. [at al.] // Anim. Genet. 2004. Nо. 35. P. 138–141.
20. A new mutation in the coding region of the bovine leptin gene associated with feed intake / Lagonigro R. [at al.] // Anim. Genet. 2003. Nо. 34. P. 371–374.
21. Agarwal R., Rout P. K., Singh S. K. Leptin: a biomolecule for enhancing livestock productivity // Indian J. of Biotech. 2009, Vol. 8. P. 169–176.
22. All association of bovine leptin polymorphisms with energy output and energy storage traits in progeny tested Holstein-Friesian dairy cattle sires / Giblin L. [at al.] // BMC Genetics. 2010. No. 11. P. 73.
23. Association of a lysine-232/alanine polymorphism in a bovine gene encoding acyl-CoA:diacylglycerol acyltransferase (DGAT1) with variation at a quantitative trait locus for milk fat content / Winter A. [at al.]. // Proc. Nat. Acad. Sci. USA. 2002. Nо. 99. P. 9300–9305.
24. Caetano-Anolles G., Bassam B., Gresshoff P. DNA amplification fingerprinting using very short arbitrary oligonucleotide primers // Bio-Technology. 1991. Vol. 9. Nо. 6. P. 553–557.
25. Engelke D., Krikos A., Bruck M. Purification of Thermus aquaticus DNA polymerase expressed in Escherichia coli // Anal. Biochem. 1990. Vol. 191, Nо 2. P. 396–400.
26. Evaluating markers in selected genes for association with functional longevity of dairy cattle / Scyda J. [et. al.]. NCBI. BioMed central genetics. 2011. Режим доступа: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3061949 (дата обращения: 19.01.2014).
27. Georges M., Massey J. M. Velogenetics, or the synergistic use of marker assisted selection and gem-line manipulation // Theriogenology. 1991. P. 151–159.
28. Heikkila A. M. Replacement decisions on Finnish dairy farms: toward better economic performance with novel technology and sustainable herds // MTT Science. 2013. No. 22. P. 101.
29. Hollola A. Dairy cattle breeds in Feenland // faba.fi. 2014. Режим доступа: http://www.faba.fi/en/dairy/breeds#Ayrshire (дата обращения: 13.11.2014)
30. Identification of a missense mutation in the bovine ABCG2 gene with major effect on the QTL on chromosome 6 affecting milk yield and composition in Holstein cattle / Cohen-Zinder M. [at al.] // Genome Res. 2005. Nо. 15. P. 936–944.
31. Jeffreys L.L. Indiviul-specific fingerprints of human DNA // Nature. 1985. P. 76–79.
32. Komisarek J. Impact of LEP and LEPR gene polymorphisms on functional traits in Polish Holstein-Friesian cattle // Anim. Sci. Papers and Reports. 2012. Vol. 28. P. 133–141.
33. Konfortov B. A., Licence V.E., Miller J.R. Re-sequencing of DNAfroma diverse panel of cattle reveals a high level of polymorphism in both intron and exon // Mamm. Genome. 1999. Nо.10. P. 1142–1145
34. Leptin promoter mutation affects leptin levels and performance traits in dairy cows / Liefers SC [at al.] // Anim. Genet. 2005. Nо. 36. P. 111–118.
35. Leptin, the obese gene product, rapidly modulates synaptic transmission in the hypothalamus / Glaum S. R. [at al.] // Molecular Pharmacology. 1996. No. 50. P. 230–235.
36. Mullis K., Faloona F., Scharf S. Specific enzymatic amplification of DNA in vitro: The polymerase chain reaction // Cold Spring Harbor Symp. Quant. Biol. 1986. Vol. 51, Nо 2. P. 263–273.
37. Positional candidate cloning of a QTL in dairy cattle: Identification of a missense mutation in the bovine DGAT1 gene with major effect on milk yield and composition / Grisart B. [at al.] // Genome Res. 2002. Nо. 12. P. 222–231.
38. Seyfert H. M., Lthen F. The structure of the bovine butyrophilin encoding gene differs grossly from mouse concerning promoter localization and exon organization of the S-untranslated region // 6th World Congress of Genetics Applied to Livestock Production. Vancouver, 1998. P. 51–54.
39. Sharifzadeh A., Doosti A. Investigation of leptin gene polymorphism in Iranian native cattle // Bulg. J. Vet. Med. 2012. No 2. P. 8692.
40. Szyda J., Komisarek J. Statistical Modeling of Candidate Gene Effects on Milk Production Traits in Dairy Cattle // J. Dairy Sci. 2007. No. 90. Р. 2971–2979.
41. Tautz D. Hypervariability of simple sequences as a general as general source for polymorphs DNA markers // Nucleic. Acids. Res. 1989. P. 6463–6471.
42. Taylor C., Everest M., Smith C. Restriction fragment length polymorphism in amplification products of the bovine butyrophilin gene: Assignment of bovine butyrophilin to bovine chromosome 23 // Anim. Genet. 1996. P. 183–185.
43. Williams J., Kubelic A., Livak K. DNA polymorphisms amplified by arbitrary primers are useful as genetic markers // Nucleic. Acids Res.1990. Vol. 18. Nо. 22. P. 6531–6535.
44. Xueyi H., Ribaut J., Gjnzalez-de-Leon D. Development of PCR-based markers to facilitate large-scale screening in molecular maize breeding // Maize Genetics Cooperation Newsletter. 1997. P. 7.
ПРИЛОЖЕНИЕ А
Таблицы расчета критерия для быков и телок (потомков быка с генотипом RRFFAA) по полиморфизмам LEP-R25C и LEP-Y7F
Таблица 1 А – Расчеты критерия для распределение генотипов по LEP-R25C
|
Генотипы LEP-R25C; |
Быки-производители (n=32) |
при а=0,01 |
|||||
|
Распределение |
э-т |
(э-т)^2 |
(э-т)^2/э |
|
|||
|
эмпирические |
теоретическое |
||||||
|
RR |
17 |
8 |
9 |
81 |
10,13 |
15,19 |
9,21 |
|
RC |
13 |
16 |
-3 |
9 |
0,56 |
||
|
CC |
2 |
8 |
-6 |
36 |
4,5 |
||
|
Генотипы LEP-R25C; |
Телята (n=32); ОАО «ПЗ «Дружба»» |
||||||
|
Распределение |
э-т |
(э-т)^2 |
(э-т)^2/э |
|
|||
|
эмпирические |
теоретическое |
||||||
|
RR |
29 |
8 |
21 |
441 |
55,13 |
72,51 |
|
|
RC |
5 |
18 |
-13 |
169 |
9,39 |
||
|
CC |
0 |
8 |
-8 |
64 |
8 |
Таблица 2 А – Расчеты критерия для распределения генотипов по LEP-Y7F
|
Генотипы LEP-Y7F |
Быки-производители (n=32) |
при а=0,01 |
|||||
|
Распределение |
э-т |
(э-т)^2 |
(э-т)^2/э |
|
|||
|
эмпирические |
теоретическое |
||||||
|
YY |
16 |
8 |
8 |
64 |
8 |
11,6875 |
9,21 |
|
YF |
13 |
16 |
-3 |
9 |
0,5625 |
||
|
FF |
3 |
8 |
-5 |
25 |
3,125 |
||
|
Генотипы LEP-Y7F |
Телята (n=32); ОАО «ПЗ «Дружба»» |
||||||
|
Распределение |
э-т |
(э-т)^2 |
(э-т)^2/э |
|
|||
|
эмпирические |
теоретическое |
||||||
|
YY |
0 |
8 |
-8 |
64 |
8 |
26,88889 |
|
|
YF |
14 |
18 |
-4 |
16 |
0,888889 |
||
|
FF |
20 |
8 |
12 |
144 |
18 |
ПРИЛОЖЕНИЕ Б
Таблица расчета критерия для быков и телок (потомков быка с генотипом RRFFAA) по полиморфизму LEP-A80V
Таблица 1 Б – Расчеты критерия для распределения генотипов по LEP-A80V
|
Генотипы LEP-A80V |
Быки-производители (n=32) |
при а=0,01 |
|||||
|
Распределение |
э-т |
(э-т)^2 |
(э-т)^2/э |
|
|||
|
эмпирические |
теоретическое |
||||||
|
AA |
32 |
8 |
24 |
576 |
72 |
96 |
9,21 |
|
AV |
0 |
16 |
-16 |
256 |
16 |
||
|
VV |
0 |
8 |
-8 |
64 |
8 |
||
|
Генотипы LEP-A80V |
Телята (n=32); ОАО «ПЗ «Дружба»» |
||||||
|
Распределение |
э-т |
(э-т)^2 |
(э-т)^2/э |
|
|||
|
эмпирические |
теоретическое |
||||||
|
AA |
32 |
8 |
24 |
576 |
72 |
98 |
|
|
AV |
0 |
18 |
-18 |
324 |
18 |
||
|
VV |
0 |
8 |
-8 |
64 |
8 |
ПРИЛОЖЕНИЕ В
Таблица расчета критерия для коров хозяйств ЗАО АФП «Нива» и ОАО «ПЗ «им. Чапаева В.И.»» по полиморфизму LEP-Y7F
Таблица 1 В – Расчет критерия для распределения генотипов LEP-Y7F
|
Генотипы LEP-Y7F |
Коровы 5-9 лактации (n=55); ЗАО АФП «Нива» |
при а=0,01 |
|||||
|
Распределение |
э-т |
(э-т)^2 |
(э-т)^2/э |
|
|||
|
эмпирические |
теоретическое |
||||||
|
YY |
31 |
13 |
18 |
324 |
24,92 |
38,79 |
9,21 |
|
YF |
24 |
29 |
-5 |
25 |
0,86 |
||
|
FF |
0 |
13 |
-13 |
169 |
13 |
||
|
Генотипы LEP-Y7F |
Коровы 1-3 лактации (n=51); ЗАО АФП «Нива» |
||||||
|
Распределение |
э-т |
(э-т)^2 |
(э-т)^2/э |
|
|||
|
эмпирические |
теоретические |
||||||
|
YY |
29 |
12 |
17 |
289 |
24,08 |
34,23 |
|
|
YF |
20 |
27 |
-7 |
49 |
1,81 |
||
|
FF |
2 |
12 |
-10 |
100 |
8,33 |
||
|
Генотипы LEP-Y7F |
Коровы 5-9 лактации (n=49);«ПЗ «им. Чапаева В.И.»» |
при а=0,01 |
|||||
|
Распределение |
э-т |
(э-т)^2 |
(э-т)^2/э |
|
|||
|
эмпирические |
теоретическое |
||||||
|
YY |
21 |
12 |
9 |
81 |
6,75 |
10,99 |
9,21 |
|
YF |
23 |
25 |
-2 |
4 |
0,16 |
||
|
FF |
5 |
12 |
-7 |
49 |
4,08 |
||
|
Генотипы LEP-Y7F |
Молодняк (n=51); «ПЗ «им. Чапаева В.И.»» |
||||||
|
Распределение |
э-т |
(э-т)^2 |
(э-т)^2/э |
|
|||
|
эмпирические |
теоретические |
||||||
|
YY |
33 |
12 |
21 |
441 |
36,75 |
48,83 |
|
|
YF |
15 |
27 |
-12 |
144 |
5,33 |
||
|
FF |
3 |
12 |
-9 |
81 |
6,75 |
ПРИЛОЖЕНИЕ Г
Таблица расчета критерия для коров хозяйств ЗАО АФП «Нива» и ОАО «ПЗ «им. Чапаева В.И.»» по полиморфизму LEP-A80V
Таблица 1 Г - Расчет критерия для распределения генотипов LEP-A80V
|
Генотипы LEP-A80V |
Коровы 5-9 лактации (n=55); ЗАО АФП «Нива» |
при а=0,01 |
|||||
|
Распределение |
э-т |
(э-т)^2 |
(э-т)^2/э |
|
|||
|
эмпирические |
теоретическое |
||||||
|
AA |
42 |
13 |
29 |
841 |
64,69 |
101,00 |
9,21 |
|
AV |
3 |
29 |
-26 |
676 |
23,31 |
||
|
VV |
0 |
13 |
-13 |
169 |
13 |
||
|
Генотипы LEP-A80V |
Коровы 1-3 лактации (n=51); ЗАО АФП «Нива» |
||||||
|
Распределение |
э-т |
(э-т)^2 |
(э-т)^2/э |
|
|||
|
эмпирические |
теоретические |
||||||
|
AA |
35 |
12 |
23 |
529 |
44,08 |
79,23 |
|
|
AV |
2 |
27 |
-25 |
625 |
23,14 |
||
|
VV |
0 |
12 |
-12 |
144 |
12 |
||
|
Генотипы LEP-A80V |
Коровы 5-9 лактации (n=49);«ПЗ «им. Чапаева В.И.»» |
при а=0,01 |
|||||
|
Распределение |
э-т |
(э-т)^2 |
(э-т)^2/э |
|
|||
|
эмпирические |
теоретическое |
||||||
|
AA |
48 |
12 |
36 |
1296 |
108 |
143,04 |
9,21 |
|
AV |
1 |
25 |
-24 |
576 |
23,04 |
||
|
VV |
0 |
12 |
-12 |
144 |
12 |
||
|
Генотипы LEP-A80V |
Молодняк (n=51); «ПЗ «им. Чапаева В.И.»» |
||||||
|
Распределение |
э-т |
(э-т)^2 |
(э-т)^2/э |
|
|||
|
эмпирические |
теоретические |
||||||
|
AA |
50 |
12 |
38 |
1444 |
120,33 |
157,37 |
|
|
AV |
1 |
27 |
-26 |
676 |
25,04 |
||
|
VV |
0 |
12 |
-12 |
144 |
12 |
ПРИЛОЖЕНИЕ Д
Таблица расчета критерия для коров хозяйства ЗАО «Агрофирма Кухаривская» по полиморфизмам LEP-R25C, LEP-Y7F, LEP-A80V
Таблица 1 Д - Расчет критерия для распределения генотипов LEP
|
Генотипы LEP-R25C |
Коровы 4-6 лактации (n=25);ЗАО «Агрофирма Кухаривская» |
при а=0,01 |
|||||
|
распределение |
э-т |
(э-т)^2 |
(э-т)^2/э |
|
|||
|
эмпирические |
теоретическое |
||||||
|
RR |
2 |
6 |
-4 |
16 |
2,66 |
11,52 |
9,21 |
|
RC |
10 |
13 |
-3 |
9 |
0,69 |
||
|
CC |
13 |
6 |
7 |
49 |
8,16 |
||
|
Генотипы LEP-R25C |
Коровы 1-3 лактации (n=52); ЗАО «Агрофирма Кухаривская» |
||||||
|
распределение |
э-т |
(э-т)^2 |
(э-т)^2/э |
|
|||
|
эмпирические |
теоретические |
||||||
|
RR |
9 |
13 |
-4 |
16 |
1,23 |
5,34 |
|
|
RC |
23 |
26 |
-3 |
9 |
0,34 |
||
|
CC |
20 |
13 |
7 |
49 |
3,76 |
||
|
Генотипы LEP-Y7F |
Коровы 4-6 лактации (n=25);ЗАО «Агрофирма Кухаривская» |
при а=0,01 |
|||||
|
распределение |
э-т |
(э-т)^2 |
(э-т)^2/э |
|
|||
|
эмпирические |
теоретическое |
||||||
|
YY |
25 |
6 |
19 |
361 |
60,16 |
79,16 |
9,21 |
|
YF |
0 |
13 |
-13 |
169 |
13 |
||
|
FF |
0 |
6 |
-6 |
36 |
6 |
||
|
Генотипы LEP- Y7F |
Коровы 1-3 лактации (n=52); ЗАО «Агрофирма Кухаривская» |
||||||
|
распределение |
э-т |
(э-т)^2 |
(э-т)^2/э |
|
|||
|
эмпирические |
теоретические |
||||||
|
YY |
50 |
13 |
37 |
1369 |
105,30 |
140,46 |
|
|
YF |
2 |
26 |
-24 |
576 |
22,15 |
||
|
FF |
0 |
13 |
-13 |
169 |
13,00 |
||
|
Генотипы LEP-Y7F |
Коровы 4-6 лактации (n=25);ЗАО «Агрофирма Кухаривская» |
при а=0,01 |
|||||
|
распределение |
э-т |
(э-т)^2 |
(э-т)^2/э |
|
|||
|
эмпирические |
теоретическое |
||||||
|
YY |
25 |
6 |
19 |
361 |
60,16 |
79,16 |
9,21 |
|
YF |
0 |
13 |
-13 |
169 |
13 |
||
|
FF |
0 |
6 |
-6 |
36 |
6 |
||
|
Генотипы LEP- Y7F |
Коровы 1-3 лактации (n=52); ЗАО «Агрофирма Кухаривская» |
||||||
|
распределение |
э-т |
(э-т)^2 |
(э-т)^2/э |
|
|||
|
эмпирические |
теоретические |
||||||
|
YY |
50 |
13 |
37 |
1369 |
105,30 |
140,46 |
|
|
YF |
2 |
26 |
-24 |
576 |
22,15 |
||
|
FF |
0 |
13 |
-13 |
169 |
13,00 |
Генетические маркеры функционального долголетия крупного рогатого скота