ИЗУЧЕНИЕ БИОРАЗНООБРАЗИЯ ПОПУЛЯЦИИ КРУПНОГО РОГАТОГО СКОТА С ИСПОЛЬЗОВАНИЕМ ГЕНОТИПИРОВАНИЯ ПО ПОЛИМОРФНЫМ ЛОКУСАМ
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
(ФГБОУ ВПО «КубГУ»)
Кафедра биохимии и физиологии
ДОПУСТИТЬ К ЗАЩИТЕ В ГАК
Заведующий кафедрой – канд. биол.
наук, доцент ________ В. В. Хаблюк
«___»______________ 2015 г.
ВЫПУСКНАЯ КВАЛИФИКАЦИОННАЯ РАБОТА
БАКАЛАВРА
ИЗУЧЕНИЕ БИОРАЗНООБРАЗИЯ ПОПУЛЯЦИИ КРУПНОГО РОГАТОГО СКОТА С ИСПОЛЬЗОВАНИЕМ ГЕНОТИПИРОВАНИЯ ПО ПОЛИМОРФНЫМ ЛОКУСАМ
Работу выполнил ______________________________________ В. А. Ростопка
(подпись, дата)
Факультет биологический
Направление 06.03.01 Биология
Научный руководитель,
д-р биол. наук, проф.___________________________________ Н. В. Ковалюк
(подпись, дата)
Нормоконтролёр,
доцент, канд. биол.
наук _________________________________________________ Н. Н. Улитина
(подпись, дата)
Краснодар 2015
РЕФЕРАТ
Данная работа выполнена на 44 листах машинописного текста. Содержит девять таблиц и шесть рисунков. Для выполнения данного исследования было использовано 42 литературных источника.
КРУПНЫЙ РОГАТЫЙ СКОТ, БИОРАЗНООБРАЗИЕ, ПОЛИМОРФИЗМ, ЧАСТОТА ВСТРЕЧАЕМОСТИ, BoLA-DRB3
Целью данного исследования является оценка генетического полиморфизма популяции крупного рогатого скота с использованием генотипирования по полиморфным локусам.
Проведенные исследования методом ПЦР-ПДРФ по изучению генетической структуры пород по локусу BoLA-DRB3 позволили установить, что в популяциях крупного рогатого скота интенсивно идут процессы снижения генетического разнообразия. Следствием этого является появление инбредной депрессии, что возможно проявляется в стадах чистопородных животных Краснодарского края в виде низкого выхода телят, высокого уровня поражения скота лейкозом, слабого иммунитета.
СОДЕРЖАНИЕ
Введение……………………………………………………………………………...4
1 Аналитический обзор……………………………………………………………..6
1.1 Проблема биоразнообразия доместицированных животных……….…….6
1.1.1 Биоразнообразие и главный комплекс гистосовместимости …......10
1.1.2 Происхождение крупного рогатого скота и предпосылки образования генетически гетерогенной популяции…………………………………………...12
1.2 Ген BoLA-DRB3 как составляющая главного комплекса гистосов-местимости крупного рогатого скота…………………………………………….14
1.2.1 Ген BoLA-DRB3: структура, функции…………………………..….15
1.2.2 Связь активности гена BoLA-DRB3 с оцениваемыми признаками КРС………………………………………………………………………………….17
1.2.3 Полиморфизм гена BoLA-DRB3 как перспективный селекционный маркер……………………………………………………………………………….19
2 Материалы и методы исследования………………………...………….……….23
2.1 Материал исследования…………………………………………………...... 23
2.2 Выделение ДНК……………………………………………………………... 23
2.3 Анализ полиморфизма гена BoLA-DRB3 методом ПЦР-ПДРФ……...…24
2.3.1 Амплификация фрагмента гена BoLA-DRB3 методом ПЦР…….…24
2.3.2 Рестрикционный анализ………………………………………………26
2.4 Электрофорез………………………………………………………………...32
2.5 Статистическая обработка данных………………………………………....33
3 Результаты исследования…………………………………………………….….34
3.1 Характеристика частот встречаемости аллелей BoLA-DRB3………….…34
3.2 Волнообразное изменение частот встречаемости аллелей BoLA-DRB у быков производителей в течение времени……………………….……………36
Заключение………………………………………………………………………….40
Библиографический список……………………………………………………….41
ВВЕДЕНИЕ
Мировая тенденция индустриализации сельского хозяйства несет в себе множество рисков. Один из них – это сокращение национальных генетических ресурсов животных и растений. Узконаправленный искусственный отбор приводит к абсолютному доминированию узкого числа вариант полиморфных аллелей. Это может послужить причиной процессов в популяции, негативно сказывающихся на способности к воспроизводству и здоровье животных.
Локус BoLA-DRB3 прямо или опосредовано связан с устойчивостью к воздействию неблагоприятных факторов/продуктивностью/длительностью хозяйственного использования, факторы как естественного, так и искусственного отбора оказывают влияние на частоты встречаемости его аллелей, что делает этот ген (и его полиморфизмы) интересным объектом для изучения механизмов взаимодействия генотип/среда.
Нами получены данные о частоте встречаемости полиморфизмов гена BoLA-DRB3 у субпопуляции крупного рогатого скота голштинской породы. Определены и соотнесены с литературными данными средняя гетерозиготность, число аллелей на локус BoLA-DRB3. Кроме того планируется собрать и математически обработать данные по продолжительности хозяйственного использования, продуктивности и уровне заболеваемости животных модельной группы. Полученные данные позволят сделать вывод о перспективах ведения селекции и сохранности полиморфизмов в исследуемой группе животных, а так же будет сделан вывод генетическом состоянии популяции и определены возможные варианты исправления ситуации в том случае, если она будет критической.
Таким образом, целью данного исследования являлась оценка генетического полиморфизма популяции крупного рогатого скота с использованием генотипирования по полиморфным локусам.
В задачи исследования входило:
- определение частот встречаемости аллелей и генотипов по локусу BoLA-DRB3 в репрезентативной выборке быков-производителей голштинской породы;
- изучение генетической структуры породы по локусу BoLA-DRB3;
- изучение волнообразных смен частот встречаемости аллелей у быков - производителей различных генераций.
1 Аналитический обзор
1.1 Проблема биоразнообразия доместицированных животных
Формирование вида (как единицы естественного отбора), в ходе эво-люции занимало значительные временные промежутки. При этом требовался индивидуальный набор участвовавших факторов, а так же наличие видов которые эволюционируют синхронно. Таким образом, имеющийся видовой состав животных и растений является ценным не возобновляемым генетическим ресурсом, даже не имея жизненно важного для человечества практического значения.
FAO (Food and Agricultural Organization – Продовольственная и сельскохо-зяйственная организация ООН) уверена, что биоразнообразие аграрного сектора – это необходимость для обеспечения выживания человечества в настоящем и будущем. Генетические ресурсы будут формировать основу любой стратегии для дальнейшей адаптации. В условиях меняющегося климата одной из стратегически важных задач, стоящих перед генетиками сегодня, является обеспечение продовольственной безопасности». [Всемирный генный банк…, 2013]. Мировая тенденция индустриализации сельского хозяйства несет в себе множество рисков, один из которых – сокращение национальных генетических ресурсов животных и растений [Доктрина продовольственной…, 2014].
Проблемы важности сохранения «культурного» биоразнообразия поднимает также международная конвенция о биологическом разнообразии, принятая на форуме «Повестка дня на XXI век». В конвенции подчеркивается значение сохранения и регионального использования генетических ресурсов для продовольствия и сельского хозяйства, с учетом взаимозависимости стран, обладающих этими ресурсами, для продовольственной безопасности планеты. Представители из почти 100 стран приняли участие в Межправительственной технической рабочей группе по генетическим ресурсам животных для производства продовольствия и сельского хозяйства, чтобы оценить прогресс в реализации “Глобального плана действий по генетическим ресурсам животных”. Данный план был принят в 2007 году с целью улучшения управления биоразнообразием животных в мире. [Продовольственная и сельскохозяйственная…, 2014].
Под “биоразнообразием” в таком случае понимается “разнообразие проявления жизни на трёх уровнях организации: генетическое (разнообразие генов и их вариантов – аллелей), видовое (разнообразие видов в экосистемах) и экосистемное разнообразие, то есть разнообразие самих экосистем” [Лебедева, Дроздов, Криволуцкий, 2004].
Ключевым документом, регулирующим этот вопрос, является “Кон-венция о биологическом разнообразии” ООН [Конвенция о…, 2014]. Она чётко указывает, что “сохранение и устойчивое использование биологического разнообразия имеет решающее значение для удовлетворения потребностей в продовольствии и здравоохранении, а также других потребностей растущего населения Земли и что доступ как к генетическим ресурсам, так и технологиям и их совместное использование имеют важное значение для решения этих задач. При этом «Биологические ресурсы» включают генетические ресурсы, организмы или их части, популяции или любые другие биотические компоненты экосистем, имеющие фактическую или потенциальную полезность или ценность для человечества”. Как видим, генетическое разнообразие признается базовой основной для всех иных видов биоразнообразия и является само ценностью.
Генетическое разнообразие может трактоваться как разнообразие популяций по признакам или маркерам генетической природы [Алтухов, 2003]. Оно представляет собой важный компонент генетической характеристики популяции, группы популяций или вида. Генетическое разнообразие, в зависимости от выбора рассматриваемых генетических маркеров, характеризуется несколькими измеряемыми параметрами:
- средняя гетерозиготность.
- число аллелей на локус.
- генетическое расстояние (для оценки межпопуляционного генетического разнообразия).
Таким образом, поиск и анализ уникальных генетических последова-тельностей, исследование динамики известных аллелей каждого вида, породы вносит вклад в формирование общей картины генетических ресурсов биосферы. Узконаправленный искусственный отбор приводит к абсолютному доминированию малого числа вариант от полиморфных аллелей. Это может послужить причиной «скрытого инбридинга» так как не останется разнообразного генетического материала для дальнейших на-правлений селекции.
За рубежом большое внимание уделяется проблемам изучения биоразнообразия в целом и биоразнообразию крупного рогатого скота в частности. Многие ведущие зарубежные институты разрабатывают долгосрочные проекты, посвященные генетическому мониторингу и, в частности, ДНК-мониторингу генофонда крупного рогатого скота (например, проект Roslin Institute (Edinburg) - "Genetic Diversity in Cattle"). Создана и международная программа по картированию генома Bos taurus [Генджиева, Сулимова, 2012].
Остро вопрос обеднения генофонда крупного рогатого скота (КРС) стоит в современных российских условиях. Так, по мнению Бойко Е.Г. развитие животноводства в Росси в ХХ – начале XXI веков происходило по пути доминирования импорта над экспортом скота [Бойко, 2009]. По количеству сельскохозяйственного скота в IXX – начале XX века России принадлежало одно из первых мест. В первой половине ХХ века страна потеряла великорусский, сибирский, великокавказский, кубано-черноморский, рубашевский, монгольский, маньчжурский, алтайский, печорский скот или более 30 местных пород и отродий КРС. Из 22 созданных заводских пород шесть уже не разводятся на территории РФ и принадлежат другим государствам, три породы (юринская, лебединская, бушуевская) полностью исчезли, девять пород находятся на грани исчезновения. При этом в ведущих животноводческих странах мирах оберегают и сохраняют древнейшие породы скота [Динамика популяционных…, 2004]. Существует несколько основных аспектов сохранения культурного биоразнообразия, один из которых – генетический потенциал существующих местных пород. Их внутривидовая изменчивость и адаптивные возможности обеспечивают устойчивое развитие животноводства в разнообразных агроэкосистемах. Классическим примером тотального экспорта генетического материала является голштинизация российской популяции КРС. Наряду с общеизвестными положительными эффектами нарастают и негативные.
Включение в отечественное сельское хозяйство транснациональных животноводческих индустрии создает опасность сокращения собственных генетических ресурсов сельскохозяйственных видов, зависимость от импорта, а также угрозу глобализации распространения инфекций и скрытых генетических дефектов. В то же время создание индустриальных цепочек производства продовольствия уменьшает эффективность использования богатства природных комплексов/ландшафтов, особенно разнообразных на территории России, и тормозит развитие биоорганического сельского хозяйства. Отсюда следует все возрастающая важность сохранения генофондов отечественных сельскохозяйственных видов животных (Столповский, 2010]. Наглядным примером выше сказанному служит всплеск заболеваемости лейкозом и некробактериозом в молочном производстве, до 40-50 % животных стали болеть различными формами мастита [Черекаев, 1997]. Голштинизированные животные более требовательные к содержанию и кормлению, чем адаптированные к суровым условиям местные породы скота. Другим негативным эффектом, по мнению В.М.Кузнецова, является возрастающая степень родства между животными [Научные проблемы…, 2014]. Так использование в Ленинградской области в течение ряда лет сыновей, внуков и правнуков небольшого числа выдающихся голштинских производителей привело к значительному генетическому сходству между когортами быков разных годов рождения и линий. Так, генетическое родство между быками разных линий составляло 20-40 %. Ожидаемо, что через несколько лет все последующие спаривания будут уже родственными и приведут к инбридингу.
На проблему культивирования полиморфности генетики обращают внимание давно. Ее пытались повышать, используя генетический маркер каппа-казеина, а так же метод ДНК ISSR (мультилокусный межмикросателитный анализ пород) [Дымань, Глазко, 1997]. Данный метод может быть использован для сравнительного анализа пород, оценки их консолидированности и чистоты, как компонент комплексного генетического мониторинга динамики генофонодов и сохранения разнообразия доместицированных видов [Применение метода ISSR-PCR ..., 2010]. На примере изучения трех родственных пород крупного рогатого скота мясного назначения – калмыцкой, якутской и монгольской показано, что генофонды этих пород четко различаются, а в стадах якутской и монгольской пород обнаружены нечистопородные животные. Метод эффективен и при изучении филогенетических связей пород: впервые показано, что калмыцкий скот наиболее отдален от двух других родственных пород турано-монгольской группы крупного рогатого скота и, по-видимому, является более древним [Отчетный доклад…, 2009]. Многие авторы видящие эту проблему пытаются решать ее на уровне разнообразия пород, сохраняя национальные породы.
Мы считаем, что перспективно исследование полиморфизма многоал-лельных локусов для оценки уровня биоразнообразия в исследуемой группе животных.
- Биоразнообразие и главный комплекс гистосовместимости
Большинство разновидностей генов имеет довольно консервативный характер. Однако, существует несколько групп генов, в которых эволюционно закрепился полиморфизм. Самыми полиморфными из них являются гены, отвечающие за группы крови и гены главного комплекса гистосовместимости (Major Histocompatibility Complex – MHC).
Поскольку гистосовместимость являет собой «индивидуальность тка-ней», выраженную в специфическом антигенном комплексе, на мембранах клеток – она имеет максимальное число вариант. Таким образом, главный комплекс гистосовместимости естественным образом связан с поддержанием биоразнообразия в природе. Это дает нам возможность использовать полиморфизм МНС для поддержания разнообразия в популяциях. Кроме того различные варианты МНС формировались в ходе эволюции как ответная реакция на вновь возникающие инфекции, итогом чего стал имеющийся полиморфизм. Таким образом, полиморфизм МНС сформировался согласно западной гипотезе «Чёрной королевы», которая гласит: “виду необходимы постоянные изменения и адаптации, чтобы поддерживать его существование в окружающем биологическом мире, постоянно эволюционирующем вместе с ним” [The Red Queen…, 2014]. То есть полиморфизм комплекса BoLA есть результат коэволюции крупного рогатого скота и его паразитов.
В природе существует ряд механизмов для поддержания генов в разнообразии, т. к. в этом заключается основа естественного отбора. Такие механизмы существуют на разных уровнях организации (Этологический - импринтинг; на стадии оплодотворения, эмбриональный, физиологический), и главный комплекс гистосовместимости прямо или косвенно принимает участие в нескольких из них.
Еще один механизм по все видимости действует на стадии оплодотво-рения. Долгое время считалось, что яйцеклетку оплодотворяет сперматозоид первым прошедший через половые пути. Однако фактически сотни сперматозоидов одновременно достигают яичников, но яйцеклетка контактирует лишь с одним. Существует мнение, что она при этом действует избирательно, выбирая того чьи генетические характеристики наиболее отличаются от ее собственных [Корочкин, 2002]. Таким образом, гены потомства обогащаются новыми последовательностями, кодирующими новые, альтернативные имеющимся признаки.
Следующий механизм связан с запаховым восприятием сигналов коди-руемых МНС. Например, самцы мышей по запаху идентифицируют самок, отличающихся от них самих по локусу MHC, и всегда предпочитают их в качестве половых партнеров [Familial imprinting …, 1998]. Точно такие же предпочтения выявлены и у человека. Проводился эксперимент, где испытуемым предлагали оценить запахи нательного белья других людей в результате чего, была выявлена зависимость уровня "приятности" запахов от степени совпадения аллельного состояния MHC у испытуемого и у донора источника запаха. Как мужчины, так и женщины предпочитали запахи тех людей, у кого аллельное состояние MHC наиболее сильно отличалось от их собственного. Следует также отметить, что у разных групп организмов эволюция шла разными путями: у млекопитающих, по сравнению с насекомыми, в целом сильнее выражена тенденция к предпочтению неродственных особей в качестве половых партнеров. У млекопитающих, по-видимому, сильнее развиты механизмы предотвращения инбридинга. Это может быть связано с особенностями иммунной системы, которая у млекопитающих отличается наибольшей сложностью и эффективностью – например, структура MHC млекопитающих явно способствует выработке тенденций к предпочтению отличающихся партнеров и к росту общей гетерозиготности. В результате формируются такие особенности эволюции млекопитающих и насекомых как различия в степени эндемизма; относительном числе эврибионтных, полиморфных видов; общем уровне разнообразия – виды млекопитающих проявляют меньшую склонность к дроблению, и т.д.. Вместе с тем, очевидно, что предпочтение "иных" в качестве брачных партеров - вещь относительная; абсолютизация этого принципа привела бы к массовой отдаленной гибридизации и полной деградации вида. Ясно, что речь идет именно об "оптимальной величине сходства/различия".
1.1.2 Происхождение крупного рогатого скота и предпосылки образования генетически гетерогенной популяции
Если учитывать весь спектр получаемой от крупного рогатого скота продукции, то он, без сомнения, является одним из самых ценных животных, когда либо одомашненных человеком. Одомашнивание крупного рогатого скота ведет отсчет во времена раннего неолита, примерно 8500 лет назад. В происхождении крупного рогатого скота принимали участие несколько видов диких видов крупных копытных принадлежащих роду быков (Bos), семейству полорогих, отряду парнокопытных и классу млекопитающих, живущих или еще недавно живших в Европе, Азии и Северной Америке [Куликов, 2000]. В основе происхождения, по всей видимости, лежат такие виды как европейский зубр, американский бизон, европейский тур. И в разные временные периоды при создании пород крупного рогатого скота приливалась кровь таких видов как: горный тибетский як (Азия), зебу (Африка), гаял, гаур, бантенг (Индонезия), а также крупный бык Савеля.
Виды этой группы могут давать потомство при скрещивании с совре-менным крупным рогатым скотом, что указывает на их родство. Однако быки, полученные от такого скрещивания, остаются бесплодными, самки могут дать приплод либо от домашнего быка, либо от быка другого чистого вида (яка, бантенга и т.д.). Это указывает, на то, что крупный рогатый скот не настолько близок к современным диким быкам, и их можно было отнести к одному виду, и, следовательно, не эти дикие формы были родоначальниками наших домашних пород.
В итоге такого сложного и многоэтапного происхождения получена группа животных с очень богатым генофондом, и большим потенциалом для искусственного отбора. Всего было выведено более тысячи пород и породных групп крупного рогатого скота, каждая из которых получила специализацию для тех или иных условий и потребностей человека. Такое большое количество вызвано двумя обстоятельствами: значительным разнообразием природно-климатических условий и специализацией на производстве определенного вида продукции. Современное животноводство развивается в трех направлениях – молочное, мясное, комбинированное. Однако тенденции в скотоводстве в последние годы нацелены на интенсивное животноводство а, следовательно – глобализацию [Зоотехния и…, 2004]. Из всего спектра пород доминирующее большинство занимают три: голштино-фризская, айрширская, джерсейская. Таким образом, отбор животных в течение длительного периода проходит через узкое горлышко искусственного отбора по ограниченному количеству хо-зяйственно полезных признаков: удой, жир белок, экстерьер. Такой способ селекции сильно снизил генетическое разнообразие крупного скота. Кроме того, интенсивное животноводство подразумевает использование специализированной техники, которая требует в свою очередь стандартизации животных по росту, характеристикам тела, параметрам вымени, что также приводит к еще большему обеднению генетического потенциала.
Проблема глобализации в животноводстве, так же актуальна и для нашей страны. Из 70 пород, разводимых на территории бывшего СССР в восьмидесятые и девяностые годы XX, на сегодняшний день официально зарегистрировано 18 отечественных пород крупного рогатого скота. Обеднение генетических ресурсов КРС, может привести к снижению эффективности селекции и снижению резистентности животных к постоянно эволюционирующим возбудителям заболеваний. В связи с этим, важно поддерживать максимально возможное разнообразие генофонда КРС.
Полученные в ходе выполнения работы данные по аллельному поли-морфизму гена BoLA-DRB3 и частотам встречаемости ценных аллелей, от-ветственных за устойчивость к заболеваниям, у широкого спектра отече-ственных пород, могут стать фундаментальной основой для разработки се-лекционно-генетических подходов к оздоровлению стад животных и сохранению биоразнообразия. Высокое содержание ценных аллелей и генотипов у костромского, калмыцкого и зебувидного скота может служить основанием для разработки программ по сохранению их генофондов и рациональному использованию в целях улучшения генофондов других пород КРС, разводимых в России [Рузина, 2010; Сулимова, 2011].
1.2 Ген BoLA-DRB3 как составляющая главного комплекса гистосовместимости крупного рогатого скота
В современной сельскохозяйственной биотехнологии всё большее значение приобретают молекулярно-биологические методы, позволяющие тонко регулировать фенотипическое проявление ценных признаков животных на основе их генетических детерминант. Важнейшую роль, по мнению ряда исследователей, играет ген BoLA-DRB3, относящийся к главному комплексу гистосовместимости [Столповский, Сулимова, 2007].
Главный комплекс гистосовместимости (Major Histocompatibility Complex, MHC) – это группа генов и кодируемых ими антигенов клеточной поверхности, которые играют важнейшую роль в распознавании чужеродного и развитии иммунного ответа. Антигены МНС представляют собой гликопротеиды, находящиеся на поверхности клеток, они играют важнейшую роль в регуляции иммунного ответа на чужеродные антигены и сами являются сильными антигенами. Антигены МНС подразделяются на антигены класса I и антигены класса II . Важнейшая функция антигенов HLA класса II – обеспечение взаимодействия между Т-лимфоцитами и макрофагами в процессе иммунного ответа. Т-хелперы распознают чужеродный антиген лишь после его переработки макрофагами, соединения с антигенами класса II и появления этого комплекса на поверхности макрофага [Молекулярная биология …, 1987].
У человека МНС локализован в шестой хромосоме и обозначается как НLA, у КРС - BoLA и локализован в 23 хромосоме [Петров, 1982].
Система BoLA-DRB3 является универсальным механизмом ответа на разнообразный спектр инфекционных агентов – так она играет ключевую роль в сопротивляемости респираторным вирусным инфекциям КРС [Elizabeth, 2012]. По мнению ряда исследователей, BoLA-DRB3 играет ключевую роль в устойчивости КРС к лейкозу – так в работах зарубежных и отечественных ученых отмечена роль второго экзона, отвечающего за полиморфизм гена [High Genetic Susceptibility to…, 2014; Polymorphism in BoLA-DRB3…, 1993].
Известно, что функциональные свойства BoLA-DRB3 как гена иммунного ответа обусловлены именно его высоким полиморфизмом – известны десятки его аллелей, регулярно описываются новые формы. Так в работе [Sequence and PCR-RFLP analysis …, 1995] проанализированы 14 новых аллелей гена.
1.2.1 Ген BoLA-DRB3: структура, функции
На молекулярно-биологическом уровне трансляция BoLA-DRB3 обеспечивает синтез белкового антигена, расположенного на внешней стороне мембраны В-лимфоцитов [Nassiry, 2005]. Расшифровке его трёхмерного строения ряд работ [Polymorphism and disease resistance…, 2014]. Пептидная конструкция (рисунок 1) несёт рецепторуную функцию и включает в себя - и -цепи, являющиеся трансмембранными полипептидами, внеклеточная часть которых организованна в два домена по 90 аминокислотных остатков. Гидрофобный трансмембранный домен содержит 30, а цитоплазматический участок 12-15 остатков. Внеклеточная часть пептида образует трёхмерную структуру (т.н. щель Бьоркмана) – боковые стены которой ограничены -спиралями, а дно -складчатостью.
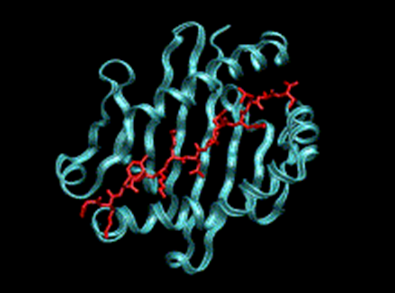
Рисунок 1 – Третичная структура пептидного комплекса BoLA DRB3
Молекула BoLA DRB3 показаны синим цветом, чужеродный белковый антигент отображается красным цветом. [The use of binding-prediction models to…, 2011]
Аминокислотная последовательность щели кодируется триплетами экзона 2 BoLA-DRB3 и обладает высокой полиморфностью (рисунок 2) [A single amino acid …, 2002].
Это свойство обеспечивает широчайшую вариабельность строения щели как рецептора по отношению чужеродным белковым антигенам.
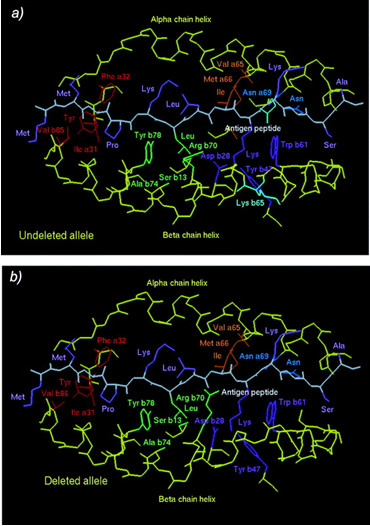
Рисунок 2 – Аминокислотная последовательность щели
Для некоторых аллельных вариантов молекул длина встраиваемого чужеродного пептида составляет 13 аминокислотных остатков. В молекулах HLC класса II щель открыта для связывания пептида с обеих сторон, что позволяет встраивать последовательности длиной 12-25 остатков [Ярилин, 1999].
1.2.2 Связь активности гена BoLA-DRB3 с оцениваемыми признаками КРС
Установлено, что локализация гена BoLA-DRB3 на 23 хромосоме в непосредственной близости от генов, детерминирующих хозяйственно-ценные признаки, обеспечивает их сцепленное наследование. Это обусловливает сложный механизм комплексной реализации генетических признаков. Так в работе С.О.Турковой показана связь полиморфизма генов BoLA-DRB3, пролактина и гормона роста в связи с устойчивостью к лейкозу и молочной продуктивностью [Туркова, 2003]. Анализу связи генов BoLA с уровнем мастита, фертильностью и другими признаками в популяции норвежского скота посвящена работа [Association of major…, 1994]. Статистически показана связь аллелей *22 и *11 с процентом жирности молока коров голштинской породы популяций Ирана [Analysis of Relationship…, 2009]. Там же отмечена корреляция аллелей *22, *24 с содержанием молочного белка, аллеля *8 – с вероятностью проявления мастита. Корреляция последовательности экзонов два и три гена BoLA-DRB3 с уровнем мастита для КРС в районе Пекина также показана в [Polymorphism of exon…, 2012].
В работе Рузиной представлен литературный обзор связи полиморфизма гена BoLA-DRB3 с признаками молочной продуктивности и качества молока (таблица 1) [Рузина, 2012].
Таблица 1 – Связь полиморфизма гена BoLA-DRB3 с признаками молочной продуктивности и качества молока
|
№ |
Параметр |
Аллели |
|
1 |
Somatic Cell Count (SCC) * Повышенный (300000 кл/мл) Сниженный (100000 кл/мл) |
*8,*22, *23 *3, *11 |
|
2 |
Увеличение удоев |
*8, *11, *23 |
|
3 |
Повышенная белковая продуктивность |
*3, *11, *26 |
|
4 |
Снижение удоев и белковой продуктивности |
*22 |
Однако автор показывает, что одни и те же аллели, согласно данным разных исследователей, могут обуславливать противоположные биологические эффекты. В связи с этим отмечено, что частота встречаемости того или иного аллеля достигает некоторого пикового значения, а потом начинает резко снижаться [Ковалюк, Сацук, Волченко, 2012]. Вероятно, это связано с эффектом «насыщения», когда несмотря на явную селекционную предпочтительность того или иного аллеля (например, *24 - у голштинов), эффект его присутствия нивелируется у дочерей высоким уровнем гомозиготности (появляется много гомозиготных животных), что негативно влияет на ряд показателей и приводит к снижению частоты встречаемости этого аллеля в следующем поколении.
1.2.3 Полиморфизм гена BoLA-DRB3 как перспективный селекционный маркер
Как было отмечено выше, ген BoLA-DRB3 обладает выраженным естественным полиморфизмом.
Локус считается полиморфным, если в популяции существуют два или более аллеля этого локуса. Однако, если один из аллелей имеет очень высокую частоту, скажем, 0,99 или больше, то высока вероятность того, что ни один другой аллель не будет присутствовать в выборке, взятой из популяции, если только эта выборка не будет очень большой. Таким образом, обычно локус определяется как полиморфный, если частота наиболее распространенного аллеля меньше 0,99. Такое деление носит весьма условный характер и в литературе можно найти другие критерии полиморфности.
Одним из наиболее простых способов измерения степени полиморфности в популяции, является подсчет среднего соотношения полиморфных локусов и путем деления их общего числа на суммарное число локусов в выборке. Однако такая мера в значительной степени зависит от числа изученных особей. Более точным показателем генетической вариабельности внутри популяции является средняя ожидаемая гетерозиготность или генное разнообразие. Эта величина может быть получена непосредственно из генных частот и в гораздо меньшей степени подвержена влиянию эффектов, связанных с ошибкой выборки. Генное разнообразие по данному локусу определяется следующим образом:
m
h = 1 - SUM xi*, (1),
i=1
где SUM – сумма;
xi - частота аллеля;
i и m – общее число аллелей данного локуса.
Для любого локуса h является вероятностью того, что два аллеля, случайным образом выбранных в популяции, будут отличаться друг от друга. Среднее по всем h для каждого изученного локуса, H, может быть использовано как оценка степени генетической вариабельности внутри популяции.
Степени генетического разнообразия h и H широко использовались для данных, полученных при электрофоретическом анализе и анализе рестрикционных фрагментов. Однако, они не всегда могут быть подходящими для данных, полученных при исследовании последовательностей ДНК, так как степень разнообразия на уровне ДНК чрезвычайно велика. В особенности, когда рассматриваются длинные последовательности, вполне вероятно, что каждая будет отличаться от других последовательностей по одному или более нуклеотидам. Тогда как h, так и H будут близки к первому и, следовательно, не будут различаться между локусами или популяциями, будучи, таким образом, не информативными.
При работе с ДНК более приемлемым показателем полиморфизма в популяции является среднее число нуклеотидных замен на позицию между двумя случайно выбранными последовательностями. Эта оценка называется нуклеотидным разнообразием и обозначается п:
пij = SUM (xi · xj · пij) (2),
где x i и x j - частоты последовательностей i-го и j-го типов;
пij - доля нуклеотидных различий между i-м и j-м типами последовательностей.
Основным полифморфным локусом гена BoLA-DRB3 является экзон два. Всего в состав гена входит шесть экзонов, кодирующих лидерную и концевую последовательности, гидрофобный трансмембранный участок, цитоплазматический и внеклеточный домены белка (рисунок 3). Последний собственно выполнят антигенную функцию и является полиморфным. Методами рестрикционного анализа ДНК описано 54 аллеля гена, по результатама секвенирования – их более 100 [Sequence and PCR-RFLP …, 1995; Identification of …, 2001].
SP a1 a2 TM CY 3’ut
A
SP b1 b2 TM CY 3’ut
B
Примечание – SP-сигнальный пептид;
a1, a2, b1 и b2 - домены 1 и 2 в А и В - генах, соответственно;
TM - трансмембранный участок;
CY - область, кодирующая цитоплазматическую часть молекулы
Рисунок 3 – Экзон-интронная структура А- и В – генов класса II BoLA- системы
Известно, что в локальных регионах может доминировать узкое число аллелей. Так при исследовании выборки из 650 особей КРС Краснодарского края обнаружено преимущественно 6-7 ПДРФ-типов из более чем 50 возможных [Ковалюк, Сацук, Волченко, 2012]. В работе отечественных учёных проведена оценка генетического разнообразия полиморфизма BoLA-DRB3 в монгольской, калмыцкой и якутской пород крупного рогатого скота Bos taurus турано - монгольской группы [Polymorphism of the …, 2010]. Авторами обнаружены 2 аллеля в породе монгольских, 5 в якутской и 34 аллеля в калмыцкой породах.
Результаты исследований полиморфизма BoLA-DRB3 имеют не только теоретическое, но и прикладное значение: ген может быть использован в качестве маркера уровня полиморфизма генома животного, а так же являться важным показателем для популяции в целом. Кроме того анализ микросателлитных локусов в составе экзонов BoLA-DRB3 применяется для установления отцовства быков. Результаты позволили исключить с вероятностью 0,99 неправильного отца [Usha, Simpson, Williams, 2009].
2 Материалы и методы исследования
2.1 Материал исследования
Исследование проводилось в 2014 году в период с 17.06.14 по 27.07.14 и с 02.09.14 по 12.10.14. В лаборатории биотехнологии генотипировано 100 голов быков - производителей голштинской черно-пестрой породы, принадлежащих различным племенным предприятиям: ОАО «ГЦВ», ОАО «Московское» по племенной работе, ОАО «Краснодарское» по племенной работе, ГУПП РК «Карелиягосплем», ОАО «Невское» по племенной работе и ОАО «Племпредприятие «Череповецкое», рожденные во временном интервале с 1982 по 2012 года.
В качестве материала для выделения ДНК служила сперма быков-производителей.
Источниками информации о происхождении и оценке быков-производителей стали их племенные свидетельства и данные каталогов племпредприятий.
2.2 Выделение ДНК
При выделении ДНК из спермы нами использовались наборы реагентов Diatom™ DNA Prep 100 ООО Лаборатория «Изоген» г. Москва.
1. Первичная обработка образцов.
- Семя размораживаем. 100 мкл переносим в чистую пробирку, добавляем 240 мкл лизирующего раствора (Lysisreagent), 20 мкл ДТТ на каждые 10 проб, термостатируем смесь при 65 С 40 мин. Центрифугируем десять секунд при 5000 об/мин. Переносим супернатант в чистую пробирку.
- К 100 мкл крови добавляем 400 мкл лизирующего раствора (Lysisreagent). Приступаем к выделению без термостатирования.
2. В пробирку с лизатом добавляем 20 мкл суспензии сорбента (диатомовые водоросли). Перед этим сорбент встряхиваем на вортексе. Ротируем 10 мин.
3. Центрифугируем десять секунд при 5000 об/мин.
4. Осторожно, не задевая осадка, удаляем супернатант с помощью водоструйного насоса. К осадку прибавляем 200 мкл лизирующего раствора.
5. Центрифугируем десять секунд при 5000 об/мин.
6. Удаляем супернатант. К осадку добавляем 1 мл рабочего однократного раствора солевого буфера (десятикратный солевой буфер (1М хлорид натрия (NaCl) и 1M хлорид калия (KCl)) разводим водой до 100 мл, а затем 96% этиловым спиртом до 300 мл и перемешиваем).
7. Центрифугируем десять секунд при 5000 об/мин.
8. Удаляем супернатант, к осадку добавляем 1 мл рабочего раствора солевого буфера, перемешиваем, центрифугируем десять секунд при 5000 об.
9. Удаляем супернатант. Убираем полосками фильтровальной бумаги остатки жидкости над сорбентом, меняя полоски от пробы к пробе.
10. Осадок сушим в термостате при 65 С пять минут.
11. К осадку добавляем 100 мкл ЭкстраГена (10% смесь ионообменников (типа Chelex), и 0,01% тритон X-100). Пробирку с ЭкстраГеном хорошо перемешать. Затем ресуспендируем на вортексе и термостатируем пять минут при 65 С.
12. Центрифугируем при 12000 об/мин
13. Перенести содержащую ДНК надосадочную жидкость (80 мкл) в чистую пробирку.
Выход ДНК составлял 3-5 мгк/100 мкл с OD 260/280 от 1,6 до 2,0.
2.3 Анализ полиморфизма гена BoLA-DRB3 методом ПЦР-ПДРФ
2.3.1 Амплификация фрагмента гена BoLA-DRB3 методом ПЦР
Для последующего анализа методом гнездовой ПЦР амплифицировали участок экзона два гена BoLA-DRB3 размером 284 п.н. (281 п.н. для аллелей с делецией).
Таблица 2 – Состав реакционной смеси для амплификации фрагментов BoLA-DRB3
|
H2O |
HLO-30 (5’-3’: tcctctctctgcagcacatttcc) (20пМ) |
HLO-32 (5’-3’ tcgccgctgcacagtgaaactctc) (20пМ) |
MgCl2 (25мМ) |
дНТФ (2,5 мМ) |
Tris-HCL (pH 8,8-буфер) |
ДНК-полимераза (5 ед./мкл) |
|
19,5 мкл |
1,2 мкл |
1,2 мкл |
1,2 мкл |
0,5 мкл |
3 мкл |
0,4 мкл |
Конечный объем реакционной смеси составлял 27 мкл. Количество реакционной смеси определялось с учетом положительного и отрицательного контроля.
Параметры амплификации указаны в таблице 3. ПЦР проводили в многоканальном амплификаторе «Терцик» фирмы «ДНК-технология», Россия.
Таблица 3 – Параметры амплификации фрагмента экзона 2 гена BoLA-DRB3.
|
Стадия ПЦР |
Количество циклов |
Температура, оС |
Длительность стадии |
|
Первоначальная денатурация ДНК |
1 |
95 |
3 мин |
|
Денатурация ДНК Отжиг праймеров Синтез ДНК |
35 |
94 65 72 |
30 сек 30 сек 30 сек |
|
Заключительный синтез |
1 |
72 |
5 мин |
Для контроля прохождения реакции проводили электрофорез в 1,5 процентном агарозном геле для оценки качества и концентрации полученного фрагмента.
Таблица 4 – Приготовление 1.5% агарозного геля
|
Гель |
Анализируемый фрагмент |
Название анализа |
Компоненты |
|
1.5% гель |
600-700 пн |
Контроль прохождения ПЦР |
- Агароза – 1.5 г - Доводим до 100мл 1% TBE-буфером - Бромистый этидий – 5мкл |
На гель наносили 5 мкл образца.
2.3.2 Рестрикционный анализ
Для рестрикционного анализа фрагмента экзона 2 гена BoLA-DRB3 использовали эндонуклеазы рестрикции RsaI, HaeIII, BstYI, BstX2I фирмы НПО «СибЭнзим», Россия. Характеристики ферментов см. в таблице 5.
Таблица 5 – Характеристики эндонуклеаз рестрикции, использованных в работе
|
Название |
Сайт рестрикции (5’-3’) |
Температура инкубации (oC) |
|
RsaI |
GTAC |
37 |
|
HaeIII |
GGCC |
37 |
|
BstYI |
СС(А/T) GG |
60 |
|
BstX2I |
(A/G)GATC(C/T) |
60 |
Состав буфера для хранения данных ферментов НПО («СибЭнзим»): 10мM Tris-HCl (pH 7.4); 300мM хлорид натрия (NaCl); 0,1мM EDTA; 1мM DTT; 0,5мг/мл BSA; 50% глицерин.
Состав буфера для инкубации НПО («СибЭнзим»): 10 мM Tris-HCl (pH 7,9 при 37 градусах Цельсия); 10мM хлорид магния (MgCl2); 50мM хлорид натрия (NaCl); 1мM DTT.
Для обработки брали 5 мкл продуктов ПЦР. Количество фермента на 1 реакцию - 5 ед. активности. Инкубацию проводили в течение 3 ч.
Карта сайтов рестрикции амплификатов представлена на рисунке 4.
\/ - присутствие делеции в 3 нуклеотидах.
BstX2I
199 85
a ____________________________________________________|___________________
284
b _______________________________________________________________________
196 85
c _________________________________________________\/_|___________________
87 197
d _____________________|__________________________________________________
87 112 85
e _____________________|______________________________|____________________
HaeIII
167 52 65
a _________________________________________|________________|_____________
219 65
b __________________________________________________________|____________
167 49 65
c _________________________________________|_______\/_______|______________
190 29 65
d ____________________________________________________|_____|_____________
167 117
e _________________________________________|______________________________
167 4 48 65
f _________________________________________|_|______________|_____________
164 55 65
g _______________________________________|__________________|____________
167 46 6 65
h ___________________________________________|___________|__|_____________
167 4 113
i _________________________________________|_|____________________________
RsaI
78 33 30 39 54 50
a ____________________|_______|_______|__________|_____________|___________
111 30 39 54 50
b ____________________________|_______|__________|_____________|__________
111 30 93 50
c ____________________________|_______|________________________|__________
111 30 143
d ____________________________|_______|__________________________________
141 39 51 50
e ____________________________________|__________|__\/_________|___________
141 39 54 50
f ____________________________________|__________|_____________|___________
141 39 104
g ____________________________________|__________|________________________
111 69 54 50
h ____________________________|__________________|_____________|__________
180 54 50
i _______________________________________________|_____________|__________
78 63 93 50
j ____________________|_______________|________________________|__________
78 156 50
k ____________________|________________________________________|_________
234 50
l _____________________________________________________________|_________
111 69 104
m ____________________________|__________________|______________________
180 104
n _______________________________________________|______________________
284
o ______________________________________________________________________
111 30 39 51 50
p ____________________________|_______|__________|_\/__________|___________
141 90 50
q ____________________________________|____________\/__________|__________
111 30 90 50
r ____________________________|_______|____________\/__________|___________
141 93 50
s ____________________________________|________________________|_________
141 143
t ____________________________________|__________________________________
111 123 50
u ____________________________|________________________________|_________
78 102 54 50
v ____________________|__________________________|_____________|__________
78 33 69 54 50
w ____________________|_______|__________________|_____________|__________
78 33 69 104
x ____________________|_______|__________________|________________________
78 63 39 54 50
y ____________________|_________________|________|_____________|___________
Рисунок 4 – Карта сайтов рестрикции фрагмента экзона 2 гена BoLA-DRB3
Рестрикционные фрагменты разделяли с помощью электрофореза в 12% полиакриламидном геле. На гель наносили весь объем рестрикционной смеси. Для оценки длины фрагментов использовали маркер молекулярных весов GenPak DNA Marker M50 ООО «Изоген».
Таблица 6 – Приготовление ПААГ 12%
|
Н2О |
ТАЕ |
ПАА (30%) |
ТЕМЕД |
Персульфат аммония |
|
9400 мкл |
600 мкл |
7500 мкл |
100 мкл |
500 мкл |
На основе паттернов рестрикции, выявили аллельные варианты гена BoLA-DRB3.
Таблица 7 – Аллели гена BoLA-DRB3
|
ПЦР – ПДРФ аллели BoLA DRB 3 |
Название ДНК - паттернов |
|||
|
Rsa I |
BstX2 I |
Hae III |
Bst2U I* |
|
|
1 |
a |
a |
a |
f |
|
2 |
b |
b |
a |
c |
|
3 |
b |
b |
b |
f |
|
4 |
c |
a |
a |
|
|
5 |
r |
c |
c |
f |
|
6 |
d |
a |
a |
d |
|
7 |
e |
c |
c |
a |
|
8 |
f |
a |
a |
b |
|
9 |
f |
d |
a |
c |
|
10 |
f |
b |
a |
f |
|
11 |
g |
e |
a |
f |
|
12 |
h |
a |
a |
b, f |
Продолжение таблицы 7
|
ПЦР – ПДРФ аллели BoLA DRB 3 |
Название ДНК - паттернов |
|||
|
Rsa I |
BstX2 I |
Hae III |
Bst2U I* |
|
|
13 |
h |
b |
a |
g |
|
14 |
h |
b |
b |
|
|
15 |
i |
b |
a |
b |
|
16 |
j |
b |
d |
f |
|
17 |
k |
b |
b |
|
|
18 |
l |
b |
f |
b |
|
19 |
s |
b |
b |
|
|
20 |
l |
b |
b |
|
|
21 |
l |
b |
e |
f |
|
22 |
m |
b |
a |
d |
|
23 |
n |
b |
a |
f |
|
24 |
n |
b |
b |
f |
|
25 |
o |
a |
a |
|
|
26 |
o |
a |
b |
b |
|
27 |
o |
b |
f |
d |
|
28 |
o |
b |
b |
f |
|
29 |
p |
c |
c |
|
|
30 |
q |
c |
c |
|
|
31 |
i |
b |
f |
|
|
32 |
m |
a |
a |
|
|
33 |
n |
b |
f |
|
|
34 |
l |
a |
b |
|
|
35 |
c |
b |
b |
|
|
36 |
l |
b |
a |
|
|
37 |
o |
b |
a |
Продолжение таблицы 7
|
ПЦР – ПДРФ аллели BoLA DRB 3 |
Название ДНК - паттернов |
|||
|
Rsa I |
BstX2 I |
Hae III |
Bst2U I* |
|
|
38 |
b |
d |
a |
|
|
39 |
t |
b |
a |
|
|
40 |
u |
b |
a |
|
|
41 |
a |
b |
a |
|
|
42 |
h |
b |
f |
|
|
43 |
k |
b |
f |
|
|
44 |
k |
b |
i |
|
|
45 |
s |
d |
b |
f |
|
46 |
v |
b |
a |
|
|
47 |
w |
a |
a |
|
|
48 |
w |
b |
a |
|
|
49 |
w |
b |
e |
|
|
50 |
x |
b |
a |
|
|
51 |
g |
a |
a |
|
|
52 |
s |
d |
a |
|
|
53 |
y |
b |
a |
|
|
54 |
j |
d |
b |
Аллельные варианты гена BoLA-DRB3 представлены на таблице 7.
2.4 Электрофорез
Молекулярный вес продуктов ПЦР и их фрагментов, полученных после рестрикции, определяли с помощью электрофореза в агарозном (1,5 - 2,5 процентном) геле, с использованием трис-боратного буфера (54 г трис; 27,5 г борная кислота; 2 мл 0,5 M ЭДТА, рН 8,0 доводят дистиллированной водой до 1 литра) (Б. Уильямс, К. Уилсон, 1978) и полиакриламидном геле (6 – 12%) (С.Херрингтон и др., 1999).
Образцы ДНК смешивали с буфером для нанесения проб, содержащим (50 % глицерина, 50 % 1 Х ТВЕ буфера и 0,025 % бромфенолового синего). Пробы вносили в лунки геля под электрофорезный буфер. Электрофорез обычно вели при постоянном напряжении 100 V (А. В. Мазин, А. С. Краев, В. А. Потапов, 1990).
Гели окрашивали в растворе этидиум бромида (1 мкг/мл) и просматривали в ультрафиолетовых лучах, при этом краситель, интеркалирующий в молекулу, испускал излучение в красно-оранжевой области видимого спектра (590 нм). После просмотра гели фото-графировали в ультрафиолетовых лучах.
2.5 Статистическая обработка данных
Статистическая обработка результатов производилась как по стандартным методикам Н.А. Плохинского и Т.Ф. Лакина, так и с использованием программных возможностей Microsoft Exel.
Первичная обработка данных производилась в программе на основе шаблона Microsoft Exel (BoLA – статистика), разработанной лабораторией биотехнологии СКНИИЖ. Программа требует внесения данных по генотипам быков и коров и автоматически определяет частоты встречаемости генотипов (в абсолютных и относительных значениях), аллелей (по группам и разновидностям), позволяет сортировать животных по генотипам и определять достоверность числовых различий с использованием критерия Стьюдента.
3 Изучение биоразнообразия популяции крупного рогатого скота с использованием генотипирования по полиморфным локусам
3.1 Характеристика частот встречаемости аллелей BoLA-DRB3
Полиморфность аллеля BoLA-DRB3 эволюционно возникла в связи с необходимостью вариабельного строения клеточного рецептора по отношению чужеродным белковым антигенам и в связи с этим имеет географическую и внутрипородную изменчивость. Так если рассмотреть средние показатели выборки быков производителей КРС всех пород, включая редкие и зебувидный скот, то в таком случае полиморфизм выражен максимально.
В выборке из 100 быков принадлежащих к голштинской черно-пестрой породе, из 54 ПДРФ анализируемых нами типов найдено 29, из них 17 - менее одного процента, и четыре менее пяти процентов. Лидируют по частоте встречаемости аллели: BoLA DRB3* 16,* 22, *24, принадлежащие к группе чувствительных.
Таблица 8 – Частота встречаемости аллеля BoLA-DRB3 в группе быков – производителей, в процентах
|
BoLA-DRB3 |
Частота встречаемости аллеля BoLA-DRB3 в группе быков – производителей, в процентах |
|
|
Голшт. ч\п (n=100) |
||
|
1 |
Н |
|
|
2 |
Н |
|
|
3 |
Н |
9,61 |
|
4 |
Н |
- |
|
5 |
Н |
- |
|
6 |
Н |
|
|
7 |
Н |
2,84 |
|
8 |
Ч |
8,19 |
|
9 |
Н |
|
|
10 |
Н |
1,97 |
|
11 |
У |
6,11 |
Продолжение таблицы 8
|
BoLA-DRB3 |
Частота встречаемости аллеля BoLA-DRB3 в группе быков – производителей, в процентах |
|
|
Голшт. ч\п (n=100) |
||
|
12 |
Н |
|
|
13 |
Н |
|
|
14 |
Н |
|
|
15 |
Н |
|
|
16 |
Ч |
14,41 |
|
17 |
Н |
- |
|
18 |
Н |
|
|
19 |
Н |
- |
|
20 |
Н |
- |
|
21 |
Н |
|
|
22 |
Ч |
19,43 |
|
23 |
У |
6,44 |
|
24 |
Ч |
19,65 |
|
25 |
Н |
|
|
26 |
Н |
1,09 |
|
27 |
Н |
5,68 |
|
28 |
У |
1,09 |
|
29 |
Н |
- |
Примечание – здесь и далее * рядом со значениями частот - p<0.05; ** - p<0.01; ***- p<0.001.
Если рассматривать генетические профили по группам аллелей. то у голштинов черно - пестрой масти среднее положение занимают нейтральные аллели.
Таблица 9 – Частота встречаемости групп аллелей BoLA-DRB3 у быков – производителей, в процентах
|
BoLA-DRB3 |
Частота встречаемости групп аллелей |
|
Голшт. ч\п (n=100) |
|
|
Н |
24,68 |
|
Ч |
61,68 |
|
У |
13,64 |
Наибольшее количество аллелей – 61,68 % приходится на группу чувствительных, а минимальное на группу устойчивых аллелей - 13,64 %.
3.2 Волнообразное изменение частот встречаемости аллелей BoLA-DRB3 у быков производителей в течение времени
Выборка быков - производителей голштинской породы черно - пестрой масти включала 100 животных, рожденных в течение 23 лет в период с 1986 по 2009 год и оцененных как улучшатели. Для последующей математической обработки генотипы быков по дате рождения были сгруппированы с шагом в 4 года, что отражает естественный репродуктивный цикл крупного рогатого скота. В итоге, весь изучаемый период был разделен на шесть временных промежутков, в которых частота встречаемости различных аллелей варьировала от 0 до 30 процентов.
Рисунок 4 – Частоты встречаемости Bola DRB3 аллелей в популяции в период с 1986 по 2009 гг.
На рисунке 4 представлены суммарные данные по динамике изменения частот встречаемости Bola DRB3 аллелей в популяции в период с 1986 по 2009 гг. Как видно из рисунка, большая часть аллелей (например, BoLA DRB3*6, *25, *14 и др. имеют частоту встречаемости от 0 до 5 %). Остальные аллели изменяют частоту встречаемости во времени, при чем, разброс показателей носит не случайный характер, что подтверждается критерием Фишера для аллелей Bola DRB3 *9, *16,* 21,* 22, *23, *24 и *27 (уровень значимости 0,1 %). Диаграммы частот встречаемости таких аллелей вынесены на отдельный график для более подробного рассмотрения. Их частоты встречаемости имеют признаки антагонистической зависимости, что выражается в противофазах амплитуд графиков зависимости частот встречаемости от временного отрезка, в который попадают даты рождения быков.
Рисунок 5 – Частоты встречаемости Bola DRB3 аллелей в популяции в период с 1986 по 2009 гг.
На рисунке 5 видно, что в разные временные периоды высокую оценку получли быки-носители разных аллелей. Так для аллеля Bola DRB3 *8 пиковое значение частоты встречаемости достигнуто в период с 1986 по 1989 год, далее оно резко снижается. Аналогичная картина имеет место для аллеля Bola DRB3 *11 и некоторых других. Для аллеля Bola DRB3 *16 наблюдается иная картина – постоянное нарастание частоты встречаемости до максимума в период с 1994 по1997 год с дальнейшим снижением на протяжении двух четырехлетних цилов.
Наблюдаемый нами эффект, описывается в литературе как инбредная депрессия. Вследствие жесткого отбора по конкретным хозяйственно полезным признакам генофонд популяции становится однообразным, примерно так же как при близкородственном скрещивании, что негативно сказывается на различных показателях жизнедеятельности. Если при этом оцениваемый бык несет отличные генетические детерминанты, то его потомство оказывается более жизнеспособным и продуктивным, а сам бык – производитель оценивается как улучшатель.
Наибольший интерес представляют случаи периодических волнообразных смен частот встречаемости аллелей, относящихся к группе чувствительных (Ч-аллелей). Подобные случаи вынесены отдельно на рисунок 6.
Рисунок 6 – Частоты встречаемости Bola DRB3 аллелей в популяции в период с 1986 по 2009 гг.
Так в период с 1994 по 1997 год оценивались как улучшатели быки, носители Bola DRB3 *16 аллеля, однако спустя восемь лет, носители *16 аллеля Bola DRB3 перешли в категорию ухудшателей. В тоже время носители Bola DRB3 *24 аллеля в период с 1994 по 1997 год оценивались как ухудшатели, а в 1998-2001 - стали улучшателями.
Таким образом, определенная часть аллелей с течением времени волнообразно изменяет свою частоту встречаемости, однако, это явление наблюдается не для всех аллелей. Некоторые аллели за промежуток времени равный двадцати четырем годам или шести генеративным циклам существенно изменили частоту встречаемости в рамках голштинской черно – пестрой породы.
У этой группы животных снизилась частота встречаемости аллелей *22 (с 19 до 13 %),*8 (с 15 до семи %),*11 (с 11 до четырех %). При этом выросла концентрация аллелей: *16 (с 11 до 18 %), *24 (17.22 до 22,58 %), *28 (с 0 до 3,6 %).
До 2005 года из 29 аллелей отсутствовало 8 аллелей, а после - отсутствует 17 аллелей. Полностью исчезли такие аллели как: *2, *6, *9, *13, *14, *18, *21, *25. (логическая связка). Все они принадлежат к группе нейтральных аллелей, и искусственный отбор не оказывает на них давления. При этом появился новый для голштинов аллель *28, относящийся к группе устойчивых.
Явной закономерностью в изменении генетических профилей для данной породы, является значительное повышение частоты встречаемости аллеля BoLA DRB3 *24.
Таким образом, изучение генетической структуры пород по локусу BoLA-DRB3 позволило установить, что в популяциях крупного рогатого скота интенсивно идут процессы снижения генетического разнообразия. Следствием чего является появление инбредной депрессии, что возможно проявляется в стадах чистопородных животных Краснодарского края в виде низкого выхода телят, высокого уровня поражения скота лейкозом, слабого иммунитета.
ЗАКЛЮЧЕНИЕ
По результатам исследования были сделаны следующие выводы:
1. В выборке из 100 быков принадлежащих к голштинской черно-пестрой породе, из 54 ПДРФ анализируемых нами типов найдено 29, 17 из них в количестве менее одного процента и еще четыре аллеля - менее пяти процентов.
2. Изучение генетической структуры пород по локусу BoLA-DRB3 позволило установить, что в популяциях крупного рогатого скота интенсивно идут процессы снижения генетического разнообразия. Следствием чего является появление инбредной депрессии, что возможно проявляется в стадах чистопородных животных Краснодарского края в виде низкого выхода телят, высокого уровня поражения скота лейкозом, слабого иммунитета.
3. Установлено, что частота встречаемости того или иного аллеля достигает некоторого пикового значения, а потом начинает резко снижаться. Вероятно, это связано с эффектом «насыщения», когда несмотря на явную селекционную предпочтительность того или иного аллеля (например, *24 - у голштинов), эффект его присутствия нивелируется у дочерей высоким уровнем гомозиготности (появляется много гомозиготных животных), что негативно влияет на ряд показателей и приводит к снижению частоты встречаемости этого аллеля в следующем поколении.
БИБЛИОГРАФИЧСЕКИЙ СПИСОК
1. Алтухов, Ю.П. Генетические процессы в популяциях / ИКЦ «Академкнига». М. 2003. 431 с.
2. Бойко, Е.Г. Перспективы использования геномного анализа при разведении и селекции крупного рогатого скота // Аграрный вестник Урала. 2009. №10(64) С.33–34.
3. Биология индивидуального развития (генетический аспект) / Л.И. Корочкин // M. Издательство МГУ. 2002. 264 с.
4. Всемирный генный банк необходим для выживания / АгроХХI. Agroxxi.ru. 2014. Режим доступа: http://www.agroxxi.ru/zhurnal-agroxxi/fakty-mnenija-kommentarii/vsemirnyi-gennyi-bank-neobhodim-dlja-vyzhivanija.html. (Дата обращения: 01.09.2014).
5. Генджиева О.Б., Сулимова Г.Е. Анализ взаимоотношений между породами крупного рогатого скота турано-монгольской группы на основе ДНК-п //Актуальные вопросы ветеринарной биологии. 2012. №2(14) С.14–16
6. Дымань Т.Н., Глазко В.И. Полиморфизм гена каппаказеина, его связь с хозяйственно-полезными признаками крупного рогатого // Цитолология и генетика. 1997. №4 c.114–118
7. Доктрина продовольственной безопасности РФ-2010. / kremlin.ru. 2014. Режим доступа: http://graph.document.kremlin.ru/page.aspx?1049708. (Дата обращения: 01.09.2014).
8. Динамика популяционных генофондов при антропогенных воздействиях / Ю.П.Алтухов [и др.] // М. Наука. 2004. 618 с.
9. Зоотехния и ветеринария / Г. В. Родионов. [и др.]. М.: Лань. 640 с.
10. История и методология зоотехнической науки: Учебное пособие / Л.В. Куликов. М: РУДН, 2000. 167 c.
11. Изменчивость гена BoLA-DRB3 у крупного рогатого скота молочного направления продуктивности и его влияние на параметры жизнеспособности / Н.В. Ковалюк, В.Ф. Сацук, А.Е. Волченко // Генетика. 2012. T.48. № 8. С. 962–965.
12. Конвенция о биологическом разнообразии. un.org. 2014. Режим доступа: http://www.un.org/ru/documents/decl_conv/conventions/biodiv.shtml (Дата обращения: 01.09.2014).
13. Лебедева, Н.В., Дроздов Н.Н., Криволуцкий Д.А. Биологическое раз-нообразие // Учеб. пособие для студ. высш. учеб. заведений. М. Гуманит. изд. центр ВЛАДОС. 2004. 432 с.
14. Молекулярная биология клетки / Б. Альбертс [и др.] // М. Мир, 1987. 196 с.
15. Научные проблемы селекции сельскохозяйственных животных. / vm-kuznetsov.ru Режим доступа: http://www.vm-kuznetsov.ru/files/etude/02_nauchnye_problemy_selekcii.pdf (Дата обращения: 01.09.2014)
16. Отчетный доклад Президиума РАН: Научные достижения Российской академии наук в 2008 году. М., 2009. 357 c
17. Применение метода ISSR-PCR для оценки популяционной структуры идентификации и сходства генофондов пород и видов доместицированных животных / Ю.А. Столповский [и др.] // Генетика. 2010. №6. с.1–9.
18. Полиморфизм гена BoLA-DRB3 у крупного рогатого скота монголь-ской, калмыцкой и якутской пород / М.Н. Рузина [и др.] // Генетика. 2010. №4. С.517–525.
19. Петров Р.В. Иммунология // М. Медицина, 1982. 368 с.
20. Полиморфизм генов BoLa-DRB3, пролактина и гормона роста у крупного рогатого скота в связи с устойчивостью к лейкозу и молочной продуктивностью / С.О. Туркова // Автореф. дис. канд. биол. наук: М. 2003. 21. Продовольственная и сельскохозяйственная организация Объединенных наций. Fao.org. / Режим доступа: www.fao.org. (Дата обращения: 01.09.2014).
21. Рузина, М. Н. Анализ полиморфизма гена BoLA-DRB3 в связи с ге-нетической устойчивостью крупного рогатого скота к лейкозу и вирусоноси-тельством // Дис… канд. биол. наук / М. 2012.141 c.
22. Столповский, Ю. А. Популяционно-генетические основы сохранения ресурсов генофондов доместицированных видов животных. дис. … доктора биологических наук: 03.02.07: Ин-т общ.генетики им. Н.И. Вавилова РАН. Москва, 2010. 339 с. ил. РГБ ОД, 71 11-3/96
23. Состояние “культурного” биоразнообразия (сельскохозяйственные животные) / Ю.А. Столповский, Г.Е. Сулимова // Ветеринарная патология.2007. №1. С.30–32.
24. Уникальность костромской породы крупного рогатого скота с позиции молекулярной генетики / Г.Е. Сулимова [и др.] // Достижения науки и тех-ники АПК. 2011. №9. С.52-54.
25. Черекаев, А.В. О племенной работе в животноводстве // Зоотехния. 1997. №5. С.2–6
26. Ярилин, А.А. Иммунология // М.: Медицина, 1999. 608 с.
27. Analysis and frequency of Bovine Lymphocyte Antigen (BoLA-DRB3) alleles in Iranian Holstein Cattle / M.R. Nassiry // Russian Journal of Genetics. 2005. Vol.41. №6. P.664–668.
28. Analysis of Relationship between Bovine Lymphocyte Antigen DRB3.2 Alleles, Somatic Cell Count and milk Traits in Iranian Holstein Population / M. Pashmi [et. al.] //Journal of Animal Breeding and Genetics. 2009. V.126. P.296–303
29. Association of major histocompatibility complex antigens (BOLA-A) with AI bull progeny test results for mastitis, ketosis and fertility in Norwegian Cattle / C.M. Mejdel [et. al.] // Animal Genetics. 1994. V.25. P.99–104.].
30. A single amino acid deletion in the antigen binding site of BoLA-DRB3 is predicted to affect peptide binding / K. Sitte [et. al.] // Veterinary Immunology and Immunopathology. 2002. V.85. P.129–135.
31. Familial imprinting determines H-2 selective mating preferences / K.Yamazaki [et. al]. // Science. 1988. №240. P.1331–1332.
32. Genes controlling vaccine responses and disease resistance to respiratory viral pathogens in cattl. / J. Elizabeth // Veterinary Immunology and Immunopathology. 2012. Vol.148. P.90–99.
33. High Genetic Susceptibility to Leukemia in Breeding Black Pied and Holstein Cattle / I.Y.Nam [et. al.] // Middle-East Journal of Scientific Research. 2014. №20 (10). P.1297–1301.
34. Identification of new cattle BoLA-DRB3 alleles by se-quence-based typing // Shinnosuke Takeshima [et. al] // Immunogenetics. 2001. V.53. P.74–81
35. Polymorphism of the BoLA-DRB3 gene in the Mongolian, Kalmyk, and Yakut cattle breeds / M. N. Ruzina [et. al.] // Russian Journal of Genetics.–2010.–V.46.–P.456-463
36. Polymorphism in BoLA-DRB3 exon 2 correlates with resistance to persistent lymphocytosis caused by bovine leukemia virus. / A. Xu [et. al.] // The Journal of Immunology. 1993. Vol151. P.6977–6985.
37. Polymorphism and disease resistance possessions of MHC Class II BoLA genes / R.K.Vandre [et. al.] // DHR International Journal Of Biomedical and Life Sciences (DHR-IJBLS). 2014. Vol.5(2). P.2278–8301.
38. Polymorphism of exon 2 of BoLA-DRB3 gene and its relationship with somatic cell score in Beijing Holstein cows / M.X. Chu [et.al.] // Molecular Biology Reports.–2012.–V.39.–P.2909-2914
39. Sequence and PCR-RFLP analysis of 14 novel BoLA-DRB3 alleles / A. Gelhaus [et.al.] // Animal Genetics. 1995. Vol.26. P.147–153.
40. The Red Queen Principle / vub.ac.be. 2014 Режим доступа: http://pespmc1.vub.ac.be/REDQUEEN.html. (Дата обращения: 01.09.2014)
41. The use of binding-prediction models to identify M. bovis-specific antigenic peptides for screening assays in bovine tuberculosis / G.J. Jones [et. al.] // Veteri-nary Immunology and Immunopathology. 2011. Vol.141. P.239–245.
42. Usha, A. P. Probability of random sire exclusion using microsatellite markers for parentage verification / A. P. Usha, S. P. Simpson, J. L. Williams // Article first published online.–2009.–DOI: 10.1111/j.1365-2052.1995.tb03155.x
ч
\
п голштины оценённые
0
0,05
0,1
0,15
0,2
0,25
0,3
1986-1989
1990-1993
1994-1997
1998-2001
2002-2005
2006-2009
временные отрезки
1
2
3
6
7
9
10
11
12
14
15
16
18
21
22
23
24
25
26
27
28
ч
\
п голштины оценённые аллели антогонисты
0
0,05
0,1
0,15
0,2
0,25
0,3
1986-1989
1990-1993 n
1994-1997
1998-2001
2002-2005
2006-2009
временные отрезки
частота встречаемости
8
11
16
22
23
24
27
ч
\
п голштины оценённые ч аллели
0
0,05
0,1
0,15
0,2
0,25
0,3
1986-1989
1990-1993
1994-1997
1998-2001
2002-2005
2006-2009
временные отрезки
частота встречаемости
8
16
22
24
ИЗУЧЕНИЕ БИОРАЗНООБРАЗИЯ ПОПУЛЯЦИИ КРУПНОГО РОГАТОГО СКОТА С ИСПОЛЬЗОВАНИЕМ ГЕНОТИПИРОВАНИЯ ПО ПОЛИМОРФНЫМ ЛОКУСАМ