ДИНАМИКА РАЗВИТИЯ ЗООПЛАНКТОНА В НОВОРОССИЙСКОЙ БУХТЕ
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
(ФГБОУ ВПО «КубГУ»)
Кафедра водных биоресурсов и аквакультуры
ДОПУСТИТЬ К ЗАЩИТЕ В ГЭК
Заведующий кафедрой –
канд. биол. наук,
__________________ Пашков А. Н.
«__»____________________ 2015 г.
ВЫПУСКНАЯ КВАЛИФИКАЦИОННАЯ РАБОТА БАКАЛАВРА ДИНАМИКА РАЗВИТИЯ ЗООПЛАНКТОНА В НОВОРОССИЙСКОЙ БУХТЕ
Работу выполнила ____________________________________ А. С. Прохорцева
(подпись, дата)
Факультет биологический
Направление 35.03.08 Водные биоресурсы и аквакультура
Научный руководитель,
канд. биол. наук, доцент _________________________________ Н. Г. Пашинова
(подпись, дата)
Нормоконтролер, ст. преподаватель _______________________ С. Н. Комарова
(подпись, дата)
Краснодар 2015
РЕФЕРАТ
Выпускная квалификационная работа бакалавра 46 с., 4 табл., 7 рис.,
45 источников.
ЗООПЛАНКТОН, ДИНАМИКА РАЗВИТИЯ ЗООПЛАНКТОНА, ПОКАЗАТЕЛИ ЧИСЛЕННОСТИ И БИОМАССА, ВИДОВОЙ СОСТАВ, НОВОРОССИЙСКАЯ БУХТА
Выпускная квалификационная работа посвящена исследованию показателей численности и биомассы зоопланктона в разных участках Новороссийской бухты, выявлению их динамики. Так же был определен видовой состав и его процентное соотношение в общем числе отобранных проб из разных точек Новороссийской бухты.
Исследования проводились на базе Новороссийского учебного и научно-исследовательского морского биологического центра (НУНИМБЦ) города Новороссийска.
Цель работы – изучить динамику развития зоопланктона в Новороссийской бухте.
Актуальность работы заключается в том, что пополнение данных о динамике развития зоопланктона позволяет делать выводы об экологическом состоянии некоторых участков Новороссийской бухты, а так же дает представление об обеспеченности основных промысловых видов рыб пищевыми ресурсами, что в свою очередь имеет значение при расчете общих допустимых уловов (ОДУ).
СОДЕРЖАНИЕ
Введение……………………………………………………………………………..4
1 Аналитический обзор……………………………………………………………..6
- Исторический обзор исследований зоопланктона Новороссийской
бухты…………………………………………………………………………………6
1.2 Биологическая характеристика исследуемых видов……………………….13
2 Характеристика Новороссийской бухты………………………………………..20
3 Материал и методы исследований……………………………………………...27
4 Динамика развития зоопланктона в Новороссийской бухте………………….32
4.1 Видовой состав зоопланктона………………………………………………32
4.2 Численность зоопланктона………………………………………………….34
4.3 Биомасса зоопланктона……………………………………………………...37
4.4 Динамика развития зоопланктона…………………………………………..38
Заключение…………………………………………………………………………40
Библиографический список……………………………………………………….42
ВВЕДЕНИЕ
Новороссийская бухта – наиболее крупная бухта Северо-Восточной части Черного моря. Вместе с прилегающей к ней открытой акваторией она долгие годы являлась одним из важных рыбопромысловых и нерестовых районов Российского сектора Черного моря. Особенности географического положения, большие глубины и площадь, достаточный водообмен с открытым морем, хорошая кормовая база – все эти факторы способствовали массовым заходам в бухту различных видов рыб для размножения и нагула [Селифонова, 2001].
Однако в последние годы Новороссийская бухта практически утратила свое значение как ценной промысловой и нагульной акватории. Это связано в первую очередь с ее химическим загрязнением и возросшей антропогенной нагрузкой. Многолетние исследования вод бухты свидетельствуют, что ее экосистема длительное время подвергается антропогенному воздействию высокой интенсивности, вызванному, прежде всего, функционированием портов, судоходством и попаданием в акваторию недостаточно очищенных стоков [Селифонова, 2001].
Под воздействием загрязнителей в бухте произошли изменения экосистемы, которая характеризуется сокращением числа видов во всех трофических группах. Подобные изменения затронули все основные компоненты экосистемы бухты, в том числе основу кормовой базы рыб – зоопланктон.
Наблюдение за изменением видового состава зоопланктона, его численности и биомассы дает возможность разрабатывать необходимые меры по сохранение и увеличению зоопланктона в Новороссийской бухте, а так же позволяет дать более полную оценку состоянию кормовой базы промысловых видов рыб и выделить наиболее продуктивные зоны бухты.
Цель работы – изучить динамику развития зоопланктона в Новороссийской бухте.
В ходе выполнения работы, для решения поставленной цели, были поставлены следующие задачи:
1. Рассмотреть литературные данные по теме исследования;
2. Рассчитать динамику численности зоопланктона в разных участках Новороссийской бухты;
3. Рассчитать динамику биомассы зоопланктона в разных участках Новороссийской бухты;
4. Проследить за динамикой зоопланктона в разных участках Новороссийской бухты.
Сведения о видовом составе имеют значение для характеристики экологического состояния водоема. Полученные данные могут быть использованы в гидробиологическом мониторинге состояния водной акватории Новороссийской бухты, а так же использоваться при расчете общих допустимых уловов (ОДУ).
1 Аналитический обзор
Литературная часть данной работы дает по возможности полное обобщение и анализ разрозненных литературных источников по изучению состояния зоопланктона в Новороссийской бухте. Многие литературные данные посвящены структуре пищевых сетей, передаче и использованию вещества и энергии в планктонных сообществах.
1.1 Исторический обзор исследований зоопланктона Новороссийской бухты
Наиболее ранними исследованиями Г. Г. Винберга [1934, 1936], В. И. Ивлева [1937], В. А. Водяницкого [1954], Ю. И. Сорокина [1972, 1982, 1996], М. Е. Виноградова, Э. А. Шушкиной, В. В. Сапожникова [1992] было показано, что в основе всех превращений органического вещества в водоеме (будь то создание его биологической продуктивности или формирования качества воды), лежат пищевые взаимоотношения населяющих его организмов или так называемые пищевые цепи. Для описания реальных трофических цепей и сетей в морских сообществах с оценкой количества передаваемой по ним энергии осуществлен большой комплекс работ по всестороннему исследованию процессов развития зоопланктона.
Результаты многочисленных экспериментов по оценке роли различной пищи для жизнедеятельности Сорероdа sp. показали, что большинство мелких и крупных видов могут потреблять, усваивать и использовать для роста и размножения бактерий, мелкие и крупные одиночные и колониальные, округлые и вытянутые (без слишком грубых выростов – рогов) диатомовые, перидиниевые, синезеленые водоросли, различных «голых» жгутиковых, инфузорий, мелких ракообразных, их яйца и др. более крупных животных. Оптимальные размеры пищевых объектов у мелких Сорероdа sp. составляют 10–35 мкм, у крупных – 30–300 мкм. К настоящему времени известно, что для тонких фильтраторов, как пенилия и ойкоплевра, оптимальная концентрация пищи лежит в пределах 0,7–1,5 г/м3, тогда как для хватателей, как акарция, она значительно выше – 3–5 г/м3. В естественных условиях обитания животные могут находить подобные концентрации пищи лишь в слоях аккумуляции микропланктона. При этом пищевые потребности копепод удовлетворяются лишь за счет потребления смешанного корма, благодаря их способности к эврифагии [Петипа, 1970].
Разработка основ питания неразрывно связана с экспериментальными методами изучения питания и развития зоопланктона [Сорокин, 1966].
Суточные рационы тонких фильтраторов (велигеры, аппендикулярии, кладоцеры) при питании микроорганизмами составляют 50–100 % веса тела при суточных затратах на обмен 15–20 % веса их тела. Простейшие, например инфузории, тоже важное промежуточное трофическое звено. Значение инфузорий как корма для многих копепод, более высоко, чем бактериальной пищи (до 45 % всего количества потребленной пищи) [Павловская, 1971].
На преобладание детрита в рационе планктонных фильтраторов и его влияния на развитие зоопланктона указывали многие авторы [Павлютин, 1976, 1987; Печень-Финенко, 1987]. Самки Calanus helgolandicus хорошо использовали свежий детрит. При концентрации 600–870 мкг С/л калянусы на этой пище имели такие же скорости фильтрации (10–60 мл/экз. сут.), как и при потреблении живых водорослей. Кроме того, детрит преобладающий компонент кишечников так называемых преимущественных детритофагов: синхет, плеописов, личинок балянусов и полихет [Зайцев, 1987]. Особый интерес представляет сапрофаг – Noctiluca miliaris. В ее рационе детрит разного размера составляет 70–90 %. Суточный рацион низок – 3–5 % сырого веса тела [Миронов, 1954].
Уже давно внимание исследователей привлекло функционирование морских планктонных сообществ в целом и в первую очередь анализ трофических взаимоотношений, которые играют главную роль в создании биологической продуктивности водоемов и формирования качества воды в условиях все возрастающего антропогенного загрязнения. В частности, в монографии Ю. И. Сорокина [1982] указывается, что большая часть потока энергии в пелагиали Черного моря идет через «детритную» пищевую цепь, т.е. через стадию мертвого органического вещества – детрита и растворенной органики. По его расчетам через «детритную» пищевую цепь используется около 80 % энергии первичных продуцентов. Годовой баланс первичной продукции и суммарной деструкции в такой экосистеме отрицательный.
В прибрежных районах моря развиваются виды, выносливые к некоторому загрязнению (Pleopis polyphemoides, личинки полихет, усоногих раков и коловратки) [Коваль, 1984; Селифонова, 1997]. Характерные в прошлом для всей неритической акватории Черного моря, ветвистоусые: Pleopis tergestina, Evadne spinifera, а также гипонейстонные копеподы сем. Pontellidae встречаются в настоящее время эпизодически. Такая же участь постигла Paracartia latisetosa. На грани исчезновения находятся: Centropages kroyeri, Paracalanus parvus. Одновременно в неритической зоне в планктоне наблюдается массовое развитие сапрофага и детритофага ночесветки Noctiluca miliaris. Массовое развитие детритоядной ночесветки, среднемноголетняя биомасса которой к началу 1980-х годов увеличилась в 15 раз позволяет считать этот организм санитаром загрязненных вод, участвующим в их очищении [Зайцев, 1987]. В районах, подверженных речному стоку возрос удельный вес коловраток, среди которых доминирует Synchaeta sp. Положительное отношение к условиям эвтрофирования отмечено и у мелкоразмерных форм ракообразных: плеописов и акарции. Существенное влияние на прибрежные экосистемы моря оказывает поступление различных бытовых, промышленных и нефтяных стоков крупных городов [Петипа, 1975]. Их токсическое действие на гидробионтов снижает самоочистительную способность прибрежных экосистем и тем самым усугубляет эффект эвтрофирования [Туманцова, 1985].
Наибольший вклад в исследования динамики зоопланктона внесла
Ж. П. Селифонова [2001, 2011]. По ее данным, из копепод основными видами являлись и остаются Acartia clausi, A.tonsa, Centropages kroea pontica, Calanus euxinus, Paracalanus parvus, Oithona similes. По данным Новороссийского биологического центра, A. tonsa новый вид, и был впервые зафиксирован в пробах взятых в шельфовой зоне, между мысом Мысхако и Анапой в 2001 г., а непосредственно в Новороссийской бухте в 2002 г. До 1994 г. из-за морфологического сходства и близких размеров этот вид не отличали от Acartia clausi. В 1994 г. впервые он был обнаружен в Севастопольской бухте.
В отличие от Acartia clausi – одного из наиболее многочисленного круглогодичного вида, A. tonsa, по мнению некоторых авторов, относится к стенотермным, теплолюбивым формам, появляется при температуре воды от 15 до 16 С и отсутствует в холодный период года. При обработке проб зоопланктона возникала некоторая трудность при определении видовой принадлежности акарции, имеющих морфологическое сходство и близкие размеры. Одной из отличительных признаков является разная длина и форма абдоменов. В районе Новороссийска эти отличия четко не проявлялись.
Paracalanus parvus – этот вид встречается повсеместно круглый год в поверхностных и зоопланктонных пробах, на протяжении моголетних изучений (1989–2003 гг.) видового состава зоопланктона. Он устойчив к различным загрязнением, например, был отмечен летом 2003 года в районе «Морского порта», где пресная вода реки Цемес впадает в бухту, неся с собой загрязнения промышленного характера, также в средней и открытой части Новороссийской бухты.
Centropages kroea pontica – представитель летних копепод в основном встречается в более глубоких слоях, в вертикальных обловах отсутствовал, но единичные экземпляры встречались в поверхностных ихтиопланктонных пробах.
Calanus euxinus – холодолюбивый вид, присутствует в осенних и весенних пробах, когда температура поверхностной воды не прогревается выше 10 С. Весной, в мае из глубин поднимается в поверхностные слои, где происходит нерест. А в сентябре появляются копеподиты IV и V стадий.
В слое гипонейстона отмечались только копеподиты и науплиусы у видов Calanus euxinus и Pseudocalanus elongates, которые заносятся из открытого моря и служат показателем поступления в бухту глубинных, охлажденных вод.
В ноябре 2003 года Новороссийской бухте был найден новый вид для Черного моря Oithona brevicosris. Первые сведения даны Ю. А. Загородней [2002 г.], которая нашла этот вид в Севастопольской бухте в декабре 2001 года, численностью 18 экз./м3. По данным автора, количество этого рачка в районе порта достигало 119 экз./м3, встречались c конца октября по ноябрь. По внешнему виду они были похоже на Oithona similis, но у некоторых экземплярах отчетливо наблюдалась разница в ширине цефалотарокса, отличие в морфологических особенностях абдомена. В основном присутствовали в пробах самки (некоторые с яйцевыми мешками), самцы были единичны. Наряду с ним в Новороссийской бухте найдены и другие новые виды: Oithona similis – относиться к холодолюбивому комплексу и является самым многочисленным видом из этого рода. Как отмечала
Ж. П. Селифонова в 1994–1995 гг. из состава зоопланктона выпал ранее массовый вид мелких ракообразных Oithona minuta [Селифонова, 2001].
Harpacticoidae sp. – приспособленные организмы, достаточно хорошо переносят антропогенное воздействие зоны порта, встречается в небольшом количестве почти во всей бухте, в тотальных обловах.
Из ветвистоусых рачков в слое гипонейстона наиболее многочисленным был Pleopis polyphemoides. Этот вид первым из кладоцер начинает свое развитие в планктоне. Важно отметить, что в Новороссийской бухте велика роль коловраток рода Synchaeta sp., выносливых к загрязнению, максимум развития которых приходиться на кутовую часть бухты.
В следующую группу зоопланктона входят планктеры, которые представляют собой незначительную ценность в питании высших организмов:
из гидроидных – Cordylophora caspia, Coryna tubulosa характерные виды для Новороссийской бухты. Obelia sp. – встретилась лишь однажды в районе Коса, в июле 2003 года.
Sagitta setosa, Oikopleura dioica, Actinotrocha metschniroffi вспышками доминируют в теплое время года, но в пробах присутствуют повсеместно круглогодично.
В 2002 году в июле температура воды в Новороссийской бухте повысилась до 28 С, в связи, с чем особенностью этого месяца стало массовое развитие гребневика Mnemiopsis leidyi, который забивал планктонную сеть настолько, что затруднял отбор проб зоопланктона. Размеры гребневика колебались в пределах 2,5–5,0 мм. В гастральной полости отдельных экземплярах были хорошо видны еще не переварившиеся взрослые рачки Acartia clausi и личинки пастинчато-жаберных моллюсков. В конце 1980-х годов в бухте уже имела место вспышка гребневика-вселенца Mnemiopsis leidyi, из-за которого в 1989–1990 гг. биомасса кормового зоопланктона снизилась. Однако с появлением Beroyae ovata – основного потребителя личиночных и взрослых стадий мнемиопсиса, численность его уменьшилась. Молодые особи Beroyae ovata также отмечены и в 2002–2003 гг., но их количественный учет не ввелся.
Noctiluca scintillans – хищник, с гетеротрофным типом питания встречается в гипонейстоне и в вертикальных ловах. В 80-х годах была высокая биомасса ноктилюк (до 500,3 мг/м3), что стало основной для развития мезозоопланктона. Массовое развитие ночесветки связано с замещением в пелагиали трофической цепи детритной. Как правило, в весенний период Noctilluca scintillans составляет большую часть биомассы зоопланктона, так в 2000 г. общая масса планктонеров составила 707 мг/м3, где до 92 % массы составила пирофитная водоросль. В подсчет биомассы кормового зоопланктона, масса ноктилюки не учитывается.
В 1989 году, где зоопланктон за исключением простейших был представлен 30 видами и личиночными формами, массовыми считались акарция и плеопис. В портовой части бухты тогда было выявлено, максимальное число личинок полихет, усоногих рачков, ноктилюки и Pleopis polyphemoides, т.к. они устойчивые к некоторым типам загрязнения.
В результате исследований 1994–1996 года к наиболее чистым районам помимо открытой части и м. Дооб относится и акватория н/б «Шесхарис». Здесь периодически встречались, в то время почти исчезнувшие гипонейстонные и оксифильные виды: Evadne spinifera, Pseudoevadne tergestina и Pontella mediterranea. В 1995 году в этом районе отмечены Calanus euxinus, Paracalanus parvus, Sagitta setosa, Oikopleura dioica не обнаруженных на других станциях Новороссийской бухты. Мертвая фракция составила 60,8 %. В среднем по бухте биомасса и численность составила 23717 экз./м3 и 666,9 мг/м3, соответственно. Также прослеживается весенний пик плотности планктонеров, ночесветка в условиях мелководья давала до 91 % всего количества зоопланктона.
В 1998 году летом общая численность мезопланктона в средней части бухты составила 18188 экз./м3 и 199,1 г/м3, а в октябре месяце 1831 экз./м3 и 188,8 мг/м3. Здесь же сотрудники Новороссийской биологической станции в своих отчетах отмечали, что в экосистеме Новороссийской бухты произошла кардинальная перестройка, вызванная мощным процессом антропогенного загрязнения. В наиболее загрязненных участках Новороссийской бухты возрос удельный вес простейших, коловраток, личинок донных животных и ракообразных, устойчивых к загрязнению. Одновременно произошло снижение других, в основном гипонейстонных, оксифильных видов (кладоцер).
Весной 2000 года отмечается высокая общая биомасса зоопланктона
707 мг/м3, где ноктилюка составила до 92 % биомассы.
В 2001 году ноктилюка имела также весомое значение по биомассе, весной также доминировали коловратки, ветвистоусые Pleopis polyphemoides, личинки усоногих раков. На плотность мезозоопланктона особое влияние оказывает развитие в бухте гребневиков-вселенцев.
1.2 Биологическая характеристика исследуемых видов
Наиболее многочисленными видами и классами, определенными в пробах были: Acartia sp., Noctilluca scintillans, Harpocticoida sp., Centropages pontica, Ostrocoda sp., Pleopis polyplemoides, Oithona, Polychaeta, Balanus larvae, Bivalvia larvae, Gastropoda larvae.
Веслоногие раки (Copepoda)
Веслоногие рачки объединяют несколько семейств низших ракообразных и насчитывают около 1800 видов. По размеру мелкие 0,5–2 мм планктонные рачки, живут как в пресных водах, так и в морях. В морских водах наиболее часто встречается каланус (Calanus sp.). Он составляет существенную часть планктона, служащего пищей для многих рыб в морях и океанах. Обитатели пресных вод циклоп (Cyclops sp.) и диаптомус (Diaptomus sp.).
Обычно всех веслоногих рачков из-за внешнего сходства в обиходе называют циклопом. Тело рачка расчленено на сегменты. Сложная голова несет один глаз, две пары антенн, ротовой аппарат плюс пару ножек-челюстей. Одна пара антенн намного длиннее другой. Эта пара антенн сильно развита, их главная функция – движение. Также нередко они служат для удержания самки самцом при спаривании. Грудь из 5 сегментов, грудные ноги с плавательными щетинками. Брюшко из 4 сегментов, на конце – вилочка. В основании брюшка самки 1 или 2 яйцевых мешка, в которых развиваются яйца. Из яиц выходят личинки науплии. Обитают в водоемах круглый год.
Многощетинковые черви (Polychaeta)
Класс в основном, морские черви. Многощетинковые черви – часто крупные, активные формы с хорошо развитой нервной системой и органами чувств.
Многощетинковые – самый богатый представителями класс кольчецов (около 5300 видов), которые за единичными исключениями живут в морях. Многие из них ведут активный образ жизни, ползая по дну, роясь в грунте или плавая в толще воды; другие – сидячие животные, живут в защитных трубках. Немногие представители ведут паразитический образ жизни.
Класс полихет характеризуется следующими признаками: чувствительные придатки головной лопасти хорошо развиты, в частности всегда имеется одна пара щупиков, или пальп, которые у сидячих полихет превращены в крону щупальцевидных придатков, часто называемых "жабрами". Каждый сегмент тела несет пару примитивных ножек – параподий, снабженных щетинками.
Форма тела полихет вытянутая, лишь слегка сплющенная в спинно-брюшном направлении или правильно цилиндрическая. Туловище состоит из различного числа (от 5 до 800) сегментов. По количеству сегментов различаются формы малосегментные, или олигомерные (Dinophilus, Myzostomum и их родичи), и формы многосегментные, или полимерные (большинство представителей Polychaeta).
Передний, или предротовой, участок тела – простомиум и задний, или анальная лопасть – пигидиум отличаются от сегментов туловища и являются особыми, не метамерными частями тела. Сегменты туловища в более простых случаях совершенно равноценны, или гомономны, имеют одинаковый вид и содержат приблизительно одинаковые органы. Такая гомономность есть признак примитивной организации и лучше всего выражена у свободноподвижных, бродячих форм. Гетерономность, или разноценность сегментов в разных областях тела, проявляется резче всего у сидячих полихет как следствие неодинаковых условий жизнедеятельности передней части тела, высовывающейся из трубки, и задней, всегда скрытой в глубине жилища.
Тело многощетинковых кольчецов, как правило, снабжено различными придатками, служащими отчасти для движения, частью органами чувств. Сильнее развиты придатки на головном отделе, где они имеют иной характер, чем на туловище. Головной отдел состоит из предротового участка – простомиума, или головной лопасти, и перистомиума, который несет ротовое отверстие и представляет первый сегмент, но часто является результатом слияния нескольких (2–3) передних сегментов. Процесс цефализации – включения одного или более туловищных сегментов в головной отдел – наблюдается не только у кольчецов, но и у членистоногих.
Наиболее постоянные и характерные придатки простомиума – пара щупиков, или пальп. Здесь же расположена пара или более органов осязания – щупалец (антенны), имеющих разнообразную величину и форму. На перистомиуме нередко в различном количестве развиваются усики, или цирры. Пальпы и антенны иннервируются головным мозгом, усики же – передним концом брюшной нервной цепочки.
Для туловища характерно присутствие парных боковых выростов – параподии.
Ветвистоусые ракообразные (Cladocera)
К ветвистоусым относится сравнительно небольшая группа водных организмов, по своему строению наиболее близких к подотряду Conchostrata. В основном это мелкие (0,2–10 мм) планктонные организмы, населяющие самые разнообразные водоемы, периодически достигающие плотности
100 тыс./м3 воды. В мировой фауне известны примерно 400, в фауне СССР – 170, в Молдавии – свыше 90 видов.
Тело большинства видов овальное, иногда суженное и палочковидно-удлиненное, обычно сжатое с боков. Оно состоит из головы, туловища и постабдомена и покрыто прозрачной хитиновой кутикулой.
Голова имеет различную форму. Иногда она очень маленькая (Ceriodaphnia) или очень большая (Bythotrephes). Передний край головного панциря у многих ветвистоусых клювообразно вытянут и образует так называемый рострум. Голова несет пять пар конечностей (придатков). Передние антенны или антеннулы отходят от нижнего (иногда заднего) ее края и за некоторым исключением состоят из парных палочковидных придатков, служащих органами чувств. На дистальном конце основного членика находятся пять – девять чувствительных папилл. Строение антеннул у самцов и самок различное. Задние, плавательные, или вторые, антенны, которые крупнее антеннул, являются органами движения. Они состоят из ствола и двух ветвей. Основания антенн отходят от задних боковых сторон головы. Ветви двух – четырехчлениковые и снабжены относительно длинными, оперенными щетинками. Количество члеников и их вооружение обычно постоянны для каждого рода и семейства. Ротовые органы, расположенные на нижней части головы, представлены жвалами и челюстями, прикрытыми верхней и нижней губами. Жвалы и мандибулы похожи на две слегка изогнутые пластинки, дистальные концы которых покрыты рядами поперечных хитиновых складок, усаженных шипами и щетинками. У видов, ведущих хищнический образ жизни (Leptodora), жвалы вооружены зубами. Челюсти, максиллулы, или первые максиллы, состоят обычно из двух небольших пластинок. Вторые максиллы рудиментарны и имеют вид бугорков. Верхняя туба хорошо развита и находится перед ротовым отверствием и жевательными пластинками жвал, нижняя губа – позади верхней. Придатки туловища у ветвистоусых рачков представлены четырьмя – шестью парами конечностей, совершенно утративших двигательную функцию. У большинства кладоцер, фильтраторов по способу питания, конечности преобразованы в аппарат, при помощи которого они отфильтровывают мелкие пищевые частицы. У хищных видов конечности в основном одноветвистые. Наиболее развит эндоподит, вооруженный многочисленными крупными шиловидными и когтевидными щетинками. Экзоподиты и максиллярные придатки сильно редуцированы или отсутствуют.
Постабдомен лишен конечностей. Строение его характерно для каждого рода. Он бывает длинный (Camptocercus sp.), короткий (Polyphemus sp.), толстый (Macrothrix sp.), конический (Moina sp.), сильно сжатый с боков или пластинкообразный (Chydoridае sp.).
На дистальном конце постабдомена у большиства видов находятся два «фурка», всегда изогнутых, гладких или покрытых зубцами или щетинками. От проксимальной части верхнего края постабдомена отходят один–четыре заостренных выступа, называемых абдоминальными выростами. Вблизи них сидят плавательные, обычно оперенные щетинки. Вдоль верхнего края постабдомена, до дистального его конца, расположены анальные зубчики, а латеральные края покрыты рядами или пучками мелких щетинок. На верхнем крае открывается анальное отверстие. Раковинки (створки), с oбеих сторон закрывающие туловище, имеют полукруглую или полуовальную форму. У некоторых видов они образуют различного рода выросты, например у Daphnidae, мукро у Bosminidaе, головной шлем и крылообразные отростки латеральных головных килей и спину у Daphnidae и др.
Моллюски (Mollusca)
Моллюски – крупный по числу видов (130 тыс.) тип животных. Обитают они преимущественно в морях (мидии, устрицы, кальмары, осьминоги), пресных водоемах (беззубки, прудовики, живородки), реже – во влажной наземной среде (виноградная улитка, слизни).
Размеры тела взрослых моллюсков разных видов значительно различаются – от нескольких миллиметров до 20 м. Большинство из них – малоподвижные животные, некоторые ведут прикрепленный образ жизни (мидии, устрицы), и только головоногие моллюски способны быстро передвигаться реактивным способом. Тело лишено сегментации, имеет двустороннюю симметрию (двустворчатые и головоногие) или асимметричное (брюхоногие). Отделами тела являются голова с расположенными на ней глазами и 1–2 парами щупалец, туловище, в котором расположено большинство внутренних органов, и нога – мускулистая брюшная часть тела, служащая для передвижения. У двустворчатых моллюсков голова редуцирована.
Представителями массовых видов являлись:
Noctiluca scintillans – вид бесцветных динофлагеллят из рода Noctiluca. Тело шаровидное (диаметр 2–3 мм), с подвижным сократимым щупальцем. Размножаются делением надвое или образованием мелких почек на поверхности тела. Цитоплазма ночесветки заполнена жировыми включениями, которые при механических или химических раздражениях (в опытах – также при действии электрического тока) обладают способностью к биолюминесценции. Образуя скопления в поверхностных слоях тёплых, реже бореальных вод, вызывают свечение моря.
Harpacticoida sp. – богатая эврибионтами группа веслоногих рачков, обитающих в морях и пресных водах преимущественно на водных растениях и различных твердых и мягких грунтах. Они встречаются в пещерных водоемах и грунтовых водах, подушках мха и пазухах листьев. Известны сверлящие формы и различного рода паразиты.
В составе современной фауны рода Harpacticoida sp. насчитывается более 400 видов, объединенных в 30 семейств. Тело у гарпактицид удлиненное, цилиндрическое или дорсовентрально сплюснутое без резкой границы между тораксом и абдоменом.
Головной и первый торакальные сегменты часто срастаются. Первый и второй абдоминальные сегменты нередко сливаются, образуя генитальный сегмент. Анальный сегмент сверху прикрыт пластинкой. Брюшко заканчивается каудальными ветвями, в большинстве случаев короткими и неподвижно сочлененными с последним сегментом. Форма и размер фурки изменчивы. Первые антенны четырех–восьми, максимум девятичлениковые у самки и десятичлениковые у самца. У последнего обе ветви изменены в геникулирующие. Задние антенны всегда двуветвистые. Челюстные ножки в большинстве случаев превратились в хватательные и на конце снабжены подвижно сочлененным загнутым когтем. Первая пара торакальных ног часто хватательного типа. Одна или обе ветви на дистальных члениках имеют когтевидные придатки. У следующих трех пар ног слабо выраженного плавательного типа, количество щетинок и шипов варьирует. Пятая пара ног сильно редуцирована и состоит из двух, а иногда даже одного членика. Пятая пара ног у самца никогда не превращается в копулятивный орган. Как правило, она меньше, чем у самки. Типичный копулятивный орган у большинства гарпактинид представлен эндоподитами второй и третьей парой ноидоизмененными в отростки (апофизы) или крепкие шипы, длина и форма которых очень разнообразны.
Особи раздельнополые, размножаются аналогично веслоногим ракообразным, однако у некоторых видов наблюдается партеногенез. Продолжительность развития отдельных стадий различна. Длительность онтогенеза в зависимости от температуры среды обитания гарпактицид может уменьшаться или увеличиваться. Покоящиеся яйца развиваются более продолжительное время. Как взрослые, так и молодые гарпактициды переносят непродолжительное пересыхание водоема, спрятавшись во влажный ил.
2 Характеристика Новороссийской бухты
Черное море расположено на юго-востоке Европы между Восточно-Европейской равниной и горными массивами Кавказа и полуострова Малая Азия. На северо-востоке оно соединено Керченским проливом с Азовским морем, а на юго-западе – системой проливов с Мраморным и Средиземным морями [Сорокин, 1982].
Новороссийский порт расположен в новороссийской бухте, известно также под названием Суджукской и Цемесской, по своей обширности и глубине является одной из самых значимых бухт Черного моря (рисунок 1).
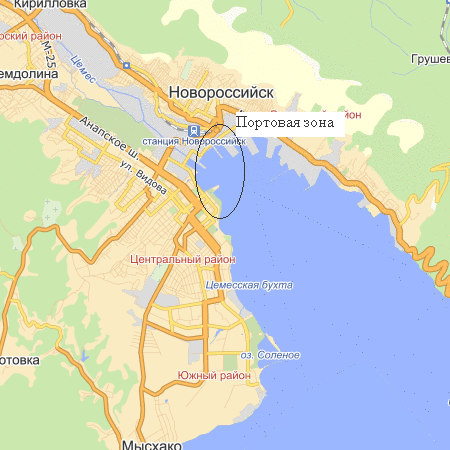
Рисунок 1 – Карта-схема Новороссийской бухты
Новороссийская бухта характеризуется следующими морфологическими и гидрологическими особенностями: бухта относится к числу закрытых, то есть ширина входа значительно меньше длины. Она вдается в материк на
14,8 км, в то время как ее ширина в средней части не превышает 5,7 км. Протяженность береговой линии бухты достигает 28 км, из которых 12,7 приходится на восточный берег, 5,6 км – на западный, 5,7 км – на бассейн порта, занимающего северо-западную часть бухты. Общая площадь Новороссийской бухты – 53,16 км. Наибольшая глубина 27,4 м [Крыштын, 1968].
Н. Ю. Миловидова [1966] и З. Г. Крыштын [1968] детально описали в своих работах особенности гидрологии бухты, грунт и характер окружающих территорий. Они указывают, что восточные и западные ее берега значительно отличаются друг от друга. Восточное побережье довольно крутое и обрывается в море отвесными скалами. Весь восточный берег ограничен сплошным горным хребтом высотой 400–600 м, и разделен на три части, мысами Шесхарис и Пенай. Западный берег представляет собой полого опускающуюся к морю холмистую местность. Берег скалистый, потом переходит в галечный [Крыштын, 1968].
Вокруг бухты расположен город Новороссийск. Жилые строения и административные учреждения сосредоточены преимущественно на ее западном берегу. Берге, прилегающий к бассейну порта, занят портовыми учреждениями и сооружениями, элеваторами, железнодорожным узлом, складами.
По своим гидрологическим характеристикам Новороссийская бухта может быть разделена на три части: порт, собственно бухта и открытая часть бухты [Крыштын, 1968].
Бассейн порта в пределах моловых ограждений характеризуется сравнительной мелководностью (глубина в средней части 10–12 м), некоторой опресненностью, загрязненностью сточными водами, замкнутостью и удаленностью от вод открытого моря, интенсивным перемешиванием толщи воды порта под воздействием движущихся судов. Обмен вод бухты и порта, вследствие известной замкнутости последнего моловыми заграждениями, протекает не очень интенсивно. В зимние месяцы при штормах южных румбов или при северо-восточных ветрах, полный обмен вод порта осуществляется в течение 10–13 часов [Крыштын, 1968; Халилова, 1984].
Собственно бухта – ограниченный участок от мыса Дооб до Сукжукской косы. Характерной особенностью этого района является, с одной стороны, непосредственное и широкое общение вод бухты и открытого моря, с другой – формирование здесь гидрологического режима, несколько отличного от режима прибрежной части открытого моря. Открытое море – это участок при входе в бухту, с глубинами 30–35 метров, гидрологический режим которого определяется режимом поверхностных слоев открытой северо-восточной части Черного моря [Крыштын, 1968].
Собственно гидрологический режим Новороссийской бухты складывается под влиянием характерных для нее климатических особенностей (ветрового режима, температуры воздуха, количество осадка течений и др.), гидрологического режима прилегающей части открытого моря и физико-географических особенностей отдельных районов бухты. Общий рельеф дна в бухте ровный [Миловидова, 1966].
Многолетняя среднегодовая температура воды составляет 14,5 С. В разные сезоны года и на разных глубинах температуры воды не одинаковы. Зимой поверхностные воды могут охлаждаться до 0 С, при этом температура глубинных участков выше – 5–9 С. Летом поверхность моря прогревается до 24–28 С у берегов и до 21–23 С в глубоководных районах [Сорокин, 1982].
Нагонные ветра, способствующие притоку воды в бухту из открытого моря, летом способствует некоторому понижению температуры на поверхности и повышению у дна. Зимой же нагонные ветра способствуют повышению температуры во всей толще воды, приводя к гомотермии. Сгонные ветра летом способствуют охлаждению как поверхностных, так и придонных слоев воды, а зимой вызывают понижение температуры на поверхности и повышение у дна. Сильные и холодные зимние норд-осты, вызывая интенсивное перемешивание вод бухты, производят охлаждение всей толщи воды [Сорокин, 1982].
Плотность воды в Новороссийской бухте у дна выше, чем на поверхности. Плотность поверхностных слоев воды в среднегодовом выводе возрастает по мере удаления от порта к открытому морю, но в отдельные месяцы распределение плотности поверхностных слоев воды в бухте определяется распределением величины температуры. Наибольшая плотность воды соответствует наиболее холодным месяцам, наименьшая – наиболее теплым [Миронов, 1973].
Временем наибольшего волнения в бухте является период с октября по март. В это время наблюдаются сильные южные и северо-восточные ветра, скорость волн доходит до 6,7 м/с, а их высота – до 1,5 м. Ударная сила волн в прибрежной зоне достигает 4,7 т/м2 [Халилова, 1984].
Среднегодовая температура воды в бухте составляет 14,4 С, а ее соленость колеблется в течение года от 17,9 до 18,5 ‰ и зависит как от количества атмосферных осадков, так и от объема сбрасываемых в бухту коллекторных стоков, опресняющие воды последней [Миловидова, 1966].
Гидрохимические особенности бухты формируются под воздействием различных факторов и зависят как от сезонных колебаний гидрохимических показателей и гидрологических особенностей акватории, так и от величины антропогенной нагрузки. Распределение отдельных гидрохимических элементов, таких, как окисляемость, растворенный в воде кислород, количество биогенов (нитритов, нитратов, фосфатов), а также нефтепродуктов в Новороссийской бухте неравномерно. По гидрохимическому режиму в ней можно выделить три экологически различных района [Халилова, 1984].
Для летнего сезона характерно понижение абсолютных величин содержания кислорода до 5,2–5,5 мл/л. Узкий предел разброса содержания растворенного кислорода по бухте позволяет утверждать, что в Новороссийской бухте происходит активная циркуляция водных масс, что катализирует диффузию кислорода из атмосферы [Халилова, 1984].
Анализ результатов измерений перманганатной окисляемости показал, что наибольшие концентрации органических восстановителей в весенне-летний период наблюдаются на восточном побережье и в верхней части бухты, варьируя в пределах 1,8–2,5 мг/л и превышая таковые у западного побережья в 1,2–2,0 раза. В среднем окисляемость в этот период составляет 1,2 мг О2/л. В зимний период окислительные процессы в воде замедляются, и значение окисляемости стремится к нулю [Болгова, 2007].
Современное состояние экосистемы бухты определяется мощным антропогенным воздействием. Процесс урбанизация, территориальный и количественный рост зон отдыха, развитие промышленности на побережье Новороссийской бухты привели к резкому сокращению площади лесов при параллельном увеличении числа отдыхающих, объема ливневых и хозяйственно-бытовых сточных вод, количество автомобильного транспорта и плавсредств [Лозановская, Орлов, Садовникова, 1998].
В последние десятилетия в связи с сельскохозяйственной деятельностью, дампингов грунтов, добычей песка, транспортировкой нефте- и газопродуктов, развитием инфраструктуры портов резко возросло антропогенное загрязнение шельфовой зоны Черного моря биогенными элементами, нефтеуглеводородами, полихлорбифенилами, синтетическими поверхностно-активными веществами (СПАВ), солями тяжелых элементов. Наиболее серьезной проблемой моря является загрязнение нефтью [Болотенко, 2006].
Наиболее сильны все виды загрязнения в изолированных молами небольших и относительно мелководных акваториях, как например, Новороссийский порт [Горяйнова, 1971]. Портовая акватория Новороссийской бухты испытывает интенсивную антропогенную нагрузку, вызванную сбросами более 25 промышленных и хозяйственно-бытовых сточных вод [Болгова, 2007].
В 2000–2001 гг. показатели концентрации железа и алюминия в осадках данного района находились на уровне 380–7600 мг/кг сухого грунта соответственно. Содержание тяжелых металлов варьировало в следующих пределах: цинк – 6–70, свинец – 3–20, медь – 2–30, кадмий – 0,02–0,10, никель – 4–9 мг/кг сухого грунта [Бологова, 2007]. Перманганатная окисляемость обычно 2–3 раза выше, чем в других районах. Например, в 1966 году величина ее отличалась на уровне 6,65 мг О2/л.
По количеству биогенных элементов такие районы также превышают средние показатели. Среднегодовое количество фосфатов в Новороссийском порту составляет 6,1 мг\м3Р, нитратов – 7,7 мг/м3 [Горяйнова, 1971]. Содержание нитритов в среднем по бухте составляет 0,46 мгк-ат/л, аммонийных соединений – 12,38 мгк-ат/л, хлорастворимых веществ – около
0,7 мг\л [Болгова, 2007].
Черное море подвергается загрязнению не только сточными водами от объектов, расположенных на берегу, но и стоками морских судов, находящихся в портах и рейде. Слив в море балластных вод от промывки танкеров считается основным источником загрязнения нефтью прибрежным морских вод и берегов.
Наиболее часто технологические проливы нефтепродуктов происходят в акватории портов. Одним из наиболее ярких примеров техногенной катастрофы можно привести аварийный разрыв технологического нефтепровода, принадлежащего ОАО «Черномортранснефть» на территорию нефтебазы «Шесхарис». Тогда произошел сброс 400 тонн нефти, из которых 170 тонн попало в Новороссийскую бухту. Несмотря на оперативное проведение работ по ликвидации последствий аварийного загрязнения морской среды (Биосанация бухты), сразу же после разлива наблюдалась катастрофическое уменьшение численности фито- и зоопланктона (в 10 и 25 раз соответственно). Даже через одну неделю после происшествия у большинства планктонных организмов регистрировалось нефтяное загрязнение покровов, а 50 % были нежизнеспособны. Поэтому можно констатировать непосредственную связь между нефтяные загрязнением и последующим уменьшением биологического разнообразия планктонного сообщества Новороссийской бухты [Казмин, Селифонова, 2005].
Исследования, проведенные по изучению уровня загрязнения морской среды анионоактивными ПАВ в районе промышленного выпуска с очистных сооружений нефтебазы «Шесхарис» в сравнении с точками, удаленными от нее, в том числе с районом мыса Пенай, показали наличие анионоактивных ПАВ на всех точках сбора материала концентрации в пределе 0,001–0,043 мг/дм3. Данные концентрации, хотя и не превышают установленных для рыбохозяйственных водоемов ПДК (0,10 мг/дм3), но все же способны негативно влиять на состояние гидробиоценоза [Болгова, 2002].
Содержание многих загрязнителей в изучаемой акватории достигло критических значений и в несколько раз превышает допустимые концентрации. Эти факты подробно описаны рядом исследователей [Правдюрин, 1991; Лозановская, Орлов, Садовникова, 1998; Болгова, 1994].
3 Материал и методы исследований
Материалом для выпускной квалификационной работы бакалавра послужили сборы проб зоопланктона, выполненные в период с 23 июня по 20 июля 2014 года в акватории Новороссийской бухты на четырех различных точках, таких как Морской вокзал, западный мол, городской пляж и Яхтклуб (рисунок 2).
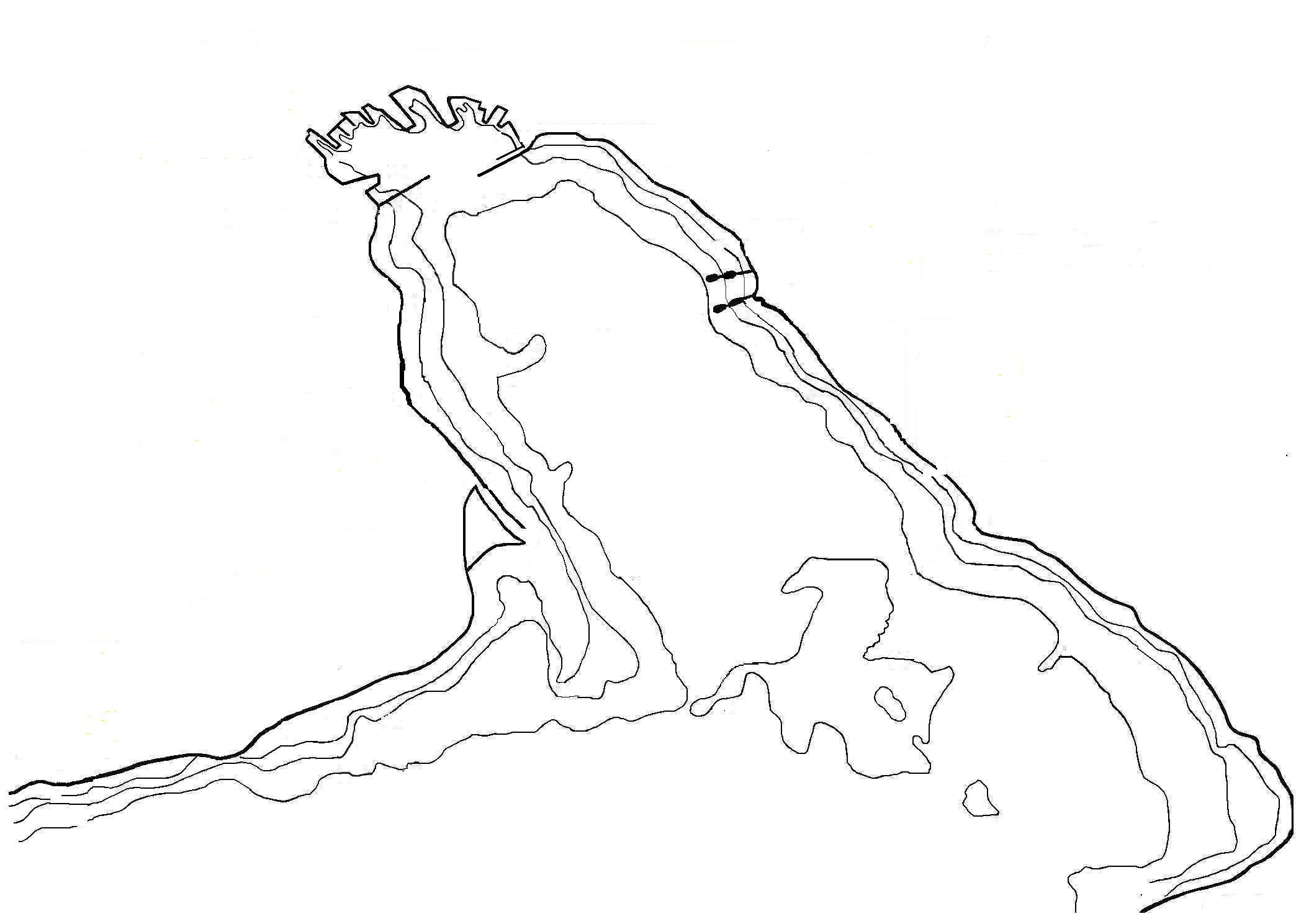
Всего нами было отобрано 9 проб, из которых 3 пробы были взяты из района городского пляжа, 2 пробы – из «Яхтклуба», 2 пробы – из «Морского вокзала», 2 – из «Западного мола». Средняя удаленность взятия проб от береговой линии составляла по трем точкам, кроме западного мола, 5–7 м, расстояние от береговой линии на западном моле 95–100 м.
1 – «Морвокзал»; 2 – «Западный мол»; 3 – «Гор. пляж»; 4 – "Яхтклуб»
Рисунок 2 – Карта-схема исследуемых районов
(красными точками отмечены места отбора проб)
В качестве основного орудия сбора планктона использовалась сеть Джеди (рисунок 3). Сеть опускали на максимальную глубину, для точного определения горизонта учитывается угол наклона сети, волнение и течение.
Данные по погодным условиям вносились нами в полевой журнал во время взятия проб. Средняя температура во время сбора материала в течение всего времени составляла 25–27 С. Скорость подъема открытой сети не превышала 1 м/с. Сеть поднимали и выливали пробу в подготовленную тару. Затем кран на стакане закрывали, верхнюю часть сети расправляли и опускали в море для того, чтобы смыть оставшиеся на стенках сети организмы. Смытый со стенок сети остаток пробы сливали в ту же тару.
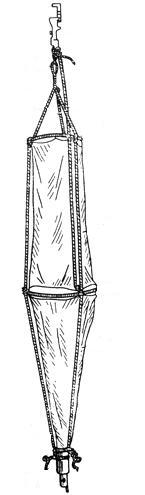
Рисунок 3 – Вид количественной сети Джеди
Полученную пробу фиксировали нейтральным формалином (40 %-ным) до конечной концентрации 4 % (проба должна была иметь устойчивый запах формалина). Пробу снабжали этикеткой, на которой отмечали дату, номер станции и пробы, глубину, горизонт облова, угол отклонения троса [Цыбынь, 1980].
Качественную и количественную обработку проводили в лаборатории на базе НУНИМБЦ. Полученный объем пробы пересчитывали на единицу объема профильтрованной воды. Количество профильтрованной воды определяли, исходя из площади входного отверстия сети, и фактического пробега сети в облавливаемом слое.
Определение качественного состава планктона при предварительной обработке материала сводилось обычно к определению массовых видов.
Учет видового состава, а также необходимый количественный подсчет организмов производили, используя камеру Богорова. При малом количестве планктона просчитывали всю пробу целиком. При обилии мезопланктона просчитывали часть пробы [Цыбынь, 1980].
Количественная обработка проб зоопланктона заключалась в подсчете численности организмов каждого вида (по возможности, по размерам и стадиям развития) и определении их массы. Перед обработкой проб все данные этикетки переносили в планктонную карточку. Осторожно открыв стаканчик, не взбалтывая осадок, при помощи резиновой груши, снабженной стеклянной трубкой, с поверхностного слоя пробы не касаясь осадка отсасывали формалин. Затем его сливали в банку с завинчивающейся или притертой крышкой. Другой такой же грушей набирали чистую воду, которой смывали в пробу приставшие к газу формалиновой груши организмы. Стаканчик с пробой наполовину заполняли водой и переливали ее в мерный стаканчик объемом 100–150 мл, затем склянку 1–2 раза ополаскивали водой, которую также сливали в стаканчик. В зависимости от густоты пробы, путем отсасывания или добавления воды в стаканчик, ее доводили до определенного объема (50 см3, если она не очень богатая, и 100 см3, если слишком густая). При относительно «бедных» планктоном водах организмы подсчитывали во всей пробе. С этой целью использовали камеру Богорова. Она имела вид стеклянной пластины (длина 115, ширина 70 мм) с сообщающимися канавками (ширина – 4, глубина – 10 мм), разделенными призматическими перегородками (рисунок 4).

Рисунок 4 – Камера Богорова
Количественный подсчёт проводили под бинокуляром МБС–1,2 или 10 при увеличении 2–4x8 (окуляры 2 или 4, объектив – 8). Рядом с бинокуляром должны были находится: планктонная карточка, пара тонких упругих препаровальных игл, чистые предметные и покровные стёкла. Обнаруженные в штемпель пипетке организмы определяли до вида, и количество их заносили в карточку в графу «0,5 см3». Обычно просматривали две такие порции, если расхождения результатов двух просчетов не больше
5 % – просчет заканчивали, если же расхождение больше 5 %, то необходимо было взять и обработать еще 1–2 порции. Затем, отсосав часть воды из мерного стаканчика, оставшийся осадок планктона в несколько приемов просматривали в камере Богорова под бинокуляром. Численность не попавших в штемпель пипетки организмов заносили в планктонную карточку в графу «Осадок».
Обнаруженные в пробе виды записывали в карточку по группам: коловратки, веслоногие раки, ветвистоусые раки, личинки хирономид, олигохеты, остракоды. Организмы, относящиеся к последним группам, не определяли до вида, принимается во внимание только их размерный состав.
Метод определения массы организма путем непосредственного взвешивания (таблица средних весов) очень трудоемок, поэтому использовали возможность рассчитывать массу тела особей, по их длине [Балушкина, Винберг, 1979], пользуясь степенным уравнением этих величин:
w = g*I*B, (1)
где I – длина тела организма, (мм);
w – масса тела, (мг);
g – масса тела, (мг сырой массы при длине тела равной 1 мм);
В – показатель степени.
Суммируя биомассу (численность) всех организмов в пробе получали общую биомассу (численность) зоопланктона в водоеме за данную дату.
Численность планктонных организмов выражалась в тыс. экз./м3, а биомасса – в мг/м3 или г/м3.
Сбор первичного материала осуществлялся в соответствии с методиками, общепринятыми в гидробиологии [Колбицкая, 1966; Сакун, Буцкая, 1968; Правдин, 1966; Мордухай-Болтовский, 1968, 1969, 1972; Колбицкая, 1981].
4 Динамика развития зоопланктона в Новороссийской бухте
Динамика развития зоопланктона Новороссийской бухты исследовалась по показателям численности и биомассы, так же определялось его видовое соотношение в разных точках.
4.1 Видовой состав зоопланктона
Зоопланктон некоторых участков Новороссийской бухты на момент проведения исследований состоял из представителей видов ветвистоусых рачков (Cladocera sp.), веслоногих (Copepoda sp.), представителей меропланктона: ракушковые раки (Ostrocoda sp.), личинки усоногих раков ( Balanus (larvae) sp.), полихеты (Polychaeta sp.), маллюски (Gastropoda sp.) (таблица 1), а также щетинкочелюстные (Sagita setosa), оболчиники (Oikopleura dioica).
Таблица 1 – Видовой состав зоопланктона некоторых участков Новороссийской бухты
|
Организмы
|
Точки отбора проб
|
|
|
станция 1
«Гор. пляж»
|
станция 2
«Морвокзал»
|
станция 3
«Яхтклуб»
|
станция 4
«Западный мол»
|
|
Sagita setosa
|
+
|
+
|
+
|
+
|
|
Noctilluca scintillans
|
+
|
-
|
+
|
+
|
|
Acartia sp.
|
+
|
+
|
+
|
+
|
|
Actinotrocha sp.
|
+
|
-
|
+
|
+
|
|
Harpocticoida sp.
|
+
|
+
|
+
|
+
|
|
Centropages pontica
|
+
|
+
|
+
|
+
|
|
Ostrocoda sp.
|
+
|
+
|
+
|
+
|
|
Paracalanus
|
+
|
+
|
-
|
-
|
Продолжение таблицы 1
|
Организмы
|
Точки отбора проб
|
|
|
станция 1
«Гор. пляж»
|
станции 2
«Морвокзал»
|
станция 3
«Яхтклуб»
|
станция 4
«Западный мол»
|
|
Pleopis polyplemoides
|
+
|
+
|
+
|
+
|
|
Oithona
|
+
|
+
|
+
|
+
|
|
Polychaeta
|
+
|
+
|
+
|
+
|
|
Hydrozoea
|
+
|
+
|
+
|
+
|
|
Balanus larvae
|
+
|
+
|
+
|
+
|
|
Bivalvia larvae
|
+
|
+
|
+
|
+
|
|
Gastropoda larvae
|
+
|
-
|
+
|
+
|
|
Oikopleura dioca
|
+
|
-
|
+
|
+
|
|
Podon intermedius
|
-
|
+
|
-
|
+
|
|
Всего
|
16
|
14
|
15
|
13
|
Из таблицы 1 видно, что большинство видов встречались на станциях взятия проб «Гор. пляж» и «Яхтклуб» (рисунок 5).
Станция 1 – «Гор. пляж»; станция 2 – «Морвокзал»; станция 3 – «Яхтклуб»; станция 4 – «Западный мол». Количество видов выражено в экземплярах.
Рисунок 5 – Количественное распределение видов по разным точкам отбора проб в Новороссийской бухте
Наиболее частыми видами, встречаемые во всех пробах с 4 станций, являлись Acartia sp., Harpocticoida sp., Ostrocoda sp., Oithona sp., Polychaeta sp. Наименьшие по количеству экземпляров в пробах на всех станциях являлись такие виды, как Podon intermedius, Paracalanus sp. Объяснить такое малое количество встречаемых видов на станциях «Морвокзал» и «Западный мол» возможно тем, что качество воды в этих точках самое низкое, в первом случае из-за большого антропогенного воздействия, а во втором, из-за того, что на станции много выбросов в воду технических отходов (смазочные вещества, нефтеотходы, горючее и др.).
Для станций «Морвокзал» и «Западный мол» характерно нестабильное содержание в воде одних и тех же видов, что не скажешь о «Горпляже» и «Яхтклубе», так как там имеется относительная отгороженность водных масс, нет активных волнений и смешивания вод с другими видами зоопланктона.
4.2 Численность зоопланктона
Доминирующую роль в планктоне играл меропланктон. По численности преобладал Acartia sp., в основном науплиальные и копеподитные стадии, летом достигал 3432,5 тыс. экз. в 1 м3 или 33,32 % общей численности всех видов. Наибольшее количество по численности встречалось на станции «Западный мол» (1170 тыс. экз. в 1 м3 или 34,085 %) (таблица 2).
Таблица 2 – Численный состав зоопланктона в разных участках Новороссийской бухты (шт/м3).
|
Организмы
|
Точки отбора проб
|
|
|
станция 1
«Гор. пляж»
|
станция 2
«Морвокзал»
|
станция 3
«Западный мол»
|
станция 4
«Яхтклуб»
|
|
Sagita setosa
|
25,0
|
5,0
|
25,0
|
12,5
|
|
Noctilluca scintillans
|
107,5
|
0,0
|
240,0
|
25,0
|
|
Acartia sp.
|
1100,0
|
287,5
|
1170,0
|
875,0
|
Продолжение таблицы 2
|
Harpocticoida sp.
|
142,5
|
75,0
|
345,0
|
7,5
|
|
Centropages pontica
|
85,0
|
15,0
|
190,0
|
10,0
|
|
Ostrocoda sp.
|
30,0
|
40,0
|
175,0
|
40,0
|
|
Paracalanus
|
5,0
|
5,0
|
0,0
|
0,0
|
|
Pleopis polyphemoides
|
100,0
|
107,5
|
425,0
|
30,0
|
|
Oithona
|
35,0
|
212,5
|
485,0
|
50,0
|
|
Polychaeta
|
122,5
|
110,0
|
305,0
|
82,5
|
|
Hydrozoea
|
32,5
|
2,5
|
87,5
|
30,0
|
|
Balanus larvae
|
205,0
|
35,0
|
105,0
|
65,0
|
|
Bivalvia larvae
|
135,0
|
12,5
|
610,0
|
962,5
|
|
Gastropoda larvae
|
207,5
|
0,0
|
105,0
|
17,5
|
|
Oicopleura dioca
|
2,5
|
0,0
|
15,0
|
15,0
|
|
Podon intermedius
|
0,0
|
10,0
|
5,0
|
0,0
|
|
Всего
|
2340,0
|
922,5
|
4302,5
|
2225,0
|
Наиболее редко на всех станциях встречался вид Sagita setosa и Hydrozoea sp. Из общей массы видов их численность колебалась на одном уровне и составляла 1,44 и 1,46 % соответственно от общего числа исследованных объектов. В единичном экземпляре во всех пробах встречался вид Zoea brachiura и составлял 0,02 % от общего числа видов.
Podon intermedius отсутствовал в точках «Гор. пляж» и «Яхтклуб», Oicopleura dioca, Gastropoda larvae и Noctilluca scintillans отсутвовали в точке «Морвокзал», Paracalanus отсутствовал в точках «Западный мол» и «Яхтклуб».
Отсутствие вида Noctilluca scintillans говорит о неблагоприятном экологическом состоянии воды в точке «Морвокзал», так как именно этот вид является индикатором.
Общее распределение численности зоопланктона в % в разных участках Новороссийской бухты представлено на рисунке 6.
Станция 1 – «Гор. пляж»; станция 2 – «Морвокзал»; станция 3 – «Западный мол»; станция 4 – «Яхтклуб».
Рисунок 6 – Доля численности зоопланктона в разных участках Новороссийской бухты
Общее число видов, обнаруженных в отобранных пробах, колебалось по разным точкам отбора. Так, наибольшее число было выявлено в точке «Западный мол» (44 % от общего количества), далее точка «Гор. пляж» с долей в 24 %, «Яхтклуб» – 23 %, наименьшая доля присутствовала в точке «Морвокзал» – 9 %. Это возможно объяснить тем, что во-первых высокая антропогенная нагрузка препятствует развитию видового разнообразия зоопланктона, во-вторых активное судоходство привело к исчезновению из зоны видов, которые обитали там ранее.
4.3 Биомасса зоопланктона
Для выявления динамики развития зоопланктона в разных участках Новороссийской бухты так же проводились расчёты по биомассе различных видов (таблица 3).
Таблица 3 – Биомасса зоопланктона в разных участках Новороссийской бухты (мг/м3).
|
Организмы
|
Точки отбора проб
|
|
|
станция 1
«Гор. пляж»
|
станция 2
«Морвокзал»
|
станция 3
«Западный мол»
|
станция 4
«Яхтклуб»
|
|
Sagita setosa
|
14,050
|
1,114
|
0,981
|
0,432
|
|
Noctilluca scintillans
|
11,162
|
0,0
|
19,440
|
1,768
|
|
Acartia sp.
|
4,381
|
1,051
|
4,423
|
14,246
|
|
Actinotrocha sp.
|
0,600
|
0,225
|
1,035
|
0,5
|
|
Harpocticoida sp.
|
0,855
|
1,282
|
6,430
|
0,048
|
|
Centropages pontica
|
0,062
|
0,049
|
0,414
|
0,009
|
|
Ostrocoda sp.
|
1,877
|
2,022
|
9,080
|
1,623
|
|
Paracalanus
|
0,043
|
0,045
|
0,0
|
0,0
|
|
Pleopis polyphem.
|
1,376
|
0,972
|
3,825
|
0,267
|
|
Oithona
|
0,103
|
0,610
|
1,316
|
0,205
|
|
Polychaeta
|
0,804
|
1,314
|
3,005
|
0,660
|
|
Hydrozoea
|
1,450
|
0,115
|
0,033
|
1,630
|
|
Balanus larvae
|
0,475
|
0,122
|
0,734
|
1,910
|
|
Bivalvia larvae
|
0,128
|
0,727
|
2,834
|
1,029
|
|
Gastropoda larvae
|
2,892
|
0,0
|
1,545
|
0,297
|
|
Oicopleura dioca
|
0,0008
|
0,0
|
0,102
|
0,119
|
|
Podon intermedius
|
0,0
|
0,09
|
0,045
|
0,0
|
|
Всего
|
27,233
|
9,740
|
80,020
|
24,778
|
Общая биомасса всех видов составила 141,771 мг/м3. Наименьшее количество видов по биомассе встречались на станции «Морвокзал» –
9,740 мг/м3, что составило 7 % от общего значения. Следующими по биомассе являлись точки отбора «Яхтклуб» и «Гор. пляж», они имели практически равные значения и составляли 24,778, 27,233 мг/м3 (17 и 19 %) соответственно. Наибольшая биомасса видов находилась на станции «Западный мол» – 80,020 мг/м3 (57 %), что объясняется стабильными условиями в данном участке, что способствовало наилучшему развитию зоопланктона (рисунок 7).
Станция 1 – «Гор. пляж»; станция 2 – «Морвокзал»; станция 3 – «Западный мол»; станция 4 – «Яхтклуб».
Рисунок 7 – Доля биомассы зоопланктона в разных участках Новороссийской бухты
В целом, изменения численности и биомассы, в разных участках Новороссийской бухты, соответствуют друг другу.
4.4 Динамика развития зоопланктона
Динамика развития зоопланктона в разных участках Новороссийской бухты изменялась значительно, что видно из таблицы 4.
Таблица 4 – Общее число видов, численность и биомасса зоопланктона на разных участках Новороссийской бухты
|
|
станция 1
«Гор.пляж»
|
станция 2
«Морвокзал»
|
станция 3
«Яхтклуб»
|
станция 4
«Западный мол»
|
|
Общее число (экземпляры)
|
16
|
14
|
15
|
13
|
|
Численность (шт/м3)
|
2340,0
|
922,5
|
2225
|
4302,5
|
|
Биомасса
(мг/м3)
|
27,233
|
9,740
|
24,778
|
80,020
|
Наиболее продуктивной оказалась зона «Западного мола». Там были наиболее высокие показатели численности и биомассы зоопланктона по сравнению с другими точками отбора проб. Наименее продуктивным был участок бухты «Морвокзал», там были самые низкие показатели численности и биомассы. Зоны «Яхтклуб» и «Гор. пляж» имели средние значения.
ЗАКЛЮЧЕНИЕ
В ходе работы, в соответствии с поставленными задачами, были сделаны следующие выводы:
1. Зоопланктон некоторых участков Новороссийской бухты на момент проведения исследований состоял из представителей видов ветвистоусых рачков (Cladocera sp.), веслоногих (Copepoda sp.), представителей меропланктона: ракушковые раки (Ostrocoda sp.), личинки усоногих раков ( Balanus (larvae) sp.), полихеты (Polychaeta sp.), маллюски (Gastropoda sp.), а также щетинкочелюстные (Sagita setosa), оболчиники (Oikopleura dioica).
2. Наиболее частыми видами, встречаемые во всех пробах с 4 станций, являлись Acartia sp., Harpocticoida sp., Ostrocoda sp., Oithona, Polychaeta. Наименьшие по количеству экземпляров в пробах на всех станциях являлись такие виды, как Podon intermedius, Paracalanus.
3. Доминирующую роль в планктоне играл меропланктон. По численности преобладал Acartia sp., в основном науплиальные и копеподитные стадии, летом достигал 3432,5 тыс. экз. в 1 м3 или 33,32 % общей численности всех видов. Наибольшее количество встречалось на станции Западный мол (1170 тыс. экз. в 1 м3 или 34,085 %).
4. Наиболее редко на всех станциях встречался вид Sagita setosa и Hydrozoea sp. Из общей массы видов их численность колебалась на одном уровне и составляла 1,44 и 1,46 % соответственно от общего числа исследованных объектов. В единичном экземпляре во всех пробах встречался вид Zoea brachiura и составлял 0,02 % от общего числа видов.
5. Общее число видов, обнаруженных в отобранных пробах, колебалось по разным точкам отбора. Так, наибольшее число было выявлено в точке «Западный мол» (44 % от общего количества), далее точка «Гор. пляж» с долей в 24 %, «Яхтклуб» – 23 %, наименьшая доля присутствовала в точке «Морвокзал» – 9 %.
6. Общая биомасса всех видов составила 141,771 мг/м3. Наименьшее количество видов по биомассе встречались на станции «Морвокзал» –
9,740 мг/м3, что составило 7 % от общего значения. Следующими по биомассе являлись точки отбора «Яхтклуб» и «Гор. пляж», они имели практически равные значения и составляли 24,778, 27,233 мг/м3 (17 и 19 %) соответственно. Наибольшая биомасса видов на станции «Западный мол» – 80,020 мг/м3 (57 %).
Сведения о видовом составе имеют значение для характеристики экологического состояния водоема. Полученные данные могут быть использованы в гидробиологическом мониторинге состояния водной акватории Новороссийской бухты, а так же использоваться при расчете общих допустимых уловов (ОДУ).
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Балушкина Е. В., Винберг Г. Г. Зависимость между длиной и массой тела планктонных ракообразных и коловраток // Эколого-физиологические основы изучения водных экосистем. Л., 1979. С. 169–172.
2. Болгова Л. В. Изменение ихтиофауны Новороссийской бухты в условиях антропогенного воздействия // Многолетняя динамика структуры прибрежных экосистем Чёрного моря. Краснодар, 1984. С. 101–107.
3. Болгова Jl. В. Оценка изменений биоразнообразия в прибрежной зоне северо-восточной части Черного моря // Рукопись, фонды Кубанского государственного университета. Новороссийск, 1994. 54 с.
4. Болгова Л. В. Изменения в структуре планктонных сообществ Новороссийской бухты // Материалы XV межреспубликанской научно-практической конференции. Краснодар: НУНИЦ КГУ, 2002. С. 164–165.
5. Болгова Л. В., Селифонова Ж. П. Развитие планктофауны прибрежных вод северо-восточной части Черного моря в условиях антропогенного воздействия // Тез.докл. X межреспубл. научно-практической конференции «Актуальные вопросы экологии и охраны природы южных регионов России и сопредельных территорий». Краснодар, 15–16 апреля 2007. С. 210–211.
6. Болотенко А. Н. Влияние аварийного сброса нефти на ихтиопланктон прибрежной зоны северо-восточной части Черного моря // Тез. докл. XI межреспубл. научно-практической конференции «Актуальные вопросы экологии и охраны природы экосистем южных регионов России и сопредельных территорий». Краснодар, 2006. С. 130–131.
7. Водяницкий В. А. О проблеме биологической продуктивности Черного моря // Тр.Севаст.биолог.ст., 1954. Т. 8. С. 347–424.
8. Винберг Г. Г. Опыт изучения фотосинтеза и дыхания в водной массе озера: К вопросу о балансе органического вещества // Тр. Лимнологич.станции в Косине. М., 1934. Вып. 18. С. 5–24.
9. Винберг Г. Г. Некоторые общие вопросы продуктивности озер // Зоолог. журнал, 1936. Т. 15. №4. С. 216–226.
10. Виноградов М. Е., Шушкина Э. А., Сапожников В. В. Экосистема Черного моря, М., 1992. 109 с.
11. Горяйнова Л. И. Распределение ветвистоусых ракообразных (Cladocera) в бухтах северо-восточной части Черного моря // Гидробиологические исследования северо-восточной части Черного моря. Ростов н/Д: РГУ, 1971. С. 106–112.
12. Загородняя Ю. А. Оценка величины суточного выедания фитопланктона веслоногим рачком Pseudocalanus elongatus // Биoлoгия моря, 2002. Вып. 42. С. 95–100.
13. Зайцев Ю. П., Гаркавая Т. П., Нестерова Д. А. и др. // Современное состояние экосистемы северо-западной части Черного моря // Современное состояние экосистемы Черного моря. М., 1987. С 2–13.
14. Ивлев B. C. Материалы по изучению баланса в озере // Тр.Лимнологич.ст. в Косине. М., 1937. Вып. 21. С. 14–36.
15. Казмин Л. В., Селифонова Ж. П.. Изменчивость структуры фито-и зоопланктона в Туапсинской бухте Черного моря под воздействием хронического нефтяного загрязнения // Современные проблемы аридных семиаридных экосистем юга России. Ростов н/Д ЮНЦРАН, 2005. 518 с.
16. Колбицкая А. Ф. Изучение нереста пресноводных рыб: Метод.пособие. М., 1966. 110 с.
17. Колбицкая А. Ф. Определитель молоди пресноводных рыб. М., 1981. 208 с.
18. Коваль Л. Г. Зоо- и некрозоопланктон Черного моря, 1984. 125 с.
19. Крыштын Э. Г. Некоторые вопросы биологии размножения хамсы, барабули, ставриды в Новороссийской бухте // Биологические исследования в Черном море. М., 1968. С. 56–59.
20.Лозановская И. Н., Орлов Д. С., Садовникова Л. Г. Экология и охрана биосферы при химическом загрязнении. М.,1998. С. 154–160.
21. Миловидова Н. Ю. О некоторых связях между макрозообентосом бухт северо-восточной части Черного моря и характером донных осадков // Научн.докл.высшей школы. Сер.биол.науки., 1966. №2. С. 21–25.
22. Миронов Г. Н Питание планктонных хищников. Питание ноктилюки // Тр.Севаст.биол.ст. М., Л,: АН СССР 1954. №8. С. 190–203.
23. Миронов О. Г. Проблема самоочищения и гидробиологичекие методы борьбы с загрязнением морской среды // Биологическое самоочищение и формирование качества воды. Москва, 1973. С. 19–21.
24. Определитель фауны Черного и Азовского морей. Т. 1–3 / Под общей ред. Ф. Д. Мордухай – Болтовского. Киев, 1968, 1969, 1972.
25. Определитель пресноводных беспозвоночных Европейской части СССР (Планктон и Бентос). Л., 1977.
26. Павловская Т. В. Инфузории как пища массовых планктонных животных // Зоологич.журнал, 1971. 50. №4. С. 633–647.
27. Павлютин А. П., Остапеня А. П. Рацион и усвояемость детрита // Биология внутренних вод. Инф. Бюл., 1976. №29. С.41–44.
28. Павлютин А. П. О трофической роли детрита // Продукционно- метаболические исследования водных экосистем. Л., 1987. С. 136–141.
29. Петипа Т. С. Роль концентрации пищи, как фактора среды в питании планктонных организмов // Биологические процессы в морских и континентальных водоемах. Кишинев, 1970. С. 291–292.
30. Петипа Т. С. Происхождение и классификация основных экологических типов питания калянид // Биология моря., 1975. №33. С. 27–49.
31. Печенъ-Финенко Г. А. Пищевая ценность детрита для морских планктонных животных // Продукционно-гидробиологические исследования водных экосистем. Л., 1987. С. 142–151.
32. Правдин И. Ф. Руководство по изучению рыб. М., 1966. 375 с.
33. Правдюрин С. А. Влияние аварийных разливов нефти в морских акваториях на молодь кефалевых // Актуальные вопросы экологии и охраны природы экосистемы Черноморского побережья: Сб. матер, научно-практической конференции. 4.1. Краснодар, 1991. С. 149–151.
34. Сакун О. Ф., Богуцкая Н. А. Определение стадий зрелости и изучение половых циклов рыб. Мурманск, ПИНРО, 1968. 48 с.
35. Селифонова Ж. П, Роль планктонных сообществ Новроссийской бухты в процессах самоочищения // Сборник научных трудов «Основные проблемы рыбного хозяйства и охраны рыбохозяйственных водоемов Азово-Черноморского бассейна». Ростов н/Д, 1995. С. 207–211.
36. Селифонова Ж. П. Роль зоопланктона в процессах самоочищения в шельфовой зоне северо-восточной части Черного моря // Тез. док. X межреспубл. Научно-практической конференции «Актуальные вопросы экологии и охраны природы экосистем южных регионов России и сопредельных территорий». Краснодар, 15–16 апреля 1997. С. 205–206.
37. Селифонова, Ж. П. Гетеротрофный нано- и микропланктон в условиях антропогенного эвтрофирования вод Новороссийской бухты // Экология 15/08/2001. N 4. С. 291–296.
38. Селифонова Ж. П., Фитопланктон акваторий портовых городов северо-восточного шельфа Черного моря // Морской экологический журнал, Севастополь, 2011. Т. XI, № 4. C. 67–77.
39. Селифонова Ж. П., Казмин М. А. Зоопланктон Новороссийской бухты в условиях антропогенного воздействия // Научный отчет Новорос. биол. ст. Архив. 2005.
40. Сорокин Ю. И. О применении радиоактивного углерода для изучения питания и пищевых связей водных животных внутренних водоемов // Тр. Института биологии внутренних вод. АН СССР, 1966. 12. №5. С. 76–118.
41. Сорокин Ю. И. Биологическая продуктивность Рыбинского водохранилища // Рыбинское водохранилище. М., 1972. 207 с.
42. Сорокин Ю. И. Черное море. М., 1982. 217 с.
43. Сорокин Ю. И. Биологические процессы // Техногенное загрязнение и процессы естественного самоочищения прикавказской зоны Черного моря. М., 1996. С. 84–95.
44. Туманцева Н. И. «Красный прилив» в черном море //Океанология. М., 1985. Т. XXV. Вып. 1. С. 130–132.
45. Халилова М. Р. Многолетние изменения гидрохимического режима Новороссийской бухты (1977–1980 гг.) // Многолетняя динамика структуры прибрежных экосистем Черного моря. Краснодар, 1984. С. 10–19.
46. Цыбынь А. В. Руководство по методам биологического анализа морской воды донных отложений. Л., 1980. С. 124–133.
ДИНАМИКА РАЗВИТИЯ ЗООПЛАНКТОНА В НОВОРОССИЙСКОЙ БУХТЕ