ОБМЕН БЕЛКОВ
Реферат
ОБМЕН БЕЛКОВ
Белки пищевых продуктов являются основным источником азота для организма. Азот выводится из организма в виде конечных продуктов азотистого обмена. Состояние азотистого обмена характеризуется понятием азотистый баланс.
Азотистый баланс – разница между поступающим в организм и выводимым из организма азотом. Различают три вида азотистого баланса: азотистое равновесие, положительный азотистый баланс, отрицательный азотистый баланс
При положительном азотистом балансе поступление азота преобладает над его выделением. В физиологических условиях встречается истинный положительный азотистый баланс (беременность, лактация, детский возраст). Для детей в возрасте 1 года жизни он составляет +30%, в 4 года - +25%, в подростковом возрасте +14%. При заболевании почек возможен ложный положительный азотистый баланс, при котором происходит задержка в организме конечных продуктов азотистого обмена.
При отрицательном азотистом балансе преобладает выделение азота над его поступлением. Это состояние возможно при таких заболеваниях как туберкулез, ревматизм, онкологические заболевания. Азотистое равновесие характерно для здоровых взрослых людей, у которых поступление азота равно его выделению.
Азотистый обмен характеризуется коэффициентом изнашивания, под которым понимают то количество белка, которое теряется из организма в условиях полного белкового голодания. Для взрослого человека он составляет 53 мг/ кг (или 24 г/сутки). У новорожденных коэффициент изнашивания выше и составляет 120 мг/кг. Азотистое равновесие обеспечивается белковым питанием.
Белковый рацион характеризуется опредёленными количественными и качественными критериями.
Количественные критерии белкового питания
Белковый минимум – то количество белка, которое обеспечивает азотистое равновесие при условии, что все энергетические затраты обеспечиваются углеводами и жирами. Он составляет 40-45 г/сутки. При длительном использовании белкового минимума страдают иммунные процессы, процессы кроветворения, репродуктивная система. Поэтому для взрослых людей необходим белковый оптимум - то количество белка, которое обеспечивает выполнение всех его функций без ущерба для здоровья. Он составляет 100 – 120 г/сутки.
Для детей норма потребления в настоящее время пересматривается в сторону её снижения. Для новорожденного потребность в белках составляет около 2 г/кг, к концу 1 года снижается при естественном вскармливании до 1 г/сутки, при искусственном вскармливании остаётся в пределах 1,5 – 2 г/сутки
Качественные критерии белкового питания
Более ценные для организма белки должны отвечать следующим требованиям:
- содержать набор всех незаменимых аминокислот (валин, лейцин, изолейцин, треонин, метионин, лизин, аргинин, гистидин, триптофан, фенилаланин).
- соотношение между аминокислотами должно быть близким к соотношению их в тканевых белках
- хорошо перевариваться в желудочно-кишечном тракте
Этим требованиям в большей степени отвечают белки животного происхождения. Для новорожденных все белки должны быть полноценными (белки грудного молока). В возрасте 3-4 года около 70-75% должно приходиться на полноценные белки. Для взрослых людей их доля должна составлять около 50%.
Переваривание белков
Переваривание белков происходит в желудке и в тонком кишечнике Переваривание белков в желудочно-кишечном тракте имеет ряд особенностей:
- протеолитические ферменты выделяются в неактивном состоянии (защитный механизм от переваривания тканевых белков)
- их активирование происходит в просвете желудочно-кишечного тракта путём частичного протеолиза
- протеазы желудочно–кишечного тракта отличаются субстратной специфичностью, могут относиться или к эндопептидам, или экзопептидазам
В желудке основным ферментом, расщепляющим белки, является пепсин. Он выделяется в неактивном состоянии в виде профермента пепсиногена. Под действием HCl происходит частичный протеолиз пепсиногена и превращение его в активную форму пепсин. При частичном протеолизе происходит изменение структуры фермента, обнажение его активного центра.
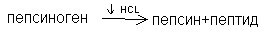
Пепсин относится к эндопептидазам, разрывает внутренние пептидные связи в белках, образованные тирозином, фенилаланином.
Роль HCl в переваривании белков:
- специфичный активатор пепсиногена
- обеспечивает оптимум рН для пепсина (рН = 1-2)
- вызывает частичную денатурацию белка
- является бактерицидным барьером
Слизистая желудка имеет целый ряд защитных механизмов от агрессивного действия пепсина и соляной кислоты:
- выработка слизи (основной её компонент гликозаминогликаны)
- выделение пепсина в неактивном состоянии
- выделение бикарбонатов, нейтрализующих HCl
У детей процессы переваривания белков в желудке менее активны, чем у взрослых, так как снижена активность пепсина и продукция соляной кислоты. У грудных детей в желудке кроме пепсина в переваривании белков участвуют ферменты химозин (фермент, створаживающий молоко), гастриксин (оптимум рН 4-5), катепсины, а также протеазы грудного молока. В желудке происходит частичное переваривание белков до пептидов.
Дальнейшее переваривание белков осуществляется в тонком кишечнике под действием ферментов поджелудочной железы и собственных ферментов слизистой оболочки кишечника. К ферментам поджелудочной железы относятся трипсин, химотрипсин, эластаза, карбоксипептидазы. Трипсин выделяется поджелудочной железой в неактивном состоянии в виде трипсиногена,
который активируется ферментом энтеропептидазой (энтерокиназой), вырабатываемой слизистой кишечника. Активация трипсиногена происходит путём частичного протеолиза с отщеплением 6 аминокислот и освобождением активного центра. В активном центре трипсина в зоне связывания преобладают кислые аминокислоты (глю, асп), поэтому трипсин расщепляет в пищевых белках пептидные связи, образованные лизином и аргинином. Трипсин, в свою очередь, активирует другие протеолитические ферменты. Химотрипсин вырабатывается в неактивном состоянии в виде химотрипсиногена, активируется трипсином путём частичного протеолиза. Химотрипсин относится к эндопептидазам, содержит в активном центре гидрофобные аминокислоты, расщепляет в белках связи, образованные ароматическими аминокислотами (фенилаланин, тирозин). Эластаза образуется из проэластазы под действием трипсина путём частичного протеолиза. В активном центре эластазы преобладает аминокислоты с разветвлённым радикалом, поэтому она расщепляет в белках связи, образованные глицином, не содержащим радикала. Карбоксипептидазы относятся к экзопептидазам, отщепляют от белков концевые аминокислоты. Карбоксипептидазы «А» отщепляют С-концевые ароматические аминокислоты (фенилаланин, тирозин, карбоксипептидазы «В» отщепляют С-концевые аминокислоты лизин и аргинин.
К ферментам кишечника относятся аминопептидазы и дипептидазы. Аминопептидазы – экзопептидазы, отщепляют N-концевые аминокислоты. К аминопептидазам относится, в частности, лейцинаминопептидаза (ЛАП). Дипептидазы кишечника расщепляет дипептиды. В тонком кишечнике происходит полное гидролитическое расщепление пищевых белков до аминокислот. Образовавшиеся аминокислоты подвергаются всасыванию. У детей снижена активность протеолитических ферментов слизистой кишечника и поджелудочной железы.
Всасывание аминокислот
Всасывание аминокислот представляет собой активный Na-зависимый процесс, требующий затрат энергии АТФ. Перенос отдельных аминокислот осуществляется специальными переносчиками. У детей могут всасываться не только аминокислоты, но также пептиды и низкомолекулярные белки. Это, с одной стороны обеспечивает поступление в организм ребёнка иммуноглобулинов, антител грудного молока. С другой стороны, может вызывать аллергические реакции.
Гниение белков в толстом кишечнике
Процессу гниения в толстом кишечнике под действием ферментов гнилостной микрофлоры подвергаются не полностью расщепившиеся белки и отдельные аминокислоты. При гниении белков образуется большое количество газообразных и негазообразных нередко токсичных веществ. К продуктам гниения белков относятся CO2, CH4, NH3, H2S, меркаптаны, альдегиды, кетоны, карбоновые кислоты, диамины, вещества циклической структуры.
Диамины образуются при декарбоксилировании диаминокислот лизина и орнитина
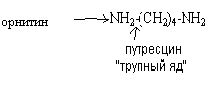
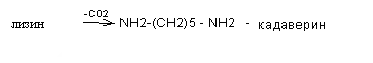
Диамины могут выводиться из кишечника или обезвреживаться в печени
При гниении белков могут образовываться токсичные циклические продукты. Гниение тирозина ведёт к появлению крезола и фенола, гниение триптофана сопровождается образованием скатола и индола.
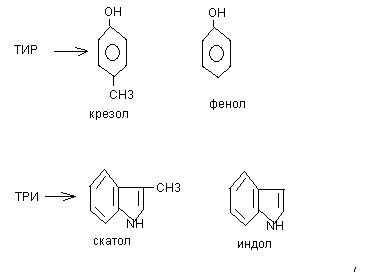
Продукты гниения белков чрезвычайно токсичны, по системе vena porta, они поступают в печень, где подвергаются процессам обезвреживания.
Обезвреживание продуктов гниения белков в печени
Выделяют несколько вариантов обезвреживания в печени токсичных продуктов гниения белков.
- синтез нетоксичной мочевины из чрезвычайно токсичного NН3
- микросомальное окисление токсичных веществ при участии ферментов мооксинегаз. В результате процесса гидроксилирования происходит снижение токсичности, повышается водорастворимость, повышается реакционная способность обезвреживаемого вещества.
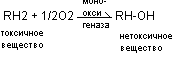
- образование парных нетоксичных соединений путём присоединения к обезвреживаемым продуктам Н2SО4 , глюкуроновой кислоты, глицина.
Серная кислота в процессах обезвреживания участвует в активной форме ФАФС – фосфоаденозилфосфосульфат (состав: аденин – рибоза – фосфат – сульфат - фосфат).
Калиевая соль индоксилсерной кислоты называется индиканом, выводится через почки. Повышенное количество индикана в моче свидетельствует об усилении гнилостных процессов.
Глюкуроновая кислота в процессах детоксикации участвует в активной форме в виде УДФ-глюкуроновой кислоты (состав: урацил-рибоза-фосфат-фосфат-глюкуроновая кислота)

Глицин, взаимодействуя с бензойной кислотой, образует гиппуровую кислоту.
На этой реакции основана проба Квика для оценки антитоксической функции печени. Антипириновая проба характеризует активность микросомального окисления в печени.
У новорожденных детей гнилостные процессы отсутствуют. У взрослых усиление гнилостных процессов наблюдается при снижении активности протеолитических ферментов желудка и кишечника, при снижении моторики кишечника, дисбактериозах.
Динамическое состояние белков в тканях организма
Белки тканей организма постоянно обновляются, то есть подвергается распаду, и постоянно замещаются вновь синтезированными белками. Период полуобмена белков в таких тканях как кровь, слизистая кишечника, печень составляет приблизительно 10 дней. В таких тканях, как кожа, мышцы период полуобмена белков более продолжителен,
Распад тканевых белков (катаболизм) осуществляют особые тканевые протеолитические ферменты катепсины. Выделяют несколько их видов, которые обозначают буквами А, В, Д, Н, N. Катепсины локализованы как в лизосомах, так и в цитозоле. Лизосомальные катепсины называются кислыми катепсинами, так как оптимум рН для них равен 4,5-5,5. Катепсины могут относиться как к эндопептидазам, так и к экзопептидазам. В активном центре катепсинов могут присутствовать цистеин, аспарагиновая кислота, серин. Например, катепсин Д по своему действию аналогичен пепсину желудочного сока, катепсин Н активен в печени, катепсин N обладает коллагенолитической активностью.
Биологическая роль катепсинов:
- участвуют в обновлении тканевых белков
- разрушают дефектные, денатурированные белки. Обычно эти белки вначале соединяются с особым белком убиквинтином, после чего разрушаются катепсинами
- реконструктивная функция – катепсины переводят неактивные формы белков в активные белки.
- при голодании, кровопотере, интоксикации катепсины обеспечивают мобилизацию белков из условных депо белков (плазма крови, мышцы, печень).
В ткани всегда существует определённый запас аминокислот. Он поддерживается на достаточно постоянном уровне благодаря сбалансированности путей образования и использования аминокислот.
Пути пополнения запаса тканевых аминокислот:
- аминокислоты, всосавшиеся из кишечника в результате переваривания пищевых белков (1/3 фонда)
- аминокислоты, образовавшиеся при распаде тканевых белков
- синтез в тканях заменимых кислот
Одной из транспортных систем аминокислот в ткани является система, в которой участвуют трипептид глютатион (глю-гли-цис) и фермент - глютамилтранспептидаза. Аминокислота, подвергающаяся всасыванию, связывается со свободной - карбоксильной группой глютаминовой кислоты глютатиона. Затем этот комплекс распадается с освобождением глютамата. Эта транспортная система активна в отношении аминокислот цистеина, серина, треонина
Пути расходования аминокислот в тканях:
- синтез тканевых белков и пептидов
- образование небелковых N-содержащих веществ (пуриновые основания, креатинин, биогенные амины)
- использование на энергетические нужды
- расходование на синтез углеводов (глюконеогенез)
- образование из аминокислот некоторых метаболитов липидного обмена (кетоновые тела)
Катаболизм аминокислот условно делят на общие реакции (происходят в отношении радикала, аминогрупп, карбоксильных групп) и специфические реакции.
Катаболизм аминогруппп аминокислот.
Трансаминирование аминокислот
Начальным процессом деградации аминогрупп является процесс трансаминирования. Трансаминирование - ферментативный процесс переноса NН2 - группы с аминокислоты на альфа - кетокислоту при участии ферментов трансаминаз и витамина В6. В процесс трансаминирования могут включаться все аминокислоты. В качестве альфа-кетокислот, чаще используется пировиноградная, щавелевоуксусная и альфа - кетоглютаровая кислота.
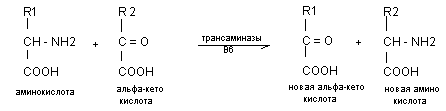
Наиболее активными тканевыми аминотрансферазами являются аланинаминотрансфераза (АлАТ) или глютамикопировиноградная трансаминаза (ГПТ) и аспарагиновая трансаминаза (АсАТ) или глютамикощавелевоуксусная трансаминаза (ГЩТ).
Витамин В6, пиридоксин, адермин
Коферментом аминотрансфераз является витамин В6, участвующий в трансаминировании в 2-х формах:
Витамин В6 распространён в злаках, дрожжах. Суточная потребность в нём составляет 2 мг. Биологическая роль: кофермент реакций трансаминирования и декарбоксилирования аминокислот. Авитаминоз проявляется дерматитом, дегенерацией в нервной системе, демиелинизацией нервных стволов
Биологическое значение реакций трансаминирования заключается в следующем:
- происходит потеря аминогрупп от аминокислоты без выделения токсичного NH3
- возможность последующего включения безазотистого остатка аминокислот в цикл Кребса с выделением энергии
- способ синтеза новых заменимых аминокислот в тканях (ПВК –> ала, ЩУК –> асп, альфа - кетоглютаровая кислота –> глю)
- определение активности трансаминаз имеет важное диагностическое значение, так как в разных тканях преобладает активность определённых трансаминаз. В сердечной мышце высока активность аспартатаминотрансферазы, в печени - аланинаминотрансферазы. Нередко определяют коэффициент Де Ритиса = АсАт/АлАТ = 1,33. При инфаркте миокарда этот коэффициент увеличивается, при заболеваниях печени снижается.
Дезаминирование аминокислот
В тканях различают несколько вариантов дезаминирования: окислительное, непрямое, внутримолекулярное дезаминирование.
Окислительное дезаминирование
Окислительное дезаминирование – это ферментативный процесс отщепления NН2 – группы от аминокислоты после предварительного окисления аминокислоты. В окислительном дезаминировании участвуют ферменты:
- L - аминокислотоксидазы – флавиновые кислоты, имеющие ФМН в качестве ко-ферментов. Эти ферменты в тканях малоактивны, поскольку их оптимум рН = 10
- D - аминокислотоксидазы – флавиновые ферменты, использующие ФАД в качестве коферментов
- глютаматдегидрогеназа – НАД (НАДФ) - зависимый аллостерический, олигомерный фермент. Он обладает высокой активностью в процессе окислительного дезаминирования глютаминовой кислоты.
- Глициноксидаза
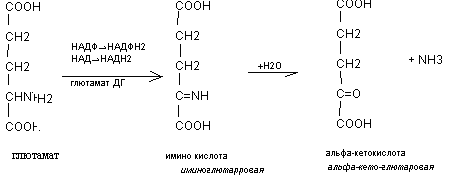
Биологическое значение реакций окислительного дезаминирования состоит в том, что эта реакция позволяет аминокислотам освобождаться от аминогруппы и, переходя в альфа - кетокислоту, включатся в цикл Кребса.
Непрямое дезаминирование
В тканях для большинства аминокислот реакции трансаминирования и окислительного дезаминирования тесно друг с другом связаны и получили название
непрямого дезаминирования. Так как возможности окислительного дезаминирования большинства аминокислот очень малы, вначале они вступает в реакцию трансаминирования с альфа - кетоглютаровой кислотой. Образовавшаяся глютаминовая кислота активно подвергается окислительному дезаминированию под действием глютамат - ДГ.
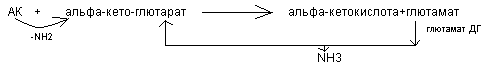
Около 1/3 аминокислот включается в непрямое дезаминирование.
Внутримолекулярное дезаминирование.
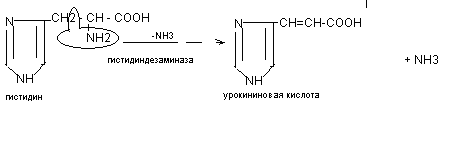
В процесс внутримолекулярного дезаминирования чаще других аминокислот вступает гистидин, серин, треонин, цистеин. Например, из гистидина происходит выделение NН3 за счёт внутримолекулярной перестройки с образованием уроканиновой кислоты:
Серин в результате внутримолекулярного дезаминирования переходит в пировиноградную кислоту
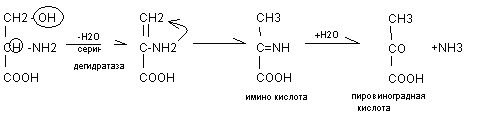
У детей процессы трансаминирования и дезаминирования идут более активно, чем у взрослых.
Катаболизм карбоксильных групп аминокислот.
Декарбоксилирование аминокислот. Биогенные амины
Катаболизм карбоксильных групп аминокислот осуществляется путём декарбоксилирования аминокислот. Декарбоксилирование аминокислот – ферментативный процесс отщепления СО2 из СООН - групп аминокислот с образованием аминов.
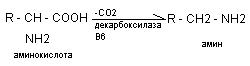
Наиболее активно в процесс деркарбоксилирования включаются аминокислоты гистидин, тирозин, глютамат, триптофан. Образующиеся амины называются биогенными аминами, поскольку они, как правило, обладают высокой физиологической, биохимической активностью, влияют на тонус сосудов, являются нейромедиаторами, участвуют в воспалительных реакциях. К основным биогенным аминам относятся гистамин, серотонин, катехоламины, гамма-аминомасляная кислота, полиамины.
Гистамин образуется при декарбоксилировании аминокислоты гистидина. Он синтезируется в тучных клетках, накапливается в секреторных гранулах, выделяется при раздражении клеток.
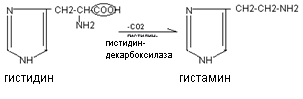
Гистамин оказывает разнообразные биологические эффекты: вызывает расширение сосудов, снижает артериальное давление, увеличивает тканевую проницаемость, вызывает местный отёк, стимулирует желудочную секрецию, обладает бронхоспатическим эффектом. В высокой концентрации он является медиатором воспалительных и аллергических реакций.
Серотонин образуется при декарбоксилировании гидрокситриптофана. Он синтезируется в хромаффиннных клетках, в некоторых ядрах подкорковых структур, тромбоцитах.
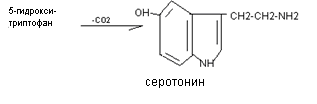
Эффекты серотонина: вызывает спазм сосудов, повышение артериального давления, стимулирует перистальтику кишечника, участвует в терморегуляции, в механизмах сна, является источником для синтеза гормона мелатонина, влияет на психические реакции человека. Так, при шизофрении наблюдается нарушение обмена серотонина.
Катехоламины (дофамин, адреналин, норадреналин) синтезируются из аминокислоты тирозина.
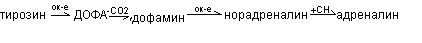
Дофамин – возбуждающий медиатор, при его дефиците развивается болезнь Паркинсона (адинамия, ригидность, тремор). Адреналин вызывает спазм сосудов, повышают артериальное давление, стимулирует работу сердца, является гормоном.
Норадреналин в основном выполняет нейромедиаторные функции.
Гамма-аминомасляная кислота (ГАМК) образуется при декарбоксилировании глютаминовой кислоты, является тормозным медиатором, улучшает кровоснабжение мозга, активирует окислительные процессы в нём.
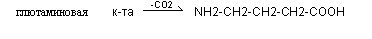
Полиамины (спермин, спермидин) синтезируются из орнитина и метионина, входят в состав хроматина, участвует в регуляции процессов трансляции, транскрипции, репликации.
Так как биогенные амины очень активны, они быстро инактивируются в тканях. Распад биогенных аминов осуществляется несколькими способами: окисление, метилирование, дезаминирование. Основным способом инактивации биогенных аминов является окислительное дезаминирование под действием ферментов аминооксидаз (моноаминооксидаз, полиаминооксидаз).
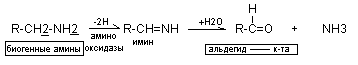
Ингибиторы МАО применяются в качестве терапевтических средств.
Образование и обезвреживание аммиака в организме
Аммиак образуется в результате дезаминирования таких веществ как аминокислоты, амины, пуриновые и пиримидиновые нуклеотиды.
Аммиак чрезвычайно токсичное вещество. Токсичность аммиака объясняется многими его эффектами, главными среди которых является связывание альфа-кетокислот и блокирование включения их в цикл Кребса, что нарушает энергетический обмен в тканях. Аммиак может нарушать обмен глютамата и глютамина в ткани мозга, вызывать повышение концентрация глютамата до токсичных концентраций. Кроме того, аммиак вызывает защелачивание в тканях и нарушает транспорт ионов Na+ и Са2+. В связи с этим концентрация аммиака в тканях и в крови поддерживается на очень низком уровне. В плазме крови она составляет 20-80 мкмоль/л. Эта низкая концентрация обеспечивается наличием в организме различных путей связывания (обезвреживания) аммиака. Эти способы можно разделить следующим образом:
- временные пути (протекают в тканях)
- восстановительное аминирование альфа-кетокислот
- амидирование белков
- синтез глютамина
- амидирование белков
- восстановительное аминирование альфа-кетокислот
- образование конечных продуктов азотистого обмена
- соли аммония
- мочевина
- соли аммония
Пути временного (экстренного) связывания аммиака в тканях
Восстановительное аминирование альфа-кетокислот
Восстановительное аминирование альфа-кетокислот заключается в присоединении аммиака к альфа - кетокислоте с одновременным её восстановлением с образованием аминокислоты. В качестве альфа-кетокислот чаще используются пировиноградная кислота, которая восстанавливается в аланин, щавелевоуксусная, переходящая в аспарагиновую кислоту и альфа - кетоглютаровая кислота, восстанавливающаяся в глютаминовую кислоту.
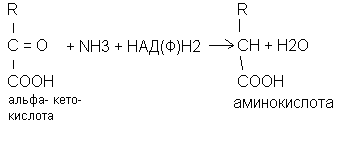
Биологическое значение восстановительного аминирования кетокислот:
- способ быстрого связывания аммиака
- способ синтеза новых заменимых аминокислот
Амидирование тканевых белков.
Амидирование тканевых белков заключается в присоединении аммиака к карбоксильным группам радикалов аспарагиновой, глютаминовой аминокислот и к альфа - концевым карбоксильным группам.
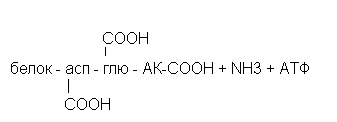
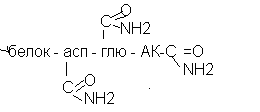
Амидирование белков сопровождается определёнными изменениями их структуры и физико-химических свойств.
Синтез глютамина
В процессе синтеза глютамина происходит амидирование карбоксильной группы свободной глютаминовой кислоты. Эта реакция ведёт к переходу аммиака в его нетоксичную транспортную форму - глютамин, в виде которой аммиак из тканей переносится в печень и почки. Глютамин может поступать в ткани, где он служит источником азота для синтеза аминосахаров, пуриновых пиримидиновых нуклеотидов.
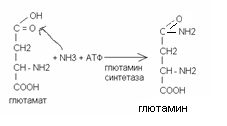
У детей синтез глютамина и его использование протекает более активно, чем у взрослых. Глютамин транспортирует аммиак в печень и почки, где образуются конечные продукты азотистого обмена: аммонийные соли и мочевина.
Конечные продукты азотистого обмена
Синтез аммонийных солей в почках
В почках под действием активного фермента глютаминазы происходит гидролитическое расщепление глютамина на глютаминовую кислоту и аммиак.
В почках при выведении протонов происходит одновременная реабсорбции ионов Nа+ и К+. Таким образом, глютаминаза почек участвует в регуляции кислотно-основного баланса.

Активность глютаминазы зависит от рН. При ацидозе активность фермента возрастает, что увеличивает выведение протонов и снижает степень ацидоза.
У взрослых за сутки выделяется 0,5-1,2 аммонийных солей. На них приходится 3,5% выводимого азота. У детей относительная доля аммонийных солей выше, чем у взрослых. У новорожденных азот аммонийных солей составляет до 8,5%.
Биосинтез мочевины.
Глютамин поступает в печень, где под действием фермента глютаминазы высвобождается аммиак, который превращается в мочевину. В синтезе мочевины участвует аминокислота орнитин, поэтому синтез мочевины называют орнитиновым циклом.
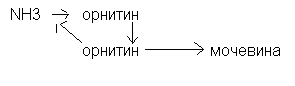
Наиболее активно процесс синтеза мочевины протекает в печени.
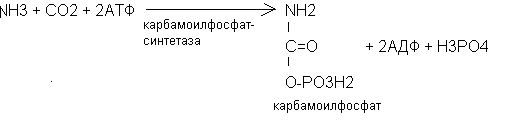
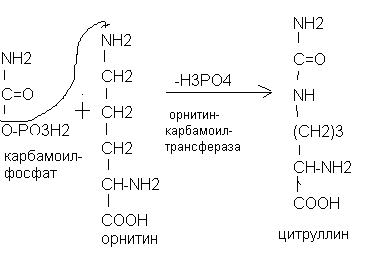
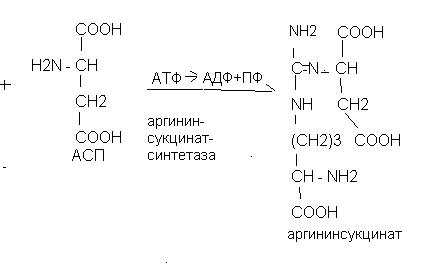
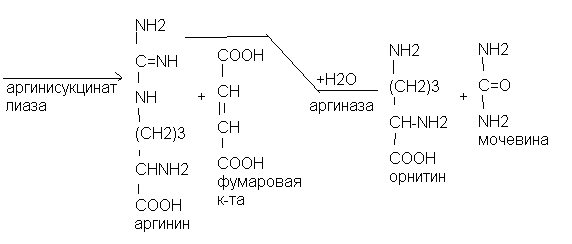
Ключевыми ферментами биосинтеза мочевины являются карбамоилфосфатсинтетаза, ортиникарбамоилтрансфераза и аргиназа. Источниками азота в мочевине являются аммиак и аспарагиновая кислота. Орнитиновый цикл тесно связан с циклом Кребса. Фумаровая кислота из орнитинового цикла «уходит» в цикл Кребса. Цикл трикарбоновых кислот, в свою очередь, обеспечивает орнитиновый цикл молекулами АТФ.
У здорового взрослого человека за сутки образуется 20-40 г мочевины, на азот которой приходится до 90% выводимого азота. У детей синтез мочевины менее активен, чем у взрослых, что связано с меньшей активностью ферментов печени. У новорожденных экскретируется около 1 г мочевины, на азот которой приходится 75% выводимого азота, к возрасту 1 года синтезируется около 4 г мочевины.
Особенности выведения конечных азотистых продуктов.
|
Взрослые |
Дети |
|
|
Мочевина NH4 - соли Мочевая кислота |
90% 3,5 1,5% |
75% 8,5% 8,5% Больше азота аминокислот и креатинина |
В детском возрасте могут выявляться нарушения синтеза мочевины. Они проявляются рвотой, судорогами после приёма белковой пищи. Симптомы интоксикации уменьшаются при дробном белковом питании. Нарушения мочевинообразования связаны с отсутствием или низкой активности ферментов, участвующих в этом процессе.
Аферментозы биосинтеза мочевины
|
Отсутствующий фермент Заболевание |
|
Карбамаилфосфатсинтетаза Гипераммониемия I типа. |
|
Орнитинкарбамоилтрансфераза Гипераммониемия II типа |
|
Аргининсукцинатсинтетаза Цитруллинемия |
|
Аргининсукцинатлиаза Аргининсукцинатурия |
|
Аргиназа Аргининемия. |
В мышцах происходит своеобразное связывание аммиака – аланиновый цикл
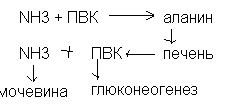
Обмен безазотистых радикалов аминокислот
Безазотистые радикалы аминокислот могут использоваться следующим образом:
- участвуют в синтезе новых аминокислот
- используются на синтез углеводов
- используются на синтез кетоновых тел
- в виде альфа-кетокислот включаются в цикл Кребса и используются как источники энергии
В зависимости от того, какие вещества могут синтезироваться из аминокислот,
они делятся на 3 группы.
- Гликогенные аминокислоты, радикал которых может использоваться на глюконеогенез. К этой группе относится большинство аминокислот.
- Кетогенные аминокислоты, радикал которых участвует в синтезе кетоновых (ацетоновых) тел. К этому виду аминокислот относятся лейцин, изолейцин, триптофан, лизин.
- Смешанные аминокислоты, участвующие в синтезе и углеводов, и ацетоновых тел. В эту группу входят фенилаланин, тирозин
Все 20 аминокислот в процессе катаболизма превращаются в 7 безазотистых продуктов: пируват, щавелевоуксусная кислота (оксалацетат), альфа - кетоглютаровая кислота, фумаровая кислота, сукцинил-КоА, ацетил-КоА (эти вещества в последующем могут идти на синтез углеводов), ацетоацетил - КоА (используется на синтез ацетоновых тел, также как и ацетил КоА).
Особенности обмена отдельных аминокислот
Обмен глицина и серина.
Глицин и серин являются источниками одноуглеродных радикалов.
Глицин – заменимая аминокислота. Она широко используется в тканях в следующих процессах:
- синтез гема
- синтез креатина
- синтез пуриновых нуклеотидов
- входит в состав глютатиона
- участвует в процессах детоксикации
- переходит в углеводы через образование пирувата
- служит источником метиленового радикала (СН2 =)
Метиленовый радикал используется для биосинтетических процессов в комплексе с активной формой фолиевой кислоты - тетрагидрофолевой кислотой (ТГФК). Основная реакция распада глицина, ведёт к образованию метилен - ТГФК
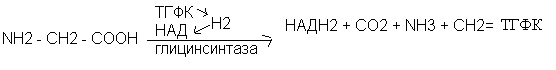
Серин – заменимая аминокислота. Используется в многочисленных биосинтетических процессах:
- синтез фосфолипидов (фосфатидилсерин)
- синтез сфингозина и сфинголипидов
- источник метиленового радикала
- переходит в углеводы через стадию образования пирувата
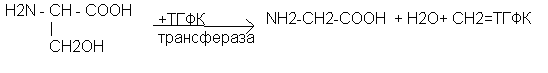
Витамин Вс, В9, фолиевая кислота, антианемический витамин
Фолиевая кислота включает в свой состав птеридин, парааминобензойную кислоту, глютаминовую кислоту. Она содержится в зелёных частях растений, в дрожжах. Суточная потребность в ней составляет до 2 мг. Биологическая роль: в виде ТГФК является переносчиком одноуглеродных радикалов от серина и глицина, использующихся для синтеза нуклеиновых кислот, аминокислот. Фолиевая кислота переходит в ТГФК при участии фермента фолатредуктазы с присоединением 4-х атомов водорода. В клинической практике в качестве противоопухолевых препаратов используют антивитамииы фолиевой кислоты, которые имеют структуру близкую к птеридину и являются ингибиторами фолатредуктазы, вследствие чего блокируют синтез нуклеиновых кислот в опухолях. В качестве бактериостатических препаратов применяют сульфаниламидные соединения, имеющие структуру, сходную с парааминобензойной кислотой. В силу этого сульфаниламиды блокируют в микроорганизмах синтез фолиевой кислотой, которая является фактором роста микроорганизмов. Авитаминоз фолиевой кислоты проявляется в виде анемии.
Обмен серосодержащих аминокислот цистеина и метионина
Цистеин и метионин являются источником: серы и метильных групп.
Цистеин при окислении, декарбоксилировании, трансаминировании переходит в таурин и серную кислоту, входит в состав глютатиона, через стадию пирувата может использоваться для синтеза углеводов.
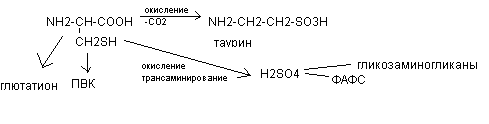
Таурин используется на синтез парных жёлчных кислот и участвует в развитии нейросетчатки, головного мозга у плода и в раннем детском возрасте. Образующаяся серная кислота используется на синтез кислых гликозаминогликанов. В активной форме в виде ФАФС она участвует в обезвреживании токсичных продуктов в печени
Метионин - незаменимая аминокислота, донатор метильных групп в реакциях метилирования.
В реакциях трансметилирования метионин участвует в активной форме – S+-(СН3) - аденозилметионин (SАМ), образующийся при взаимодействии метионина с АТФ.
Общая схема реакции метилирования различных веществ (R) с участием фермента метилтрансферазы имеет вид:
S+ (СН3) - аденозилметионин + R R-СН3 + аденозилгомоцистеин
Примеры:
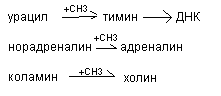
Метионин используется в многочисленных биосинтетических процессах:
- синтез холина
- синтез тимина, с последующим включением его в ДНК
- синтез адреналина
- синтез карнитина – переносчика жирных кислот при их бета окислении
- синтез креатина – азотистого вещества мышц
- реакции обезвреживания
- донор серы
В реакции метилирования аденозилметионин, отдавая СН3 –радикал, превращается в аденозилгомоцистеин, который затем распадается на аденозин и гомоцистеин. В последующем гомоцистеин может дальше превращаться 2 способами: при взаимодействии с серином переходит в цистеин или при участии ТГФК и вит. В12 реметилируется в метионин
Витамин В12, кобаламин, антианемический витамин
Витамин В12 содержит корриновое кольцо с кобальтом в центре. Он содержится в печени, мясе. Суточная потребность в витамин В12 составляет 3 мкг. Биологическая роль:
- участвует в синтезе метионина (реметилирование)
- участвует в распаде жирных кислот с нечётным числом углеводных атомов
- участвует в восстановлении рибонуклеотидов до дезоксирибонуклеотидов
Авитаминоз проявляется анемией и поражением некоторых структур спинного мозга.
Нарушение обмена серосодержащих аминокислот
Цистинурия – заболевание, при котором серосодержащие аминокислоты теряются с мочой в результате нарушения реабсорбции в почках
Цистиноз – накопление серосодержащих аминокислот в тканях в результате снижения активности лизосомальных ферментов их распада
Гомоцистинурия – патологическое состояние, при котором с мочой выделяется гомоцистеин в результате нарушения промежуточных стадий обмена серосодержащих аминокислот. Накапливающиеся в литературе данные свидетельствуют о том, что гомоцистеин играет существенную роль в патогенезе сердечно-сосудистых заболеваний, тромбозов.
Обмен фенилаланина и тирозина
Фенилаланин – незаменимая аминокислота. Основной реакцией превращения фенилаланина в организме является окисление его в тирозин при участи фермента фенилаланингидроксилазы и кофермента тетрагидробиоптерина. При врожденном дефекте данного фермента развивается заболевание фенилкетонурия, при котором фенилаланин переходит в токсичные для ткани мозга соединения фенилпируват, фенилацетат. А возникающий дефицит тирозина блокирует синтез нейромедиаторов. Фенилкетонурия сопровождается развитием слабоумия (фенилпировиноградная олигофрения).
Тирозин – заменимая аминокислота. Она используется на синтез многих важных веществ:
- синтез тироксина (гормона щитовидной железы)
- путём окисления переходит в диоксифенилаланин (ДОФА), который затем в коже используется для синтеза меланинов, а в эндокринной системе – для синтеза норадреналина, адреналина, дофамина (катехоламины)
- путём трансаминирования превращается в фумаровую кислоту, которая используется для синтеза углеводов, и в ацетоуксусную кислоту, идущую на синтез ацетоновых тел.
Окисление тирозина
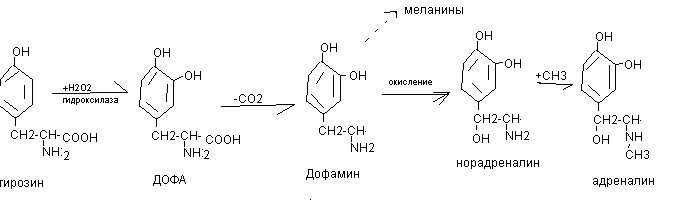
При нарушении активности ферментов синтеза меланинов развивается альбинизм, при котором снижается фотопротекторная, антиоксидантная, иммуномодулирующая функция меланинов.
Трансаминирование тирозина
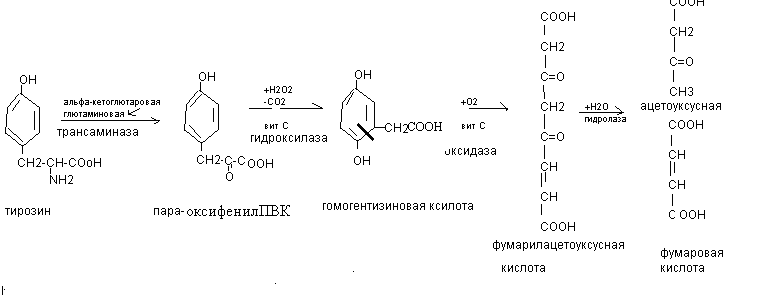
При врожденном дефекте трансаминазы, гидроксилазы, гидролазы развиваются различные виды тирозинозов. При отсутствии оксидазы гомогентизиновой кислоты наблюдается алкатонурия, характеризующаяся повышенным выделением с мочой гомогентизиновой кислоты, которая при контакте с воздухом переходит в продукты тёмного цвета.
Регуляция белкового обмена
Авторегуляция проявляется в том, что при увеличении в рационе белковой пищи происходит постепенная активация ферментов желудочно – кишечного тракта, активация тканевых ферментов, участвующих в катаболизме белков и аминокислот.
Нервная регуляция подтверждается тем, что денервация мышечной ткани резко снижает синтез белков в ней, а при интенсивной мышечной работе происходит усиление синтеза мышечных белков.
Эндокринная регуляция осуществляется при участии гормонов гипофиза, щитовидной, поджелудочной, половых желез, надпочечников. К гормонам, которые уменьшают распад тканевых белков и активируют их синтез, относятся соматотропин, физиологические концентрации гормонов щитовидный, андрогены, инсулин. Распад тканевых белков активируют высокие концентрации гормонов щитовидной железы. В соединительной, лимфоидной ткани распад белков усиливают глюкокортикоиды.
У новорожденных развивается физиологическая транзиторная гипопротеинемия - снижение концентрации белка в плазме крови. Она связана с усиленным распадом белков и использованием их на энергетические нужды в период неонатальной адаптации.
Патология белкового обмена
Нарушение обмена серосодержащих аминокислот: смотри обмен серосодержащих аминокислот
Нарушение обмена фенилаланина, тирозина: смотри обмен фенилаланина и тирозина
Нарушение синтеза мочевины: смотри биосинтез мочевины
Белковое голодание может наблюдаться при недостатке белков в рационе, недостатке витаминов, заболеваниях желудочно–кишечного тракта. При белковом голодании усиливается распад собственных тканевых белков, особенно в таких тканях как мышцы, печень и плазма крови. Развивается отрицательный азотистый баланс, дистрофия мышц, нарушение антитоксической функции печени, гипопротеинемия и как следствие, «голодные» отёки. Происходит уменьшение подкожной клетчатки, страдают иммунные процессы. Тяжелая форма белкового голодания носит название квашиоркор (красный ребёнок).
Литература
Биологическая химия с упражнениями и задачами. - М.: ГЭОТАР-Медиа, 2011
Олейникова И.И.: Биохимия. - М.: НОУДПО "Институт АйТи", 2011
Тюкавкина Н.А.: Биоорганическая химия. - М.: ГЭОТАР-Медиа, 2011
Лось Д.А.: Сенсорные системы цианобактерий. - М.: Научный мир, 2010
под ред. Е.С. Северина ; рец.: А.А. Терентьев, Н.Н. Чернов: Биохимия с упражнениями и задачами. - М.: ГЭОТАР-Медиа, 2010
под ред. Н.А. Тюкавкиной: Биоорганическая химия. - М.: ГЭОТАР-Медиа, 2010
Пустовалова, Л.М.: Основы биохимии для медицинских колледжей. - Ростов н/Д: Феникс, 2010
Пустовалова, Л.М.: Основы биохимии для медицинских колледжей. - Ростов н/Д: Феникс, 2010
РАН, Институт физиологии растений им. К.А. Тимирязева ; отв. ред.: Н.В. Загоскина, Е.Б. Бурлакова ; рец.: С.Д. Варфоломеев, Н.А. Тюкавкина: Фенольные соединения. - М.: Научный мир, 2010
Сисакян Н.М.: Проблемы биохимии и космической биологии. - М.: Наука, 2010
сост.: Л.Ю. Фролова и др.: Лев Львович Кисилев. - М.: ИПО "У Никитских ворот", 2010
Тюкавкина Н.А.: Биоорганическая химия. - М.: Дрофа, 2010
Шимановский Н.Л.: Молекулярная и нанофармакология. - М.: ФИЗМАТЛИТ, 2010
Антина Е.В.: Химия билирубина и его аналогов. - М.: КРАСАНД, 2009
Под ред. Е.С. Северина ; Рец.: Д.М. Никулина и др. ; Авт. кол.: Л.В. Авдеева и др.: Биохимия. - М.: ГЭОТАР-Медиа, 2009
под ред. Н.А. Тюкавкиной: Биоорганическая химия. - М.: ГЭОТАР-Медиа, 2009
под ред. Н.И. Ковалевской ; Ю.Б. Филиппович и др. ; рец.: И.Г. Горичев, Г.И. Ушакова : Биологическая химия. - М.: Академия, 2009
ОБМЕН БЕЛКОВ