ОБМЕН И ФУНКЦИИ НУКЛЕИНОВЫХ КИСЛОТ
Реферат
ОБМЕН И ФУНКЦИИ НУКЛЕИНОВЫХ КИСЛОТ
Нуклеиновые кислоты – высокомолекулярные полимерные соединения, мономером которых являются мононуклеотиды.
Мононуклеотиды включают в свой состав три вещества: азотистое основание, углевод (рибоза или дезоксирибоза), фосфорную кислоту. Различают 2 вида азотистых оснований: пуриновые (производные пурина) и пиримидиновые (производные пиримидина).
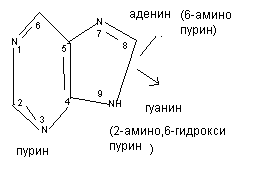

Азотистые основания соединяются с углеводом - N- гликозидной связью. Пуриновое основание соединяется с углеводом за счёт 9 атома азота, а пиримидиновое - за счёт 1 атома азота. К углеводу фосфоэфирной связью присоединяется фосфорная кислота.
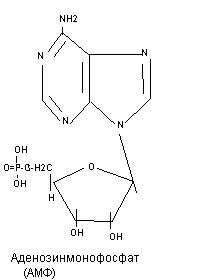
В зависимости от количества остатков фосфорной кислоты различают нуклеозидмонофосфаты (цикло-АМФ, ФАФС, S-аденозилметионин), нуклеозиддифосфаты (УДФ-глюкоза, ЦДФ-холин), нуклеозидтрифосфаты (макроэрги).

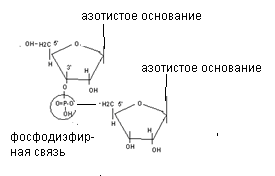
Нуклеотиды соединяются в полинуклеотидную цепь фосфодиэфирными связями, образованными фосфорной кислотой и рибозой соседних нуклеотидов (к рибозе одного нуклеотида фосфорная кислота присоединяется в третьем положении, а к рибозе соседнего нуклеотида - в пятом положении).
Рибонуклеиновые кислоты (РНК)
Все виды РНК состоят из одной полинуклеотидной цепи. Азотистые основания в РНК представлены аденином, гуанином, урацилом, цитозином. Углевод представлен рибозой. Различают несколько видов РНК.
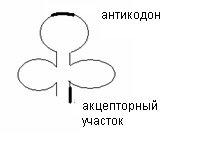
Транспортные РНК (тРНК) осуществляют транспорт аминокислот на рибосомы, к месту синтеза белка. Молекулярная масса тРНК составляет около 30 000 дальтон. Полинуклеотидная цепь тРНК включает в свой состав 70-80 нуклеотидов. На долю тРНК приходится около 15% всего запаса РНК клетки. В тРНК содержится большое количество минорных нуклеотидов. Между комплементарными нуклеотидами участков тРНК возникают водородные связи, и формируется её вторичная структура в виде трилистника (форма «клеверного листа»). В составе тРНК выделяют 2 важных функциональных участка. На средней петле располагается антикодон, комплементарный кодонам иРНК, на открытом конце – акцепторный участок, к которому присоединяется аминокислота. Для переноса каждой аминокислоты в клетках имеется «своя» тРНК.
тРНК имеет 3-ю структуру, которая представляет собой компактное наложение петель друг на друга.
Различают изоакацепторные тРНК, которые переносят одну и ту же аминокислоту, но отличаются одним нуклеотидом в антикодоне.
Рибосомальные РНК (рРНК) составляют до 80% всей РНК клетки. Рибосомальная РНК локализована в рибосомах и обеспечивает биосинтез белка. Рибосома человека имеет молекулярную массу 80S, включает большую субъединицу массой 60S (включает РНК с массой 5S, 5-8S, 25S) и малую субъединицу с массой 40S (включает РНК массой 18S). Вторичная структура рРНК представляет компактную укладку, формирующую овальный каркас большой и малой субъединиц, соединённый с белками.
Информационная РНК (иРНК) имеет большую молекулярную массу около 106 дальтон. На её долю приходится около 3% РНК клетки. В первичной структуре иРНК представлены кодоны, среди которых различают инициирующие (в них первый нуклеотид А), терминирующие (в них первый нуклеотид У) и кодоны, определяющие порядок аминокислот в синтезируемом белке. На одном конце иРНК имеется «шапочка - кеп», необходимая для связывания иРНК с малой субъединицей рибосомы в начале синтеза белка. На другом конце полинуклеотидной цепи располагается полиадениловый «хвост», выполняющий защитную функцию. 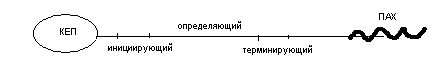
Дезоксирибонуклеиновая кислота
Азотистые основания в ДНК представлены аденином, гуанином, тимином, цитозином, углевод - дезоксирибозой. ДНК играет важную роль в хранении генетической информации. В отличие от РНК в ДНК присутствуют две полинуклеотидные цепи. Молекулярная масса ДНК около 109 дальтон. Полинуклеотидные цепи в молекуле ДНК объединяются по принципу комплементарности, известному как «правила Чаргафа» (1939 г.). Правила Чаргафа включают несколько положений.
- Количество остатков аденина равно количеству остатков тимина (А=Т). Количество остатков гуанина равно количеству остатков цитозина (Г=Ц)
- Сумма пуриновых оснований (А + Г) равна сумме пиримидиновых оснований (Т + Ц)
- В комплементарных позициях количество оснований с аминогруппой равно количеству оснований с кетогруппой (Г + Т = А + Ц)
- Для всех видов ДНК существует коэффициент видовой специфичности – отношение Г + Ц/А + Г < 1
На основании данных правил Уотсон и Крик создали модель структуры ДНК, согласно которой в молекуле ДНК две полинуклеотидные цепи располагаются антипараллельно и соединяются водородными связями между комплементарными азотистыми основаниями. В паре А-Т возникают 2 водородные связи, в паре Г - Ц формируются 3 водородные связи.
Вторичная структура наиболее распространённой В формы ДНК представляет собой правозакрученную двойную спираль, в одном витке которой уложено 10 пар нуклеотидов. Шаг спирали равен 3,4 нм. В фагах присутствует Z форма (зигзагообразная) и кольцевая форма ДНК.
Для ДНК характерна более компактная укладка в виде суперспирали. ДНК формирует надмолекулярную структуру, объединяясь с ядерными белками и формируя полинуклеосомы.
ДНК образует вязкие растворы с двойным лучепреломлением, поглощающие УФЛ в интервале 260-280 нм. Под действием концентрированных растворов кислот, мочевины, физических факторов возможна денатурация ДНК, при которой происходит разрыв водородных связей и расхождение цепей молекулы ДНК. Денатурация может носить обратимый характер и переходить в реактивацию – восстановление водородных связей и структуры ДНК после удаления денатурирующего фактора. При ренативации возможно явление гибридизации – объединение комплементарных молекул ДНК из разных организмов. Возможна гибридизация нитей ДНК с РНК.
Обмен нуклеиновых кислот.
Переваривание нуклеиновых кислот
Нуклеиновыми кислотами богаты мясо, икра, дрожжи. Поджелудочная железа выделяет ферменты РНК - азу и ДНК - азу, которые деполимеризуют нуклеиновые кислоты до нуклеотидов. В кишечном соке содержатся ферменты фосфатазы, нуклеотидазы, нуклезидазы, эстеразы, осуществляющие распад нуклеотидов. Всасыванию подвергаются нуклеозиды, азотистые основания, пентозы и фосфорная кислота.
Распад нуклеиновых кислот в тканях
Распад нуклеиновых кислот в тканях идентичен процессу их переваривания. Углеводы и фосфорная кислота используются стандартно, а азотистые основания подвергаются распаду до конечных продуктов: мочевой кислоты (пуриновые основания) и мочевины (пиримидиновые основания).
Распад пуриновых нуклеотидов
Распад пуриновых оснований происходит путём их гидролитического дезаминирования без разрыва пуринового кольца с образованием мочевой кислоты.
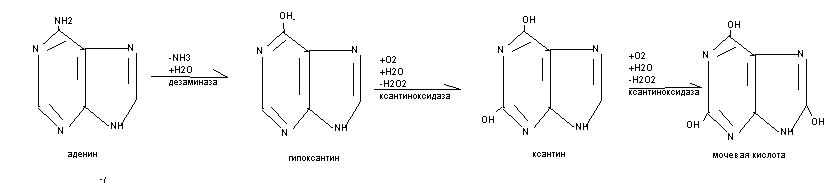
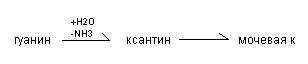
Распад пуриновых оснований происходит не в свободном виде, а в составе нуклеозидов.
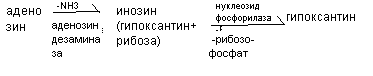
У взрослого человека экскретируется 0,5-1,5 г мочевой кислоты в сутки, азот которой составляет 3,5% всего выводимого азота. У детей относительная доля мочевой кислоты выше, чем у взрослых, на её азот приходится до 8,5%. В крови взрослых людей содержание мочевой кислоты равно 0,1-0,3(0,4) ммоль/л, у детей - до 0,47 ммоль/л. Мочевая кислота является антиоксидантом, в детском возрасте стимулирует развитие головного мозга. Мочевая кислота может присутствовать в тканях и в крови как в свободной форме (плохо растворимой в воде), так и в виде солей (более растворимых в воде). Повышение концентрации мочевой кислоты в крови - гиперурекимия. На её фоне могут развиваться подагра и почечнокаменная болезнь. При подагре кристаллы мочевой кислоты откладываются в околосуставных тканях в виде подагрических узлов. При почечнокаменной болезни кристаллы мочевой кислоты формируют камни в мочевыводящих путях.
К нарушениям распада пуриновых оснований относят некоторые иммунодефициты. При отсутствии аденозиндезаминазы развивается Т- и В – иммунодефицит, а отсутствии нуклеозидфосфорилазы возможен В - иммунодефицит.
Для уменьшения гиперурекемии используют препараты – аналоги пуриновых оснований (например, аллопуринол), которые угнетают фермент ксантиноксидазу и блокируют образование мочевой кислоты.
Распад пиримидиновых нуклеотидов
Распад пиримидиновых оснований происходит путём их гидролитического дезаминирования с разрывом кольца и образования мочевины.
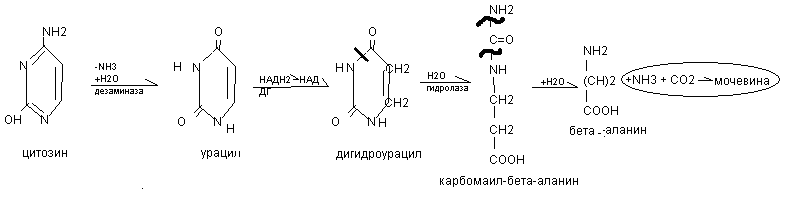
При распаде тимина образуется бета - аминоизомасляная кислота.
Синтез пуриновых нуклеотидов
Возможны 2 способа синтеза пуриновых нуклеотидов в тканях: основной путь (синтез из простых предшественников) и дополнительный путь (синтез из готовых азотистых оснований).
Основной путь синтеза пуриновых нуклеотидов
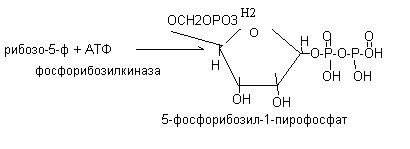
Исходным веществом для синтеза пуриновых нуклеотидов является активная форма рибозы – 5-фосфорибозил – 1 -пирофосфат, которая образуется из рибозо – 5 - фосфата (из пентозофосфатного пути) и АТФ под действием фермента фосфорибозилкиназы
Особенностью синтеза пуриновых нуклеотидов является образование трехкомпонентного нуклеотида с первых стадий синтеза.
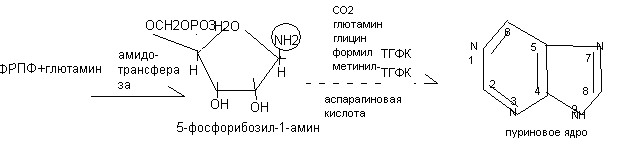
Азот аминогруппы 5 – фосфорибозил - 1-амина займёт 9 положение в пуриновом основании. В последующем происходит формирование пуринового нуклеотида.
Источники атомов углерода и азота в пуриновом кольце:
1-из аспарагиновой кислоты
2- из формил - ТГФК
3,9- из глутамина
4,5,7 - из глицина
6- из СО2
8- из метенил – ТГФК
Первым нуклеотидом - предшественником является инозиновая кислота (инозинмонофосфат - ИМФ), состоящая из гипоксантина, рибозы и фосфорной кислоты.
Из ИМФ в последующем образуются АМФ, ГМФ. При синтезе АМФ к ИМФ присоединяется аспарагиновая кислота, расходуется энергия ГТФ и через промежуточную стадию в 6 положении ОН - группа заменяется на NH2 –группу. В последующем происходят последовательные реакции АМФ АДФАТФ. Синтез ГМФ включает окисление у 2 углеродного атома, с образованием ксантиловой кислоты с последующим замещением ОН - группы на NН2 – группу глютамина. В синтезе ГМФ используется энергия АТФ. В последующем происходят реакции ГМФ ГДФГТФ.
Авторегуляция синтеза пуриновых нуклеотидов
Регуляторными ферментами синтеза пуриновых нуклеотидов являются фосфорибозилкиназа и амидотрансфераза Активность этих ферментов по аллостерическому механизму подавляются высокими концентрациями пуриновых нуклеотидов. На конечных стадиях синтеза ГТФ активирует синтез адениловых нуклеотидов, а АТФ – гуаниловых нуклеотидов.
Дополнительный путь синтеза пуриновых нуклеотидов
Возможен синтез пуриновых нуклеотидов из готовых пуриновых оснований и активной формы рибозы.

Аналогично протекает синтез ГМФ. При врождённом дефекте гипоксантин-гуанинфосфорибозилтрансферазы развивается заболевание Леш Нихана, при котором наблюдается гиперурикемия, нарушение психики.
Синтез пиримидиновых нуклеотидов
Основной путь синтеза пиримидиновых нуклеотидов происходит из исходных простых веществ. Особенностью синтеза пиримидиновых нуклеотидов является предварительный синтез пиримидинового кольца и включение его в состав нуклеотида только на завершающих стадиях.
При дефекте оротатфосфорибозилтрансферазы развивается – оротатацидурия. ОМФ является предшественником уридиловых, цитидиловых и тимидиловых нуклеотидов
Авторегуляция синтеза пиримидиновых нуклеотидов
Ключевыми ферментами являются карбамаилфосфатсинтетаза и карбамаиаспартаттрансфераза
Эти аллостерические ферменты угнетаются высокими концентрациями готовых пиримидиновых нуклеотидов.
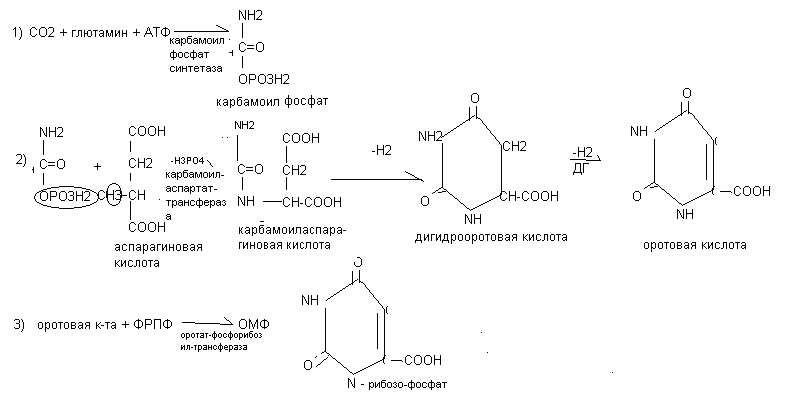
Синтез уридилового нуклеотида: Синтез цитидилового нуклеотида
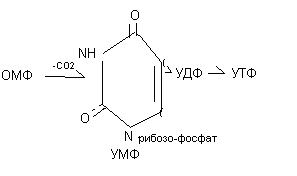
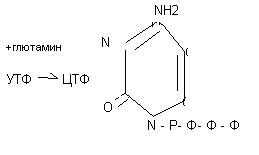
Синтез тимидилового нуклеотида:

Многие противоопухолевые препараты являются ингибиторами фермента тимидилатсинтетазы.
Дополнительный путь синтеза пиримидиновых нуклеотидов возможен из готовых оснований.
Биосинтез ДНК
Возможны 2 пути биосинтеза ДНК в организме: репликация, репарация
Репликация - самовоспроизведение молекулы ДНК с целью передачи генетической информации. В репликации ДНК участвует сложный репликационный комплекс, который включает в себя:
- нуклеотиды в виде трифосфатов (АТФ, ГТФ, ТТФ, ЦТФ). Они являются одновременно и структурным материалом и источником энергии;
- ДНК-матрица – программа, по которой будет синтезироваться ДНК;
- праймер (затравка) - короткая молекула РНК, к которой присоединяется первый нуклеотид ДНК;
- ферменты:
- ДНК-полимеразы соединяют нуклеотиды в полинуклеотидную цепь,
- ДНК-рестриктазы разрывают полинуклеатидную цепь ДНК.
- ДНК-лигазы соединяют фрагменты ДНК,
- хеликазы раскручивают молекулу ДНК,
- топоизомеразы осуществляют кратковременные разрывы ДНК в процессе синтеза и контролируют конформацию вновь синтезированной ДНК,
- праймазы – осуществляют синтез затравки;
- белковые факторы;
- ионы металлов.
Репликация ДНК происходит в S-фазу клеточного цикла. Важную роль в чередовании циклов выполняют белки - циклины.
Сущность репликации сводится к соединению нуклеотидов в комплементарную антипараллельную дочернюю цепь ДНК. В репликации выделяют 3 стадии: инициация (начало синтеза), элонгация (удлинение цепи), терминация (окончание синтеза).
Матрицей для синтеза ДНК являются обе полинуклеотидные цепи материнской ДНК. Репликация начинается в нескольких участках материнской ДНК (точки репликации, точки Ориджины). В них происходит частичный разрыв водородных связей с формированием репликационных утолщений (узелков). В последующем, при участии ферментов ДНК-рестриктаз происходит разрезание молекулы ДНК. Под действием ферментов хеликаз возникает расплетание (раскручивание) двух цепей, и при участии топоизомераз формируется репликационная вилка, в которой одна цепь имеет направление 53, а вторая 35. Затем на каждой из ПНЦ синтезируются дочерние нити ДНК по принципу комплементарности. Поскольку ДНК- полимераза замыкает связь только в направлении 5’3’, то на одной цепи ДНК происходит синтез непрерывной (лидирующей) нити ДНК в направлении 53. При синтезе лидирующей цепи праймазы синтезируют праймер, затем ДНК- полимераза присоединяет к праймеру первый ДНК-овый нуклеотид и по принципу комплементарности происходит удлинение молекулы ДНК. На второй материнской нити ДНК синхронно синтезируется отстающая нить ДНК, которая синтезируется в виде небольших фрагментов в направлении 53. В последующем эти фрагменты (фрагменты Оказаки) соединяются между собой ДНК-лигазами. Праймеры при этом расщепляются.
Таким образом, биосинтез ДНК проходит по полуконсервативному типу, при котором в новой ДНК одна цепь материнская, а другая - дочерняя.
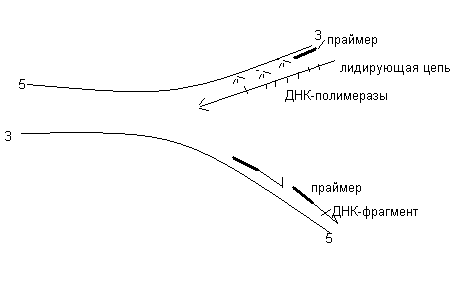
Репарация ДНК происходит при появлении в её молекуле повреждений, искажений. При репарации вначале распознаётся место повреждения, затем ферменты рестриктазы вырезают дефектный участок, ДНК-полимеразы по принципу комплементарности синтезируют отсутствующий участок, а ДНК-лигазы прикрепляют его к сохранившимся участкам неповреждённой ДНК.
Биосинтез РНК (транскрипция)
Транскрипция – синтез молекулы РНК по матрице ДНК. Биологическая роль: перенос генетической информации с ДНК на РНК. Для транскрипции необходимы:
- матрица (программа) – кодирующая нить ДНК,
- субстраты – АТФ, ГТФ, УТФ, ЦТФ,
- ферменты – РНК-полимеразы,
- белковые факторы,
- ионы магния, марганца.
Выделяют 3 стадии транскрипции: инициация, элонгация, терминация
На молекуле ДНК имеется особый участок промотор, с которым связывается РНК-полимераза. Промотор иногда называют ТАТА участком (преобладает тимин, аденин, между которыми 2 Н-связи). Рядом с промотором расположены сигнальные участки, определяющие скорость транскрипции. Далее в молекуле ДНК располагаются кодирующие (экзоны) и некодирующие (интроны) участки гена. Участок (сайт) терминации определяет окончание синтеза РНК.
Инициация заключается во взаимодействии иницирующих белков с промотором и расхождении нитей ДНК, их раскручивании и формировании транскрипционной вилки. РНК-полимераза связывается с промоторным участком и по принципу комплементарности соединяет нуклеотиды цепи РНК в направлении от 5 конца к 3. РНК-полимераза - это олигомерный фермент, состоящий из нескольких субъединиц, не требующий затравки. При достижении РНК – полимеразой участка терминации происходит его связывание с белками терминации, что сопровождается отсоединением РНК-полимеразы от ДНК, диссоциацией её и окончанием транскрипции.
Процессинг РНК
Синтезированная РНК переписывает с кодирующей нити ДНК, как кодирующие участки, так и некодирующие участки гена и является про-РНК (незрелой РНК). Про-РНК в последующем подвергается созреванию (процессингу). Существует несколько механизмов процессинга:
- сплайсинг – вырезание копий интронов и соединение копий экзонов;
- присоединение к про-РНК добавочных нуклеотидов;
- модификация азотистых оснований в составе про-РНК
Особенности процессинга для рРНК, тРНК, иРНК.
Процессинг иРНК заключается в добавлении КЭП - участка и полиаденилового хвоста в сочетании со сплайсингом.
Процессинтг тРНК происходит путём метилирования азотистых оснований и добавления акцепторного участка ЦЦА в сочетании со сплайсингом.
Процессинтг рРНК заключается в вырезании из большого предшественника фрагментов всех видов РНК: 18S; 5S; 5,8S; 28S;.
Возможен альтернативный сплайсинг, который состоит в том, что для разных белков интроны могут играть роль экзонов.
Возможен и безматричный синтез РНК; он происходит из нуклеозиддифосфатов при участии фермента полинуклеотидфосфорилазы. В этом варианте синтезируются стандартные, небольшие молекулы РНК, необходимые для синтеза стандартных белков.
Таким образом, передача генетической информации происходит в следующем направлении: ДНК РНК белок. Однако, в некоторых фагах, эмбриональных тканях возможен синтез ДНК по матрице РНК (РНКДНК). Этот вариант синтеза катализирует фермент РНК-зависимая ДНК-полимераза (обратная транскриптаза, ревертаза). В вирусах возможен также вариант синтеза РНКРНК при участии РНК-репликазы.
Биосинтез белков – трансляция
Основной структурой синтезируемых белков является первичная структура (последовательность аминокислот в полипептидной цепи), которая заложена в генетическом коде ДНК.
Генетический код имеет ряд характеристик.
- Триплетность –1 аминокислота кодируется тремя нуклеотидами. Из 4 видов нуклеотидов ДНК при триплетности кода возможно 64 различных сочетания, что достаточно для кодирования 20 аминокислот.
- Однозначность – 1 триплет кодирует только 1 аминокислоту.
- Вырожденность – для кодирования 1 аминокислоты имеется несколько триплетов
- Непрерывность – между триплетами отсутствуют нуклеотиды, не принадлежащие соседним триплетам.
- Неперекрываемость – один нуклеотид не может одновременно принадлежать 2-м триплетам.
- Универсальность – код в разных организмах одинаков, отвечает за одни и те же аминокислоты.
Таким образом, код ДНК является линейным непрерывным и однонаправленным. Последовательность нуклеотидов строго соответствует последовательности аминокислот в синтезируемом белке – принцип коллинеарности.
Трансляция
Для трансляции необходимы следующие факторы:
- все виды РНК (тРНК, иРНК, рРНК),
- аминокислоты в активной форме,
- макроэрги (донаторы энергии),
- ферменты,
- добавочные белковые факторы,
- ионы Mg2+
На первой подготовительной стадии происходит активация аминокислот и связывание их со своей транспортной РНК. В этой стадии участвуют ферменты аминоацил-тРНК-синтетазы. Это специфичные ферменты, обеспечивающие соединение аминокислоты с соответствующей тРНК.
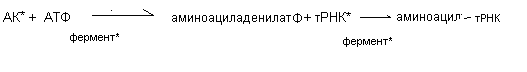
Инициация синтеза белка происходит при образовании инициирующего комплекса, который включает в себя инициирующий кодон (АУГ, АГУ) иРНК, аминоацил - тРНК, рибосому. Информационная РНК своим КЭП-участком соединяется с малой субъединицей рибосомы. К инициирующему кодону присоединяется тРНК со своей первой аминокислотой (чаще всего метионином). К малой субъединице присоединяется большая субъединица рибосомы, и на рибосоме формируется два функциональных участка: пептидильный (Р-участок) и аминоацильный (А-участок). Первая тРНК с первой аминокислотой присоединяется к Р-участку, а А-участок оказывается свободным.
Элонгация включает в себя замыкание пептидной связи, транслокацию рибосомы по иРНК с использованием энергии ГТФ и АТФ. К свободному А-участку присоединяется своим антикодоном вторая тРНК со второй аминокислотой. Под действием фермента пептидилтрансферазы первая аминокислота отрывается от первой тРНК и присоединяется ко второй аминокислоте с формированием дипептида. В последующем происходит смещение (транслокация) рибосомы по иРНК на расстояние 3 нуклеотидов. При этом вторая тРНК с дипептидом оказывается в пептидильном участке, а аминоацильный участок освобождается. Первая тРНК покидает рибосому и уходит в цитозоль за новой аминокислотой, а к А-участку присоединяется третья тРНК с третьей аминокислотой. Затем дипептид переносится на третью аминокислоту сообразованием трипептида. Синтез полипептидной цепи белка происходит в направлении от N-конца к С-концу. В процессе трансляции тРНК выполняет своеобразную адапторную роль в переводе четырёхзначной информации иРНК в двадцатизначную в белках.
Терминация происходит при приближении белоксинтезирующего комплекса к терминирующему кодону иРНК (УАГ, УГА). Этому кодону не соответствует ни одна из тРНК, поэтому не приносится новая аминокислота, и синтез белка обрывается.
Посттрансляционная модификация белков
Многие синтезированные белки в последующем подвергаются посттрансляционной модификации. Существует несколько её вариантов. Наиболее часто встречается:
- частичный протеолиз – отщепление «ненужных» участков
(проферментфермент; прогормонгормон);
- модификация отдельных аминокислот:
- окисление (пролингидроксипролин в коллагене);
- фосфолирирование (присоединение фосфата);
- гликозилирование (присоединение углевода);
- карбоксилирование (присоединение группы СООН в некоторых факторах свёртывания крови);
- присоединение простетической группы;
- замыкание дисульфидных мостиков;
- изменение олигомерности белка (объединение нескольких мономеров)
В посттрансляционной модификации белков играют важную роль белки - шапероны (они «следят» за правильностью модификации).
Ингибиторы биосинтеза белка
В клинической практике применяют в качестве антибактериальных препаратов ингибиторы синтеза нуклеиновых кислот и белка в микроорганизмах. Они проявляют эффект на различных стадиях:
Антимицин Д – встраивается в молекулу ДНК и блокирует синтез новой ДНК,
Новобиацин – ингибирует ДНК-гиразу (топоизомеразу),
Рифамицин – блокирует РНК-полимеразу,
Тетрациклин, левомицетин – связывают либо малую, либо большую субъединицу рибосомы и тем самым блокируют синтез белка,
Пенициллин – блокирует синтез белков, входящих в оболочку микроорганизмов.
Регуляция биосинтеза белка
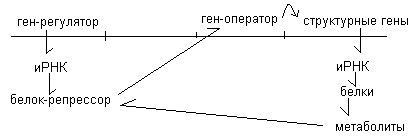
Наиболее подробно выяснена регуляция синтеза белка на микроорганизмах. Общепринятой является схема авторегуляции Моно и Жакоба. Согласно этой схеме, в молекуле ДНК выделяют ген-регулятор, который отвечает за синтез особой РНК и в последующем за синтез особого белка репрессора. На удалении от этого участка находятся ген-оператор и струрктурные гены. Структурные гены (цистроны) служат матрицей для синтеза иРНК, а в последующем – белков. Белки в процессе обмена образуют метаболиты. Метаболиты связываются с репрессором. Репрессор регулирует активность гена – оператора, который, в свою очередь, влияет на структурные гены.
Угнетение биосинтеза белков осуществляется по принципу обратной связи. Высокая концентрация белка и метаболитов приводит к тому, что метаболиты связываются с регрессором и активируют его. Активный репрессор подавляет ген - оператор, а тот - структурные гены, в силу чего синтез белка прекращается.
Литература
Биологическая химия с упражнениями и задачами. - М.: ГЭОТАР-Медиа, 2011
Олейникова И.И.: Биохимия. - М.: НОУДПО "Институт АйТи", 2011
Тюкавкина Н.А.: Биоорганическая химия. - М.: ГЭОТАР-Медиа, 2011
Лось Д.А.: Сенсорные системы цианобактерий. - М.: Научный мир, 2010
под ред. Е.С. Северина ; рец.: А.А. Терентьев, Н.Н. Чернов: Биохимия с упражнениями и задачами. - М.: ГЭОТАР-Медиа, 2010
под ред. Н.А. Тюкавкиной: Биоорганическая химия. - М.: ГЭОТАР-Медиа, 2010
Пустовалова, Л.М.: Основы биохимии для медицинских колледжей. - Ростов н/Д: Феникс, 2010
Пустовалова, Л.М.: Основы биохимии для медицинских колледжей. - Ростов н/Д: Феникс, 2010
РАН, Институт физиологии растений им. К.А. Тимирязева ; отв. ред.: Н.В. Загоскина, Е.Б. Бурлакова ; рец.: С.Д. Варфоломеев, Н.А. Тюкавкина: Фенольные соединения. - М.: Научный мир, 2010
Сисакян Н.М.: Проблемы биохимии и космической биологии. - М.: Наука, 2010
сост.: Л.Ю. Фролова и др.: Лев Львович Кисилев. - М.: ИПО "У Никитских ворот", 2010
Тюкавкина Н.А.: Биоорганическая химия. - М.: Дрофа, 2010
Шимановский Н.Л.: Молекулярная и нанофармакология. - М.: ФИЗМАТЛИТ, 2010
Антина Е.В.: Химия билирубина и его аналогов. - М.: КРАСАНД, 2009
Под ред. Е.С. Северина ; Рец.: Д.М. Никулина и др. ; Авт. кол.: Л.В. Авдеева и др.: Биохимия. - М.: ГЭОТАР-Медиа, 2009
под ред. Н.А. Тюкавкиной: Биоорганическая химия. - М.: ГЭОТАР-Медиа, 2009
под ред. Н.И. Ковалевской ; Ю.Б. Филиппович и др. ; рец.: И.Г. Горичев, Г.И. Ушакова : Биологическая химия. - М.: Академия, 2009
ОБМЕН И ФУНКЦИИ НУКЛЕИНОВЫХ КИСЛОТ