ОБМЕН И ФУНКЦИИ ЛИПИДОВ
Реферат
ОБМЕН И ФУНКЦИИ ЛИПИДОВ
Спиртовой и жирнокислотный состав основных жиров тканей человека
Липиды – неоднородные в химическом отношении органические вещества, нерастворимые в воде, но растворимые в органических растворителях.
Жиры включают в свой состав различные спирты и жирные кислоты.
Спирты представлены глицерином, сфингозином, холестерином
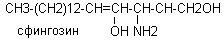
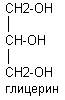
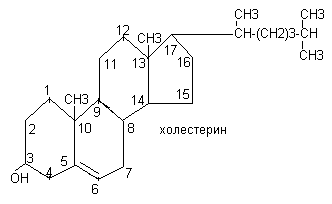
В тканях человека преобладают длинноцепочечные жирные кислоты с чётным числом углеродных атомов. Различают насыщенные и ненасыщенные жирные кислоты.

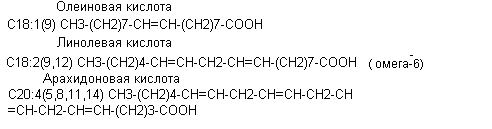

Классификация жиров.
Наиболее принятой является классификация жиров по виду спирта, входящего в состав жира. Согласно ей выделяют:
- глицеринсодержащие жиры: триацилглицерины, глицерофосфолипиды
- сфингозинсодержашие жиры: сфингофосфолипиды, сфингогликолипиды (цереброзиды, ганглиозиды)
- холестеринсодержащие жиры: свободный холестерин, эфиры холестерина, стероиды
Глицеринсодержащие жиры
Триацилглицерины (ТАГ).
Триацилглицерины - это сложные эфиры глицерина и высших жирных кислот.
СН2 – О - СО R1
I
СН – О - СО R2
I
СН2- О - СО R3
Консистенция жиров определяется их жирнокислотным составом: ненасыщенные кислоты преобладают в жидких жирах, насыщенные – в твёрдых жирах. В жирах тканей человека приблизительно 2/3 составляют ненасыщенные жирные кислоты (преобладают пальмитолеиновая и олеиновая кислота), 1/3 приходится на насыщенные жирные кислоты (преобладают пальмитиновая и стеариновая кислоты). Температура плавления жиров тканей человека составляет 15оС, следовательно, в организме человека жиры находятся в жидком состоянии. Триацилглицерины более чем на 90% являются резервным энергетическим материалом организма
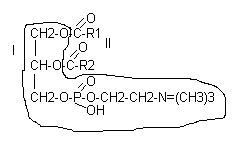
Глицерофосфолипиды (ФЛ)
Большинство глицерофосфолипидов построены на основе фосфатидной кислоты, состоящей из глицерина, двух жирных кислот и остатка Н3РО4:
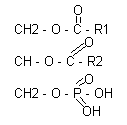
В различных фосфолипидах остаток фосфатидной кислоты (фосфатидил) соединяется с дополнительными N-содержащими веществами: с холином, коламином, серином, инозитом. В ацетальфосфатидах (плазмагенах) в альфа - положении содержится не жирная кислота, а альдегид. Кардиолипины представляют собой дифосфатидилглицерины.
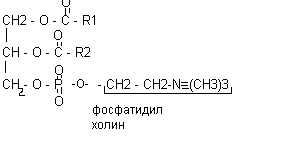

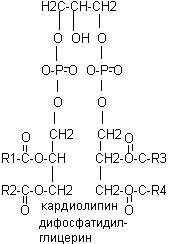
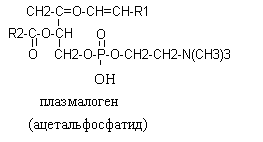
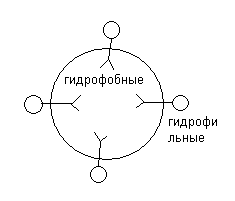
Все фосфолипиды являются дифильными веществами, т.е. содержат в своем составе гидрофильную (I) и гидрофобную часть (II), в силу чего являются структурными компонентами клеточных мембран.
Сфингозинсодержащие жиры
В основе сфинголипидов содержится церамид, состоящий из спирта сфингозина и жирной кислоты, присоединённой амидной связью
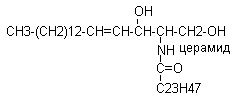
Сфингофосфолипиды состоят из церамида, Н3РО4 и азотсодержащего вещества (холин, коламин и другие)
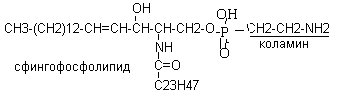
Сфингофосфолипиды в большом количестве входят в состав клеточных мембран головного мозга, в состав сурфактанта легких. В эмбриогенезе их содержание в тканях постепенно возрастает, поэтому содержание сфингофосфолипидов в амниотической жидкости характеризует степень зрелости плода.
Гликосфинголипиды представлены цереброзидами и ганглиозидами.
Цереброзиды содержатся преимущественно в белом веществе головного мозга, состоят из церамида и галактозы.
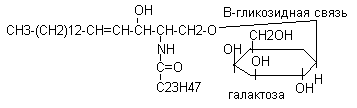
Ганглиозиды состоят из церамида и олигосахаридных фрагментов, в которых концевое положение обычно занимают сиаловые кислоты. Ганглиозиды находятся в сером веществе головного мозга, входят в состав клеточных рецепторов, участвуют в связывании некоторых токсинов, чужеродных веществ, участвуют механизмах памяти, в иммунных реакциях.
Холестеринсодержащие жиры
Холестерин входит в состав клеточной мембраны (его содержание составляет около 2%), является источником синтеза других стероидов организма (жёлчные кислоты, витамин Д, стероидные гормоны). В тканях он находится как в свободном состоянии, так и в виде эфиров (стероиды).
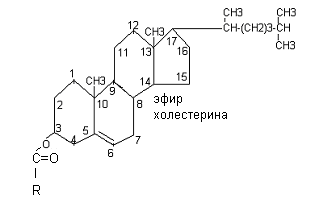
Содержание жиров в организме человека составляет 10-20% массы тела, причём жиров является структурными жирами, а приходится на резервные жиры. У новорожденных содержания ниже, чем у взрослых (8-16%), у недоношенных 3-4%. В течение первого года жизни содержание жиров увеличивается до 28%.
Функции жиров
- Энергетическая функция: снабжают организм энергией. Калорическая ценность жиров выше, чем у углеводов и белков (1г жира даёт при окислении около 9 ккал). Энергетическую роль выполняют резервные жиры
- Пластическая функция: жиры входят в состав всех мембран, составляя их каркас. Эту роль выполняют структурные белки.
- Регуляторные функции:
а) липиды определяют проницаемость клеточных мембран, регулируют активность мембранных ферментов
б) из липидов синтезируются особые тканевые гормоны эйкозаноиды
- Защитная функция: липиды создают механическую защиту внутренних органов от повреждений и травм
- Терморегуляторная функция: липиды подкожной клетчатки снижают теплоотдачу организма
- Участвуют в проведении нервных импульсов, формируют миелиновые оболочки нервных пучков, играющие роль «электроизолятов»
- Липиды растворяют жирорастворимые витамины
- Жиры являются важными источниками эндогенной воды
Структура и функции клеточных мембран
Состав клеточных мембран. В состав клеточных мембран в различных соотношениях входят белки, жиры и углеводы. На долю белков в среднем приходится 50%, липидов - 30%, углеводов - 10% .
Белки представлены ферментами, структурными, транспортными, рецепторными белками. Около половины липидов мембран составляют глицерофосфолипиды, треть приходится на холестерин, меньшая часть - на сфинголипиды. Углеводы клеточных мембран представлены компонентами гликосфинголипидов, гликопротеидов.
Структура клеточных мембран. В настоящее время общепринятой является мозаичная структура клеточной мембраны. Согласно этой модели, основу клеточной мембраны составляют глицерофосфолипиды, которые ориентированы в мембране таким образом, что гидрофильные участки находятся на поверхности, а гидрофобные в глубине клеточной мембраны. В силу дифильности глицерофосфолипиды образуют билипидный слой. Фосфолипиды в клеточных мембранах располагается ассимитрично, на поверхности плазматической мембраны располагается в основном фосфатидилхолин, а внутри фосфотидилколамин и фосфатидилсерин.
Белки в клеточных мембранах делятся на поверхностные белки и интергральные. Интегральные белки обычно расположены в мембране асимметрично. Толщину мембраны пронизывает гидрофобные участки белка, чаще всего уложенные в виде альфа - спирали, С-конец полипептидной цепи находится на внутренней поверхности, а N-конец на внешней поверхности мембраны. Очень часто к N-концевому фрагменту присоединяются углеводы, выполняющие рецепторную функцию. Гидрофобные части белка связываются с гидрофобными участками липидов, а гидрофильные с гидрофильными участками липидов.
Физико-химические свойства мембран определяются химическим составом мембран и температурой окружающей среды. Жёсткость мембранам придают холестерин и насыщенные жирные кислоты. Непредельные жирные кислоты придают текучесть липидам клеточной мембраны. При низкой температуре фосфолипиды достаточно жёстко зафиксированы в составе мембраны, при повышении температуры возможно перемещение липидов. При температуре тела жиры находятся в жидком состоянии.
Функции клеточных мембран
- Разделительная функция – мембраны придают форму клеткам, формируют внутренние отсеки, взаимодействуют со структурой цитоскелета.
- Коммуникативная функция – мембраны обеспечивают межклеточные контакты с помощью рецепторов.
- Метаболическая функция – в клеточные мембраны встроены мембранные ферменты.
- Транспортная функция – через мембрану осуществляется транспорт веществ.
- Рецепторная функция – избирательное взаимодействие рецепторов мембран с различными веществами.
Транспорт веществ через клеточные мембраны
- Пассивный транспорт веществ, который осуществляется по градиенту концентрации через соответствующие мембранные каналы
- Активный транспорт против градиента концентрации с использованием энергии АТФ
- Облегчённый транспорт, в котором участвуют особые дополнительные транспортные белки, осуществляющие или однонаправленное перемещение двух веществ, или разнонаправленное перемещение двух веществ через мембрану
4. Транспорт макромолекул осуществляется путём эндоцитоза или экзоцитоза.
Переваривание жиров.
Для взрослого человека суточная потребность в жирах составляет 70-80 г, для детей 5 – 7 г/кг.
У взрослых людей процесс пищеварения происходит в тонком кишечнике. Необходимыми условиями для этого являются:
- наличие ферментов
- оптимальное рН
- эмульгирование жиров
Необходимость эмульгирования жиров связана с водонерастворимостью жиров. Водорастворимые ферменты могут действовать на липиды только на поверхности жировой капли. Эмульгирование повышает поверхность раздела липид / вода и обеспечивает большую поверхность контакта фермента и жира. В эмульгировании жиров основную роль играют жёлчные кислоты, выделяемые в просвет кишечника в составе жёлчи.
Различают простые и парные, первичные и вторичные жёлчные кислоты:
Простые жёлчные кислоты являются производными холановой кислоты.
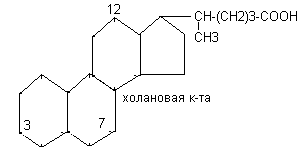
К простым жёлчным кислотам относятся холевая, дезоксихолевая кислота, хенодезоксихолевая и литохолевая кислоты.
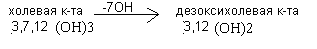
Синтез желчных кислот из холестерина происходит в печени. Ключевым ферментом является 7-альфагидроксилаза. Она переводит холестерин при участии цитохрома Р450 в 7-альфахолестерин - 3,7 (ОН)2. Он, в свою очередь, переходит в хенодезоксихолевую кислоту 3,7 (ОН)2 путём укорочения бокового радикала и в холевую кислоту 3,7,12 (ОН)3. Эти две кислоты являются первичными жёлчными кислотами. Их полярность увеличивается при образовании парных жёлчных кислот путём присоединения глицина (гликокола) и таурина.

У взрослого человека до 80% всех жёлчных кислот представлено гликохолевой и таурохолевой кислотами. В кишечнике под действием микрофлоры происходит отцепление таурина, гликокола и ОН группы в 7 положении с образованием вторичных желчных кислот: дезоксихолевой и литохолевой.
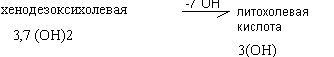
Все жёлчные кислоты относятся к поверхностно активным веществам, имеющим в своем составе гидрофобные и гидрофильные участки. Гидрофильными являются ОН - группы, остатки таурина и гликокола, а гидрофобными – радикал жёлчной кислоты. Благодаря дифильности жёлчные кислоты располагаются в поверхностном слое жировой капли и уменьшают поверхностное натяжение.
В результате снижения поверхностного натяжения под действием перистальтики кишечника, выделения СО2 происходит дробление крупных капель жира на множество мелких – эмульгирование, резко возрастает поверхность соприкосновения капель жира и ферментов.
Липолитические ферменты, участвующие в переваривании жиров, активны при pН 8 – 8,5. Такая среда обеспечивается секрецией бикарбонатов поджелудочной железой.
Основные ферменты переваривания жиров вырабатываются поджелудочной железой и стенкой тонкого кишечника.
В переваривании ТАГ участвует поджелудочная липаза. Она вырабатывается в неактивной форме, и в тонком кишечнике взаимодействует с дополнительным белком колипазой, который повышает активность липазы и обеспечивает контакт фермента с соответствующими жирами. Поджелудочная липаза отщепляет последовательно остатки жирных кислот из альфа-положении с образованием бета – моноацилглицерина ( -МАГ)
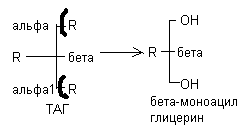
Образующиеся бета-МАГ могут в дальнейшем подвергаться расщеплению под действием липазы до глицерина и жирных кислот. Около 50% МАГ подвергается всасыванию.
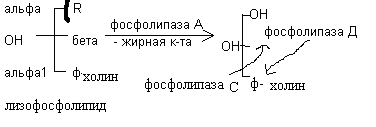
Переваривание глицерофосфолипидов происходит под действием ферментов поджелудочной железы фосфолипаз, которые чаще всего обозначаются как фосфолипаза А, А2, С, Д. Под действием фосфолипазы А2 отщепляется остаток жирной кислоты из – положения с образованием продукта неполного распада глицерофосфолипида – лизофосфолипида. Лизофосфолипиды являются поверхностно активными веществами и усиливают процессы эмульгирования жиров.
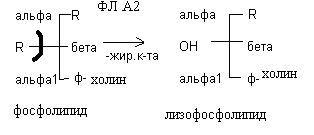
Под действием фосфолипазы А отщепляется остаток жирной кислоты в – положении. Фосфолипаза С отрывает остаток фосфорной кислоты, а фосфолипаза Д – остаток холина. Таким образом, при полном распаде глицерофосфолипидов образуются глицерин, жирные кислоты, Н3РО4, холин.
Эфиры холестерина они расщепляются ферментом холестеролэстеразой.
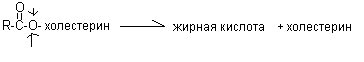
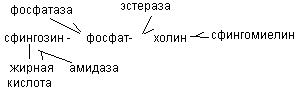
Переваривание сфинголипидов осуществляется ферментами эстеразами, фосфатазами, амидазами, гликозидазами.
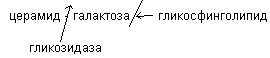
Всасывание продуктов расщепления жиров
Всасывание продуктов расщепления жиров происходит в тонком кишечнике и определяется водорастворимостью или водонерастворимостью образовавшихся продуктов расщепления жиров. Водорастворимые вещества (глицерин, холин, Н3РО4) легко всасывается по градиенту концентрации.
Водонерастворимые вещества (бета-МАГ, холестерин, длинноцепочечные жирные кислоты) не могут всасываться самостоятельно. В их всасывании участвуют жёлчные кислоты, которые образуют в просвете кишечника особые сферические водорастворимые структуры – мицеллы, в которые встраиваются гидрофобные жирные кислоты, холестерин. В процессе всасывания мицеллы распадаются, все водонерастворимые вещества подвергаются всасыванию. Жёлчные кислоты частично возвращаются в просвет кишечника, но в основном проходят процесс гемато-гепато-энтеральной циркуляции: всасываются, с током крови возвращаются в печень и повторно выделяются в состав жёлчи в просвет кишечника. Вследствие многократной циркуляции жёлчных кислот их небольшого количества (4 - 6 г) оказывается достаточным для всасывания большого количества гидрофобных продуктов. 10% короткоцепочечных жирных кислот может всасываться в виде тончайшей эмульсии путём пиноцитоза.
Ресинтез жиров в слизистой тонкого кишечника
Ресинтез – синтез липидов, характерных для организма человека, из компонентов пищевых жиров. Недостающие жирные кислоты, спирты, необходимые для ресинтеза, могут синтезироваться в клетках слизистой кишечника (энтероцитах) и выделяться в составе жёлчи. Ресинтез триацилглицеринов происходит из активной формы глицерина и жирных кислот последовательно через стадию моноацилглицерина, диацилглицерина. Ресинтез глицерофосфолипидов происходит из фосфатидной кислоты, фосфохолина и диацилглицеринов. Ресинтезу подвергаются и другие виды липидов.
Особенности переваривания и всасывании жиров у детей
Главная особенность переваривания жиров в раннем детском возрасте заключается в том, что примерно половина жиров расщепляется в желудке. Данная особенность обусловлена следующими обстоятельствами:
- жиры молока находится в эмульгированном состоянии
- при грудном вскармливании в переваривании жиров участвует липаза грудного молока
- в процессе сосания у грудного ребёнка вырабатывается лингвальная липаза, которая оказывает эффект в желудке
- активно вырабатывается желудочная липаза с оптимумом рН около 5,0
- у детей в желудке менее кислая среда, приближенная к оптимуму рН для липаз
- активность панкреатической липазы у детей снижена
- в детском возрасте менее активен синтез жёлчных кислот, повышена их потеря через кишечник и замедлена циркуляция.
Всасывание жиров у детей происходит с большей скоростью, чем у взрослых в связи с высокой проницаемостью слизистой кишечника.
Транспорт жиров кровью
Гидрофобные жиры не могут транспортироваться кровью самостоятельно. Они переносятся в следующих формах:
- липопротеиды (липопротеины) – белково-липидные комплексы
- хиломикроны – жировые капли, образующиеся в млечном соке
- свободные жирные кислоты транспортируются в комплекте с альбуминами
Хиломикроны - это мельчайшие капельки жира с размерами около 500 нм, плотностью 0,95 г/см3, состоящие из 2% белка и 90% ТАГ. Хиломикроны синтезируется в слизистой кишечника, считаются транспортной формой пищевых (экзогенных) жиров организме. Хиломикроны попадают сначала в лимфу, а затем разносятся кровью в основном в жировые депо (>50%), а также к печени, лёгким, мышечной ткани.
Липопротеиды (ЛП) являются основной транспортной формой жиров.
По электрофоретической подвижности различают: пре - ЛП, - ЛП, - ЛП
По плотности выделяют:
- ЛП очень низкой плотности (ЛПОНП)
- ЛП низкой плотности (ЛПНП)
- ЛП высокой плотности (ЛПВП)
- ЛП промежуточной плотности
- ЛП очень высокой плотности
Все ЛП построены по общему принципу. В центре частицы находится гидрофобное ядро, в которое входят ТАГ и эфиры холестерина, вокруг него формируется гидрофильная оболочка, в которую входят ФЛ, холестерин. На поверхности располагаются белки - апопопротеины (АроPt).
Различают несколько видов АроPt: A, B, C, E. Они формируют структуру липопротеидных частиц, взаимодействуют с тканевыми рецепторами к ЛП, являются активаторами ферментов обмена ЛП
ЛП осуществляют транспорт липидов, жирорастворимых витаминов и гидрофобных гормонов.
Закономерности строения липопротеидов в ряду: ЛПОНП ЛПНПЛПВП представлены в таблице.
|
ЛПОНП |
ЛПНП |
ЛПВП |
|
|
Размеры уменьшаются |
80 нм |
25 нм |
10 нм |
|
Плотность возрастает |
1,006 г/см3 |
1,006-1,06 г/см3 |
1,25 г/см3 |
|
% содержания белков увеличивается |
10% |
25% |
50-60% |
|
% содержания липидов уменьшается |
60% ТАГ |
45-48% холестерин |
30% холестерин 30% ФЛ |
ЛПОНП – синтезируется в печени, считаются основной транспортной формой эндогенных жиров. В эндотелии сосудов ЛПОНП и хиломикроны подвергаются действию фермента липопротеидной липазы, которая расщепляет в их составе ТАГ. В результате в составе ЛП повышается доля холестерина, и ЛПОНП превращаются в ЛПНП.
ЛПНП считаются транспортной формой холестерина от печени к органам и тканям. В тканях имеются рецепторы и ЛПНП, при участии которых происходит поглощение холестерина с последующим использованием его на построение мембран, синтез стероидов, депонированием в виде эфиров.
ЛПВП синтезируется в печени в виде дисковидных структур. Они считается транспортной формой холестерина из тканей к печени. В кровотоке при контакте с эндотелием происходит поглощение холестерина ЛПВП. Они постепенно превращаются в сферические структуры и переносят холестерин в печень. В поглощении холестерина частицами ЛПВП участвует фермент ЛХАТ (лицитинхолестеролацилтрансфераза), который в составе ЛПВП переносит остатки жирных кислот с фосфолипидов на холестерин с образованием эфиров холестерина. Эфиры холестерина более гидрофобны по сравнению со свободным холестерином и, в силу этого, погружаются внутрь ЛП частицы.
У детей общее содержание ЛП ниже, чем у взрослых. В детском возрасте снижена концентрация хиломикронов и ЛПОНП, повышено содержание ЛПВП, в которых повышено содержание гидрофильных компонентов.
Содержание липидов в крови взрослых:
|
Общие липиды 4-8 г/л |
|
ТАГ 1-2,5 ммоль/л |
|
ФЛ 2,5-3,0 ммоль/л |
|
Холестерин 3,5-5,2 ммоль/л |
|
Свободные жирные кислоты 0,5 – 1,0 ммоль/л |
У детей содержание общих липидов ниже, чем у взрослых. В то же время концентрация свободных жирных кислот у детей повышено примерно в два раза.
Большая часть переносимых кровью липидов откладывается в жировых депо, к которым относятся подкожно-жировая клетчатка, большой и малый сальники. У детей наиболее активно депонирование жиров происходит в возрасте 1 года, 7 лет и в пубертатном периоде. В раннем детском возрасте у детей важным видом жировой ткани является бурая жировая ткань. Она локализована в основном на спине, на груди, имеет бурый оттенок, который обусловлен большим содержанием митохондрий и Fе - содержащих цитохромов. В бурой жировой ткани происходит нефосфолирирующее окисление жиров, которое сопровождается выделением тепловой энергии (она является органом термогенеза). Жировое депо у детей легко истощается при нарушении питания, болезнях, стрессе. Липиды в жировых депо постоянно обновляются.
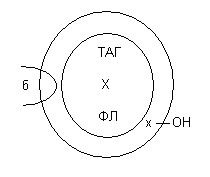
Обмен триацилглицеринов
Распад триацилглицеринов в тканях (липолиз)
Триацилглицерины поэтапно расщепляется тканевыми липазами.
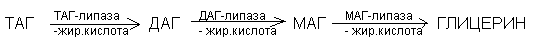
Ключевым ферментом липолиза является гормональнозависимая ТАГ-липаза. Образующиеся на этом этапе распада жиров глицерин и жирные кислоты окисляются в тканях с образованием энергии.
Окисление жирных кислот.
Различают несколько вариантов окисления жирных кислот: - окисление, - окисление, - окисление. Основным вариантом окисления жирных кислот является - окисление. Оно наиболее активно протекает в жировой ткани, печени, почках и сердечной мышце.
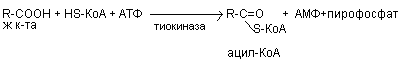
- окисление заключается в постепенном отщеплении от жирной кислоты двух углеродных атомов в виде ацетил - КоА с освобождением энергии. Запас жирных кислот сосредоточен в цитозоле, где протекает активация жирных кислот с образованием ацил - КоА
Последующее -окисление ацил-КоА происходит в митохондриях. Митохондриальная мембрана непроницаема для длинноцепочечных ацил - КоА. В переносе их внутрь митохондрий участвует специальный переносчик карнитин (метил, гидропроизводное аминомасляной кислоты). Ацил - КоА образует с карнитином комплекс, который после переноса жирной кислоты внутрь митохондрий распадается.
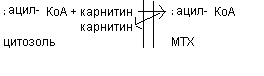
Химизм - окисления насыщенных жирных кислот
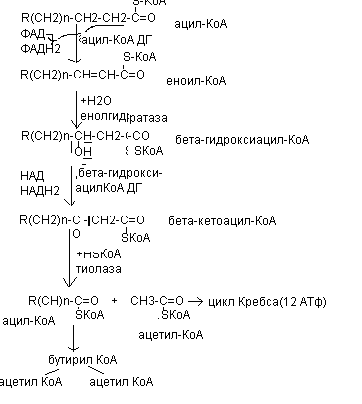
Энергетическая эффективность бета - окисления жирных кислот складывается из энергии окисления ацетил - КоА в цикле Кребса и энергии, освобождающейся в самом бета – цикле. Энергия окисления жирной кислоты тем выше, чем длиннее её углеродная цепь. Количество молекул ацетил - КоА из данной жирной кислоты и количество образующихся из них молекул АТФ определяется по формулам:
n=N/2, где n-количество молекул ацетил - КоА, N- число атомов углерода в жирной кислоте.
Количество молекул АТФ за счёт окисления молекул ацетил-КоА = (N/2)*12
Число - циклов окисления на один меньше, чем количество образующихся молекул ацетил-КоА, поскольку в последнем цикле масляная кислота за один цикл переходит в две молекулы ацетил-КоА, и рассчитывается по формуле
Количество - циклов = (N/2)-1
Количество молекул АТФ в - цикле рассчитывается, исходя из последующего окисления образовавшихся в нём НАДН2 (3 АТФ) и ФАДН2 (2 АТФ) по формуле
Количество молекул АТФ, образующихся в бета-циклах = ((N/2)-1)*5
2 макроэргические связи АТФ расходуются на активацию жирной кислоты
Суммарная формула для подсчёта выхода АТФ при окислении насыщенной жирной кислоты имеет вид: 17(N/2)-7.
При окислении жирных кислот с нечётным числом углеродных атомов образуется сукцинил – КоА, который вступает в цикл Кребса.
Окисление ненасыщенных жирных кислот на начальных стадиях представляет обычное бета - окисление до места двойной связи. Если эта двойная связь находится в бета - положении, то продолжается окисление жирной кислоты со второго этапа (минуя стадию восстановления ФАД ФАДН2). Если двойная связь находится не бета - положении, то ферментами еноилтрансферазами связь перемещается в бета – положение. Таким образом, при окислении ненасыщенных жирных кислот образуется меньше энергии по формуле (теряется образование ФАДН2):
7(N/2)-7-2m, где m-число двойных связей.
Окисление глицерина
На первом этапе глицерин активируется в глицерофосфат, затем окисляется до фосфодигидроксиацетона, который через стадию образования пирувата переходит в ацетил – КоА и окисляется в цикле Кребса.
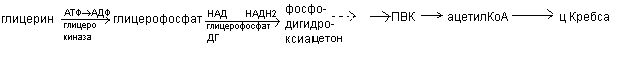
Синтез триацилглицеринов (липогенез)
Для синтеза ТАГ необходимы глицерин и жирные кислоты.
Синтез глицерина
Если глицерин поступает с пищей в недостаточном количестве, он может синтезироваться из углеводов через образование общего метаболита фосфодигидроксиацетона.
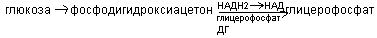
Активная форма глицерина – глицерофосфат используется на синтез ТАГ и глицерофосфолипидов.
Синтез жирных кислот
Синтез насыщенных жирных кислот происходит в цитозоле при участии сложного полиферментного комплекса (синтетаза жирных кислот или пальмататсинтетаза). Этот комплекс включает в себя особый ацилпереносящий белок и 6 ферментов. Для синтеза жирных кислот донором водорода является НАДФН2, образующийся в пентозофосфатном пути окисления глюкозы. Исходным веществом для синтеза жирных кислот является ацетил - КоА, который образуется в митохондриях в результате бета – окисления жирных кислот, и самостоятельно выйти в цитозоль не может. Транспорт ацетил - КоА из митохондрий в цитозоль осуществляется с помощью цитратного челночного механизма:
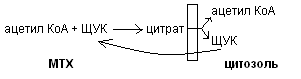
Ацетил - КоА на первом этапе карбоксилируется в малонил - КоА
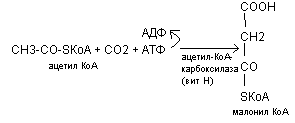
Затем ацетил - КоА и малонил - КоА соединяются с полиферментным комплексом (синтетаза жирных кислот), в котором имеется 2 SН-группы.
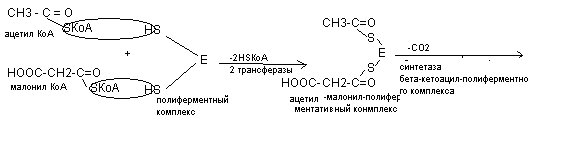
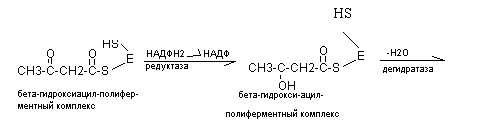
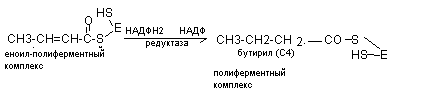
В последующем к этому комплексу присоединяется новая молекула малонил - КоА и в результате синтезируется капроновая кислота (С6) и далее до С16 (пальмитиновая кислота). Более длинная жирная кислота синтезируется с участием дополнительных ферментов элонгаз.
В тканях организма человека синтезируется только мононенасыщенные кислоты. Они образуются из соответствующих насыщенных жирных кислот при участии ферментов десатураз (монооксигеназ) и цитохрома Р450.
Синтез триацилглицеролов
ТАГ синтезируются из активной формы глицерина и жирных кислот через стадию фосфатидной кислоты.
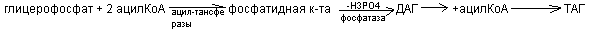
Обмен глицерофосфолипидов
Синтез глицерофосфолипидов
Глицерофосфолипиды синтезируется из фосфатидной кислоты и азотсодержащих добавочных веществ. В синтезе фосфолипидов активатором служит ЦТФ, который может активировать или фосфатидную кислоту, или серин (коламин, холин). В связи с этим возможны два варианта синтеза фосфолипидов.
а) Активация фосфатидной кислоты:
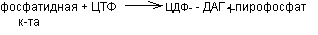
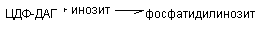
б) Активация холина (серина, коламина):
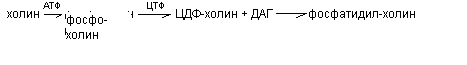
Таким образом, синтез глицерофосфолипидов и триацилглицеринов на начальных стадиях осуществляется путём образования фосфатидной кислоты. Для активации синтеза из неё структурных фосфолипидов используются липотропные вещества. К ним относится холин, метионин, витамин В12 и др. Липотропные вещества препятствуют жировой дистрофии печени, миокарда при гепатитах, миокардитах.
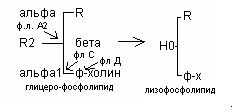
Распад глицерофосфолипидов
Распад фосфолипидов осуществляется тканевыми фосфолипазами. Различают несколько видов фосфолипаз (фосфолипазы А, А2, С, Д), которые разрывают различные связи в фосфолипидах.
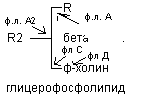
При ряде патологических состояний наблюдается активация тканевой фосфолипазы А2. Это сопровождается образованием продуктов неполного распада фосфолипидов - лизофосфолипидов. Накопление лизофосфолипидов в составе клеточной мембраны повышает её проницаемость для Na+, К+, Н2О, в результате чего возможен лизис клеток (в частности, гемолиз эритроцитов). Фосфолипаза А2 присутствует в яде некоторых змей.
Обмен сфинголипидов.
Синтез сфинголипидов.
Сфингозин является компонентом всех сфинголипидов.
Синтез сфингозина происходит из активной формы пальмитиновой кислоты и аминокислоты серина.
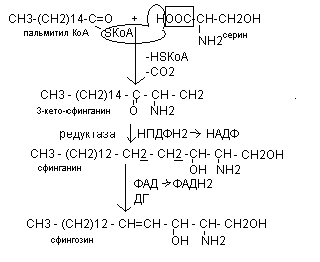
Структурным блоком сфинголипидов является церамид, включающий в свой состав сфингозин и жирную кислоту, присоединённую амидной связью.
Синтез церамида осуществляется из активной формы жирной кислоты и сфингозина.

Синтез сфингофосфолипидов происходит из церамида и активной формы холина.
ЦДФ – холин (цитидиндифосфохолин) + церамид сфингофосфолипид (сфингомиелин)
Синтез сфингогликолипидов
Синтез цереброзидов осуществляется из церамида и активной формы моносахаров.
Церамид + УДФ - галактоза (уридиндифосфатгалактоза) цереброзид
Синтез ганглиозидов происходит путём присоединения к церамиду олигосахаридного фрагмента, на конце которого чаще всего находятся сиаловые кислоты и аминогексозы.
Распад сфинголипидов
Расщепление сфинголипидов происходит при участии лизосомальных ферментов. При их дефекте развивается сфинголипидозы, при которых в ткани головного мозга накапливается сфинголипиды и продукты их неполного распада. Сфинголипидозы проявляются неврологическими симптомами. Для их антенатальной диагностики используется определение содержания сфинголипидов в амниотической жидкости.
Распад сфингофосфолипидов (сфингомиелинов) осуществляется неспецифичными эстеразами и специфичным ферментом сфингомиелиназой, который расщепляет в сфигофосфолипидах связь между церамидом и фосфохолином.. При отсутствии этого фермента развивается сфингомиелиноз (болезнь Нимана-Пика).
Распад цереброзидов происходит под действием бета - гликозидаз, расщепляющих связь между церамидом и моносахаридом. При отсутствии данного фермента развивается цереброзидоз (болезнь Гоше)
Распад ганглиозидов осуществляется различными гликозидами, включая гексаминидазу. При отсутствии данного фермента развивается ганглиозидоз (болезнь Тея - Сакса)
Обмен холестерина
Ежесуточно в организме взрослого человека обменивается до 1,5 г холестерина. Примерно половина этого количества синтезируется в организме, а половина поступает с пищей (экзогенно). Холестерин пищевых продуктов всасывается в тонком кишечнике при участии жёлчных кислот.
Биосинтез холестерина
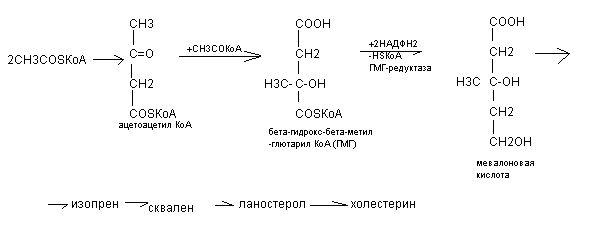
Синтез холестерина происходит в печени из ацетил-КоА. Синтез холестерина представляет собой сложный многоэтапный процесс, протекающий в 20 стадий. Начальная стадия – образование мевалоновой кислоты является ключевой
ГМГ - редуктаза – ключевой фермент синтеза холестерина, она угнетается высокими концентрациями холестерина. Синтезированный в печени холестерин включается в состав липопротеидов ЛПОПН. Под действием липопротеидной липазы ЛНОПН переходят в ЛПНП, которые транспортируют холестерин от печени к органам и тканям. В тканях имеются рецепторы к липопротеидам, при участии которых происходит захват холестерина и проникновение его в клетки.
В клетках часть холестерина превращается в эфиры при участии фермента АХАТ (ацитилхолестеролацилтрансфераза). Эфиры холестерина депонируются в тканях.

Использование холестерина в тканях.
Холестерин необходим для всех клеток и тканей.
1. В печени примерно половина синтезирующегося холестерина превращается в жёлчные кислоты при участии ключевого фермента 7- альфагидроксилазы, который ингибируется высокой концентрацией холестерина. Применение веществ, адсорбирующих жёлчные кислоты в кишечнике, повышает переход холестерина в жёлчные кислоты и снижает его уровень в крови.
2. Холестерин используется для построения клеточных мембран, где он составляет примерно третью часть всех липидов мембран и определяет физико-химические свойства липидной фазы мембран.
3. В надпочечниках, половых железах холестерин используется на синтез стероидных гормонов
4. В коже из производного холестерина происходит образование витамина Д3 (холекальциферола).
Выделение холестерина из организма
Избыток холестерина удаляется из тканей при участии ЛПВП, которые адсорбируют холестерин из клеток и переносят его в печень. Основная часть холестерина выводится из организма через кишечник в виде жёлчных кислот, продуктов их обмена и образующихся из холестерина под действием микрофлоры холестанола и копростанола. Выведение холестерина из организма в небольших количествах происходит со слущивающимся эпителием, с мочой в виде соединений стероидных гормонов с глюкуроновой кислотой.
Нарушение обмена холестерина
В норме концентрация холестерина в крови составляет 3,5 – 5,2 ммоль/л. У детей концентрация холестерина в крови ниже, чем у взрослых. У новорожденных уровень холестерина равен 2,67 ммоль/л, у детей в возрасте одного года - 4,03 ммоль/л.
Симптом повышения уровня холестерина в крови называется гиперхолестеринемией. Реже встречаются врождённые гиперхолестеринемии, чаще развиваются приобретённые (вторичные) гиперхолестеринемии. На фоне гиперхолестеринемии возможно развитие заболеваний атеросклероз и жёлчекаменная болезнь.
При атеросклерозе избыток холестерина откладывается в эндотелии сосудов, вследствие чего нарушается кровоснабжение тканей. Для диагностики атеросклероза рекомендуется определение коэффициента атерогенности, который показывают соотношение между ЛПНП и ЛПВП.
К атерогенности = (Хобщ. - ХЛПВП)/ХЛПНП 3.
Для лечения атеросклероза применяют ингибиторы ГМГ-редуктазы, которые блокируют синтез холестерина.
Жёлчекаменная болезнь связана с нарушением соотношения между водонерастворимым холестерином и гидрофильными фосфолипидами и жёлчными кислотами в составе жёлчи. Холестерин является основой формирования камней в жёлчных путях.
При циррозах печени, гепатитах возможно развитие гипохолестеринемии.
Взаимосвязь липидного и углеводного обменов
Обмен углеводов и липидов тесно взаимосвязан как в физиологических условиях, так и при патологии. Эта взаимосвязь возможна благодаря наличию общих метаболитов в обмене углеводов и липидов.
Углеводы могут использоваться для синтеза различных классов липидов.
Некоторые возможные пути перехода углеводов в липиды:
- ГлюкозафосфодигидроксиацетонглицерофосфатТАГ, ФЛ
- Глюкозаацетил КоАжирные кислоты, холестеринлипиды
- Глюкоза ацетил-КоА холестерин стероиды
- ГлюкозаНАДФН2(пентозофосфатный путь)синтез жирных кислот, синтез сфингозина, синтез холестерина.
У детей углеводы очень активно используются на синтез липидов.
Схема взаимодействия углеводного и липидного обмена.
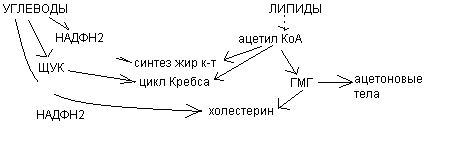
Ацетоновые тела.
Распад липидов ведёт к образованию веществ, называемых ацетоновыми телами. К ацетоновым телам относятся:
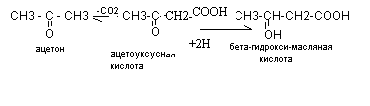
Основная масса ацетоновых тел синтезируются в печени из ацетил - КоА через стадию гидроксиметилглютарил - КоА (ГМГ) по схеме:.
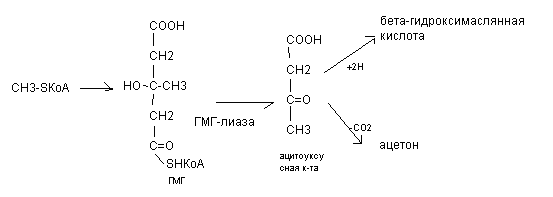
В норме концентрация ацетоновых тел очень мала, составляя не более 0,6 ммоль/л. В физиологических условиях ацетоновые тела являются важным водорастворимым энергетическим материалом для различных тканей. Из печени они транспортируются в ткани, где активируются под действием НS-КоА или сукцинил–КоА (ацетоуксусная кислота + HS-КоАацетоацетил - КоА). Активная форма ацетоновых тел окисляется в цикле Кребса с образованием энергии (ацетоацетил - КоА24 АТФ).
В патологических условиях при высокой концентрации ацетоновых тел развивается кетоацидоз. У детей выражена склонность к кетоацидозу, поскольку у них ограничены запасы гликогена как энергетического материала. В детском возрасте выше скорость распада ТАГ, так как очень лабильна ТАГ-липаза. У детей активно протекает распад кетогенных аминокислот. В то же время усвоение ацетоновых тел в детском возрасте снижено.
Регуляция липидного обмена
На состояние липидного обмена влияют многие физиологические факторы, в том числе калорийность рациона, интенсивность физической нагрузки.
Нервная регуляция липидного обмена подтверждается тем, что жировая ткань богато иннервирована.
Эндокринная регуляция осуществляется гормонами гипофиза (липотропин, соматостатин), щитовидной железы (тироксин), надпочечников (адреналин, глюкокортикоиды), поджелудочной железы (инсулин, глюкагон), половых желез (андрогены и эстрогены).
Инсулин активирует синтез ТАГ из глюкозы (липогенез) за счёт активации фермента ацетил - КоА – карбоксилазы. Одновременно инсулин обладает антилиполитическим действием (тормозит липолиз).
Большинство других гормонов, участвующих в регуляции липидного обмена, угнетают липогенез, и в большей степени активирует липолиз. Так, гормоны адреналин и глюкагон активируют ТАГ – липазу, а глюкокортикоиды индуцируют синтез ТАГ - липазы.
В регуляции обмена холестерина участвует гормоны тироксин и эстрогены, которые снижают уровень холестерина в крови.
Возможна авторегуляция отдельных звеньев липидного обмена. Например, синтез холестерина регулируется по принципу обратной связи (высокая концентрация холестерина в клетках угнетает фермент ГАГ - редуктазу и тем самым уменьшает его образование)
Патология липидного обмена
Нарушения обмена жиров возможны на этапе их переваривания, транспорта, тканевого обмена.
Переваривание жиров нарушается при заболеваниях поджелудочной железы (недостаток ферментов), печени и жёлчевыводящих путей (отсутствуют жёлчные кислоты, страдает эмульгирование, всасывание). При нарушении переваривания и всасывания липидов развиваются авитаминозы жирорастворимых витаминов, истощаются жировые депо, возникает дефицит жиров в организме как основного резервного энергетического материала.
Нарушение транспорта жиров связано с нарушением обмена липопротеидов крови. Примерами врождённых нарушений являются бета - алипопротеинемия (болезнь Танжера), альфа - алипопротеинемия, семейная гиперхолестеринемия. Гораздо чаще встречается приобретённые дислипопротеинемии, при которых изменено соотношение между липидами в различных липопротеидах, в частности, гиперлипопротеинемии – повышение уровня каких либо видов жиров крови.
Нарушение тканевого обмена липидов часто сочетается с нарушением углеводного обмена (голодание, ожирение, сахарный диабет), что может вести к накоплению в тканях, крови ацетоновых тел.
При голодании снижается выработка инсулина, активируется образование глюкагона и адреналина. В результате усиливается распад жиров в тканях и их окисление в качестве основного энергетического материала. Распад липидов приводит к образованию большого количества ацетил - КоА, который при голодании не может быть использован на синтез жирных кислот, холестерина, не может окисляться в цикле Кребса (в силу дефицита щавелевоуксусной кислоты и НАДФН2). Избыток ацетил - КоА используется на синтез ацетоновых тел, поэтому длительное голодание сопровождается выделением ацетоновых тел с мочой.
При сахарном диабете дефицит инсулина сопровождается нарушением усвоения глюкозы тканями, активацией липолиза, образования ацетил - КоА и, как следствие, повышенным образованием ацетоновых тел.
Ожирение может возникать в силу нарушения характера питания (алиментарное ожирение), при эндокринных заболеваниях, длительном применении некоторых лекарственных препаратов. Возможен генетический вариант ожирения, связанный со сбоями в работе гена ожирения, который активирует синтез гормонов лептинов, активирующих липолиз. При алиментарном ожирении выражена стадийность изменений обмена веществ в организме. В начале патологического состояния активируется выработка инсулина, а в последующем инсулярный аппарат истощается, и возникает относительное преобладание контринсулярных гормонов глюкокортикоидов, развивается состояние стероидного диабета, проявляющегося ожирением и повышенным синтезом ацетоновых тел.
Жировая дистрофия миокарда, печени может развиваться после миокардита, гепатита в силу увеличения отложения ТАГ в миокардиоцитах и гепатоцитах. Для профилактики жирового перерождения тканей показано применение различных липотропных веществ, способствующих синтезу структурных глицерофосфолипидов.
В последние годы накапливаются данные о митохондриальных болезнях, при которых страдает бета-окисление жирных кислот и нарушается энергетический обмен в тканях.
Перекисное окисление липидов (ПОЛ)
ПОЛ – неферментативный свободно-радикальный процесс, в который в основном вовлекаются фосфолипиды клеточных мембран.
Инициатором ПОЛ являются активные радикальные формы О2: супер - оксид О2-., гидроксирадикал ОН* (О2* + Н2О2О2 + ОН + ОН*), оксид азота NО*, и пероксинитрил (NO* + О2*ОNОО). Активные формы О2 атакуют атомы углерода в ненасыщенных жирных кислотах, находящиеся между двойными связями.
Выделяют стадии инициации, разветвления и обрыва процесса ПОЛ
Инициация процесса заключается в том, что активные формы О2 отрывают атом Н от жирной кислоты, превращая жирную кислоту в радикал жирной кислоты R*
Разветвление процесса с образованием большого количества новых радикалов: R* + О2 RОО* (перекись жирной кислоты). Образовавшиеся радикалы воздействуют на новые молекулы жирных кислот: RН + RОО* R* + RООН (гидроперекись жирной кислоты). Гидроперекись также служит источником новых радикальных форм при участии ионов металлов переменной валентности: RООН + Fе2+ RО* + ОН* + Fе3+. Образовавшиеся радикалы атакуют новые жирные кислоты. Некоторое количество гидроперикиси жирных кислот превращается в малоновый диальдегид (МДА)– конечный продукт ПОЛ.
Обрыв (затухание процесса) происходит при взаимодействии радикальных форм жирных кислот между собой: R*+R*1RR1, R*+RОО* RООR
В физиологических условиях образуется невысокие концентрации продуктов ПОЛ, которые участвуют в обновлении фосфолипидов клеточных мембран, в регуляции проницаемости клеточных мембран, в фагоцитозе, пиноцитозе и синтезе эйкозаноидов.
Активность ПОЛ уменьшают антиоксидантные ферменты супероксиддесмутаза, каталаза, глютадионпероксидаза, некоторые микроэлементы, витамины Е, А, С.
Витамин Е, токоферол, антистерильный витамин.
В своём составе витамин содержит циклический спирт токол и ненасыщенный боковой радикал, Витамин Е относится к жирорастворимым витаминам. Он широко распространён в природе. Суточная потребность в витамине Е для взрослого человека составляет 20-50 мг. Витамин Е является мощным антиоксидантом, «ловушкой» для свободных радикалов, участвует в обмене селена. Авитаминоз Е встречается редко и проявляется в повсеместном повреждении клеточных мембран. В эритроцитах авитаминоз проявляется гемолизом, в мышцах - мышечной слабостью, дистрофией, в репродуктивных органах – нарушением подвижности сперматозоидов, рассасыванием плода, невынашиванием беременности.
Эйкозаноиды
Эйкозаноиды – биологически активные производные арахидоновой (С20:4) кислоты и эйкопентановой (С20:5) кислоты.
Все эйкозаноиды делятся на следующие группы:
I. простаноиды ( циклические соединения)
- простагландины
- простациклины
- тромбоксаны
- лейкотриены (нециклические вещества)
- липоксины (нециклические соединения)
Синтез эйкозаноидов.
Источником синтеза различных видов эйкозаноидов является арахидоновая кислота, входящая в состав фосфолипидов:
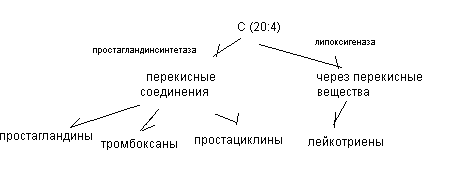
Простагландины – циклические производные арахидоновой кислоты, основу которых составляет простаноевая кислота.
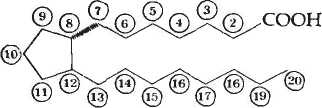
В зависимости от добавочной группы у 9 атома углерода простаноевоей кислоты выделяют: РgЕ (в девятом положении кето - группа) и РgF (в девятом положении ОН - группа). Индекс в названии простагландина (PgE2) отражает количество двойных связей в его молекуле.
Простагландины рассматривают как тканевые местные гормоны. Они обладают аутокринным или паракринным эффектом. РgF обладают сосудосуживающим действием, вызывает бронхоспазм, усиливают сокращение миометрия матки. PgЕ обладают сосудорасширяющим, антиаритмическим действием на сердце, антисекреторным эффектом на слизистую желудка (противоязвенное действие). Они увеличивает диурез, участвуют в болевой рецепции, терморегуляции, в иммунологических процессах. В патологических условиях в больших концентрациях Pg является медиаторами воспаления и аллергических реакций.
Тромбоксаны – циклические производные арахидоновой кислоты. Они синтезируются в тромбоцитах, обладают сосудосуживающим эффектом, увеличивает агрегацию тромбоцитов, способствует тромбообразованию.
Простациклины синтезируется в эндотелии сосудов, оказывают сосудорасширяющее действие, снижает агрегацию тромбоцитов, обладают фибринолитическим, противовоспалительным, антиоксидатным действием.
Лейкотриены синтезируется в лейкоцитах. Они относятся к нециклическим производным арахидоновой кислоты, содержат в своём составе 3 сопряженные двойные связи. Различают несколько видов лейкотриенов. Наиболее распространены ЛТА и ЛТВ, в составе которых отсутствуют аминокислоты. В ЛТС, ЛТД, ЛТЕ содержится несколько аминокислот. Неимунные эффекты лейкотриенов заключаются в том, что они вызывают длительныё Са-независимыё спазм гладкой мускулатуры. Иммунные эффекты ЛТ проявляются в активировании перемещения лейкоцитов в очаг воспаления, синтеза антител. В больших концентрациях ЛТ участвует в воспалительных и аллергических реакциях.
Липоксины содержат 4 сопряжённые двойные связи, являются факторами хемотаксиса, фагоцитоза.
Литература
Ленинджер А. Основы биохимии. - В 3–х т. - М., «Мир», 1985.
Мецлер Д. Биохимия. - В 3–х т. - М., «Мир», 1985.
Спирин А.С. Молекулярная биология. Структура рибосом и биосинтез белка. - М., 1986.
Страйер Л. Биохимия. - В 3–х т. - М., «Мир», 1985.
Теппермен Дж., Теппермен Х. Физиология обмена веществ и эндокринной системы. - М., «Мир», 1989.
Ткачук В.А. Введение в молекулярную эндокринологию. - М., 1983.
Уайт А., Хендлер Ф., Смит Э и др. Основы биохимии. / В 3–х томах. М., «Мир», 1981.
Хашен Р., Шейх Д. Очерки по патологической биохимии. / М., 1982.
Хорст А. Молекулярные основы патогенеза болезней. / М., 1982.
Биохимия / Жеребцов Н.А., Артюхов В.Г., Попова Т.Н. Изд.: ДеЛи, 2002.
Шведова В.Н., Комов В.П., Биохимия. Изд.: ДРОФА, 2004.
Коничев А.С., Севастьянова Г.А. Биохимия и молекулярная биология. Словарь терминов. Изд.: ДРОФА, 2008 г.,.
Марри Р. и др. Биохимия человека. - М., 1993.
Биохимия. Краткий курс с упражнениями и задачами. 3-е изд. Николаев А.Я., Северин Е.С., Северин Е.С. Николаев А.Я. Изд.: ГЭОТАР-МЕДИА, 2005.
Биохимия: задачи и упражнения. Коничев А.С
ОБМЕН И ФУНКЦИИ ЛИПИДОВ