БИОЛОГИЧЕСКОЕ ОКИСЛЕНИЕ
Реферат
БИОЛОГИЧЕСКОЕ ОКИСЛЕНИЕ
Биологическое окисление – это совокупность окислительных процессов, протекающих в живых организмах. Биологическое окисление выполняет ряд важных функций:
- энергетическая функция – окислительные процессы снабжают биологические процессы энергией.
- биосинтетическая функция – путём окислительных реакций могут синтезироваться новые вещества, необходимые для организма.
- обезвреживающая (детоксикационная) функция - путём окислительных реакций многие вещества лишаются своей токсичности.
По современным представлениям процесс окисления веществ сводится к потере ими электронов. Вещество, теряющее электроны – донор электронов, вещество, присоединяющее электроны – акцептор электронов. Все живые организмы, в зависимости от вида конечного акцептора электронов, делятся на аэробные и анаэробные организмы. У аэробов конечным акцептором электронов служит кислород. У анаэробных организмов электроны переносятся не на кислород, а на какие-то другие вещества
Краткая история учения о биологическом окислении
На первых этапах изучения процессов окисления были предложены теории активации кислорода, в которых предполагался какой-то механизм активации кислорода, поскольку кислород в организме является более активным окислителем, чем вне организма. К теориям этого направления относится, в частности, перекисная теория А.Н. Баха (1847 г.). Согласно ей, в организме есть вещества, которые, взаимодействуя с молекулярным кислородом, образуют перекисные вещества, в которых кислород становится более активным.
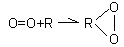
Впоследствии кислород в составе перекиси окисляет многие субстраты в организме. В результате к окисленному веществу присоединяется кислород. Эта теория носит частный характер.
Позже (1911 г.) возникла теория дегидрирования А.В. Палладина. Согласно ей, вещества окисляются не путём присоединения кислорода, а путём потери атомов водорода. В первую анаэробную фазу окисления происходит перенос атомов водорода с субстрата (RH2) на акцептор (X) при участии ферментов дегидрогеназ:
RH2 + X = R + XH2
Во вторую аэробную стадию окисления атомы водорода переносятся с восстановленного акцептора (ХН2) на кислород. Акцептор при этом окисляется и повторно участвует в дегидрировании субстрата
XH2 + O2 = X + H2O
По теории Палладина допускалось участие в окислительных процессах кислорода воды. Теория Палладина более универсальна и положена в основу современных представлений о биологическом окислении.
Процессы биологического окисления могут протекать в разных отсеках клетки. Принято выделять 2 вида окисления: внутримитохондриальное и внемитохондриальное.
Внутримитохондриальное окисление протекает на внутренней мембране митохондрий, выполняет энергетическую функцию.
Внемитохондриальное окисление протекает в цитозоле, ЭПС, пероксисомах и на внешней мембране митохондрий. Оно в основном участвует в биосинтетических и детоксикационных процессах.
В этих видах окислениях участвует большое количество ферментов, коферментов, переносчиков электронов. К ферментам участвующим в биологическом окислении относятся дегидрогеназы, оксигеназы, пероксидазы.
Дегидрогеназы
В зависимости от состава небелковой части дегидрогеназы делят на никотинамидзависимые и флавиновые ферменты.
Никотинамидзависимые дегидрогеназы
Никотинамидзависимые дегидрогеназы - сложные белки, состоящие из белковой и небелковой части. Белковая часть дегидрогеназ определяет их специфичность, имеет молекулярную массу, равную 70 тыс. д. В активном центре дегидрогеназ присутствуют SH группы. Кофермент дегидрогеназ представлен динуклеотидами НАД и НАДФ.
НАД – никотинамидадениндинуклеотид
В состав НАД входят два нуклеотида:
- аденин – рибоза – Н3 РО4
- никотинамид – рибоза - Н3 РО4
НАДФ – никотинамидадениндинуклеотидфосфат.
Состав НАДФ:
- аденин - рибоза (Н3 РО4) - Н3 РО4
- никотинамид – рибоза - Н3 РО4
Коферменты НАД и НАДФ определяют третичную структуру дегидрогеназ, придают активность белковой части фермента и участвуют в переносе кислорода. В организме встречаются дегидрогеназы, активные только в присутствии НАД: лактатдегидрогеназа, малатдегидрогеназа. Имеются ферменты, где коферментом является только НАДФ: глюкозо-6-фосфатдегидрогеназа, 6-фосфоглюконатдегидрогеназа. Для фермента глютаматдегидрогеназы в качестве кофермента возможно использование как НАД, так и НАДФ,
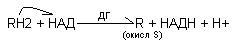
Общий вид реакции, катализируемой НАД (НАДФ)- дегидрогеназами имеет вид:
Субстрат Н2 + кофермент (НАД, НАДФ) субстрат + НАДН2 (НАДН2), т.е. водород отщепляется от окисляемого субстрата, а кофермент при этом восстанавливается.
НАД и НАДФ непрочно связаны с белковой частью фермента. В данной реакции непосредственным акцептором протонов и электронов в составе НАД или НАДФ является часть кофермента - никотинамид.
Механизм восстановления кофермента

В последующем НАДН2 используется в энергетических процессах, а НАДФН2 используется в качестве источника водорода для восстановительных синтезов (синтез жирных кислот, стероидных гормонов, холестерина).
В составе НАД и НАДФ содержится витамин РР.
Витамин РР, никотиновая кислота, противопеллагрический витамин.
Витамин РР содержится в основном в злаках. Суточная потребность в нём составляет 10 мг.
Биологическая роль РР – входит в состав НАД и НАДФ, участвует в процессах биологического окисления. Авитаминоз проявляется заболеванием пеллагрой (шершавая кожа). К её симптомам относятся дерматит, слабоумие (деменция), расстройства функций кишечника ( диарея) - болезнь «трёх Д».
Флавопротеиды – флавиновые дегидрогеназы
Это сложные белки, состоящие из белка и небелковой части, представленной флавинмононуклеотидом (ФМН) или флавинадениндинуклеотидом (ФАД). Белковая часть флавопротеидов имеет большую молекулярную массу около 200 тыс. д. и прочно связывается с небелковой частью.
ФМН – флавинмононуклеотид, состоит из флавина, рибитола, Н3РО4.
ФАД – флавинадениндинуклеотид, включает флавиновый и адениловый нуклеотиды:
- флавин – рибитол - Н3РО4.
- аденин – рибоза - Н3РО4.
Общий вид реакции с участием флавопротеидов:
1 стадия
субстратН2 + ФМН (ФАД) флавопротеид субстрат + ФМНН2 (ФАДН2)
2 стадия флавопротеид
ФМНН2 (ФАДН») + Х ФМН (ФАД) +ХН2
акцептор
В качестве субстратов для флавопротеидов служат янтарная кислота, активные формы жирных кислот. В этом случае флавопротеиды являются первичными акцепторами протонов и электронов для этих веществ. Донором водорода для флавопротеидов может также служить молекула НАДН2. В этом случае флавопротеиды являются промежуточными акцепторами протонов и электронов. В качестве акцепторов электронов для флавопротеидов могут являться убихинон (во внутримитохондриальном окислении) или непосредственно кислород (во внемитохондриальном окислении). Непосредственным переносчиком протонов и электронов в составе флавопротеидов служит флавин.
Схема восстановления флавина:
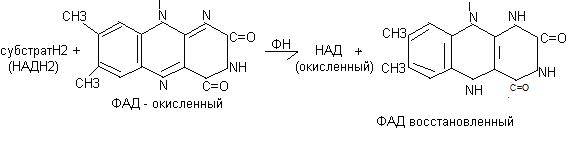
В составе ФМН и ФАД содержится витамин В2
Витамин В2 , рибофлавин, витамин роста.
Рибофлавин включает флавин и рибитол. Рибофлавин распространён в оболочке злаков, в дрожжах. Суточная потребность в нём составляет 1-2 мг. Биологическая роль – входит в состав ФМН и ФАД, участвует в биологическом окислении.
Авитаминоз проявляется в виде дерматита, катаракты, анемии, поражении сердечной мышцы
Убихинон (КоQ)
Убихинон - небелковое жирорастворимое вещество, перемещающееся во внутренней мембране митохондрий. Его роль сводится к переносу электронов и протонов от флавопротеидов на цитохромы.
Общий вид реакции с участием убихинона:
ФМНН2 + КоQ ФП ФМН (окисл) + КоQН2 (восст)
Механизм восстановления убихинона:

Цитохромы
Цитохромы - гемсодержащие белки. Различные виды цитохромов обозначают латинскими буквами А, А3, С, С1, В, В5, Р450. Цитохромы отличаются строением белковой части, структурой гема, оптическими свойствами, величиной окислительно-восстановительного потенциала. Их роль заключается в переносе электронов за счёт окисления и восстановления содержащегося в их составе атома железа: Fe2+ Fe3+
Большинство цитохромов переносят электроны друг от друга в зависимости от величины их окислительно-восстановительного потенциала. И только один комплекс - цитохромоксидаза способен переносить электроны непосредственно на кислород. В связи с этим цитохромоксидаза – конечный (терминальный) участок в цепи переноса электронов. Цитохромоксидаза включает в себя два гема двух цитохромов цА и цА3, ионы меди, 6 полипептидных цепей, имеет молекулярную массу 450 тысяч дальтон. Цитохромоксидаза может переносить 4 электрона непосредственно на молекулу О2 с образованием воды.
Оксигеназы
Оксигеназы - это ферменты, катализирующие окисление веществ путём присоединения одного или двух атомов кислорода. Различают монооксигеназы и диоксигеназы. Они участвуют во внемитохондриальном окислении (смотри дальше)
Пероксидазы
Пероксидазы - это ферменты, катализирующие окислительные реакции с участием пероксидных соединений во внемитохондриальном окислении (смотри дальше).
Внутримитохондриальное окисление. Окислительное фосфорилирование.
Митохондрии поглощают до 80-90% всего потребляемого клеткой кислорода. Все компоненты внутримитохондриального окисления встроены во внутреннюю мембрану митохондрий в определённой последовательности и образуют дыхательные цепи или цепи переноса электронов (ЦПЭ). Дыхательными цепями они называются в связи с тем, что очень часто внутримитохондриальное окисление называют внутритканевым дыханием. Расположение компонентов цепи переноса электронов во внутренней мембране митохондрий определяется величиной их окислительно-восстановительного потенциала.
В начале ЦПЭ находятся вещества с отрицательным окислительно-восстановительным потенциалом. Эти вещества легче отдают электроны. У каждого следующего компонента увеличивается величина окислительно – восстановительного потенциала. Вещества с более высоким положительным потенциалом легче принимают электроны. Таким образом, в результате перепада потенциалов в цепи происходит спонтанное, самопроизвольное перемещение электронов от начала цепи до её конца. В митохондриях принято различать короткую и длинную дыхательные цепи.
Длинная дыхательная цепь.
Длинная дыхательная цепь включает в себя окисление, начинающееся в матриксе митохондрий при участии НАД (НАДФ)- дегидрогеназ. В длинной цепи окисляются изолимонная кислота, яблочная кислота, жирные кислоты, молочная кислота.
В матриксе происходит дегидрирование субстратов с переносом электронов и протонов на кофермент НАД (НАДФ).
НАД - зависимая дегидрогеназа выполняет роль коллектора электронов и протонов от окисляемых веществ. Образующаяся восстановленная форма НАД затем включается в длинную дыхательную цепь, в которой НАДН2 окисляется при участии флавопротеидов по схеме:.

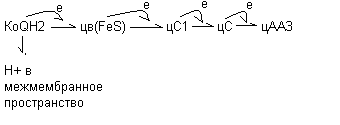
В последующем электроны с восстановленной формы флавопротеидов переносятся при участии железосеросодержащих белков (Fe-S комплексов) на следующий компонент: КоQ по схеме:
Н+ из матрикса
ФМНН2 (FeS) + KoQ ФМН+ КоQH2
ФП
Н+ в межмембранное пространство
КоQН2 окисляется системой цитохромов, на которые с КоQ перебрасываются только электроны, а протоны выделяются в межмембранное пространство:
Под действием цитохромоксидазы на молекулу кислорода перебрасываются 4 электрона с образованием восстановленной формы кислорода 2О 2-, который в последующем взаимодействует с 4Н+ с образованием Н2О.
В общем виде длинная дыхательная цепь имеет вид:
RH2
+
НАД
НАДН2 ФП(FeS) KoQ цВ (FeS) цС1 цС цА, А3 О2
Короткая дыхательная цепь.
В короткой дыхательной цепи окисляются субстраты, для которых первичным акцептором электронов является флавопротеид (отсутствует этап окисления субстрата НАД-ДГ). Веществами, окисляющимися в короткой цепи, являются янтарная кислота, активные формы жирных кислот, глицерофосфат.
Первая стадия окисления: 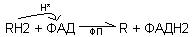
В последующем ФАДН2 при участии флавопротеидов*(FeS*), окисляется КоQ:

Восстановленный КоQ далее окисляется также, как и в длиной дыхательной цепи, системой цитохромов:
Длинная и короткая дыхательные цепи включают в свой состав структурно-функциональные фрагменты, которые называются окислительными (дыхательными) комплексами. В длинной цепи выделяют 3 основных комплекса (I, III, IV), а в короткой 2 (III, IV).
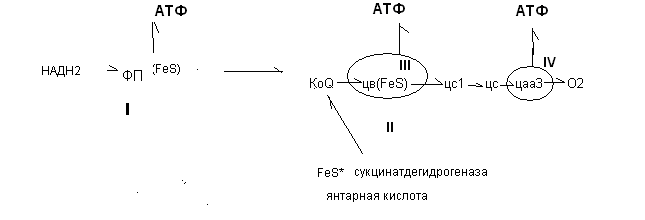
I комплекс - НАДН - дегидрогеназный комплекс располагается между НАДН2 и КоQ и включает в себя ФП и FeS – белки
III комплекс - КоQН2-дегидрогеназный или (цитохром С - редуктазный комплекс) располагается между КоQ и ц С и включает в себя ц В, FeS- белки, цС1
IV комплекс - цитохромоксидазный комплекс – окисляет цС и включает в себя цА,А3
II дополнительный сукцинатдегидрогеназный комплекс включает ФП* и FeS*,
Каждый дыхательный комплекс может быть выключен из работы дыхательной цепи определёнными веществами – ингибиторами.
Ингибиторы первого комплекса – амитал, барбитураты, ротенон
Ингибитор второго комплекса – малонат
Ингибитор третьего комплекса – антимицин А
Ингибиторы четвертого комплекса – Н2S, цианиды, СО
Энергетический обмен
Внутримитохондриальное окисление тесно связано с энергетическим обменом. Энергетический обмен – сбалансированное протекание реакций образования и реакций использования энергии.
Реакции, идущие с высвобождением энергии, называется экзоргиническими реакциями, а идущие с поглощением энергии - эндорганическими. Основным экзоргоническим процессом в организме является транспорт электронов по дыхательной цепи. Окислительно-восстановительный потенциал начальных компонентов НАД окисленный /НАД восстановленный составляет -0,32 в. Окислительно-восстановительный потенциал конечных компонентов дыхательной цепи равен +0,82 в.
В результате разницы потенциалов в ЦПЭ происходит перемещение электронов с большой энергией. В процессе транспорта электронов высвобождается энергия. Та энергия, которая может быть использована на выполнение какой-то работы, – свободная энергия. Энергия, освобождающаяся в дыхательной цепи, рассчитывается по формуле:
F = -23*n*е,
где n- количество переносимых электронов на атом О2 (2е),
е – перепад окислительно-восстановительного потенциала между началом и концом ЦПЭ.
е = 0,82 –(-0,32) = 1,14 в F = -23*2*1,14 = -52 ккал/моль
Высвободившаяся энергия может быть использована организмом на выполнение различных видов работы:
- механической работы – сокращение мышц
- химической работы - на синтез новых веществ
- осмотической работы – перенос ионов против градиента концентрации
- электрической работы – возникновение потенциалов в нервной системе
Все организмы в зависимости от вида энергии, которую они используют для выполнения работы, делятся на два вида: фототрофы – могут использовать энергию солнечного света, хемотрофы – могут использовать энергию только химических связей особых макроэргических веществ.
Макроэргические вещества – вещества, при гидролизе связей которых высвобождается энергия более 5 ккал/моль. К ним относят фосфоенолпируват, креатинфосфат, 1,3-дифосфоглицерат, ацилы жирных кислот, АТФ (ГТФ, ЦТФ, УТФ). Среди перечисленных макроэргов центральное место занимает АТФ. АТФ является аккумулятором и источником химической энергии. В молекуле АТФ заключена энергия от 7,3 ккал/моль (в стандартных условиях) до 12 ккал/моль (в физиологических условиях). В состав АТФ входят аденин, рибоза, 3 остатка Н3РО4. АТФ синтезируется из АДФ и фосфорной кислоты с затратой энергии. Распад АТФ, наоборот, является экзэргоническим процессом. Основным источником энергии для синтеза АТФ является перенос электронов по дыхательной цепи. Присоединение Н3РО4 называется – фосфорилированием.
Окислительное фосфолирирование
Процесс синтеза АТФ из АДФ и Н3РО4, за счёт энергии транспорта электронов по ЦПЭ называется окислительным фосфорилированием. Процессы окисления в дыхательной цепи и синтез АТФ тесно взаимосвязаны (сопряжены). При этом ведущим процессом является транспорт электронов, а сопутствующим является фосфорилирование. Участки дыхательной цепи, на которых происходит синтез АТФ, называются участками сопряжения. Их в длинной цепи три (1, 3, 4 – окислительные комплексы), в короткой дыхательной цепи их два (3,4 комплексы). Если вещество окисляется в длинной дыхательной цепи, то максимально синтезируется три молекулы АТФ. Эффективность сопряжения окислительного фосфолирирования выражается коэффициентом фосфолирирования (Р/О). Он показывает, сколько молекул Н3РО4 присоединяется к АДФ при переносе двух электронов на один атом кислорода, то есть, сколько синтезируется молекул АТФ при переносе двух электронов на один атом кислорода. Для длинной цепи коэффициент Р/О равен 3, для короткой - 2.
Механизм окислительного фосфорилирования.
Впервые в тридцатые годы факт синтеза АТФ в процессе окисления был выявлен отечественным биохимиком В.А. Энгельгардтом. Основной гипотезой объяснения механизма окислительного фосфорилирования стала хемоосмотическая
теория П. Митчела. Согласно ей, при транспорте электронов по дыхательной цепи возникает протонный потенциал, который и аккумулирует энергию, освободившуюся при переносе электронов. Впоследствии протонный потенциал используется для синтеза АТФ. Возникновение протонного потенциала связано с непроницаемостью для протонов внутренней мембраны митохондрий. В результате транспорта электронов по дыхательной цепи одновременно происходит выталкивание Н+ из матрикса в межмембранное пространство. Считается, что в матрикс поступает 6 – 10 Н+. В результате этого происходит закисление в межмембранном пространстве, возникает перепад рН (рН) и одновременно заряжается внутренняя мембрана митохондрий, возникает мембранный потенциал. Совокупность мембранного потенциала и рН и образуют протонный потенциал –Н+.
В трансформировании протонного потенциала в энергию АТФ участвует фермент АТФ-синтетаза, встроенный во внутреннюю мембрану митохондрий. Это олигомерный фермент, включает два функциональных участка. Один из них формирует во внутренней мембране гидрофильный протонный канал, по которому Н+ из межмембранного пространства по градиенту концентрации с огромной скоростью и энергией возвращается в матрикс. Второй участок – фосфорилирующий направлен в сторону матрикса. Поток Н+ вызывает конформационные перестройки фосфорилирующей части фермента, что сопровождается синтезом АТФ из АДФ и Н3РО4.
Регуляция окислительного фосфолирирования.
Регуляция процессов окисления и фосфорилирования осуществляется путем дыхательного контроля – изменение скорости окисления в дыхательной цепи при изменении соотношения концентраций АТФ и АДФ. При увеличении концентрации АТФ, скорость переноса электронов по дыхательной цепи замедляется, и, наоборот, при увеличении концентрации АДФ скорость переноса электронов увеличивается.
Дыхательный контроль приводит в соответствие процессы образования и использования энергии в организме. В физиологических условиях процессы окисления и процессы синтеза АТФ тесно сопряжены. Степень сопряжения увеличивает гормон инсулин, витамины Е, К.
В то же время в физиологических условиях и в патологических условиях возможно явление разобщения окисления и фосфорилирования.
Разобщение – частичное или полное прекращение синтеза АТФ при сохранении транспорта электронов по дыхательной цепи. Способствуют частичному разобщению высокие концентрации гормонов щитовидной железы, билирубина, свободных жирных кислот, динитрофенола.
Механизм действия разобщителей заключается в том, что, будучи жирорастворимыми веществами, они обеспечивают транспорт Н+ через внутреннюю мембрану митохондрий из межмембранного пространства в матрикс, минуя протонную АТФ-азу. Это снижает протонный потенциал и, следовательно, синтез АТФ.
В физиологических условиях частичное разобщение выполняет важную терморегуляторную роль. В норме свободная энергия, равная 52 ккал/моль, распределяется следующим образом: 60% - используется на выполнение работы, 40% на согревание организма. При увеличении теплоотдачи организма при низкой внешней температуре происходит частичное разобщение окисления и фосфолирирования и в результате снижается доля свободной энергии использующейся на работу, но одновременно увеличивается энергия, расходуемая на поддержание температуры тела.
Таким образом, у хемотрофных организмов основным аккумулятором и основным источником энергии является АТФ. АТФ синтезируется из АДФ и расщепляется с образованием АДФ, поэтому в тканях постоянно осуществляется цикл АДФ - АТФ. Пути синтеза АТФ:
- транспорт электронов по дыхательной цепи
- субстратное фосфорилирование – окисление некоторых субстратов обязательно сопровождается синтезом АТФ
- синтез АТФ из других макроэргов (за счёт креатинфосфата)
- синтез АТФ из двух молекул АДФ
АТФ является энергетической «разменной валютой» клетки.
Особенности энергетического обмена у детей.
Они определяются высокими энергозатратами в детском возрасте. Для детей скорость окислительных процессов в течение первого года в три раза выше, чем у взрослых, а в более позднем возрасте далее в два раза. Это проявляется в более высокой потребности в кислороде, калорической ценности рациона, скорости обмена АТФ, активности ферментов энергетического обмена. В то же время, у детей существует несовершенство регуляции энергетического обмена. Могут возникать диспропорции между процессами образования энергии и теплоотдачей. В детском возрасте органом термогенеза или теплообразования является бурая жировая ткань, в которой происходит нефосфолирирующее окисление (энергия окисления субстрата используется не на работу, а на образовании тепла).
Нарушение энергетического обмена.
Снижения энергетического обмена - гипоэргические состояния могут возникать при недостатке кислорода, питательных веществ, повреждении митохондрий, разобщении окислительного фосфорилирования под действием токсинов и микроорганизмов. Для лечения гипоэргических состояний используют цитохромы, КоQ, витамины. В последнее время изучаются и выявляются особенности гипоэргических состояний, которые обозначаются как митохондриальные болезни Их связывают с мутациями ДНК как митохондриальных, так и ядерных.
Внемитохондриальное окисление.
Внемитохондриальное окисление протекает в ЭПС, пероксисомах, на внешней мембране митохондрий, цитозоле. Этот вид окисления в разных тканях расходует разное количество кислорода.
Основные функции внемитохондриального окисления:
- антитоксическая функция – обезвреживание путём окисления токсических веществ
- синтез новых соединений путём окислительных реакций
Различают несколько видов внемитохондриального окисления в зависимости от их внутриклеточной локализации и от участвующих компонентов. Во внемитохондриальном окисление принимают участие флавопротеиды, цтохром Р450, цитохром В5, ферменты оксигеназы, пероксидазы.
Окисление с участием оксидаз.
Окисление с участием оксидаз происходит в основном на внешней мембране митохондрий. Оксидазы – аэробные флавиновые дегидрогеназы, которые переносят электроны от окисляемых субстратов по короткой цепи на кислород. Примеры: окисление некоторых аминокислот ферментами аминокислотооксидазой, аминов – аминооксидазами, ксантина – ксантинооксидазами. В результате такого окисления в тканях образуется очень активные радикалы кислорода (АФК)
- О2 + 1еФП О2-+ - ион – радикал (супероксид)
- О2 + 2еФП О2 2- – пероксид радикал
- О2-+ + Н2О2 О2* + ОН+ + ОН.
В физиологических условиях образуется очень незначительное количество активных форм О2. Они выполняют функцию регуляции проницаемости клеточных мембран путём окисления липидов в составе мембран, активности мембранных ферментов, участвуют в синтезе биологически активных эйкозаноидов. Особо важную роль в физиологических условиях АФК играют в фагоцитозе т.к. принимают участие в нескольких механизмах фагоцитоза.
- При контакте с чужеродными веществами в фагоцитах активируется мембранная флавиновая оксидаза, под действием которой образуются ион-радикалы О2, вызывающие окисление чужеродного вещества.
- В фагоцитах активируется фермент миелопероксидаза, которая путём окисления хлоридов через образование НСLО образует атомарный кислород, который окисляет чужеродные вещества, повышает проницаемость мембран фагоцитов и облегчает эндоцитоз.
- Образующийся из NО сильный окислитель ONOO так же участвует в фагоцитозе
- Пептиды – дефензины формируют в оболочках поглощаемых микроорганизмах дополнительные ионные каналы и способствуют разрушению микроорганизмов
При фагоцитозе потребление кислорода увеличивается в 2-5 раз, и это явление называется «окислительным взрывом»
В патологических условиях высокие концентрации активных форм кислорода оказывают токсический эффект, окисляют липиды, белки, нуклеиновые кислоты. NO обладает угнетающим действием на окислительное фосфолирирование. Поэтому в организме для разрушения избыточных концентраций активных форм кислорода существует защитная антиокислительная система. Она представлена ферментами и веществами неферментативной природы. К антиоксиданстным ферментам относят:
- супероксиддесмутаза – разрушает ион-радикал кислорода
- каталаза – разрушает пероксид
- глютатионпероксидаза – разрушает пероксидазы при участии пептида глютатиона.
К неферментативным веществам относят: белки, содержащие SH - группы, глютатион, витамины Е, А, С, некоторые гормоны, белки крови (трансферрин, церулоплазмин), селен.
Окисление с участием оксигеназ.
Окисление с участие оксигеназ наиболее активно протекает в ЭПС. В нём участвуют диоксигеназы и монооксигеназы.
Диоксигеназы – окисляют субстрат путем присоединения двух атомов кислорода по схеме: R + O2 RO2. Примерами могут служить: окисление гомогентизиновой кислоты диоксигеназой гомогентизиновой кислоты, окисление триптофана трипотофанпирролазой с разрывом пиррольного кольца.
Монооксигеназы окисляют субстраты путем присоединение одного атома кислорода. Данный вид окисления активно происходит в ЭПС печени, где на него тратится до 50% поглощаемого кислорода. В микросомальном окислении участвуют дополнительные вещества – косубстраты НАДН2 или витамин С. Микросомальное окисление в основном выполняет антитоксическую функцию (обезвреживаются продукты гниения белков, лекарственные вещества). Путём этого варианта окисления синтезируются некоторые аминокислоты (тир), биогенные амины. Благодаря микросомальному окислению происходит биотрансформация различных ксенобионтов. В них формируется гидроксильная группа, к которой в последующем присоединяются глюкуроновая кислота, Н2SО4, глютатион.
Пероксидазное окисление.
Пероксидазное окисление происходит по схеме:
RН2 + Н2О2 = R + Н2О
Примеры пероксидаз: каталаза, глютатионпероксидаза, йодидпероксидаза (участвует в синтезе тиреоидных гормонов).
ОБЩИЕ ПУТИ КАТАБОЛИЗМА
Катаболизм основных органических веществ протекает в несколько этапов. На первом этапе происходит распад сложных веществ до их составных компонентов: белков – до аминокислот, жиров – до глицерина и жирных кислот, углеводов - до моносахаридов. Эти реакции специфичны и не сопровождается высвобождением энергии.
На втором этапе образующиеся мономеры с помощью специфических реакций превращаются в два общих продукта распада: пировиноградную кислоту и ацетил-КоА. На втором этапе высвобождается четверть энергии, заключённой в исходных органических веществах.
На третьем этапе общие продукты катаболизма: пировиноградная кислота (ПВК) и ацетил- КоА включаются в дальнейшее окисление. На этом этапе высвобождается 2/3 всей энергии.
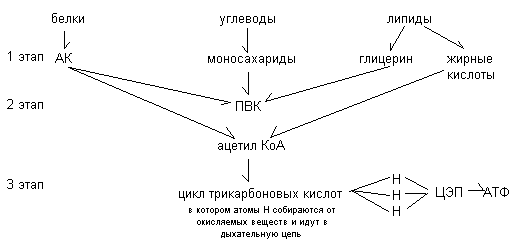
Схема общих путей катаболизма.
Окислительное декарбоксилирование пировиноградной кислоты
Если в процессе катаболизма белков, жиров, углеводов образуется ПВК, для дальнейшего окисления необходим переход её в ацетил КоА. Этот процесс называется окислительным декарбоксилированием пировиноградной кислоты. В нём заключено два вида реакций: окисление и образование СО2 путём разрушения карбоксильной группы. Окислительное декарбоксилирование пирувата осуществляется при участии пируватдегидрогеназного комплекса.
Состав полиферментного пируватдегидрогеназного комплекса
Пируватдегидрогеназный комплекс (ПДК) молекулярной массой 6*106 дальтон, включает в себя три вида ферментов (Е1-Е3) и пять видов коферментов. 2 кофермента НАД и HS-КоА находятся в свободном состоянии и входят в состав комплекса только в момент реакции. Общий вид реакции окислительного декарбоксилирования пирувата:
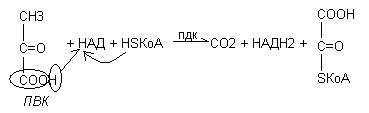
Ферменты пируватдегидрогеназного комплекса
Е1 – пируватдегидрогеназа (пируватдекарбоксилаза)
Е2 – дигидролипоилацетилтрансфераза (трансацетилаза)
Е3 – дигидролипоилдегидрогеназа
Коферменты пируватдегидрогеназного комплекса
- Тиаминдифосфат (ТДФ, ТПФ), содержащий витамин В1, кофактор пируватдегидрогеназы
- Липоевая кислота, кофактор трансацетилазы
- Кофермент ФАД, содержащий витамин В2, кофактор дегидрогеназы дигидролипоевой кислоты
- Кофермент НАД, содержащий витамин РР
- Кофермент НS-КоА, содержащий аденин, рибозу, два остатка фосфорной кислоты, пантотеновую кислоту (витамин В3)
Окислительное декарбоксилирование ПВК протекает в несколько стадий, в процессе которых двухуглеродный фрагмент, образующийся из ПВК, переносится на липоевую кислоту, а затем на HS-КоА.

Биологическая роль окислительного декарбоксилирования пирувата заключается в том, что оно является важным этапом катаболизма, позволяющим включаться в цикл Кребса тем веществам, при распаде которых образуется ПВК. Образовавшаяся молекула НАДН2 окисляется в длинной дыхательной цепи с образованием 3-х молекул АТФ. Окислительное декарбоксилирование пирувата протекает внутри митохондрий.
Регуляция пируватдегидрогеназного комплекса осуществляется путём фосфолирирования, дефосфолирирования пируватдегидрогеназы
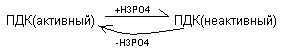
Активаторами ПДК служат АДФ и НАД окисленный. Ингибиторами этого комплекса являются АТФ и НАДН2..
В состав ПДК входит пять витаминов.
Липоевая кислота
Липоевая кислота - витаминоподобное вещество, представляет собой восьмиуглеродную жирную кислоту с двумя -SH группами. Биологическая роль: является коферментом ПДК, участвует в окислении - кетокислот.
Пантотеновая кислота
Пантотеновая кислота является витамином, который, в свою очередь, включает - аланин и производное масляной кислоты. Она распространена в животных и растительных продуктах. Суточная потребность в пантотеновой кислоте составляет до 10 мг. Биологическая роль: входит в состав НS- КоА и участвует в окислительном декарбоксилировании - кетокислот, участвует в активации жирных кислот. Авитаминоз проявляется дерматитом, депигментацией волос, поражением нервной системы.
Витамин В1, тиамин, антиневритный витамин
Витамин В1 включает в свой состав пиримидиовое кольцо, содержит аминогруппу. Суточная потребность в нём составляет 2 мг. Тиамин содержится в злаках, дрожжах. Биологическая роль: входит в состав кофермента ТДФ и участвует в окислительном декарбоксилировании - кетокислот, является коферментом окисления глюкозы по пентозофосфатному пути. Авитаминоз проявляется полиневритами (болезнь бери-бери).
Цикл трикарбоновых кислот (цикл Кребса)
Ацетил-КоА окисляется в цикле трикарбоновых кислот - цикле Кребса. В данном цикле происходит полное окисление ацетил-КоА. Цикл начинается с взаимодействия ацетил-КоА с щавелевоуксусной кислотой (ЩУК), а заканчивается образованием щавелевоуксусной кислоты. Цикл трикарбоновых кислот (ЦТК) протекает внутри митохондрий.
Химизм цикла Кребса (цикла трикарбоновых кислот)
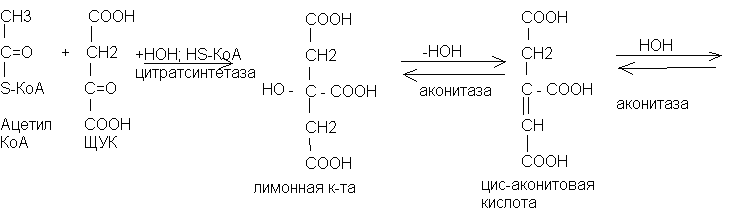
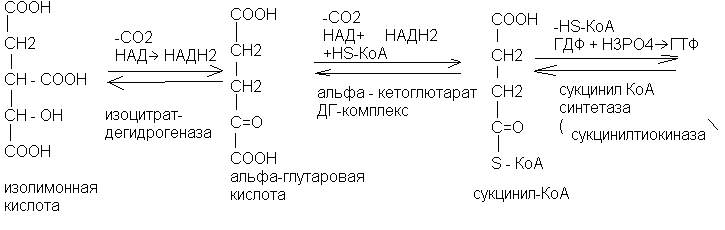
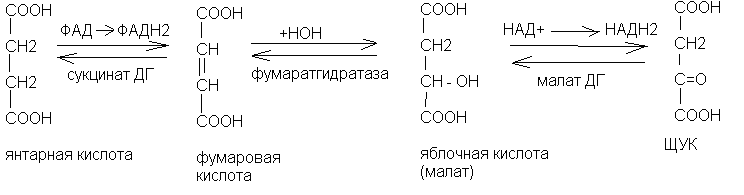
Биологическое значение цикла Кребса
- Энергетическая функция. Энергетическая эффективность выражается количеством молекул АТФ
В цикле Кребса выделяют 3 реакции, идущие с образованием НАДН2 по схеме:
RH2 + НАДR+НАДН2.. Их катализируют ферменты:
- изоцитратдегидрогеназа
- кетоглютаратдегидрогеназный комплекс
- малатдегтдрогеназа
Образовавшиеся в ЦТК 3 молекулы НАДН2 в последующем окисляются в длинной ЦПЭ с образованием 9 молекул АТФ (при окислении каждой НАДН2 синтезируется 3 молекулы АТФ).
В ЦТК одна реакция (сукцинатдегидрогеназная) протекает по схеме:
RН2 + ФАД R + ФАДН2
Образовавшийся в ЦТК ФАДН2 окисляется в короткой ЦПЭ, давая энергию для синтеза 2 молекул АТФ.
В сукцинилтиокиокиназной реакции ЦТК непосредственно образуется 1 макроэрг – ГТФ (1 ГТФ = 1 АТФ)
В целом общая энергетическая эффективность ЦТК составляет 12 молекул АТФ
- Анаболическая функция заключается в том, что некоторые метаболиты цикла Кребса не окисляются в нём, а используются для синтеза новых веществ. Например, альфа - кетоглютаровая используется на синтез глютаминовой кислоты. Сукцинил-КоА используется на синтез гема. Ацетил КоА идёт на синтез жирных кислот, холестерина.
Щавелевоуксусная кислота может участвовать в синтезе аспарагиновой кислоты.
- Взаимосвязь обмена белков, жиров, углеводов.
Аминокислоты Цикл Кребса Углеводы
Липиды
Регуляция активности ЦТК
Ключевыми ферментами ЦТК являются цитратсинтетаза и изоцитратдегидрогеназа. Они ингибируются высокой концентрацией АТФ и НАДН2. Активаторами этих ферментов являются АДФ и НАД окисленный.
Лимитирующим фактором цикла Кребса являются запасы щавелевоуксусной кислоты. Запасы щавелевоуксусной кислоты могут пополняться 2 путями:
А) дезаминированием аспарагиновой кислоты по схеме:
аспарагиновая кислота -NН3 + Н2О ЩУК
Б) карбоксилированием пировиноградной кислоты по схеме:
ПВК + СО2 ЩУК
ОБМЕН И ФУНКЦИИ УГЛЕВОДОВ
Термин «углеводы» связан с тем, что большинство веществ этого класса соответствуют формуле Сn(H2O)m.
Содержание углеводов в организме человека в среднем составляет около 2%. Наиболее высоко содержание углеводов в печени, соединительной ткани.
Углеводы выполняют многие функции в организме:
- Энергетическая: окисление 1 г углеводов даёт 3,75 ккал
- Структурная функция: входят в состав клеточных мембран, рецепторов, межклеточного вещества, соединительной ткани.
- Входят в состав других важных для организма веществ (нуклеиновые кислоты, АТФ, НАД, ФАД и др.)
- Вместе с белками в составе гликопротеидов выполняют специфические функции:
- иммунная функция (иммуноглобулины)
- транспортная функция (трансферрин, некоторые гормоны)
- ферментативная функция (холинэстераза)
- рецепторная функция
- коммуникативная функция (межклеточные взаимодействия)
Классификация углеводов
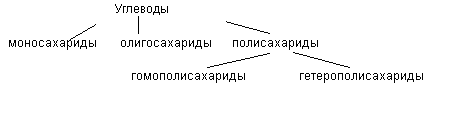
Моносахариды.
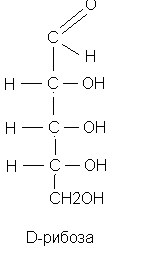
По химической природе они являются альдегидо - и кетоспиртами. В зависимости от числа углеродных атомов выделяют триозы, тетрозы, пентозы, гексозы, гептозы.
Наиболее распространёнными в организме пентозами являются рибоза, дезоксирибоза, рибулоза, ксилулоза. Гексозы организма в основном представлены глюкозой, фруктозой, галактозой, маннозой.

Производные моносахаридов.
Аминосахара – производные моносахаридов. у которых ОН - группа во 2 положении замещена на аминогруппу.
Ацетиламиносахара – производные аминосахаров, у которых к аминогруппе присоединён остаток уксусной кислоты.

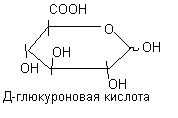
Гексуроновые кислоты – производные гексоз, у которых в 6-ом положении содержится СООН - группа.
О - гликозиды – производные циклических форм моносахаридов, у которых к гликозидному гидроксилу присоединён какой-либо спирт.
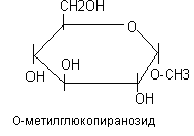
N-гликозиды – производные моносахаридов, в которых к полуацетальному гидроксилу присоединяется азотсодержащее вещество.
Олигосахариды
Олигосахариды представлены дисахаридами и смешанными олигосахаридами.
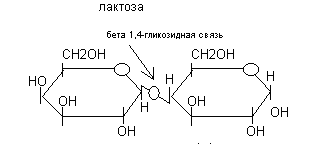
К наиболее распространённым дисахаридам относятся мальтоза (2 глюкозы), сахароза (глюкоза и фруктоза), лактоза (галактоза и глюкоза).
Лактоза - специфический дисахарид молока (в грудном молоке её содержится 6,5% или 65 г/л).

Смешанные олигосахариды представлены несколькими углеводами, соединёнными гликозидными связями. Чаще всего в их составе содержатся моносахариды манноза, фруктоза, нейраминовая кислота, галактоза. Олигосахариды в комплексе с белками определяют групповую специфичность крови, резус - фактор, входят в состав иммуноглобулинов, клеточных рецепторов, определяют межклеточные взаимодействия.
В грудном молоке присутствует большое количество специфичных олигосахаридов, например: фукозилактоза (фукоза, галактоза, глюкоза); лакто- N -тетраоза (галактоза,глюкоза, фукоза, N-ацетилглюкозамин), бифидус-фактор.
Полисахариды.
Полисахариды представлены гомополисахаридами (состоят из одного вида моносахарида) и гетерополисахаридами (включают разные моносахара и их производные)
Основными гомополисахаридами для организма являются крахмал (пищевой полисахарид) и гликоген (резервный полисахарид организма)
Гликоген
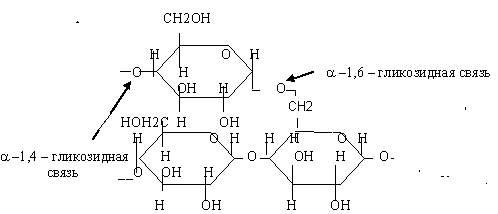
Наиболее высокая концентрация гликогена находится в печени – 5%, в мышцах – 2%. Он состоит из цепей циклических форм глюкозы, соединенных 1,4--гликозидной связью, ветвящихся за счёт 1,6-альфа - гликозидных связей. Молекулярная масса гликогена высока, достигает 107-109 дальтон. Биологическая роль гликогена: является резервным энергетическим материалом, который очень легко может перейти в глюкозу.
Гетерополисахариды
Гетерополисахариды гликозаминогликаны (ГАГ) – линейные неразветвлённые полисахариды, построенные из дисахаридных фрагментов, которые, в свою очередь, в свой состав включают гексуроновую кислоту и N - ацетилгексозаминсульфат.
В зависимости от состава дисахаридных фрагментов выделяют несколько видов ГАГ:
- гиалуроновая кислота
- хондроигинсульфаты
- кератансульфаты
- гепарин, гепарансульфат.
Гиалуроновая кислота включает в свой состав глюкуроновую кислоту и N-ацетилглюкозамин. Её молекулярная масса достигает 105-107 д. Гиалуроновая кислота содержится в межклеточном веществе соединительной ткани, в синовиальной жидкости, в слизистых секретах. За счёт присутствия большого количества полярных групп гиалуроновая кислота очень гидрофильна (1 грамм её может связать до 500 мл воды). Биологическая роль:
- играет роль тканевого цемента, соединяет клетки, волокнистые структуры в единую ткань
- участвует в водно-солевом обмене
- определяет сосудисто-тканевую проницаемость
- придаёт тургор ткани
Хондроитинсульфаты содержат в своём составе глюкуроновую кислоту, N-ацетилгалактозамин сульфат. Они распространены в хрящевой ткани, коже, сухожилиях. Молекулярная масса их составляет 18-28 тысяч дальтон. Выделяют несколько видов хондроитинсульфатов: хондроитин -4- сульфаты (остаток сульфата в N-ацетилгалактозамине находится в 4 положении), хондроитин -6-сульфаты (сульфат находится в 6 положении), дерматансульфаты (содержат идуроновую кислоту). Биологическая роль хондроитинсульфатов: структурные компоненты соединительной ткани.
Кератансульфаты содержат в своём составе N-ацетилглюкозаминсульфат, галактозу,. С возрастом содержание кератансульфатов в межпозвоночных хрящах, в роговице возрастает.
Гепарин включает в свой состав глюкоранатсульфат (или идуронатсульфат), N-ацетилглюкозаминсульфат. Гепарин синтезируется в тучных клетках. Биологическая роль гепарина: является антикоагулянтом, структурным компонентом базальных мембран, активатором некоторых ферментов, выполняет дезинтоксикационную функцию.
Гликозаминогликаны чаще всего находятся в тканях не в свободном состоянии, а в составе протеогликанов.
Протеогликаны (ПГ) – это белковоуглеводные комплексы, в которых содержатся белки (<5%), а углеводная часть представлена гликозаминогликанами. В хрящевой ткани протеогликаны образуют особые структуры – протеогликановые агрегаты. Наиболее распространённым среди них является агрекан. Он имеет структуру, представленную на рисунке. Этот агрегат имеет молекулярную массу до 1 миллиарда д. Наряду большими агрегатами в соединительной ткани присутствуют малые протеогликановые агрегаты, например, бигликаны, в которые входят одна полипептидная цепь и две - три углеводные цепочки.
Особенности содержания и обмена ГАГ и ПГ у детей.
- Повышенно содержание протеогликанов, что обуславливает физиологическую гипергидратацию новорожденных.
- Иное распределение ГАГ: преобладает содержание гиалуроновой кислоты по сравнению с уровнем хондроитинсульфатов и кератансульфатов.
- Более активен обмен ГАГ
- Относительно высокое выделение ГАГ с мочой
Переваривание углеводов