Биообъект как средство производства лекарственных,диагностических и профилактических препаратов
Вопрос 9.
Биообъект как средство производства лекарственных,диагностических и профилактических препаратов.Определение.Требования.Классификация.Примеры.
Ответ.
Биообъект-это продуцент, биосинтезирующий нужный продукт, либо катализатор, фермент, который катализирует присущую ему реакцию.
Требования, предъявляемые к биологическим объектам.
Для реализации биотехнологических процессов важными параметрами биообъектов являются: чистота, скорость размножения клеток и репродукции вирусных частиц, активность и стабильность биомолекул или биосистем.
Следует иметь в виду, что при создании благоприятных условий для избранного биообъекта биотехнологии эти же условия могут оказаться благоприятными, например, и для микробов – контаминантов, или загрязнителей. Представителями контаминирующей микрофлоры являются вирусы, бактерии и грибы, находящиеся в культурах растительных или животных клеток. В этих случаях микробы-контаминанты выступают вредителями производств в биотехнологии. При использовании ферментов в качестве биокатализаторов возникает необходимость предохранения их в изолированном или иммобилизованном состоянии от деструкции банальной сапрофитной (не болезнетворной) микрофлорой, которая может проникнуть в сферу биотехнологического процесса извне вследствие нестерильности системы.
Активность и стабильность в активном состоянии биообъектов – одни из важнейших показателей их пригодности для длительного использования в биотехнологии.
Таким образом, независимо от систематического положения биообъекта, на практике используют либо природные организованные частицы (фаги, вирусы) и клетки с естественной генетической информацией, либо клетки с искусственно заданной генетической информацией, то есть в любом случае используют клетки, будь то микроорганизм, растение, животное или человек. Для примера можно назвать процесс получения вируса полиомиелита на культуре клеток почек обезьян в целях создания вакцины против этого опасного заболевания. Хотя мы заинтересованы здесь в накоплении вируса, репродукция его протекает в клетках животного организма. Другой пример с ферментами, которые будут использованы в иммобилизованном состоянии. Источником ферментов также являются изолированные клетки или специализированные ассоциации их в виде тканей, из которых изолируют нужные биокатализаторы.
Классификация биообъектов.
1) Макромолекулы
- ферменты всех классов (чаще гидролазы и трансферазы); –в т.ч. в иммобилизированном виде (связанные с носителем) обеспечивающем многократность использования и стандартность повторяющихся производственных циклов;
-ДНК и РНК – в изолированном виде, в составе чужеродных клеток.
2) Микроорганизмы
- вирусы (с ослабленной патогенностью используются для получения вакцин);
-клетки прокариоты и эукариоты –продуценты первичных метаболитов: аминокислот, азотистых оснований, коферментов, моно- и дисахаров, ферментов для заместительной терапии и т.д.); –продуценты вторичных метаболитов:антибиотики, алкалоиды, стероидные гормоны, и др.;
- нормофлоры – биомасса отдельных видов микроорганизмов применяемые для профилактики и лечения дисбактериозов;
-возбудители инфекционных заболеваний – источники антигенов для производства вакцин;
- трансгенные м/о или клетки – продуценты видоспецифичных для человека белковых гормонов, белковых факторов неспецифического иммунитета и т. д.
3) Макроорганизмы
- высшие растения – сырье для получения БАВ ;
-животные - млекопитающие, птицы, рептилии, амфибии, членистоногие, рыбы, моллюски, человек;
-трансгенные организмы.
В качестве биологических объектов или систем, которые использует биотехнология, прежде всего необходимо назвать одноклеточные микроорганизмы, а также животные и растительные клетка. Выбор этих объектов обусловлен следующими моментами:
1. Клетки являются своего рода «биофабриками», вырабатывающими в процессе жизнедеятельности разнообразные ценные продукты: белки, жиры, углеводы, витамины, нуклеиновые кислоты, аминокислоты, антибиотики, гормоны, антитела, антигены, ферменты, спирты и пр. Многие из этих продуктов, крайне необходимы в жизни человека, пока недоступны для получения «небиотехническими» способами из-за дефицитности или высокой стоимости сырья или же сложности технологических процессов.
2. Клетки чрезвычайно быстро воспроизводятся. Так, бактериальная клетка делится через каждые 20-60 минут, дрожжевая - через каждые 1,5-2 ч, животная – через 24 ч, что позволяет за относительно короткое время искусственно нарастить на сравнительно дешевых и недефицитных питательных средах в промышленных масштабах огромные количества биомассы микробных, животных или растительных клеток. Например, в биореакторе емкостью 100 м3 за 2-3-сут. можно вырастить 1016 – 1018 микробных клеток. В процессе жизнедеятельности клеток при их выращивании в среду поступает большое количество ценных продуктов, а сами клетки представляют собой кладовые этих продуктов.
3. Биосинтез сложных веществ, таких как белки, антибиотики, антигены, антитела и др. значительно экономичнее и технологически доступнее, чем химический синтез. При этом исходное сырье для биосинтеза, как правило, проще и доступнее, чем сырье для других видов синтеза. Для биосинтеза используют отходы сельскохозяйственной, рыбной,, пищевой промышленности, растительное сырье, дрожжи, древесина, меласса и др.).
4. Возможность проведения биотехнологического процесса в промышленных масштабах, т.е. наличие соответствующего технологического оборудования, доступность сырья, технология переработки и т.д.
Вопрос 53.
Иммобилизация ферментов физическими методами. Используемые носители. Характеристика методов иммобилизации. Область применения иммобилизованных ферментов.
Ответ.
Существует два основных метода иммобилизации ферментов: физический и химический.
Физическая иммобилизация ферментов представляет собой включение фермента в такую среду, в которой для него доступной является лишь ограниченная часть общего объема. При физической иммобилизации фермент не связан с носителем ковалентными связями. Существует четыре типа связывания ферментов:
- адсорбция на нерастворимых носителях;
- включение в поры геля;
- пространственное отделение фермента от остального объема реакционной системы с помощью полупроницаемой перегородки (мембраны);
- включение в двухфазную среду, где фермент растворим и может находиться только в одной из фаз.
Перечисленные подходы проиллюстрированы рисунке 1.
Рис. 1. Способы иммобилизации ферментов: а - адсорбция на нерастворимых носителях, б – включение в поры геля, в – отделение фермента с помощью полупроницаемой мембраны, г – использование двухфазной реакционной среды.
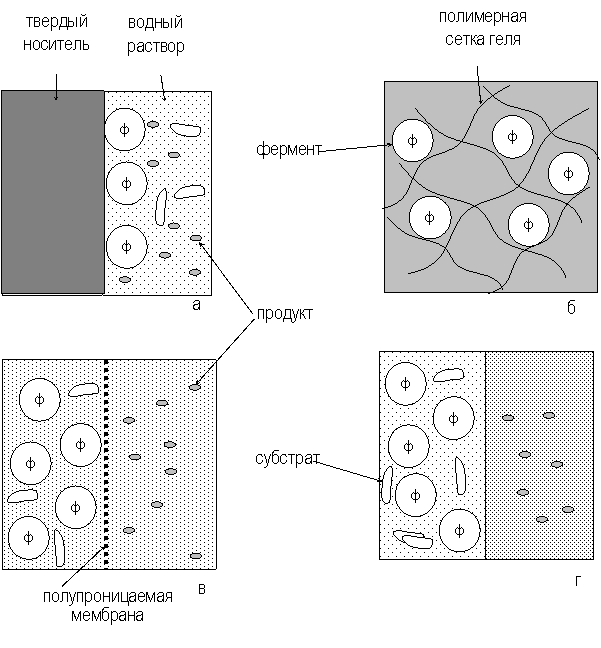
Адсорбционная иммобилизация является наиболее старым из существующих способов иммобилизации ферментов, начало ей было положено еще в 1916 г. Этот способ достаточно прост и достигается при контакте водного раствора фермента с носителем. После отмывки неадсорбировавшегося белка иммобилизованный фермент готов к использованию. Удерживание адсорбированной молекулы фермента на поверхности носителя может обеспечиваться за счет неспецифических ван-дер-ваальсовых взаимодействий, водородных связей, электростатических и гидрофобных взаимодействий между носителем и поверхностными группами белка. Вклад каждого из типов связывания зависит от химической природы носителя и функциональных групп на поверхности молекулы фермента. Взаимодействия с носителем могут оказаться настолько сильными, что сорбция биокатализатора может сопровождаться разрушением его структуры. Например, при адсорбции некоторых растительных клеток на гранулах цитодекса клеточная стенка деформируется, повторяя рельеф поверхности частиц носителя. Преимуществом метода адсорбционной иммобилизации является доступность и дешевизна сорбентов, выступающих в роли носителей. Им также можно придать любую конфигурацию и обеспечить требуемую пористость. Важным фактор - простота применяемых методик. При адсорбционном связывании можно решить и проблему очистки фермента, так как связывание белка с носителем во многих случаях достаточно специфическое. К сожалению, прочность связывания фермента с носителем не всегда достаточно высока, что ограничивает применение метода. К недостаткам адсорбционной иммобилизации следует отнести отсутствие общих рекомендаций, позволяющих сделать правильный выбор носителя и оптимальных условий иммобилизации конкретного фермента.
Некоторых из перечисленных затруднений можно избежать при иммобилизации ферментов путем включения в гели. Суть этого метода иммобилизации состоит в том, что молекулы фермента включаются в трехмерную сетку из тесно переплетенных полимерных цепей, образующих гель. Среднее расстояние между соседними цепями в геле меньше размера молекулы включенного фермента, поэтому он не может покинуть полимерную матрицу и выйти в окружающий раствор, т.е. находится в иммобилизованном состоянии. Дополнительный вклад в удерживание фермента в сетке геля могут вносить также ионные и водородные связи между молекулой фермента и окружающими ее полимерными цепями. Пространство между полимерными цепями в геле заполнено водой, на долю которой обычно приходится значительная часть всего объема геля. Например, широко применяемые гели полимеров акриловой кислоты в зависимости от концентрации полимера и его природы содержат от 50 до 90% воды.
Для иммобилизации ферментов в геле существует два основных способа. При одном из них фермент помещают в водный раствор мономера, а затем проводят полимеризацию, в результате чего образуется полимерный гель с включенными в него молекулами фермента. В реакционную смесь часто добавляют также бифункциональные (содержащие в молекуле две двойные связи) сшивающие агенты, которые придают образующемуся полимеру структуру трехмерной сетки. В другом случае фермент вносят в раствор готового полимера, который затем каким-либо образом переводят в гелеобразное состояние. Способ иммобилизации ферментов путем включения в полимерный гель позволяет создавать препараты любой геометрической конфигурации, обеспечивая при этом равномерное распределение биокатализатора в объеме носителя. Метод универсален, применим для иммобилизации практически любых ферментов, полиферментных систем, клеточных фрагментов и клеток. Фермент, включенный в гель, стабилен, надежно защищен от инактивации вследствие бактериального заражения, так как крупные клетки бактерий не могут проникнуть в мелкопористую полимерную матрицу. В то же время, эта матрица может создавать значительные препятствия для диффузии субстрата к ферменту, снижая каталитическую эффективность иммобилизованного препарата, поэтому для высокомолекулярных субстратов данный метод иммобилизации не применим вообще.
Общий принцип иммобилизации ферментов с использованием мембран заключается в том, что водный раствор фермента отделяется от водного раствора субстрата полупроницаемой перегородкой. Полупроницаемая мембрана легко пропускает небольшие молекулы субстрата, но непреодолима для крупных молекул фермента. Существующие модификации этого метода различаются лишь способами получения полупроницаемой мембраны и ее природой. Водный раствор фермента можно включать внутрь микрокапсул, представляющих собой замкнутые сферические пузырьки с тонкой полимерной стенкой (микрокапсулирование). При двойном эмульгировании получается водная эмульсия из капель органического раствора полимера, содержащих, в свою очередь, еще более мелкие капли водного раствора фермента. Через некоторое время растворитель затвердевает, образуя сферические полимерные частицы с иммобилизованным в них ферментом. Если вместо водонерастворимого отвердевающего полимера используются жидкие углеводороды с высокой молекулярной массой, метод называется иммобилизацией путем включения в жидкие мембраны. К модификациям метода иммобилизации ферментов с использованием полупроницаемых оболочек относятся также включение в волокна ( при этом вместо капель, содержащих ферменты, получаются нити) и включение в липосомы. Применение систем мембранного типа позволяет получать иммобилизованные препараты с высоким содержанием фермента. Метод, как и предыдущий, достаточно универсален, т.е. применим как ферментам, так и к клеткам, а также их фрагментам. Благодаря высокому отношению поверхности к объему и малой толщине мембраны удается избежать значительных диффузионных ограничений скорости ферментативных реакций. Основной недостаток мембранных систем - невозможность ферментативного превращения высокомолекулярных субстратов.
При иммобилизации ферментов с использование систем двухфазного типа ограничение свободы перемещения фермента в объеме системы достигается благодаря его способности растворяться только в одной из фаз. Субстрат и продукт ферментативного превращения распределяются между обеими фазами в соответствии с их растворимостями в этих фазах. Природа фаз подбирается таким образом, что продукт накапливается в той из них, где фермент отсутствует. После завершения реакции эту фазу отделяют и извлекают из нее продукт, а фазу, содержащую фермент, вновь используют для проведения очередного процесса. Одним из важнейших преимуществ систем двухфазного типа является то, что они позволяют осуществлять ферментативные превращения макромолекулярных субстратов, которые невозможны при применении жестких носителей с ограниченным размером пор.
Главным отличительным признаком химических методов иммобилизации является то, что путем химического взаимодействия на структуру фермента в его молекуле создаются новые ковалентные связи, в частности между белком и носителем. Препараты иммобилизованных ферментов, полученные с применением химических методов, обладают по крайней мере двумя важными достоинствами. Во-первых, ковалентная связь фермента с носителем обеспечивает высокую прочность образующегося конъюгата. При широком варьировании таких условий, как рН и температура, фермент не десорбируется с носителя и не загрязняет целевых продуктов катализируемой им реакции. Это особенно важно при реализации процессов медицинского и пищевого назначения, а также для обеспечения устойчивых, воспроизводимых результатов в аналитических системах. Во-вторых, химическая модификация ферментов способна приводить к существенным изменениям их свойств, таких как субстратная специфичность, каталитическая активность и стабильность. Химическая иммобилизация ферментов является искусством, уровень которого определяется, в первую очередь, умением экспериментатора. Основная задача экспериментатора заключается в формировании новых ковалентных связей в молекуле фермента при использовании его функциональных групп, несущественных для проявления его каталитической активности. При химической модификации фермента его активный центр желательно защищать. При сопоставлении различных приемов иммобилизации химические методы для крупномасштабных биотехнологических процессов кажутся малопривлекательными из-за сложности и дороговизны. В промышленных процессах обычно используются те или иные методы физической иммобилизации.
Применение иммобилизованных ферментов
Особенно ощутимый вклад иммобилизованные ферменты внесли в тонкий органический синтез, в анализ, в медицину, в процессы конверсии энергии, в пищевую и фармацевтическую промышленности.
Для синтетической органической химии важно то, что в двухфазных реакционных средах фермент сохраняет каталитическую активность даже при исключительно малом содержании воды, поэтому равновесие катализируемой реакции (выход продукта) экспериментатор может регулировать в широких пределах, подбирая нужный органический растворитель. Иммобилизованные ферменты дали толчок к созданию принципиально новых методов "безреагентного" непрерывного анализа многокомпонентных систем органических (в ряде случаев и неорганических) соединений.
В будущем важную роль в контроле окружающей среды и в клинической диагностике должны сыграть такие методы, как биолюминесцентный анализ и иммуноферментный анализ.
В медицине иммобилизованные ферменты открыли путь к созданию лекарственных препаратов пролонгированного действия со сниженной токсичностью и аллергенностью. Иммобилизационные подходы способствуют решению проблемы направленного транспорта лекарств в организме.
Проблемы биоконверсии массы и энергии в настоящее время пытаются решить микробиологическим путем. Тем не менее иммобилизованные ферменты вносят ощутимый вклад в осуществление фотолиза воды и в биоэлектрокатализ.
Заслуживает внимание и использование иммобилизованных ферментов в процессах переработки лигноцеллюлозного сырья.
Иммобилизованные ферменты могут использоваться и как усилители слабых сигналов. На активный центр иммобилизованного фермента можно подействовать через носитель, подвергая последний ультразвуковой обработке, механическим нагрузкам или фотохимическим превращениям. Это позволяет регулировать каталитическую активность системы фермент - носитель под действием механических, ультразвуковых и световых сигналов. На этой основе были созданы механо- и звукочувствительные датчики и открыт путь к бессеребряной фотографии.
Промышленные процессы с применением иммобилизованных ферментов внедрены прежде всего в пищевую и фармацевтическую промышленность. В пищевой промышленности с участием иммобилизованных ферментов идут процессы получения глюкозо-фруктовых сиропов, глюкозы, яблочной и аспарагиновой кислоты, оптически активных L- аминокислот, диетического безлактозного молока, сахаров из молочной сыворотки и др.
В медицине иммобилизованные ферменты используются также как лекарственные препараты, особенно в тех случаях, когда необходимо локальное воздействие. Кроме того, биокатализаторы широко используются в различных аппаратах для перфузионной очистки различных биологических жидкостей. Возможности и перспективы использования в медицине ферментов в иммобилизованном состоянии гораздо шире, чем достигнутые на сегодняшний день, именно на этом пути медицину ждет создание новых высокоэффективных методов лечения.
Вопрос 77.
Биотехнология витаминов и коферментов. Биологическая роль витаминов. Достоинства и недостатки традиционных методов получения(выделение из природных источников, химический синтез) и микробиологического синтеза витаминов.
Ответ.
Витамины (от лат. vita – жизнь + амины) – низкомолекулярные органические соединения различной химической природы, абсолютно необходимые для нормальной жизнедеятельности организмов. Витамин являются незаменимыми пищевыми веществами, т.к. за исключением никотиновой кислоты они не синтезируются организмом человека и поступают главным образом в составе продуктов питания. Некоторые витамины могут производиться нормальной микрофлорой кишечника. В отличие от других жизненно важных пищевых веществ витамины не обладают пластическими свойствами и не используются организмом в качестве источника энергии. Участвуя в разнообразных химических превращениях, они оказывают регулирующее влияние на обмен веществ и тем самым обеспечивают нормальное течение практически всех биохимических и физиологических процессов в организме.
Коферменты (син. коэнзимы) – органические соединения небелковой природы необходимые для осуществления каталитического действия многих ферментов, соединяясь с белковой частью молекулы фермента – апоферментом, кофермент образует каталитически активный комплекс – холофермент. Прочно связанные с белками коферменты называются простетическими группами. Коферменты могут участвовать в активировании молекул субстрата, образуя с ними реакционно-способные соединения, которые затем подвергаются ферментативному превращению. Некоторые метаболиты, выступающие в ферментативных реакциях как обычные субстраты, в определенных условиях могут играть роль коферментов. Многие коферменты являются производными витаминов и, поэтому нарушение обмена веществ при витаминной недостаточности опосредовано через понижение активности определенных ферментов.
Коферменты, как правило, термостабильны, разнообразны по химическому строению и механизму действия.
Биологическая роль витаминов
|
Название витамина
|
Действие витамина на организм
|
Содержится в продуктах
|
|
Витамин А(Ретинол)
|
Витамин А предотвращает проблемы со зрением, способствует здоровью иммунной системы, имеет весомое значение для роста клеток и улучшает состояние кожи.
|
К основным источникам ретинола можно отнести печень, молоко, яйца и витаминизированные каши, зеленые и оранжевые овощи (например картофель, морковь, тыква и капуста), и оранжевые фрукты - персики, папайя, дыня, абрикосы или манго.
|
|
Витамин В12(Цианокобаламин)
|
Витамин В12 помогает воспроизводству красным кровяным тельцам, нервным клеткам. Он участвует в делении клеток, поэтому без него невозможна регенерация тканей и рост мышц.
|
В рыбе, красном мясе, мясе птиц, молоке, сыре и яйцах можно найти этот витамин. Его также добавляют в некоторые сухие завтраки.
|
|
Витамин B6(Пиридоксин)
|
Для правильной работы мозга и других неврологических функций незаменим Витамин В6. Также он помогает организму расщеплять белки и вырабатывать эритроциты.
|
Широкий спектр продуктов содержат витамин В6 - в том числе картофель, бананы, бобы, семена, орехи, красное мясо, рыба, яйца и птица, шпинат и витаминизированные каши.
|
|
Витамин В1(Тиамин )
|
Тиамин служит катализатором для преобразования углеводов в энергию и необходим для мышц, для сердечной деятельности а также состояния нервной системы.
|
Люди получают тиамин из различных продуктов, в том числе разных сортов хлеба, круп и макаронных изделий; постного мяса, сушеных бобов, соевых продуктов и гороха, а также из пророщенных зерен, таких например - как зародыши пшеницы.
|
|
Витамин В3(Никотиновая кислота)
|
Никотиновая кислота помогает поддержанию здоровья кожи, а также в работе нервной системы.
|
Вы найдете ниацин в птице, красном мясе, крупах, рыбе и арахисе.
|
|
Витамин В2(Рибофлавин)
|
Рибофлавин нужен организму для роста, превращения углеводов в энергию, и в производстве эритроцитов.
|
Некоторыми из источников рибофлавина являются молоко, мясо, яйца, бобовые (например горох и чечевица), орехи, зелень. А также: спаржа, брокколи и витаминизированные каши.
|
|
Витамин B9(Фолиевая кислота)
|
Фолиевая кислота (B9) - содействует в выработке эритроцитов. Кроме того, она необходима, для воссоздания ДНК.
|
Апельсиновый сок, печень, сушеные бобы и другие бобовые, зелень, спаржа - очень хороший источник этого витамина. А так же: хлеб, рис и зерновые культуры.
|
|
Витамин С(Аскорбиновая кислота)
|
Витамин С нужен для формирования коллагена(ткани, служащей для связывания клеток). Это важно и для здоровья десен, зубов и для роста костей. Также Витамин С - поддерживает в тонусе кровеносные сосуды. Он служит катализатором для усваивания железа организмом, стимулирует функции головного мозга и ускоряет заживление ран.
|
Витамин С - есть в клубнике, киви, гуаве, перце, шпинате помидорах и брокколи. И конечно самый высокий уровень этого витамина - в цитрусовых!
|
|
Витамин D(Кальциферол)
|
Витамин D, служит укреплению костей, потому что помогает организму усваивать укрепляющий кости кальций и наращивать прочность скелета человека.
|
Этот витамин является уникальным - ваше тело производит его, когда вы получаете солнечные ванны! Витамин D содержится также и некоторых продуктах, например он есть в жирной рыбе (такой как лосось) в яичных желтках, тунце или сардине а также в молоке коровьем, соевом молоке и апельсиновом соке.
|
|
Витамин Е(Токоферол)
|
Для выработки и поддержания красных кровяных телец в здоровом состоянии нужен витамин E. А еще токоферол - антиоксидант, и в его функции входит защита клеток от разрушений и повреждений.
|
Токоферол есть в зелени и орехах, растительных маслах и авокадо. Также его достаточно в пророщенных зернах пшеницы и ячменя.
|
|
Витамин K
|
Помогает контролировать свертывание крови в организме и необходим для синтеза в печени белков, которые управляют свертыванием. Нехватка этого витамина - может привести к носовым и внутренним кровотечениям.
|
Пополнить запасы витамина K - вам поможет брюссельская капуста, обычная капуста и брокколи, а также зелень. Много его в сое, рапсе и оливковом масле.
|
Достоинства и недостатки методов получения витаминов.
Производство витаминов в нашей стране организовано в начале 30-х гг прошлого века. Вначале выпускались витаминные препараты из натурального сырья. Затем было освоено производство синтетических витаминов С и K3 . С 1949 по технологии, разработанной советскими учёными, в промышленном масштабе стал осваиваться синтез других витаминов, например тиамина (витамин B1 ). В 1950 производство витаминов увеличилось по сравнению с 1940 в 5,6 раза. К 1955 г. были разработаны схемы синтеза всех известных основных витаминов. Дальнейшее развитие витаминной промышленности связано главным образом с разработкой и внедрением синтетических методов производства витаминов. Эти методы по характеру технологических процессов значительно сложнее, чем метод извлечения витаминов из натурального сырья, но они позволяют получать продукцию в химически чистом виде, что имеет большое значение для их лечебного применения и точных дозировок при изготовлении кормовых концентратов. Кроме того, издержки на производство синтетических витаминов ниже издержек на получение соответствующих витаминов из натурального сырья.
Метод выделения витаминов из природных источников, безусловно проще с точки зрения производства, но не удобен тем, что требует переработки огромного количества сырья. Что касается химического синтеза ,то недостатками его является все же: многостадийность процессов, значительная материалоёмкость, обусловливающая необходимость размещения предприятий вблизи сырьевых баз; необходимость выработки высокочистой продукции .
Витаминная промышленность нуждается в более эффективных технологиях, и такие технологии успешно создаются.
С помощью лишь генетических манипуляций (воздействием на регуляцию метаболизма) были получены штаммы микроорганизмов, которые производят в десятки тысяч раз больше витаминов, чем необходимо для их роста. Это штаммы Ashbya gossypii – продуцент рибофлавина, штаммы Pseudomonas denitrifikans и Propionibacterium freudonreichii, производящие витамин В12 и др. В России на базе бактерий рода Bacillus subtilis сконструирован эффективный продуцент витамина В2.
Для микробиологического синтеза органических соединений в качестве сырья применяют наиболее дешевые источники азота (например, нитраты или соли аммония) и углерода (напр., углеводы. орг. кислоты, спирты. жиры. углеводороды. в т.ч. газообразные).
При менение биосинтеза дает возможность сокращения стадий химического синтеза за счет использования высокоактивных штаммов микроорганизмов. Например производство витаминов В12, В2, В3 и D (эргостерина) стало возмож- ным осуществлять в 1 стадию. БТ методы нашли применение в синтезе вит. С, убихинона, каротиноидов. В12 –получают и спользованием прокариотической микрофлоры – мутагенных штаммов пропионовых бактерий – 50 мг/л среды и его предшественника – ди метилбенимидазола – до 200 мг/л. В2, - (рибофлавин) поучают с использованием дрожжеподобных грибов Eremothecium и Ashbya – 3,8-6,4 г/л. В последнее время используется мутантный штамм Bacillus subtilis – 3,5-4,5 г/л. -В3 – (пантотеновая к-та) и синтез кофермента КоА актиномицетами из аланина и пантотената К с помощью иммобилизованных клеток бактерий Brevibacteria. Недостатки – небольшой выход готового продукта, для этого проводят совершенствование по направлениям: селекция мутантных штаммов, оптимизация состава и удешевление сред, опти мизация условий культивирования продуцента.
Используемая литература.
- Биотехнология:учеб.пособие для студ.высш.учеб.заведений/Ю.О.Сазыкин,С.Н.Орехов,И.И.Чакалева;под ред.А.В.Катлинского.-3-е изд.,-М.:Издательский центр «Академия»,2008-256с.
- Биотехнология лекарственных средств. Учебное пособие/ Под ред. Быкова В. А. и Далина М. В. – М.: Медбиоэкономика– 303с.
- Основы фармацевтической биотехнологии:учеб.пособие/под ред. Чучалин В.С. Прищеп Т.П. Белова Л.С. Зайков К.Л. Михалева Л.К.,- Ростов н/Д, «Феникс»,2006г.
- http://biofile.ru/bio/16312.html
- http://www.myshared.ru/slide/832251/
- http://www.biotechnolog.ru/prombt/prombt10_3.htm
- http://refdb.ru/look/2970966-p4.html
- http://studend.ru/gotovye-raboty/poluchenie-vitaminov-i-kofermentov-biotekhnologicheskimi-metodami.html
PAGE \* MERGEFORMAT 1
Биообъект как средство производства лекарственных,диагностических и профилактических препаратов