Особенности распределения амфипод рода Gammarus литорали Кольского залива (среднее и южное колено)
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО РЫБОЛОВСТВУ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«Мурманский государственный технический университет»
Особенности распределения амфипод рода Gammarus литорали Кольского залива (среднее и южное колено)
022000.68 – Экология и природопользование
Диссертация на соискание степени магистра
Магистрант:
__________________Д.С. Патенко,
Научный руководитель:
доцент кафедры «Биоэкология», к.б.н.Н.А. Пахомова
Руководитель программы:
зав. кафедрой «Биоэкология», д.б.н., профессор. Н.Г. Журавлева
Зав. Выпускающей кафедры:
зав. кафедрой «Биоэкология», д.б.н., профессор. Н.Г. Журавлева
Мурманск
2014
РЕФЕРАТ
Выпускная квалификационная работа на тему «Особенности распределения амфипод рода Gammarus литорали Кольского залива (среднее и южное колено)» выполнена магистрантом Патенко Д.С. Материал работы был получен на литорали южного колена Кольского залива, предоставлен лабораторией зообентоса Мурманского морского биологического института КНЦ РАН. Сбор литорального зообентоса в ходе мониторинга производился в эстуарной части Кольского залива в период с апреля по ноябрь 2010 г. Материал, собранный на литорали среднего колена Кольского залива, предоставлен лабораторией кафедры Биоэкологии МГТУ. Сбор зообентоса в ходе мониторинга производился на литорали Кольского залива с апреля по ноябрь 2012 г.
На основе проведённой работы можно сделать вывод о том, что, несмотря на времена года и места отбора проб, распределение амфипод рода Gammarus зависит от биологических факторов.
Диссертационная работа изложена на 85 страницах, проиллюстрирована 33 рисунками. Список литературы состоит из 81 источников.
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
Амфипода – одна из многочисленных разнообразных по видовому составу групп морских беспозвоночных. В процессе эволюции амфиподы приспособились к существованию в морях, эстуариях, а также в солоноватоводных, пресных и гиперсоленых водоемах. Они являются важной составляющей биоресурсов водных экосистем и, развиваясь в массовом количестве, при благоприятных условиях среды составляют основу питания многих рыб и морских, водоплавающих птиц. Амфиподы в основном являются некрофагами и детритофагами поэтому они играют значительную роль в процессах самоочищения водоемов, в особенности на начальных стадиях разрушения животных и растительных остатков (Любина, 2008).
Не менее важными, определяющими распределение амфипод на литорали, являются интенсивность приливно-отливных течений, термогалинный режим, степень насыщения кислородом морской воды, а так же сезонные и межгодовые колебания величин этих абиотических факторов. (Шкляревич, 2007).
Исследования различных вопросов распределения амфипод имеет теоретическое значение для зоогеографического и экологического районирования водоемов, изучения путей формирования их фаун (Гурьянова, 1939; Брязгин, 1972).
Актуальность: детальные знания естественного состояния фауны позволяют сохранить ее биоразнообразие в районах антропогенного воздействия, так как арктические шельфовые моря превращаются в перспективные районы нефтедобычи.
В качестве района исследования было выбрано 3 участка в южном колене: мыс Притыка, устье р. Кола, устье р. Тулома и 2 участка в среднем колене: литораль Абрам-Мыса, устье реки Белокаменка.
Цель: изучение и выявление особенностей биологии распределения бокоплавов рода Gammarus литорали Кольского залива (южного и среднего колена).
Задачи, решаемые при выполнении работы:
- Изучить видовой состав рода Gammarus и количественное распределение гаммарид литорали, исследуемых участков Кольского залива;
- Изучить биомассу поселений амфипод;
- Изучить сезонную динамику размерно-частотного ряда поселений G. duebeniи G. oceanicus;
- Изучить половую структуру поселений G. duebeniи G. oceanicus.
1. ОБЗОР ЛИТЕРАТУРЫ
1.1. Характеристика физико-географических и океанологических условий, влияющих на существование литоральных организмов в районе исследований
Литораль, как переходный участок между сушей и морем, испытывает наиболее сильное влияние изменений окружающей среды, как в течение года, так и в масштабе многолетних вариаций. Видовой состав и распределение литоральных организмов зависят от биологических, так и от абиотических факторов. Среди основных абиотических факторов можно назвать продолжительность времени осушки, температуру воды и воздуха, соленость воды, фотопериод, кислородный реи ледовый режим, характер грунта.
Кольский залив, где проводились исследования, располагается на широте 69°с.ш. В связи с таким географическим положением здесь складываются совершенно особые условия освещения. С 22 мая по 23 июля в этих широтах длится полярный день, и литораль в течение 2 месяцев оказывается под непрерывным влиянием солнца. С 30 ноября 12 января длится полярная ночь, и литораль на протяжении также двух месяцев погружена во тьму. Вегетационный период длится 80 – 130 суток. Такой характер освещения определяет сезонную изменчивость всех продукционных процессов в морских экосистемах данного региона.
По истории возникновения и по современной морфологии Кольский залив является типичным фьордом тектнонического происхождения (Шипилов, Ковальчук, 2009). Он вдается в материк на юг почти на 60 км. Очертания залива имеют два коленчатых изгиба, благодаря которым его акваторию условно разделяют на три части: северное, среднее и южное колена (Рис. 1). В вершину залива впадают две крупнейшие реки Кольского залива – Кола и Тулома, оказывающие существенное влияние на его гидрологический режим.
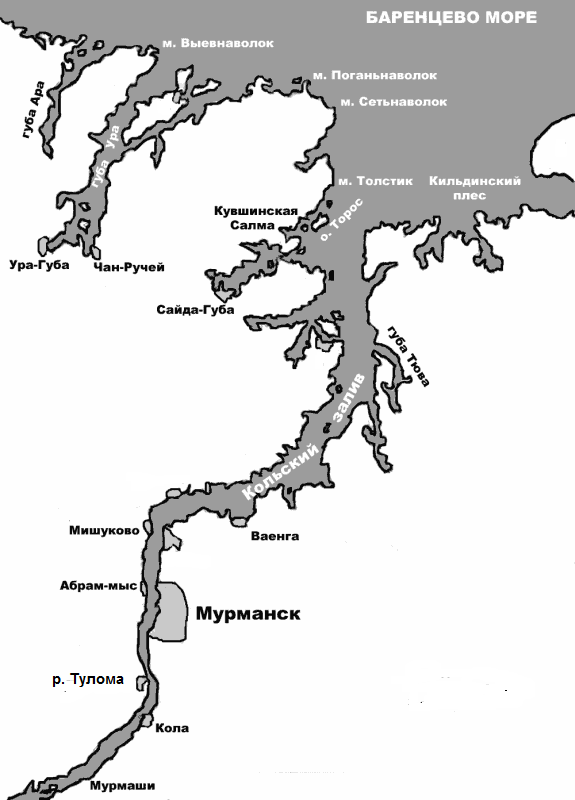
Рис. 1. Схема Кольского залива
Современный облик залива сформировался относительно недавно, после разрушения ледника. В настоящее время изменения его морфологии связаны в основном с изостатическим подъемом суши и переформированием рыхлых отложений на мелководье и осушках под совместным действием приливов, речного стока и ветрового волнения. Некоторые участки залива существенно преобразились в результате строительства в прибрежной зоне, дноуглубительнях и намывных работ, захоронения грунта. Ширина залива постепенно уменьшается от устья к кутовой части и составляет 3.0 - 3.5 км в северном, 1.5 – 2.5 км в среднем и 1.0 – 1.5 км в южном колене. Глубина залива также постепенно убывает от входа к вершине. Продольный профиль дна залива неровный, имеется множество замкнутых котловин. Самая глубокая котловина находится в устье, напротив Сайда-гуды (свыше 300 м). К северу от нее начинается подводный порог глубиной 104 м, отделяющий эту котловину от открытой части моря. В южном колене глубина не превышает 40 – 50 м (Дженюк, 1997).
Берега залива характеризуются разной степенью изрезанности и пологости. В северной части залива восточный берег образован крутыми склонами гранитных гор, менее изрезан по сравнению сзападным, где лежат самые крупные губы. В среднем колене, напротив, более изрезанным является восточный берег. В южной части залива берега извилистые, выступают многочисленными мысами, довольно сильно изрезаны, но, несмотря на это, здесь нет ни одной глубокой губы. В целом берега в южном колене залива пологие, значительно ниже по сравнению с северным и средним коленами (Дерюгин, 1915).
Берега залива, особенно в южной части, покрыты моренными валунами и песком; к морю мощность моренного покрова уменьшается. Донные осадки залива представлены продуктами ледниковой деятельности; валунами, галькой, щебнем, гравием, песком. В местах со слабым течением находятся скопления ила. Основными материалами современных донных осадков Кольского залива являются речной сток и абразия берегов (Дерегюн, 1915; Митяев, 1997). Верхний горизонт донных отложений в южном колене представлен мелкоалевритовым илом или илистым песком с большим количеством мусора антропогенного происхождения и вкраплениями гравийно-галечного материала, в среднем колене – мелкоалевритовыми илами, перемешанными с мелкой галькой размером до 2 – 3 см. В северном колене мелководные зоны представлены грубыми осадками от гравийных до алевропесчаных (Митяев, 1997).
Формирование климата над Кольским заливом определяется теплым Мурманским течением, под влиянием которого находится все Мурманское побережье. Благодаря значительной протяженности залива с севера на юг, вглубь материка, климат в северной его части более теплый, морской, в южной - более холодный, континентальный. Годовой ход температуры воздуха над северной частью залива, как и над Баренцевым морем, является типично морским, с максимумом в августе и минимумом в феврале. В вершине залива эта закономерность нарушается. Однако и здесь отчетливо выражен свойственный морскому климату контраст между холодной весной и теплой осенью. Средняя годовая температура несколько понижается с севера на юг, переходя в вершине залива от положительных к отрицательным значениям (Дженюк, Огурцова, 1997). Наибольшая изменчивость средней месячной температуры, наблюдается в зимние месяцы с декабря по март (особенно в вершине залива, где средние квадратичные отклонения могут достигать 3° С), наименьшая - в конце лета и начале осени, август-сентябрь (Яковлев, 1972). Изменчивость среднесуточных и срочных температур значительно больше изменчивости средней месячной температуры. Суточный ход температуры воздуха, как и везде в высоких широтах, полностьюотсутствует в период полярной ночи, осенью значителен (в среднем 0.3°С – в ноябре, 1.3°С – в октябре) и достигает максимума в летние месяцы (июнь – 4.8°С, июль – 5.5°С, август – 4.8°С). Поэтому летом даже в условиях незаходящего солнца всегда имеет место ночное понижение температуры, тогда как зимние минимумы возможны в любые часы суток и могут сохраняться длительное время (Дженюк, Огурцова, 1997).
В формировании температурного режима воздуха над Кольским заливом большое значение имеет адвекация воздушных масс, особенно летом и зимой, когда температурные различия воздушных масс, поступающих с Баренцева моря или материка, наиболее значительны (Яковлев, 1972). Для Кольского залива характерна отчетливо выраженная смена преобладающих направлений ветра в годовом ходе. В холодном полугодии, с октября по апрель, преобладают ветра южных и юго-западных направлений, которые дуют со стороны Лапландии и несут стужу; в теплом полугодии преобладают ветра с севера и северо-востока, которые приносят холод и туман (Дерюгин, 1915). Повторяемость штилей в течение всего года невелика – от 5-6% зимой до 8-9% летом. Средняя скорость ветра составляет в декабре – феврале 6.5-6.5 м/с, в юле – августе – 4.0-4.3 м/с, а среднем за год – 5.0-5.3 м/с (Дженюк, Огурцова, 1997).
Пресноводный баланс залива определяется главным образом речным стоком. Приток пресных вод распределен вдоль побережья очень неравномерно, и основная его часть приходится на вершину залива, куда впадают две крупные реки – Кола и Тулома. В южном колене залива других сколько-нибудь значимых водотоков нет, а на его восточном берегу естественный гидрологический режим полностью нарушен и водным хозяйством г. Мурманска. Сток реки Тулома зарегулирован двумя водохранилищами; Нижне-Туломский ГЭС (с 1937 г.) и Верхне-Туломский ГЭС (с 1965 г.) второе из них полностью обеспечено управление стоком Туломы, что существенно сказалось на водообмене и опреснении вод залива. Оценка суммарного речного стока показывает, что опреснение заметно сказывается на гидробиологическом режиме и экосистемах только в южном колене залива (Гагарина, Дженюк, 1997).
В среднем в год в районе исследований наблюдается около 200 дней с осадками, и их сумма составляет около 500 мм. Наибольшее количество осадков выпадает в августе (более 60 мм), наименьшее – в марте (23 – 27 мм) (Яковлев, 1972; Дженюк, Огурцова, 1997). В связи с обильными летне-осенними осадками и дождевыми паводками могут наблюдаться локальные и кратковременные изменения пресноводного баланса залива. В таких ситуациях возможно аномальное опреснение литорали, в том числе и на участках побережья, удаленных от устьев рек (Гагарина, Дженюк, 1997).
Снежный покров на побережье Кольского залива сохраняется больше полугода (среднее числодней со снежным покровом в Мурманск – 198). Его первое появление отмечается 13 октября. Образование устойчивого снежного покрова в среднем приходится на 1 ноября. Весной снежный покров сходит в среднем 20 мая, что не исключает возможности снегопадов с образованием снежного покрова, сохраняющего 1 – 2 суток, до второй половины июня (Дженюк, Огурцова, 1997).
Гидрологические процессы в Кольском залива являются основными факторами, оказывающими влияние на жизнедеятельность морской флоры и фауны, особенно на литорали. С одной стороны, гидрология Кольского залива формируется под действием течений, господствующих в Баренцевом море, с другой стороны - под влиянием континентального стока. Основная водная масса залива образована теплыми солеными водами атлантического происхождения, поступающими сюда с приливными течениями (Цехоцкая, 1985; Ожигин, Ившин, 1999). Поэтому для Кольского залива характерны те же гидрофизические процессы, что и для прилегающей части Баренцева моря – формирование сезонного термоклина, осенне-зимняя конвекция, изменения температуры воды, солености, плотности в приливном цикле. В то же время на гидрологический режим, особенно в южном колене залива, существенно влияют метеорологические условия прилегающей суши и поступление пресных вод. Это приводит к возрастанию величины годового хода всех гидрологических характеристик, их повышенной синоптической изменчивости, к перемещениям градиентных зон в горизонтальной и вертикальной плоскостях (Дженюк, Савельева, 1997).
Опреснение резко увеличивается в южном колене залива, где объем морской воды относительно невелик и сильно изменяется в приливном цикле. Здесь понижение солености отчетливо выражено на всех горизонтах, хотя сильно опреснение (до 10 – 15%) возможно только в поверхностном слое, преимущественно с июня по октябрь. В зимние и весенние месяцы в южной части залива соленость поверхностных вод составляет 20 - 25%. Приведенные цифры характерны для сравнительно глубоководной части южного колена. В вершинной части залива, где глубина не превышает 10 м (первые 8 км от устьев Туломы и Колы), возможна любая степень опреснения от поверхности до дна в зависимости от сочетания стока, приливных явлений. В среднем и северном коленах соленость поверхностного слоя воды также подвержена значительной сезонной изменчивости. Зимой она не опускается ниже 30‰, в начале лета понижается до 15-20‰. Короткопериодная изменчивость солености особенно велика в южном колене, где ее размах в среднем за приливный цикл составляет около 5‰, в отдельных случаях – до 12‰. Основной вклад в нее вносят приливные движения и связанные с ними перемещения градиентных зон. В среднем и северном коленах диапазон короткопериодной изменчивости составляет около 2.5‰ (Дженюк, 2009). Однако и здесь возможны значительные аномалии солености, вызванные периодическими изменениями пресноводного баланса.
Можно отметить, что в прибрежных водах Кольского залива и во всем его поверхностном слое ведущим экологическим фактором в летние месяцы является не столько норма солености, сколько ее изменчивость разных масштабов. Вероятность сильного опреснения поверхностного слоя быстро понижается по мере удаления от вершины залива, однако сохраняется на всех участках его акватории вплоть до границы с открытым морем (Дженюк, Савельева, 1997).
Для поверхностного слоя Кольского залива, также как и для Баренцева моря в целом, характерен ассиметричный годовой ход температуры воды. Отмечается сравнительно быстрый ее рост в конце весны и начале лета (май-июль) и медленное понижение на протяжении всех осенних и зимних месяцев, когда происходит конвективное перемешивание. В Кольском залива годовой ход выражен сильнее, чем в открытом море. Годовой минимум приходится на март, когда температура поверхностного слоя понижается до 0.5°С в южном колене и 1°С в северном. От апреля к июлю температура поверхностного слоя повышается до 11°С в южном колене и до 10С в северном. На вершине Кольского залива и его мелководных боковых губах и бухтах, где на протяжении всей зимы возможно образование временного ледяного покрова, температура поверхностного слоя, в зависимости от степени опреснения, может изменяться от 0 до минус 1.9°С. Максимальная температура не поддается точной оценке, так как зависит от случайных сочетаний аномалий температурного воздуха, тепла речного стока и интенсивности вертикального турбулентного обмена. Температура воды, как и другие гидрофизические характеристики Кольского залива, подвержена приливной изменчивости, в которой преобладает полусуточная составляющая. Размах приливных колебаний на поверхностном горизонте достигает 1.5°С в летние месяцы и не превышает 1°С зимой (Дженюк и соавторы, 2009).
Динамика вод залива складывается из приливных течений и колебаний уровня, в которых преобладает полусуточная составляющая, стоковых течений, особенно отчетливо выраженных в южном колене, и непериодических изменения течений и уровня, вызванных гидрометеорологическими причинами. Средний многолетний уровень на побережье Кольского залива близок к – 0.4 м межгодовые изменения среднего уровня невелики и не носят закономерного характера (Дженюк, Коротков, Савельева, 1997). Короткопериодная изменчивость уровня превышает изменение средних месячных и годовых значений, по меньшей мере, на порядок. Поэтому все экологически значимые процессы связаны именно с ней. Преобладающий вклад в нее вносят приливные колебания. Они индуцируются баренцевоморской приливной волной и поэтому близки к правильным полусуточным (с периодом 12.5 часов). В пунктах Кольского залива средняя величина прилива изменяется от 1.7 м в квадратуру до 3.1 м в сизигию (Дженюк, 2009).
Суммарный перенос вод в заливе складывается из приливных, стоковых и ветровых течений. Доминирующими среди них являются приливные течения, вызванные баренцевоморской приливной волной. Приливные течения имеют реверсивный характер: на приливе они направлены вдоль оси залива от входа к вершине, на отливе – в противоположном направлении. На скорость поверхностно течения значительное влияние оказывает стоковое течение, направленное от вершины к открытому морю. В северном колене скорость поверхностного течения изменяется в пределах от 0 до 25 см/с на приливе и до 50 см/с на отливе. В среднем колене пределы изменчивости составляют 10 – 35 см/с на приливе и 20 – 75 см/с на отливе. В южном колене изменчивость наибольшая: на приливе от 25 – 50 см/с севернее Мурманска до 50 – 120 см/с непосредственно в вершине залива; на отливе соответственно 50 – 100 и 75 – 150 см/с. Непериодические изменения скорости суммарного течения могут быть обусловлены аномалиями речного стока и плотностной структуры вод, но главным образом – воздействие ветра. Так, при совпадении сизигийного течения на фазе отлива и сильном ветре сгонного направления возможны кратковременные усиления суммарного течения до 200 см/с в вершине залива, до 125 см/с в районе порта Мурманск и до 100 см/с в начале среднего колена. Далее в сторону открытого моря максимальные скорости течений, как правило, не превышают 50 см/с и лишьв отдельных сужениях могут достигать 70 см/с (Дженюк, Коротков, Савельева, 1997).
Ветровое волнение не относится к числу ведущих экологических факторов, но, тем не менее, в значительной степени определяет интенсивность и глубину перемешивания в поверхностном слое, влияет на строение литорали и условия жизнедеятельности в ее пределах. Кроме того, от ветрового волнениязависят формирование и устойчивость пленок нефтяного загрязнения. Интенсивность штормового волнения возрастает от вершины залива к его северной части, для него характерна сезонная изменчивость. В частности, летом преобладают ветра северного направления, но средние скорости ветра при этом невелики, поэтому интенсивность ветрового волнения от зимы к лету резко уменьшается. В северном колене высота волн в течение года чаще всего составляет 1-2 м, зимой - 3-5 м. в среднем и южном коленах разгоны северного ветра ограничены, поэтому летом здесь преобладают условия, близкие к штилевым; тогда как появление волн высотой более 1 м возможно только в зимние месяцы (Дженюк, 2009).
Ледовый режим как экологический фактор в Кольском заливе не имеет очень большого значения, так как благодаря климатическим условиям и влиянию теплого Атлантического течения сплошного ледяного покрова никогда не бывает, и лед образуется только в южной сильно опресненной части залива и в кутах глубоко врезающихся в материк губ (Гурьянова, 1930). Ледовые явления претерпевают значительные изменения от года к году, от месяца к месяцу, а также в течение суток. В некоторые годы лед в заливе бывает только в течение февраля-марта и ежедневно выносится в море, но отмечаются годы, когда южное и средние колена полностью покрываются льдом толщиной до 30 см. Кутовая часть южного колена практически всегда в холодные зимы покрыта припаем, а на акватории портов он сохраняется в основном под западным берегом (Зайков, 1997).
Из гидрохимических показателей, влияющих на существование литоральных гаммарид, главными являются кислородный режим и концентрация водородных ионов (рН). Основными факторами, определяющими распределение гидрохимических характеристик в Кольском заливе, являются речной сток в залив и биохимические процессы, происходящие в нем. Наличие полярной ночи и полярного дня создает значительную сезонную изменчивость в распределении гидрохимических характеристик за счет резкого изменения соотношения деструкционных и продукционных процессов. Содержание кислорода в водах залива в связи с эти имеет ярко выраженную сезонную изменчивость. Абсолютное содержание кислорода в поверхностном слое изменяется от 10.3 – 10.9 мг/л в осенне-зимний период до 10.0 – 13.0 мг/л весной и летом, а насыщенность воды кислородом, соответственно, от 87 – 98 до 90 - 117%. В целом воды залива хорошо аэрированы. Распределение величин водородного показателя в Кольском заливе, в отличие от растворенного кислорода, в значительно большей степени определяется влиянием речного стока и не испытывает существенных сезонных колебаний. Наиболее характерными величинами pH для южного колена являются 7.9 – 8.1, для среднего колена 8.0 - 8.15, для северного колена – 8.1 - 8.2 (Березин, 1997).
В прибрежных районах шельфа высока роль взвеси как фактора, определяющего существование морских экосистем. Взвешенные вещества представляют собой в основной массе клетки микроводорослей и твердые минеральные частицы, выносимые с суши. Динамика численности микроводорослей подчинена сезонными колебаниями. Количество минеральной взвеси зависит от интенсивности стокаматерика. Наибольшая концентрация минеральной взвеси наблюдается в кутовой части залива, где влияние речного стока максимально. Для весеннего периода характерно очень низкое содержание взвешенных веществ (1.07 мг/л в южном колене; 0.65 мг/л в среднем колене). Осенью в вершинной части залива, близ устьев рек и портового комплекса г. Мурманска концентрация взвеси составляет 5 – 6 мг/л. В целом эти цифры ниже, чем в морской зоне прибрежья (в районе губы Териберка), где концентрация взвешенных частиц может достигать 13 мг/л. Содержание биогенов повышено в южном колене залива, что определяется величиной сброса промышленных и бытовых вод (Березин, 1997).
1.2. История изучения видов рода Gammarus
В 1745 г. Карлом. Линнеем (Linnaeus, 1745) был описан первый представитель рода Gammarus с побережья острова Готланд в Балтийском море, названный им в начале Cancer macrouruscaerleus, и в 1758г. переименованный им же в C. locusta. Впоследствии Фабрициус (Fabricius, 1775) перевёл этот вид в установленный им новый род Gammarus и выделил его в качестве типа рода.
Позднее Лич (Lech, 1813-1814, 1815) описал новые виды - Gammaruscampylops и G. marinus – с морского побережья Северной Атлантики.
В работе Ратке (Rathke, 1836) впервые указывается на нахождение G.locusta в Черном море.
В 1851 г. Лиллиеборгом (Lilljeborg, 1851) был описан третий вид рода - G. duebeni, - который он, однако, уже в 1855 г. ошибочно свел в синоним к G. locusta. Линней, Лиллиеборг, Мильн-Эдвардсон имели дело с разными видами. Так, по Линнею, внутренняя ветвь уроподов III у Cancerlocusta «короче наружной», в то время как в описании, данном Мильн-Эдвардсоном, говорится об относительно длинной внутренней ветви и этому, в свою очередь, соответствует описание и рисунки, данные в последствии Сарсом для G. locusta (Sars, 1890-1895). На основании этих различий Лиллиеборг назвал вид, описанный Мильн-Эдвардсом, - «mutates», а в качестве линнеевского вида «locusta» рассматоивал вид, найденный в Балтийском море Цаддахом (Zadach, 1844, 1878). Этот вид затем был выделен Секстон (Sexton,1912) и назван в честь Цаддаха «G. zaddachi».
Далее, Секстоном (Sexton, 1912) был описан новый вид – G. zaddachi, причем уже в первом описании этого вида, как и в последующих работах, ею было отмечено существование двух форм – морской («saline-form») и типичной, или пресноводной («fresh-water-form»), различающихся по степени развития щетинок на теле, члениках конечностей и тельсоне (Sexton, 1912, 1913, 1942, pl.I, II), в последствии выделенных Спунером (Spooner, 1947) и Сегерстроле (Segerstrale, 1947) в качестве подвидов.
Т. Ф. Дементьевой (1931) был выделен новый вид – G. setosa – из опресненных вод побережья Новой Земли на основании сильного развития у них длинных перистых щетинок на тельсоне, а также различий в относительной длине члеников стебелька антенн.
А. В. Гудимов, А.А. Фролов охарактеризовали литоральные сообщества эстуария р. Тулома и кута залива. В этой статье описан вид G. duebeni(Lilljeborg, 1851) и другие сообщества, и данная статья находится в книге «Кольский залив: океанография, биология, экосистемы, поллютанты», 1997.
В 2007г г. вышла статья Шкляревича Г.А., Разновская С.В. «Литоральные амфиподы Кандалакшского залива». В ней были описаны такие виды как Gammarusoceanicus(Segerstale, 1974), Gammarusduebeni(Lilljeborg, 1851), Gammarussetosus(Дементьевой, 1931).
О.С. Любина и В.В. Саяпин описали распределение и видовой состав амфипод из различных географических районов. Таким районами изучения стали сублитораль южной части Карского моря и Нижнего Дона. В Карском море, по собранным материалам, отмечено 116 видов, принадлежащих к 71 роду и 26 семействам гаммаридных амфипод (Любина, 2008). В 2003 г. была оформлена статья Е.Н. Лупповой об особенностях экологии литоральных бокоплавов Gammarus oceanicus(Segerstale, 1974) и Gammarus duebeni(Lilljeborg, 1851).
1.3. Литоральная зона и особенности распределения сообществ
Дважды в сутки во время отлива обнажается литоральная зона. Литораль делится на три горизонта. Первый горизонт является самой сухой частью литорали. В данной части литорали плотность поселений сообществ значительно меньше, чем на других горизонтах. Второй горизонт наиболее омываемый. Последний горизонт самый омываемый, практически не осушаемый, и здесь наблюдается наибольшее количество организмов. На осушаемой полосе остается много бурых водорослей, но больше всего их в нижней части литорали вблизи уреза малой воды (Марфенин, 2006).
На фукусах и аскофиллуме немало морских беспозвоночных. Как правило, на этих водорослях и под ними на грунте можно найти двустворчатых моллюсков мидий (Mytilusedulis), морских улиток литорин (Littorinaobtusata, L. saxatilis, L. littotea), гидроидов (Laomrdeaflexuosa, Dynamenapumila, Clavamulticornis), иногда мшанок и прикрепленных полихет (Spirorbisspirorbis). Там, где мидии, обязательно присутствуют и морские звезды Asteriasrubens, которые ими питаются (Марфенин, 2006).
Тут же на фукусах прячутся бокоплавы (Gammarusduebeni). Вблизи валунов в лужицах можно обнаружить актиний (Aulactiniastella). Они сидят, зарывшись в песок, только венчик щупалец неприметно расправлен над поверхностью. На заиленной части литорали внимание привлекают холмики с темными песчаными колбасками. Это следы активной деятельности крупной полихеты – пескожила (Arenicolamarina). В заиленном песке живет и множество двустворок. Самые распространенные – Macomabalthica.На камнях видны белые домики балянусов (Semibalanusbalanoides). Они состоят из крепко соединенных друг с другом пластинок. В верхней части литорали обычны солоноватоводные высшие растения – солерос, морскаяастрочка и другие (Марфенин, 2006).
1.4. Особенности эстуарной зоны
В словаре И.С. Щукина (1980, с. 504) эстуарий – это «… воронкообразный сужающийся к вершине залив, образующийся в результате подтопления низовьев речной долины и преобразованный воздействием речного и приливного факторов». И в более раннем определении С.Д. Лаппо (Лаппо, 1940) эстуарий – это устье реки в виде воронкообразного залива, «в котором нельзя отличить границу между рекой и морем». Больше, однако, отвечают существу дела те определения, в которых главное и определяющее – не геоморфология, но особенный тип взаимодействия пресных и морских вод, при котором всегда возникает значительный горизонтальный, а в двуслойном эстуарии и вертикальный градиент солености (Day, 1951; Ketchum, 1951; Pritchard, 1967; Odum, 1971;Хлебович, 1986). Эстуарий в таком понимании может занимать в зависимости от объема пресного стока и морфологии (степени изоляции) пространство всего залива либо только определенную его часть. Это может быть открытая, прилегающая к устью реки вершина залива или замкнутый полуизолированный внутренний бассейн, а также отсеченная зарегулированная акватория (Семенов, 1988).
С гидробиологической и экологической точки зрения больше конкретности и пространственной определенности вносит в понятие эстуария представление О. Кинне (Kinne, 1971) о хорогалинной зоне и его предложение считать эту зону с критической соленостью 5-8‰, разделяющую морскую и пресноводную фауны (и экосистемы), ядром эстуария. Развивая это положение, В.В. Хлебович (1986) предлагает «считать эстуарием зону смешения морских вод с речными, заселенную специфически эстуарными организмами, имеющими центром развития зону критической солености и не встречающимися в истинно пресных и полносоленых водах» - с верхней и нижней границами по солености 1-3 и 18-24‰, соответственно. А.К. Виноградов (Виноградов, 1986) выделяет границу хорогалинной зоны 22-26‰. Биологически считается также возможным определять верхнюю (по течению) границу по исчезновению широко эвригалинных морских форм, а нижнюю – по исчезновению наиболее эвригалинных пресноводных форм (Хлебович, 1986).
Из вышесказанного можно сделать вывод, что эстуарий не является строго определенной формой залива и должен быть исключен из основных его морфологических категорий (Семенов, 1988). Вместе с тем, что гидробиологические критерии равно применимы и к устьевым лиманам в морях без приливов, и к открытым большим акваториям некоторых сильно опресненных внутриматериковых морей с приливами. Однако ни в первом, ни во втором случае нельзя было бы сказать, что такого рода «эстуария» характерен специфически эстуарный тип взаимодействия морских и пресныхвод резко выраженным горизонтальным градиентом солености. Поэтому, если придерживаться и этого последнего принципа, то к эстуарию можно отнести любые замкнутые или полузамкнутые бассейны и с приливным перемешиванием морских и пресных вод, относительно постоянной хорогалинной зоной (ядром эстуария) с соответствующей солоноватоводной фауной и флорой (Семенов, 1988).
1.5. Общий план строения тела
Гаммарусы – чрезвычайно подвижные животные, способные к активному перемещению, как в толще, так и придонных слоях воды, так и по грунту и среди слоевищ водорослей в условиях слабого увлажнения во время отлива. Для них характерно удлинённое, умеренно сжатое с боков тело, способное свободно распрямляться и сгибаться дугообразно. Общее строение тела, конечностей, головных придатков гаммарусов является наиболее типичным для семейства Gammaridae и для всего отряда Amphipoda (Sars, 1890-1895, pl. 1; Гурьянова, 1951, Рис. 2).
Как у всех амфипод, тело гаммарусов состоит из 18 сегментов и делится на три отдела: голову (cephalon), включающую четыре головных и слившихся с ними I грудной сегмент, несущий максиллипеды; грудь (thorax или mesosoma), составленную семью сегментами, и брюшко (abdomen), состоящее из шести свободных сегментов (Рис. 2).
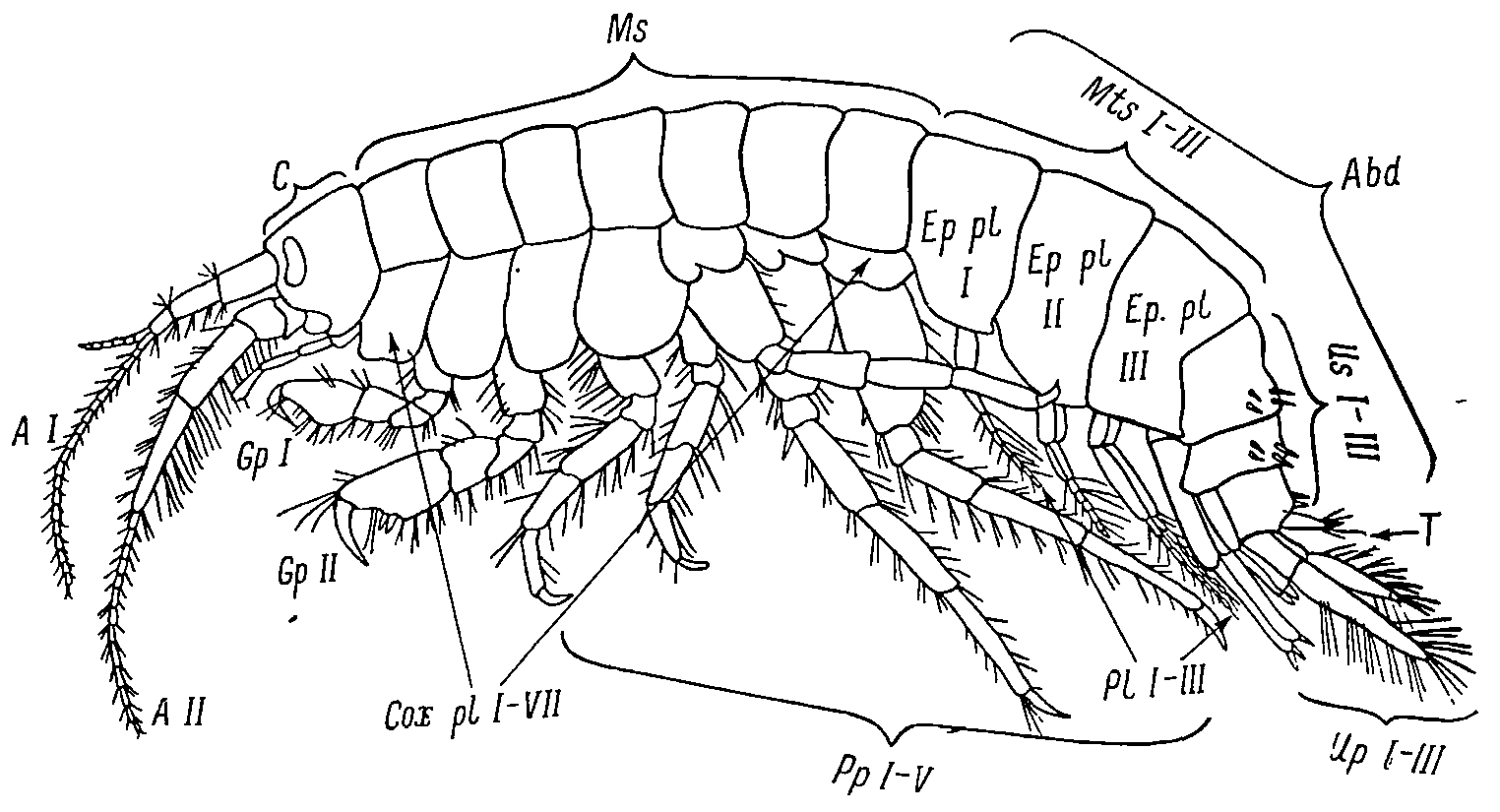
Рис.2. Общий вид гаммарусов (Цветковой, 1975)
В свою очередь, брюшной отдел подразделяется на два отдела: передний, или собственно брюшной, отдел (метазома, или плеозома), куда входят три первых брюшных сегмента, несущих плавательные конечности – плеоподы, и задний, или хвостовой, отдел (урозома), включающих три задних брюшных сегмента, каждый из которых несет пару прыгательных ног – уроподов. Кроме того, на последнем урозомальном сегменте имеется хвостовая пластинка, или тельсон.
Выросты боковых сторон первых трех брюшных сегментов образуют эпимеральные пластинки (epimera), передний край которых закруглён, задний - оттянут назад в виде небольшого угла. Спинная сторона первых трёх брюшных и иногда последних грудных сегментов нередко несёт срединный продольный киль, иногда вооруженный шипами, либо имеет зазубрины по одному краю.
На спинной стороне всех трёх урозомальных сегментов у большинства видов имеются небольшие бугорки, как правило, усаженные группами шипов и щетинок (последние у различных видов развиты в разной степени).
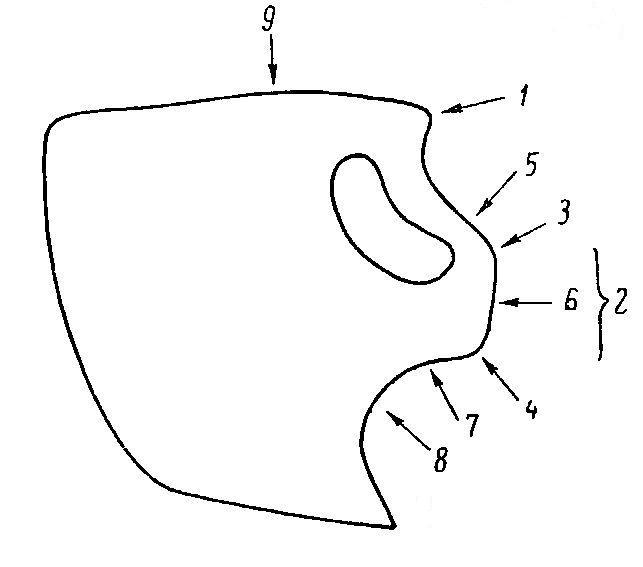
Рис.3. Строение головы и типы межантеннальной лопасти у гаммарусов: 1 - рострум; 2 - межантеннальная лопасть; 3 - верхний угол межантеннальной лопасти; 4 - нижний угол межантеннальной лопасти; 5 – верхний край межантеннальной лопасти; 6 – передний край; 7 – нижний край межантеннальной лопасти; 8 - нижнеантеннальныйсинус; 9 - верхний край головы (Цветковой, 1975)
Передний край головы имеет небольшой лобный вырост – рострум, слабо выраженный и плохо заметный. Боковые выросты оттянуты в межантеннальную лопасть (Рис. 3). Верхний ее угол ясно выражен, и имеет три вида: заостренной треугольной лопасти, как например у G. pephredo, почти прямоугольной – у G. lagunogammarus, и закругленной, как у видов подрода Gammarus; нижний угол срезан или ясно выражен.
Нижняя часть межантеннальной лопасти образует глубокий синус, в котором помещаются основания нижних антенн. Глаза обычно удлиненно-почковидные, сложные, расположены по бокам головы и состоят из многочисленных фасеток, снабженных темным или красновато-бурым пигментом со светлым ободком.
Голова несёт 8 придатков - 5 парных и 3 непарных: верхние антенны (антенны I, antennulae); нижние антенны (антенны II, antennae); верхняя губа (labiumsuperior, l); нижняя губа (labiuminferior, L); жвалы, или мандибулы (mandibulae, Md); верхняя (maxillaI, maxillulae, или MxI) и нижняя (maxillaII, maxillulae, или MxII) челюсти и непарный придаток, образованный из слияния пары грудных конечностей – ногочелюсти, или максиллипеды (maxillipedes, Mxp).
Два первых грудных сегмента несут специализированные хватательные конечности - гнатоподы (gnathopodaI, II, GpI, II); грудные сегменты III – VII несут пять пар ходильных ног, различающихся по своему строению и вооружению. Три первых абдоминальных (или метазомальных) сегмента несут парные плавательные конечности, или плеоподы (pleopoda, PlI – III); три последних абдоминальных (или урозомальных) сегмента несут парные прыгательные ножки, или уроподы (uropoda, UpI – III). Кроме того, на последнем урозомальном сегменте имеется препарная двулопастная хвостовая пластинка – тельсон (telson, T).
1.6. Особенности морфологии и экологии видов рода гаммарус, обитающих в районе исследования
1.6.1. Gammarus oceanicus, Segerstale, 1974
Тип Arthropoda – членистоногие
Класс Crustacea – ракообразные
Подкласс Malacostraca– высшиераки
ОтрядAmphipoda– разноногие
Подотряд Gammaridea– бокоплавы
РодGammarus
Подрод Lagunogammarus
Семейство Gammaridae
Вид Gammarus oceanicus
Нижний край головы 1-го членика стебелька антенн I с двумя пучками щетинок, расположенными посредине и в проксимальной части членика. 3-й членик щупика жвал с ровным рядом щетинок по нижнему краю. Шипы на спинной стороне I-III урозомальных сегментов сидят на хорошо заметных буграх. Щетинки на спинной стороне урозомальных сегментов, на тельсоне и на заднем крае 4-го членика переоподовV простые, не превышают длину шипов в соответствующих группах. Добавочный жгутик антенн I меньше длины основного жгутика (Рис.4.).
Самки отличаются от самцов более слабыми гнатоподами с меньшим числом шипов на крае 6-го членика, более низкими буграми на урозомальных сегментах, меньшим числом пучков щетинок на нижнем крае члеников стебелька антенн I и более выпуклым задним краем базального членика переоподовV. Молодые особи, кроме указанных выше признаков, отличаются также недостаточным развитием щетинок на боковой стороне и нижнем крае 2-го и 3-го члеников щупика жвал.
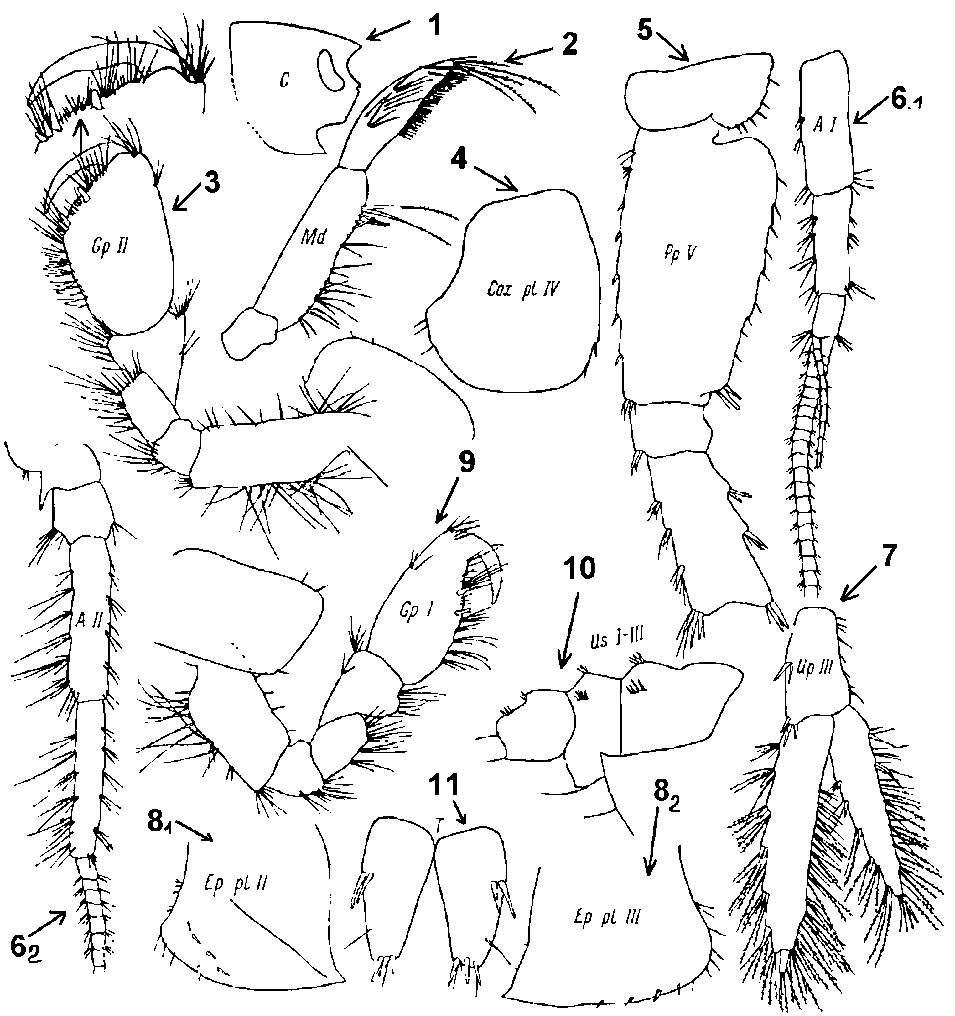
Рис. 4. Части тела Gammarus oceanicus, Segerstale, 197, по Цветковой, 1975
: 1 – С – голова; 2 – Md – мандибула; 3 – GpII – гнатоподаII; 4 – CoxplIV – коксальная пластинка IV; 5 PpV – переоподаV; 61-62 – AI иAII – антенны I и II; 7 – UpIII – уроподаIII; 81-82 – Ep. plII и III – эпимеральная пластинка II и III; 9 – GpI - гнатоподаI; 10 - UsI – III – урозомаI-III; 11 - T –тельсон
G. oceanicus и G. setosus имеют сходное вооружение нижнего края 3-го членика щупика жвал; отличаются отсутствием перистых щетинок на переоподах, урозоме и тельсоне. Особенно трудно различаются молодые особи обоих видов, так как особи G. setosus еще не имеют хорошо развитых перистых щетинок.
Длина самцов может достигать 38 мм длины (обнаружены в Баренцевом море – у северного побережья Норвегии) (Stephensen, 1940). Наиболее крупные самки – 35 мм длины, известны с побережья Шпицбергена (Segerstrale, 1948). В центральной части Белого моря максимальные размеры тела особей данного вида – 35 мм () и 22 мм () (Брязгин, 1952). В восточной части Балтийского моря максимальные размеры G. oceanicus значительно меньше 22 мм (у побережья Польши; Micherdzinski, 1959) и 23 мм (Латвийская ССР, коллекции ЗИН АИ СССР).
Прижизненная окраска тела варьирует от зеленоватой, желтоватой, зеленовато-бурой до темно красной.
Бореальный широко распространенный атлантический вид. Доходит на севере до западного и северного побережья Шпицбергена, у восточного побережья Гренландии до 77° с. ш. и у западного побережья – до 73° с. ш., вдоль восточного побережья Америки на юг доходит до побережья Коннектикута, у Западной Европы – до Ла-Манша; на восток идет до западного побережья Новой Земли (Рис. 5.).
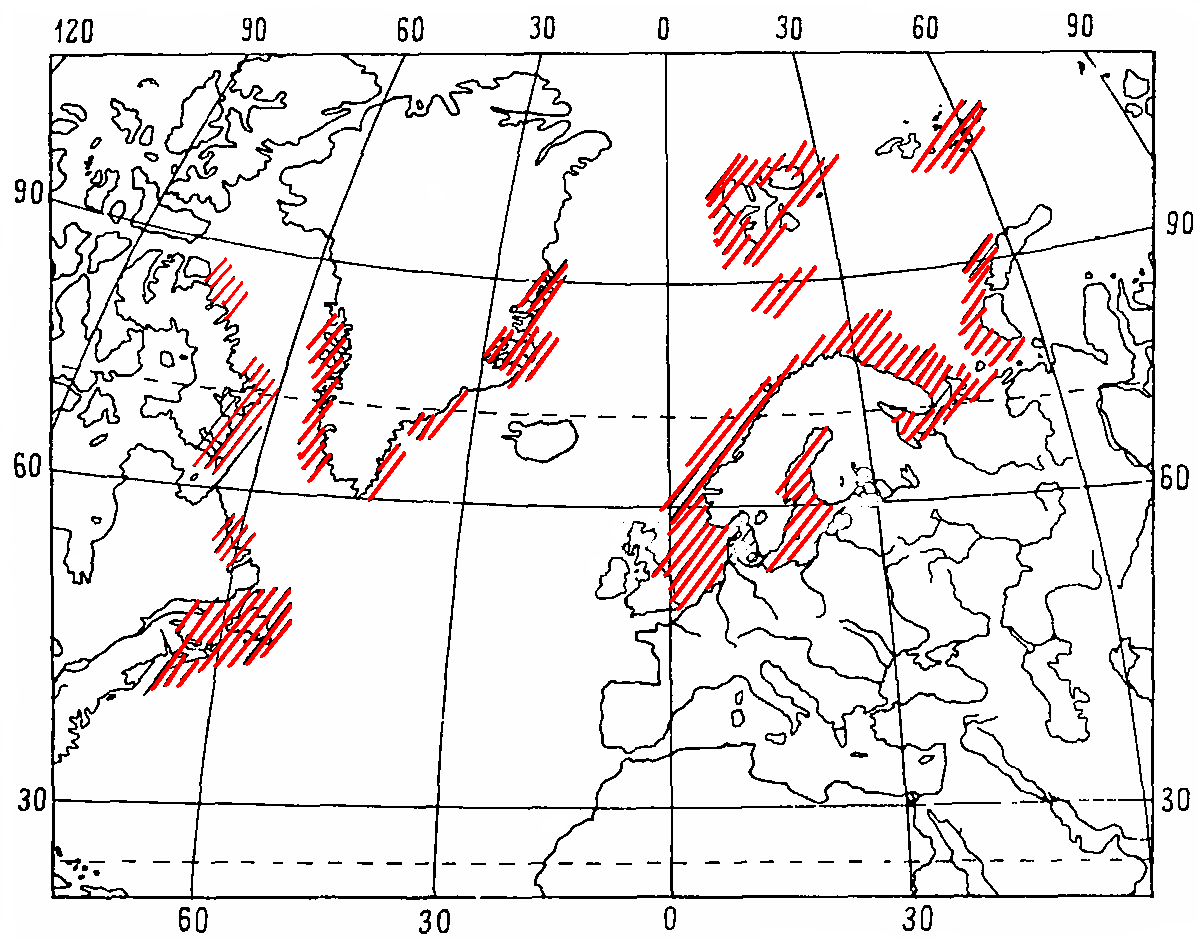
Рис. 5. Распространение Gammarus oceanicus, Segerstale, 1974, по Цветковой, 1975
ЧастообитаетвместесGammarus duebeni, G. setosus, Marinogammarus finmachicus, M. obtusatus, Gammaruslocusta, G. salinus, G. wilkitzkii, G. tigrinus, G. lawrencianus; в устьях ручьев и рек - G. zaddashi и Gammaracanthusloricatus; иногда образует чистые популяции.
G. oceanicus– морской эвригалинный вид, заходящий в солоноватые воды и выдерживающий колебания солености в очень большом диапазоне – от нормальной морской (32-34‰) до сильно распресненной воды в приустьевых участках рек и ручьев, где соленость в отлив падает до 1-5‰ при pH6.81 (Segerstrale, 1947, 1950; Spooner, 1951; Steen, 1951; Маргулис, 1962; Цветкова, 1968, и др.). Эвритермный вид, выдерживающий колебания температуры воды от – 1.8 -+ 4°С зимой до 12-21°С летом.
1.6.2. Gammaruszaddachi, Sexton, 1912
Тип Arthropoda – членистоногие
Класс Crustacea – ракообразные
Подкласс Malacostraca– высшиераки
Отряд Amphipoda– разноногие
Подотряд Gammaridea– бокоплавы
Род Gammarus
Подрод Lagunogammarus
Семейство Gammaridae
Вид Gammarus zaddachi
Нижний край головы 1-го членика стебелька антенн I с 3-7 пучками длинных щетинок; нижний край 3-го членика щупика жвал с густым рядом щетинок неравной длины (в виде «бахромы»); на боковой стороне членика – 3 поперечных ряда щетинок, расположенных по всей длине членика. Задний край 2-го и 4-го члеников переоподов IVи V с длинными (в 3-4 раза длиннее шипов) густыми простыми щетинками; такие же длинные и многочисленные щетинки – на урозомальных сегментах и тельсоне (Рис.6.).
Самки отличаются более слабымигнатоподами с менее скошенным пальмарным краем и меньшим развитием шипов, но с более сильно развитым вооружением в виде щетинок.
По вооружению антенн I, 3-го членика щупика жвал, урозомы и тельсона ближе всего примыкает к G. wilkitzkii, но хорошо отличается от него сильным развитием длинных щетинок на заднем крае и заднем нижнем углу базального членика. От G. salinus, имеющего сходное вооружение антенн и 3-го членика щупика жвал, взрослые особи этого вида хорошо отличаются сильным развитием длинных щетинок на урозоме, переоподах IV–V и тельсоне; молодые особи этих различий не имеют (Dennert, 1969).
Наиболее длинные самцы (23 мм) отмечены в Балтийском море и у побережья Польши и Финляндии; в Белом море самцы мельче – до 18 мм; размеры тела самок в пределах ареала приблизительно одинаковы (до 15026 мм); минимальные размеры самок, приступающих к размножению, - 7 мм (Kinne, 1961).

Рис.6. Части тела Gammarus zaddachi, Sexton, 1912, по Цветковой, 1975
: 1 – С – голова; 2 – AI иAII – антенны I и II; 3 – Md – мандибула; 4 – GpI и GpII – гнатоподаI и II; – CoxplIV – коксальная пластинка IV; 5 PpIII и V – переоподаIII и V; 6 – T –тельсон; 7 – Ep. plII и III – эпимеральная пластинка II и III; 9 – UsI – III – урозома; 10 – UpIII – уроподаIII.
Прижизненная окраска тела варьирует от светлой до темно-зеленой и бурой, с поперечными полосами (Segerstrale, 1947; Kinne, 1954); у беломорских особей – светлая с темно-бурыми поперечными полосами.
Бореальный широко распространенный приевропейский вид (у побережья Великобритании, Ирландии, северной Франции; в Северном и Балтийских морях, в Баренцевом море вдоль берегов Норвегии и Кольского полуострова на восток до Белого моря и полуострова Канип) (Рис.7.).
В различных районах Балтийского моря встречается вместе с G. oceanicus, G. locusta, G. salinus; у побережья Западной Европы – также с G. chevreuxi. По мере продвижения в пресные водоемы постепенно замещается пресноводным видом G. pulex (Spooner, 1947).
G. zaddachi– солоноватоводный вид, обитающий в местах с пониженной соленостью воды (от 18 до 1‰) при рН 6.81; иногда заходит в пресные воды (Spooner, 1947; Segerstrale, 1947 и др.). По данным Кинне (Kinne, 1961), в условиях эксперимента предпочитает соленость воды 5 и 10‰ и хуже переносит соленость в 30‰ (наблюдается более высокая смертность, и развитие яйца не доходит до конца). Выдерживает сезонные колебания температуры в пределах ареала от -1.7 до + 21°С.
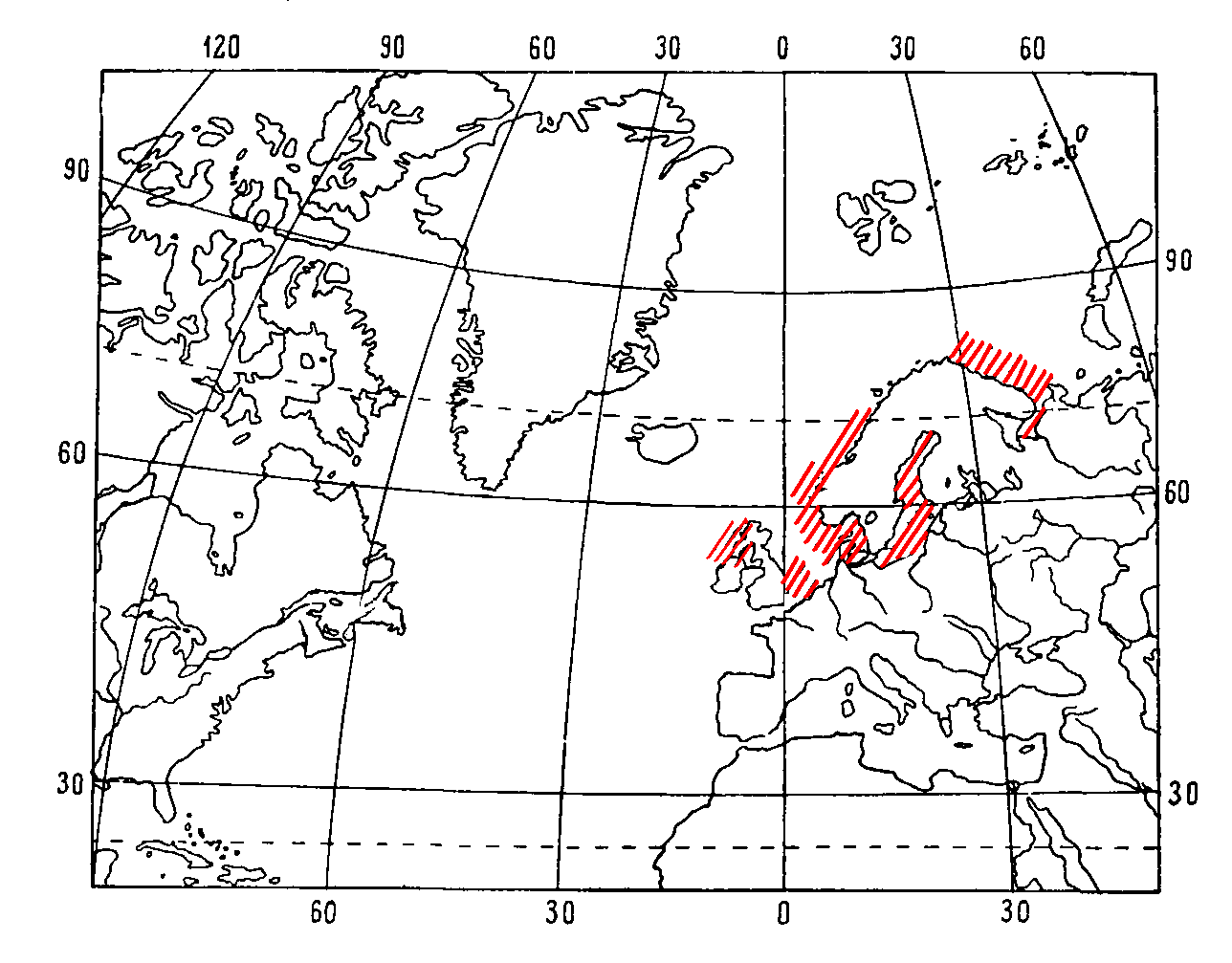
Рис.7. Распространение Gammaru szaddachi, Sexton, 1912, по Цветковой, 1975
1.6.3. Gammarussetosus, Дементьева, 1931
Тип Arthropoda – членистоногие
Класс Crustacea – ракообразные
Подкласс Malacostraca– высшие раки
Отряд Amphipoda– разноногие
Подотряд Gammaridea– бокоплавы
РодGammarus
Подрод Lagunogammarus
Семейство Gammaridae
Вид Gammarus setosus
Половозрелые особи G. setosus отличаются от всех других видов подрода G. (Lagunogammarus) более коренастым телом и развитием густых пучков перистых щетинок среди групп шипов на спинной стороне всех урозомальных сегментов, вершинах лопастей тельсона и на члениках переоподов; эти щетинки заметно длиннее шипов. По нижнему краю 1-го членика стебелька антенн I 2–3 пучка простых щетинок (кроме апикального), расположенных всегда (даже у молодых неполовозрелых особе) в дистальной части членика; 2-й и 3-й членики соответственно с 3 – 6 и 2 – 4 такими щупиками, расположенными равномерно по нижнему краю члеников. Задний край базального членика переоподов V окаймлен довольно длинными шиповидными щетинками; его задний нижний угол срезан и вооружен двумя шипами и пучком длинных простых щетинок. У самцов 6-й членик гнатоподов II сильно расширен в дистальной части, задний край его выпуклый. Третий членик щупика жвал с ровным рядом тонкоперистых щетинок по нижнему краю и тремя поперечными рядами тонкоперистых щетинок на внутренней поверхности членика (Рис.8.).
Самки отличаются меньшими размерами тела, более сильным развитием щетинок на гнатоподах (одновременно с более слабым вооружением шипами) и антеннах, а также несколько более слабым развитием перистых щетинок, особенно на урозоме и тельсоне.
Взрослые особи G. setosus хорошо отличаются от G. oceanicus (близкий вид) вооружением перистыми щетинками переоподов, урозомы и тельсона. Также иным вооружением заднего края базального членика переоподовIV и особенно V пар, несущего у G. setosus длинные щетинки и более сильным вооружением 2-го и 3-го члеников щупика жвал и 2-го и 3-го члеников стебелька антенн I.

Рис.8. Части тела Gammarus setosus, Дементьева, 1931, по Цветковой, 1978
1 – С – голова; 2 – Т – тельсон; 3 – AI – антенна I; 4 – Md - мандибула; 5 – EpplII и III – эпимеральная пластинка II и III; 6 – PpV – переоподаV; 7 – GpI – I; 8 - CoxplIV – коксальная пластинка IV; 9 – GpII – гнатоподаII; 10 – UsI-III; 11 – UpIII – уроподаIII
Длина тела половозрелых самцов 17 – 37 мм, самок – 13 – 31 мм. Максимальная длина тела самцов – 50 мм (Shoemaker, 1955, мыс Барроу, Аляска). В работах Н.Л. Цветковой (Цветкова, 1975) наиболее крупные особи обнаружены у побережья Новой Земли (самцы – 37 мм, самки – 25 мм) и у Земли Франца Иосифа (самцы – 36 мм, самки – 30-31 мм).
Прижизненная окраска тела G. setosus на литорали Белого и Баренцева морей варьирует от темно-серой, почти черной до темно-бурой, с более яркими красно-бурыми поперечными полосами по краям сегментов и члеников антенн и переоподов.
Бореально-арктический широко распространенный вид, циркумполярный в Арктике. В высоких широтах Арктики встречен у побережья Гренландии, Шпицбергена, Земли Франца-Иософа, а также у западного и восточного берегов Новой Земли и далее на восток у островов и в прибрежных водах всех сибирских морей и в арктических районах Северной Америки. У азиатских берегов – из Анадырского и Кроноцкого заливов, Авачинской губы и различных районах Охотского моря (Цветкова, 1968) (Рис.9.).
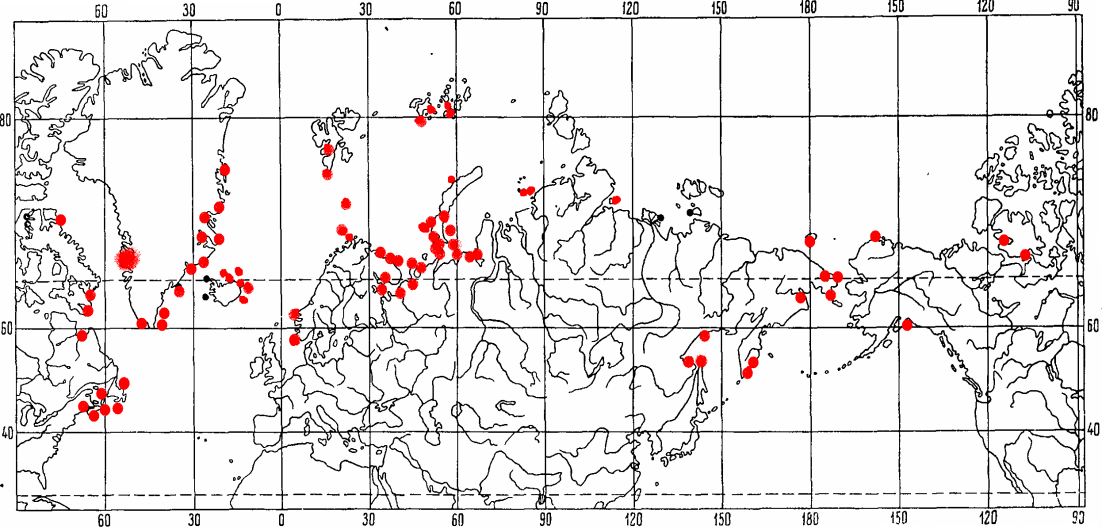
Рис. 9. Распространение Gammarus setosus, Дементьевой, 1931, по Цветковой, 1975
В Белом море нередко встречается в поясе Littorinasaxatilisи Gammarusoceanicus. На юго-восточном побережье Баффиновой Земли обитает в верхнем горизонте литорали вместе с Gammarusoceanicus; в среднем горизонте - G. oceanicus, Macomabalthica и др. На открытых участках побережья Белого и Баренцева морей обычно встречается вместе с Gammarus oceanicus, Marinigammarus obtusatus; в приустьевых участках рек и ручьев – вместе с Gammarus zaddachi, G. duebeni.
G. setosus - морской эвригалинный вид, заходящий в солоноватые воды. Населяет как чисто морские, так и опресненные прибрежные воды, а также водоемы лагунного типа, солоноватые и реликтовые озера. Выдерживает значительные колебания солености (от 32 – 35 до 1,24‰). Относительно холодноводный вид, обитающий в районах с колебаниями температуры воды от – 1.7°С зимой и до + 21°С летом; широко заселяет холодные арктические воды и наиболее холодные районы Северной Пацифики (Охотское море; Анадырский залив).
1.6.4. Gammarus duebeni, Lilljeborg, 1851
Тип Arthropoda – членистоногие
Класс Crustacea – ракообразные
Подкласс Malacostraca– высшие раки
Отряд Amphipoda– разноногие
Подотряд Gammaridea– бокоплавы
Род Gammarus
Подрод Gammarus
Семейство Gammaridae
Вид Gammaru sduebeni
Межантеннальная лопасть головы с закругленными верхним и нижним углами и почти прямым вертикальным передним краем. Задний нижний угол 2-го (базального) членика переоподовV прямой, вооружен лишь пучком щетинок с внутренней стороны. Нижний край 1-го членика стебелька антенн I с 1 – 3 пучками щетинок, расположенными в передней трети членика. Нижний край 3-го членика щупика жвал с ровным рядом коротких щетинок (в виде «гребня»); посредине боковой стороны 3-го членика – один поперечный ряд щетинок, из которых одна расположена несколько выше. Спинная сторона I – IIIурозомальных сегментов, тельсон и 4-6-й членики переоподовIII – Vс длинными простыми щетинками (Рис.10.).
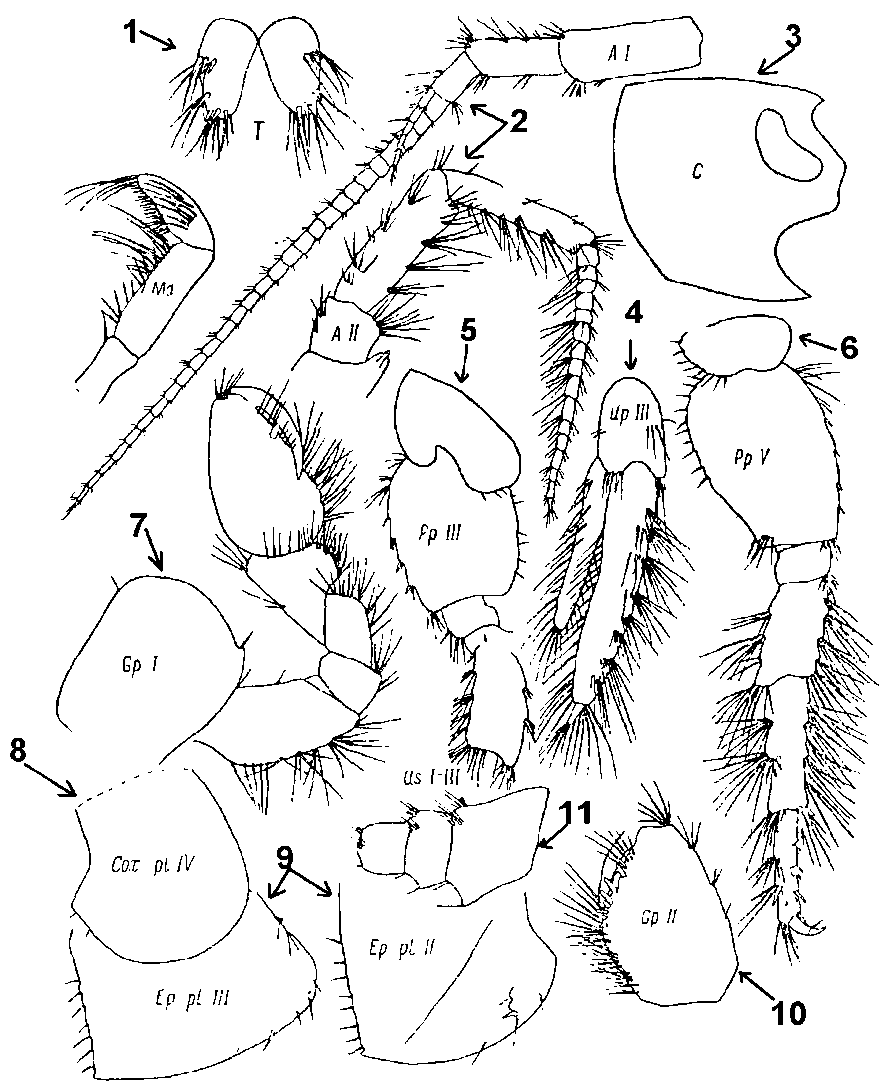
Рис. 10. Части тела Gammarus duebeni, по Цветковой, 1975: 1 – Т – тельсон; 2 – А I и АII – антенны; 3 – С – голова; 4 – Up – уроподаIII; 5 – PpIII – переоподаIII; 6 – PpV- переоподаV; 7 GpIгнатоподаI; CoxplIV –коксальная пластинка; 9 – EpplIII–II – эпимеральная пластинка III–II; GpI – гнатоподаI; UsI – III – урозомаI – III.
Антенны Iприблизительно равны по длине II паре; стебелек их относительно более короткий и толстый, чем у G. oceanicus, G. salinusG. и zaddashi. Первый членик стелька по нижнему краю с 1 – 2 пучками щетинок, расположенными всегда в дистальной части членика ближе к дистальному нижнему углу, в отличие от G. oceanicus, имеющего пучки щетинок в проксимальной части членика – в середине и ближе к его основанию, и от G. setosus, имеющего 2 – 3 пучка в дистальной половине членика, начиная с его середины. Второй и третий членики стебелька антенн I вместе немного длиннее 1-го членика; второй членик составляет около длины 1-го членика, в отличие от G. oceanicus, G. zaddachiс 2 – 4 пучками щетинок.
Наибольшая длина тела самцов в Баренцевом море – 24 – 25 мм (август 1967 г., сбор А. В, Янковского); в Белом море – 21 мм (июнь 1964 г., губа Чупа, сборы автора); в западной части Балтийского моря – 23 мм (Киль, Kinne, 1954b). Минимальные размеры самок на побережьях Великобритании – 7 – 8 мм (Хайнес, 1954), а в Белом море – 10 – 11 мм (Маргулис, 1962б).
Прижизненная окраска тела – серо-зеленоватая и коричневата (у особей в Балтийском море (Kinne, 1954)) или грязно-серая (у особей в Белом море), без полос.
Широко распространенный бореальный атлантический вид. От северного побережья Франции, берегов Великобритании, Ирландии и Фарерских островов на север вдоль берегов Норвегии и далее на восток вдоль полуострова Канин; есть в Балтийском море. В западной части Атлантики – от южной Гренландии вдоль берегов Канады на юг до 45°с.ш. (Рис. 11.).
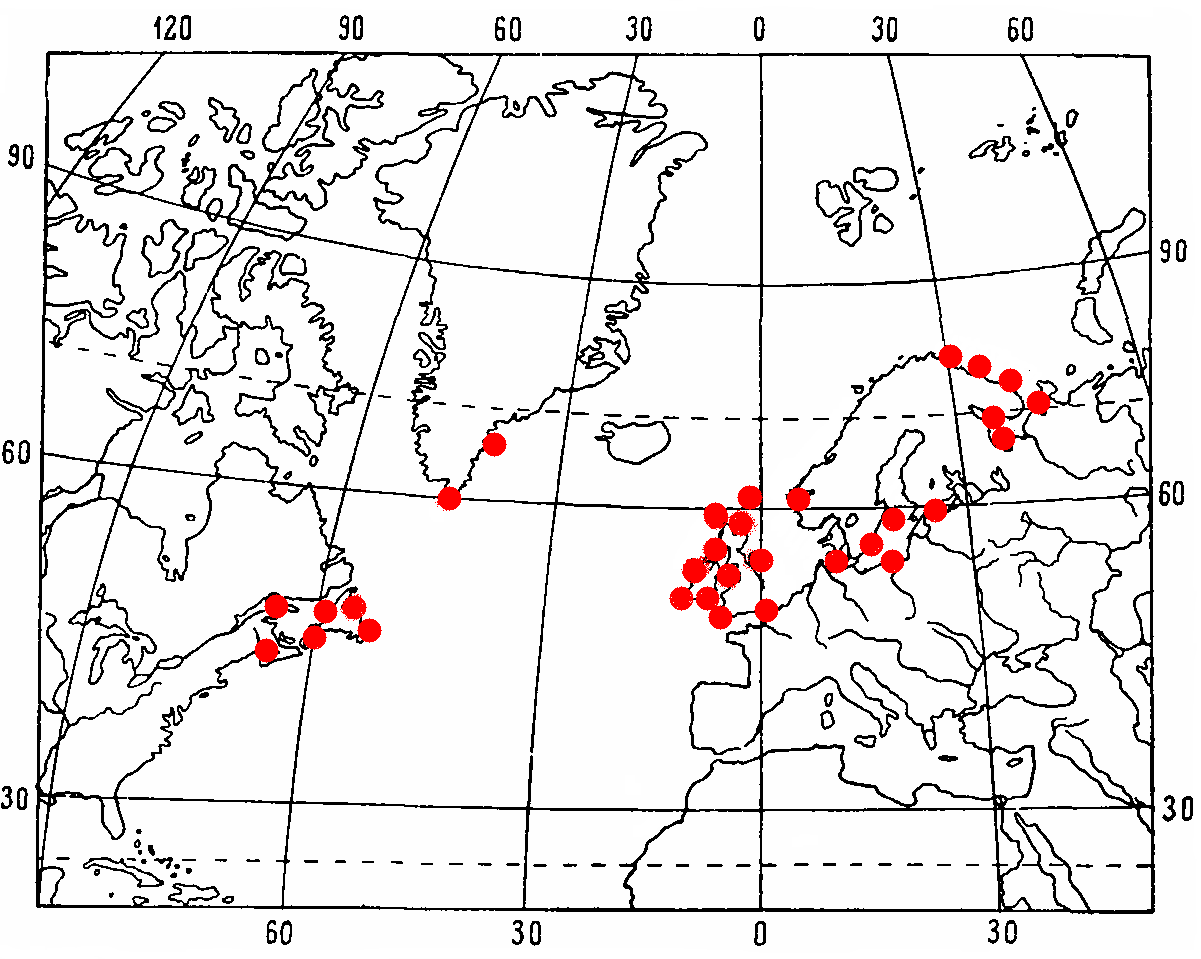
Рис. 11. Распространение G. duebeni, Lilljeborg, по Цветковой, 1975
В Белом и Баренцевом морях обитает совместно с Gammarus oceanicus, G. setosus, G. zaddachi; в Балтийском — с G. locusta, G. oceanicus, G. salinus, G. zaddachi; на побережье Канады — с Gammarus oceanicus, G. setosus, G. lawrencianus, G. tigrinus(Bousfield, 1958b; Bousfield, 1958a. Leim, 1960); в пресных водах Великобритании Gammarusduebeni.
G. duebeni — солоноватоводный вид; населяет, как правило, опресненные участки морского побережья (обычно с соленостью воды от 3 до 12‰) и нередко заходит в пресные воды. Выдерживает значительные и резкие суточные и сезонные колебания солености, обусловленные как приливо-отливными колебаниями уровня моря, так и сильным испарением воды в лагунах в летний период, когда соленость воды поднимается до 28— 30 ‰ (Howes, 1939; Forsman, 1951; Bousfield a.Leim, 1960; Соколова, 1963, и др.).Выдерживает колебания температуры в чрезвычайно широком диапазоне — от - 3°С (при вмерзании в лед) до +32°С (побережье Финляндии (Segerstrale, 1946, 1950; Forsman, 1949, цит. по: Segerstrale, 1950).Пo данным Стефенсена (Stephensen, 1917), обитает в теплых источниках южной Гренландии при температуре воды 40°С.
2. МАТЕРИАЛЫ И МЕТОДЫ
2.1. Фактический материал
Материал, собранный на литорали южного колена Кольского залива, предоставлен лабораторией зообентоса Мурманского морского биологического института КНЦ РАН. Сбор литорального зообентоса в ходе мониторинга производился в эстуарной части Кольского залива в период с апреля по ноябрь 2010 г. Материал, собранный на литорали среднего колена Кольского залива, предоставлен лабораторией кафедры Биоэкологии МГТУ. Сбор зообентоса в ходе мониторинга производился на литорали Кольского залива с апреля по ноябрь 2012 г.
В кутовой части южного колена залива было установлено три мониторинговых разреза, расположенных по мере возрастания эстуарных условий: 1 разрез был расположен в районе мыса Притыка (Рис. 12А, 14) сразу за новым мостом, 2 разрез – напротив устья реки Кола (Рис 1 Б, 14), 3 разрез – в устье реки Тулома (Рис. 12В,14). В кутовой части среднего колена залива было также установлено два мониторинговых разреза: 1 разрез был расположен в устье реки Белокаменка (Рис.13А, 14), 2 разрез – на литорали Абрам-Мыса (Рис. 13Б, 14).
Станции отбора проб на разрезах располагались от верхних горизонтов литорали к нижним горизонтам (Рис. 14, 15, 16). На каждой станции в зависимости от преобладающих грунтов и наличия растительности собирали по 3-6 проб разными орудиями лова (Рис. 14, 15, 16). На каменистых грунтах с растительностью собирали 3-6 проб квадратной количественной рамкой (R0.0625) со сторонами 0,25х0,25 м (площадь пробоотбора 0,0625 м). При этом выполняли 3 пробы с поверхности валунов, и 3 пробы – из грунта под камнями. Литоральные организмы с камней вместе с макрофитами счищались скальпелем, а под камнями выбирались вместе с грунтом.На песчаных и илисто-песчаных грунтах выполняли 6 проб, методом извлечения грунта колонкой (С) диаметром 10,2 см, (площадь поверхности 0,008 м), высотой 7 см.
Рис. 11. Район мыса Приты
Рис. 12. Район устья р. Кол

Рис. 12. Район исследования южного колена 2010г.: А – мыс Притыка; Б – напротив устья р. Кола; В – устье р. Тулома


Рис.13. Район исследования среднего колена 2012г.: А – устье р. Белокаменка; Б – на литорали Абрам-Мыса
Для того, чтобы оценить распределение организмов в толще донных осадков, отобранный колонкой цилиндр грунта делили на два горизонта: СI – поверхность (1,5-2 см), СII – толща осадка (оставшиеся 5 см).
В нижнем горизонте литорали на самом мористом первом разрезе собирали пробы на встречаемость крупной полихеты Alittavirens большой количественной рамкой R1 со сторонами 1х1м.
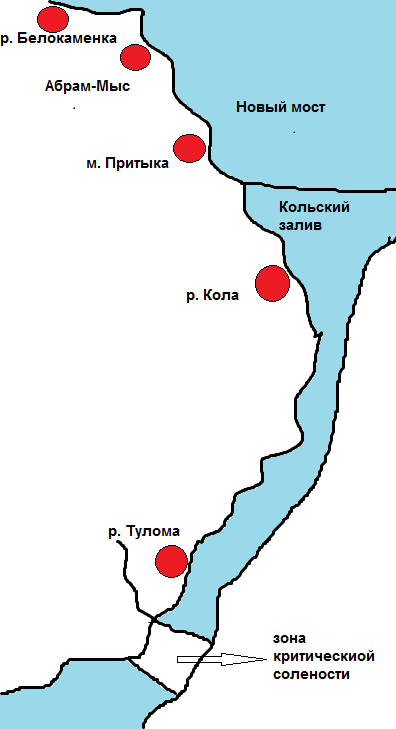
Рис.14. Карта-схема расположения мониторинговых разрезов на литорали Кольского залива 2010 и 2012гг.
На начальном этапе мониторинга в конце апреля – мае 2010 и 2012 гг. была проведена фоновая количественная съемка для получения общей картины распределения организмов. В ходе этой съемки было выполнено максимальное количество станций на всех разрезах. Всего в этот период было отобрано 120 проб. В течение последующих этапов мониторинга, на каждом разрезе выполняли только 2-3 контрольные станции. Сбор материала для второго этапа мониторинга проводился в начале августа 2010 и в начале августа 2012 гг., для третьего этапа – в конце ноября 2010 и в конце ноября 2012 гг.
Нами в лабораторных условиях организмы отделялись от грунта, отсортированные по таксономическим группам пробы перефиксировались 70% этанолом. Пробы ракообразных были разложены в отдельные емкости, снабженные краткой станционной информацией: номер станции, дата и район сбора проб, номер и название рейса. Далее проводилась идентификация вида, и выполнялся общий гидробиологический анализ.

Рис. 15. Схема размещения станций и объем собранного материала на разрезах в районе исследования в ходе трех этапов мониторинга. Значками отмечены орудия лова, в которых арабской цифрой отмечено количество проб. Цифра, стоящая на закрашенном серым цветом поле обозначает количество проб под камнями, а на белом фоне – на камнях.
Рис.16. Схема размещения станций и объем собранного материала на разрезах в районе исследования в ходе трех этапов мониторинга. Значками отмечены орудия лова, в которых арабской цифрой отмечено количество проб. Цифра, стоящая на закрашенном серым цветом поле обозначает количество проб под камнями, а на белом фоне – на камнях.
2.2. Камеральная обработка и анализ материала
Камеральную обработку материала проводили в лабораторных условиях. Зафиксированные пробы отмывались от формалина и остатков грунта. Затем проводили первичную разборку и сортировку проб по различным таксономическим группам: Polychaeta, Insecta, Olygichaeta, Crustacea, Gastropoda, Bivalvia для последующей идентификации. Первичную сортировку проб выполняли с использованием стереомикроскопа МБС-1 и МБС-10 (Рис.17).

Рис.17. Стереомикроскоп МБС-10
При анализе проб определяли видовой состав литоральных беспозвоночных, подсчитывали количество особей и вес каждого вида в пробе. Затем определяли численность и биомассу каждого вида на 1 м. Пробы промывали через капроновое сито с ячеей 0,5 мм и фиксировали 4%-ным нейтрализованным формалином. Одновременно с отбором проб определяли характер донных осадков и измеряли соленость поверхностного слоя при полной и малой воде. Для определения солености использовали ручной рефрактометр ATAGO ATC-S/MILL-E, температуру измеряли ртутным термометром.
Организмы рода Gammarus идентифицировали до вида. После определения вида у каждого экземпляра устанавливали пол, измеряли длину и определяли массу тела. Каждую особь измеряли от начала головы до основания тельсона с помощью измерительной линейки на окуляре микроскопа МБС-10. Далее определяли пол организмов.Самцов определяли по наличию у них семенных мешков на вентральной части последнего переонального сегмента, самок – по наличию элементов марсупиальных сумок в основании первых четырех пар переопод.
Взвешивание проводилось после одноминутной обсушки маленьких навесок материала на фильтровальной бумаге. Животных после обсушки помещали в предварительно взвешенный бокс, и определяли вес на аналитических весах (Рис.18).

Рис.18. Аналитические весы
Материал был разделен по районам исследования, все особи гаммарусов были взвешены, измерены (линейный размер определяли от начала головы до основания тельсона), изучено соотношение полов. Для каждого вида подсчитывали количество особей в пробе и суммировали их вес. Полученные значения усреднялись по станциям и пересчитывались на 1 м2. При подсчёте среднего значения вычислялась стандартная ошибка, или ошибка среднего.
Для анализа размерного и возрастного состава поселений строили гистограммы размерно-частотного распределения в программе Microsoft office Excel 2007. Для построения вариационного ряда весь диапазон промеров разбивался на серию равных интервалов (классов вариант), затем подсчитывали, количество попавших вариант в каждый интервал. Число классов приблизительно определяли по эмпирической формуле:
k = 1 + 3,32 * lg(n) (1)
где n–объем выборки.
Векторные рисунки (графики, карты) редактировали в программе CorelDRW 12.
3. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
3.1. Видовой состав и количественное распределение гаммарусов в эстуарии Кольского залива
В результате проведенной обработки данных исследуемых районов побережья Кольского залива было обнаружено четыре вида гаммарусов: умеренно-тепловодные бореальные G. oceanicus, G. zaddachi, G. duebeniи холодноводный бореально-арктический G. setosus (Рис. 19).
Рис. 19. Обнаруженные виды рода Gammarus: а – G. oceanicus; б – G. zaddachi; в – G. duebeni; г - G. setosus
Наиболее массовыми видами на всех участках побережья были G. oceanicusи G. duebeni, их численность составляет по трем мониторингам около 80%, оставшиеся два других вида – незначительны и их численность – 20%. Максимальное количество G. zaddachiнаблюдается при пониженной солености, так как данный вид является солоноватоводным (Цветкова, 1975). По данным Кинне (Kinne, 1961а), в условиях эксперимента хуже соленость переносит в 30‰, при таком показатели воды, наблюдается высокая смертность, и развитие яйца не доходит до конца. А благоприятной соленостью воды для них является 5 и 10‰. По данным Цветковой (Цветкова, 1975) в местах с пониженной соленостью воды (6 – 2‰) (восточная часть Балтийского моря) имеет непрерывный ареал. С повышением солености (западная часть Балтийского моря, прибрежные воды Северной Атлантики вплоть до Баренцева и Белого морей) имеет прерывистое распространение и приурочен лишь к устьям рек и ручьев, избегает открытых участков с нормальной морской соленостью. Так и в нашем исследование G. zaddachi приурочен к местам, где вода имеет низкую соленость (Рис. 20а, в).
Наиболее массовое поселение особей вида G. setosus встречается в районах с пониженным и высоким уровнем солености температуры (рис. 20 а и б). Данный вид относится к морскому эвригалинному типу. И может населять как чисто морские, так и опресненные прибрежные воды. Выдерживает значительные колебания солености (от 32 – 35 до 1,24‰) (Цветкова, 1975). Хоть и является холодноводным видом, но может переносить колебания температуры от – 1,7° зимой и летом до +21°С (Цветкова, 1975). По результатам исследований 2008 – 2009г. О. С. Любиной (Любина, 2009), данный вид повсеместно распространен вдоль береговой линии залива. Наиболее массовые поселения его обнаружены в районах с пониженным уровнем солености на литорали кутовой части фьорда и около устья р. Грен до мыса Финнесет. Из графиков видно, что и у нас G. setosus больше всего приурочен к местам с пониженной соленостью и минимальной температурой, даже если это было лето, то особи этого вида выбирают местность с наименьшим прогреванием воды и низким показателем солености воды (Рис. 20б).
Виды G. oceanicusи G. duebeni постоянно встречаются в наибольшем количестве, по сравнению с другими двумя видами. Данные особи преобладают как в южном колене, так и в среднем колене Кольского залива ь в течение всего 2010 и 2012 гг. По отношению к температурному режиму G. oceanicusотносится к группе эвритермных холодноводных бореально-арктических видов, G. duebeni – к группе эвритермных умеренно тепловодных бореальных видов.
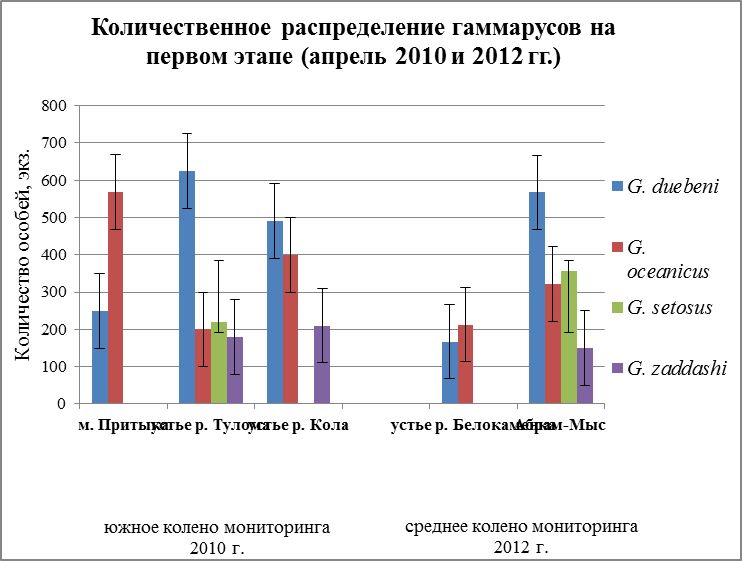
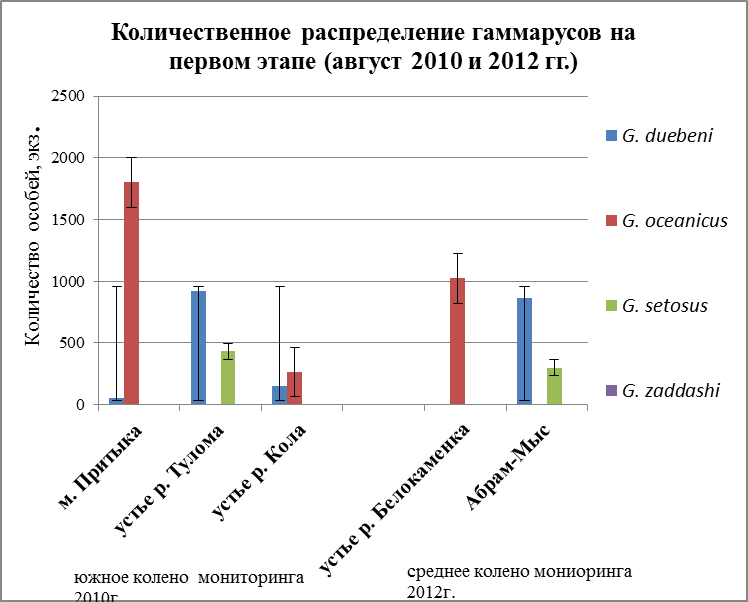
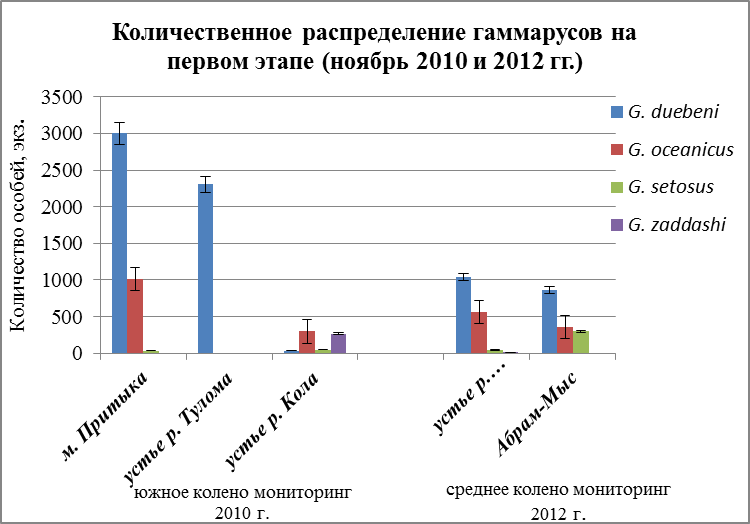
Рис. 20. Количественное распределение гаммарусов: а – апрель мониторинга 2010 и 2012гг., б – август мониторинга 2010 и 2012гг., в – ноябрь мониторинга 2010 и 2012 гг.
Как видно из графиков (Рис. 20а,б,в) оба вида варьируют друг над другом. И в каждом районе преобладает тот или иной вид. Это связано с их отношением к температуре и солености. Так G. duebeni доминирует над G. oceanicus в тех районах, где вода более опреснена, там же где соленость воды выше 5‰ доминировать начинает другой вид – G. oceanicus. Оба вида способны переносить колебания температуры, поэтому они также имеют преобладание над другими видами рода Gammarus. По отношению к соленостиG. oceanicus является морским эвригалинным видом и выдерживает колебания солености воды в очень широком диапазоне (от 32-34‰ до 1-5‰) (Цветкова, 1975). К группе солоноватоводных видовотноситсяG. duebeni. Чаще населяет устья речек и ручьев, впадающих в море, выдерживая колебания солености от почти пресной воды до 18 ‰ (Цветкова, 1975).
Если учитывать отношение рассматриваемых видов амфипод к основным абиотическим факторам, преобладание в Кольском заливе G. oceanicus иG. duebeniнад другими двумя видами можно объяснить тем, что данные виды наиболее эврибионты, т.е. оба вида могут приспосабливаться и заселять места с различными условиями окружающей среды. Распространение G. setosus в Кольском заливе, скорее всего, связано с температурным фактором. В работе Икко (Икко, 2010) также говорится о том, что этот вид массовый в тех местах, где температура минимальна. Наиболее массовые скопления G. setosusобразовывал в местах, где протекали холодные струи ручьев, т.е. в верхнем горизонте литорали. Для солоноватоводного вида G. zaddachiважным фактором, который влияет на распространение вида, является соленость воды. Скорее всего, именно, поэтому этот вид встречается в устьях рек, впадающих в море. Как было установлено Кинне (Kinne, 1961а), G. zaddachiпредпочитает существовать в интервале от 5 до 10‰. Практически полное отсутствие его в августе месяце говорит о том, что, вероятно, связано с более высокой соленостью поверхностных слоев воды в это время по сравнению с другими сезонами.
3.1.1. Динамика количественного распределения
В ходе проведения исследования было проанализировано распределение амфипод рода Gammarus по горизонтам литорали.
В верхних горизонтах исследованных участков литорали на все трех разрезах обитает G. duebeni (Рис. 21, станция 1).Наиболее массовые поселения этого вида (1200 ± 60 экз./м) обнаружены под камнями в среднем горизонте литорали на самом эстуарном разрезе. В нижнем горизонте, видно из графиков (Рис. 21, станция 3 и 4) рачки этого вида попадаются редко и никогда не доминируют. Стенобионтный по солености и содержанию кислорода вид G. zaddachi полностью отсутствует на самом мористом разрезе, но его поселения образуют заметные скопления (122 и 149 экз./м) в нижнем горизонте разреза 2 и 3 (Рис. 21). Холодноводный вид G. setosus встречен только в нижнем горизонте литорали на разрезах 2 и 3 (Рис. 21). Он образует высокие скопления (262 экз./м) под камнями в нижнем горизонте второго разреза. Эвригалинный вид G. oceanicusобнаружен в нижнем горизонте на всех разрезах, где и доминирует. Также небольшие его поселения встречены в верхнем горизонте литорали на 1 и 2 разрезе (Рис. 21).
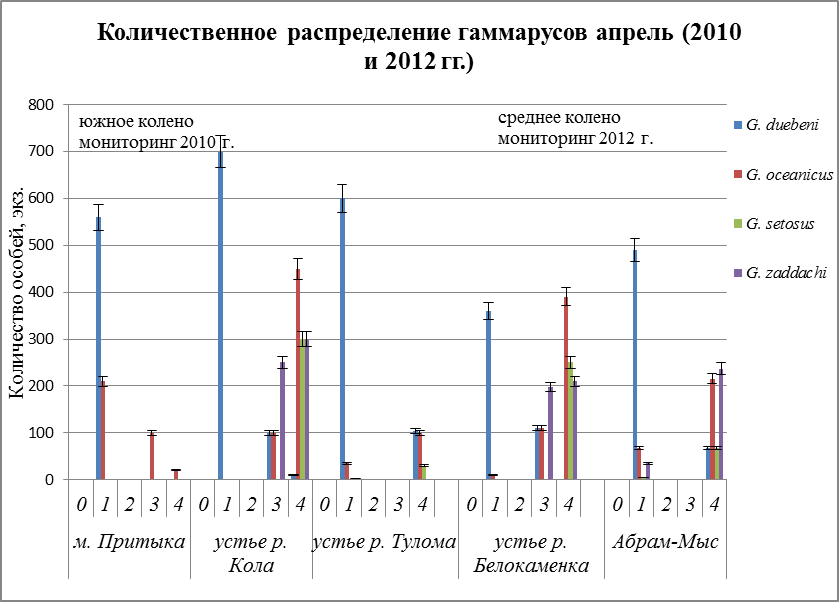
Рис. 21. Количественное распределение гаммарусов в апреле мониторинга 2010 и 2012 гг. по горизонтам литорали
Вертикальная зональность прослеживается и в другие сезоны года.
В августе месяце наблюдается иная картина. На всех разрезахвстречаетсяG. Duebeni. Преимущественное преобладание его в более пресном водоеме (Рис. 22). Максимальное количество особей данного вида встречается в верхнем горизонте литорали (Рис. 22), и лишь в Балтийском море населяет глубины от 0,5 до 1,0 м (Segerstrale, 1946; Kinne, 1954). По графикам видно преобладание еще одного вида – G. oceanicus (Рис. 22). Но наблюдается и его практически полное отсутствие (Рис. 22), его встречаемость в мористых местах незначительна. Малозначительная группа видов G.setosus и G. zaddachiна всех разрезах встречается редко, особенно G. zaddachi. Это скорее всего объясняется тем, что данный вид менее устойчив к дефициту кислорода, высокой температуре, длительному периоду осушки и инсоляции (Bulnheim, 1979). Оба вида населяют нижние горизонты литорали. Максимальное количество G. setosus на втором разрезе и его численность составляет 224 ± 60 экз/м также как и в апреле месяце, образует большие скопления под камнями.
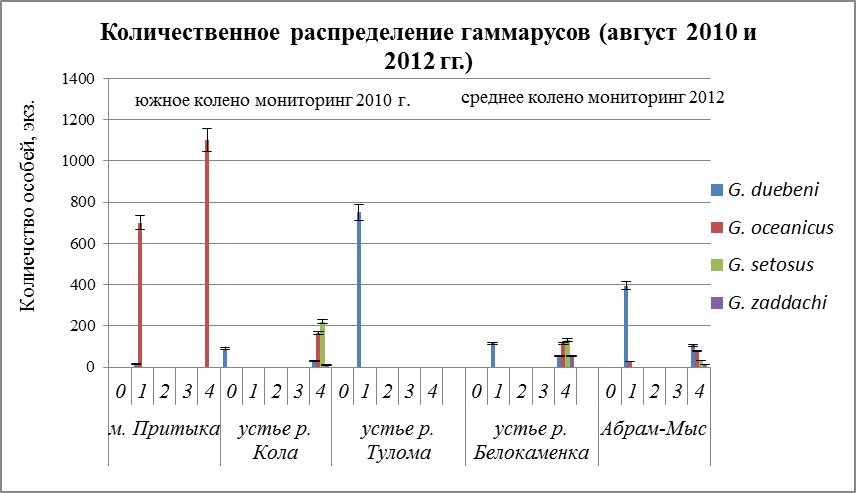
Рис.22. Количественное распределение гаммарусов в августе по горизонтам литорали
В холодное время года наблюдается практически тоже распределение, что и в другие два сезона. К верхнему горизонту литорали приурочен вид, относящийся к группе солоноватоводных рачков – G. duebeni (Рис. 23). Как говорилось ранее, что G. oceanicus морской эвригалинный вид, который приспосабливается к различным перепадам солености, и поэтому он встречается почти на трех разрезах (Рис. 23). Максимальное количество особей наблюдается не на нижнем горизонте литорали, а на верхнем (Рис. 23) и численность составляет 1021 экз./м. Смена лидерства происходит у двух других видов. Преобладание теперь у G. zaddachi. Это может быть связано с тем, что данный вид не может переносить сильные колебания солености, а на станции 4 устья р. Кола (Рис. 23) для него наиболее благоприятный уровень солености.
Основным показателем при характеристике местообитаний может служить встречаемость и доминирование видов различных экологических групп. К группе солоноватоводных видов относятся: G. duebeni, G. zaddachiи частично G. setosus, а к эвригалинно-морским – G. oceanicus. Доминирование солоноватоводногоG. duebeni в верхних этажах литорали на всех разрезах и этапах показывает на то, что в этой зоне, очень большое значение имеет пресный сток (осадки, ручьи при таянии льда и снега (в апреле месяце)), что позволяет данному виду обитать в самых неблагоприятных участках литоральной зоны. В литературных источниках имеются сведения, что данный вид не выдерживает конкуренции с другими видами гаммарид в местах, где они обитают вместе (Hynes, 1954). Поэтому данный вид, может быть, и встречается в большом количестве одни. Наиболее показательно распределение стенобионтных видов G. zaddachi и G. setosus. Обнаружение достаточно плотных поселений этих видов в нижнем горизонте литорали на трех этапах и на разрезах 2 и 3 указывает на устойчивое преобладание солоноватых вод в этих участках. При этом можно утверждать, что на самом мористом месте 1 разрез, преобладающая соленость превышает необходимый порог для существования этих видов. Вероятно эвригалинно-морской видG. oceanicus на эстуарных разрезах 2 и 3 находится в неблагоприятных условиях, поэтому его численность увеличивается только в нижнем горизонте литорали, поскольку этот участок меньший период времени подвергается осушке.
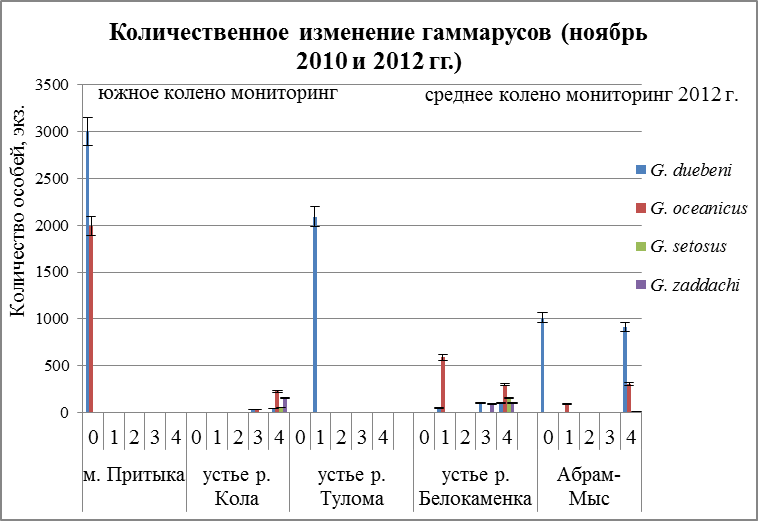
Рис. 23. Количественное распределение гаммарусов в ноябре по горизонтам литорали
3.2. Биомасса гаммарусов
Биомасса поселений в течение года разница по временам. Данное наблюдение прослеживается, как в южном, так и в среднем колене Кольского залива за 2010 и 2012 гг. По графикам (Рис. 24, 25) видно, что наименьшая продуктивность у вида G. zaddachi. На протяжении всего времени, наибольшая биомасса приходится на ноябрь, и составляет около 10%. В летнее время его продуктивность минимальна и составляет лишь доли процентов. Также можно пронаблюдать, что данныйвид предпочитает места с пониженной соленостью, поэтому, как видно из графиков (Рис. 24, 25), максимальная его продуктивность в районах устья р. Кола, устья реки Тулома и литорали района Абрам-Мыса. G. zaddachiявляется солоноватоводным видом, обитает в местах с пониженной соленостью воды (Spooner, 1947; Segerstrale, 1947; Kinne, 1954b). В связи с этим можно сделать вывод, что этот вид наиболее благоприятно чувствует себя, и вследствие чего, его биомасса увеличивается. Размеры этого вида не велики, наибольший размер у самцов в Белом море – 18 мм, самки – 7 мм (Kinne, 1961a). Такие небольшие размеры могут также сказываться на его биомассе. По биомассе другого вида G. setosus можно сказать, что этот вид наиболее продуктивен в летнее время года, в районе устья реки Кола, и в зимнее время, где его масса достигает максимума(Рис. 24,25). Этот рачок относительно холодноводный вид, (Цветкова, 1968), который размножается в холодное время года (Цветкова, 1968). Скорее всего, именно по этой причине его максимальная биомасса достигает летом, так как к этому времени года ювенильные особи достигают половозрелости и становятся более крупные в размерах(максимальная длина тела самцов – 50 мм, у самок – 31 мм (Shoemaker, 1955)) и весе. И, скорее всего, по причине его размножения, именно в холодное время года, мы наблюдаем, что биомасса также преобладает в ноябре, так как чаще встречаются самки с молодью, которые имеют значительный вес и размер. Если говорить о двух других видах, то они являются самыми массивными, и встречаются во все времена года и на всех разрезах. По результатам, которые выше, данные два вида преобладают и в количественном отношении. В поселении G. oceanicus наибольшие показатели биомассы регистрировались в августе, наименьшая биомасса – в ноябре (Рис. 24,25). Наибольшая биомасса прослеживается лишь в определенном районе исследования – мыс Притыка, наименьшая биомасса в более опресненном районе – устье р. Тулома. Та же картина наблюдается и в среднем колене: наибольшее количество особей встречается в более опресненном месте – устье р. Белокаменка. У другого вида – G. duebeni наибольшие показатели биомассы прослеживаются в ноябре, где составляет практически 100% (Рис. 24,25). Наименьшая биомасса данного вида – в августе месяце (Рис. 24,25), так как особи этого вида относятся к видам, которые не способны переносить колебания солености, и приурочены к более опресненным местам.Максимальная биомасса наблюдается в районе устья р. Тулома и в районе Абрам-Мыса, где соленость воды достигает оптимального уровня для благоприятной жизнедеятельности этого вида. В ноябре месяце наибольшая биомасса бокоплавов G. duebeni может быть связана с тем, что данный вид размножается преимущественно весной и летом, к этому времени ювенильные особи перерастают в взрослые особи. Длина тела самцов в Белом море – 21 мм (Цветкова, 1975), размеры самок в Белом море – 10-11 мм (Маргулис, 1962б). Хоть размеры небольшие, но при этом они доминируют по массе над другими двумя видами G. setosus и G. zaddashi. Также и численность говорит об их весе, а данный вид является одним из доминирующих видов, еще, поэтому масса тела может превалировать над другими видами. Что же касается вида G. oceanicus, то его максимальная масса прослеживается в августе месяце мониторинг 2010 г.) и в апреле (мониторинг 2012 г.), причем, данный вид сильнее реагирует на температуру, чем на соленость воды, так как является эвригалинным морским видом.Размножение происходит в весенний период времени при температуре 3–6°С, и именно по этой причине можно объяснить такую высокую биомассу в апреле и августе, где ювенильные особи достигают половозрелости, а самки вынашивают молодь. Максимальные размеры тела особей этого вида в центральной части Белого моря – у самцов 35 мм и у самок 22 мм (июль 1964 г., сбор В. Ф. Брязгина). Размеры особей этого вида могут влиять на их массу. В ноябре месяце (Рис. 24,25) высокая биомасса наблюдается из-за того, что особи размножаются не только весной, но и осенью: в сентябре (Маргулис, 1962б). Наибольшая биомасса регистрируется в районе мыса Притыка, где в августе месяце температура воды + 14°, которая благоприятно влияет на их продуктивность.
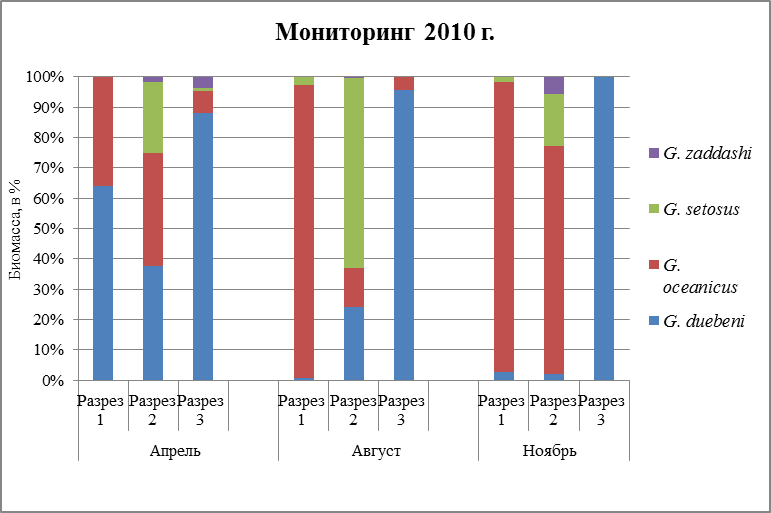
Рис. 24. Биомасса гаммарусов за период 2010г.
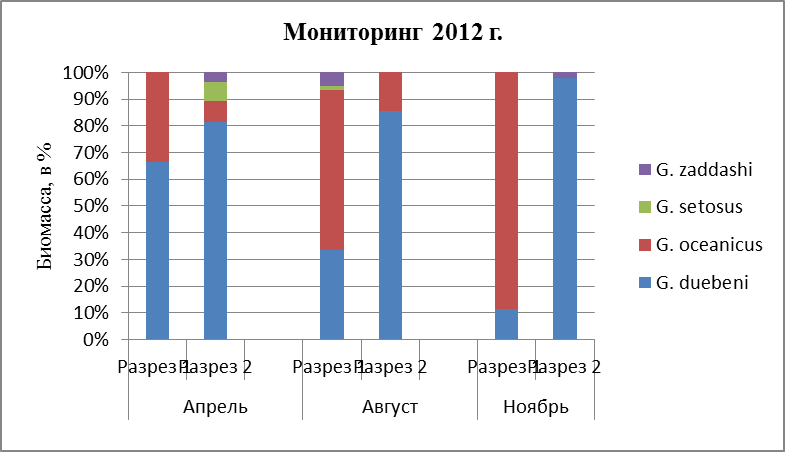
Рис. 25. Биомасса гаммарусов за период 2012 г.
3.3. Размерно-частотныйрядпоселений G. oceanicusи G. duebeni
При рассмотрении размерно-частотного ряда и половой структуры, были выбраны два вида G. oceanicusG. duebeni, так как они являются массовыми видами и у них можно проследить изменения во времени.
Изучение размерного состава популяции амфипод рода Gammarus показывает, что в ней всегда имеется несколько размерных классов, по численность резко преобладающих над остальными.
Анализ гистограмм размерно-частотного распределения мониторингового поселения G. oceanicus на местах отбора проб в течение года показал, что молодь в данном поселении присутствовала на протяжении всего года. В середине апреля 2010 г., как видно на графике (Рис. 26a, 27а), наблюдается появление ювенильных особей размером около 3,5 мм.

Рис.26. Размерно-частотная структура G. oceanicus в течение сезонного мониторнига 2010 г. (а –апрель)
Молодь данного размера встречалась в поселении и в летнее время и также на графиках видно, что имеется большое количество особей с меньшим размером – 2, 45 мм, которые только что вышли из марсипиумов (Рис. 26б, 27б).
В ноябрьских пробах молодь таких размеров отсутствует. Очевидно, что генеративные возможности самок ограничены. Об этом и говорит такой факт, как снижение плодовитости к осени (Маргулис, 1962б).
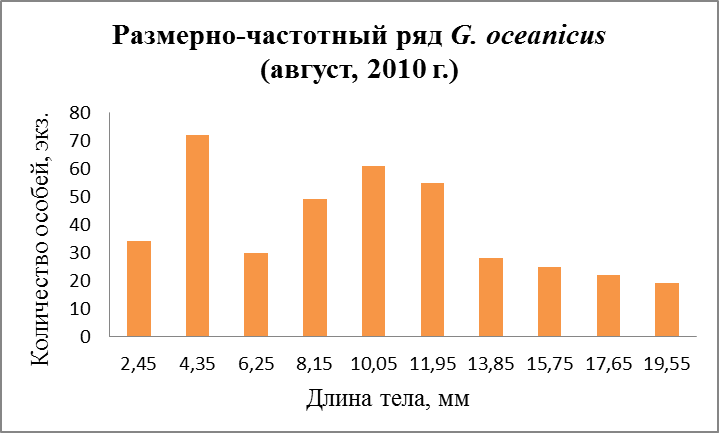
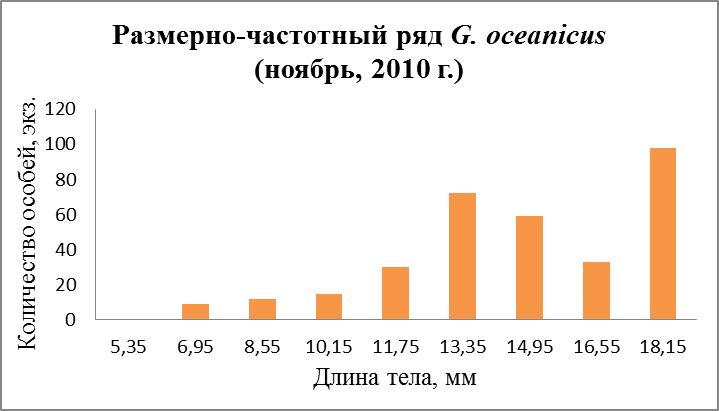
Рис.26. Размерно-частотная структура G. oceanicus в течение сезонного мониторнига 2010 г. (б – мониторинг, август; в – мониторинг ноябрь).
-

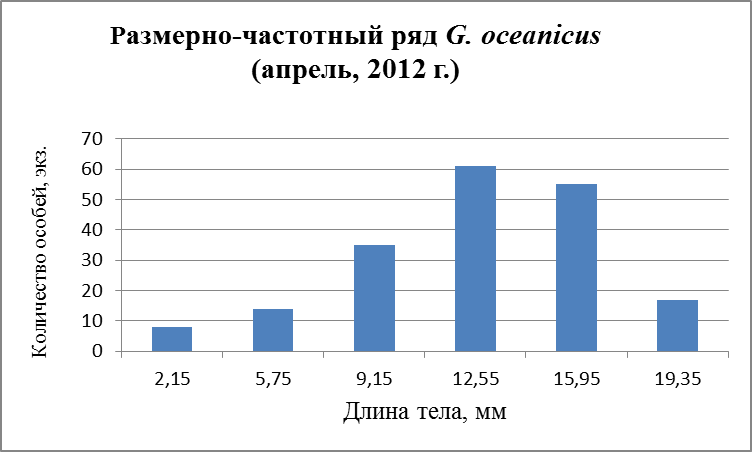
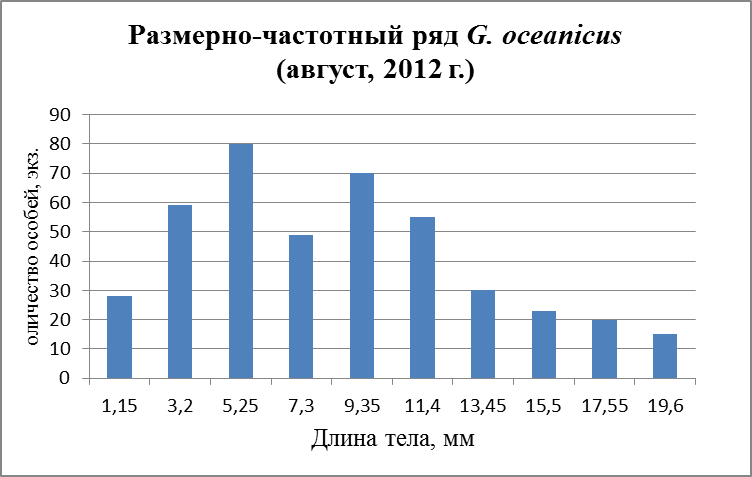
Рис.27. Размерно-частотная структура G. oceanicus в течение сезонного мониторнига 2012 г. (а – апрель, б – август; в – ноябрь).
В течение лета и осени поселение G. oceanicusна всех разрезах обоих колен Кольского залива (мыс Притыка, устье р. Кола, устье р. Тулома, устье р. Белокаменка и литораль Абрам-Мыса) наблюдаются три возрастные группы (рис. 26 б, в, 27б, в), которые, в свою очередь, подразделяются: 1 – ювенильные особи, 2 – особи средних размеров и 3 - самые крупные. Первую группу составляли особи длиной от 2,45 до 8,15 мм. Вторую группу составляли более крупные особи от 10,15 до 16,55 мм. Третья, самая малочисленная, группа особей – от 17,65 до 19, 55 мм. Из графиков другого периода (Рис. 26 а, 27а) можно составить лишь две возрастные группы. В апреле в первую группу особей вошли размеры длиной от 3,55 до 8,55 мм, во вторую группу - от 11,05 до 16,05 мм.
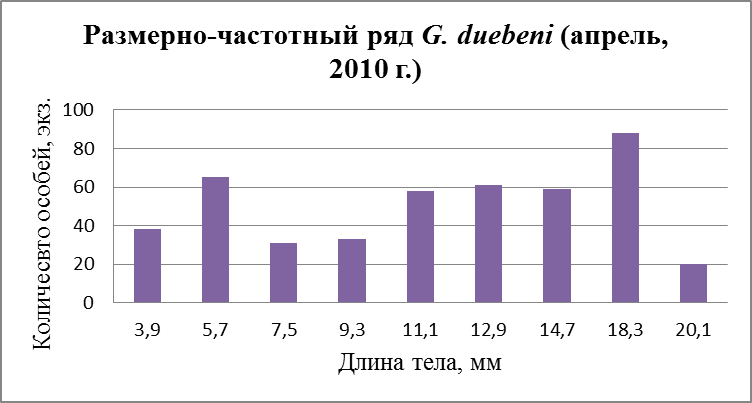
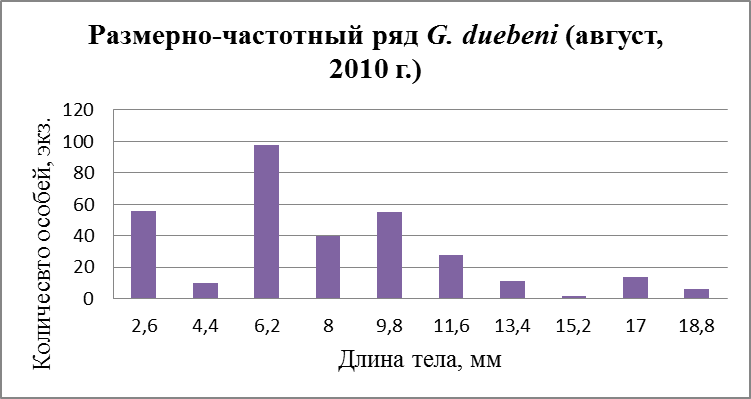
Рис. 28. Размерно-частотная структура G. duebeni в течение сезонного мониторнига 2010 г. (а –апрель; б – август).
Анализ гистограмм размерно-частотного распределения мониторингового поселения G. duebeniв местах отбора проб также показал, что молодь в данном поселении присутствовала на протяжении всего года (Рис. 28, 29). Как видно по графикам (Рис. 28, 29) в апреле, августе и ноябре длина тела ювенильных особей примерно одинакова и варьирует от 2,6 до 9,8 мм. Появление молоди во все сезоны происходит из-за того, что G. duebeni способен выдерживать колебания температуры в чрезвычайно широком диапазоне от - 3° до +32°С (Segerstrale, 1946, 1950; Forsman, 1951).
На графиках также просматриваются три размерные группы в которую входят 1 – ювенильные особи, 2 – особи средних размеров и в последнию 3 – самые крупные. В апреле в первую группу входят особи с длиной тела от 3,9 до 9,3 мм. Во вторую – от 11,1 до 14,7 мм. В третью – от 18,3 до 20,1 мм. В августе наблюдается немного иная картина. В первую группу входят особи с длиной тела от 2,6 до 9,8 мм. Во вторую – от 11,6 до 15,2 мм. В последнюю – от 17 до 18,8 мм.
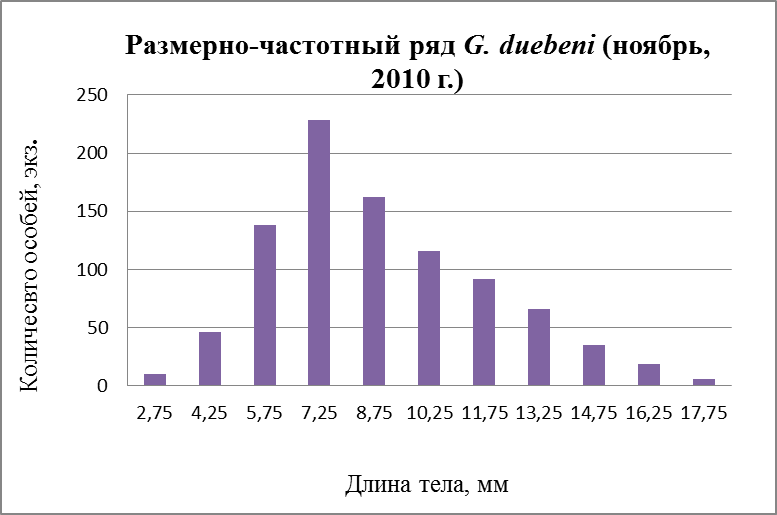
Рис. 28. Размерно-частотная структура G. duebeni в течение сезонного мониторнига 2010 г. (в –ноябрь)
В ноябре месяце размерные ряд подразделяется по следующим группам: 1 – от 2,75 до 8,75 мм; 2 – от 10,25 до 14,75 и 3 – от 16,25 до 17,75мм (Рис. 28в, 29в). По графику последнего сезона виден спад молоди с наименьшим размером 2,75 мм и увеличение размера в последующем. Это говорит о том, что происходит спад вымета молоди. По данным Маргулис (1962б) и наблюдениям Цветковой (1975) в Белом море самки с отложенной икрой наблюдались с мая по октябрь. Наибольшим преобладанием является длина тела 7,25 мм после которой наблюдается постепенное уменьшение особей с наибольшими размерами. Так как при низких температурах происходит замедление роста гаммарусов.
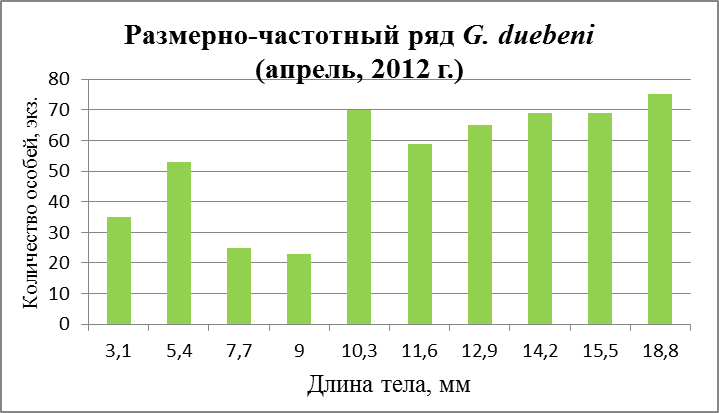
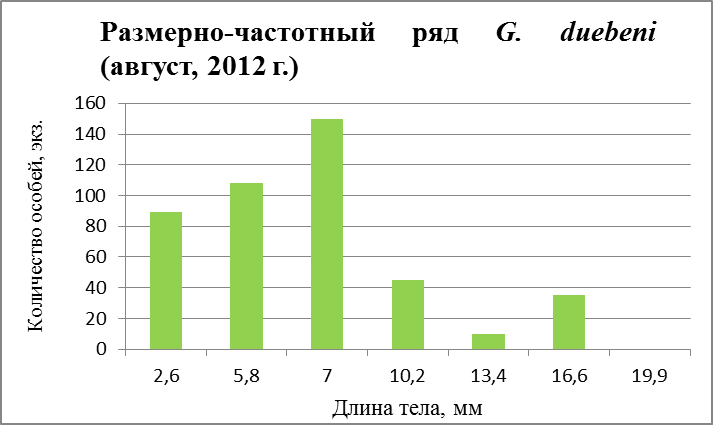

Рис. 29. Размерно-частотная структура G. duebeni в течение сезонного мониторнига 2012 г. (а –апрель; б – август, в – ноябрь)
3.4. Половая структура поселений G. oceanicus и G. duebeni
Бокоплавы обоих видов размножаются несколько раз в течение жизни и дают за один репрдуктивный сезон несколько поколений молоди Репродуктивный цикл бокоплавов начинается с гаметогенеза. У самок внешним проявлением гаметогенеза является увеличение размеров яйцеклеток. Состояние самок оценивали по следующим признакам (Бек, 1980):
- f 1 – самки с неопушенными оостегитами – до начала репродуктивного цикла;
- f 2 – самки с эмбрионами на разных стадиях развития;
- f 3 – самки с молодью;
- f 4 – самки с пустой сумкой.
Часть самок G. duebeniи G. oceanicus откладывает яйца уже осенью, но основная масса откладывает их в январе (Бек, 1980). Особенно заметно у G. dubeni (Рис. 30,31), так как осенью наблюдается наибольшее количество ювенильных особей. Выход первого приплода у данных видов происходит весной – в начале лета только при положительной температуре воды. Это хорошо прослеживается у G. oceanicus, где в апреле месяце численность ювенильных особей достигает своего максимума (Рис. 32,33). По данным Е. Н. Лупповой (Луппова, 1992) у G. oceanicus выход молоди имеет место три раза в год: 1 поколение – конец марта – начало апреля; 2 поколение – июль; 3 поколение – август. В нашем случае наблюдается тоже три выхода молоди: 1 поколение – апрель; 2 поколение – август; 3 поколение – ноябрь. Перерыв в размножении наступает в сентябре и продолжается до конца октября (Луппова, 1992). В связи с этим молодь данного вида и имеет наименьшую численность в ноябре месяце, и преобладание самцов и самок на стадии f 1, которые готовятся к репродуктивному циклу (Рис. 32,33). Также по результатам Е. Н. Лупповой (Луппова, 1992) у G. duebeniвыход молоди происходит 4 раза в течение года: 1 – зимой, предположительно в марте; 2 – в апреле; 3 – в начале июня; 4 – в середине августа. По нашим данным выход молоди отличается от данных Е. Н. Лупповой и составляет лишь 2 раза: 1 – апрель; 2 – ноябрь (Рис. 30, 31). Перерыв в размножении отмечен с мая до конца октября. Поэтому мы и наблюдаем преобладание самок на стадии зрелости f 1 в агусте месяце (Рис. 30, 31).
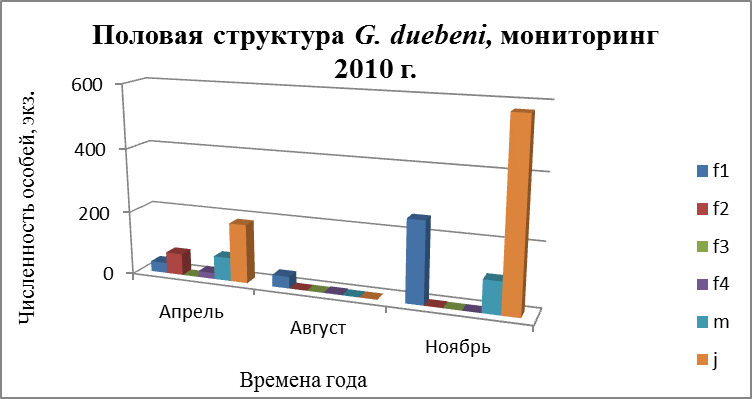
Рис. 30. Половая структура поселений G. Duebeniза период 2010 г.: f1 – самки с неопушенными оостегитами; f2 – самки с эмбрионами на разных стадиях развития; f3 – сакми с молодью; f4 - самки с постой сумкой; m – самцы; j – ювенильные особи
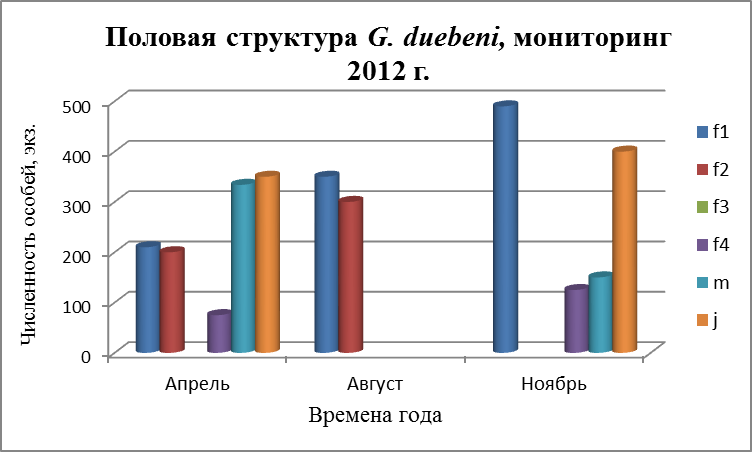
Рис. 31. Половая структура поселений G. Duebeniза период 2012 г.: f1 – самки с неопушенными оостегитами; f2 – самки с эмбрионами на разных стадиях развития; f3 – сакми с молодью; f4 - самки с постой сумкой; m – самцы; j – ювенильные особи
Одной из основных причин сезонной динамики соотношения полов является известный факт преобладания в каждом поколении гаммарусов особей одного пола (Бек, 1974). Из трех поколений молоди G. oceanicus, выходящих в течение года, в двух большинство составляют самцы (Рис. 32, 33).
У G. duebeni преобладание самок над самцами. Общее преобладание самок данного вида в летнее время объясняется, скорее всего, более ранними сроками созревания. Увеличение самок обоих видов в холодное время года (ноябрь), вероятно, связано с большей устойчивостью их к неблагоприятным условиям среды (Кузнецов, 1964). В холодное время при ограниченных пищевых ресурсах наиболее выгодно для вида выживание самок, поскольку большинство из них выхаживают в это время яйца на разных стадиях развития (Луппова, 1992).
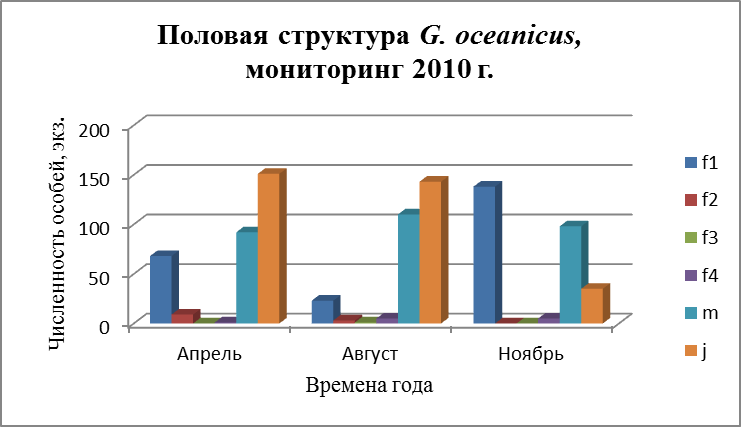
Рис. 32. Половая структура поселений G. Duebeniза период 2010 г.: f1 – самки с неопушенными оостегитами; f2 – самки с эмбрионами на разных стадиях развития; f3 – сакми с молодью; f4 - самки с постой сумкой; m – самцы; j – ювенильные особи
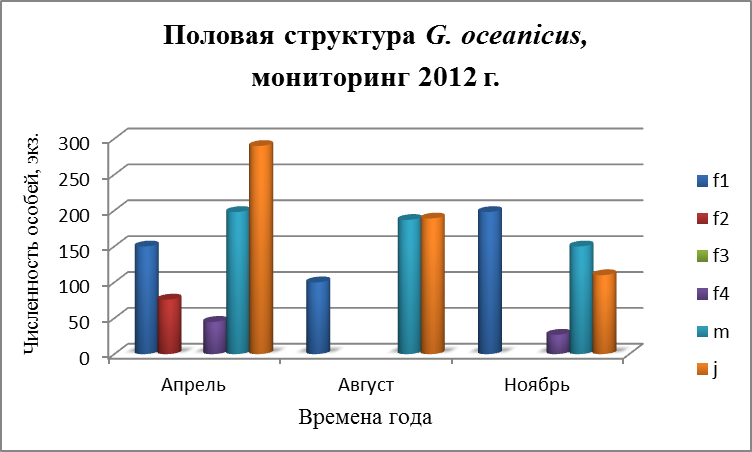
Рис. 33. Половая структура поселений G. Duebeniза период 2010 г.: f1 – самки с неопушенными оостегитами; f2 – самки с эмбрионами на разных стадиях развития; f3 – сакми с молодью; f4 - самки с постой сумкой; m – самцы; j – ювенильные особи
Из литературных данных известно, что в других поселенияхG. oceanicus часто отмечаются неравное соотношение полов в течение года. Так, по данным Т. А. Бек (Бек, 1974), на побережье пролива Великая Салма Кандалакшского залива Белового моря в 1972 году летом преобладали самцы, осенью соотношение сдвигалось в стронону самок. По данным Е. Н. Лупповой (Луппова, 2003) в губе Ярнышноу Баренцева моря в период с 1978 по 1982 гг. летом всегда преобладали самцы, к началу перерыва в размножении соотношение полов выравнивалось, а зимой большинство состаляли самки.
По данным О. Кинне (Kinne, 1959), который полагает, что наиболее вероятной причиной сезонной изменчивости соотношения полов является влияние температуры воды на формирование пола: при низких значениях температуры в выводке продуцируются преимущественно самцы, при высоких – самки. По сведениям Т. А. Бек (Бек, 1974) на примере популяции трех видов беломорских гаммарусов показала, что определяющее влияние на формирование пола оказывает не абсолютное значение температуры воды, а направление ее изменения: при понижающейся температуре формирутся преимущественно самцы, а при повышающейся самки. Наши результаты с данными сведениями не совпадают.
ЗАКЛЮЧЕНИЕ
Исследования амфипод, проведенные на местах исследования южного и среднего колена Кольского залива, показали, что в массовом количестве встречаются лишь четыре вида амфипод рода Gammarus:G. oceanicus, G. setosus, G. zaddachi, G. duibeni.
Доминирующие позиции среди рачков начинают проявляться в зоне пониженной солености (3 - 10‰), где два вида относятся к группе эвргиалинно-морских видов: G. oceanicusи G. setosus, которые способны выдерживать более значительные перепады солености, в отличии отG. duebeniи G. zaddachi, которыеотносятся к группе солоноватоводных рачков и предпочитают места с более низким уровнем солености. Широкие возможности амфипод, в частности G. duebeniи G. oceanicus, позволяют приспосабливаться к изменениям солености и температуры воды, где прекрасно демонстрируют свое распределение на всех районах исследования.
По распределению гаммарусов можно судить об опреснении воды. Так если преобладание рачков G. duebeni, то эти воды можно относить к водам, имеющим критическую соленость. И также, если преобладание амфипод G. oceanicus, то такие воды можно отнести к наиболее морским водам.
Наиболее плотные поселения рачков, встречаемых видов, приурочены к районам устьев р. Кола, р. Тулома, р. Белокаменка. В данных районах на протяжении всего периода уровень солености воды меняется не значительно, но если соленость становится высокой, особенно в летнее время года, то преобладают рачки вида G. oceanicus и их преобладание также замечено в районе мыса Притыка, где показатель солености выше, чем в других районах исследования.
В течение 2010 и 2012 гг. изменения распределения и преобладание того или иного вида наблюдаются также засчет влияния температуры. Несмотря на то, что все виды можно отнести к эвритермным видам, за исключением G. setosus, который холодолюбивый вид, их количество меняется с изменением температуры. Так в местах с сильным прогреванием воды (+18°С) преобладают особи G. oceanicus, зато в местах, где температура не достигаетвыше 7°С, частота встречаемости других видов увеличивается. Так в апреле месяце в районе устья р. Тулома, где температура составляет +4°С, встречаются все четыре вида.
Также температура влияет на размерный состав и на половую структуру гаммарусов. В результате того, что наиболее массовыми особями оказались два вида: G. oceanicusиG. duebeni, размерный ряд и половая структура была проанализирована только у них. Высокое преобладание самок над самцами наблюдается в холодное время года, а при увеличении температуры воды, наблюдается смена соотношения в сторону увеличения доли самцов. Что касается размеров, то можно выделить несколько групп: 1 – особи самых маленьких размеров (до 8 мм), 2 – особи, имеющие средние размеры (до16 мм), и 3 – самые крупные экземпляры (от 17 до 22 мм). Так у вида G. oceanicus преобладание крупных особей наблюдается лишь в холодное время года, когда самки прекращают нереститься. Средние размеры наблюдаются на протяжении всего времени, но особенно в весенний период, и особи маленьких размеров, преобладают в летнее время года, когда самки начинают размножаться. У другого вида G. duebeniпреобладание крупных особей значительно выражено в весенний промежуток времени, что может быть связано с увелечением размеров самок, которые готовятся к нересту. В холодоное время года у них преобладают особи средних размеров. В летний период наблюдается преобладание особей с маленькими размерами тела по той же причине, что и у G. oceanicus, самки начинают нереститься.
Таким образом по некоторым биологическим показателям (размер и соотношенте по полу) наблюдается сезонная изменчивость, обусловленная особенностями размножения.
ВЫВОДЫ
- На литорали Кольского залива обнаружено 4 вида бокоплавов, относящихся к роду Gammarus: G. duebeni, G. setsus, G. oceanicus, G. zaddachi. Доминирующими видами являются G. duebeniи G. oceanicus.
- Сезонная динамика биомассы поселений всех видов характеризуется их продуктивностью, которая связана с их численностью.
- У амфиподG. duebeniи G. oceanicus прослеживается сезонные изменения размерного ряда. Так у G. oceanicus на протяжение всего года, кроме апреля, размерный ряд подразделяется на три группы: 1 – особи с минимальными размерами (2,45 – 8,15 мм); 2 – особи со средними размерами (10,15 – 16,65 мм); - самые крупные (17,65-19,55 мм). Апрельский размерный ряд отличается тем, что не имеются особи с крупными размерами. У G. duebeni на протяжение всего года, размерный ряд составляет три группы. Апрель: 1 – 3,9–9,3 мм; 2 – 11,1-14,7 мм; 3 – 18,3–20,1 мм. Август: 1 – 2,6–9,8 мм; 2 – 11,6-15,2 мм; 3 – 17–18,8 мм. Ноябрь : 1 – 2,75-8,75 мм; 2 – 10,25-14,75 мм; 3 – 16,25-17,75 мм.
- Соотношение полов в популяциях обоих видов всегда отличается и характеризутеся сезонными изменениями. В поселении G. oceanicus в теплое время года всегда больше самцов чем самок; в поселение G. duebeni только весной преобладают самцы. С похолоданием у обоих видов самцов становится меньше, чем самок.
- В южном колене и в среднем колене Кольского залива, не зависимо от года исследования и места отбора проб, наблюдается одинаковая картина распределения гаммарусов.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
- Атлас океанов. Северный ледовитый океан. – Л.: изд-во Министерства обороны СССР, 1980. - 184 с.
- Базикалова, А.Я. О росте некоторых амфипод из Байкала и Ангары / А.Я. Базикалова. - Тр. Байкальский лимнол. Ст. 1951. Т. 13. С. 206 – 216.
- Бек, Т.А. Материалы к изучению популяционной структуры массовых видов литоральных гаммарусов (Amphipoda, Gammaridea) / Т.А. Бек. - Тр. Беломорский биол. ст. МГУ, 1974. – Т. 4. С. 110 – 122.
- Бек, Т.А. Размножение бокоплавов родов Gammarusи Marinogammarus на литорали Белого моря /Т.А. Бек. - Тр. Беломорской биол. ст. МГУ, 1980. – Т. 5. С. 103 – 114.
- Березин, О.Н. Гидролого-гидрохимический и ледовый режим. Гидрохимический режим. / О.Н. Березин; Кольский залив: океанография, биология, экосистема, поллютанты. – Апатиты: Изд. КНЦ РАН. 1997. С. 74 – 81.
- Биоразнообразие: результаты и перспективы исследований: мат-лыВсерос. заоч. науч. конф. 11 ноября 2009г. / отв. ред. А.М. Пучнин. - Тамбов: изд. Дом ТГУ им Г.Р. Державина. – 2009. – 260с.
- Брязгин, В.Ф. Фауна Lisianassidae (Amphipods, Gammaridea) Баренцева моря / В.Ф. Брязгин; Материалы рыбохозяйственных исследований Северного баччейна. - Мурманск.: Изд-во ПИНРО, 1972. – Вып. 21. С. 83–87.
- Брязгин, В.Ф. Животные и растения Баренцева моря / В.Ф. Брязгин, Н.В. Денисенко, С.Г. Калюжный, Э.Е. Рыжов. – Апатиты: Изд-во КФ АН СССР. 1981. – 188с.
- Винберг, Г.Г. Линейные размеры и масса тела животных / Журн. общей биологии. 1971. Т. 32. Вып. 6. С. 714 – 722.
- Виноградов, А.К. Хорогалинная зона 22-26‰ в морских экосистемах /А.К. Виноградов. - М.: Изд-во АН СССР, ВГБО, 1986. – С. 64 – 65.
- Гагарина, С.А. Физико-географическая характеристика залива. Речной сток и пресноводный баланс / С.А. Гагарина, С.Л. Дженюк; Кольский залив: океанография, биология, экосистемы, подлютанты. – Апатиты: Изд. КНД РАН. 1997. С. 46 – 51.
- Гудимов, А.В. Литоральные донные сообщества эстуарий р. Тулома и кута залива /А.В. Гудимов, А.А. Фролов; Кольский залив: океанография, биология, экосистемы. – Апатиты: Апатиты. 1997. – С. 123–130.
- Гурьянова, Е.Ф. К вопросу о происхождении и истории развития фауны Полярного бассейна / Е.Ф. Гурьянова. - М.: Изд-во АН СССР, 1939. - №6. – С. 679 – 704.
- Гурьянова, Е.Ф. Бокоплавы морей СССР и сопредельных вод (Amphipods, Gammaridea) /Е.Ф. Гурьянова. - М.; Л.: Изд-во АН СССР, 1951. – 1029 с.
- Гурьянова Е.Ф., Закс И.Г., Ушаков П.В. Литораль Кольского залива / Е.Ф. Гурьянова, И.Г. Закс, П.В. Ушаков; Работы Мурманской биол. ст. Ленинградского общ-ва естествоиспытателей. – Л.: 1925. Т. 1. С. 91 – 109.
- Гурьянова Е.Ф., Закс И.Г., Ушаков П.В. Литораль Кольского залива / Е.Ф. Гурьянова, И.Г. Закс, П.В. Ушаков; Часть 1. Описание основных площадок литорали // Тр. Ленинградского общ-ва естествоиспытателей. 1928. Т. 58. Вып. 2. С. 89 – 114.
- Гурьянова Е.Ф., Закс И.Г., Ушаков П.В. Литораль Кольского залива / Е.Ф. Гурьянова, И.Г. Закс, П.В. Ушаков; Часть III. Условия существования на литорали. - Тр. Ленинградского общ-ва естествоиспытателей. 1930. Т. 60. Вып. 2. С.17 – 101.
- Дементьева, К.М. Фауна Кольского залива и условия ее существования / К.М. Дементьева. - Тр. Гос. океанографич. ин-та, 1931. – Т. 1. Вып. 2 – 3. С. 65 – 82.
- Дженюк, С.Л. Морфометрия / Кольский залив: океанография, биология, экосистемы. – Апатиты: Апатиты. – 1997. – С. 20.
- Дженюк, С.Л. Гидролого-гидрохимический и ледовый режим. Динамика вод. / С.Л. Дженюк, С.В. Коротков, С.П. Савельев; Кольский залив: океанография, биология, экосистемы, поллютанты. – Апатиты: Изд-во КНЦ РАН. 1997. С. 59 – 68.
- Дженюк, С.Л. Физико-географическая характеристика залива. Климат. / С.Л. Дженюк, Т.Н. Огурцова; Кольский залив: океанография, биология, экосистемы, поллютанты. – Апатиты: Изд-во КНЦ РАН. 1997. С. 36
- Дженюк, С.Л. Природная среда Кольского залива и ее естественные и антропогенные изменения. Океанологические характеристики и процессы / С.Л. Дженюк, Д.В. Моисеев, Л.И. Боровая, А.Н. Ипатов; Кольские залив: освоение и рациональное природопользование. – М.: Наука. 2009 . – С. 20 – 45.
- Жирков, И.А. Жизнь на дне. Биогеография и биоэкология бентоса / И.А. Жирков – М.: Т-во научных изданий КМК. – 2010. – 453 с.: ил.
- Зацепин, В.И. Учеб. руков. для большого практикума по гидробиологии, раздел “Донная фауна морей СССР” Вып.1, Ракообразные (Malacostraca) / В.И. Зацепин, Л.А. Риттих. - М.: Изд-во Моск. ун-та, 1979. - 217 с.
- Зенкевич, Л.А. Биология северных и южных морей / Л. А. Зенкевич; М.: Наука. 1977. – 180 с.
- Зенкевич, Л.А. Фауна и биологическая продуктивность моря / Л.А. Зенкевич; Моря СССР. - Т.П.М.: Советская наука. – 1947. - 588 с.
- ИвантерЭ.В. Введение в количественную биологию: Учеб.пособие; Э.В. Ивантер, А.В. Коросов. – ПетрГУ: Петрозаводск, 2003. - 304 с.
- Иллюстрированный атлас беспозвоночных Белого моря /под общ.ред. Н.Н. Марфенина. - М.: Т-во научных изданий КМК, 2006. – 312 с.
- Кольский залив: освоение и рациональное природопользование / отв. редактор Г.Г. Матишов; ММБИ. – М.: Наука. – 2009. – 381с.
- Кузнецов, В.В. Биология массовых и наиболее обычных видов ракообразных Баренцева и Белого морей / В.В. Кузнецов. - М. – Л.: Изд-во АН СССР, 1964. – С. 1 – 241.
- Лаппо, С.Д. Океанографический справочник арктических морей СССР; С.Д. Лаппо. - М.-Л.: Изд-во Главвсевморпути, 1940. – 182 с.
- Луппова, Е.Н. Особенности экологии двух массовых видов литоральных бокоплавов - Lagunogammarusoceanicus (Segerstrale, 1947) и Gammarusduebeniduebeni (Lilljeborg, 1851) в Баренцевом и Белом морях /Е.Н. Луппова; Автореферат. - Апатиты: Изд-во КНЦ РАН, 1992. – 18 с.
- Луппова, Е.Н. Особенности экологии литоральных бокоплавов Lagunogammarus oceanicus (Segerstrale, 1947) и Gammarus duebeni (Lilljeborg, 1851) в Баренцевом и Белом морях /Е.Н. Луппова// Фауна беспозвоночных Карского, Баренцева и Белого морей (информатика, экология, биогеография). - Апатиты.: Изд-во КНЦ РАН, 2003. – 385 с.
- Любина, О.С. Амфиподы (Amphipoda, Gammaridea) из различных географических районов /О.С. Любина, В.В. Саяпин. - Апатиты.: Изд-во КНЦ РАН, 2008. – 182 с.
- Маргулис, Р.Я. Биология размножения видов рода Gammarus в Великой Салме / Р.Я. Маргулис; Биология Белого моря. - М.: Изд-во Моск. ун-та, 1962. - Т.1С. 231 – 247.
- Матишов, Г.Г. Мировой океан и оледенение Земли / Г.Г. Матишов. - М., 1987. - 270 с.
- Матишов, Г.Г. Гадробиологические исследования в заливах и бухтах северных морей /Г.Г. Матишов. - Апатиты: Российская академия наук. – 1994. – 175 с.
- Петров, С.В. Комплексные океанологические исследования Баренцева и Белого морей/С.В. Петров. - Апатиты: Наука. – 1987. – С. 26-30.
- Проблемы морской палеоэкологии и биогеографии в эпоху глобальных изменений: Материалы VIII Всероссийской школы по морской биологии и IX международной конференции «Комплексные исследования природы архипелага Шпицберген» (Мурманск, 12-14 ноября 2009 г.). М.: ГЕОС, 2009. – С. 302 – 313.
- Семенов, В.Н. Класиификация морских бассейнов бореально-арктической зоны: экологический подход /В.Н. Семенов. - Апатиты: Наука, 1988. – 29 с.
- Соколова, М.Н. Условия существования и биоценотические связи массовых видов беспозвоночных эпифауны литорали Кандалакшского залива Белого моря/ М.Н. Соколова; Тр. Беломорск. биол. ст. МГУ, 1963. – Т. 2. С. 69 – 113.
- Фауна амфипод Баренцева и Карского морей / Е.М. Митина, О.С. Любина; Современный бентос Баренцева и Карского морей. - Апатиты: Изд-во КНЦ РАН. – 2000. - Гл. 3. - 146 с.
- Фауна беспозвоночных Карского, Баренцева и Белого морей (информатика, экология, биогеография) / Коллектив авторов. - Апатиты: Изд-во КНЦ РАН. – 2003. - 385 с.
- Хлебович, В.В. Критическая соленость биологических процессов /В.В. Хлебович. - Л.: Наука, 1974. – 234 с.
- Хлебович, В.В. К биологической типологии эстуариев Совесткого Союза / В.В. Хлебович; Гидробиологические исследования эстуариев. - Л.: Изд-во ЗИН АН СССР, 1986. – С. 5 – 16.
- Цветкова, Н.Л. Об экологии, распределении и теплоустойчивости литоральных гаммарид (Amphipoda, Gammaridea) Кандалакшского залива / Зоол. Журнал; Н.Л. Цветкова. - Л.: Наука, 1968. – Т. 47. Вып. 11. С. 1639 – 1647.
- Цветкова, Н.Л. Прибрежные гаммариды северных и дальневосточных морей СССР и сопредельных вод /Н.Л. Цветкова. - М.: Наука, 1975. – 257 с.
- Шкляревич, Г.А. Литоральные амфиподы Кандалакшского залива Белого моря /Г.А, Шкляревич, С.В. Разновская; Современные проблемы науки и образования, 2007. - №6. С. 168 –173.
- Щукин, И.С. Четырехязычный энциклопедический словарь терминов по физической географии / И.С. Щукин. - М.: Сов. энциклопедия, 1980. – 703 с.
- Экосистемы новосибирского мелководья и фауны моря Лаптевых и сопредельных вод арктического океана: Сб. науч. трудов ;под. Ред. А.Н. Голикова. - Л.: Наука, 1990. - 463 с.
- Bousfield, E.L. A Fresh-water Amphipod Crustaceans of glaciated North America/E.L. Bousfield// Canad. Field Natuarilist, 1958a. – V. 72. № 2. P. 55 – 113.
- Bousfield, E.L. Littoral marine arthropods and mollusks from western Nova Scotia, 1956 /E.L. Bousfield// Proc. of the Nova Scotian Inst. Sci., 1958b. – V. 24. P. 303 – 325.
- Bulnheim H.P. Comparative studies on the physiological ecology of five eurihaline Gammarus spicies /H.P. Bulnheim// Oecologia (Berl.), 1979. – V. 44. P. 80 – 86.
- Day J.H. The ecology of South African estuaries /J.H. Day// I. A review of estuarine conditions in general. – Trans. Roy. Soc. S. Africa, 1951. - № 33, P. 53 – 91.
- Fabricius J.C. Systema Entomologiae / J.C. Fabricius// Flensburgi et Lipsiae, 1775. – P. 1 – 832.
- Forsman B. Studies on Gammarus duebeni Lillj. with notes on some rockpool organisms in Sweden /B. Forsman// Zool. Bird. Uppsala, 1951. – V. 29. P. 215 – 237.
- Howes N. H. The ecology of a saline lagoon in South – east Essex. – J. Linn. Soc. /N.H. Howes// 1939. – V. 40. № 273. P. 383 – 446.
- Hynes H.B.N. the ecology of Gammarus duebeni Lilljeborg and its occurrence in fresh water in Britain /H.B.N. Hynes// J. Anim. Ecol., 1954. – V. 23. № 1. P. 38 – 84.
- Ketchum, B.H. The flushing of tidal estuaries / B.H. Ketchum// Sewage Ind. Wastes, 1951. - № 23. P. 198 – 209.
- Kinne O. Die Gammarus Arten der Kieler Bucht (G. locusta, G. oceanicus, G. salinus, G. zaddachi, G. duebeni) /O. Kinne// Zool. Jb. (System), 1954b. – Bd. 82. H. 5. S. 105 – 424.
- Kinne O. Growth, moulting frequency, heart beat, number of eggs and incubation time in Gammarus zaddachi exposed to different environments /O. Kinne// Crustaceana, 1961a. – V. 2. P. 26 – 36.
- Kinne O. Temperature: Animals – invertabrates. – In: Marine ecology, vol. 1, Environmental factors, p. 1, London, Ed. by O. Rinne, 1970. – P. 407 – 514.
- Leach W.E. Crustaceans /W.E. Leach// Biol. Bull., 1813 – 1814. – V. 129. № 4. P. 44 – 53.
- Leach W.E. A tabular View of the external characters of Four Classes of Animals, with Linne arranged under Insecta; with the distribution of the Genera composing Three of these classes into Orders, and descributions of several New Genera composing, and Species /W.E. Leach// Transact. Linne. Soc. London, 1815. – V. 11. P. 306 – 400.
- Lilljeborg W. Norges Crustaceer /W. Lilljeborg// In: Ofv. kongl. Vetenskape Akad. Forhandl. Stockholm, 1851. – Bd. 8. № 1. P. 19 – 25.
- Micherdzinski W. Kielze rodzaju Gammarus Fabricus (Amphipoda) w wodach Polski /W. Micherdzinski// Acta Zoologica, Cracov., 1959. – T. 4. № 10. P. 1 – 111.
- Odum, E. P. Fundamentals og Ecology /E.P. Odum// Philodelphia, London, Toronto, W.B. Saunders Company, 1971.
- Pritchard, D. W. Whan is an estuary: physical viewpoint. – In: Estuaries./G.H. Lauff, ed. Washington, D.C., Amer. Assoc. for the advance of sci., 1967. –publ. № 83, P. 3 – 5.
- Rathke H. Zur Fauna der Krym /H. Rathke// Mem. K. Akad. Wiss., Bd. 3, St. Petersb., 1836. – P. 82 – 84.
- Sars, G.O. An account of the Crustacea of Norway /G.O. Sars// Amphipoda. Cristiana a. Copenhagen, 1890 – 1895. – P. 1 – 711.
- Segerstrale, S.G. On the occurrence of the Amphipod, Gammarus duebeni Lillj. in Finland, with Notes on the Ecology of the Species /S.G. Segerstrale// Soc. Sci. Fennica, Comment. Biol., 1946. – Bd. 9. № 18. S. 1 – 22.
- Segerstrale, S.G. New observations on the distribution and morphology of the Amphipod, Gammarus zaddachi Sexton, with notes on related species /S.G. Segerstrale// J. Mar. Biol. Assoc. U. K., 1947. – V. 27. № 1. – P. 219 – 244.
- Segerstrale, S.G. On Collections of Gammarus (Amphipoda) from Arctic waters (Coast Petsamo Kanin, coast of Siberia) /S.G. Segerstrale// Soc. Sci. Fennica, Comment. Biol., 1948. – Bd. 10. № 6. P. 1 – 13.
- Segerstrale, S.G. The amphipods on the coast of Finland – some facts and problems /S.G. Segerstrale// Soc. Sci. Fennica, Comment. Biol., 1950. – Bd. 10 № 14. S. 1 – 28.
- Sexton, E.W. Some brackish-water Amphipoda from the Mouth of the Weser and the Elbe and arom the Baltic /E.W. Sexton// Proc. Soc. London, 1912. – V. 2. P. 656 – 665.
- Sexton, E.W. on a collection of Gammarus from the Knigsberg Museum /E.W. Sexton// Schr. Physkon. Ges. Z. Knigsberg I Pr., 1913. – Bd. 54. P. 90 – 94.
- Sexton, E.W. The relation of GammaruszaddachiSexton to some other species of Gammarusoccuring in fresh, estuarine and marine waters /E/W/ Sexton// J. Mar. Biol. Assoc. Cambridge, 1942. – Vol. 25. № 3. P. 575 – 606.
- Shoemaker, C.R. Amphipoda cillected at the Arctic Laboratory, office of Naval Research, Point Barrow, Alasca, by G.E. VacGinite /C.R. Shoemaker// Smithson. Miscell. Coll., 1955. – V. 128. № 1. P. 1 – 78.
- Spooner, G. M. The distribution of Gammarus species in Estuaries. Pt. 1. /G.M. Spooner// J. Mar. Biol. Assoc. U. K., 1947. – Vol. 27. №1. P. 1 – 52.
- Spooner, G.M. On Gammarus zaddachi oceanicus Segerstrale /G.M. Spooner// J. Mar. Biol. Assoc. U. K., 1951. – V. 30. P. 129 – 147.
- Steen, E. Ecological observations on some Gammarus and Marinogammarus species in the Scandinavian West coast /E. Steen// Oikos, 1951. – V. 3. № 2. P. 232 – 242.
Особенности распределения амфипод рода Gammarus литорали Кольского залива (среднее и южное колено)