СТРОЕНИЕ И ФУНКЦИИ БЕЛКОВ
Реферат
СТРОЕНИЕ И ФУНКЦИИ БЕЛКОВ
Белки - высокомолекулярные полимерные азотсодержащие органические вещества, состоящие из аминокислот, соединённых пептидными связями, и имеющие сложную структурную организацию.
Термин «белки» обусловлен способностью этих соединений выпадать в осадки белого цвета. Название «протеины» произошло от protos (греч.) – первый, важный и отражает центральную роль этого класса веществ в организме.
Содержание белков в организме человека выше, чем содержание липидов, углеводов. От общей массы тканей (сырой массы) оно составляет 18 – 20%. Преобладание в тканях белков по сравнению с другими веществами выявляется при расчёте содержания белков на сухую массу тканей – 40 – 45%. Содержание белков в различных тканях колеблется в определённом интервале. Наиболее высоко содержание белков в скелетных мышцах (18 – 23% от сырой массы или 80% от сухой массы ткани). Низким содержанием белков отличается жировая ткань (6% сырой массы или 4% сухой массы ткани).
В детском возрасте общее количество белков в организме, их состав иные, чем у взрослых людей. В организме плода общее содержание белков не превышает 10% . У новорожденных оно составляет 10 – 12% массы тела. В период новорожденности наблюдается усиление процессов распада белков для энергетических целей. В силу этого содержание белков временно снижается. В раннем детском возрасте преобладают незрелые растворимые структурные белки. С возрастом усиливается их дифференцировка в зрелые функциональные белки.
Биологические функции белков разнообразны. Они связаны с высокой специфичностью белков, способностью взаимодействовать с различными лигандами, рецепторами, структурами клеток.
- Пластическая (структурная) функция – белки входят в состав всех клеточных структур вместе с нуклеиновыми кислотами, липидами, углеводами.
- Энергетическая функция - 1г белков обеспечивает образование около 4 ккал энергии
- Регуляторные функции:
а) ферментативная функция – более 2 тысяч белков являются биологическими катализаторами, регулируя скорость химических реакций в организме
б) гормональная функция – некоторые гормоны, регулирующие биохимические и физиологические процессы в организме, относятся к белкам
в) белки гистоны в составе хроматина регулируют активность генов ДНК
г) внутриклеточный белок кальмодулин регулирует активность различных ферментов
- Защитная (иммунная) функция – некоторые белки (иммуноглобулины, интерферон, лизоцим) обладают способностью связывать вещества, чужеродные для организма.
- Специфические функции:
а) сократительная функция (белки мышц актин и миозин)
б) фоторецепторная функция (белок сетчатки родопсин)
в) свёртывание крови (фибриноген)
г) рецепторная функция – белки входят в состав клеточных рецепторов к биологически активным веществам.
Химический состав белков
Элементарный состав белков
Химический состав белков достаточно разнообразен. В них содержатся многие химические вещества. Однако обязательными химическими элементами являются углерод (51 – 55%), кислород (21 – 23%), азот (16% - наиболее постоянная величина), водород (6- 7%) и сера (0,5 – 2%)
Аминокислотный состав белков.
Аминокислоты по химической природе являются производными карбоновых кислот, в которых атом водорода в – положении замещён на аминогруппу.. В состав природных белков входят –аминокислоты, которые отличаются структурой радикала у -углеродного атома.
Н2N- СН - СООН
I
R
Номенклатура аминокислот. Аминокислоты имеют обычно тривиальные названия. В белках и пептидах обозначаются тремя первыми буквами их названия. Например, валин – вал, треонин – тре и т.д.
Классификация аминокислот. Аминокислоты классифицируют по структуре их углеводородного радикала и по полярности радикала аминокислот. Структура радикала и полярность аминокислот определяют характер образуемых ими связей в молекуле белка.
По структуре радикала выделяют 7 групп аминокислот
- аминокислоты, не имеющие радикала: глицин
- аминокислоты с углеводородным радикалом: аланин, валин, лейцин, изолейцин, фенилаланин, пролин.
- аминокислоты, содержащие в радикале карбоксильную группу: глютаминовая, аспарагиновая кислоты, глютамин, аспарагин
- аминокислоты, содержащие в радикале аминогруппу: лизин, аргинин
- аминокислоты, содержащие в радикале гидроксильную группу: серин, треонин, тирозин, гидроксипролин, гидрокислизин
- аминокислоты, содержащие в радикале тиогруппу: цистеин, цистин, метионин
- аминокислоты, содержащие гетероциклический радикал: гитидин, триптофан
По полярности радикала аминокислоты делятся на две группы
1. Неполярные (гидрофобные) аминокислоты: аланин, валин, лейцин, изолейцин, фенилаланин, триптофан, пролин, гидроксипролин, метионин
2. Полярные (гидрофильные) аминокислоты
а) электронейтральные (незаряженные) аминокислоты: серин, треонин, цистеин, аспарагин, глютамин
б) кислые (отрицательно заряженные): глютаминовая, апарагиновая
в) основные (положительно заряженные) аминокислоты: лизин, аргинин, гистидин
Виды связей аминокислот в белках.
Различают прочные, ковалентные связи: пептидные, дисульфидные и непрочные, нековалентные связи в молекуле белка: водородные, ионные, вандерваальсовые, гидрофобные.
Пептидные связи (- СО-NН -) являются основным видом связей в белках. Впервые они были изучены А.Я. Данилевским (1888 г.). Пептидные связи образованы путём взаимодействия - карбоксильной группы одной аминокислоты и - аминогруппы другой аминокислоты. Пептидная связь является сопряжённой связью, электронная плотность в ней смещена от азота к кислороду, в силу чего она занимает промежуточное положение между одинарной и двойной связью. Длина пептидной связи составляет 0,132 нм. Вращение атомов вокруг пептидной связи затруднено, атомы О и Н в ней находятся в транс-положении. Все атомы пептидной связи располагаются в одной плоскости. Атомы О и Н пептидной связи могут дополнительно образовывать водородные связи с другой пептидной связью. Пептидные связи определяют порядок чередования аминокислот в полипептидной цепи белка, т.е. формируют первичную структуру белка. Пептидные связи – прочные связи (энергия разрыва составляет около 95 ккал/моль). Расщепление пептидных связей осуществляется при кипячении белка в присутствии кислот, щелочей или под действием ферментов пептидаз.
Дисульфидные связи (-S- S-) образованы двумя молекулами цистеина в составе белковой молекулы. Возможны внутрицепочечные дисульфидные «мостики» в пределах одной полипептидной цепи и межцепочечные связи между отдельными полипептидными цепями. Например, в молекуле гормона инсулина присутствуют оба варианта дисульфидных связей. Дисульфидные связи определяют пространственную укладку белковой молекулы, т.е. третичную структуру белков. Дисульфидные связи разрываются при действии некоторых восстановителей и при денатурации белка.
Водородные связи возникают между атомом водорода и электроотрицательным атомом, чаще кислородом. Водородные связи примерно в 10 раз слабее пептидных связей. Наиболее часто они возникают между атомом Н и атомом О различных пептидных связей: либо близко расположенных в молекуле белка, либо находящихся в разных полипептидных цепях. Огромное количество водородных связей фиксирует в белках в основном вторичную структуру (-спираль и - складчатую структуру) но также участвуют в образовании третичной и четвертичной структур белка. Непрочные водородные связи легко разрываются при денатурации белка.
Ионные связи образуются между противоположно заряженными аминокислотами в составе белковой молекулы (положительно заряженными лизином, аргинином, гистидином и отрицательно заряженными глютаматом и аспартатом). Ионные связи определяют пространственную укладку белков, т.е. формируют третичную и четвертичную структуры белков. Ионные связи разрываются при денатурации.
Ван-дер-ваальсовые взаимодействия – разновидность связей, возникающих при кратковременной поляризации атомов.
Гидрофобные связи возникают между неполярными (гидрофобными) радикалами аминокислот в полярном растворителе (вода). Гидрофобные радикалы погружаются внутрь белковой молекулы, меняя пространственное расположение полипептидной цепи. Гидрофобные взаимодействия имеют энтропийную природу, придают устойчивость молекуле белка, формируют его третичную, а также четвертичную структуру.
Структурная организация белков
Принято выделять четыре уровня структурной организации белков, которые обозначаются как первичная, вторичная, третичная и четвертичная структуры белков.
Первичная структура - последовательность соединения аминокислот в полипептидной цепи. В белковой молекуле при чередовании жестких (пептидная связь) и гибких ( -углеродный атом) участков формируется компактная укладка цепи в пространстве.
Впервые первичная структура изучена в 1954 году Сенджером для гормона инсулина. Изучение первичной структуры представляет сложный процесс и включает два основных этапа: изучение аминокислотного состава и изучение последовательности соединения аминокислот в полипептидной цепи.
- Изучение аминокислотного состава белка осуществляется путём его гидролиза до аминокислот. Для разрыва прочных пептидных связей между аминокислотами используют кислотный, щелочной и ферментативный гидролиз белка. Кислотный гидролиз осуществляется кипячением раствора белка в течение 16-92 часов, при температуре 1100 с 6-нормальным раствором кислоты. Щелочной гидролиз производится кипячением раствора белка в течение 4 – 8 часов, при 1100 с 2-4 нормальным раствором NaOH. Ферментативный гидролиз происходит при участии ферментов протеиназ (пептидаз): трипсин, пепсин. В отличие от кислотного и ферментативного гидролиза ферментативный гидролиз (протеолиз) наиболее специфичен, при нём ферменты расщепляют только определённые связи в белках. Окончание процесса гидролиза оценивают по двум признакам: а) отсутствие положительной биуретовой реакции на пептидные связи и б) окончание прироста концентрации аминогрупп и карбоксильных групп в гидролизате. Динамику прироста аминогрупп и карбоксильных групп определяют методом формольного титрования, связывая формальдегидом аминогруппы аминокислот, освобождающихся при гидролизе белка. Образовавшиеся при гидролизе аминокислоты идентифицируют методом хроматографического анализа, основанном на разных физико-химических свойствах аминокислот.
- Исследование последовательности аминокислот в составе белка, в свою очередь, проводится различными методами. Белки с высокой молекулярной массой предварительно подвергаются частичному ферментативному гидролизу до коротких пептидов. Затем в полученных коротких пептидах определяются последовательно более доступные для исследования концевые аминокислоты, находящиеся или на N-конце, или на С-конце пептида.
С целью узнавания С - и N -концевых аминокислот применяются ферментативные методы. Ферменты аминопептидазы отщепляют от пептида N - концевую аминокислоту, которая определяется хроматографически Ферменты карбоксипептидазы, отщепляют от белка С - концевую аминокислоту.
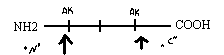
Кроме ферментативных используются химические методы распознавания концевых аминокислот
А) методы исследования N- концевых аминокислот заключаются в присоединении к N -концевой аминокислоте какой - то «химической метки» связью, более прочной, чем пептидная связь. При последующем
гидролизе N- концевая аминокислота оказывается связанной с каким-либо химическим веществом. - меткой. С этой целью используют реактив Сенджера - динитрофторбензол С6Н5(NO2)2F. Этот метод неудобен, так как он предполагает одноразовое использование. В связи с этим чаще используют реактив Эдмана - фенилизотиоцианатнат С6Н5-N(S)=C. Одновременно с присоединением фенилизотиоцианата к N –концевой аминокислоте происходит образование циклического продукта и ослабление связи N-концевой аминокислоты с полипептидной цепью. С помощью последующего мягкого гидролиза осуществляется отщепление меченой N-концевой аминокислоты с сохранением остальной части белковой молекулы. Вторая аминокислота с N-конца в результате становится концевой и распознается повторным применением реактива.
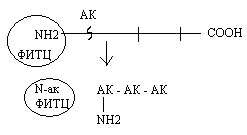
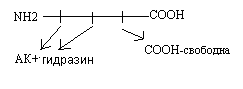
Б) Методы распознавания С - концевой аминокислоты.
Метод Акобори заключается в использовании фенилгидразина. Фенилгидразин разрывает пептидные связи в белке и присоединяется ко всем аминокислотам, кроме C-концевой. Последующий хроматографический анализ позволяет распознать С - концевую аминокислоту в составе белка.
Исследование первичной структуры имеет важное общебиологическое и медицинское значение:
- первичная структура является определяющей для последующих структур белка.
- знание первичной структуры белка необходимо для искусственного синтеза белков.
- первичная структура определяет видовую специфичность, например, в белке инсулине, обычно в середине молекулы у различных видов животных и человека происходит замена, как правило, 3-х равноценных аминокислот.
- изменения в первичной структуре могут приводить ко многим болезням, например, к серповидно клеточной анемии, при которой в гемоглобине в - цепи в 6 положении глютаминовая кислот заменяется на валин. Эта замена на неравноценную аминокислоту приводит к нарушению функции гемоглобина и появлению серповидной формы эритроцитов.
Вторичная структура - регулярно повторяющаяся форма укладки полипептидной цепи в пространстве. Чаще всего в белках встречается 2 вида вторичной структуры: - спираль и - структура.
- спираль в 1951 году изучена Л. Полингом с помощью рентгеноструктурного метода. Она представляет собой правозакрученную спиральную структуру, в одном витке которой укладывается 3,6 аминокислоты. Шаг спирали (расстояние между соседними витками) составляет 0,54 н.м. - спираль фиксируется водородными связями, которые замыкаются между пептидными связями, образованными каждой 4-ой аминокислотой. Вторичная - структура укладывается самопроизвольно и определяется первичной структурой белка. Доля участков, уложенных в спиральную структуру, в различных белках различна. Например, в гемоглобине, миоглобине преобладает - структурная укладка, которая в 4 раза уменьшает размеры белковой молекулы.
–структура имеет вид «гармошки» и стабилизируется водородными связями между удалёнными участками одной полипептидной цепи или между несколькими белковыми молекулами. Выделяют параллельные – структуры, в которых N и С-концы соответствуют друг другу, и антипараллельные структуры. Примером белков, преимущественно содержащих – структуры, являются иммуноглобулины.
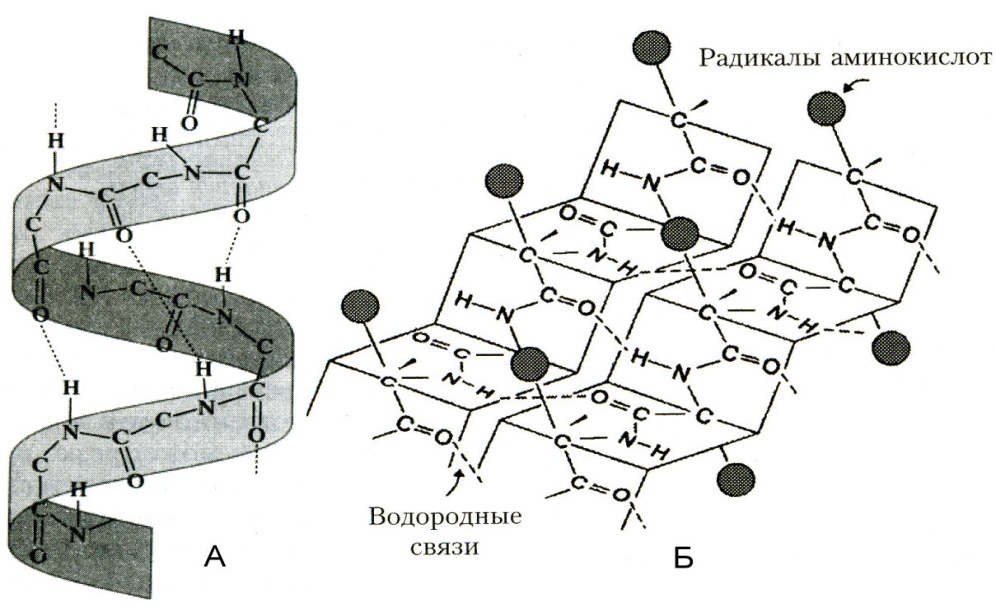
Вторичную структуру изучают методами рентгеноструктурного анализа, исследованием поглощения белком ультрафиолетовых лучей (чем больше доля – структур, тем больше поглощение).
Вторичная структура разрушается при денатурации.
Третичная структура - специфическая для каждого белка форма укладки полипептидной цепи в пространстве. Данная структура формируется самопроизвольно и определяется первичной структурой. Третичная структура значительно, в десятки увеличивает компактность белка. В формировании третичной структуры участвуют нековалентные связи (гидрофобные, ионные) и ковалентные ( дисульфидные) связи.
Третичная структура определяет биологическую активность и физико-химические свойства белков. При нарушении третичной структуры белок утрачивает свою биологическую активность.
Методами изучения третичной структуры являются рентгеноструктурный анализ и определение химической активности отдельных радикалов аминокислот в белке. Третичная структура белка миоглобина впервые была изучена Дж. Кендрью (1957 г.). М. Перутцем (1959 г.) была изучена структура гемоглобина.
В третичную структуру белков входят - спиральные, - складчатые структуры, - петли (в них полипептидная цепь изгибается на 1800) и, так называемый, неупорядоченный клубок. Например, в белке инсулине содержится 57% - спиральных участков, 6% - складчатых структур, 10% молекулы уложены в виде - петлей и 27% молекулы представляют неупорядоченный клубок.
Совокупность первичной, вторичной, третичной составляет конформацию белковой молекулы. Прижизненная (нативная) конформация формируется самопроизвольно и её образование носит название фолдинг. Конформация белков очень неустойчива и формируется при участии особых белков – шаперонов (компаньонов). Шапероны способны связываться с частично денатурированными, находящимися в неустойчивом состоянии белками, и восстанавливать их нативную конформацию. Шапероны классифицируют по молекулярной массе (60 – 100 кд.). Наиболее изучены Ш-60, Ш-70 и Ш-90. Например, Ш-70 взаимодействуют с белками, богатыми гидрофобными радикалами, защищают их от высокотемпературной денатурации. В целом шапероны экранируют основные белки организма, препятствуют денатурации и способствуют формировании конформации, облегчают транспорт денатурированных белков в лизосомы, участвуют в процессе синтеза белков.
По конформации все белки делятся на три группы:
- фибриллярные белки: коллаген, эластин, фиброин.
- Глобулярные белки: гемоглобин, альбумин, глобулин.
- Смешанные белки: миозин.
Третичная структура присуща всем белкам. Четвертичную структуру имеют только олигомерные белки, в составе которых имеется несколько субъединиц, протомеров. Протомером считается отдельная полипептидная цепь, субъединицей – функционально активная часть олигомерного белка. Субъединица может содержать или один протомер, или несколько.
Четвертичная структура - количество и взаимное расположение субъединиц в олигомерных белках. Четвертичную структуру имеют только олигомерные белки, в составе которых имеется несколько субъединиц, протомеров. Протомером считается отдельная полипептидная цепь, субъединицей – функционально активная часть олигомерного белка. Субъединица может содержать один протомер или несколько протомеров.
В формировании четвертичной структуры участвуют непрочные нековалентные связи (гидрофобные, ионные, водородные). Четвертичная структура белков формируются самопроизвольно и легко разрываются при денатурации. Отдельные субъединицы в олигомером белке взаимодействуют друг с другом, что приводит к изменению третичной структуры отдельных протомеров.. Это явление называется кооперативными изменениями конформации протомеров и сопровождается, как правило, повышением активности белка.
Олигомерные белки имеют ряд особенностей в сравнении с мономерными белками.
- Имеют очень компактную укладку и относительно небольшая поверхность раздела, поэтому, располагаясь внутриклеточно, они связывают меньше воды
- Активность их регулируется в организме. Протомеры, как правило, неактивны, а олигомерные белки значительно активнее.
- Если в синтезе олигомерного белка участвуют однотипные протомеры, это экономит генетический материал (на коротком участке ДНК «штампуется» несколько одинаковых протомеров)
- Они функционально более приспособлены для условий организма.
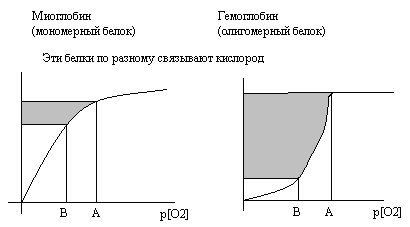
Функциональность олигомерных белков иллюстрируется при сравнении белков гемоглобина и миоглобина, участвующих в переносе кислорода в ткани. Гемоглобин эритроцитов - олигомерный белок, включает 4 полипептидные цепи. Миоглобин мышц – мономерный белок, включает 1 полипептидную цепь. Кривая насыщения кислородом у миоглобина свидетельствует о прямой зависимости её от концентрации кислорода. Для гемоглобина кривая насыщения кислородом носит S-образный характер. Это связано с постепенным последовательным изменением структуры (конформации) каждого из 4-х протомеров в составе гемоглобина, в результате которого резко возрастает сродство гемоглобина к кислороду. Такой характер насыщения гемоглобина кислородом резко повышает его кислородную ёмкость по сравнению с миоглобином.
Особое положение среди белков занимают доменные белки.
Домены – структурно и функционально обособленные участки одной полипептидной цепи. Домены могут отвечать за взаимодействие белка с различными веществами - лигандами (низкомолекулярные вещества, ДНК, РНК, полисахариды и др.) Примерами доменных белков служат альбумин сыворотки крови, иммуноглобулины, некоторые ферменты (трипсин поджелудочной железы).
В силу высокой избирательности белков они могут объединяться в комплексы, которые чаще всего называются полиферментные комплексы – это структурные объединения нескольких ферментов, катализирующих отдельные стадии сложного химического процесса. Пример: пируватдегидрогеназный комплекс (ПДК) комплекс трех видов ферментов, катализирующий окисление пировиноградной кислоты (ПВК).
Возможно специфическое соединение не только отдельных белков, но и белков с липидами (жирами) при образовании клеточных мембран, белков с нуклеиновыми кислотами при формировании хроматина.
Физико-химические свойства белков.
Физико- химические свойства белков во многом определяются конформацией белковой молекулы (первичная – третичная структура белка). Физико- химические свойства белков проявляются в растворах.
Растворимость белков у различных белков различна.
В целом растворимость белков высока, но различна для разных видов белков. На неё влияют следующие факторы:
- форма белковой молекулы (глобулярные белки растворимы лучше, чем фибриллярные белки)
- характер радикала аминокислоты белка, соотношение полярных неполярных радикалов (чем больше в составе белка полярных гидрофильных радикалов, тем лучше его растворимость)
- свойства растворителя, присутствие солей. Невысокая концентрация солей (KCL, NaCl) иногда повышает растворимость белков. Например, альбумины лучше растворимы в чистой дистиллированной воде, глобулины растворяются только в присутствии 10% солей (KCL, NaCl). Белки соединительной ткани коллаген и эластин не растворимы ни в воде, ни в солевых растворах.
Молекулярная масса белков достаточно велика, находится в пределах от 6000 д. до 1000000 д. Например, молекулярная масса гемоглобина – 68000 д., альбумина - 100 000 д., рибонуклеазы – около 14 000 д., миозина – 500 000 д.
Методы определения молярной массы белков должны быть щадящими, не разрушать белковых молекул. Например, к белкам не применим эбулиоскопический метод, основанный на измерении температуры кипения растворов. Наиболее точными методами определения молекулярной массы белков являются метод ультрацентрифугирования и рентгеноструктурный метод.
Метод ультрацентрифугирования (седиментации) основан на изменении скорости осаждения белков различной молекулярной массы при вращении белковых растворов с большой скоростью. Молекулярная масса белков, найденная этим методом, обозначается единицей Сведберга (S=10-13c.)
Рентгеноструктурный метод позволяет рассчитать молекулярную массу путём анализа многочисленных рентгеновских снимков молекулы белка.
Электрофоретический метод основан на зависимости скорости передвижения белков в постоянном электрическом поле от молекулярной массы белка (электрофоретическая подвижность выше у белков с меньшей молекулярной массой)
Хроматографический метод основан на различной скорости прохождения различных белков через молекулярные гелевые «сита».

Крупные молекулы, превышающие размеры пор геля, проходят через гель быстрее, чем более мелкие молекулы белка, которые задерживаются внутри зёрен геля.
Электронномикроскопический метод проводится путём сравнения размеров белковой молекулы с эталонными образцами известной массы.
Химические методы связаны с особенностями химического состава белков
Форма белковых молекул различна. Белковые молекулы по форме могут быть фибриллярными и глобулярными. Фибриллярные белки имеют нитевидную форму молекулы. Они, как правило, не растворимы в воде и в разбавленных солевых растворах. К фибриллярным белкам относятся основные структурные белки соединительной ткани: коллаген, кератин, эластин. У глобулярных белков полипептидные цепи плотно свёрнуты в компактные сферические структуры. Большинство глобулярных белков хорошо растворяются в воде и слабых солевых растворах. К глобулярным белкам относятся ферменты, антитела, альбумины, гемоглобин. Некоторые белки имеют промежуточный вид молекулы, содержат в своём составе и нитевидные, и шаровидные участки. Примером таких белков служит белок мышц миозин, растворимый в солевых растворах.
Размеры белковых молекул находятся в интервале от 1 до 100 нм, близком к размерам коллоидных частиц. В силу этого белковые растворы обладают свойствами, как истинных растворов, так и коллоидных растворов.
Многие молекулярно- кинетические свойства белковых растворов сходны со свойствами коллоидных растворов.
- Медленная скорость диффузии белков, необходимой для их обмена.
-
Невозможность прохождения белков через полупроницаемые мембраны. В отсеках с высокой концентрацией белка создаётся избыточное гидростатическое давление, обусловленное односторонним перемещением молекул воды через полупроницаемую мембрану в сторону высокой концентрации белка. Избыточное давление, создаваемое белками, называется онкотическим давлением. Оно является важным фактором, определяющим передвижение воды между тканями, кровью, кишечником.
- Высокая вязкость белков обусловлена различными межмолекулярными взаимодействиями крупных белковых молекул. Повышенная вязкость крови, в частности, повышает нагрузку на сердечную мышцу.
- . Некоторые белки способны образовывать гели, что увеличивает прочность белков (например, коллаген).
Оптические свойства белков определяются размерами белковых молекул, структурой радикалов аминокислот в белках, наличием пептидных связей и альфа-спиральных участков в белках.
- Белковые растворы обладают эффектом светопреломления (рефракции) и светорассеивания. Эти свойства обусловлены большими размерами белковых молекул, соизмеримыми с длиной волны видимой части спектра.. При этом короткие синие лучи рассеиваются в большей степени, чем более длинноволновые красные лучи. Степень рефракции пропорциональна концентрации белкового раствора.
- Белковые растворы поглощают ультрафиолетовые лучи в диапазоне 190-230 нм за счёт присутствия пептидных связей и в диапазоне 260-280 нм за счёт присутствия в белках циклических аминокислот. Степень поглощения УФЛ пропорциональна концентрации белка в растворе.
- Белковые растворы способны вращать плоскость поляризованного света, что обусловлено оптической активностью содержащихся в белке аминокислот и наличием в нём альфа-спиральных участков. Существует прямая зависимость между поляризаций света и концентрацией белков в растворе.
Белки, являясь молекулярными растворами, обладают свойствами истинных растворов. Будучи истинными растворами, белковые растворы отличаются высокой устойчивостью.
Факторы устойчивости белковых растворов
Устойчивость белковым растворам придают два фактора: заряд белковой молекулы и гидратная оболочка.
Заряд белковой молекулы.
Появление заряда на молекулах белков связано с его амфотерными свойствами (наличием кислотных и основных свойств). Группы, способные приобретать заряды, называются ионогенными. К ним относятся – СООН группы глютамата, аспартата, –NH2 группы лизина, аргинина, азот имидазольного кольца гистидина. В очень незначительной степени ионизируются –SH группы цистеина и –OH группы тирозина. Ионизация различных функциональных групп белка групп определяется рН среды.
Ионизация кислотных групп (СООН - группы – доноры Н+).
При рН = 2-4 половина карбоксильных групп в белках находится в ионизированном состоянии (–СОО-), половина – в неионизированном виде(– СООН). В силу этого при рН 2-4 карбоксильные группы придают белкам буферные свойства. При физиологических значениях рН в интервале 7,35 – 7,45 (более щелочная среда) преобладает ионизированная форма карбоксильных групп, придающая белковым молекулам отрицательный заряд.
Н2N- белок - СООН - Н+ Н2N- белок - СОО-
Ионизация щелочных групп (NH2 -группы - акцепторы Н+)
При рН около 10 половина аминогрупп белков ионизирована, а половина не ионизирована. При рН = 10 NH2 – группы придают белкам буферные свойства. Физиологическое значение рН близкое к 7, является более кислой средой, поэтому, при физиологических величинах рН преобладает ионизированная форма аминогрупп (NH3+), придающая белковым молекулам положительный заряд.
Н2N - белок - СООН + Н+ + Н3N - белок - СООН
Кислотно-основные свойства изучают особым методам потенциометрического титрования Изменение ионизации белка при разных значениях рН имеет вид графика, приведенного ниже.
Из всех аминокислот только гистидин обладает буферными свойствами при рН = 6-7. Входя в состав белка гемоглобина, гистидин определяет его буферные свойства, необходимые для связывания кислорода.
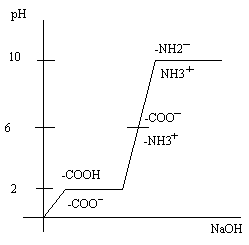
Изменениями величины рН среды белок можно перевести в особое изоэлектрическое-электронейстральное состояние, в котором сумма положительных зарядов равна сумме отрицательных зарядов и молекула в целом электронейтральна ( + Н3N- белок - СОО-). Значение рН, при котором молекула белка электронейтральна, называется изоэлектрической точкой (ИЭТ). Для большинства белков изоэлектрическая точка находится в кислой среде (рН = 5-5,5). В то же время для гистонов ИЭТ находится в щелочной среде (рН= 9-11). В изоэлектрическом состоянии белки менее устойчивы, чем при наличии зарядов, поскольку заряд белковой молекулы является фактором электростатического отталкивания белковых молекул, определяют ионные связи в белках и формируют наиболее устойчивую конформацию белковой молекулы.
Таким образом, заряд белковой молекулы является мощным стабилизирующим фактором, препятствующий осаждению белков из растворов.
Формирование гидратной (водной) оболочки
Белки обычно имеют такую пространственную укладку, при которой гидрофобные группы «прячутся» в глубине белковой молекулы, а гидрофильные находятся на поверхности молекулы. К гидрофильным группам относятся – СООН, –NH2, –SH, –ОН, пептидная связь, карбонильная группа. К гидрофильным группам притягиваются диполи Н2О, в результате чего вокруг белковой молекулы формируется защитная водная «шуба», которая препятствует склеиванию белковых молекул и осаждению их из растворов. Вода, входящая в состав гидратных оболочек, называется связанной водой. Она отличается по физическим свойствам и определяет биологическую активность биополимеров.
Таким образом, гидратная оболочка белковых молекул является вторым мощным стабилизирующим фактором белковых растворов.
Если каким-то воздействием убрать один или оба стабилизирующие факторы, то белки выпадают в осадок (происходит осаждение белков).
Виды осадочных реакций белков из растворов
- Изоэлектрическое осаждение (при приближении рН раствора к изоэлектрической точке, белок теряет заряд и осаждается из раствора). Пример: сворачивание молока при его скисании. Этот процесс осаждения в начальных стадиях носит обратимый характер и может быть использован для разделения белков.
- Дегидратация – снятие водной оболочки белковой молекулы при добавлении дегидратирующих средств (спирт, ацетон). Этот процесс также обратим, и используется для разделения белков.
- Высаливание – осаждение белков из растворов при добавлении к ним электронейтральных или слабокислых солей, таких как NaCl, KCl, (NH4)2SO4.. Механизм высаливания заключается в обратимом снятии с белковой молекулы двух стабилизирующих факторов. Высаливающие вещества содержат в своем составе гидрофильные катионы и анионы, которые «снимают» водную оболочку с белка. При добавлении (NH4)2SO4 в растворе возникает слабокислая реакция и рН приближается к изоэлектрической точке, что уменьшает заряд молекулы белка. Высаливание не нарушает структуры белка и является полностью обратимым процессом, вследствие чего используется для разделения белков.
- Денатурация – нарушение физико-химических свойств белка, его биологической активности при воздействии факторов, разрушающих вторичную, третичную, четвертичную структуры белка.
При денатурации белковая молекула теряет свою прижизненную (нативную) структуру и переходит в форму неупорядоченного клубка, на поверхности которого располагается много гидрофобных групп, что резко снижает растворимость белка.
Признаками денатурации являются:
- выпадение осадка
- изменение оптических свойств
- изменение активности его химических групп и конформации белковой молекулы
- снижение биологической активности
- более быстрое расщепление ферментами пептидазами
К денатурирующим факторам относятся химические факторы (минеральные и органические кислоты, соли тяжелых металлов, алкалоиды, высокая концентрация мочевины); физические факторы (высокая температура, рентгеновское излучение, УФЛ).
На начальных стадиях денатурация носит обратимый характер и возможна ренатурация – восстановление структуры белка. При продолжительном действии денатурирующих факторов она приобретает необратимый характер. Денатурацию белков применяют для обнаружения белков в растворах и биологических жидкостях, для удаления белков из биологических жидкостей при проведении биохимических исследований.
Методы количественного определения белков, используемые
в лабораторной практике
Для определения концентрации белков в биологических жидкостях и растворах используются оптические, колориметрические и азотометрические методы.
Оптические методы основаны на оптических свойствах белков. К ним относятся:
- спектрофотометрические методы, оценивающие интенсивность поглощения белками УФ лучей в диапазоне около 200 нм и 260 нм. Степень УФЛ - поглощения пропорциональна концентрации белка;
- рефрактометрические методы основаны на способности растворов белков преломлять свет пропорционально их концентрации;
- нефелометрические методы основаны на способности растворов белков рассеивать свет пропорционально их концентрации;
- поляриметрические методы основаны на способности растворов белков вращать плоскость поляризованного света пропорционально их концентрации.
Колориметрические методы основаны на цветных реакциях белков – биуретовая реакция, метод Лоури, метод сорбции белками определённых красителей. Интенсивность окраски определяется концентрацией белкового раствора.
Азотометрические методы основаны на определении содержания азота и пересчёте его на концентрацию белка (в белках 16% азота).
Выделение, фракционирование и очистка белков