Аскорбиновая кислота. Синтез (методика).Способы качественного и количественного анализа в фармакопеях разных стран с приведением методик. Разработка нового метода количественного определения аскорбиновой кислоты
ГБОУ ВПО УГМУ
Министерства здравоохранения Российской Федерации
Кафедра фармации
Курсовая работа
По дисциплине: Фармацевтическая химия
Тема: “ Аскорбиновая кислота. Синтез (методика).Способы качественного и количественного анализа в фармакопеях разных стран с приведением методик. Разработка нового метода количественного определения аскорбиновой кислоты”
Студентки: 5 курса заочного отделения
Зюзевой Ю.Л. гр. ЗФ-501
Преподаватель:
Екатеринбург 2015
СОДЕРЖАНИЕ
|
Введение
|
3
|
|
1. Теоретическая часть
|
4
|
|
1. 1 Характеристика аскорбиновой кислоты как химического соединения
|
4
|
|
1.2 Методы синтеза аскорбиновой кислоты
|
5
|
|
1.3 Качественные реакции на аскорбиновую кислоту
|
8
|
|
1.3.1 Инструментальные методы анализа
|
8
|
|
1.3.2 Химические методы анализа
|
9
|
|
1.4. Определение количественного содержания аскорбиновой кислоты
|
11
|
|
1.4.1 Йодатометрия
|
11
|
|
1.4.2 Йодометрия
|
12
|
|
1.4.3 Алкалиметрия
|
12
|
|
1.4.4 Инструментальные методы
|
13
|
|
2. Практическая часть
|
18
|
|
2.1 Характеристика объекта исследования
|
18
|
|
2.2 Методика выполнения анализа
|
18
|
|
2.3 Результаты анализа
|
19
|
|
2.4 Статистическая обработка результатов эксперимента
|
19
|
|
Заключение
|
23
|
|
Список использованной литературы
|
24
|
ВВЕДЕНИЕ
Аскорбиновая кислота (витамин С) принимает активное участие в окислительно-восстановительных процессах в организме и входит в состав ряда сложных ферментов, обуславливающих процессы клеточного дыхания. Витамин С участвует в процессах углеводного и белкового обмена; повышает сопротивляемость организма к инфекционным заболеваниям; регулирует холестериновый обмен; участвует в нормальном функционировании желудка, кишечника, поджелудочной железы; совместно с витамином Р обеспечивает нормальную эластичность стенок кровеносных капилляров; стимулирует образование протромбина; обезвреживает действие ряда лекарственных веществ (мышьяковая группа) и промышленных ядов (свинец).
Витамин С в организме не синтезируется и не откладывается в запас, что обусловило широкое использование его препаратов для стимуляции и регуляции физиологических процессов, профилактики и лечения ряда заболеваний при гипо- и авитаминозах, повышения общей устойчивости организма к экзогенным и эндогенным неблагоприятным факторам. Поэтому изучение методов анализа аскорбиновой кислоты является актуальным.
Цель выполнения курсовой работы – ознакомиться с аскорбиновой кислотой как фармацевтической субстанцией. В соответствии с поставленной целью необходимо решение следующих задач:
1. Изучить способы получения аскорбиновой кислоты.
2. Изучить методики качественного и количественного определения аскорбиновой кислоты.
3. Разработать методику количественного определения аскорбиновой кислоты в лекарственных формах.
Работа представлена на 24 страницах, содержит введение, заключение и основную часть, состоящую из 2 глав. Работа включает 2 таблицы, 7 рисунков, 14 литературных источников.
-
Теоретическая часть
- Характеристика аскорбиновой кислоты как химического соединения
Кислота аскорбиновая (витамин С) (5R)-5-[(1S)-1,2-Дигидроксиэтил]-2,3-дигидроксифуран-2(5Н)-он [3]:
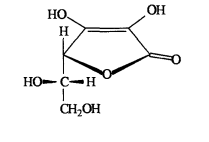
С6Н8О6 М. в. 176,13
Описание. Белый кристаллический порошок без запаха, кислого вкуса. Кристаллизуется из пересыщенных водных растворов в виде кристаллов моноклинической системы с температурой плавления 192оС (с разложением).
Аскорбиновая кислота оптически деятельна; ее удельное вращение в водном растворе []D20= +23, а в метаноле []D20= +48 (при концентрации 0,85%). Удельное вращение зависит от вида растворителя и концентрации вещества в растворе [7].
Аскорбиновая кислота в водном растворе имеет типичный спектр поглощения в УФ-области с максимумом при 265 нм. Окислительно-восстановительный потенциал аскорбиновой кислоты Е01 равен при рН 4,0 и температуре 35оС +0,166 В. Децинормальный раствор аскорбиновой кислоты в воде имеет рН 2,2.
Растворимость. Легко растворим в воде, растворим в спирте, практи�чески нерастворим в эфире, бензоле и хлороформе. Растворимость ее в спиртах зависит от числа атомов углерода в их молекуле. В метиловом спирте растворяется хорошо; в этиловом – труднее, а в амиловом спирте – трудно.
Качество аскорбиновой кислоты как фармакопейного препарата регламентируется ФС 42-0218-07 [3].
1.2 Методы синтеза аскорбиновой кислоты
Кислоту аскорбиновую можно выделить из растительного сырья, в частности из плодов шиповника. Вначале получают водные экстракты, сгущают их до сиропов в вакууме, осаждают сопутствующие вещества (спиртом или эфиром), а остаток очищают хроматографическими методами и перекристаллизовывают [1, 2, 6].
Синтез аскорбиновой кислоты принципиально может быть осуществлен следующими методами [7]:
- изомеризацией и лактонизацией 2-кетогексоновых кислот;
- из пентоз через озазон и нитрил (озонцианидный метод);
- конденсацией бензоинового типа двух альдегидов с низкой молекулярной массой под каталитическим влиянием KCN с образованием кетоспирта;
- конденсацией эфиров -оксикислот.
Анализируя указанные методы можно отметить следующее:
- озон-цианидный метод синтеза через 3-кетогексоновые кислоты не может найти практического применения из-за отсутствия промышленных ресурсов ликсозы. Синтез L-ликсозы из D-галактозы или D-глюкозы очень сложен;
- метод бензоиновой конденсации двух альдегидов, как, например, этилглиоксилата и L-треозы, не перспективен, как из-за дефицитности сырья, так из-за неоднозначности реакции конденсации альдегидов (альдольная конденсация, образование бензоинов из одного и того же альдегида). Это приводит к низкому выходу целевого продукта.
- метод конденсации эфиров -кислот также неэффективен из-за сложности синтеза этих эфиров и из-за низкого выхода аскорбиновой кислоты.
В настоящее время промышленный способ получения аскорбиновой кислоты основан на синтезе из D-глюкозы, которую восстанавливают в D-сорбит каталитическим гидрированием. Важным этапом синтеза является процесс глубинного бактериохимического окисления (брожения) с помощью Acetobacter suboxydans D-сорбита до L-сорбозы. Последнюю подвергают ацетонированию (чтобы не допустить окисления четырех гидроксилов) и полученную диацетон L-сорбозу окисляют до диацетонкетогулоновой кислоты. Затем осуществляют процесс омыления и лактонизацию 2-кето-L-гулоновой кислоты до кислоты аскорбиновой [1]. Схема реакции представлена на рисунке 1.
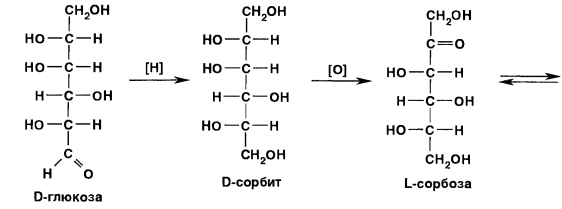
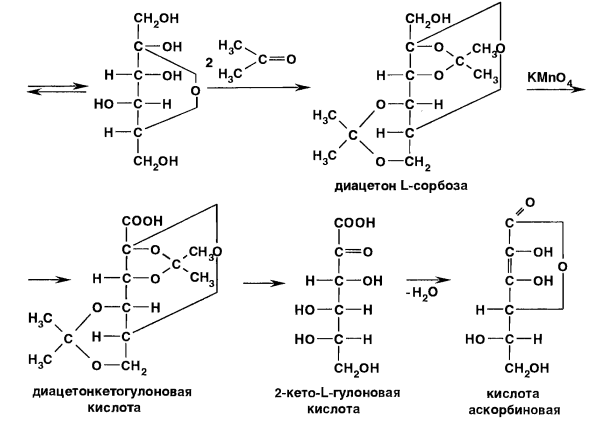
Рисунок 1 – Общая схема анализа кислоты аскорбиновой
Известны исследования процесса селективного каталитического окисления D-глюкозы с целью получения аскорбиновой кислоты и глюконата кальция. В качестве гетерогенных катализаторов использовались наночастицы палладия, импрегнированные в матрицу сверхсшитого полистирола [11].
Широкое промышленное применение нашел способ получения медицинской аскорбиновой кислоты путем многоступенчатой кристаллизации [11]. Этот способ заключается в растворении технической аскорбиновой кислоты, очистке активированным углем, кристаллизации в течение 6 - 8 часов и выделении медицинской аскорбиновой кислоты. Количество выделенного целевого продукта после первой кристаллизации составляет 65 - 70% от введенной технической аскорбиновой кислоты. Остальные 30 - 35% кислоты содержатся в маточном растворе, который собирают, упаривают в вакуум-аппарате и подают на повторную кристаллизацию. Выделение медицинской аскорбиновой кислоты из маточных растворов по описанной технологии является длительным (100 - 120 часов), что приводит к неизбежным потерям целевого продукта вследствие длительного пребывания в водных растворах и требует больших энергетических затрат. Недостатком этого способа является длительность процесса и значительные потери целевого продукта при выделении его из маточных растворов.
Запатентован способ получения медицинской аскорбиновой кислоты в котором, маточные растворы, образующиеся при кристаллизации медицинской аскорбиновой кислоты, предварительно обрабатывают натрийсодержащим щелочным соединением, например NaOH, Na2CО3, NaHCO3, или соляной кислотой до pH 2,2 - 2,4. Это позволяет сократить продолжительность процесса в 4 - 5 раз и уменьшить потери целевого продукта на 2 - 3% [13].
1.3 Качественные реакции на аскорбиновую кислоту
1.3.1 Инструментальные методы анализа
В ведущих зарубежных фармакопеях метод ИК-мпектроскопии является основным для идентификации аскорбиновой кислоты [4]. Для определения подлинности препарата ГФ ХII также рекомендует использовать метод ИК- спектроскопии [3]. Инфракрасный спектр субстанции, снятый в диске с калия бромидом, в области от 4000 до 400 см-1 по положению полос поглощения должен соответствовать рисунку спектра аскорбиновой кислоты (рисунок 2).

Рисунок 2 – ИК- спектр пропускания ФСО аскорбиновой кислоты
Ультрафиолетовый спектр поглощения 0,001% раствора субстанции в 0,1М растворе хлористоводородной кислоты в области от 2300 до 300 нм должен иметь максимум при 243 нм [3, 4].
ГФ требует определить угол вращения () 10% раствора и рассчитать удельное вращение по формуле:
(1)
где: С - концентрация раствора; - длина трубки поляриметра = 1 дм
Из-за нестойкости препарата при нагревании, для определения температуры плавления его предварительно сушат при температуре 60оС в течение 2 часов. Скорость подъёма температуры – 5о в минуту по той же причине [6].
1.3.2 Химические методы анализа
В ГФ ХII предусмотрены две реакции, подтверждающие подлинность аскорбиновой кислоты [3].
Первый метод основан на том, что 0,05 г субстанции растворяют в 2 мл воды и прибавляют 0,5 мл раствора серебра нитрата. Выпадает темный осадок металлического серебра.
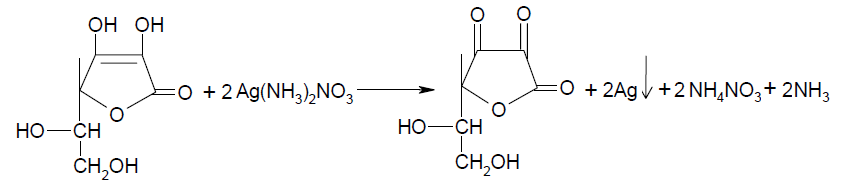
Этот же метод установления подлинности предлагает использовать и Международная фармакопея, фармакопея Республики Беларусь и т.д.
Второй метод основан на том, что к 1 мл 5% раствора субстанции прибавляют 2 мл 0,1 М раствора йода. Реактив обесцвечивается.
В Международной фармакопее приведена следующая методика определения подлинности аскорбиновой кислоты: растворяют 0,04 г препарата в 4 мл воды, прибавляют 0,1 г гидрокарбоната натрия Р и около 20 мг сульфата железа (II)Р; встряхивают и оставляют стоять; появляется темно-фиолетовой окрашивание, которое исчезает при добавлении 5 мл серной кислоты (100 г/л) [4].
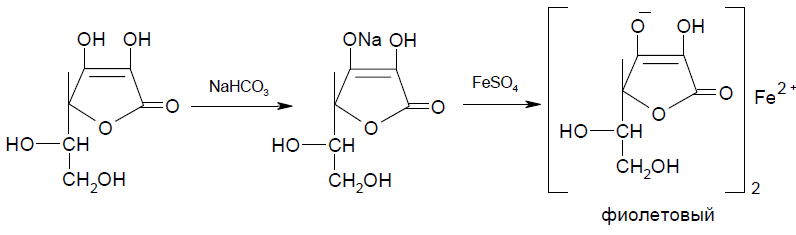
Помимо приведенных методов определения подлинности существуют и другие методы определения подлинности аскорбиновой кислоты.
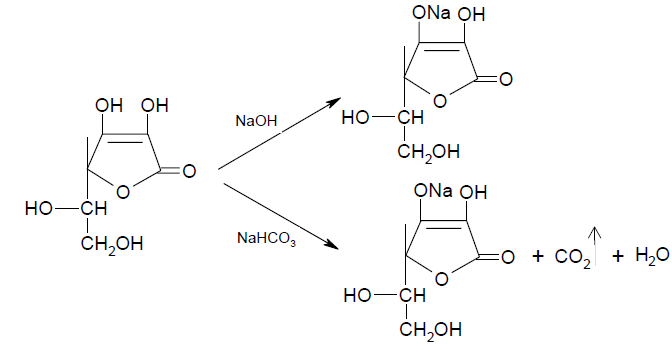
Аскорбиновая кислота является -лактоном, содержащим два спирто-
вых гидроксила в 5 и 6 положениях и два енольных гидроксила во 2 и 3 по-
ложениях. Енольные гидроксилы обладают кислотными свойствами, дают кислую реакцию на лакмус, взаимодействуют и с NaOH и с NaHCO3. Ки-
слотные свойства более выражены у гидроксила в 3-ем положении [6]:
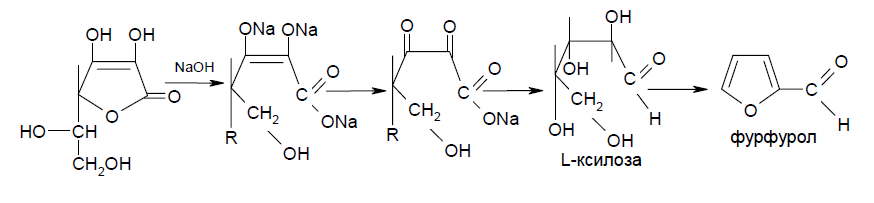
Следует иметь в виду, что аскорбиновая кислота является лактоном и при действии сильных щелочей лактонное кольцо гидролизуется, а затем образуется фурфурол [6]:
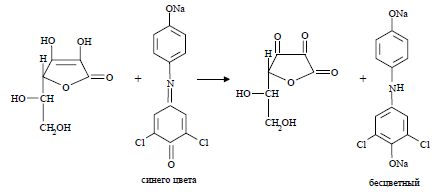
Синее окрашивание 2,6-дихлорфенолиндофенолята натрия исчезает от действия на реактив кислотой аскорбиновой [5]:
1.4 Определение количественного содержания аскорбиновой кислоты
1.4.1 Йодатометрия
В ГФ ХII рекомендует проводить количественное определение аскорбиновой кислоты методом йодатометрии. Около 0,1 г (точная навеска) субстанции растворяют в 20 мл воды, прибавляют 0,5 мл 1% раствора калия йодида, 1 мл 2% раствора хлористоводородной кислоты и титруют 0,0167 М раствором калия йодида до появления стойкого слабо-синего окрашивания (индикатор – 2 мл раствора крахмала) [3]:
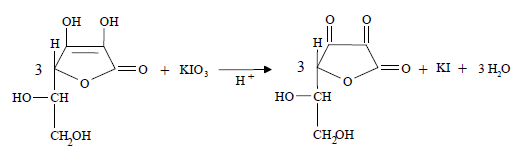
Избыточная капля титрованного раствора калия йодата реагирует с калия йодидом, выделяя йод, который указывает на конец титрования:
KIO3 + 5 KI + 6 HCl = 3 I2 + 6 KCl + 3 H2O
1 мл 0,0167 М раствора калия йодата соответствует 8,824 мг С6Н8О6
При йодатометрическом методе количественного определения кислоты аскорбиновой в инъекционном растворе следует учитывать наличие антиоксидантов-стабилизаторов, которые будут реагировать с титрантом - KIO3. Поэтому в начале к раствору добавляют раствор формальдегида, связывающий антиоксиданты:
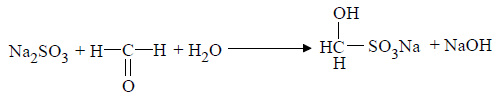
Затем кислоту аскорбиновую титруют стандартным раствором калия йодата [6].
1.4.2 Йодометрия
В других фармакопеях предлагается использовать метод йодометрии. Точную навеску (около 0,2 г) препарата растворяют в смеси 25 мл воды, свободной от углекислоты и 25 мл серной кислоты ( 100 г/л) [4]. Титруют без остановки раствором йода (0,1 моль/л), используя в качестве индикатора раствор крахмала, прибавляемый к концу титрования. Титрование проводят до появления устойчивого синего окрашивания. Каждый миллилитр раствора йода соответствует 8,806 мг С6Н8О6
1.4.3 Алкалиметрия
В некоторых лекарственных формах аскорбиновую кислоту определяют методом нейтрализации, используя кислотные свойства ее растворов. Кислота аскорбиновая титруется стандартным 0,1 М раствором натрия гидроксида, как одноосновная кислота по енольному гидроксилу в 3-ем положении [5, 6]:
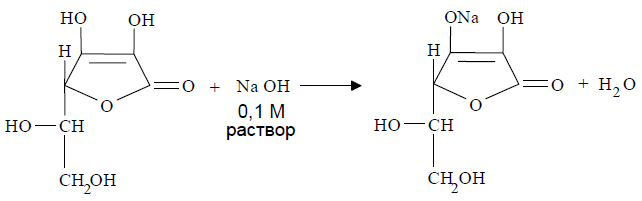
Несмотря на то, что аскорбиновая кислота является достаточно сильной кислотой, метод нейтрализации использовать не всегда целесообразно. Это обусловлено тем, что наряду с реакцией нейтрализации в некоторой степени протекает гидролиз лактонного кольца с образованием натриевой соли -кето- L-гулоновой кислоты, которая далее легко карбоксидируется, что приводит к завышенным результатам анализа [5]:
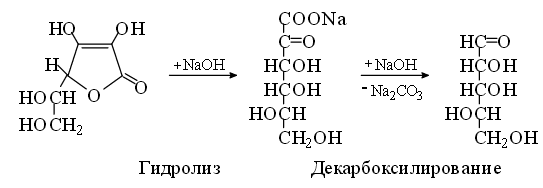
1.4.4 Инструментальные методы
Как видно из данных, приведенных в подразделах 4.1-4.3, для определения количественного содержания аскорбиновой кислоты применяются традиционные титриметрические методы. Несмотря на неоспоримые достоинства титриметрии, этот метод имеет ряд ограничений, к числу которых следует отнести: невозможность получения достоверного результата в присутствии других компонентов, входящих в состав лекарственного средства; высокая лабильность и способность к окислению. Поэтому все более широко применяются инструментальные методы анализа.
Разработан способ определения процентного содержания медицинской аскорбиновой кислоты в кристаллическом препарате, заключающийся в измерении светового потока, прошедшего через раствор и рассеянного раствором аскорбиновой кислоты, при этом раствор аскорбиновой кислоты нагревают, регистрируют экстремальное значение суммарного светового потока и температуру его наступления [14]. Устройство для реализации способа определения аскорбиновой кислоты представлено на рисунке 3.

Рисунок 3 – Устройство для определения содержания аскорбиновой кислоты
1 - источник света; 2 - измерительная ячейка; 3 - стеклянные окна; 4 - зеркала,
5 – фотоприемник; 6 - регистрирующий прибор; 7 - нагреватель; 8 - датчик температуры; 9 - регистрирующий прибор
На рисунке 4 показаны графики зависимости тока фотоприемника от температуры для определенной концентрации; рассеивающей способности раствора аскорбиновой кислоты (кривая 1), светового потока, прошедшего через среду (кривая 2), суммарного светового потока (кривая 3) [14].
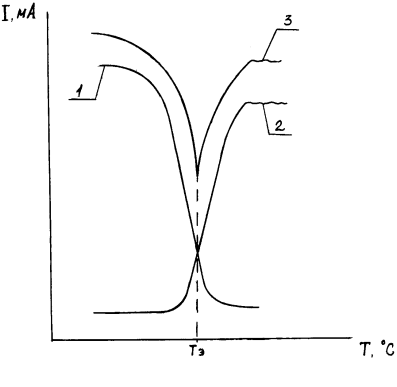
Рисунок 4 – Зависимость тока фотоприемника от температуры для определенной концентрации аскорбиновой кислоты
1 - рассеивающая способность раствора аскорбиновой кислоты; 2 - световой поток,
прошедший через среду; 3 - суммарного светового потока
Устройство работает следующим образом. Готовый раствор аскорбиновой кислоты загружают в измерительную ячейку 2 и нагревают с помощью нагревателя 7. Суммарный световой поток с помощью зеркал 4 попадает на фотоприемник 5 и регистрируется прибором 6. По мере увеличения температуры кристаллы аскорбиновой кислоты растворяются, световой поток, рассеянный средой (кривая 1, рис. 4), уменьшается, а световой поток, прошедший через среду (кривая 2, рис. 4), увеличивается. Наступает характерный момент, когда луч света, прошедший через среду, становится больше луча, рассеянного средой. Этому экстремальному значению суммарного светового потока соответствует определенное значение температуры раствора, которая измеряется датчиком температуры 8 и регистрируется прибором 9. Процентное содержание медицинской аскорбиновой кислоты определяется по формуле:
(2)
где Тз - температура раствора, при которой зарегистрировано экстремальное значение суммарного светового потока, oС; mв - масса воды, ч; mн - масса навески кристаллического продукта, г; а, в - коэффициенты
Применительно к анализу аскорбиновой кислоты такой метод анализа как флуоресцентный характеризуется высокой специфичностью, позволяющей осуществлять оценку качества определяемого вещества в присутствии других компонентов и высокой чувствительностью [12].
При разработке методики использована известная реакция конденсации кислоты дегидроаскорбиновой с ОФДА:
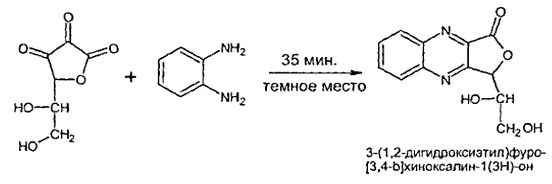
На рисунке 5 показано, что спектр флуоресценции продукта конденсации КДА с ОФДА имеет характерный максимум при длине волны возбуждения 340 нм и длине волны регистрации 425 нм.
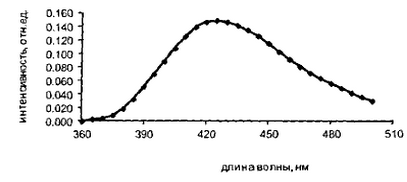
Рисунок 5 - Спектр флуоресценции продукта конденсации кислоты
дегидроаскорбиновой с ОФДА при длине волны 340 нм
Таким образом, появление интенсивного излучения полученного хиноксалинового производного может быть положено в основу флуориметрической методики качественного и количественного анализа кислоты аскорбиновой в ЛС, ЛП и лекарственном растительном сырье.
Разработана флуориметрическая методика определения подлинности и количественного содержания кислоты аскорбиновой, основанная на ее окислении до кислоты дегидроаскорбиновой с последующей конденсацией с о-фенилендиамином. Установлено, что для ее проведения необходимо использовать в качестве окислителя меди ацетат, в качестве стабилизатора контрольного раствора - натрия эдетат, рН раствора должно находиться в пределах от 4 до 5. Измерять величину интенсивности излучения следует регистрировать при длине возбуждения 340 нм и длине волны регистрации 425 нм.
В основу количественного определения аскорбиновой кислоты положена флуориметрическая методика, для проведения которой измеряют величину флуоресценции при длине волны возбуждения 340 нм и длине волны регистрации 425 нм. С целью выявления линейной зависимости была построена графическая зависимость интенсивности флуоресценции хиноксалинового производного КА от первоначальной концентрации КА в растворе (рисунок 6) [12].
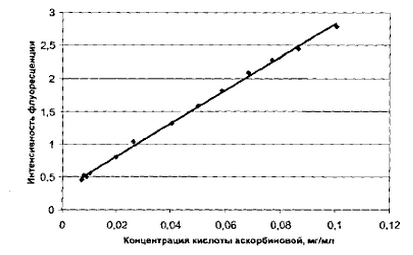
Рисунок 6 – Зависимость интенсивности флуоресценции от концентрации кислоты аскорбиновой в растворе
Метрологические характеристики разработанной методики и методики, приводимой в фармакопее (титриметрической) приведены в таблице 1.
Таблица 1 – Данные для сравнительной метрологической оценки двух методик количественного анализа субстанции аскорбиновой кислоты
|
Титриметрическая методика
|
Флуориметрическая методика
|
|
Содержание кислоты аскорбиновой, %
|
Метрологические характеристики
|
Содержание кислоты аскорбиновой, %
|
Метрологические характеристики
|
|
99,80
|
Хср=99,29±1,023
f=5; S2=0,158417
S=0,3980
P=95%
T(P,f)=2,57
Eср.=1,03%
|
99,89
|
Хср=99,29±0,923
f=5; S2=0,7564
S=0,8698
P=95%
T(P,f)=2,57
Eср.=0,97%
|
|
98,80
|
|
100,3
|
|
|
99,75
|
|
98,83
|
|
|
99,10
|
|
98,03
|
|
|
99,10
|
|
98,69
|
|
|
99,20
|
|
99,79
|
|
Предложено использовать метод высоко-эффективной жидкостной хроматографии для анализа водорастворимых витаминов, в том числе и аскорбиновой кислоты [9]. Установлено, что наилучшие результаты разделения водорастворимых витаминов удается достигнуть при градиентном элюировании. Подвижная фаза А – (0,6% фосфорная кислота) рН 1,5-1,8; подвижная фаза Б – ацетонитрил. При разделении аскорбиновой и никотиновой кислот более предпочтительнее использовать не подвижные фазы «Luna C18(2)» «Gemini C18». Подобранные условия использованы при определении витаминов в коммерческих образцах. Полученные результаты хорошо согласуются с паспортными данными.
Анализ учебной и специальной литературы, показал, что существует большое разнообразие методов анализа кислоты аскорбиновой.
Наиболее часто используемыми, для количественного определения кислоты аскорбиновой остаются различные титриметрические, спектрофотометрические, фотометрические и хроматографические методы.
2. Практическая часть
2.1 Характеристика объекта исследований
Объектом исследований служила жидкая лекарственная форма «Аскорбиновая кислота» (ампулы по 1 мл; 5% раствор для инъекций).
Рисунок 7 – Кислота аскорбиновая
Торговое название: Аскорбиновая кислота.
Международное непатентованное название: Аскорбиновая кислота (Ascorbic acid).
Лекарственная форма: раствор для инъекций 5%.
Описание: прозрачная бесцветная или слегка окрашенная жидкость.
Состав: действующее вещество – аскорбиновая кислота - 50 мг в 1 мл.
2.2 Методика выполнения исследований
Определение аскорбиновой кислоты в лекарственной форме проводили йодометрическим методом. К 1 мл препарата прибавляли 5 мл воды, 0,15 мл 1% раствора формальдегида, 2 мл 2% раствора кислоты хлороводородной, 0,5 мл 1% раствора калия йодида, 2 мл крахмала и тировали 0,0167 моль/л раствором йодата калия до появления светло-синего окрашивания, не исчезающего в течение 30 сек.
1 мл 0,0167 М раствора калия йодата соответствует 0,008824 г кислоты аскорбиновой.
Расчет содержания кислоты аскорбиновой в 1 мл раствора проводили по формуле:
(3)
де Vтитр. – практический объем титранта, мл; Vпр. – объем пробы, взятый для анализа, мл; K – поправочный коэффициент титранта (К=1); P – объем лекарственной формы (Р=1 мл).
2.3 Результаты анализа
Результаты анализа лекарственной формы представлены в таблице 2.
Таблица 2 – Результаты анализа лекарственной формы
|
№ определения
|
Объем титранта, пошедший на титрования, мл
|
Содержание аскорбиновой кислоты в лекарственной форме, г
|
|
1
|
5,6
|
0,049
|
|
2
|
5,7
|
0,050
|
|
3
|
5,7
|
0,050
|
|
4
|
5,8
|
0,051
|
|
5
|
5,9
|
0,052
|
2.4 Статистическая обработка результатов эксперимента
Среднее значение определяемого параметра – содержания аскорбиновой кислоты в препарате определяли по формуле:
(4)
Определяем значений:
d1= 0,049-0,0504=0,0014
d2= 0,0500-0,0504=0,0004
d3= 0,0500-0,0504=0,0004
d4= 0,051-0,0504=0,0006
d5= 0,052-0,0504=0,0016
Стандартное отклонение рассчитывали по формуле:
(5)
где f – число степеней свободы; f=n-1
Величина дисперсии (S2) рассматривается как мера воспроизводимости результатов, представленных в данной выборке. Дисперсию рассчитывали по формуле:
Стандартное отклонение среднего результата (Sx) рассчитывали по формуле:
(6)
Расчет граничных значений доверительного интервала проводили по критерию Стьюдента, т.к. варианты, входящие в выборку распределены нормально: при Р=95%
(7)
Рассчитываем относительную погрешность отдельной варианты и среднего результата:
(8)
(9)
(10)
(11)
(12)
(13)
На основании полученных при проведении эксперимента данных можно заключить, что использование йодометрического метода определения количества аскорбиновой кислоты в лекарственном средстве позволяет получать результаты с точностью, необходимой для проведения контроля.
ЗАКЛЮЧЕНИЕ
Кислота аскорбиновая (витамин С) как фармацевтическая субстанция широко используется в лекарственных препаратах для стимуляции и регуляции физиологических процессов, профилактики и лечения ряда заболеваний при гипо- и авитаминозах, повышения общей устойчивости организма к экзогенным и эндогенным неблагоприятным факторам.
Изучены способы получения аскорбиновой кислоты. Установлено, что аскорбиновая кислота может быть выделена из растительного сырья или синтезирована. Современный промышленный способ получения аскорбиновой кислоты основан на синтезе из D-глюкозы, которую восстанавливают в D-сорбит каталитическим гидрированием.
Изучены методики качественного и количественного определения аскорбиновой кислоты. Анализ нормативных документов зарубежных стран и отечественных производителей свидетельствует о том, что во всем мире прослеживается тенденция к внедрению в практику фармацевтического анализа современных инструментальных методов, обеспечивающих специфичность аналитических методик.
Разработана методика количественного определения аскорбиновой кислоты в жидкой лекарственной форме методом йодометрии. Статистическая обработка результатов эксперимента показала, что применение этого метода позволяет получать результаты с точностью, необходимой для проведения контроля.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
Учебники, пособия, многорафии:
1 Беликов, В. Г. Фармацевтическая химия : учеб. пособие /Беликов В. Г. - 4-е изд., перераб. и доп. - М. : МЕД пресс-информ , 2007 . - 622 с.
2 Глущенко, Н.Н. Фармацевтическая химия: учебник /Н.Н. Глущенко, Т.В. Плетнева, В.А. Попков; Под ред. Т.В. Плетневой. – М.: Изд. центр «Академия», 2004. – 384 с.
3 Государственная фармакопея российской федерации ХII. Часть 1. – М.: Изд-во «Научный центр экспертизы средств медицинского применения, 2008. – 704 с.
4 Международная фармакопея. Изд. 3-е, Т.2. Спецификация для контроля качества фармацевтических препаратов.- М.: Наука, 1990.- 364 с.
5 Смирнов, В.А. Витамины и коферменты: учебное пособие. Часть 2. /В.А. Смирнов, Ю.Н. Климович.- Самара: Самра.ГТУ, 2008.- 91 с.
6 Фармацевтическая химия: учебное пособие / под ред. А. П. Арзамасцева - М.: ГЭОТАР-Медиа, 2008. - 640 с.
7 Шнайдман, Л.О. Производство витаминов /Л.О. Шнайдман. – М.: Пищевая промышленность, 1973. – 440 с.
Статьи
8 Алексеев, А.В. Определение антиоксидантов методом активированной хемилюминесценции с использованием 2,2-азо-бис(2амидинопропана) / А.В. Алексеев, Е.В. Проскурина, Ю.А. Владимиров //Вестник Моск. У-та. Сер. 2. Химия, 2012.- Т. 53.- № 3.- С. 187-193
9 Бендрышев, А.А. Определение водорастворимых витаминов в витаминных премиксах, биологически-активных добавках и фармацевтических препаратах методом высоко-эффективной жидкостной хроматографии с градиентным элюированием / А.А. Бендрышев, Е.Б. Пашкова, А.В. Пирогов, О.А. Шпигун //Вестник Московского у-та. Сер. 2. Химия, 2010.- Т. 51.- № 4.- С. 315-324.
10 Магин, Д.В. Фотохемилюминесценция как метод изучения антиоксидантной активности в биологических системах. Математическое моделирование / Д.В. Магин, Д.Ю. Измайлов, И.Н. Попов, Г. Левин, Ю.А. Владимиров //Вопросы медицины, 2000, т. 46.- № 4.- С. 419-425.
11 Щенников, С.В. Современные каталитические технологии в синтезе аскорбиновой кислоты и глюконата кальция / С.В. Щенников, Э.М. Сульман, М.Г. Сульман, В.Г. Матвеева // Вестник Тверского государственного университета, 2011.- № 12.- С.172-178
Авторефераты
12 Таубе, А.А. Разработка флуориметрических методик оценки качества кислоты аскорбиновой и кислоты фолиевой в лекарственных средствах: автореф. дисс. канд. фарм. наук (14.04.02) /А.А. Таубе, М., 2012.- 24 с.