ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА
ФГБОУ ВПО «Петрозаводский государственный университет»
Институт педагогики и психологии
Кафедра технологического образования
Модуль: « машиноведение»
ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА
Пояснительная записка к курсовой работе
Петрозаводск
2015
Содержание___________________________________________________ 2
Введение______________________________________________________3
Разделы:
1. Параметры состояния рабочего тела__________________________4
2. Основные газовые законы___________________________________5
3. Смеси идеальных газов_____________________________________7
4. Теплоемкость газов________________________________________9
5. Первый закон термодинамики_______________________________10
6. Основные термодинамические процессы_______________________11
7. Второй закон термодинамики _______________________________13
8. Круговые процессы________________________________________14
9. Истечение газов и паров. Дросселирование____________________ 17
10. Пары. Водяной пар_______________________________________19
11. Влажный воздух_________________________________________ 20
Приложения_______________________________________________ 21
Список литературы____________________________________________ 25
Введение
Теплотехника — общетехническая дисциплина, изучающая методы получения, преобразования, передачи и использования теплоты, а также принцип действия и конструктивные особенности тепло- и парогенераторов тепловых машин, агрегатов и устройств. В развитии теплотехники и её теоретических основ большая заслуга принадлежит российским учёным. Д. И. Менделеев провёл фундаментальные работы по общей теории теплоёмкостей и установил существование для каждого вещества критической температуры. М. В. Ломоносов создал основы молекулярно-кинетической теории вещества и установил взаимосвязь между тепловой и механической энергией. Теплотехника, отрасль науки и техники, охватывающая методы получения и использования тепловой энергии.
- ПАРАМЕТРЫ СОСТОЯНИЯ РАБОЧЕГО ТЕЛА
Условие задачи: Разрежение в газоходе парового котла измеряется тягомером с наклонной трубкой. Угол наклона трубки = 30°.Длина столба воды , отсчитанная по шкале , 160 мм . Определить абсолютное давление
Газов , если показание ртутного барометра приведенное к 0 С составляет, 740 мм.
Так как трубка тягомера находится под наклонов в 300 и показание его 160мм.то,пользуясь свойствами прямоугольных треугольников можно определить реальную высоту водяного столба.(см.рис 1)
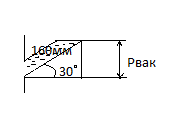
Рисунок 1- схема решения.
Рвак лежит против угла a=300 и поэтому Рвак= 160/2=80мм вод.ст.
Далее переводим единицы из мм.вод.ст. в Па Рвак=8089,81=784,8 Па
Далее переводим в мм.рт.ст.Рвак=748,8/133,3=5,88мм.рт.ст.
Определяем абсолютное давление
Рабс=Ратм-Рвак=740-5,88=734,1мм.рт.ст.
Ответ: Абсолютное давление газов =734,1мм.рт.ст.
2. ОСНОВНЫЕ ГАЗОВЫЕ ЗАКОНЫ
Условие задачи: В воздухонагреватель парового котла вентилятором подается 130000м3/ч воздуха при температуре 30°С .Определить объем воздуха на выходе воздухонагревателя ,если нагрев его до 400°С При постоянном давлении.
Для решения данной задачи необходимо воспользоваться законом Гей-Люссака V1/ V2 =Т1/Т2 Где:
V1-объем воздуха на входе в котел =130000м3
V2 - объем воздуха на выходе из котла.
Т1- температура воздуха на входе в котел t=300С, Т=t+273=3030 К.
Т2 - температура нагрева воздуха в котле T=4000 С,T=t+273=6730 К.
Соответственно объемный расход воздуха на выходе V2=V1*T2/T1=130000*673/303=288745м3 /ч
Ответ: Объем воздуха на входе воздухонагревателя =288745м3 /ч
Условие задачи: Масса пустого баллона емкостью 50 л. Равна 80 кг. Определить массу баллона после заполнения его кислородом при температуре t=20°С. До давления 100 бар.
Для решения мне понадобилась формула
m= PV/(RT)
Следует перевести единицы измерения:
R-постоянная для кислорода =259,8
T-перевод в Кельвины=20+273,15=293,15
P-100бар=10 Мпа *10
V=50л=0,05
m=10*10 6 *0,05 / (259,8*293,15)=0,5/76160,37=6,57
Прибавим к первоначальной массе
m =80+6,57=86,57кг.
Ответ: Масса баллона =86,57кг.
3. СМЕСИ ИДЕАЛЬНЫХ ГАЗОВ
Условие задачи: Определить газовую постоянную ,плотность при нормальных условиях и объемный состав смеси, если её массовый состав следующий:
Н2=8,4%,СН4=48,7%,С2Н4=6,9%,СО=17%,СО2= 7,6%,O2=4,7%,N2=6,7%
Для начала нужно определить газовую постоянную каждого элемента из приложения А ,где:
Н2-водород=4124,3
СН4-метан=519
С2Н4-этилен =297
СО- окись углерода =296,8
СЩ2-углекислый газ=189
O2-кислород =259,8
N2-азот=296,8
Находим газовую постоянную смеси Rсм= где;
gi- массовые доли газов, входящих в смесь
Ri- газовые постоянные газов (приложение А)
Rсм=8,4/100*412,4+48,7/100*519+6,9/100*297+17/100*296,8+7,6/100*189+4,7/100*259,8+6,7/100*296,8=0,084*4124,3+0,487*519+0,069*297+0,17*296,8+0,076*189+0,047*259,8+0,067*296,8=346,4+252,8+20,5+50,5+15+12,2+19,9
=717,3 Дж(кгК)
Далее определяем объемные доли компонентов по формуле:
ri=gi*Ri/Rсм
rн2=gH2*RH2/Rсм=0,084*4124,3/717,3=0,48
rCH4=gCH4*RCH4/Rсм=0,487*519/717,3=0,34
rСO =gCO*RCO/Rсм=0,17*296,8/717,3=0,07
rC2H4=gC2H4*RC2H4/Rсм=0,069*297/717,3=0,03
rCO2=gCO2*RCO2/Rсм=0,076*189/717,3=0,02
rO2=gO2*RO2/Rсм=0,047*259,8/717,3=0,017
rN2=gN2*RN2/Rсм=0,067*296,8/171,3=0,028
Плотность смеси выражается из формулы pсм=
Где;pi –плотности газов входящих в смесь
pH2=0,090кг/м3
pCH4=0,72кг/м3
pCO=1,25кг/м3
pC2H4 =1,26кг/м3
pCO2=1,977кг/м3
pO2=1,429кг/м3
pN2=1,25кг/м3
(приложение А)
pсм= pH2* rн2+ pCH4 *rCH4+ pCO *rСO + pC2H4 *rC2H4+ pCO2* rCO2+ pO2* rO2+ pN2* rN2=0,090*1,429+0,35*0,72+0,07*1,25+0,02*1,26+0,02*1,977+0,017*1,429+0,028*1,25=0,0432+0,252+0,00875+0,00252+0,03954+0,0242+0,035=0,5кг/м3
Ответ: Газовая постоянная Rсм=717,3Дж(кгК), плотность смеси pсм=0,5кг/м3, объемные доли компонентов rO2 =0,017, rN2=0,028,
rN2=0,028, rн2=0,48
4 .ТЕПЛОЕМКОСТЬ ГАЗОВ
Условия задачи:
Определить среднюю массовую теплоемкость при постоянном объеме для азота в пределах 200-800°С, считая зависимость теплоемкости нелинейной,
Известно, что средняя мольная теплоемкость азота при постоянном давлении может быть определена по формуле
µp = 28,7340+0,0023488*tср
Вычислим среднюю мольную теплоемкость азота при постоянном давлении в пределах 200-800°С
µp = 28,7340+0,0023488(200+800)/2 = 29,9084 кДж/(кмоль*К);
Переведем среднюю мольную теплоемкость азота при постоянном давлении в среднюю массовую теплоемкость при постоянном давлении по следующей формуле:
p = µp/µ = 29,9084/28 = 1,0681 кДж/(кг*К)
µ = 28 - молекулярная масса азота, кг/кмоль.
Теперь определим среднюю массовую теплоемкость при постоянном объеме, используя формулу перевода:
v = p - R = 1068,1 Дж/(кг*К) – 296,8 Дж/(кг*К) = 771,3 Дж/(кг*К) = 0,7713 кДж/(кг*К)
Ответ: средняя массовая теплоемкость при постоянном объеме v = 0,7713 кДж/(кг*К).
5.ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
Условия задачи: В сосуд содержащий 5л.воды при температуре t=20°С помещен электронагреватель мощностью 800Вт.Определить сколько времени потребуется,что бы нагреть воду до 100° С. Потерями тепла сосуда в окружающую среду пренебречь.
5 л = 5 дм3
Масса воды в сосуде будет равна:
m=V* = 0,005м3 * 1000 кг/м3 = 5 кг.
Найдем количество теплоты, необходимое для нагревания воды от 20 С (293 К) до 100 С (373 К):
Q = Cv*m*(t2-t1) = 4200 Дж/(кг*К)*5*(373-293) = 1 680 000 Дж = 1680 кДж.
Время, затраченное на нагревание воды данным электронагревателем вычислим по следующей формуле:
T = Q/N = 1 680 000/800 = 2100 с = 2100/60 = 35 мин.
Ответ: 35 минут.
6. ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ
Условие задачи: Сосуд объемом 60 л заполнен кислородом при давлении 125 бар. Определить конечное давление кислорода и количество сообщенного ему тепла, если начальная температура кислорода 10°С, а конечная - 30°С. Теплоемкость кислорода считать постоянной, не зависящей от температуры.
Для решения мне понадобилась формула
m= PV/(RT)
P – давление, переведем в Па: 125 бар = 125*105 Па;
V – объем кислорода, переведем в м3: 60 л = 0,06 м3;
R – газовая постоянная для кислорода по таблице равна 259,8 Дж/кг;
Т – температура, перевод в Кельвины: 10+273 = 283 К (начальная температура), 30+273 = 303 К (конечная температура).
Масса кислорода равна:
m = = 10,2 кг;
Так как процесс изохорный, из соотношения P1/T1 = P2/T2, находим давление в конечном состоянии:
P2 = P1* T2/ T1 = 125*105*303/283 = 134*105Па = 134 бар.
Чтобы определить количество подведенного к кислороду тепла, я воспользовалась формулами:
Q = m*Cv (T2- T1),
Cv = R/(k-1), где k – показатель адиабаты, для кислорода равен 1,4.
Cv =259,8/(1,4-1) = 649,5 кДж/(кг*К);
Q = 10,2 * 649,5 * (303-283) = 132,5 кДж.
Ответ: конечное давление кислорода P2 =134 бар, количество сообщенного тепла Q =132,5 кДж.
Условие задачи: Воздух при давлении 1 бар и температуре 27°С сжимается в компрессоре до давления 35 бар. Определить величину работы, затраченной на сжатие 100 кг воздуха, если сжатие производится изотермически.
Из формулы m= PV/(RT) выразим V:
V = m RT/P
R для воздуха равна 287 Дж/кг;
P переведем в Па: 1 бар = 1*105 Па; 35 бар = 35*105 Па;
T переведем Кельвины: 27+273 = 300 К.
Найдем объем воздуха в начальном состоянии:
V = 100*287*300/(1*105) = 86 м3;
Работа, затраченная на изотермическое сжатие, находится по уравнению:
L = P1* V1 * = 1*105* 86 * = -305,76 * 105 = -30576 кДж.
Ответ: работа, затраченная на сжатие 100 кг воздуха, L = -30576 кДж.
7. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
Условие задачи: 1 кг воздуха сжимается от Р1= 1 бар и t1 = 15°С до Р2 =5 бар и t2 = 100°С. Определить изменение энтропии. Теплоемкость
считать постоянной.
Чтобы найти изменение энтропии при постоянной теплоемкости, можно использовать несколько формул, но исходя из начальных данных мы будем использовать следующую формулу:
s = s2 – s1 = Cp* – R*
Найдем по формуле Cp= R*k/(k-1)
R для воздуха равна 287 Дж/кг,
k – показатель адиабаты, для воздуха равен 1,4
Cp= 287*1,4/0,4 = 1004,5 Дж/(кг*К);
Температуру переводим в Кельвины: 15+273 = 288 К, 100+273=373 К.
Давление переводим в Паскали: 1 бар = 1*105Па, 5 бар =5*105Па.
s = 1004,5* – 287* = 261,3– 459,2 = -197,9 кДж/(кг*К).
Ответ: изменение энтропии s =-197,9 кДж/(кг*К).
8.КРУГОВЫЕ ПРОЦЕССЫ
Условие задачи: Определить для цикла, данного в задаче 187, количество
подведенного и отведенного тепла, среднее КПД цикла и мощность
при расходе воздуха 30 кг/мин.
Задача 187: Определить параметры точек смешанного термического
цикла ДВС (см. рис. 6), если Р1=0,83 бар, t1= 57°С, степень сжатия
=15; степень повышения давления = 1,6; степень предварительного
расширения = 1,4; показатель адиабаты k= 1,4; рабочим телом является 1 кг сухого воздуха.

1. Найдем количество подведенного тепла, учитывая, что оно складывается из количества подведенного тепла при изохорном процессе 2-3 и изобарном процессе 3-4:
q1 = q’1 + q’’1 = Cv(Т3 – Т2) + Cp(Т4 – Т3);
Найдем Cv и Cp:
Cv = R/(k-1) = 287/(1,4-1) = 717,5 Дж/(кг*К);
Cp = R*k/(k-1) = 287*1,4/(1,4-1) = 1004,5 Дж/(кг*К);
Найдем Т2 из адиабатного процесса 1-2:
= ( = ( = = 2,95;
Т2 = 2,95 * (57+273) = 974 К.
Найдем Т3 из изохорного процесса 2-3:
P2/T2 = P3/T3, T3 = T2* P3/ P2, где отношение давлений в точках 3 и 2 есть степень повышения давления = 1,6.
Следовательно,
T3 = T2* = 974 * 1,6 = 1558 К.
Найдем Т4 из изобарного процесса 3-4:
V4/T4 = V3/T3;
T4 = T3* V4/ V3, где отношение объемов в точках 4 и 3 есть степень предварительного расширения = 1,4.
Следовательно,
T4 = 1558 * 1,4 = 2181 К.
Подставляем найденные значения и находим количество подведенного тепла q1:
q1 = 717,5*(1558-974) + 1004,5*(2181-1558) = 419020 + 625803 = 1044823 Дж = 1045 кДж.
2. Найдем количество отведенного тепла q2, которое отводится во время изохорного процесса 5-1:
q2 = Cv(Т1 – Т5)
Найдем Т5 из адиабатного процесса 4-5:
= (;
V5 = V1 = = 287*330/(0,83*105) = 1,14 м3.
Исходя из схемы процесса. Найдем V4.
V4 = V3 * ;
V3 = V2, V2 = V1/ = 1,14/15 = 0,076 м3.
V4 = 0,076*1,4 = 0,1064 м3.
Рассчитаем Т5:
Т5 = Т4 * = 2181* = 845 К.
Подставляем найденные значения и находим количество отведенного тепла q2:
q2 = 717,5*(303 – 845) = -369512 Дж = -369,5 кДж. (знак минус показывает, что тепло отведенное)
3. Найдем среднее КПД цикла, используя следующую формулу:
= 1 - * ;
= 1 - * = 1 – 0,3385 * = 0,646 = 65%.
4. Найдем мощность при расходе воздуха 30 кг/мин:
N = ;
Переведем Q в кг/ч: 30*60 = 1800 кг/ч;
Найдем L (работа цикла):
L = q1 - q2 = 1045 – 369, 5 = 676 кДж.
N = = 338 кВт.
Ответ: количество подведенного тепла q1=1045 кДж, количество отведенного тепла q2 = 369,5 кДж, среднее КПД цикла = 65%, мощность N=338 кВт.
9. ИСТЕЧЕНИЕ ГАЗОВ И ПАРОВ. ДРОССЕЛИРОВАНИЕ
Условие задачи: Водяной пар давлением 20 бар с температурой 400C при истечении из сопла расширяется по адиабате до давления 2 бар. Определить площадь минимального и выходного сечения сопла, а также скорости истечения в этих соплах, если расход пара 4 кг/с. Процесс расширения пара в сопле принять адиабатным.
1. Найдем площадь минимального сечения сопла по формуле:
Fmin = Gmax*vкр/кр;
Удельный объем водяного пара в минимальном сечении vкр находим из соотношения параметров адиабатного процесса:
= ;
Найдем v1, предварительно переведя основные параметры:
R – газовая постоянная для водяного пара 481,6 Дж/кг;
Т – переведем в Кельвины: 400+273 = 673К;
P – переведем в Паскали: 20 бар = 20*105Па.
v1 = R*T1/P1 = 481,6 * 673/(20*105) = 0,16 м3;
Теперь найдем соотношение = P2/P1:
= 2/20 = 0,1 < 0,546 (кр для водяного пара = 0,546), следовательно, теоретическая скорость истечения газа будет равна критической кр.
кр = Pкр/P1
Pкр = 0,546*P1 = 0.546 * 20 *105 = 10,92 бар.
vкр = v1 * = 0,16* = 0,246 м3;
Найдем теоретическую скорость истечения газа из сопла минимального сечения по следующей формуле:
кр = = = 614,9 м/с.
Найдем площадь минимального сечения сопла
Fmin = 4*0,246/615 = 0,0016 м2 = 16 см2;
2. Определим площадь выходного сечения по формуле:
Fmax = G*v2/;
v2 = v1 * ;
v2 = 0,16* = 0,83 м3;
Определим скорость истечения водяного пара из выходного сопла по формуле:
= = = = 1040 м/с;
Найдем Fmax:
Fmax = 4*0,83/1040 = 0,0032 м2 = 32 см2.
Ответ: площадь минимального сечения сопла Fmin = 16 см2, площадь выходного сечения сопла Fmax =32 см2, скорость истечения в Fmin кр =614,9 м/с, скорость истечения в Fmax =1040 м/с.
10. ПАРЫ ВОДЯНОЙ ПАР
Условие задачи: В сосуде шарообразной формы находится в верхней поло-
вине сухой насыщенный пар, в нижней - вода в состоянии насыщения.
Во сколько раз вес воды больше веса пара, если внутренний диаметр
сосуда 1 м и давление внутри него 20 ат?
Переведем давление в Паскали: 20 ат = 20*105 Па.
Отношение массы воды к массе пара выглядит следующим образом:
= ;
Учитывая, что пар и вода занимают каждый по половине объема сосуда, то объем можно сократить в верхней и нижней части формулы, остается:
= ;
Плотность сухой насыщенный пар и вода в состоянии насыщения можно определить по таблицам для водяного пара и воды, зная их давление - 2000 кПа.(приложение Б)
Плотность сухого насыщенного пара будет равна обратному удельному объему v:
пара = 1/ v = 1/0,09953 = 10 кг/м3;
Плотность воды в состоянии насыщения будет равна обратному удельному объему v:
воды = 1/ v = 1/0,0011766 = 850 кг/м3;
= = 85 раз.
Ответ: в 85 раз.
11. ВЛАЖНЫЙ ВОЗДУХ
Условие задачи: Температура влажного воздуха t = 25°С, а температура
точки росы tр = 20°С. Определить относительную влажность воздуха,
энтальпию, абсолютную влажность воздуха, влагосодержание, парциальное давление водяного пара. При решении задачи использовать hd-диаграмму.
Используя hd-диаграмму,( приложение В) находим:
относительную влажность воздуха = 75%;
энтальпию h = 62 кДж/кг;
влагосодержание d= 14,5 г/кг;
парциальное давление водяного пара P = 2,25 к Па = 2,25*1000/133 = 17 мм рт.ст.
абсолютную влажность воздуха определим следующим образом:
Абсолютная влажность - количество водяного пара в 1м3 влажного воздуха, численно равное плотности пара (п) при его парциальном давлении (Рп).
По таблицам определим удельный объем водяного пара при давлении Рп = 2,25 кПа (приложение Д)
v = 56,926 м3/кг;
п = 1/56,926 = 0,01756 кг/м3 = 17,56 г/м3.
Ответ: = 75%; h = 62 кДж/кг; 14,5 г/кг; P =17 мм рт.ст., п =17,56 г/м3.
Приложение А
Физические постоянные некоторых газов
|
Газ |
Химиче ская формула |
Относитель ная молеку лярная масса, кг/кмоль |
Газовая по стоянная, Дж/кг |
Плотность газа при н . у ., кг /м з |
|
Кислород |
О2 |
32 |
259,8 |
1,429 |
|
Водород |
Н2 |
2 |
4124,3 |
0,090 |
|
Азот |
N2 |
28 |
296,8 |
1,250 |
|
Оксид углерода |
СО |
28 |
296,8 |
1,250 |
|
Воздух |
— |
28,96 |
287 |
1,293 |
|
Углекислый газ |
44 |
189 |
1,977 |
|
|
Водяной пар |
Н2О |
18 |
481,6 |
0,804 |
|
Гелий |
Не |
4 |
2077,2 |
0,178 |
|
Аргон |
Аг |
40 |
208,2 |
1,784 |
|
Аммиак |
N Нз |
17 |
488,2 |
0,771 |
|
Ацитилен |
С2Н2 |
26 |
320 |
1,171 |
|
Бензол |
СбНб |
78,1 |
106 |
- |
|
Бутан |
С4Н10 |
58,1 |
143 |
2,673 |
|
Оксид азота |
NO2 |
46 |
181 |
- |
|
Оксид серы |
SO2 |
64,1 |
130 |
2,93 |
|
Метан |
СН4 |
16 |
519 |
0,72 |
|
Пропан |
СзНв |
44,1 |
189 |
2,02 |
|
Пропилен |
СзНб |
42,1 |
198 |
1,91 |
|
Сероводород |
H2S |
34,1 |
244 |
1,54 |
|
Хлор |
70,9 |
117 |
3,22 |
|
|
Этилен |
С2Н4 |
28,1 |
297 |
1,26 |
|
Этан |
С2Н6 |
30,1 |
277 |
1,36 |