Материалы, используемые в электронной технике (МЭТ)
Лекция № 1
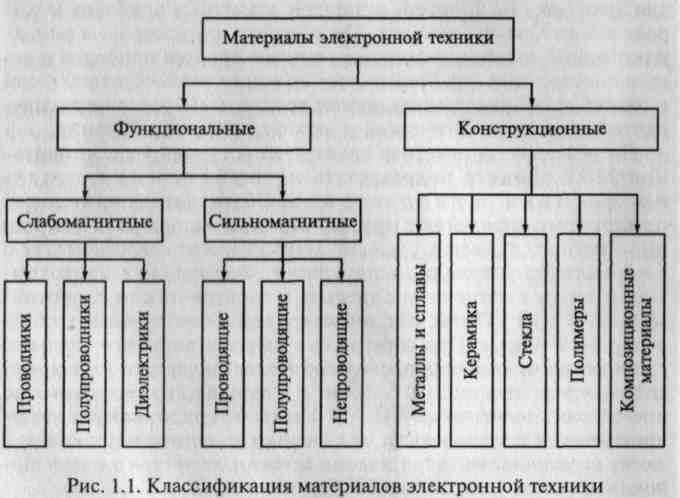
Классификация материалов
Строение атомов
Основные виды химической связи
Классификация материалов
Материалы, используемые в электронной технике (МЭТ), можно подразделить на функциональные и конструкционные. Под функциональными МЭТ следует понимать материалы, которые обеспечивают реализацию определенных функций в элементах электронной аппаратуры. При использовании таких материалов в приборах и устройствах электроники, в первую очередь, принимаются во внимание их электрические свойства. В качестве примеров функциональных МЭТ можно назвать резистивные, конденсаторные и электроизоляционные материалы, высокопроводящие и сверхпроводящие вещества, материалы для хранения и записи информации, материалы с нелинейными электрическими свойствами, материалы для активных элементов полупроводниковой электроники, таких как диоды, транзисторы, лазеры, фотодетекторы и др.
Конструкционными называются материалы, предназначенные для изготовления корпусов и деталей различных приборов и устройств электронной техники. Как правило, эти материалы выполняют вспомогательные функции, причем корпуса приборов и детали конструкций характеризуются большим разнообразием форм и размеров. К ним предъявляются прежде всего жесткие эксплуатационные, технологические и экономические требования.
По реакции на внешнее электрическое поле функциональные МЭТ принято подразделять на проводники, полупроводники и диэлектрики. Объективным критерием, по которому определяют принадлежность материала к той или иной группе, является удельное электрическое сопротивление в нормальных условиях эксплуатации. Формально к проводникам относятся материалы с удельным электрическим сопротивлением < 10-5 Ом•м, а к диэлектрикам —материалы, у которых >10-8 Ом•м. При этом важно иметь в виду, что удельное сопротивление хороших проводников электрического тока может составлять всего лишь 10-8 Ом•м, а у лучших диэлектриков оно превосходит значения 1016 Ом•м. Удельное сопротивление полупроводников в зависимости от строения и состава материалов, а также от условий их эксплуатации может изменяться в очень широких пределах —от 10-5 до 108 Ом•м.
На практике многие материалы часто подвергаются одновременному воздействию как электрического, так и магнитного полей. По поведению в магнитном поле функциональные МЭТ классифицируются на слабомагнитные и сильномагнитные вещества (рис. 1.1). Последние иногда называют магнетиками. Подавляющее большинство функциональных материалов электроники относится к слабомагнитным веществам. Среди магнетиков также можно выделить вещества, хорошо проводящие электрический ток, наряду с материалами, совсем непроводящими. В зависимости от удельной проводимости различным оказывается частотный диапазон использования магнетиков.
Хорошими проводниками электрического тока являются металлы. Из 105 химических элементов лишь 24 являются неметаллами, причем 12 элементов могут проявлять полупроводниковые свойства. Но кроме элементарных веществ существуют тысячи химических соединений, сплавов или композиций, проявляющих свойства проводников, полупроводников или диэлектриков. Резкую границу между значениями удельного сопротивления материалов, относящимся к различным классификационным группам, провести достаточно сложно. Указанные ранее критерии в значительной мере условны. Одни и те же вещества в разных ситуациях могут проявлять различные электрические свойства. Например, проводимость полупроводников сильно зависит от содержания примесей, типа и концентрации структурных дефектов. Поэтому
чистые кристаллы алмаза являются прекрасными диэлектриками с весьма высоким удельным сопротивлением. Но при введении в такие кристаллы определенных примесей они приобретают полупроводниковые свойства.
Многие полупроводники при низких температурах ведут себя подобно диэлектрикам. В то же время диэлектрики при сильном нагревании могут проявлять свойства полупроводников. Качественное различие между материалами состоит в том, что для металлов проводящее состояние является основным, а для полупроводников и диэлектриков —возбужденным.
Развитие радиотехники потребовало создания диэлектриков, в которых специфические высокочастотные свойства сочетаются с необходимыми теплофизическими и физико-механическими характеристиками, а также с высоким удельным сопротивлением. Такие материалы получили название высокочастотных диэлектриков. Кроме того, в зависимости от функций, выполняемых диэлектриками в электронной аппаратуре, они подразделяются на активные и пассивные материалы. С помощью активных диэлектриков осуществляется преобразование различных сигналов и управление параметрами электрических цепей. К пассивным относятся электроизоляционные и конденсаторные материалы.
Круг конструкционных материалов, применяемых в электронике, также достаточно широк. Эти материалы можно классифицировать по разным признакам. В частности, их принято подразделять на конструкционные материалы общего назначения (универсальные) и конструкционные материалы со специальными свойствами (специализированные). На рис. 1.1 приведена одна из возможных классификаций конструкционных МЭТ по составу и особенностям технологического цикла.
Основные эксплуатационные требования к конструкционным материалам сводятся к достижению высокой конструкционной прочности изготовляемых деталей и узлов, а также обеспечению устойчивого иммунитета к воздействию внешней среды. Под конструкционной прочностью понимают комплекс механических свойств, гарантирующих надежную и длительную эксплуатацию материала в заданных условиях.
Строение атомов
Имеются многочисленные и убедительные доказательства, что атомы любого вещества состоят из положительно заряженного ядра и окружающих его электронов. В свою очередь, ядро состоит из фотонов и нейтронов. Нейтроны являются нейтральными частицами, поэтому заряд ядра определяется числом содержащихся в нем протонов. Масса электрона в 1 836 раз меньше массы протона и нейтрона. Это означает, что практически вся масса атома сосредоточена в ядре. Вместе с тем размер ядра очень мал и сопоставим с размером электрона. Если ядро представить в виде шарика, то его радиус, м, можно довольно точно оценить по формуле
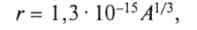
где А —массовое число элемента, т.е. суммарное число нуклонов в ядре.
Электроны заполняют оболочки атома, компенсируя положительный заряд протонов. Атом в целом является нейтральным образованием. Число электронов и протонов в атоме определяется порядковым номером химического элемента в Периодической системе элементов Д. И. Менделеева.
В простейшей планетарной модели атома, предложенной Э. Резерфордом, электроны вращаются по круговым орбитам относительно ядра (рис. 1.2, а). Условию сохранения радиуса г орбиты отвечает равновесие между центробежной силой, отбрасывающей электрон от ядра, и силой кулоновского притяжения:

где т —масса электрона; v —скорость движения электрона по орбите; Z —атомный номер; е —заряд электрона; Ze —заряд ядра; е0 —электрическая постоянная, е0 = 8,85- 10~12 Ф/м.
Полная энергия электрона Э в атоме складывается из кинетической энергии движения по орбите Эк потенциальной энергии Эп, обусловленной полем протонов:

Характерная особенность потенциальной кривой Эп(r) заключается в сильном увеличении ее крутизны по мере уменьшения г. Совместное решение формул (1.1) и (1.2) позволяет показать, что при движении электрона в поле центральных сил полная и кинетическая энергии одинаковы по величине, но противоположны по знаку, причем каждая из них равна половине потенциальной энергии.
Основной недостаток планетарной модели Резерфорда заключается в ее противоречивости. С ее помощью не удалось объяснить стабильность атомной структуры. Согласно законам классической электродинамики периодическое движение электрона с центростремительным ускорением должно сопровождаться излучением электромагнитных волн, причем частота этого
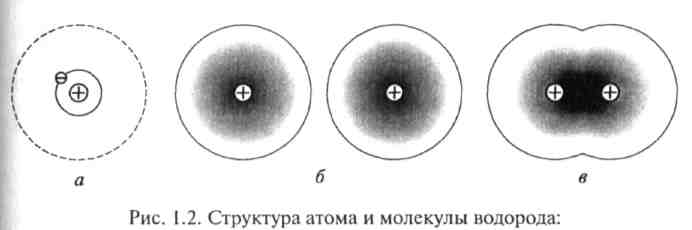
а —простейшая планетарная модель атома водорода (пунктиром показана разрешенная орбита электрона в возбужденном состоянии); б, в —квантово-механическая модель электронной структуры двух уединенных атомов водорода и молекулы водорода соответственно
монохроматического излучения должна соответствовать частоте вращения. Результатом излучения должно быть уменьшение энергии электрона и превращение круговой траектории движения в спираль. Конечным итогом такого процесса является падение электрона на ядро.
Чтобы устранить противоречия планетарной модели, Н.Бор постулировал квантовые условия для движения электронов в атоме. В соответствии с постулатом Бора стабильны только такие круговые орбиты, для которых момент количества движения оказывается кратным постоянной Планка h = h/(2n):
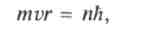
где п —главное квантовое число, п = 1, 2, 3, ...; h —постоянная Планка,
h = 6,62 •-34 Дж •с.
Исходя из этого условия легко определить те энергетические уровни и радиусы стационарных орбит, которые может иметь электрон в атоме:
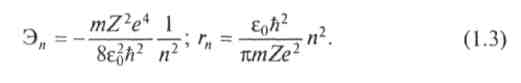
Из формулы (1.3) следует, что энергия электронов в атомах должна быть квантованной, т.е. электроны могут занимать лишь вполне определенные энергетические уровни, находясь на которых они не излучают и не поглощают энергии. Все процессы излучения и поглощения энергии атомом связаны с переходами электронов с одного разрешенного уровня на другой, с одной стационарной орбиты на другую. Дискретный характер энергетических состояний электронов в атомах подтверждается многочисленными экспериментами по изучению спектров излучения и поглощения света различными газами, находящимися в атомарном состоянии.
Вследствие ступенчатых переходов электронов с уровня на уровень оптические спектры уединенных атомов оказываются линейчатыми, т. е. представляют собой набор узких спектральных линий. Фактически каждый такой спектр является «паспортом» атомов, с помощью которого можно отличить один химический элемент от другого. На этом принципе основано определение состава веществ методом эмиссионной оптической спектроскопии.
На рис. 1.3 в качестве примера приведена схема энергетических уровней атома водорода. Положение уровней на энергетической шкале дополнено их спектроскопическими обозначениями. Заселенность третьего энергетического уровня соответствует возбужденному состоянию атома. Возвращение электрона в основное состояние может произойти либо одним скачком, либо путем последовательных переходов с задержкой на промежуточных уровнях (оба случая показаны на рис. 1.3). При переходах излучаются фотоны с энергией, определяемой разностью в положении соответствующих уровней.
По мере возрастания главного квантового числа п увеличивается плотность расположения уровней на энергетической шкале. Соответственно уменьшается дискретность энергии и поведение электрона приближается к классическому. Значение п = °° определяет границу между сплошными и дискретными состояниями. Переход электрона в область состояний со сплошным энергетическим спектром означает его отрыв от атома с некоторой кинетической энергией, т.е. ионизацию атома. Энергия ионизации определяется глубиной залегания основного состояния относительно сплошного спектра. Как видно из рис. 1.3, для атома водорода Э1 = -13,6 эВ. Этому состоянию соответствует радиус электронной орбиты а0= 0,53- 10~10 м, который в физике принято называть боровским радиусом.
Открытие волновых свойств у элементарных частиц и создание квантовой механики повлекли за собой изменение представлений о движении электронов. При квантово-механическом описании
поведения электрона в атоме оперируют с отрицательным зарядом, диффузно распределенным в пространстве, т.е. «размазанным» вокруг ядра, как показано на рис. 1.2, б. Понятие орбиты заменяется в квантовой механике волновой функцией стационарного состояния. Квадрат модуля волновой функции определяет усредненную по времени вероятность обнаружения частицы в различных точках пространства. Исходя из волновой природы микрочастиц можно непосредственно придти к выводу о дискретности энергетического спектра электронов в атомах без каких-либо дополнительных постулатов и условий. В частности, решение уравнения Шредингера для движения электрона в центральном поле приводит к тем же собственным значениям энергии электронов в атоме водорода, какие были получены на основе постулатов Бора (см. формулу (1.3)). Учитывая волновые свойства частиц при оценке стабильности электронных состояний в атомах, постулат Бора можно переформулировать следующим образом: в атоме разрешенными являются лишь те электронные орбиты, на длине которых укладывается целое число длин волн де Бройля (А. = h/(mv)).
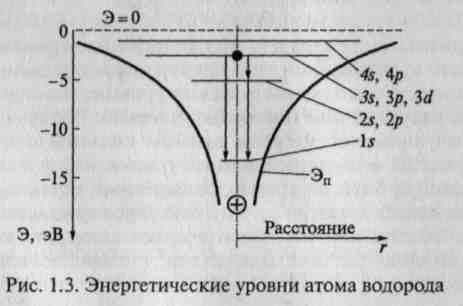
Заселение электронных состояний в атомах начинается с самых низких энергетических уровней, затем заполняются более высокие, а верхние уровни остаются свободными и соответствуют возбужденному состоянию атома. В квантовой теории атома каждое электронное состояние описывается набором четырех квантовых чисел. Как уже отмечалось, главное квантовое число п определяет энергию электрона. Совокупность электронов, обладающих одинаковым значением главного квантового числа, называют электронной оболочкой. Состояниям с квантовыми числами п = 1, 2, 3, 4, 5, 6, 7 присвоены буквенные обозначения К, L, М, N, О, Р, Q. В свою очередь, оболочки подразделяются на подоболочки, отличающиеся значением азимутального квантового числа /. Последнее определяет орбитальный (вращательный) момент количества движения электрона в соответствии с формулой
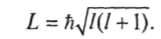
Квантовое число / может принимать одно из следующих значений:
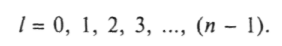
В атомной физике применяются заимствованные из спектроскопии буквенные обозначения квантовых состояний с различными l:
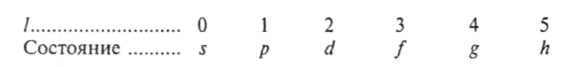
В спектроскопических обозначениях электронных состояний в атоме первая цифра всегда указывает главное квантовое число.
Поскольку азимутальное число / всегда меньше п, возможна следующая последовательность состояний электронов:
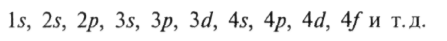
Если атом находится в магнитном поле, направление которого совпадает с осью Z, то проекция момента количества движения на эту ось 7тоже принимает дискретные значения, характеризуемые магнитным квантовым числом т:
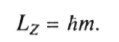
Поскольку проекция не может быть больше величины самого момента L, должно выполняться условие т < l, т.е. магнитное квантовое число может принимать значения 0, ±1, ±2, ±3, ... ±l.
Наряду с азимутальным вращением электрон вращается вокруг собственной оси. Представление электрона в виде волчка безусловно является огрубленным, но оно позволяет наиболее доступным способом интерпретировать смысл четвертого квантового числа. Собственный момент количества движения электрона Ls и его проекция LSZ заданное направление Z также оказываются квантованными величинами. Проекция спина может принимать значения, отличающиеся друг от друга на величину постоянной Планка:
LSZ = ћs
где s —спиновое квантовое число, s = ±1/2.
Число электронов z в каждой полностью заполненной оболочке определяется выражением
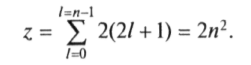
Для полностью заполненной оболочки характерно равенство суммарного орбитального и суммарного спинового моментов.
Поведение частиц с полуцелым спиновым квантовым числом, какими являются электроны, подчиняется принципу Паули (правило запрета). Согласно этому принципу в атоме (или в какой-либо другой квантовой системе) не может быть даже двух электронов, обладающих одинаковой совокупностью четырех квантовых чисел. Иными словами, в одном энергетическом состоянии может находиться только один электрон. В общем случае на энергетическом уровне могут находиться два электрона, но эти электроны будут различаться направлением проекции спинового момента. Принцип Паули дает объяснение периодической повторяемости свойств атомов, относящихся к различным химическим элементам.
Химические свойства атомов определяются в первую очередь числом электронов внешней оболочки и энергией их связи с атомом. Электроны, находящиеся во внешней оболочке, называются валентными
Основные виды химической связи
Если при уменьшении расстояния между атомами энергия системы понижается по сравнению с суммарной энергией изолированных атомов, то между атомами возникает сила притяжения. Устойчивая структура образуется в том случае, когда силы притяжения уравновешиваются силами отталкивания. При этом силы притяжения препятствуют удалению частиц друг от друга, а силы отталкивания противодействуют их слиянию. Притяжение между частицами сопровождается уменьшением потенциальной энергии притяжения системы Эпр. При малых расстояниях преобладают силы отталкивания между одноименными зарядами соседних атомов. Силы отталкивания, обусловленные взаимодействием ядер, играют основную роль при сближении легких атомов, ядра которых сравнительно слабо экранированы электронными оболочками. Во всех других случаях преобладает отталкивание электронов соседних атомов, причем природа этого отталкивания связана не столько с кулоновским взаимодействием, сколько с принципом запрета Паули. Действительно, перекрытие электронных облаков двух близко расположенных атомов приведет к тому, что число электронов в каждой из взаимодействующих оболочек превысит допустимую квоту, определяемую принципом Паули. Поэтому такой процесс может происходить в том случае, если избыточные электроны займут свободные состояния с более высокой энергией. В результате увеличивается полная энергия системы, что эквивалентно появлению сил отталкивания.
За нулевой уровень отсчета потенциальной энергии принимают уединенное состояние атомов, когда они бесконечно удалены друг от друга. В этом случае при сближении атомов потенциальная энергия отталкивания Эот оказывается положительной. На рис. 1.4 показан характер изменения потенциальной энергии при сближении двух взаимодействующих атомов. Возрастание энергии отталкивания при уменьшении расстояния между атомами приближенно можно описать степенной функцией следующего вида:
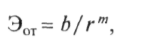
где b —некоторая константа; 6 < т < 12.
Результирующая функция Э(г), определяемая суммой обеих составляющих потенциальной энергии, проявляет отчетливый минимум при r = r0, который соответствует устойчивой атомной конфигурации. Глубина этого минимума Э0 характеризует энергию связи взаимодействующих атомов. В точке r = r0 равнодействующая всех сил равна нулю.

Энергия и тип химической связи зависят от строения валентных оболочек, полноты заселенности их валентными электронами. В общем случае валентными могут быть электроны не только внешней, но и предшествующей оболочки. Вместе с тем электроны внутренних полностью заполненных оболочек прочно связаны с ядром и в образовании химических связей не участвуют.
В элементарных веществах различают три основных вида химической связи: ковалентную (гомеополярную), металлическую и молекулярную (связь Ван-дер-Ваальса). В химических соединениях и растворах (жидких и твердых) часто реализуется ионная (гетерополярная) связь.
Ковалентная связь. Эта связь образуется путем спаривания валентных электронов соседних атомов при перекрытии электронных оболочек. Обобществленные электроны заполняют внешнюю электронную оболочку каждого из взаимодействующих атомов с образованием устойчивой электронной конфигурации, которая подобна электронной структуре атомов инертных газов. Поэтому число связей, образуемых каждым атомом, определяется дефицитом электронов во внешней оболочке, необходимых для ее полного заселения. Наиболее ярким примером ковалентной связи является объединение в молекулу двух атомов водорода. Схема такой молекулы показана на рис. 1.2, в.
Следует отметить, что перекрытие электронных облаков, приводящее к обобществлению электронов, не сводится к простому наложению друг на друга двух электронных орбиталей, а сопровождается существенным перераспределением плотности электронного заряда и соответствующим изменением энергии системы. В частности, при обобществлении электронов происходит втягивание электронных облаков в пространство между ядрами. Появление состояния с повышенной плотностью электронного заряда в межъядерном пространстве и приводит к появлению сил притяжения.
В основе ковалентной связи лежит обменное электронное взаимодействие, которое имеет чисто квантовую природу. Чем больше степень перекрытия электронных оболочек, тем больше энергия обменного взаимодействия, тем сильнее химическая связь. Характер обменного взаимодействия существенно зависит от направления спинов электронов, участвующих в образовании связи между атомами. Устойчивое состояние системы реализуется лишь при антипараллельной ориентации спинов спариваемых электронов.
Ковалентная связь возникает не только между одинаковыми атомами, но и между атомами различных элементов. Молекулы с ковалентными связями подразделяются на полярные и неполярные, которые по-разному ведут себя в электрическом поле. В общем случае следует отличать полярность молекулы в целом от полярности содержащихся в ней связей. Для двухатомных молекул эти понятия совпадают, причем при взаимодействии двух атомов различной природы ковалентные связи практически всегда полярны. В этом случае максимум плотности электронного заряда смещается в сторону более металлоидного атома.
Неполярные молекулы обладают центром симметрии, и благодаря симметричному распределению зарядов у них отсутствует электрический момент при отсутствии внешнего поля. При этом неполярная молекула может быть построена исключительно с помощью полярных связей. В полярных молекулах, называемых диполями, центры противоположных по знаку зарядов находятся на некотором расстоянии /друг от друга. Это расстояние называют плечом диполя. Важнейшей характеристикой полярной молекулы является дипольный (электрический) момент, под которым понимают произведение заряда на плечо:
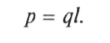
В типичных случаях дипольный момент молекул имеет значение 10-30... 2•-29 Кл•м.
Если в образовании ковалентной связи участвуют только электроны в s-состоянии, то все направления связи оказываются равноценными вследствие сферической симметрии электронных облаков. Однако ситуация изменяется, когда связи образуются с помощью электронов p- или d-состояний. В этом случае распределение электронной плотности имеет вид вытянутых орбиталей гантелевидной формы, т.е. сильно зависит от направления. Ярко выраженную направленность приобретают и ковалентные связи. Они реализуются в тех направлениях, которые обеспечивают наибольшее перекрытие электронных облаков.
Направленность ковалентных связей характеризуется валентными углами, при этом речь идет о средних углах между связями, так как атомы в молекуле находятся в непрерывном движении, совершая примерно 1013 колебаний в секунду. Поэтому в каждый момент времени истинный угол может быть различным, например у молекул воды средний валентный угол равен 104,5°.
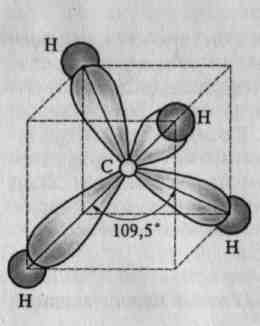
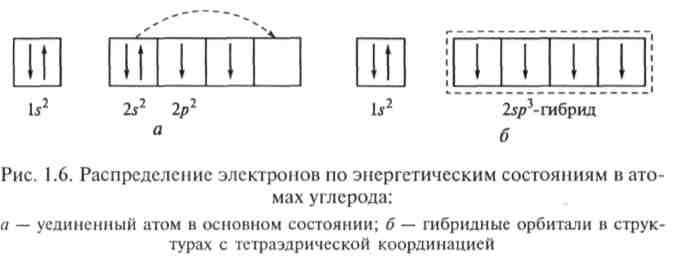
Для молекул с тетраэдрической симметрией характерным является угол связи 109,5°. Ярким примером такой структуры может служить молекула метана СН4, в которой атом углерода образует четыре ковалентные связи с водородным окружением (рис. 1.5). Вместе с тем в исходном состоянии атом углерода имеет лишь два неспаренных электрона во внешней p-оболочке (рис. 1.6, а). Однако следует учитывать, что при образовании молекулы атомы могут возбуждать друг друга и производить «распаривание» некоторых электронов. В частности, в рассматриваемом случае при образовании молекулы СН4 один из электронов атома углерода вследствие возбуждения переходит из 25-состояния в свободную 2р-ячейку, как показано на рис. 1.6, б. В результате такого перехода в атоме углерода возникает четыре электрона с некомпенсированными спинами, которые способны участвовать в образовании четырех sp3-гибридных ковалентных связей.
Гибридизация валентных электронов углеродного атома сопровождается искажением их электронных облаков. Вместо конфигураций, свойственных s- и р-состояниям, облака каждого электрона при sp3-гибридизации приобретают резко асимметричную форму, вытянутую в одну сторону от ядра атома и одинаковую для всех четырех электронов (см. рис. 1.5). Аналогичная картина наблюдается в кристаллических веществах с тетраэдрической координацией атомов. К их числу относятся алмаз, кремний, германий и карбид кремния SiC. Структура алмаза показана на рис. 1.7, из которого видно, каким образом каждый атом образует четыре связи со своими ближайшими соседями. Ковалентная связь характерна для многих органических полимеров, основу которых составляют цепочки из атомов углерода.
Ковалентная связь характеризуется высокой прочностью, что подтверждается высокой твердостью и высокой температурой плавления таких веществ, как алмаз и карбид кремния. Внутримолекулярные связи в органических молекулах также достаточно прочны, а низкие температуры плавления и низкая механическая прочность органических полимеров являются следствием межмолекулярных сил, которые не являются ковалентными.

Ионная связь. Эта связь возникает вследствие перехода валентных электронов от металлического атома к металлоидному и электростатического притяжения разноименно заряженных ионов друг к другу. Этот вид химической связи наиболее характерен для ионных кристаллов. В ионном кристалле комбинации противоположно заряженных ионов нельзя отождествлять с индивидуальными молекулами вследствие регулярного чередования в узлах решетки ионов различного сорта. Правильнее рассматривать весь монокристалл ионного соединения как одну гигантскую молекулу, в которой каждый ион испытывает сильное воздействие со стороны всех соседних ионов.
Способность атомов захватывать или отдавать электрон при образовании химических связей характеризуется их электроотрицательностью. За приближенную меру электроотрицательности атома принимают полусумму энергии ионизации Эи и энергии сродства к электрону Эс, т. е.
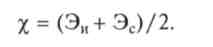
При этом энергией сродства к электрону называют
то количество энергии, которое выделяется в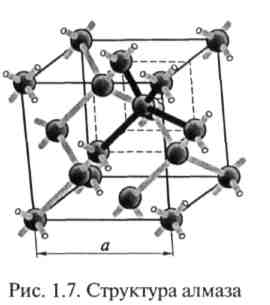
случае
присоединения электрона к нейтральному атому.
Наименьшей электроотрицательностью характеризуются
атомы щелочных металлов, которые легко отдают
электрон (малая Эи) и в то же время имеют малое
электронное сродство. Наоборот, наибольшей
обладают атомы галогенов, которые легко
принимают электрон для завершения
внешней оболочки. Чем больше разность
электроотрицательностей атомов, участвующих в образовании химической связи,
тем больше степень ионности соединения.
В результате передачи и присоединения электронов каждый из взаимодействующих ионов создает оболочку с устойчивой электронной конфигурацией, которая соответствует структуре оболочки атома инертного газа, ближайшего по расположению в Периодической системе элементов Д. И. Менделеева.
Атомы инертных газов имеют замкнутые электронные оболочки и распределение заряда в них характеризуется сферической симметрией. Поэтому катионы и анионы тоже можно рассматривать как правильные сферы разных размеров, причем катионы, отдающие электроны, как правило, обладают меньшими размерами и располагаются в междоузлиях, образованных при плотной упаковке более крупных шаров —анионов. Сферическая симметрия электростатического поля обусловливает отсутствие направленности ионной связи.
Число ближайших соседей, окружающих данный ион в кристаллической решетке, называют координационным числом К. В случае кулоновского взаимодействия каждый катион стремится окружить себя максимальным числом анионов, т.е. образовать структуру с возможно более высоким координационным числом. В этом проявляется ненасыщенность ионной связи и ее принципиальное отличие от ковалентной. Структура ионных кристаллов, а следовательно, и значения координационных чисел зависят от соотношения размеров катиона rк и аниона ra. Условию устойчивости структуры соответствует такое соотношение радиусов частиц rK/ra, при котором каждый ион соприкасается с ионами противоположного знака. Координационное число K 'возрастает с увеличением размера катиона, т.е. по мере приближения соотношения rK/ra к единице. Для кристаллических структур с определенным значением К существуют пределы устойчивости, определяемые геометрическим фактором. Предельным является такое соотношение ионных радиусов, при котором соприкасаются между собой не только разноименные ионы, но и ионы с одинаковым зарядом. Далее указаны допустимые диапазоны изменения отношения rK/ra для ионных кристаллов с различным координационным числом:
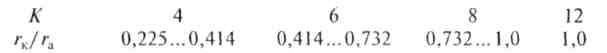
При одинаковых размерах ионов координационное число может достигать 12, как это имеет место у металлов, кристаллизующихся в структурах плотной кубической или гексагональной упаковки.
Металлическая связь. Эта связь существует в системах, построенных из положительных атомных остовов, находящихся в среде свободных коллективизированных электронов (рис. 1.8). Притяжение
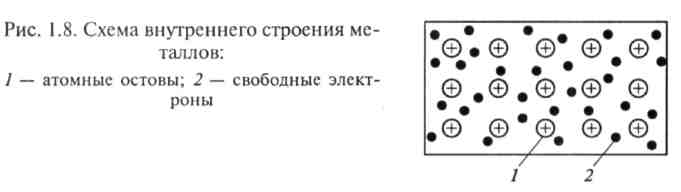
между положительными атомными остовами и электронами обусловливает целостность металла.
Металлическую связь можно рассматривать до некоторой степени как ковалентную связь, поскольку в основе этих связей лежит обобществление внешних валентных электронов. Специфика металлической связи состоит в том, что в обобществлении электронов участвуют все атомы кристалла и обобществленные электроны не локализуются вблизи своих атомов, а свободно
перемещаются внутри всей решетки, образуя электронное облако. Последнее оказывает «цементирующее» действие на кристалл, объединяя в единую систему всю совокупность одноименно заряженных ионов.
Под влиянием двух противоположных сил: «стягивающего» действия коллективизированных электронов и сил отталкивания между ионами —последние фиксируются на некотором равновесном расстоянии друг от друга, соответствующем минимуму потенциальной энергии системы.
Металлические связи являются ненасыщенными и ненаправленными. Отсутствие направленности связей экспериментально подтверждается равномерным распределением заряда валентных электронов по объему металлических кристаллов. Об отсутствии насыщения связей в металле свидетельствует тот факт, что число связей у каждого атома существенно превышает число валентных электронов. Кроме того, атомы металлов обладают способностью образовывать твердые растворы большой концентрации с элементами самой различной валентности.
В системах с ненасыщенными связями проявляется тенденция к формированию структур с максимально высокими координационными числами. Действительно, большинство чистых металлов имеют структуру, соответствующую наиболее плотной шаровой упаковке кубического или гексагонального типа (К= 12), либо ближайшую к ним по плотности структуру объемно-центрированного куба (К= 8).
Из-за больших межатомных расстояний металлическая связь характеризуется меньшей энергией в сравнении с ковалентной и ионной связями. Не имея локализованных связей, металлические кристаллы не разрушаются при изменении положений атомов, т.е. им свойственна пластичность (ковкость) при деформациях.
Благодаря наличию свободных электронов металлы обладают высокой электро- и теплопроводностью.
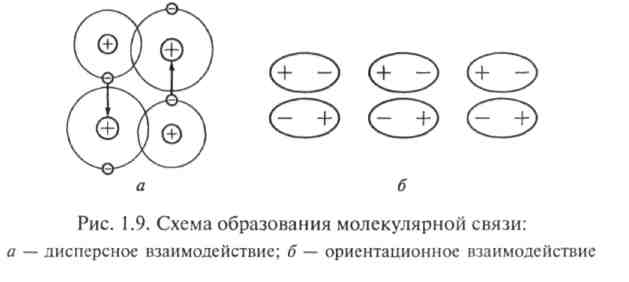
Молекулярная связь (связь Ван-дер-Ваальса). Эта связь наблюдается у ряда веществ между молекулами с ковалентным характером внутримолекулярного взаимодействия. Существование межмолекулярного притяжения в этом случае объясняется согласованным движением валентных электронов в соседних молекулах, благодаря которому возникает упорядоченная система мгновенных электрических моментов (диполей). Взаимодействие между ними способствует понижению потенциальной энергии молекул. В любой момент времени электроны должны быть максимально удалены друг от друга и максимально приближены к положительным зарядам (ядрам). Тогда силы притяжения валентных электронов ядром соседней молекулы оказываются сильнее взаимного отталкивания электронных оболочек этих молекул (рис. 1.9, а). Подобное притяжение между флуктуирующими диполями получило название дисперсионного взаимодействия.
Если молекулы обладают постоянным электрическим моментом, т.е. являются диполями от природы, то между ними возникает электростатическое взаимодействие, стремящееся расположить молекулы в строгом порядке (рис. 1.9, б), которому соответствует минимум потенциальной энергии системы. Такой тип взаимодействия полярных молекул, зависящий от их ориентации, называют ориентационным.
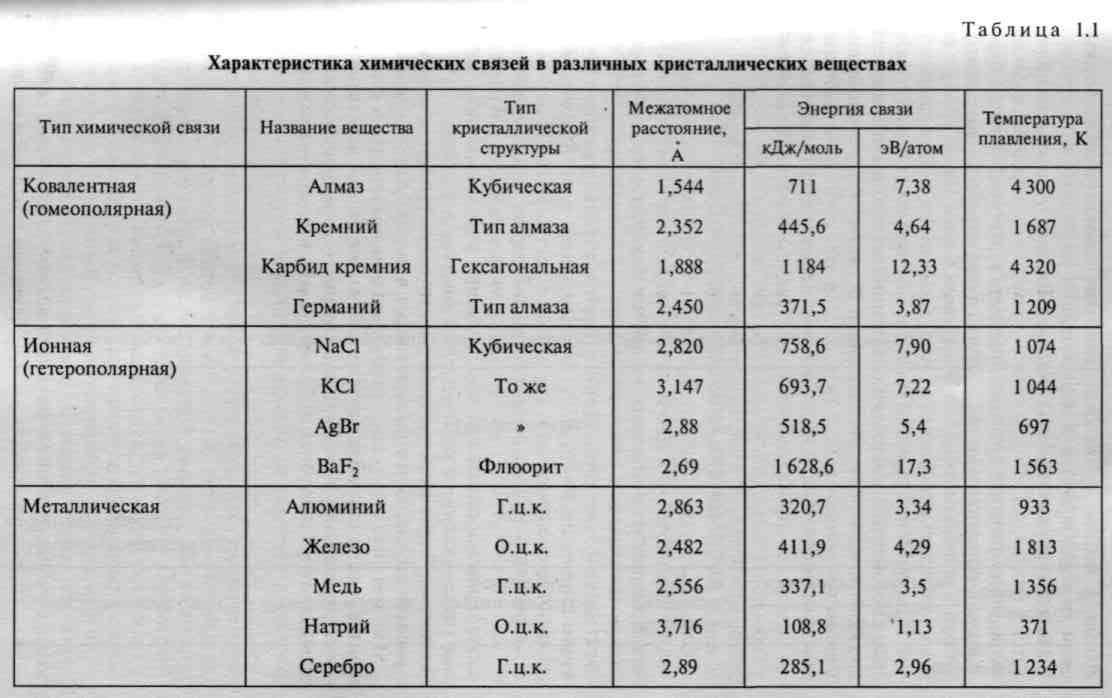
Связь Ван-дер-Ваальса является наиболее универсальной среди всех видов связей. Она возникает между любыми частицами, но это наиболее слабая связь, ее энергия примерно на два порядка меньше энергии ионной и ковалентной связей (табл. 1.1). В подавляющем большинстве случаев на молекулярную связь накладываются другие, более сильные виды взаимодействия частиц.
В явном виде связь Ван-дер-Ваальса обнаруживается в молекулярных кристаллах, образуемых молекулами с насыщенными связями. Примерами таких веществ могут служить кристаллы предельных углеводородов (СН4, С2Н6, С19Н40 и т.п.). Молекулярная
связь легко разрушается тепловым движением частиц. Поэтому молекулярные кристаллы обладают низкими температурами плавления (например, у парафина состава С19Н4о температура плавления Tпл = 50 °С).
При дисперсионном взаимодействии отсутствуют какие-либо ограничения на направления связей. Для молекулярных кристаллов с таким видом связей характерны плотноупакованные структуры с максимально возможным числом ближайших соседей (z = 12) вокруг каждой структурной единицы (атома или молекулы). Наиболее яркими примерами веществ, в которых дисперсионное взаимодействие оказывается определяющим, являются кристаллы инертных газов (Ne, Ar, Kr, Xe и др.). Для атомов с целиком заполненными электронными оболочками исключается сама возможность существования других механизмов связи.
Лекция № 2
Особенности строения твердых тел
Элементы зонной теории твердого тела
Особенности строения твердых тел
Большинство материалов, применяемых в электронике, в нормальных условиях находятся в твердом агрегатном состоянии. Твердые тела подразделяют на кристаллические и аморфные, существенно различающиеся по внутреннему строению и свойствам. Многие вещества в зависимости от условий их получения могут находиться как в кристаллическом, так и в аморфном состояниях. Кристаллические вещества, как правило, более управляемы и предсказуемы по физическим свойствам.
Все основные успехи твердотельной электроники и микроэлектроники связаны с применением различных кристаллических материалов и, прежде всего, полупроводниковых монокристаллов, освоение которых привело к качественному преобразованию элементной базы электронной техники.
Кристаллы. Анизотропия и симметрия физических свойств являются наиболее характерными особенностями кристаллов, обусловленными симметрией их внутреннего строения. При описании внутренней структуры кристаллов обычно пользуются понятием кристаллической решетки.
Последняя представляет собой регулярную пространственную сетку, узлам которой соответствуют атомы, ионы или молекулы, образующие кристалл. В периодической решетке всегда можно выделить элементарную ячейку, транслируя которую в пространстве легко получить представление о структуре всего материала.
В анизотропной кристаллической среде удобно ориентироваться с помощью трехмерной системы координат, выбираемой в соответствии с симметрией кристалла. В общем случае это косоугольные координаты с неодинаковыми масштабными отрезками по осям: аbc ; 90°.
Направления кристаллографических осей координат соответствуют направлениям ребер элементарной ячейки, а масштабные отрезки по осям —длинам этих ребер. Решетка, построенная путем параллельного переноса (трансляции) какого-либо узла по трем направлениям, называется трансляционной решеткой.
Применяемые в электронике кристаллические материалы могут существовать как в форме крупных монокристаллов или достаточно тонких монокристаллических слоев, нанесенных на подложку, так и в виде поликристаллических веществ, представляющих собой совокупность большого числа сросшихся друг с другом сравнительно мелких кристаллических зерен (кристаллитов). При этом под монокристаллом понимают однородное твердое тело периодического строения без явных макродефектов структуры, вызывающих нарушение дальнего порядка в расположении атомов, ионов или молекул. В случае поликристалла в пределах каждого зерна также сохраняется упорядоченность структуры, однако регулярное расположение частиц нарушается на границах раздела, при переходе от одного зерна к другому. Фактически граница между зернами представляет собой переходной слой толщиной 1 ...5 нм. Вследствие хаотической ориентации зерен в поликристаллических веществах отсутствует анизотропия физических свойств. Вместе с тем с помощью специальных методов обработки (прокатка, протяжка, воздействие внешних полей и др.) могут быть получены текстурованные материалы с ориентированным расположением кристаллитов.
При описании анизотропных свойств монокристаллов и при структурном анализе возникает необходимость индицировать кристаллографические плоскости и направления. Наиболее часто для этой цели используется система индексов Миллера.
Индексы Миллера. Использование этих индексов позволяет реализовать универсальный подход при индицировании плоскостей любых кристаллических многогранников и структур независимо от их симметрии. Выберем систему координат, оси которой совпадают с направлением ребер элементарной ячейки. Пусть масштабные единицы на осях соответствуют длине периодов трансляции a, b и с, т. е. длине ребер ячейки. Положение любой плоскости в пространстве определяется тремя точками. В выбранной системе координат удобно в качестве трех опорных узлов взять точки пересечения заданной плоскости с осями X, Y, Z (рис. 1.10). Обозначим отрезки ОА, ОВ и ОС (выраженные в единицах периодов трансляции) через H, K и L, а обратные им величины —через H0, K0 и L0. Наименьшие целые числа с теми же соотношениями, что и между H0, K0 , L0, принято обозначать символами h, к, l. Их и называют индексами Миллера. Поскольку по всем осям периоды трансляции приняты за единицу, атомные плоскости определяются совокупностью целых чисел. Если значения H, К, L равны,
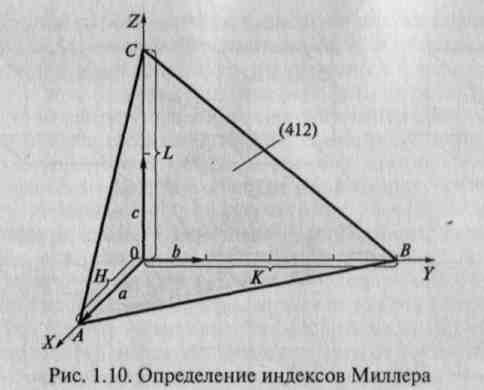
например, числам 1, 4 и 2 соответственно, то обратные им величины H0, К0, L0 составят 1, 1/4 и 1/2. Таким образом, индексы Миллера для данной кристаллографической плоскости следует представлять в виде (412).
В случае когда индицируемая плоскость параллельна какой-либо из координатных осей, индекс, соответствующий этой оси, обращается в нуль. Так, в кубических кристаллах плоскость (011) параллельна оси X, а плоскость (100) одновременно параллельна осям Y и Z. При отрицательных координатах узловых точек A, В или С отвечающие им индексы Миллера также становятся отрицательными, однако знак «минус» ставят не_ впереди индекса, а над ним. Например, грани куба (100) и (100) ориентированы параллельно друг другу, но расположены по разные стороны относительно плоскости YZ.
Для описания кристаллографических направлений применяются индексы в виде набора наименьших целых чисел, относящихся между собой как проекции вектора, параллельного данному направлению. В отличие от обозначений плоскостей индексы направлений заключаются в квадратные скобки. В кубических кристаллах направления и плоскости с одинаковыми индексами взаимно-перпендикулярны друг другу. Например, положительное направление оси Синдицируют как [100], оно является нормалью к плоскости (100). Положительное направление оси Y обозначают символом [010], отрицательное направление оси Z —[001], диагональ куба —[111] и т.д. Примеры индицирования кристаллографических плоскостей и направлений в кубической решетке сгруппированы на рис. 1.11. В кристаллах более низкой симметрии ортогональность плоскостей и направлений с одинаковыми индексами, как правило, не соблюдается.
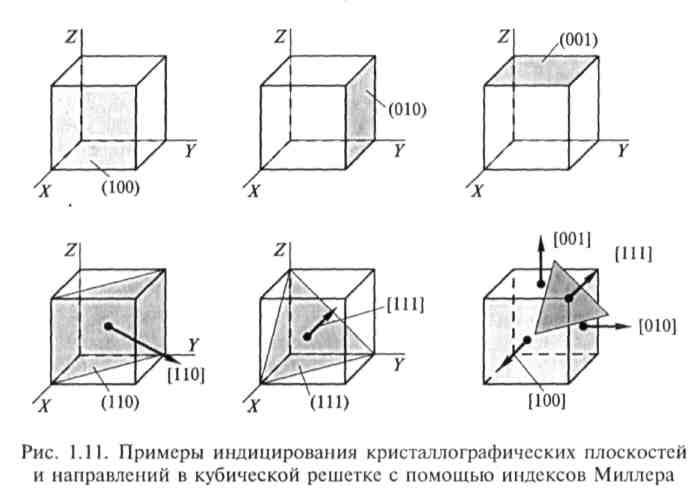
Некоторые плоскости, различающиеся по индексам Миллера, оказываются эквивалентными в кристаллографическом и физическом смыслах в соответствии с симметрией кристалла. Например, в кубических решетках эквивалентными являются грани (100), (010), (001), (100), (010) и (001). Семейство эквивалентных плоскостей принято обозначать символом, заключенным в фигурные скобки, например {100} или {111}. Последнее семейство включает в себя восемь плоскостей, образующих при пересечении правильный октаэдр. Плоскости с большими индексами Миллера характеризуются меньшей плотностью заселения атомами (ретикулярной плотностью) и меньшими межплоскостными расстояниями.
Дефекты в строении твердых тел. Кристаллы с идеально правильным строением в природе не существуют. В реальных структурах всегда наблюдаются те или иные отклонения от регулярного расположения частиц. Такие отклонения принято называть дефектами структуры.
Идеальная периодичность структуры кристалла нарушается прежде всего тепловыми колебаниями атомов. Последние принято рассматривать как систему взаимно связанных вибраторов со спектром колебаний от акустических до инфракрасных частот. Амплитуда колебаний частиц тем больше, чем сильнее разогрет кристалл. При температурах, близких к точке плавления, амплитуды колебаний могут достигать
... 12 % от межатомных расстояний.
По аналогии с фотоном квант энергии тепловых колебаний кристаллической решетки называют фононом. В отличие от фотонов, электронов и протонов фононы относятся к категории квазичастиц, т.е. они не могут существовать сами по себе, например в вакууме, а обязательно требуют наличия материальной среды, носителями движения в которой они являются. С колебаниями атомов кристаллической решетки связаны многие физические явления в твердых телах: термическое расширение, теплопроводность, электропроводность, температурные изменения теплоемкости и упругих свойств кристаллов, особенности оптического поглощения, рекомбинационного излучения и др.
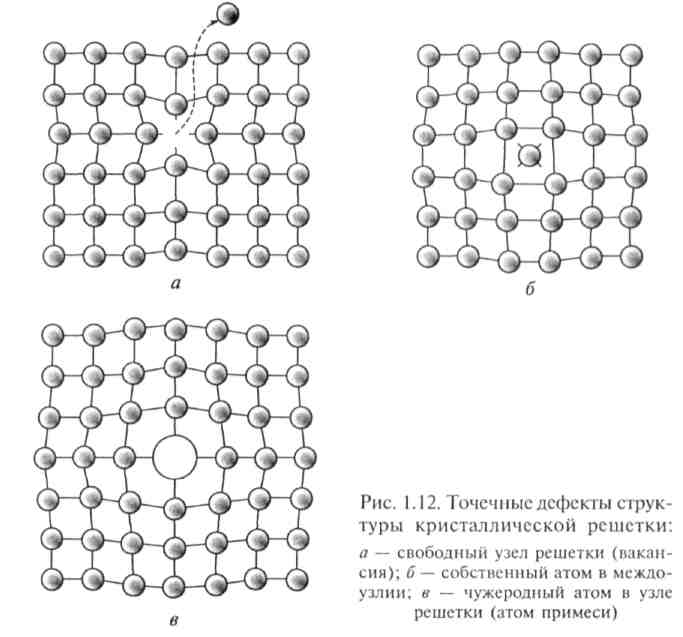
Если фононы трактовать как динамические, т.е. изменяющиеся во времени нарушения периодичности кристаллической решетки, то все прочие нерегулярности структуры можно отнести к разряду статических дефектов. В зависимости от масштабов нерегулярности статические дефекты подразделяются на точечные и протяженные. К точечным дефектам относятся вакансии, т.е. незанятые узлы решетки, атомы в междоузельных позициях и примесные атомы (рис. 1.12). Вакансии могут возникать при переходе атомов из узлов решетки либо на поверхность кристалла, либо в междоузельное пространство. Комбинацию вакансия—междоузельный атом называют дефектом по Френкелю. Вакансии, образуемые при участии поверхности кристалла, называют дефектами по Шоттки. Точечные дефекты, не связанные с наличием примесей, называют собственными. Равновесная концентрация собственных точечных дефектов возрастает при нагревании, так как с повышением температуры увеличивается вероятность теплового освобождения атомов из узлов решетки.
Примеси могут либо замещать атомы основы в узлах кристаллической решетки, либо внедряться в междоузлия. При замещении важную роль играют близость размеров взаимозамещаемых атомов и степень соответствия их электронных оболочек. Современные методы очистки позволяют получать материалы с содержанием примеси на уровне 10-9 %, что соответствует концентрации примесных атомов 1017 м-3. Чтобы образно представить себе степень чистоты такого вещества, отметим, что она эквивалентна загрязнению 4 тыс. т пшеницы одним зерном ячменя.
В кристаллической решетке химических соединений типа АВ выделяют еще один вид локального разупорядочения —антиструктурные дефекты («антисайты»). В этом случае некоторое число атомов А занимают позиции атомов В, или наоборот. Поведение таких дефектов эквивалентно поведению примесей, поскольку собственный атом решетки оказывается в «чужом» узле.
Несмотря на то, что относительная концентрация точечных дефектов в реальных кристаллах, как правило, невелика, их влияние на физические свойства материалов оказывается весьма существенным.
Например, содержание некоторых примесей в количестве тысячных долей атомного процента может вызвать изменение удельного сопротивления полупроводниковых кристаллов в 105... 106раз. Железо, тщательно очищенное от примесей, становится химически инертным веществом и не подвергается коррозии даже в условиях тропической влажности. Ряд металлов, таких как вольфрам, молибден, хром, титан и другие, после глубокой очистки приобретают высокую пластичность, благодаря чему металлы можно раскатывать в тонкую фольгу даже при комнатной температуре.
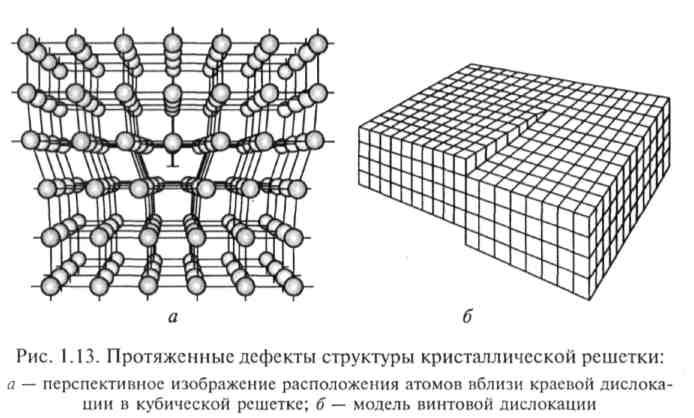
К протяженным дефектам структуры относятся дислокации, границы зерен, трещины, поры, микровключения другой фазы. Под дислокациями понимают особый вид линейных несовершенств в кристаллической решетке, нарушающих правильное чередование атомных плоскостей. Слово «дислокация» в переводе на русский язык означает «смещение». Такие протяженные дефекты возникают в кристалле в результате деформации сдвига. Различают краевые и винтовые дислокации, показанные на рис. 1.13. Для краевой дислокации характерно наличие «лишней» полуплоскости, называемой экстраплоскостью. Край этой полуплоскости является осью дислокации. Вблизи оси наблюдаются наибольшие упругие искажения кристаллической решетки. Ось краевой дислокации всегда перпендикулярна направлению сдвига.
В случае винтовой дислокации кристалл состоит из атомных плоскостей, закрученных вокруг единой оси, и напоминает винтовую лестницу. При этом шаг винтовой спирали равен межплоскостному расстоянию, а ось дислокации параллельна направлению сдвига. Винтовые дислокации играют важную роль в процессе роста кристаллов, определяя один из механизмов зарождения кристаллизации.
Краевые дислокации оказывают сильное влияние на механические свойства кристаллов. Оценки показывают, что в реальных кристаллах критические скалывающие напряжения, определяющие прочность материала к деформациям сдвига, обычно на три-четыре порядка ниже расчетной прочности идеальных кристаллов. Такое снижение прочности объясняется движением дислокаций по плоскостям скольжения. Скольжение осуществляется путем переключения химических связей между соседними атомами под действием относительно слабой внешней нагрузки.
Для увеличения прочности кристаллов используются два пути. Первый из них связан с получением бездефектных кристаллов. С помощью специальных технологических методов удается выращивать бездислокационные кристаллы различных веществ в форме «усов» диаметром до 0,1 мкм и длиной до 10 мм. При отсутствии дислокаций в нитевидных кристаллах становится невозможным их разрушение за счет пластического сдвига. Разработаны высокопрочные композиционные
материалы, состоящие из матрицы, наполненной нитевидными кристаллами.
Второй путь упрочнения реализуется путем генерации различных дефектов, затрудняющих скольжение дислокаций. Для этой цели используют введение примесей, закалку образцов, сильную пластическую деформацию в холодном состоянии (наклеп). Особенно сильное тормозящее действие на дислокации оказывают .границы блоков и микровключения побочных фаз. Таким способом удается повысить предел прочности различных металлов и сплавов в 6 —раз. Наоборот, глубокая очистка кристаллов от примесей и стабилизация их равновесной структуры с типичной плотностью дислокаций 105... 106 см-2 приводят к существенному увеличению подвижности этих дефектов, сопровождающемуся резким возрастанием пластичности материалов. Именно такая закономерность была отслежена в отношении вольфрама, молибдена, титана и ряда других металлов, о чем упоминалось ранее.
Границы между зернами способствуют ускоренной диффузии собственных и примесных атомов в твердом теле. В полупроводниковых поликристаллических веществах межзеренные границы, как правило, играют роль потенциальных барьеров, ограничивающих движение носителей заряда. Поэтому они сильно влияют на удельное сопротивление поликристаллических полупроводников. В случае металлов электрические свойства слабо зависят от поверхностных дефектов, однако при этом могут существенно изменяться механические свойства материалов. В частности, при уменьшении размеров кристаллитов наблюдаются увеличение предела текучести и возрастание вязкости металлов, благодаря чему уменьшается опасность их хрупкого разрушения под действием предельных нагрузок.
Полиморфизм. Некоторые твердые вещества обладают способностью образовывать не одну, а две и более кристаллические структуры, устойчивые при различных температурах и давлениях. Такое свойство материалов называется полиморфизмом, а отвечающие им кристаллические структуры называются полиморфными формами или аллотропными модификациями вещества. Модификацию, устойчивую при нормальной и более низкой температуре, принято обозначать буквой ; модификации, устойчивые при более высоких температурах, обозначаются соответственно буквами , и т.д.
Полиморфизм широко распространен среди технических материалов и имеет важное значение для их обработки и эксплуатации. Классическим примером полиморфизма является низкотемпературное превращение белого олова (-Sn) в серое (-Sn), известное в технике как «оловянная чума».
Практический интерес представляет полиморфизм углерода —существование его в виде алмаза или графита. В обычных условиях графит является более устойчивой модификацией, чем алмаз. Однако при повышении давления устойчивость алмаза растет, а графита падает, и при достаточно высоких давлениях алмаз становится более устойчивым. Если при этом повысить температуру, чтобы увеличить подвижность атомов, то графит можно перевести в алмаз. На этом принципе основано получение искусственных алмазов. В нашей стране их промышленное производство началось в 1961 г. Синтез проводится под давлением порядка 101() Па при температуре на уровне 2 000 °С. Получаемые таким образом искусственные алмазы имеют более высокую прочность и твердость, чем природные кристаллы.
Стекла и другие аморфные тела. Не все твердые тела имеют кристаллическую структуру, хотя кристаллическое состояние большинства твердых тел является естественным, потому что свободная энергия при упорядоченном расположении атомов меньше, чем в случае их нерегулярного расположения, а любая система стремится перейти в состояние с минимальной свободной энергией. Однако атомы не всегда имеют благоприятную возможность располагаться упорядоченно в процессе отверждения. Препятствием этому может быть резкое уменьшение скорости диффузии атомов при охлаждении среды. Твердые тела, которые характеризуются случайным хаотичным расположением частиц, называют аморфными. В отличие от кристаллов аморфные тела изотропны по свойствам, не имеют определенной температуры плавления и характеризуются достаточно широким температурным интервалом размягчения. Наглядным примером аморфных веществ могут служить стекла и многие пластики. В стеклах при отсутствии периодичности в строении можно наблюдать определенный ближний порядок, т.е. закономерное расположение ближайших соседей относительно каждого атома.
Важнейшими факторами, способствующими стеклообразованию, являются наличие сравнительно прочных связей между молекулами или ионами вещества в жидком состоянии и низкая симметрия кристалла и самих частиц, образующих кристалл. Чем более симметрично расположены частицы в кристаллической фазе, тем большее число способов относительного расположения этих частиц в отверждающейся жидкости отвечает их расположению в кристалле. Кроме того, влияет и симметрия самих частиц. В металлах, например, ионы обладают шаровой симметрией, поэтому фактор ориентации частиц при фазовом переходе совсем не играет роли. Кристаллизация металлов со структурами плотнейших упаковок протекает очень легко и перевод их в стеклообразное состояние практически невозможен. В отличие от металлов оксиды кремния и бора образуют низкосимметричные кристаллы, поэтому в расплавах число равноценных относительных положений ионов, отвечающих структуре кристалла, сравнительно мало. Соответственно кинетика кристаллизации оказывается замедлен-
ной, и вероятность образования стекла при охлаждении расплава существенно возрастает.
Стеклообразное состояние можно рассматривать как состояние сильно переохлажденной жидкости, т.е. жидкости с очень высокой вязкостью. Именно высокая вязкость ограничивает диффузионную активность атомов и препятствует образованию кристаллической фазы. Однако такое состояние термодинамически неустойчиво. Поэтому при отжиге может происходить «расстекловывание» материала, т.е. переход в более устойчивое кристаллическое состояние.
Элементы зонной теории твердого тела
Зонная теория является основой современных представлений о механизмах различных физических явлений, происходящих в твердых кристаллических веществах при воздействии на них электромагнитного поля. Зонная теория твердого тела —это теория валентных электронов, движущихся в периодическом потенциальном поле кристаллической решетки.
Электроны в периодическом поле. В квантовой механике движение микрочастиц в поле потенциальных сил описывается с помощью уравнения Шредингера. Потенциальная энергия электрона U(r), движущегося в идеальной кристаллической решетке, рассматривается как периодическая функция, которая обладает трансляционной симметрией. Существует два подхода при решении задачи о движении электрона в периодическом потенциальном поле. Эти подходы различаются выбором нулевого приближения.
В одном из них, называемом приближением слабой связи, в качестве нулевого приближения выбирают волновые функции, описывающие состояния свободного электрона. При этом потенциальная энергия решетки U(r) рассматривается как возмущающий фактор. Моделью слабой связи можно описать поведение электро-нов, энергия которых превышает высоту потенциальных барьеров, разделяющих соседние атомы. Такой энергией могут обладать, например, валентные электроны, включая электроны проводимости в металлах.
Решение уравнения Шредингера для волновых функций слабосвязанных электронов, движущихся в среде со строгой трансляционной симметрией, показывает, что возмущения, вносимые в поведение системы периодическим потенциалом кристаллической решетки, приводят к существенной трансформации спектра стационарных электронных состояний. Это выражается в превращении сплошного энергетического спектра, характерного для свободных электронов, в совокупность чередующихся разрешенных и запрещенных полос энергии. Последние принято называть энергетическими зонами. Значения энергии, принадлежащие запрещенным зонам, не могут быть реализованы в твердом теле. Влияние периодического потенциала решетки зависит как от высоты потенциальных барьеров, так и от энергии электронов. При увеличении энергии электронов разрешенные полосы энергии расширяются, а запрещенные полосы, наоборот, сужаются. В пределе при уменьшении степени связи электронов их энергетический спектр становится непрерывным. Усиление потенциального поля решетки приводит к увеличению высоты запрещенных зон. Физической причиной появления разрывов энергии в спектре электронных состояний является интерференция электронных волн, подобная интерференции рентгеновских лучей в кристаллах.
Качественно к такому же выводу о зонном характере энергетического спектра твердого тела можно прийти исходя из совершенно другой, более наглядной модели. В этой модели, называемой приближением сильной связи, за волновую функцию нулевого приближения выбирают функцию, соответствующую состоянию электронов в изолированных, т.е. Невзаимодействующих атомах, из которых построена кристаллическая решетка. Возмущающим фактором является взаимодействие соседних атомов при их сближении. С помощью такой модели удается правильно описать поведение электронов, энергия которых меньше высоты потенциальных барьеров между атомами.
Пока атомы удалены друг от друга, они обладают дискретными энергетическими спектрами, которые, естественно, будут тождественны, если в систему входят атомы одной природы. При сближении атомов до расстояний порядка 10-10 м (что соответствует межатомным расстояниям в кристалле) происходит перекрытие волновых функций валентных электронов (электронных оболочек), благодаря чему валентные электроны получают возможность переходить от одного атома к другому без изменения энергии, т.е. по механизму квантово-механического туннелирования. В квантовой механике доказывается, что при конечной глубине и ширине потенциальной ямы существует конечная (т.е. отличная от нуля) вероятность обнаружения электрона в области барьера, окружающего потенциальную яму. Чем меньше расстояния между атомами и чем меньше глубина залегания энергетического уровня, характеризующего состояние электрона, тем больше туннельная прозрачность барьеров, разделяющих соседние атомы.
Энергетические зоны. В изолированном атоме электрон пребывает на стационарном уровне Эп сколь угодно долго. При туннельном «просачивании» электронов от одного атома к другому происходит расщепление дискретного энергетического уровня в полосу разрешенных значений энергий шириной ЭN (рис. 1.14), которая связана с временем пребывания электрона т вблизи данного узла решетки соотношением неопределенности
ЭN=ћ
Чем легче туннелируют электроны сквозь барьер, тем шире полоса разрешенных энергий. Таким образом, вероятность туннельных переходов электронов и степень расщепления дискретных уровней в энергетические зоны оказываются тесно связанными между собой, поскольку определяются одним и тем же фактором —степенью перекрытия волновых функций электронов соседних атомов.
В приближении сильной связи каждую разрешенную зону следует считать сформированной из дискретных уровней изолированных атомов. Электроны внутренних атомных оболочек, как правило, не играют активной роли в электрических, оптических и магнитных явлениях, происходящих в твердых телах. Энергия связи таких электронов с ядром обычно составляет десятки электрон-вольт. Это много больше энергии взаимодействия электронов с периодическим полем решетки и с внешними полями. Поскольку внутренние оболочки сильно локализованы вокруг ядра, степень их взаимного перекрытия оказывается слабой, электронный обмен между соседними атомами сильно заторможен. Следствием рассмотренных причин является весьма незначительное «размытие» уровней внутренних электронных оболочек при объединении атомов в твердое тело.
Расщеплению в зону подвержены не только уровни стационарных орбит, занятые электронами в нормальных условиях, но и уровни, соответствующие возбужденным состояниям атомов. Ширина образующихся энергетических зон не зависит от размеров твердого тела и числа атомов, заключенных в нем. Однако она возрастает с увеличением энергии электронного уровня. Это особенно отражается на уровнях возбужденных состояний, расщепление которые бывает столь значительным, что сопровождается перекрытием зон, т.е. разделяющие их зазоры запрещенных значений энергии обращаются в нуль.
При малых межатомных расстояниях, которые реализуются в кристаллической решетке, электронные оболочки взаимодействуют не только со «своими», но и с соседними атомными остовами. В частности притяжение электронов одного атома ядром соседнего понижает высоту потенциального барьера, разделяющего электроны в уединенных атомах. Кроме того, такое кулоновское притяжение уменьшает потенциальную энергию электронов, т.е. вызывает смещение всех электронных уровней, как показано на рис. 1.14. Отмеченное обстоятельство свидетельствует о том, что объединение атомов в кристалл энергетически выгодно.
Каждая разрешенная зона состоит из множества энергетических уровней, определяемого числом атомов, составляющих твердое тело т.е. каждый атом имеет свое «представительство» в каждой энергетическойй зоне. Отсюда следует, что в кристалле конечных размеров расстояние между уровнями обратно пропорционально числу атомов, т. е. зависит от размеров твердого тела. В кристалле объемов в 1см3 содержится 1022... 1023атомов. Экспериментальные данные показывают, что энергетическая протяженность зоны валентных электронов не превышает единиц электрон-вольт. Таким образом, энергетический зазор между уровнями в зоне составляет величину порядка 10-22... 10-23эВ, т.е. разрешенные зоны характеризуются квазинепрерывным спектром. Достаточно ничтожно малого энергетического воздействия, чтобы вызвать переход электронов с одного уровня на другой, если там имеются свободные состояния. Самый нижний и самый верхний энергетические уровни в полосе разрешенных значений принято называть соответственно дном и потолком энергетической зоны.
В результате можно сделать вывод о том, что приближение сильной связи как и модель слабосвязанных электронов, качественно приводит к одному и тому же результату, а именно: к появлению разрешенных и запрещенных зон в энергетическом спектре электронов в кристалле.
Распределение электронов. В соответствии с принципом Паули на каждом энергетическом Уровне может находиться не более двух электронов, причем с противоположным направлением спинового магнитного момента. Поэтому число электронных состояний в зоне оказывается конечным и равным числу соответствующих атомных состояний. Конечным оказывается и число электронов, заполняющих данную энергетическую зону, что играет важную роль в формировании энергетического спектра кристалла.
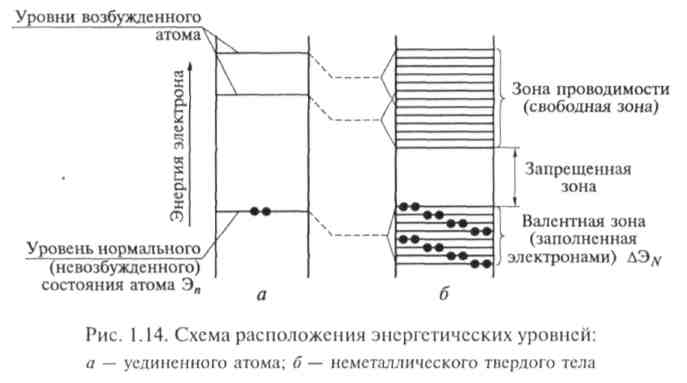
Подобно энергетическим уровням в изолированных атомах энергетические зоны могут быть полностью заполненными, частично заполненными и свободными. Внутренние оболочки в изолированных атомах заполнены, поэтому соответствующие им зоны также оказываются заполненными.
Самую верхнюю из заполненных зон называют валентной зоной. Эта зона соответствует энергетическим уровням электронов внешней оболочки в изолированных атомах. Ближайшую к ней свободную, незаполненную или частично заполненную электронами зону называют зоной проводимости. Взаимное положение этих двух зон определяет большинство процессов, происходящих в твердом теле.
Выводы зонной теории. Характер энергетического спектра у металлических проводников, полупроводников и диэлектриков существенно различен. В металлических проводниках валентная зона заполнена не полностью или перекрывается с зоной проводимости. В полупроводниках и диэлектриках зона проводимости и валентная зона разделены некоторым энергетическим зазором, называемым запрещенной зоной. Формально к полупроводникам относятся вещества, у которых ширина запрещенной зоны менее 3 эВ. Вещества с более широкой запрещенной зоной относятся к диэлектрикам. У реальных диэлектриков ширина запрещенной зоны может достигать 10 эВ. Различия в положении энергетических зон у диэлектриков, полупроводников и металлических проводников показаны на рис. 1.15.
Согласно зонной теории электроны валентной зоны имеют практически одинаковую свободу движения во всех твердых телах независимо от того, являются ли они металлами или диэлектриками. Движение осуществляется путем туннельного перехода электронов от атома к атому. Для объяснения различий в электрических

свойствах материалов надо принять во внимание различную реакцию на внешнее электрическое поле заполненной и незаполненной зон. Внешнее электрическое поле стремится нарушить симметрию в распределении электронов по скоростям, ускоряя электроны, движущиеся в направлении действующих электрических сил, и замедляя частицы с противоположно направленным импульсом. Однако подобные ускорение и замедление связаны с изменением энергии электронов, что должно сопровождаться переходом их в новые квантовые состояния. Очевидно, такие переходы могут осуществляться лишь в том случае, если в энергетической зоне имеются свободные уровни. В типичных случаях добавочная энергия, приобретаемая электронами на длине свободного пробега под действием электрического поля, составляет 10-8... 10- 4 эВ, т.е. намного превосходит расстояние между подуровнями в зоне.
В металлах, где зона не полностью укомплектована электронами, даже слабое поле способно сообщить электронам достаточный импульс, чтобы вызвать их переход на близлежащие свободные уровни. По этой причине металлы являются хорошими проводниками электрического тока.
В полупроводниках и диэлектриках при температуре около 0 К все электроны находятся в валентной зоне, а зона проводимости абсолютно свободна. Электроны полностью заполненной зоны не могут принимать участия в создании электрического тока. Для появления электропроводности необходимо часть электронов перевести из валентной зоны в зону проводимости. Энергии электрического поля недостаточно для осуществления такого перехода, требуется более сильное энергетическое воздействие, например нагревание твердого тела.
Средняя кинетическая энергия тепловых колебаний атомов в кристаллической решетке приблизительно равна (3/2)kТ. При комнатной температуре эта величина составляет около 0,04 эВ, что в общем случае много меньше ширины запрещенной зоны Э. Однако следует иметь в виду, что тепловая энергия неравномерно распределяется между частицами. В каждый момент времени имеется небольшое число атомов, у которых амплитуда и энергия тепловых колебаний значительно превышают среднее значение. В процессе тепловых колебаний атомы взаимодействуют не только друг с другом, но и с электронами, передавая им часть тепловой энергии. Именно в результате таких тепловых флуктуации некоторые из электронов могут перейти из валентной зоны в зону проводимости. Очевидно, чем выше температура и чем меньше запрещенная зона, тем выше интенсивность межзонных переходов. У диэлектриков запрещенная зона может быть настолько велика, что электронная электропроводность не играет определяющей роли.
Эффективная масса носителей заряда. Электроны, находящиеся в зоне проводимости, нельзя считать абсолютно свободными, поскольку они взаимодействуют с периодическим потенциальным полем кристаллической решетки. При математическом описании поведения электронов в зоне проводимости пользуются понятием эффективной массы тп. Эффективная масса не определяет ни инерционных, ни гравитационных свойств электрона. Однако, вводя понятие эффективной массы, можно движение реального электрона в кристалле с массой т0 рассматривать как движение абсолютно свободного электрона. Иными словами, эффективная масса учитывает в неявном виде влияние периодического потенциала решетки на характер движения электрона под действием внешних сил. С ее помощью удается простейшим образом описать процессы переноса заряда и энергии в твердом теле. Значение тп может во много раз отличаться от массы свободного электрона т0. Существует ряд экспериментальных методов определения эффективной массы, среди которых наибольшей надежностью отличается метод циклотронного резонанса.
Эффективная масса тп зависит от степени перекрытия атомных волновых функций. Она сильно возрастает по мере увеличения глубины потенциальной ямы. Чем меньше перекрытие электронных оболочек, тем слабее взаимодействие между соседними атомами, тем труднее ускоряются электроны внешним полем, т.е. увеличивается их эффективная масса.
Эффективная масса электронов зависит также от положения энергетических уровней в зоне. Как правило, она максимальна для состояний, близких к середине разрешенных интервалов энергии. Вблизи потолка энергетических зон и, в частности, вблизи потолка валентной зоны, эффективная масса электронов принимает отрицательное значение. Если тп< О, то ускорение электрона проводимости направлено против действующих на него сил. Но это обстоятельство не свидетельствует о нарушении закона Ньютона, поскольку в уравнениях движения учитывают только внешние силы, действующие на электрон, и не принимают во внимание силы, действующие со стороны периодического поля кристалла.
Электроны валентной зоны могут участвовать в процессе электропроводности лишь при наличии энергетических вакансий в ней. Такие вакансии возникают при каждом акте перехода электронов в зону проводимости. В случае не полностью заполненной валентной зоны ее реакция на внешнее электрическое поле будет выражаться в направленных эстафетных переходах электронов с одного уровня на другой внутри квазинепрерывного спектра. При математическом описании этого процесса сложное коллективное поведение валентных электронов с отрицательной эффективной массой удобно представлять эквивалентным потоком положительно заряженных частиц с положительной эффективной массой. Такие квазичастицы принято называть дырками.
Число дырок равно числу вакансий в распределении плотности состояний для электронов валентной зоны. Поэтому часто в целях упрощения представлений о механизмах электропроводности полупроводников свободные электронные состояния вблизи потолка валентной зоны отождествляют с дырками. Однако при более глубоком рассмотрении явлений под дырками следует понимать квазичастицы, динамические свойства которых тождественны динамическим свойствам совокупности электронов с отрицательной эффективной массой. Вместе с тем следует иметь в виду, что аналогию между электронами и дырками, как носителями заряда в твердом теле, можно распространять до определенных пределов. Дело в том, что электроны, как элементарные частицы с отрицательным зарядом, могут существовать сами по себе, например, в вакууме, а представления о дырках лишаются всякого смысла, если отсутствуют электроны, движущиеся в периодическом поле кристаллической решетки.
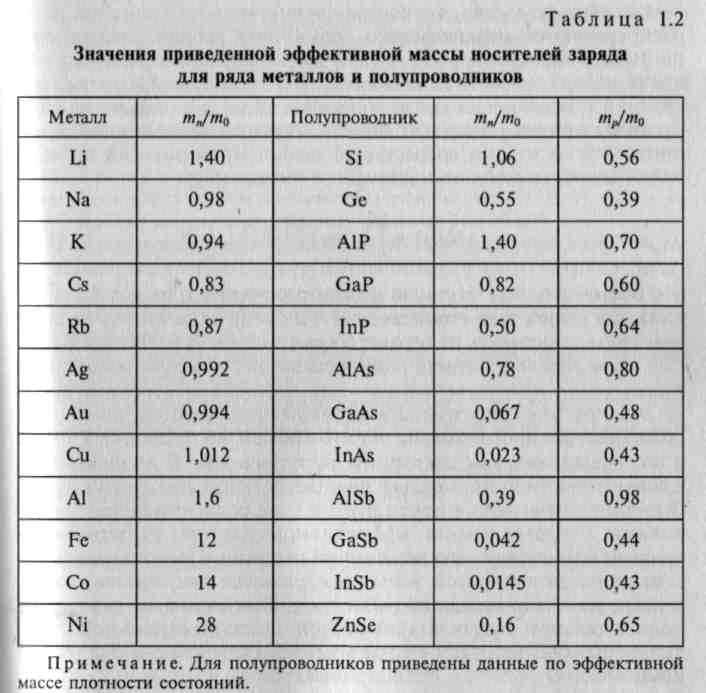
Дырки с минимальной энергией располагаются у потолка валентной зоны и увеличивают свою энергию, перемещаясь в глубину валентной зоны. Иными словами, для дырок и электронов отсчет энергии идет в противоположных направлениях. Поскольку энергетическая протяженность зоны проводимости больше ширины валентной зоны, эффективная масса дырок тр у большинства полупроводников больше эффективной массы электронов тп. В качестве примера в табл. 1.2 приведены сведения об эффективных массах носителей заряда ряда металлов и полупроводников.
Атомы металлов переходной группы содержат незаполненные внутренние электронные оболочки, поэтому соответствующие им энергетические зоны также не заполнены. Однако степень перекрытия внутренних оболочек относительно невелика, в связи с чем эффективные массы электронов для этих металлов оказываются очень большими.
Упрощенная диаграмма, изображенная на рис. 1.14, не учитывает то обстоятельство, что состояния внутри энергетической зоны распределяются неравномерно. Из зонной теории следует, что плотность состояний N(Э) должна быть наибольшей в окрестности середины энергетической зоны. При этом под плотностью состояний понимают их число в единице объема в расчете на единичный интервал энергии. Вблизи нижнего края каждой зоны плотность состояний возрастает с увеличением энергии по корневой зависимости в соответствии с выражением
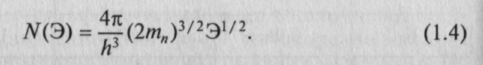
По аналогичной формуле можно рассчитать плотность состояний для дырок валентной зоны N*(Э), если тп заменить на тр, а энергию отсчитывать от верхнего края в глубь валентной зоны.
Таким образом, зонная теория связывает электропроводность твердых тел с наличием частично заполненных электронами энергетических зон. Электроны в целиком заполненной зоне могут обмениваться состояниями, но этот обмен не приводит к переносу заряда, так как электроны неразличимы. В диэлектриках каждая зона либо полностью заполнена, либо абсолютно пуста. Электропроводность в почти пустой зоне осуществляется электронами с определенной эффективной массой, учитывающей влияние периодического потенциала решетки. Проводящие свойства почти заполненной зоны определяются движением дырок, каждая из которых характеризуется положительным зарядом и положительной эффективной массой. Электрический ток в полупроводниках в общем случае имеет электронную и дырочную компоненты.
Различие между электропроводимостями металлов и неметаллов возрастает по мере охлаждения материалов. Наоборот, различие в электрических свойствах двух классов неметаллов —полупроводников и диэлектриков —постепенно сглаживается по мере стремления температуры к абсолютному нулю. Вообще разделение твердых тел на полупроводники и диэлектрики носит в значительной мере условный характер. По мере того, как в качестве полупроводников начинают использовать материалы со все более широкой запрещенной зоной, деление веществ на полупроводники и диэлектрики постепенно утрачивает свой изначальный смысл.
Лекция № 3