ИК-ЛЮМИНИСЦЕНЦИЯ КОМПЛЕКСОВ ЭРБИЯ (III), ИТТЕРБИЯ (III), НЕОДИМА (III)
PAGE \* MERGEFORMAT- 2 -
ИК-ЛЮМИНИСЦЕНЦИЯ КОМПЛЕКСОВ ЭРБИЯ (III), ИТТЕРБИЯ (III),
НЕОДИМА (III)
Курсовая работа
Оглавление
|
[0.1]
[0.2]
Введение
[0.3] 1 Люминесценция лантаноидов (Ш) с органическими лигандами
[0.4] 2 ИК – люминесценция комплексов лантанидов
[0.5] 3 Механизм переноса энергии в комплексах лантанидов.
[0.6] 4. Комплексы неодима, иттербия и эрбия с 8-гидроксихинолином
[0.7] 5. Комплексы с полидентатными лигандами на основе 8-гидроксихинолина
[0.8]
Заключение
[0.9]
Список цитируемой литературы
|
Введение
В начале 1990-х годов, в качестве люминесцентных материалов для электролюминесцентных устройств были предложены ионы лантаноидов, поскольку их металлическая основа обеспечивает длительное линейное излучение, которое может быть рассмотрено почти как монохроматическое. Уникальные свойства проявляют ионы лантаноидов с электронной конфигурацией [Xe] 4fn. 4f-Электроны экранированные электронами 5s и 5p, мало зависят от кристаллического поля или подобных эффектов, в отличие от поведения электронов d-уровня. По этой причине линейное поглощение -излучение спектра на металлической основе не наблюдается. Ионы 4f электронов могут быть размещены на любой из 4f-орбитали, и это дает увеличение для многих спектроскопических условий и энергетических уровней. Лантаноиды, близкие по энергии с f-уровнями (M(III) - Nd, Pr, Ho, Er, Tm, Yb), дают излучение в ИК-области спектра. Излучение ионов Nd3+, Er3+, Yb3+ в ИК-области спектра, в последнее время приобрело большую популярность из-за широкой области применения, в том числе в области телекоммуникаций и биомедицинских анализов. Среди ионов лантаноидов, излучающих в ИК-области спектра, Er3+ играет особую роль в сфере телекоммуникаций, так как он показывает резкое излучение, происходящее в области с длиной волны 1,55 мкм (0,8 эВ), охватывая, таким образом, спектроскопическое окно, в котором стекла оптического волокна показывают высокую прозрачность (так называемые третично-связанные окна). Легированные кварцевые волокона, такие как EDFAs (оптические волокна, легированные ионами эрбия) находятся в центре оптического усилителя, используемого для дальней связи систем, работающих в 1,5-мкм спектроскопическом окне.
Используют также Yb3+ и Nd3+ в качестве легирующих примесей в оптических усилителях, так как они могут усилить сигнал в первичном и вторично-связанном окне, на 1 мкм и 1,33 мкм длины волны. Недостатком этой технологии является слабое поглощение ионов лантаноидов, из-за запрещенной симметрии f-f переходов, и их очень низкой растворимости во всех неорганических матрицах. Для преодоления этих проблем используют комплексы металлов, где металл координируется с органическим лигандом, который может работать и как сенсибилизатор.
1 Люминесценция лантаноидов (Ш) с органическими лигандами
Мощным стимулом к получению и исследованию комплексных соединений лантанидов (Ln) является возможность их использования в качестве излучающего компонента в оптических диодах – OLED (Organic Light Emitting Diodes). Соединения Ln с органическими лигандами проявляют характеристичную узкополосную люминесценцию как в видимой (Pr, Sm, Eu, Tb, Dy, Tm), так и инфракрасной областях спектра (Nd, Yb, Er). Если в первом случае используются лиганды, поглощающие УФ-излучение, то во втором – лиганды, поглощающие также в видимом диапазоне спектра. Описана люминесценция Nd(III), Yb(III) и Er(III) в комплексах с -дикетонами, органическими красителями, включая порфирины, и некоторыми другими органическими лигандами [1-2].
Ионы Ln(III) обладают уникальными оптическими свойствами, среди которых есть и люминесценция, вызванная f-f переходами. Фотолюминесценция неорганических соединений Ln(III) недостаточно сильная, поскольку поглощение ионами само по себе очень мало. Иная картина наблюдается в органических комплексах Ln(III). В 1942 году Вайсман предположил, что свет поглощается органической частью этих комплексов и выбрасывается в виде спектральной линии иона Ln(III). Эта схема излучения называется антенным эффектом [3]. Суть этого эффекта в передачи энергии от возбужденного органического лиганда к центральному иону Ln(III). Эффективность этой передачи зависит от типа лиганда, связанного с ионом Ln(III). Полный механизм этого процесса, показан на рис. 1. Передача возбуждения является специфической особенностью комплексов Ln(III) с органическими лигандами. Этот процесс в основном заключается в передаче энергии с триплетного уровня лиганда на соответствующий 4f уровень иона Ln(III). Последний возбуждается при поглощении энергии, передаваемой с триплетного уровня органического лиганда, и может претерпевать излучательный переход, который вызывает характерную линию излучения иона (люминесценция ионов) (рис. 1).
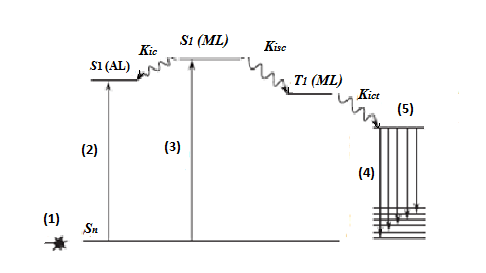
Рис. 1. Схематическое представление передачи энергии от органической части комплекса к центральному иону Ln(III) (Kisc, Kiet и Kic константы скорости для интеркомбинационного, внутримолекулярного переноса энергии и внутренней конверсии, соответственно, S1 (AL) является первым синглетом возбужденного состояния вспомогательного лиганда, S1 (ML) является первым синглетом возбужденного состояния основного лиганда и T1 (ML) является триплетом состояния основного лиганда). Обозначения: (1) – возбуждение; (2, 3) – поглощение; (4) – люминесценция иона; (5) - резонансные уровни иона Ln(III).
Интенсивность люминесценции ионов лантанидов в комплексах определяется, с одной стороны, процессами передачи энергии от триплетного состояния лиганда к резонансному уровню иона лантанида, и, с другой стороны, процессами безызлучательной дезактивации возбужденного синглетного и триплетного уровня лиганда, и излучательного перехода иона лантанида. Такой механизм открывает возможности для контролируемого синтеза комплексов с высокой производительностью люминесценции. Эти лантаноид-лиганд пары должны удовлетворять следующим условиям [4]:
(1) энергия резонансного уровня должна быть ниже, чем энергия триплетного уровня, чтобы обеспечить высокую вероятность перехода от лиганда триплетного уровня на Ln(III) резонансного уровня.
(2) вероятность безызлучательной дезактивации резонансного уровня должна быть низкой по сравнению с вероятностью радиационного перехода.
Учитывая эти условия, ионы лантанидов были разделены на три группы[5]:
- Ионы La3+, Gd3+ и Lu3+, которые не имеют электронных переходов в видимой и ближней ИК спектральных областях.
- Ионы Рг3+, Nd3+, Но3+, Er3+, Tm3+ и Yb3+, которые поглощает энергию от триплетного уровня лигандов, но она быстро потребляется безызлучательными переходами между близко расположенными издучательными уровнями этих ионов.
- Ионы Sm3+, Eu3+, Tb3+ и Dy3+, чьи комплексы проявляют сильную люминесценцию иона со слабой молекулярной флуоресценцией и фосфоресценцией.
2 ИК – люминесценция комплексов лантанидов
Рассмотрим подробнее спектры фотолюминесценции ИК-области излучения на примере комплексов хинолина. Молекула хинолина поглощает квант света, переходя в синглетное состояние, за счет -* перехода. Далее, за счет внутримолекулярных переходов, молекула переходит в возбужденное триплетное состояние с последующей передачей энергии на ион лантанида. Ион лантанида переходит в основное состояние за счет испускания кванта света в соответствующей области.
Комплексы гидроксихинолина возбуждаются в меньшие по энергии полосы поглощения лиганда Q (определен как -* переход), показанный на рис.2. Как показано, три полосы излучения наблюдается для Nd3 + (около 880, 1060 и 1330 нм и определены как 4F3/2 4I9/2, 4F3/24I11/2 и 4F3/24I13/2 переходы, соответственно), в то время как комплексы Yb3+ и Er3+ характеризуются одной полосой, центр которой около 980 нм, 2F5/22F7/2 и 1530 нм, 4I13/24I15/2, соответственно [6].
Рис.2. Спектры излучения в ИК-области спектра (exc= 371 нм) комплексов Ln(Q)3 (Ln = Nd, Er, Yb).
Умеренное расширение и частичное разрешение (резкая линия) этих полос приписывается к частичному снятию вырождения с 4f-уровней на 2J+1 называемому эффектом кристаллического поля, которое делает f-f переходы допустимыми. Тонкие структуры, возникающие из этого расщепления, могут быть использованы в качестве инструмента для исследования металлического окружения, так как спектроскопическая форма зависит от симметрии комплексов и становится более широкой, при снижении симметрии. Примечательно то, что спектроскопическая широта позволяет получить высокую пропускную способность для усиления оптического усиления в лазерных системах.
В качестве примера, рассмотрим 1,5 мкм спектры излучения и поглощения двух тетракис комплексов эрбия общей формулой [Er(5,7XQ)2(H5,7XQ)2Cl] (X = Cl, Br), показывающие различия в тонкой структуре, описанной для различных координационных геометрий (рис. 3) [7].
Рис.3. Сравнение спектров фотолюминесценции (PL, жирная линия) и поглощения (диффузное отражение, DR, тонкая линия), [Er(5,7ClQ)2(H5,7ClQ)2Cl] (а) и [Er(5,7BrQ)2(H5,7BrQ)2Cl] (б)
Эмиссионные свойства комплексов эрбия с производными гидроксихинолина были лучше изучены в связи с интересом их применения, в качестве примера для обсуждения можно указать на несколько аспектов, связанных с фотофизическими процессами. Краткие литературные фотофизические параметры представлены в таблице 1 [8].
Таблица
Основные литературные фотофизические параметры комплексов эрбия с производными гидроксихинолина.
3 Механизм переноса энергии в комплексах лантанидов.
Вначале 1990-х годов, Лен ввел термин «антенна» - обозначающий поглощение, перенос энергии, последовательных выбросов с участием различных поглощающих (лиганды) и излучающих (ионы лантанидов) компонентов в люминесцентных комплексах лантаноидов, которые работают как преобразователи света молекулярных устройств (LMCDs). Этот двухступенчатый процесс возбуждения позволяет добиться большого возбужденного состояния степени заполнения используя дозы света (Дж/см2) четырех-пяти порядков ниже чем те, которые требуются для голых ионов и позволяет преодолеть слабые поглощения ионов лантаноидов. Рис.4. показывает на примере эрбия, упрощенную схему энергетических уровней, иллюстрирующую процесс передачи энергии. После оптического возбуждения в ближнем УФ синглет лиганда возбужденного состояния S1 может либо распадаться в основное состояние S0, или до триплетного состояния Tn через механизм межсистемного пересечения (МСП) путем усиления эффекта тяжелого атома. Возбужденные триплеты впоследствии могут заполнить верхние уровни ионов лантаноидов через перенос резонансной энергии (RET). После быстрого возбужденного состояния наступает релаксация иона, радиационный распад (2S +1)Гj (2S +1)Гj, дает излучение Ln3+ в ИК-области спектра.
Рис 4. Схема Яблонски, иллюстрирующая двухступенчатый процесс возбуждения эрбия в комплексе гидроксихинолина. Пунктирные стрелки обозначают безызлучательный механизм релаксации.
В упрощенной модели, общий (или абсолютный) квантовый выход Фtot сенсибилизированной люминесценции комплексов лантаноидов может быть записан:
Фtot = ISCETФLn = sensФLn = sens obs/ rad (1)
где ФLn является внутренним квантовым выходом для прямого возбуждения ионов лантанидов, ISC представляет эффективность межсистемного процесса пересечения и ET является эффективностью 3* - Ln передачи (лиганд-металл).
Эти последние условия могут быть объединены в эффективный параметр чувствительности sensФLn, строго ограниченный несколькими конкурентными безызлучательными процессами распада при излучении иона лантаноида, и зависящий от соотношения между константами скорости излучения(кrad = 1 / rad) и процессами дезактивации возбужденного состояния (кobs = 1 / obs). obs – наблюдаемое время распада ИК-области спектра соединения лантаноида, а rad – это «природное» радиационное время жизни данного иона лантаноида при отсутствии безызлучательной дезактивации. Только общий квантовый выход Фtot и время жизни люминесценции obs могут быть непосредственно измерены и их значения найдены в литературе, тогда как другие члены уравнения (3) часто трудно определить, и представлены, в большинстве случаев, только грубые значения. Таким образом, световой поток люминесцентных материалов на основе комплексов лантаноидов существенно зависит от: (I) поглощения антенного блока, (II) эффективности двухступенчатого 1S*3T*Ln* процесса сенсибилизации и (III) эффективности люминесценции иона металла, влияющей на время жизни излучения [9].
4. Комплексы неодима, иттербия и эрбия с 8-гидроксихинолином
В настоящее время используют бидентатные и полидентатные комплексы на основе хинолина (рис.5).
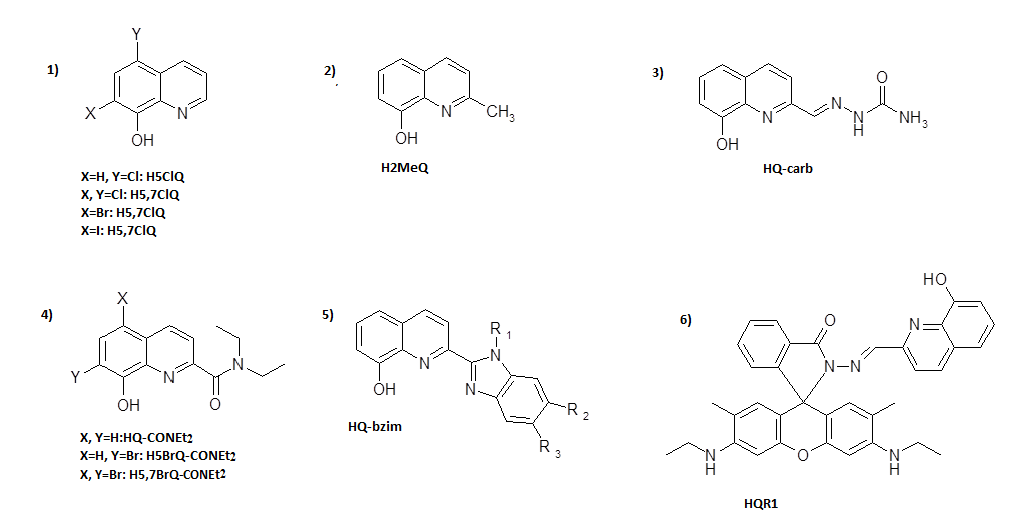
Рис.5. Некоторые производные хинолина, используемые для подготовки люминесцентных комплексов с ионами лантанидов.
Ранее предполагалось, что гидроксихинолин с трехвалентным металлом образует трис-хелатную октаэдрическую структуру LnQ3. Однако в дальнейшем появились предположения об иной стехиометрии комплексов с 8-гидроксихинолином (HQ) и его производных. В результате синтеза, основанного на добавлении этанольного раствора HQ к раствору нитрата лантанида в воде, получают продукт, который осаждается после добавления небольшого избытка раствора аммиака, и соответствует соотношению металл-лиганд как 1:3.
В дальнейшем было показано, что в результате реакции получаются смеси различных комплексов, вместо одного продукта. Например, один из полученных комплексов содержит три иона лантаноидов, перекрытых Q лигандами («тримерные» комплексы общей формулой Ln3Q8+). Он и является преобладающим продуктом при использовании 8-гидроксихинолина и 5-хлор-8-гидроксихинолина в качестве лигандов. Также, вместо них, используют лиганды 5,7-дигалоген-гидроксихинолина (H5, 7XQ, X = Cl, Br, I). В результате получается смесь димерных трис [Ln(5,7XQ)3(H2O)2]2 (состоит из двух трис комплексов, связаных водородными связями) и тетракис (NH4[Ln(5,7XQ)4]) комплексов в соотношении металл-лиганд как 1:3 и 1:4 соответственно. Данное соотношение было получено применением различных путей синтеза, при добавлении ацетата аммония и избытка лиганда в ацетоне к раствору хлорида лантаноида (Рис 6) .
Рис.6. Схема синтеза для получения комплексов лантаноидов с гидроксихинолином: (I)"тримерные" виды формируются только тогда, когда X = H, при отсутствии небольших катионов. (II) тетракис виды могут быть сформированы, когда X = H или галоген. Противоионы Na+ дают чистый вид. NH4+ дает смесь. (III) Трис виды формируются Х = галоген и с наименьшим количеством катионов, насколько это возможно.
Были проведены исследования по приготовлению и характеристике соединений лантаноидов (Er, Yb, Nd,) с HQ и H5,7XQ (X = Cl, Br) лигандами (рис. 5 (1)). В результате этих исследований, были отделены безводные, нейтральные и чистые продукты, пригодные для переработки в оптических устройствах, четко определенными методами синтеза. В зависимости от условий реакции, были получены три разных вида нейтральных комплексов эрбия с высокими выходами, как это кратко в (рис. 7) [10].
Рис.7. Реакционная схема соли эрбия с лигандами гидроксихинолина.
Видимо небольшие различия в условиях реакции производят различные продукты: (I) безводный, "чистый" трехъядерный комплекс Er3Q9 получается, когда Q – незамещенный лиганд, депротонированный NH3 либо в воде, либо смеси этанол/вода; (II) трис-димерных комплексов, где мононуклеарный блок состоит из [Er(5,7XQ)3(H2O)2] [X = Cl и Br], где ион восьмикоординирован тремя депротонированными лигандами и двумя молекулами воды, полученными тем же методом, что и (I); (III) тетракис мононуклеарные комплексы [Er(5,7XQ)2(H5,7XQ)2Cl] [X = Cl и Br], где депротонированы только два из четырех скоординированных лигандов, получают путем смешивания хлорида эрбия с H5,7XQ в органических растворителях (CH3CN/CH3OH 4:1) без добавления основания. Различное поведение гидроксихинолина и 5,7-галогензамещенной позволяет описать электронные и стерические эффекты, вызванные наличием галогензаместителей в феноксидном кольце [11].
Как показано, трехядерные и трис типы достигаются октакоординацией вокруг иона лантанида, в то время как тетракис комплексы принимают довольно необычное координационное число 7 (координация обеспечивается двумя бис-хелатными, двумя монодентатными лигандами и одним хлоридом). Структурный признак показывает, что в трехъядерной молекуле Er3Q9 каждый металл представляет собой искаженную анти-призматическую геометрию с двумя внешними металлами, соединенными четырьмя атомами азота и четырьмя атомами кислорода. В то время как внутренний эрбий координируется азотом и семью атомами кислорода. Способность Q выступать в качестве мостикового лиганда позволяет ионам эрбия достичь предпочтительного координационного числа 8, также в присутствии только трех молекул лиганда на ион. Результаты спектроскопии и данные масс-электроскопии (ESI) Er3Q9 в растворе показывают, что трехъядерная структура сохраняется в растворе.
С другой стороны, образование мононуклеарных трис видов вместо трехядерных комплексов при использовании дигалоген - замещенных лигандов 8-гидроксихинолина является следствием стерических затруднений из-за атома галогена в 7 положении гидроксихинолинового кольца, которое предотвращает переходный механизм.
Тетракис комплексы, где два лиганда в анионной форме, а остальные являются "цвиттер-ионными" (рис. 8), были полученные в отсутствии основания, благодаря повышенной кислотности дигалоген - замещенных 8-гидроксихинолинов (в связи с наличием электроноакцепторных групп особенно в 5-положении фенокси-кольца) по отношению к некоторой незамещенной, так, чтобы частичное депротонирование лиганда происходило немедленно при добавлении соли Er3+. Можно предположить, что формирование "цвиттер-ионных" комплексов из реакционной смеси в нейтральных условиях подвергается конкурентоспособному прототропному равновесию между различными формами хинолина (рис. 8), сильно зависящими от присутствия ионов металлов. Эти равновесия включают как хинолиниум (H25,7XQ+) и хинолинат (5,7XQ-) ионы вместе с цвиттер-ионной формой лиганда, хотя кислый характер иона лантанида, вероятно, сдвигает равновесие к протонированной форме. Таутомерная перегруппировка нейтрального хинолина в комплексе, вероятно, предпочтительней из-за сильной кислоты Льюиса Ln3+ для анионного донора атомов кислорода [12].
Рис.8. Структура тетракис комплекса [Er(5,7CLQ)2(Н5,7ClQ)2Cl] [57], когда два лиганда в анионной форме и два в виде цвиттер-ионов. Пунктирная линия показывает водородную связь.
Аналогично реакциям, описанным на рис. 7, были получены соответствующие комплексы гидроксихинолина с Nd3+ и Yb3+. Соединения, полученные в воде, а именно трехъядерный и трис-комплексы, были отделены как чистые продукты с высокими выходами. Привлекает внимание то, что тетракис комплексы неодима, а также других металлов, относящихся к первой половине ряда лантаноидов (Ce-Eu) не были получены. Тетракис комплексы можно получить, только начиная с середины ряда, с иона Gd3+, находящегося на границе между «легкими» и "тяжелыми" лантаноидами. Такое поведение описывает эффект "лантаноидного сокращения". На самом деле ионы лантаноидов в первой половине ряда имеют большие ионные радиусы и предпочитают координационное число выше, чем 7, которые содержатся в тетракис комплексах.
Вскоре, после доказательства существования "чистой" трехъядерной структуры 8-хинолинолата Ln3+, сообщили о синтезе и структурных характеристиках Ho3Q9·HQ, который изоструктурен Er3Q9. Методика проведения синтеза для получения данного соединения удивительно отличалась от тех, которые описаны выше, взаимодействием 8-гидроксихинолина с металлическим гольмием в присутствии металлического стронция и металлической ртути при 190C в вакууме в потоке 1,3,5-три-трет-бутилбензола (рис. 9).
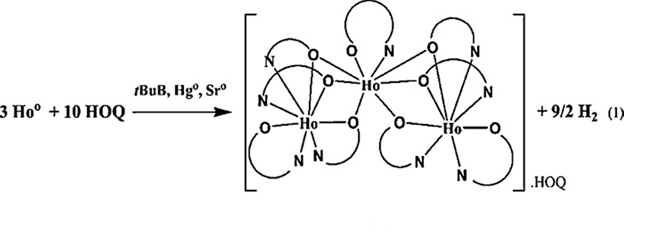
Рис.9. Синтез соединения Ho3Q9 · HQ.
Этот псевдо-твердый метод синтеза, на основе прямой реакции металлов в основном состоянии с лигандом HQ при повышенной температуре в присутствии инертного потока, также был применен для получения гетеробиметаллических комплексов Ln2CaQ8 (Ln = Nd, Eu) и LaCo2Q7. Похожей трехъядерной структурой лантаноидов / щелочноземельных гетеробиметаллических комплексов с лигандом H2MeQ, и общей формулой [Ln2Mg (2MeQ)8] (Ln = Eu, Gd, Tb, Er), полученных перегруппировкой между двумя 2MeQ-комплексами Ln3 + и Mg2 + при 200 - 300°C в потоке 1,2,4,5-тетраметилбензола (TMБ). Однако, при использовании этого метода синтеза, образуются побочные продукты, т.к. синтез тяжело контролировать [13].
5. Комплексы с полидентатными лигандами на основе 8-гидроксихинолина
Рассмотренные выше примеры показывают, что реакция с 8-гидроксихинолином и его производными с металлами лантаноидов дает различные комплексы с различной ядерностью и стехиометрией. В целях улучшения координационных свойств 8-гидроксихинолина производные ионов лантаноидов (III), исследуют координационную способность новых лигандов, где эффективность гидроксихинолина в качестве антенны лиганда сохраняется, и внедряют дополнительные группы доноров, направленные на улучшение возможности привязки для насыщения координации металла. Эта стратегия кажется подходящей в пользу формирования устойчивых комплексов, так как координация химии лантаноидов, в основном объясняется пространственной, а не орбитальной направленностью. Часто «управляемый энтропией» процесс, который преимущественно занимает комплексообразование с хелатного лиганда в результате снижение гидратации иона лантанида, с положительным изменением энтропии (хелатирующий эффект). Более того, такие полидентатные лиганды должны обеспечить эффективное экранирование лантаноидов эмиттер от вторжений внешних гасителей в первой координационной сфере.
На рис. 10, показан комплекс эрбия(III) [(HQ-carb) ErCl3] с тетрадентатным HQ-carb лигандом (рис. 10), семикарбазон 8-гидрокси-хинолин-2-карбальдегида. Этот комплекс был получен путем взаимодействия HQ-carb с одним эквивалентом трифлата эрбия(III) в присутствии избытка хлористого калия, или непосредственно с лигандом и хлоридом эрбия(III). Учитывая то, что, в отсутствие основания фенольные группы хинолина частично остаются протонированными, три хлорида заполняют координационную сферу Ln3 + , тем самым уравновешивают заряд металла 3+. В этом случае использование лиганда с несколькими донорными местами не приводит к контролируемым продуктам в соотношении комплексов лиганд-металл 2:1 или их смеси 1:1 и 2:1, или димеров.
Рис.10. Лиганд HQ-carb скоординированный (а) и структура [(HQ-carb) ErCl3] комплекс (б).
HQR1 лиганд (рис. 5 (6)), несущий родаминовую группу, был предложен в качестве антенны лиганда с двумя хромофорными единицами. Комплекс иттербия(III) был получен в растворе метанола реакцией (HQR1) с эквивалентом Yb(NO3)35H2O. По согласованию, родаминовый 6G фрагмент лиганда изменяет свою форму из закрытого и нефлуоресцентного спиролактам-кольца таутомера на открытое кольцо таутомера, в то время как звено 8-гидроксихинолина, даже в отсутствие основания, теряет протон, ведущий к образованию тетрадентатного лиганда. В этом случае было получено соотношение металла к лиганду, как 1:2, где ион Yb3+ хелатирован двумя ONNO тетрадентатными звеньями из двух QR1-лигандов, выполняющих роль координационного окружения центрального иона лантанида. Молекулярная структура катионного комплекса [Yb(QR1)2]+ представлена на рис. 11.
Рис.11. Молекулярная структура катионного комплекса [Yb(QR1)2]+ со схемой нумерации атомов. Анионы молекул растворителя и водорода опущены для четкости.
С другой стороны, использование тридентатных вместо тетрадентатных лигандов может привести к улучшению контроля нуклеарности комплексов. Фактически, с помощью HQ-CONEt2, H5BrQ-CONEt2 и H5,7BrQ-CONEt2 лигандов (рис. 5 (4)), были получены одноядерные, безводные, комплексы лантаноидов с соотношением металл-лиганд как 1:3 [14]. Эти комплексы были получены путем взаимодействия гидратов солей лантаноидов(III) в метаноле при 55С, с использованием карбоната калия в качестве основания. Красный продукт, полученный после медленного испарения растворителя, экстракцией дихлорметаном и последующей кристаллизацией показали, что комплексы нейтральны Ln(Q-CONEt2)3 (Ln = Yb, Eu, Er, Nd). В этом случае три тридентатных лиганда эффективно насыщают ион лантанида, и он становятся девяти-координированным.
Структура соединения эрбия Er(Q-CONEt2)3·К(SO3CF3) показана на рис. 12.
Рис. 12. Структура соединения Er(Q-CONEt2)3
Заключение
Таким образом, в результате проведенного литературного обзора было показано, что соединения лантанидов с органическими лигандами проявляют характеристичную узкополосную люминесценцию как в видимой, так и инфракрасной областях спектра. Излучение ионов Nd3+, Er3+, Yb3+ в ИК-области спектра, имеет широкую область применения. Среди ионов лантаноидов, излучающих в ИК-области спектра, Er3+ играет особую роль, так как он показывает резкое излучение, происходящее в области с длиной волны 1,55 мкм. Наиболее эффективными молекулами для сенсибилизации ИК-люминесценции являются полихелатные лиганды 8-гидрокисхинолинового ряда.
Список цитируемой литературы
- Связь между составом, устойчивостью и спектральными свойствами комплексов 4f-элементов и их использование в люминесцентном анализе / З.М. Топилова, С.Б. Мешкова, Д.В. Большой, М.О. Лозинский, Ю.Е. Шапиро // Журнал неорганической химии. – 2011. - Т. 42, № 1. – С. 99-105.
- Русакова Н.В., ИК-люминесценция ионов неодима(III) и иттербия(III) / Н.В. Русакова , С.Б. Мешкова // Журнал аналитической химии. – 1990. -Т. 45, № 10. – С. 1914-1917.
- Kuz’mina N.P., Eliseeva S.V. Photo and Electroluminescence of Lanthanide(III) Complexes / N.P. Kuz’mina, S.V. Eliseeva // Journal of Inorganic Chemistry. – 2009. - Vol. 51, № 1. – Р. 73–88.
- Efficient red electroluminescence from organic devices using dye-doped rare earth complexes / C.J. Liang, D. Zhao, Z.R. Hong [et al.] // Appl. Phys. Lett. – 2000. - Vol. 82. – P. 67–76.
- Salata O.V. The Chemistry of Metal Enolates / O.V. Salata, N.A.H. Male, V. Christou – England: West Sussex PO19 8SQ. - 2002. – 1209 p.
- Albrecht M., Osetska O., Frhlich R. Structural Characterization of Methanol Substituted Lanthanum Halides / M. Albrecht, O. Osetska, R. Frhlich // Dalton Trans. – 2010. - Vol. 29, № 7. – Р. 1784–1795 .
- Structural and photophysical properties of trianionic nine-coordinated near-IR emitting 8-hydroxyquinoline-based complexes // G. Bozoklu, C. Marchal, J. Pcaut, M. Mazzanti – Dalton Trans. – 2010. - Vol. 39, № 38. – P. 9112–9122.
- Structural and photophysical studies of highly stable lanthanide complexes of tripodal 8-hydroxyquinolinate ligands based on 1, 4, 7-triazacyclononane / A. Nonat, D. Imbert, J. Pcaut [et al.] // Inorg. Chem. – 2009. - Vol. 48, № 9. – P. 4207–18.
- Syntheses at Elevated Temperature and Structures of Lanthanide/Alkaline Earth Heterobimetallic Derivatives of 2-Methyl-8-hydroxyquinoline / G.B. Deacon, C.M. Forsyth, P.C. Junk [et al.] // Eur. J. Inorg. Chem. – 2010. - Vol. 2010, № 18. – P. 2787–97.
- The Supramolecular Chemistry of Organic-Inorganic Hybrid Materials / K. Lunstroot, K. Driesen, P. Nockemann [et al.] // Dalton Trans. – 2009. - Vol. 46. – P. 234–236.
- Efficient sensitization of lanthanide luminescence by tetrazole-based polydentate ligands / M. Giraud, E.S. Andreiadis, A.S. Fisyuk, [et al.] // Inorg. Chem. – 2008. - Vol. 47. - P. 3952–3954.
- Photochemistry / J.-C.G. Bnzli, A.-S. Chauvin, S.V. Eliseeva [et al.] // Coord. Chem. Rev. – 2010. - Vol.39. – P. 42–57.
- Near-infrared photoluminescence of erbium tris(8-hydroxyquinoline) spin-coated thin films induced by low coherence light sources / F. Quochi, R. Orr, F. Cordella, [et al] // J. Appl. Phys. – 2006. - Vol. 99. – P. 65-71.
- A systematic study of the photophysical processes in polydentate triphenylene-functionalized Eu3+, Tb3+, Nd3+, Yb3+ and Er3+ complexes // S.I. Klink, L. Grave, D.N. Reinhoudt, [et al.] // J. Phys. Chem. – 2010. - Vol. 104, № 23. – P. 5457–5468.
ИК-ЛЮМИНИСЦЕНЦИЯ КОМПЛЕКСОВ ЭРБИЯ (III), ИТТЕРБИЯ (III), НЕОДИМА (III)