Влияние вязкости растворителя на подвижность ионов сильного электролита
Министерство образования и науки Российской Федерации
Государственное образовательное учреждение
высшего профессионального образования
«Воронежский государственный университет»
Химический факультет
Кафедра Физической химии
«Влияние вязкости растворителя на подвижность ионов сильного электролита»
Курсовая работа
По специальности 020101 Химия
Специализация 020101.04 Физическая химия
Воронеж 2014
Содержание
- Обзор литературы по теме
- Вязкость ……………………………………..……………………….…….3
- Движение частиц в вязких средах………………………………….…5
- Электропроводность и ее виды………..………..………………….…..6
1.3.1 Удельная электропроводность растворов электролитов…….……7
1.3.2 Молярная электропроводность растворов электролитов….…...…8
1.4 Потенциометрическое титрование………….……………..………....10
1.5 Числа переноса и методы их определения…………….…………….10
- Методика выполнения работы
2.1 Проверка концентрации кислоты методом потенциометрического титрования…………………………….……….….13
2.2 Измерение эквивалентной электропроводности растворов HCl...14
2.3 Определение чисел переноса методом Гитторфа………..…………15
- Обработка результатов
3.1 Потенциометрическое титрование………………………..…….……..16
3.2 Электропроводность растворов HCl……………………………….….18
3.3 Числа переноса………………………………………………..……………23
- Выводы……………………………………………………………...………25
- Список литературы…………………………………………...……….26
- Обзор литературы по теме
1.1 Вязкость.
Свойство газов и жидкостей оказывать сопротивление необратимому перемещению одной их части относительно другой при сдвиге, растяжении и др. видах деформации. Вязкость характеризуют интенсивностью работы, затрачиваемой на осуществление течения газа или жидкости с определенной скоростью. При ламинарном сдвиговом течении жидкости между двумя плоскопараллельными пластинками, верхняя из которых движется с постоянной скоростью v под действием силы F, а нижняя неподвижна, слои жидкости перемещаются с разными скоростями - от максимальной у верхней пластинки до нуля у нижней (рис. 1и рис.2).

|
Рис. 1. Распределение скоростей при ламинарном сдвиговом течении ньютоновской жидкости (пояснения в тексте)
|
Рис. 2. Распределение скоростей при ламинарном течении ньютоновской жидкости в канале (пояснения в тексте).
|
При этом касательное напряжение =F/S, а скорость деформации 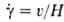 ,
,
где S-площадь пластинок, H - расстояние между ними. Если между и 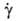 имеется линейная зависимость, жидкость называется ньютоновской; отношение
имеется линейная зависимость, жидкость называется ньютоновской; отношение 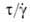 называют динамической вязкостью (или просто вязкостью) . Величину, равную отношению вязкости вещества к его плотности, называют кинематической вязкостью, обратную вязкости величину - текучестью. В общем случае пространственного течения для ньютоновских жидкостей имеет место линейная зависимость между тензорами напряжений и скоростей деформации. Жидкости, для которых указанные зависимости не являются линейными, называются неньютоновскими.
называют динамической вязкостью (или просто вязкостью) . Величину, равную отношению вязкости вещества к его плотности, называют кинематической вязкостью, обратную вязкости величину - текучестью. В общем случае пространственного течения для ньютоновских жидкостей имеет место линейная зависимость между тензорами напряжений и скоростей деформации. Жидкости, для которых указанные зависимости не являются линейными, называются неньютоновскими.
В системе СИ значения вязкость выражают в Па·с. Для газов составляет обычно от 1 до 100 мкПа·с, для воды при 20°С 1 мПа·с, для большинства низкомолекулярных жидкостей до 10 Па·с. Расплавленные металлы по порядку величины близки к обычным жидкостям.
Вязкость низкомолекулярных жидкостей, относящихся к одному гомологическому ряду, примерно линейно растет с увеличением молярной массы вещества; она увеличивается также с введением в молекулу циклов или полярных групп. Вязкость разбавленных суспензий и эмульсий линейно возрастает с увеличением относительного объема дисперсной фазы. Вязкость растворов и расплавов полимеров достигает 0,1 МПа·с, каучуков и резиновых смесей, битумов и асфальтов - 100 МПа·с. В отличие от низкомолекулярных гомологов, вязкость полимеров растет пропорционально их молярной массе не линейно, а в степени 3,5, т.е. гораздо сильнее.
С повышением температуры вязкость газов увеличивается, поскольку она обусловлена интенсивностью теплового движения. Вязкость жидкостей с повышением температуры уменьшается благодаря снижению энергии межмолярных взаимодействий, препятствующих перемещению молекул.
С увеличением давления вязкость всегда возрастает. Для многих расплавов и растворов полимеров и коллоидных систем, в отличие от низкомолекулярных жидкостей, вязкость зависит от режима течения (т.е. от 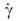 или
или 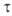 ). Поэтому при характеристике таких сред необходимо указывать условия измерения вязкости (значения
). Поэтому при характеристике таких сред необходимо указывать условия измерения вязкости (значения 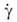 или
или 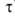 ). Различают: наибольшую ньютоновскую вязкость (или вязкость неразрушенной структуры), отвечающую предельно низким
). Различают: наибольшую ньютоновскую вязкость (или вязкость неразрушенной структуры), отвечающую предельно низким 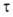 ; эффективную (или "структурную") вязкость, зависящую от уровня действующих в среде напряжений; наименьшую ньютоновскую вязкость (или вязкость предельно разрушенной структуры), измеряемую при наиболее интенсивном режиме деформирования, когда вязкость перестает зависеть от
; эффективную (или "структурную") вязкость, зависящую от уровня действующих в среде напряжений; наименьшую ньютоновскую вязкость (или вязкость предельно разрушенной структуры), измеряемую при наиболее интенсивном режиме деформирования, когда вязкость перестает зависеть от 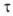 .
.
Значением вязкости характеризуют переход некристаллизующихся (переохлажденных) жидкостей из текучего в стеклообразное состояние при охлаждении. Температуру, при которой вязкость достигает 1011 - 1012 Па·с, условно принимают за температуру стеклования. Свойства разбавленных растворов полимеров оценивают так называемой характеристической вязкостью ("предельным числом вязкости"), которая определяется как 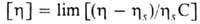 при С0, где
при С0, где 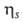 - вязкость растворителя, а С - концентрация раствора. Величина
- вязкость растворителя, а С - концентрация раствора. Величина 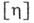 связана с размерами и формой макромолекул в растворе и используется для их определения.
связана с размерами и формой макромолекул в растворе и используется для их определения.
Значения вязкости среды обусловливают мощность мешалок, насосов и т.п., оказывая влияние на скорость тепло- и массопереноса. Температурная зависимость вязкости - важнейшая характеристика нефтепродуктов, особенно смазочных материалов.
1.2. Движение частиц в вязких средах
Под броуновским движением понимают хаотическое движение микроскопических частиц, взвешенных в жидкости или газе, происходящее под действием ударов молекул окружающей среды. Это явление впервые исследовано английским ученым Робертом Броуном. Причина броуновского движения – тепловое движение молекул среды. Столкновения молекул среды с частицей носят случайный характер, поэтому удары с разных сторон оказываются не скомпенсированными. Удары молекул среды приводят частицу в беспорядочное движение: скорость ее хаотически меняется по величине и направлению. Броуновское движение – наиболее наглядное экспериментальное подтверждение представлений молекулярно-кинетической теории о хаотическом тепловом движении атомов и молекул. Чем больше размер частицы, тем большее число молекул окружающей среды могут столкнуться с ней и, следовательно, тем меньшее количество ударов останется не скомпенсированным. Поэтому большая частица не приходит в движение. Если частица имеет небольшие размеры ( 1 мкм = 10–4см =10–6м), число столкновений будет невелико, следовательно, большее количество ударов останется не скомпенсированным, и частица придет в движение. Такую частицу называют броуновской. Со стороны среды на частицу действуют сила вязкого трения (сила Стокса) пропорциональная скорости
Fcопр= - bv (1)
(коэффициент пропорциональности b зависит от размеров и формы частицы, а также от свойств вязкой среды). Кроме того, действует результирующая сила F ударов молекул о частицу с разных сторон. Эта сила (сила Ланжевена) носит случайный характер.
Уравнение движения частицы можно записать в виде:
ma = F – bv (2)
Формула, или закон Cтокса получена для медленного поступательного движения шара в неограниченной вязкой среде. Законом Стокса пользуются в коллоидной химии, молекулярной физике, физике аэрозолей. По закону Стокса можно определить скорость осаждения мелких капель тумана, частиц ила, коллоидных и аэрозольных частиц.
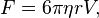 (3)
(3)
где 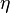 —вязкость жидкости,
—вязкость жидкости,  — радиус частицы.
— радиус частицы.
1.3. Электропроводность и ее виды
Электрическая проводимость растворов электролитов, т.е. способность их проводить электрический ток, зависит от природы электролита и растворителя, концентрации, температуры и некоторых других факторов. Различают удельную и молярную электрическую проводимости.
Для измерения электрической проводимости раствора прибегают к измерению его сопротивления. Раствор помещают в специальный сосуд, имеющий два металлических электрода. Измерение может быть проведено как с помощью постоянного, так и с помощью переменного тока. Но в любом случае следует принять меры для максимального снижения поляризованного сопротивления, т.е. сопротивления границы электрод – раствор, обусловленного протеканием электрохимических реакций.
На практике распространен метод с использованием переменного тока с частотой, обычно не выше Гц. Достаточно быстрое изменение направления тока служит оптимальным средством для почти полного устранения поляризованного сопротивления. Основой установки является мост Уитстона, образованный контуром из сопротивлений R1 - R4.
|
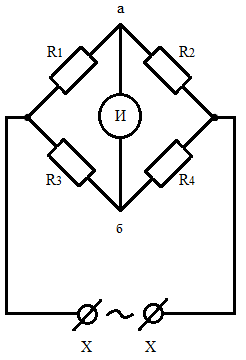
|
Рис.3. Схема моста Уитстона.
|
На одну из диагоналей моста подается питание от генератора переменного (синусоидального) напряжения, а на другой диагонали регистрируется сигнал так называемым индикатором нуля И, в качестве которого обычно применяют осциллограф. Мост находится в равновесии, т.е. на диагонали аб отсутствует сигнал, если выполнено условие R1/R2 = R3/R4. Поэтому, если на место R1 поставить сосуд с раствором, а на место R2 – магазин сопротивлений, то при равновесии моста
(4)
1.3.1 Удельная электропроводность растворов электролитов
Электрический ток есть упорядоченное перемещение заряженных частиц. Растворы электролитов обладают ионной проводимостью (являются проводниками второго рода), т.е. электропроводность растворов электролитов обусловлена перемещением ионов в электрическом поле (в отличие от электронной проводимости проводников первого рода).
Величина преимущественного передвижения иона в направлении одного из электродов при прохождении тока через раствор отнесённая к градиенту потенциала 1 В/см, есть абсолютная скорость движения иона. Абсолютные скорости движения ионов имеют величины порядка 0,0005 – 0,003 см2/(В·с). Абсолютные скорости движения катионов U+ и анионов U–различаются; это приводит к тому, что ионы разных знаков переносят разные количества электричества.
Всякий проводник, по которому течет ток, представляет для него определенное сопротивление R, которое, согласно закону Ома, прямо пропорционально длине проводника l и обратно пропорционально площади сечения S; коэффициентом пропорциональности является удельное сопротивление материала – сопротивление проводника, имеющего длину 1 см и сечение 1 см2:
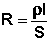 , Ом (5)
, Ом (5)
В качестве количественной меры способности раствора электролита проводить электрический ток используют обычно удельную электропроводность (каппа) – величину, обратную удельному сопротивлению ( т.е. величину, обратную сопротивлению столба раствора между электродами площадью 1 см2, находящимися на расстоянии 1 см):
= , Ом-1см-1 (6)
Величина удельной электропроводности электролита зависит от ряда факторов: природы электролита, температуры, концентрации раствора.
Удельная электропроводность растворов электролитов (в отличие от электропроводности проводников первого рода) с увеличением температуры возрастает, что вызвано увеличением скорости движения ионов за счет понижения вязкости раствора и уменьшения сольватированности ионов. Зависимость удельной электропроводности от концентрации раствора представлена на рис. 4.
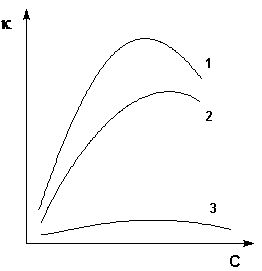
Рис. 4. Зависимость удельной электропроводности электролитов от концентрации (1 – H2SO4, 2 – KOH, 3 – CH3COOH)
Как видно из рисунка, с увеличением концентрации удельная электропроводность растворов сначала возрастает, достигая некоторого максимального значения, затем начинает уменьшаться. Эта зависимость очень чётко выражена для сильных электролитов и значительно хуже для слабых. Наличие максимума на кривых объясняется тем, что в разбавленных растворах сильных электролитов скорость движения ионов мало зависит от концентрации, и сначала растет почти прямо пропорционально числу ионов; с ростом концентрации усиливается взаимодействие ионов, что уменьшает скорость их движения. Для слабых электролитов наличие максимума на кривой обусловлено тем, что с ростом концентрации уменьшается степень диссоциации, и при достижении определенной концентрации число ионов в растворе начинает увеличиваться медленнее, чем концентрация. Для учета влияния на электрическую проводимость растворов электролитов их концентрации и взаимодействия между ионами введено понятие молярной электропроводности раствора.
1.3.2 Молярная электропроводность растворов электролитов
Молярная электропроводность раствора есть величина, обратная сопротивлению раствора, содержащего 1 моль растворенного вещества и помещенного между электродами, расположенными на расстоянии 1 см друг от друга. С удельной электропроводностью и молярной концентрацией раствора С молярная электропроводность связана следующим соотношением:
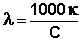 , Ом-1см2моль-1 (7)
, Ом-1см2моль-1 (7)
Молярная электропроводность как сильных, так и слабых электролитов увеличивается с уменьшением концентрации (т.е. увеличением разведения раствора V = 1/С), достигая некоторого предельного значения o, называемого молярной электропроводностью при бесконечном разведении (рис. 5– 6).
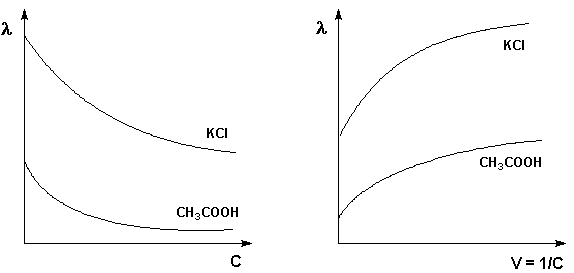
|
Рис. 5. Зависимость молярной электропровдности от концентрации.
|
Рис. 6. Зависимость молярной
электропроводности от разведения
|
Для слабого электролита такая зависимость молярной электропроводности от концентрации обусловлена в основном увеличением степени диссоциации с разбавлением раствора. В случае сильного электролита с уменьшением концентрации ослабляется взаимодействие ионов между собой, что увеличивает скорость их движения и, следовательно, молярную электропроводность раствора. Последнюю связывает с абсолютными скоростями движения катионов и анионов U+ и U– уравнение Аррениуса (8):
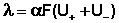 (8)
(8)
Ф. Кольрауш показал, что в молярную электропроводность бесконечно разбавленных растворов электролитов каждый из ионов вносит свой независимый вклад, и o является суммой молярных электропроводностей катиона и аниона + и – (т.н. подвижностей ионов), и сформулировал закон независимости движения ионов:
Молярная электропроводность при бесконечном разведении равна сумме электролитических подвижностей катиона и аниона данного электролита.
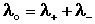 (9)
(9)
Подставив в это выражение уравнение Аррениуса (8) и приняв, что при бесконечном разведении степень диссоциации равна единице, получим:
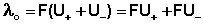 (10)
(10)
Отсюда
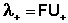 ;
; 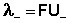 (11)
(11)
Электролитическая подвижность является важнейшей характеристикой иона, отражающей его участие в электропроводности раствора.
1.4. Потенциометрическое титрование
Сущность метода состоит в том, что конечная точка титрования находится не за счет изменения окраски индикатора, сопротивления раствора или его оптической плотности, а по резкому изменению потенциала индикаторного электрода.
Если потенциал используемого индикаторного электрода связан нернстовской зависимостью только с концентрацией титруемого вещества или титранта. В близости от точки эквивалентности потенциал индикаторного электрода начинает быстро меняться, в этом случае получают S-образную кривую титрования. При этом должны выполняться условия:
- электрохимическая реакция между титрантом и определяемым веществом (ионом) должна быть очень быстрой, практически равновесной;
- конечная точка титрования должна быть достаточно близка к точке эквивалентности стехиометрической реакции титрования.
Таким требованиям отвечают реакции нейтрализации, осаждения, комплексообразования, а также окислительно-восстановительные. Соответственно индикаторный электрод должен быть обратим либо по ионам , либо по катионам металла , образующим с анионами раствора или растворимое комплексное соединение, или нерастворимое, выпадающее в осадок. При окислительно-восстановительном титровании практически всегда используется гладкий платиновый электрод, принимающий равновесный потенциал титруемой Ox, Red-системы.
1.5. Числа переноса и методы их определени
Одним из важнейших понятий в электрохимии является число переноса ионов. В электролитах электричество переносится одновременно положительными и отрицательными ионами, поэтому возникает вопрос, каково участие в этом процессе ионов каждого знака.
Количество переносимого электричества определяется концентрацией ионов и скоростью их движения; когда концентрации катионов и анионов одинаковы, участие их в переносе электричества зависит лишь от относительной скорости их движения. Т.к. скорости движения катионов и анионов могут быть существенно различными, потому и числа переноса должны быть разными. Это было установлено Гитторфом (1854).
Числом переноса ионов называется доля прошедшего через электролит электричества, перенесенная данным родом ионов :
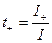
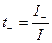
где I+, I- - сила тока, переносимая катионами и анионами; I – общая сила тока, перенесенная всеми ионами.
Если электролит распадается на ионы двух типов, то сумма чисел переноса равна 1:
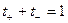
Выразим I+ и I- через v0+, v0- при E 1:
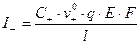 ;
; 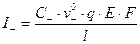 ;
; 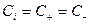 ;
;
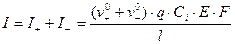
Тогда для t+ и t- будем иметь:
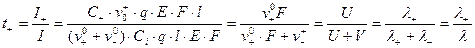
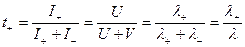

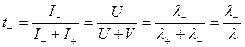
Число переноса ионов равно отношению подвижности данного иона к сумме подвижностей всех. Аналогично подвижностям t+ , t- уменьшаются с ростом концентрации и увеличиваются с ростом Т.
Числа переноса можно определять экспериментально по методу Гитторфа.
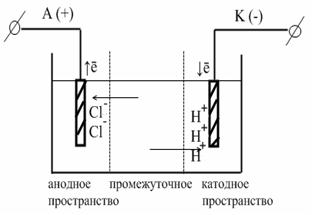
В методе Гитторфа числа переноса определяют по изменению концентраций катионов и анодов в анодном и катодном пространствах электролитической ячейки, вызванному пропусканием через раствор определенного количества электричества с помощью постоянного тока. В качестве примера рассмотрим определение чисел переноса при электролизе водного раствора НCl.
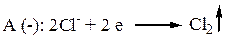
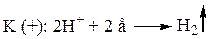
В промежуточном отделении: не изменяется концентрация ионов. В анодном отделении: накапливается меньше ионов хлора, т. к. Cl- << H+. Убыль концентрации электролита больше.
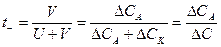
где СА, СК - убыль электролита в процессе электролиза у анода и у катода; С – общая убыль концентрации электролита в процессе электролиза. В катодном отделении: накапливается больше ионов Н+. Убыль концентрации HCl меньше у катода:
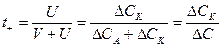
Недостатки метода Гитторфа:
Определенные по методу Гитторфа числа переноса являются кажущимися числами переноса, т. к. не учитывается количество молекул растворителя (воды), которое переносится ионами в составе их сольватных оболочек (т. е. не учитывается сольватация ионов).
Цель данной работы: оценить влияние вязкости растворителя на подвижность ионов Н3О+ и Cl- .
II. Методика выполнения работы
2.1 Проверка концентрации кислоты методом потенциометрического титрования.
Оборудования и реактивы: вольтметр; магнитная мешалка; магнит; бюретка; стеклянный и хлорсеребряный электроды; рабочие растворы НСl.
Собрали установку:
|
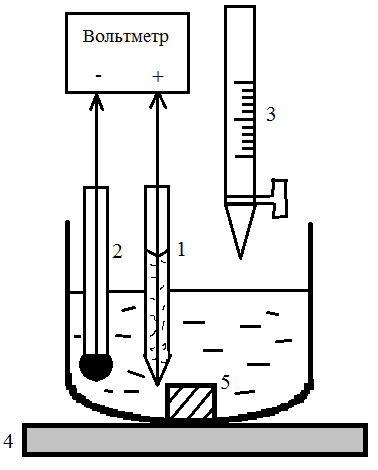
|
Рис.1. Установка для проведения потенциометрического титрования:
1 – хлорсеребряный электрод;
2 – стеклянный электрод;
3 – бюретка;
4 – магнитная мешалка;
5 – магнит.
|
Приготовили серию растворов соляной кислоты с концентрациями 0,2; 0,05; 0,02; 0,01; 0,002; 0,001 моль/л методом последовательного разбавления.
При непрерывном размешивании раствора магнитной мешалкой провели титрование раствора, с концентрацией 0,2 моль/л, добавляя по 1 мл. NaOH с концентрацией 0,2 моль/л, постоянно фиксируя по вольтметру напряжение цепи между стеклянным и хлорсеребряным электродами. Пройдя точку эквивалентности не прекращая титрование, ввели в раствор еще небольшой объем NaOH. По полученным данным построили график зависимости напряжения от объема щелочи.
То же проделали с раствором концентрацией 0,001 моль/л (добавляли по 0,2 мл NaOH с концентрацией 0,05 моль/л).
Далее определили начальную концентрацию наших растворов и ввели поправку в расчете концентрации электролитов.
2.2 Измерение эквивалентной электропроводности растворов HCl
Оборудование и реактивы: установка и ячейка для измерения электрической проводимости; водный раствор 0,02М КСl; рабочие растворы НСl; термометр; мерная посуда; дистиллированная вода.
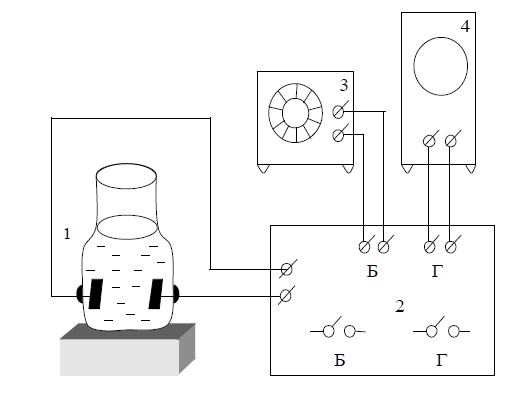
На рис.2. изображена установка для измерения электрической проводимости растворов. Электроды сосуда (1) подключают к клеммам Х моста Уитстона (2). К клеммам Б подводят ток от генератора низкой частоты (3). К клеммам Г присоединяют осциллограф (4), служащий индикатором нуля.
Следует помнить, что сопротивление сосуда зависит от удельной электропроводности раствора, формы и площади электродов, расстояния между ними, а также от их взаимного расположения и объема раствора в сосуде. Это связано с тем, что в переносе электричества участвует больший объем раствора, чем тот, который непосредственно заключен между электродами. Поэтому известная из физики взаимосвязь между сопротивлением R, удельной электрической проводимостью , длиной и площадью поперечного сечения S проводника ( в нашем случае – раствора электролита) дополняется эмпирическим множителем и принимает вид:
(1)
Величина А называется постоянной сосуда с размерностью .
Приготовили серию растворов соляной кислоты с концентрациями 0,20,001 моль/л, где растворитель – вода-глицерин в соотношении 5; 10 и 20 об.% глицерина.
С помощью установки для измерения электрической проводимости определили сопротивление раствора KCl с концентрацией 0,02 моль/л. Далее нашли постоянную сосуда.
Измерили сопротивление воды и нашли ее электрическую проводимость, чтобы найти удельную проводимость исследуемого вещества.
Измерили сопротивления приготовленных серий растворов, и рассчитали их молярную электропроводность. Затем построили график зависимости молярной электропроводности от квадратного корня из концентрации, определили молярную проводимость бесконечно разбавленного раствора. Рассчитали вязкость приготовленных растворов, и по полученным данным проверили правило Вальдена.
2.3 Определение чисел переноса методом Гитторфа
Оборудование и реактивы: два стакана на 500 мл; электролитический мостик; два электрода; генератор постоянного тока; миллиамперметр до 50 мА; секундомер; мерная посуда; конические колбы на 100 и 250 мл; индикатор «метиловый оранжевый»; бюретка; рабочие растворы HCl.
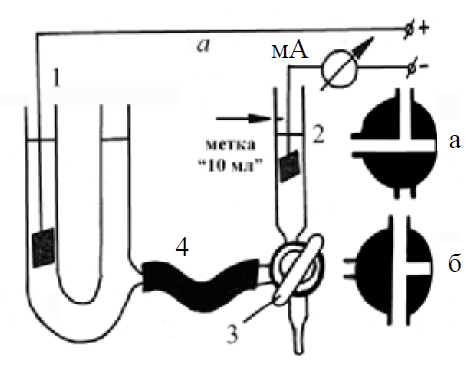
Установка для измерения чисел переноса представлена на рис. 3.8.
Анодное пространство (1) и катодное (2) соединены с помощью
трехходового крана (3). При электролизе кран ставится в положение,
изображенное на рис. 3, а. Для слива католита его переводят в
положение, показанное на рис. 3, б .
Налили в ячейку аликвоту заранее приготовленного раствора HCl с концентрацией 0,05 моль/л. Провели электролиз, записывая значения силы тока каждые 10 минут. После этого измерили объем католита и оттитровали его раствором NaOH с концентрацией 0,05 моль/л.
То же проделали с другими растворами HCl (такой же концентрацией, но разными растворителями)
III. Обработка результатов
3.1 Потенциометрическое титрование
Получили кривую титрования водного раствора соляной кислоты раствором NaOH( рис.1)
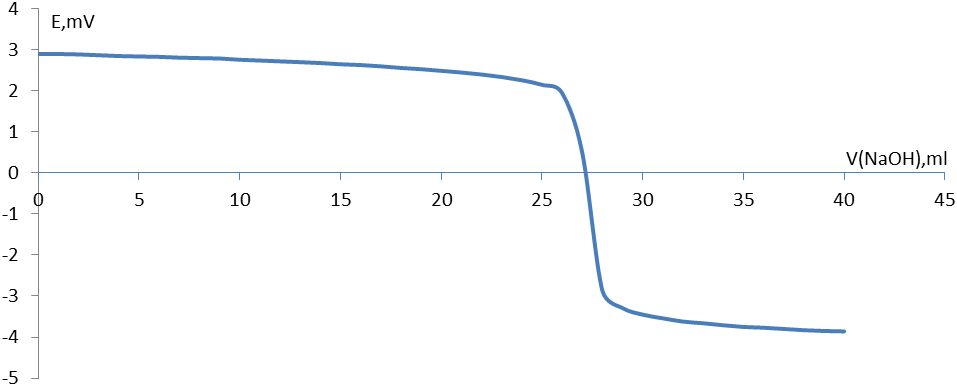
Рис. 1. Кривая потенциометрического титрования 0,2М раствора HCl 0,2М раствором NaОН. Растворитель – вода.
Удобнее определить положение точки эквивалентности по дифференциальной кривой титрования:
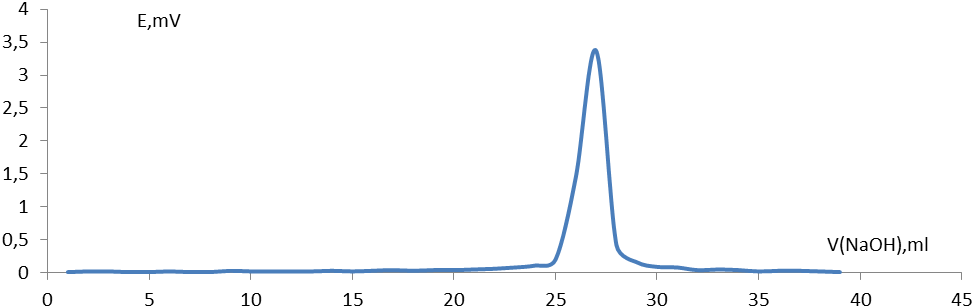
Рис. 2. Дифференциальная кривая потенциометрического титрования раствора HCl 0,2М
Видно, что нейтрализация происходит при добавлении к 25мл НСl 27 мл раствора NaОН.
Начальная концентрация кислоты находится по формуле:
(1)
Вводим поправку на концентрацию растворов:
(2)
Анализ кривых титрования рис. 3. и рис.4 . аналогичен представленному выше.
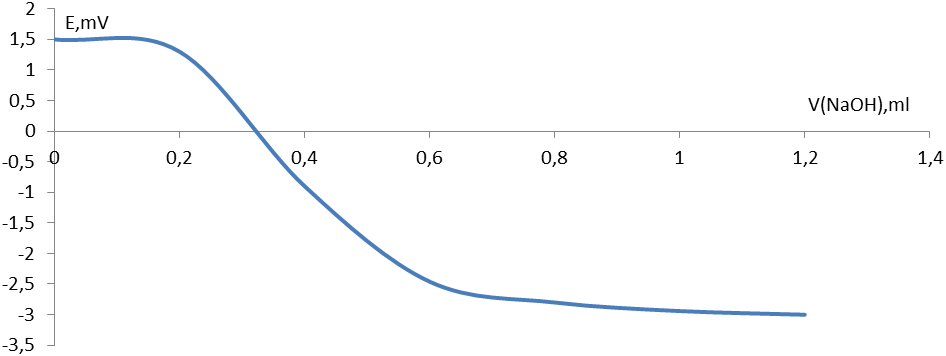
Рис . 3. Кривая потенциометрического титрования для 0,001М раствора HCl 0,05М раствором NaОН. Растворитель – вода.
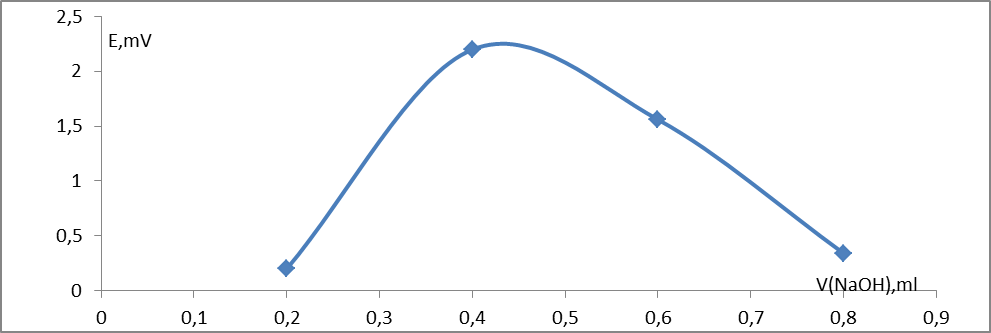
Рис. 4. Дифференциальная кривая потенциометрического титрования раствора HCl 0,001М
Следовательно, нейтрализация происходит при добавлении 0,6 мл раствора NaOH. Тогда начальная концентрация равна:
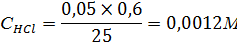
Найдем соотношение :
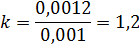
Тогда общая поправка на концентрацию:
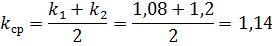
3.2 Электропроводность растворов HCl
Так как электропроводность KCl известна, находим постоянную сосуда по формуле:
, (3)
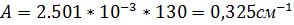
Тогда электропроводность воды равна:
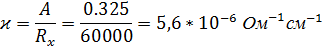
Согласно данным, учитывая что и получаем:
Таблица 1.
Значения удельной и молярной электропроводностей в растворе HCl. Растворитель – вода.
|
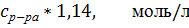
|
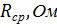
|
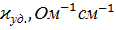
|
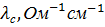
|
|
0,00114
|
1100
|
0,00029
|
254,4192
|
|
0,00228
|
595
|
0,000541
|
237,1938
|
|
0,0114
|
116,5
|
0,002784
|
244,2353
|
|
0,0228
|
60
|
0,005411
|
237,3355
|
|
0,057
|
28
|
0,011602
|
203,5391
|
|
0,228
|
8
|
0,04062
|
178,1561
|
Зависимости молярной электропроводности от квадратного корня из концентрации оказалась линейной (рис.5.)
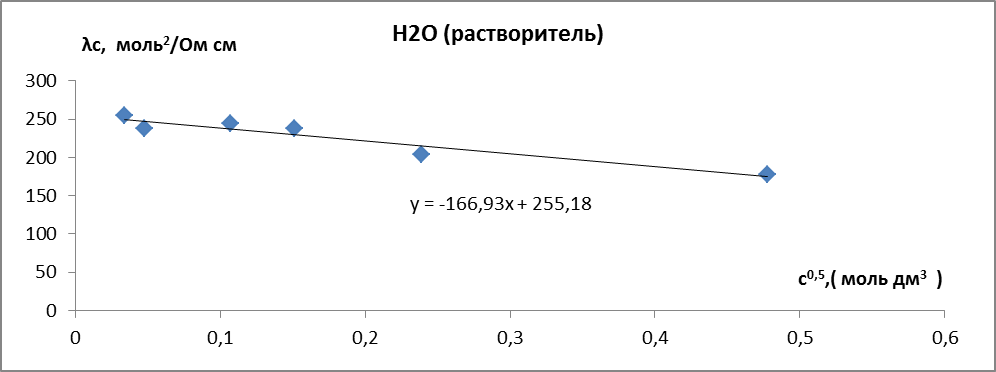 Рис. 5. Зависимость молярной электропроводности раствора HCl от квадратного корня из концентрации. Растворитель – вода.
Рис. 5. Зависимость молярной электропроводности раствора HCl от квадратного корня из концентрации. Растворитель – вода.
Экстраполяцией линейной зависимости на с0 определили
Для серии растворов, с растворителем – вода-глицерин с 5 об.% глицерина получаем:
Таблица 2.
Значения удельной и молярной электропроводностей. Растворитель – вода-глицерин с 5 об.% глицерина.
|
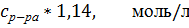
|
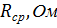
|
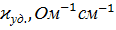
|
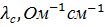
|
|
0,00114
|
600
|
0,000507
|
445,137
|
|
0,00228
|
350
|
0,000894
|
392,2636
|
|
0,0114
|
135
|
0,002373
|
208,1752
|
|
0,0228
|
70
|
0,004609
|
202,1336
|
|
0,057
|
30
|
0,010799
|
189,4583
|
|
0,228
|
11
|
0,029511
|
129,4353
|
Определили аналогичным образом
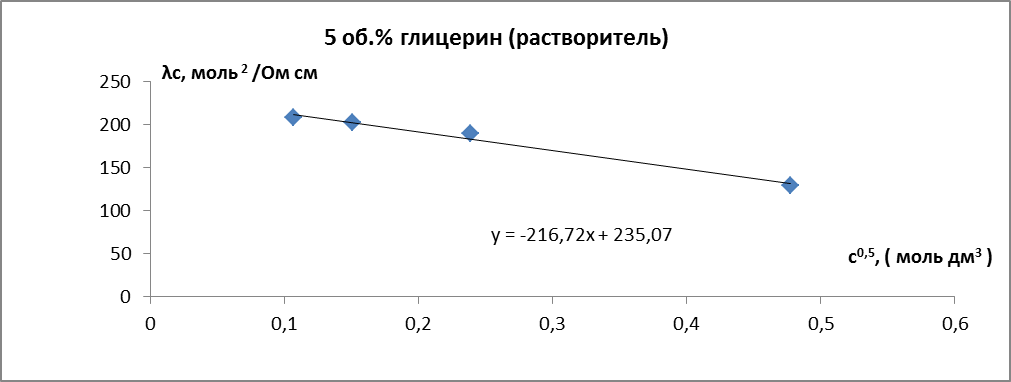
Рис. 6. Зависимость молярной электропроводности раствора HCl от квадратного корня из концентрации. Растворитель – вода-глицерин с 5 об.% глицерина.
Таким образом
Для серии растворов, с растворителем – вода-глицерин с 10 об.% глицерина получаем:
Таблица 3.
Значения удельной и молярной электропроводностей. Растворитель – вода-глицерин с 10 об.% глицерина.
|
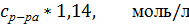
|
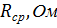
|
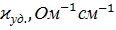
|
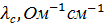
|
|
0,00114
|
560
|
0,000536
|
470,5598
|
|
0,00228
|
285
|
0,001096
|
480,8912
|
|
0,0114
|
120
|
0,002664
|
233,7206
|
|
0,0228
|
60
|
0,005373
|
235,6468
|
|
0,057
|
29
|
0,011163
|
195,8417
|
|
0,228
|
11,5
|
0,028217
|
123,7586
|
Определим :
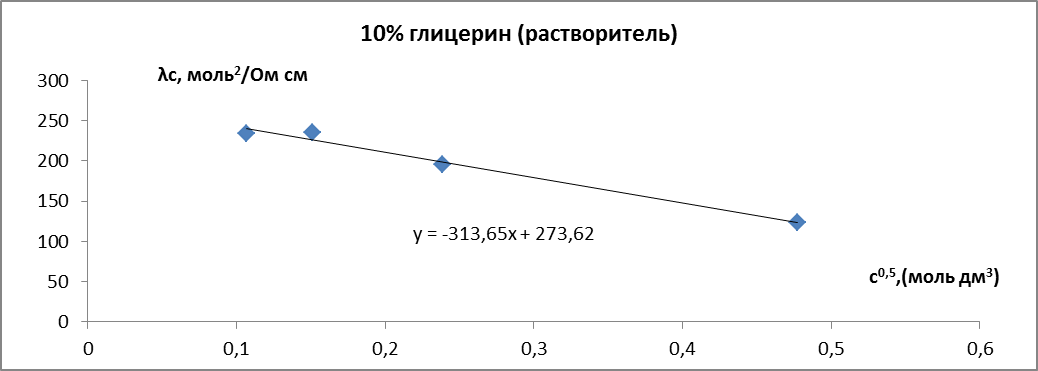
Рис. 7. Зависимость молярной электропроводности раствора HCl от квадратного корня из концентрации. Растворитель – вода-глицерин с 10 об.% глицерина.
Таким образом
Для серии растворов, с растворителем – вода-глицерин с 20 об.% глицерина получаем:
Таблица 4.
Значения удельной и молярной электропроводностей. Растворитель – вода-глицерин с 20 об.% глицерина.
|
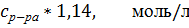
|
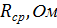
|
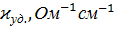
|
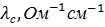
|
|
0,00114
|
900
|
0,000296
|
259,7466
|
|
0,00228
|
500
|
0,000585
|
256,5789
|
|
0,0114
|
205
|
0,00152
|
133,3654
|
|
0,0228
|
100
|
0,003185
|
139,693
|
|
0,057
|
49
|
0,006568
|
115,222
|
|
0,228
|
16
|
0,020248
|
88,80482
|
Определим :
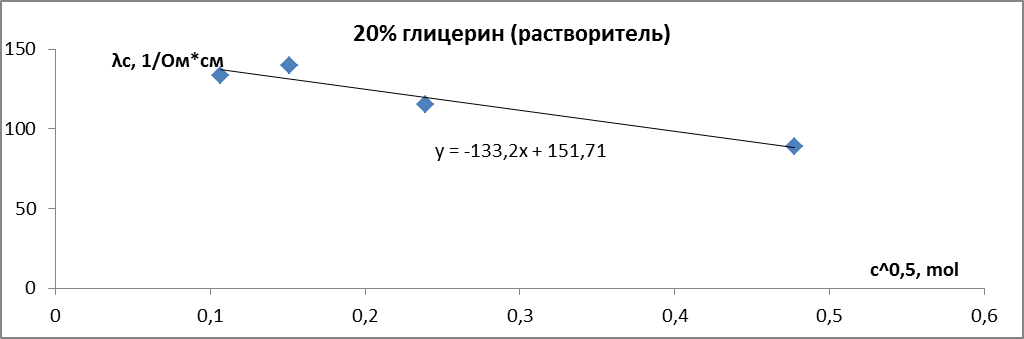
Рис. 8. Зависимость молярной электропроводности раствора HCl от квадратного корня из концентрации. Растворитель – вода-глицерин с 20 об.% глицерина.
Таким образом
Вязкость раствора рассчитывается по формуле:
, (4)
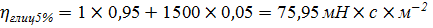
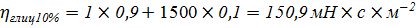
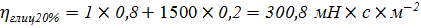
Проверка правила Вальдена:
(5)
Таблица 5.
Правило Вальдена.
|
|
|
|
Растворитель – вода.
|
260
|
|
Растворитель – вода-глицерин с 5 об.% глицерина
|
17848,25
|
|
Растворитель – вода-глицерин с 10 об.% глицерина
|
41346,6
|
|
Растворитель – вода-глицерин с 20 об.% глицерина
|
45721,6
|
3.3 Числа переноса
Посчитаем конечную концентрацию, учитывая что
Таблица 6.
Расчет конечных концентраций различных растворов.
|
|
t,сек
|
I,мА
|
V(NaOH), мл
|
V (католита), мл
|
Скон, моль/мл
|
|
Растворитель – вода-глицерин с 5 об.% глицерина
|
4200
|
39,4
|
12,6
|
12
|
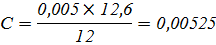
|
|
Растворитель – вода-глицерин с 10 об.% глицерина
|
3600
|
43,6
|
6,7
|
14
|
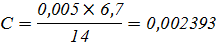
|
|
Растворитель – вода-глицерин с 20 об.% глицерина
|
4200
|
23,2
|
6,2
|
13,5
|
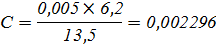
|
Рассчитаем числа переноса по формулам:
(6)
(7)
Учитывая, что . и получаем:
Таблица 7.
Расчет чисел переноса различных растворов.
|
|
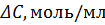
|
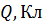
|
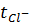
|
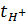
|
|
Растворитель – вода-глицерин с 5 об.% глицерина
|
0,00045
|
165,48
|
0,003149
|
0,996851
|
|
Растворитель – вода-глицерин с 10 об.% глицерина
|
0,003307
|
156,96
|
0,028466
|
0,971534
|
|
Растворитель – вода-глицерин с 20 об.% глицерина
|
0,003404
|
97,44
|
0,045507
|
0,954493
|
Пользуясь табл.7, можно увидеть, что числа переноса для катиона больше, чем для аниона, поскольку для ионов в водном растворе существует эффект туннелирования протона, позволяющий переносить заряд без затраты энергии . С увеличением вязкости числа переноса для катиона уменьшаются, а для аниона- увеличиваются.
Найдем подвижность ионов по формуле:
(8)
Таблица 7.
Расчет подвижности ионов различных растворов.
|
|
Ом-1см-1моль-1
|
,Ом-1см-1моль-1
|
|
Растворитель – вода-глицерин с 5 об.% глицерина
|
188,8634
|
0,596614
|
|
Растворитель – вода-глицерин с 10 об.% глицерина
|
190,2653
|
5,57469
|
|
Растворитель – вода-глицерин с 20 об.% глицерина
|
109,9767
|
5,243285
|
IV.Выводы
- Определили молярную и удельную электропроводность в растворах соляной кислоты в разных растворителях.
- Установили, что вязкость раствора влияет на значение молярной и удельной электропроводности.
- Установили, что правило Вальдена не выполняется, так как данное правило подходит для больших органических ионов, что не соответствует нашему условию.
- Пользуясь значениями чисел переноса, рассчитали молярные подвижности катиона и аниона в растворах с различной вязкостью.
V.Список литературы
1. Измайлов И.А. Электрохимия растворов
2. Дамаскин Б.Б., Петрий О.А. Электрохимия. М.: Высш. шк., 1987
3. Антропов Л.И. Теоретическая электрохимия, 1984
4. Курс физической химии, т.II / под. ред. Герасимова Я.И. М.: Химия,
1973 С. 397-430.
5. Краснов К.С., Воробьев Н.К., Васильева В.Н., Годнев И.Н., Физическая химия, т.II/ под. ред. Краснова К.С.
6. Практикум по Электрохимии
Рис.2. Схема установки для измерения электропроводности
растворов
Рис. 3. Установка для
определения чисел
переноса и положения
трехходового крана 3
при электролизе (а) и сливе католита (б)
Влияние вязкости растворителя на подвижность ионов сильного электролита