ВЛИЯНИЕ ФИЗИКО-ХИМИЧЕСКИХ ФАКТОРОВ НА РОСТ НЕФТЕОКИСЛЯЮЩИХ АКТИНОБАКТЕРИЙ
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
(ФГБОУ ВПО «КубГУ»)
Кафедра генетики, микробиологии и биотехнологии
ДОПУСТИТЬ К ЗАЩИТЕ В ГАК
Заведующий кафедрой –д-р биол.
наук, доцент В.В.Тюрин
« » 2014г.
ВЫПУСКНАЯ КВАЛИФИКАЦИОННАЯ РАБОТА
БАКАЛАВРА
ВЛИЯНИЕ ФИЗИКО-ХИМИЧЕСКИХ ФАКТОРОВ НА РОСТ НЕФТЕОКИСЛЯЮЩИХ АКТИНОБАКТЕРИЙ
Работу выполнил Н.В.Лень
(подпись, дата)
Факультет биологический
Направление 020200.62 Биология
Научный руководитель
канд. биол. наук, ст. преп. Н.Н. Волченко
(подпись, дата)
Нормоконтролер
канд. биол. наук, доц. Г. Г. Вяткина
(подпись, дата)
Краснодар 2014
РЕФЕРАТ
Выпускная квалификационная работа бакалавра выполнена на 45 страницах машинописного текста. В работу включено 12 рисунков. Библиографический список содержит 48 источников.
Ключевые слова: НЕФТЕОКИСЛЯЮЩИЕ МИКРООРГАНИЗМЫ, БИОРЕМЕДИАЦИЯ, СТИМУЛЯЦИЯ РОСТА, ЛЁГКАЯ ВОДА, АЗОТ.
Цель работы состояла в оценке влияния легкой воды и изменения химического состава питательной среды на рост нефтеокисляющего микроорганизма Rh. erythropolis B2 из коллекции кафедры генетики, микробиологии и биотехнологии КубГУ.
Использовались такие методы как: методы определения концентрации микроорганизмов с помощью счетной камеры Горяева и оптической плотности, гравиметрический метод; определение показателя гидрофобности клеток и их эмульгирующей активности.
Обнаружено влияние изотопного состава воды на активность роста бактерий Rh. erythropolis В2 при температуре культивирования 20-23°С, где на 4 сутки значения оптической плотности бактериальной суспензии равнялась 1 условной единицы, что более чем в 5 раз превышает значения на контрольной среде. Отсутствие влияние легкой воды на показатель гидрофобности, и на эмульгирующую активность. Так же был отмечен стимулирующий эффект гидролизата мяса ферментативного в концентрациях 1 г/л и 10 г/л, где концентрация микроорганизмов равно1,1 г/л 2,4 г/л. Влияние мочевины как источника азота на рост и накопление биомассы бактерий, где на 4 сутки культивирования данные по приросту биомассы равны 1,5 условной единицы, что в 1,5 раза выше значений ОП на среде с KNO3.
СОДЕРЖАНИЕ
Определения, обозначения, сокращения……………………………..………….5
Введение…………………………………………………….……………………..6
1 Аналитический обзор………………………………………...………………...8
- Применение микроорганизмов для ликвидации нефтезагрязнений……8
- Влияние физических и химических факторов…………………………..11
- Влияние изотопного состава воды……………………………………….17
2 Материал и методы исследования…………………………………………....20
2.1 Объект исследования……………………………………………………..20
2.2 Использованные питательные среды…………………………………....20
2.3 Культивирования микроорганизмов……….…………………………....22
2.4 Методы определения концентрации микроорганизмов……..………....22
2.5. Определение концентрации биомассы при культивировании на жидкой питательной среде……………………………………………………………….23
2.6 Метод количественного учета микроорганизмов с помощью счетной камеры Горяева………………………...………………………………………...24
2.7 Определение показателя гидрофобности клеток………………..……...24
2.8 Определение эмульгирующей активности………………………….......25
3 Влияние физико-химических факторов на рост нефтеокисляющих актинобактерий……………………………………………………..…………………....27
3.1 Применимость метода измерения оптической плотности, как показателя концентрации клеток для исследуемого штамма…………………...……...27
3.2 Температурная зависимость роста бактерий Rhodococcus erythropolis B2
от изотопного состава воды………………………………..................................28
3.3 Влияние изотопного состава воды на накопление биомассы микроорганизмов……………………………………………...…………………………..…32
3.4 Влияние различной концентрации легкой воды на показатель
гидрофобности бактерий Rhodococcus erythropolis В2………………….........34
3.5 Влияние гидролизата мяса ферментативного в составе среды на накопление биомассы бактерий…………………………………………………….....35
3.6 Влияние различных источников азота на скорость роста бактерий………………………………………………………………………………...38
Заключение ………………………………………………………………………41
Библиографический список……...……………………………….……………..42
ОПРЕДЕЛЕНИЯ, ОБОЗНАЧЕНИЯ, СОКРАЩЕНИЯ.
БиоПАВ – биогенные поверхностно-активные вещества
ГМФ – гидролизат мяса ферментативный
ДТ – дизельное топливо
ЛВ – легкая вода
МПА – мясопептонный агар
НАМК – нитроаммофоска
ПАВ – поверхностно-активные вещества
ПАУ – полициклические ароматические углеводороды
ПГ – показатель гидрофобности
УВ – углеводороды
УОБ – углеводородоокисляющие бактерии
ЭА – эмульгирующая активность
ВВЕДЕНИЕ
Потери нефти и нефтепродуктов в нашей стране при добыче, транспортировке, переработке и хранении, по официальным данным, оцениваются в 8-9 млн. т. в год. Примерно половина из них попадает в почву и подземные воды, другая половина загрязняет поверхностные воды и акватории [Применение различных технологий.., 2004]. В естественные экосистемы часто кроме нефтепродуктов попадают высоко-минерализованные нефтепромысловые сточные воды.
В естественных условиях процессы самоочищения происходят очень медленно. Единственным максимально эффективным методом нейтра-лизации нефти и нефтепродуктов является микробиологический. В отличие от физических и химических методов, он обеспечивает не только обезвреживание углеводородных поллютантов, но и скорейшую их деструкцию с трансформацией в безопасные неорганические соединения.
Перспективным путем решения проблемы нефтяных загрязнений (рекультивация нефтезагрязненных территорий, очистка акваторий от нефтяных разливов) является применение штаммов микроорганизмов, ассимилирующих углеводороды нефти, адаптированных к конкретным условиям [Кудрина, Максимов, 2007]. Способность нефтеокисляющих микроорганизмов окислять углеводороды (УВ) используются для биологической отчистки экосистем, загрязненных нефтью и нефтепродуктами, в частности, при ликвидации нефтяных загрязнений.
Культивирование микроорганизмов занимает значительное место в жизни человека и за последние 20 лет приобрело серьёзные масштабы. При помощи наращивания биомассы микроорганизмов в ферментерах получают огромное разнообразие веществ, используемых в промышленных масштабах. В Кубанском государственном университете в настоящее время проводится масштабирование процесса наращивания микроорганизмов от уровня лабораторного культивирования до уровня экспериментального пилотного производства, и как следствие – ведется поиск новых методов стимулирования роста. Это в перспективе позволит создать новые, более эффективные технологии получения микробных биопрепаратов.
Цель данной работы состояла в изучении влияния физико-химических факторов на изменение скорости роста и накопления биомассы нефтеокисляющего микроорганизма Rhodococcus erythropolis В2 из коллекции кафедры генетики, микробиологии и биотехнологии КубГУ.
Исходя из поставленной цели данной работы, нами были обозначены следующие задачи:
- Изучить влияние изотопного состава воды на накопление биомассы клеток Rhodococcus erythropolis B2;
- Определить зависимость увеличения выхода бактериальной суспензии от увеличения концентрации гидролизата мяса ферментативного (ГМФ) в среде;
- Изучить влияние различных источников азота на скорость роста и накопление биомассы микроорганизмов нефтеокисляющих бактерий штамма Rhodococcus erythropolis В2.
1 Аналитический обзор
- Применение микроорганизмов для ликвидации нефтезагрязнений
Использование ферментативной активности углеводородокисляющих
микроорганизмов для отчистки окружающей среды от нефтяных загрязнений является одной из важных составляющих биоремедиации почв и водоёмов. В настоящее время выделены микроорганизмы-деструкторы, утилизирующие парафины нефти и другие составляющие её фракции. Природные места обитания углеводородокисляющих бактерий (нефтяные месторождения, морские акватории, грунты и почвы, загрязненные нефтепродуктами) различаются как величиной минерализации пластовых вод нефтяных месторождений, соленостью почв, так и галотолерантностью аборигенной микрофлоры [Свойства углеводородокисляющих бактерий.., 2006].
Складирование нефтезагрязнённых отходов является одним из распространенных способов временного решения связанных с ними экологических проблем. К числу таких отходов предприятий по переработке нефти и нефтехимического синтеза относятся нефтезагрязненные почвы, грунты и устойчивые к биодеградации нефтешламы. Нефтешлам представляет собой вязкую массу с сильным запахом нефтяных и нефтехимических компонентов, содержащий преимущественно тяжелые фракции УВ.
В России активно ведутся работы по биоразложению нефтешламов. Так, Никитина Е.В. и соавторы исследовали образцы нефтешлама – отход нефтехимического производства «Нижнекамскнефтихим» (Нижнекамск, Татарстан, Россия), с разных глубин трех участков шламмонакопителя. Основные физиолого-таксономические группы микроорганизмов были представлены аэробными гетеротрофами, актиномицетами, микромицетами, денитрификаторами и сульфатредукторами [Особенности распределения.., 2003].
Тарасов А.Л. с сотрудниками изучали нефтеокисляющие бактерии выделенные из нефти и пластовых вод Бондюжского и Ромашкинского месторождения (Татарстан), Мыхпайского месторождения (Западная Сибирь). Исследования, проведенные на нефтяных месторождениях, показали, что в пластовых водах распространенны бактерии, относящиеся к родам Rhodococcus, Arthrobacter, Micrococcus, Psyhrobacter, Spirillum, Acinetibacter, Flavobacterium, Bacillus. [Динамика микробных процессов…, 2002].
Ксенобиотики, содержащие ароматические углеводороды, являются одними из наиболее распространенных антропогенных загрязнителей. Они наносят серьезный ущерб окружающей среде. Изучение литературных источников по биодеградации ксенобиотиков микроорганизмами показало эффективность такого вида очистки. В связи с этим поиск эффективных путей их биодеградации с помощью микроорганизмов представляется весьма актуальным [Исследование способности нефтеокисляющих…, 2002].
Могилевская И.В. и Владимцева И.В. использовали углеводородокисляющие микроорганизмы для биологической отчистки сточных вод, относящиеся к следующим родам бактерий: Pseudomonas, Acinetobacter, Arthrobacter, Rhodococcus, Mycobacterium и грибы: Candida, Fusarium. Культивирование проводилось в селективной питательной среде в течение 8 суток для накопления биомассы микроорганизмов. По окончанию культивирования провели высев на плотную питательную среду в чашки Петри для получения изолированных колоний выросших штаммов микроорганизмов. Через 19 суток после высева в жидкую питательную среду коллекция выделенных культур насчитывала 25 штаммов из которых 4 штамма относятся к микроскопическим грибам [Могилевская, Владимцева, 2005].
Из существующих и перспективных направлений ликвидации разливов нефти и нефтепродуктов выделяются:
- Механические методы, осуществляемые с помощью сорбентов.
- Химические методы
- Биологические биологические, с помощью микроорганизмов способных утилизировать нефть и нефтепродукты.
На сегодняшний день механические методы отчистки нефтезагрязненных почв являются наиболее распространенными, однако они имеют существенные недостатки. Поэтому разработка и совершенствование технологий биоремедиации нефтезагрязненных почв в настоящее время являются важной экологической задачей. Биологические методы отчистки почв от нефтезагрязнений, основанные на применение биопрепаратов из активных микробных штаммов, проявляющих способность расти и использовать в качестве источника углерода и энергии углеводороды нефти, получили на сегодняшний день широкое развитие и применение.
Разработка технологий получения биопрепарата нефтеокисляющих бактерий для утилизации нефтяных загрязнений, является одной из приоритетных и весомо важных задач в современной биотехнологии [Перспективы использования…, 2006; Capacity of Oil–Oxidizing Bacteria…, 2002]. Биопрепарат – это концентрат клеток и стимулирующих веществ, способных выполнять какую-либо требуемую функцию. Сухая форма биопрепарата легко транспортируется и имеет значительный срок хранения. Жидкая форма биопрепарата более предпочтительна, но имеет определенные недостатки (срок и условия хранения), снижающие экономическую выгоду [Сравнительная характеристика отечественных биопрепаратов…, 2010].
На основе штаммов микроорганизмов выделяют две основные группы биопрепаратов:
- Биопрепараты на основе монокультуры;
- Биопрепараты на основе микробных консорциумов.
Монобактериальные препараты характеризуются более сильной специфичностью по отношению к УВ, более узким интервалом рН, оптимальным для активности микроорганизмов, поэтому использование в качестве биопрепарата монокультуры в лабораторных условиях менее эффективно, чем препараты из смешанных культур [Новиков, Комзолова , 1992].
Препараты на основе микробных сообществ имеют менее специализированные адаптационные и экологические возможности и наиболее эффективны для очистки почвы и воды в короткие сроки, так как потенциал смешанной культуры обеспечивается сложными ассоциативными связями [Combined Use of Biogenic Additives…, 2002].
1.2 Влияние физических и химических факторов
В настоящее время бактерии рода Rhodococcus привлекают все большее внимание, вследствие их широкого практического использования. Они играют важную роль в процессах почвообразования, в обогащении биоценозов витаминами и другими физиологически активными соединениями, а созданные на их основе препараты используются в биоремедиации окружающей среды от ксенобиотиков, повышении нефтеотдачи почвенных пластов, отчистке сточных вод и почвы от нефтепродуктов и т.д. [Jung, 2004]. Способность этих бактерий эмульгировать и деградировать углеводороды в значительной степени обусловлена особенностями строения клеточной оболочки, содержащей липиды, [Tsitko, Zaitsev, Lobanok , 2003] от состава и метаболизма которых зависит также и адаптация этих микроорганизмов к неблагоприятным условиям [Влияние состава клеточных липидов на…, 2000].
С целью повышения активности микроорганизмов–нефтедеструкторов широко используются методы химической стимуляции за счет внесения различных соединений. Так, Ревин В.В. с коллегами проверили влияние кальция на изменение состава липидов клеток Rhodococcus erythropolis AC-858 в процессе культивирования. В качестве источника ионов кальция применялся СаCl2. В результате опыта было показано, что наиболее быстрый прирост биомассы наблюдался до 4 суток культивирования. Начиная с 6 суток происходило снижение уровня биомассы, что совпадало с началом литических процессов. Наибольшее содержание липидов было в 6-суточных клетках. Сопоставление опытных и контрольных вариантов показало, что при отсутствии ионов кальция в питательной среде, выход биомассы был незначительный, а добавление ионов кальция стимулировало рост бактерий. Выход биомассы и накопление клеточных липидов были почти в 1,5 раза больше в среде с ионами кальция, чем в контроле [Влияние кальция на изменение…, 2008].
Среди химических веществ, загрязняющих окружающую среду, особое место занимают тяжелые металлы. Это обусловлено тем, что металлы, в отличие от органических загрязнителей, не подвергаются процессам разложения. К тяжелым металлам относят группу химических элементов, имеющие плотность более 5 г/см3 и относительную атомную массу более 40 а.с.м. [Фрумин, 2002]. При эффективных биотехнологических методах отчистки экосистем, загрязненных тяжелыми металлами и нефтепродуктами, предлагается использование микроорганизмов с высокой активностью оксигеназ и устойчивые к воздействию токсичных металлов [Christofi, Ivshina, 2002].
Костина Л.В. с коллегами изучали устойчивость актинобактерий к солям ванадия. В результате работы было исследовано 64 штамма актинобактерий, показано что 52 из 64 штаммов сохраняют жизнеспособность при концентрации ванадата натрия, как источника ионов ванадия, превышающей ПДК = 150 мг/кг ванадия в 85 раз. Наиболее устойчивые к солям ванадия штаммы Dietzia maris ИЭГМ 147, Gordonia rubropertincta ИЭГМ 95, Gordonia terrae ИЭГМ 147, Rhodococcus ruber ИЭГМ93, ИЭГМ 231 [Костина, Куюкина, Ившина, 2004].
В связи с тем что биологическая деградация нефти в окружающей среде начинается микроорганизмами-деструкторами, важно, чтобы их численность была высокой особенно на начальном этапе восстановления экосистемы[Eriksson, Dalhammar, Borg-Karlson, 2000]. Короткое лето – основной лимитирующий фактор при биоремедиации в зоне холодного и умеренного климата. Поэтому для этих регионов оптимальным является внесение психротолерантных микроорганизмов, которые обладают достаточной активностью при низкой температуре, приспособлены к сезонным колебаниям температур, в теплый период накапливают биомассу, но продолжают расти в то время, когда активность других бактерий снижена[Заварзин, Колотилова, 2001]. Интродукция этих микроорганизмов, способных функционировать при низких положительных температурах, позволит продлить период рекультивации на несколько месяцев.
Влияние снижения температуры на активность и рост нефтеокисляющих микроорганизмов изучала Коршунова Т.Ю. с коллегами. В процессе работы были выделены 14 бактериальных изолятов, разлагающих нефть в жидкой среде в условиях низкой положительной температуре. Дальнейший эксперимент показал, что исследуемые культуры различались по способности утилизировать индивидуальные углеводороды. Некоторые штаммы демонстрировали очень низкую деструктивную активность, что может быть вызвано уменьшением растворимости субстрата или отсутствием у этих микроорганизмов ферментных систем, способных функционировать при пониженных температурах. Были отобраны 8 наиболее эффективных штаммов и проведена их идентификация. Среди них оказалось представители родов: Rhodococcus, Pseudomonas, Acinetobacter [Микроорганизмы, разлагающие нефтяные…, 2012].
Азот является элементом, необходимым для существования животных, растений и микроорганизмов, он входит в состав белков (16--18% по массе), аминокислот, нуклеиновых кислот, нуклеопротеидов, и др. В составе живых клеток по числу атомов азота около 2% , по массовой доле -- около 2,5% (четвёртое место после водорода, углерода и кислорода). В связи с этим значительное количество связанного азота содержится в живых организмах, «мёртвой органике» и дисперсном веществе морей и океанов. Это количество оценивается примерно в 1,9·1011 т. В настоящее время особое внимание уделяется не только экспериментам по влиянию источника углерода на физиологические процессы микроорганизмы, но так же большой интерес уделяется опытам с различными источниками азота для нормального роста и развития бактерий [Isolation and partial…, 2003].
В своем опыте Демков В.А. с коллегами проводил эксперимент, где рассматривал влияние нитрилов и амидов на нитрилгидратазную активность и рост Rhodococcus erythropolis Е84. В процессе эксперимента линейные алифатические нитрилы и амиды оказались хорошими источниками азота и углерода для штамма Rh. erythropolis Е84. Изобутилонитрил также использовался в качестве источника азота и углерода, но скорость роста на нем была меньше, чем на линейных алифатических нитрилах. Для проверки ингибирующего действия нитрилы и амиды были в концентрации 20 мМ в среду. В этих условиях подавляли рост только лактонитрил и 2-цианопиридин [Утилизация нитрилов и амидов…, 2008].
Так же влияние источников азота изучала Асланова-Мирзоева Ф.О. с Ганбаровым Х.Т., где в качестве объекта исследования использовали 15 штаммов дрожжевых культур, относящихся к трем родам и 6 видам: Brettanomyces intermedus штаммы СА17 и СА18; Candida kefir штаммы BL2 и BL3; C. macedoniensis штаммы BI79 и MI44; C. рseudotropicalus штаммы B 178, KD18, KD19 и GA16; C. nelliculosa штаммы НА45 и НА46; Saccharomyces cerevisiae штаммы AQ46, ST72 и ST73. В качестве источников азота использовали NaNO3, NH4NO3, (NH4)2SO4, аспарагин, мочевину, пептон. Источники азота добавляли в среду в количестве 0,03%, рассчитанных по азоту, а пептон 0,3%. Культивирование проводили в термостате при температуре равной 28-30С и через 2-3 суток определяли прирост биомассы фотоколориметрически. Из полученных экспериментальных данных Асланова-Мирзоева Ф.О. сделала вывод, что исследованные дрожжевые грибы из неорганических источников азота активно потребляют аммонийные соли, чем нитрат натрия. Так же дрожжевые грибы активно усваивали органические источники азота , но наибольший прирост биомассы наблюдался в среде, где источником азота являлся пептон [Асланова-Мирзоева, Ганбаровым, 2012].
В литературе имеются данные о влиянии некоторых витаминов на рост и образование каротиноидов различными микробами. Наиболее обстоятельно изучалось влияние витамина В1 и органических кислот [Влияние витамина В1 и органических…, 2003; Специфика влияния витаминов…, 2003]. Так, Дараселия Г.Я. проводила опыт о влияние витаминов на рост Rhodococcus sp. В результате опыта она пришла к следующему выводу, что данный штамм ауксотрофен в отношении пиримидинового компонента витамина В1, т.е. культура не способна синтезировать пиримидиновую часть молекулы витамина В1. Добавление к среде витамина В1 несколько увеличивало накопление биомассы по сравнению с контролем, где витамины отсутствовали [Дараселия, 2004]. Так же Дараселия Г.Я. с содействием Фоминой М.И., проводили опыт, основной задачей которого было стимуляция роста и каротиногенеза Rhodococcus specium штамм 44 комплексным кислотным гидролизатом бактериального происхождения. Стимулятор вносили в среду перед стерилизацией, а так же спустя 28 и 48 часов. Однако внесение стимулятора через 24 часа культивирования не оказало никакого действия, а внесение через 48 часов культивирования – угнетало рост и биосинтез каротиноидов. При внесении стимулятора перед стерилизацией среды культивирования увеличивает прирост биомассы, при этом прирост биомассы составил 33% по сравнению в контролем [Дараселия, Фомина, 2008].
Костина Е.Г. с коллегами проводила опыт по влиянию концентрации дизельного топлива на деградацию данного субстрата в процессе роста Rhodococcus erythropolis. В ходе проведения эксперимента дизельное топливо (ДТ) вносили в количестве 1% и 5% от объема среды. Сравнивая данные по убыли ДТ, можно отметить одинаковые закономерности по влиянию концентрации углеводорода, не смотря на то, что в варианте с 5% дизельного топлива суммарная убыль ниже, чем в 1% дизельного топлива. Однако по абсолютным единицам за один и тот же промежуток культура Rhodococcus erythropolis ассимилировала дизельное топливо в 4 раза больше, чем в случае с 1% содержанием [Костина, Атыкян, Ревин, 2008].
Звягинцева И.С. с коллегами изучено влияние солености среды на деструкцию нефтяных масел бактериями штамма Rhodococcus erythropolis ИНМИ100. Для изучения микробиологической деструкции нефти и нефтепродуктов бактерий выращивали на среде Раймонда при содержании NaCl в среде от 0,5 до 10%. В качестве источника углерода использовали техническое турбинное масло, очищенное минеральное масло, смесь парафинов с длиной цепи С14 – С18 и сырую девонскую нефть Ромашкинского месторождения (Татарстан). Установлена зависимость деструкции нефтяных масел культурами Rhodococcus erythropolis от концентрации NaCl в среде. Оптимальное значение солёности для утилизации турбинного масла составляют 0,5%. Минеральное масло и смесь парафинов (С14 – С18) утилизировалось в более широком диапазоне солёности среды (0,5-7%) [Деградация нефтяных масел нокардиоподобными бактериями, 2001].
Антипова К.А. с соавторами исследовала оценку влияния ПАВ на рост и деструктивную активность углеводородокисляющих микроорганизмов. В её работе использовались штаммы Pseudomonas sp. ТУ 10, Bacillus sp. ТУ 22, и Rhodococcus sp. В качестве исследуемых ПАВ использовались додецилсульфат натрия в концентрации 0,2% и 0,4%; тритон Х-100 и твин 80 по 0,05%, 0,1% и 0,2%. Контролем служила среда без диспергентов. Культивирование проводилось во флаконах при температуре 30С в течение 48 часов, после чего определялась концентрация клеток путём посева материала из соответствующих разведений на агаровые чашки, которые помещались в термостат при температуре равной 30С, через 2 суток подсчитывалось число сформировавшихся колоний и определялась концентрация жизнеспособных клеток. В результате опыта было определено, что ПАВ по разному влияли на развитие бактериальных штаммов – тритон Х-100 проявлял стимулирующее действие в отношение всех исследуемых видов микроорганизмов при повышении концентрации, тогда как додецилсульфат натрия оказывал положительное действие только на Pseudomonas sp. ТУ 10, Bacillus sp. ТУ 22 при повышение концентрации, а твин 80 благоприятно влиял на увеличение биомассы Bacillus sp. ТУ 22, и Rhodococcus sp. Из трех испытуемых препаратов он обладал наиболее эффективным действием, которое особенно проявлялось по отношению к Bacillus sp. ТУ 22 и меньшей степени - к родококкам [Влияние поверхностно-активных веществ…, 2007].
В настоящее время одной из основных задач как микробиологии так и биотехнологии является разработка оптимальной питательной среды для выращивания нокардий и родококков. Поэтому Халдун А.О. и Нуратинов Р.А. в своем эксперименте модифицировали среду Гельберга, получив 4 варианта дополнительно внеся картофельный экстракт. Объектами исследования послужили штаммы бактерий родов Rhodococcus и Nocardia. В результате опыта по полученным данным выяснилось, что разработанная новая питательная среда являлась оптимальной из всех испытанных вариантов. На этой среде родококки и нокардии дают обильную биомассу за короткий промежуток времени [Халдун, Нуратинов, 2008].
1.3 Влияние изотопного состава воды
Основную массу природной воды – свыше 99% – составляет протиевая (легкая) вода содержащая 52 ppm дейтерия, в отличие от обычной воды, где содержится 150 ppm дейтерия, но около 90% протиевой воды является недоступной для употребления человеком. Протий — название самого лёгкого изотопа водорода, обозначается как: 1H. Ядро протия состоит из одного протона, отсюда и название изотопа. Протий (protium)составляет 99,985 % от общего числа атомов водорода во Вселенной и является наиболее распространенным в природе среди изотопов всех химических элементов. Молекула протиевой воды состоит из атомов водорода, каждый из которых имеет атомный вес, равный единице, и атома кислорода с атомным весом, равным 16 единицам – 1H216O. Чистой 1H216O в естественных условиях не существует, её получают только в специализированных лабораториях. Для получения чистой 1H216O ведут многостадийную очистку природных вод или синтезируют воду из исходных элементов 1H2 и 16O, которые предварительно тщательно очищают от изотопных примесей.
Лёгкая вода – это сложный по своей структуре и составу продукт, оказывающий полифизиологическое действие на живой организм. В этой связи важно оценить, какое влияние на организм окажет легкая вода. Учитывая роль воды в организме и известные изотопные эффекты тяжелой воды, и результаты, полученные по легкой воде, можно ожидать, что наибольший эффект легкая вода окажет на свойства биологических мембран, регуляторные системы и энергетический аппарат живой клетки. Исходя из этого, Егорова-Зачернюк Т.А. с коллегами, провела опыт по влиянию дейтериевой (тяжелой) воды на мембраны галобактерий и на ступенчатой адаптации галобактерий. Получение адаптированной культуры происходило благодаря постепенному увеличению концентрации тяжелой воды. После 4 пересевов авторы смогли получить полностью адаптированную культуру к высокодейтериевой ростовой среде. При этом включение дейтерия в липиды клеточных мембран составляло около 80% даже при 85%-ом содержании тяжелой воды в среде [Егорова-Зачернюк, Складнев, Швец, 2008].
Так же, Никитин Д.И. с коллегами изучал влияние вариации изотопного состава воды на специфичность отклика бактерий. В своем опыте он использовал восемь сред с разной концентрацией тяжелой воды: 0,01; 0,1; 1,0; 5; 20; 50; 70; 90%. Культивирование проходило в течение 4-7 суток. Результаты влияния тяжелой воды на бактерий оценивали по кинетике роста клеток. Полученные данные показали, что в интервале исследованных концентраций дейтерия обнаружены две зоны различного влияния на бактерии: первая в интервале от 0,01% до 1%, вторая при концентрации больше чем 25%. В зоне малых концентраций при содержании дейтерия 0,01% наблюдалась значительная активация, уменьшавшаяся с ростом концентрации дейтерия и сменившаяся затем ингибированием роста. При 1% дейтерия влияние либо не проявлялось, либо обнаружилось на поздней фазе роста. При 5% дейтерия в воде обнаружилась ограниченная чувствительность лишь бактерий с доминированием лецитина. При концентрации дейтерия больше 25% во всех случаях наблюдалось ингибирование роста [Никитин, Оранская, Лобышев, 2003].
Семенов К.Т. и Асланян Р.Р. наблюдали за особенностями роста культуры одноклеточных водорослей на средах с легкой и тяжелой водой. По полученным данным, ими было установлено, что при использовании легкой воды вместо обычной для приготовления питательной среды, легкая вода стимулировала рост водорослей на экспоненциальной фазе кривой роста, однако к концу культивирования этот эффект практически отсутствовал. Тяжелая вода в концентрации 0,5% в питательной среде немного активировала рост культуры и к концу времени культивирования число клеток в опыте превышало контроль на 10%. При концентрации от 2% до 10%, тяжелая вода не оказывала на рост культуры статистически значимого воздействия. При концентрации тяжелой воды в 20% и более существенно ингибировался рост культуры [Семенов, Асланян, 2013].
2 Материал и методы исследования
Работа проводилась на базе кафедры генетики, микробиологии и биотехнологии Кубанского государственного университета в 2012-2014 учебном году. Образцы легкой воды были предоставлены «Центром новых промышленных технологий» Бизнес–инкубатора КубГУ и содержали в своем составе 52 ppm дейтерия.
2.1 Объект исследования
Объектом исследования послужил штамм из коллекции нефтеокисляющих бактерий кафедры генетики, микробиологии и биотехнологии КубГУ Rhodococcus erythropolis В2. Выбор микроорганизма был основан на исследованиях сотрудников кафедры, показавших что данный микроорганизм способен утилизировать нефтяную пленку более чем на 50% и при этом обладать высокой скоростью роста в жидких средах [Биологическая реабилитация земель…, 2006], высокое выделение ПАВ и сравнительно короткая продолжительность культивирования до наступления стационарной фазы [Биоремедиация черноземной почвы…, 2005].
- Использованные питательные среды
Культивирование проводилось на жидких и плотных питательных средах. Исследуемые бактерии выращивались на твердой питательной среде с агаром производства ГНЦПМ, г. Оболенск (Россия), следующего состава (г/л):
- панкреатический гидролизат рыбной муки – 24,0
- натрий хлористый – 4,0
- агар микробиологический – 12,0
- рН 7,3
Стерилизация питательной среды проводилась в стеклянной лабораторной посуде при t=120°С и давлении 0,5 атм. в течение 30 минут в паровом стерилизаторе ВК-75-01.
Использовалась стандартная жидкая питательная среда без источника углерода (г/л):
- KNO3 – 4,0
- Na2HPO412H2O – 1,4
- KH2PO4 – 0,6
- MgSO47H2O – 0,8
- стандартный раствор микроэлементов (из 10 элементов) – 1мл на 1 л среды. Стерилизация проводилась аналогично среде МПА. И две модернизированные минеральные среды, модернизация заключалась в изменении химического источника азота следующего состава (г/л):
- NH4HCO3 1,4
- Na2HPO412H2O – 1,4
- KH2PO4 – 0,6
- MgSO47H2O – 0,8
- КСl 3
- стандартный раствор микроэлементов (из 10 элементов) – 1мл на 1 л среды. Стерилизация проводилась аналогично среде МПА
- (NH2)2CO 1,7
- Na2HPO412H2O – 1,4
- KH2PO4 – 0,6
- MgSO47H2O – 0,8
- КСl 3
- стандартный раствор микроэлементов (из 10 элементов) – 1мл на 1 л среды. Стерилизация проводилась аналогично среде МПА.
В качестве единственного источника углерода использовали сахарозу (С12Н22О11) или гексадекан (С16Н34). Использование сахарозы обусловлено её применением в качестве С–субстрата при возможном дальнейшем масштабировании культивирования в ферментерном комплексе ОКА-01. Все углеводороды проходили автоклавирование по выше описанной методике.
Чистые культуры бактерий выращивались на скошенном мясопептонном араге (состав представлен ранее).
- Культивирования микроорганизмов
Культивирование бактерий производилось в плоскодонных колбах, с начальным объемом среды 150 мл и внесенным в среду инокулятом объемом 0,75 мл. Процесс культивирования протекал на орбитальной качалке (Biosan multi-shaker psu-20), при температурах культивирования t°=30-33°С, t°=20-23°C и частоты вращения 120 об/мин. Микроорганизмы росли в питательной среде минимального состава минеральных солей (состав представлен в разделе «Питательные среды») и сахарозой в качестве источника углерода, на протяжении 4 суток.
- Метод определения концентрации микроорганизмов
Метод определения оптической плотности (ОП) культуры, как показатель концентрации клеток и количества биомассы в исследуемом образце [Рубан,1976; Режимы раздельного и…, 2008]. Измерения проводились на колориметре фотоэлектрическом концентрационном КФК-2МП, для пересчета ОП в количество клеток использовались калибровочные графики.
Гравиметрический метод определения абсолютно сухой биомассы, заключался в центрифугировании нативной жидкой культуры в течение 30 минут, с последующим аккуратным отделением супернатанта, выдерживанием центрифугированной биомассы в сушильном шкафу в течение трех суток и взвешиванием сухой массы бактерий на весах второго класса точности (погрешность 0,0005 г) с вычетом массы центрифужных пробирок.
2.5 Определение концентрации биомассы при культивировании на жидкой питательной среде
Использовалась усовершенствованная методика Brown для определения абсолютно сухого веса (АСВ) биомассы [Brown, Punchik, Cooper, 1997]. Во взвешенные с точностью до 0,0001 г чистые центрифужные пробирки емкостью 12 мл помещали 10 мл исследуемой суспензии клеток. Пробирки центрифугировали 30 мин при 3500 об/мин. При помощи пастеровской пипетки отбирали чистый супернатант, либо, в случае всплывания части биомассы. В пробирку добавляли 9 мл дистиллированной воды, клетки ресуспендировали, затем центрифугировали повторно. [Методы общей бактериологии, 1983]. После трех циклов отмывки дистиллированной водой, согласно правилам определения концентрации биомассы при культивировании на углеводородах [Marino, Karp, Cooper, 1998], клетки промывали органическим растворителем для удаления остатков углеводородного субстрата, адсорбировавшегося на поверхности микроорганизмов и посуды. В качестве растворителя использовали гексан. После удаления гексана, клеточную биомассу сушили непосредственно в центрифужной пробирке до АСВ. Пробирки взвешивали, на основании разницы между массами исходной пустой и заполненной высушенными клетками пробирок судили о концентрации биомассы. В случае присутствия в жидкой минеральной среде нерастворимого осадка солей, из полученной массы вычитали массу сухих веществ соответствующего объема неинокулированного контроля.
В экспериментах по оптимизации состава питательной среды для наработки биомассы клеток, культивирование велось непосредственно в центрифужных пробирках на орбитальной качалке при частоте оборотов 200 об/мин.
- Метод количественного учета микроорганизмов с помощью счетной камеры Горяева
Счетная камера Горяева представляет собой предметное стекло, разделенное бороздками на части. Центральная часть стекла ниже боковых на 1/10 мм, на ней нанесена сетка. Площадь большого квадрата сетки равна 1/25 мм2, площадь малого квадрата – 1/400 мм2. Покровное шлифованное стекло притирают к камере до появления радужных полос. Пастеровской пипеткой вводят в камеру исследуемую бактериальную суспензию. Клетки микроорганизмов подсчитывают с объективом 40х в фазово-контрастном микроскопе. Объем столба жидкости над каждым квадратом составляет 1/250 мм3[Пименова, Гречушкина, Азова, 1971].
Количество клеток в 1 мл исходной суспензии вычисляют по формуле:
M= a1000 / hS, где (1)
М – число клеток в 1 мл суспензии;
а – среднее число клеток в квадрате сетки;
h – глубина камеры в мм;
S – площадь квадрата сетки в мм2;
1000 мм3 = 1 мл.
- Определение показателя гидрофобности
Показатель гидрофобности (ПГ) демонстрирует соотношение гидрофильных и гидрофобных компонентов клеток в поверхностных слоях их оболочки и является важной физико-химической характеристикой. При измерении ПГ в качестве углеводородной фазы используют хлороформ [Оценка гидрофобных свойств…, 2002]. Определение ПГ проводились по следующей схеме:
- Разбавить в 10 раз 1 мл суспензии клеток, после чего измерить оптическую плотность (ОП). Измерения проводились на колориметре фотоэлектрическом концентрационном КФК-2МП.
- Рассчитать количество буфера и суспензии для получения ОП = 0,25 (длина оптического пути 3,0 мм, = 670 нм) с общим объемом 4,5 мл.
Количество суспензии (а): а = 4,5м – ( ОП=0,25)
Количество буфера (в); в = 4,5 – а.
- Приготовить суспензию согласно найденным объемам и измерить ОП1 (исходную).
- Внести 1 мл хлороформа во все пробирки и поставить на качалку на 15 мин. ( 150 об/мин) в горизонтальном положение.
- Отстаивать в вертикальном положение час, после этого измерить ОП2 ( конечная).
- Найти ПГ по формуле:
ПГ = 100 - ОПпосле / ОПдо 100% (2)
- Определение эмульгирующей активности
Эмульгирующую активность (ЭА) определяли встряхиванием в химической пробирке 4 мл бактериальной суспензии с 3 мл дизельного топлива на орбитальной качалке при 200 об/мин с последующим отстаиванием в вертикальном положении в течение 1 часа для разделения водной и углеводородной фаз. Наличие или отсутствие эмульсии на границе раздела фаз определяется визуально: "+" - эмульсия есть, "-" - эмульсия отсутствует. Так же эмульгирующую активность - рассчитывают количественно по формуле:
ЭА = (Нэ/Н)100, где (3)
ЭА - эмульгирующая активность (%),
Н э - высота столбика эмульсии (мм),
H - высота всего столбика жидкости в пробирке (мм) [Willumsen, Karlson, 1997].
3 Влияние физико-химических факторов на рост нефтеокисляющих актинобактерий
Для более эффективного выращивания микроорганизмов в лабораторных или промышленных условиях необходимо определить степень влияния физических и химических факторов и оптимизировать состав питательной среды.
3.1 Применимость метода измерения оптической плотности, как показателя концентрации клеток для исследуемого штамма
За параметр, косвенно говорящий о количестве клеток и интенсивности роста микроорганизмов, была выбрана оптическая плотность жидкой культуры, которая измерялась на фотоэлектроколориметре. Сложности с отработкой методики связанны с особенностью клеток данного штамма собираться в клеточные агрегаты, что ведет за собой снижение оптической плотности при неизменном значении концентрации клеток. Так же в связи с вышеописанной причиной практически все измерения оптической плотности культур будут сравниваться с другим методом оценки количества клеток в единице объема жидкости.
Для определения прямой зависимости концентрации бактерий от оптической плотности культуры было проведено сравнение показаний оптической плотности культуры и количественного учета микроорганизмов с помощью счетной камеры Горяева. Из полученных данных можно говорить о достоверности используемого метода и по калибровочным кривым возможно определить количество клеток по мутности культуры.
Для построения графиков были выбраны показания оптической плотности и количество клеток, учтенных с помощью счетной камеры Горяева.
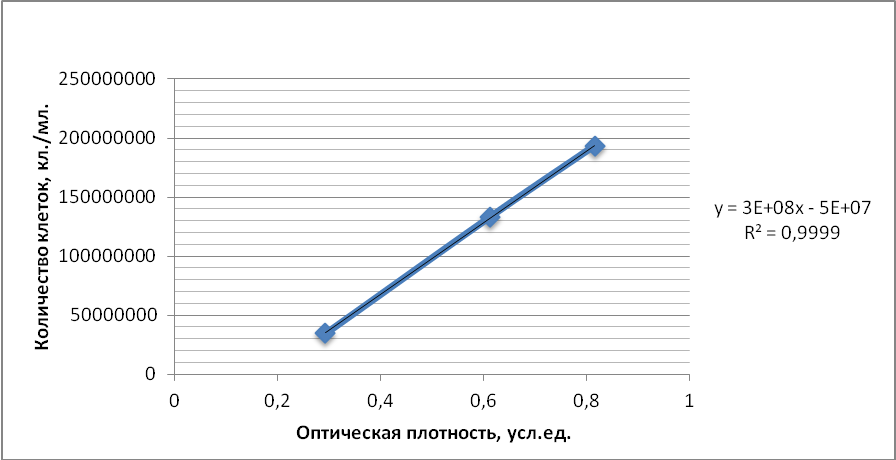
Рисунок 1 — График зависимости оптической плотности от количества клеток бактерий на легкой воде
При сравнении данных зависимости количества клеток от оптической плотности на легкой воде (ЛВ) показано, что в жидкой культуре с ОП 0,2 – 1 усл. ед. при длине волны 670 нм концентрация клеток находится в пределах 5106 – 2,5107 на 1 мл среды. Следовательно, для дальнейших экспериментов оптическую плотность бактериальной суспензии можно использовать как экспресс показатель оценки содержания клеток на основе единого калибровочного графика для образцов в обычной и легкой воде на сахарозе.
- Температурная зависимость роста Rhodococcus erythropolis B2 от изотопного состава воды
Целью эксперимента являлось определение наличия влияния легкой воды на скорость роста и активность бактерий Rhodococcus erythropolis В2. Данный этап исследования заключался в определение прироста биомассы бактерий во времени, для чего необходимо построить кривые роста для данного штамма.
Опыт проводился в разных температурных условиях в трех параллелях при температуре равной t1= 30-33 °С и t2=20-23 °С, где среда на основе легкой воды является опытом, а на основе обычной воды – контролем.
В процессе культивирования отбирались пробы 3 раза в сутки из 2 образцов, в течение 4 суток роста. На основании данных оптической плотности были построены кривые роста.
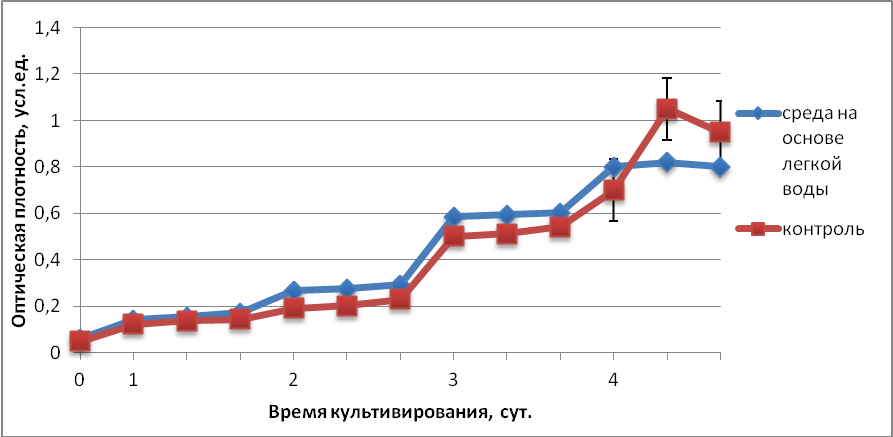
Рисунок 2 – Кривая роста для исследуемого штамма при t1= 30-33°С
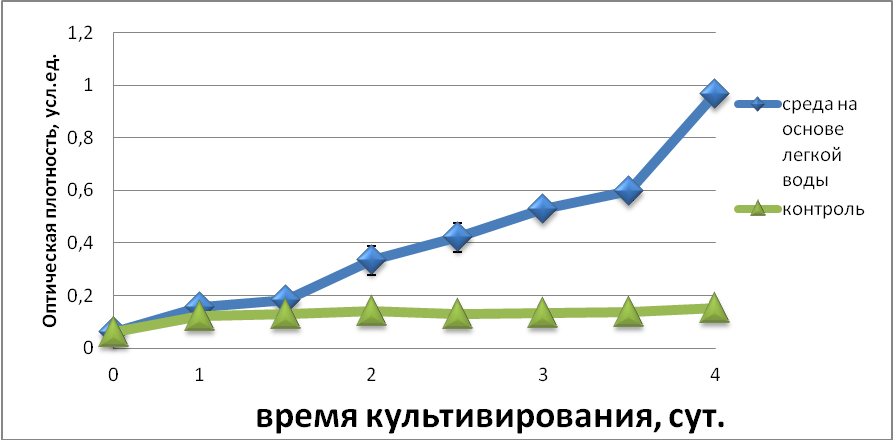
Рисунок 3 Кривая роста для исследуемого штамма при t2= 20-23°С
Сравнивая результаты опытов протекавших при разных температурах, можно отметить отличие роста культуры при 20-23°С. Как видно из рисунка 2, рост микроорганизмов при 30-33°С практически не различался на всех стадиях кривой в случае обычной и легкой воды. На 4 сутки ОП культур обоих вариантов составляло около 0,7, что соответствует 1,5107кл/мл.
В случае снижения температуры культивирования до 20-23°С, наблюдались отличия в интенсивности роста на протяжении всего периода культивирования. В среде на обычной воде сохранялась динамика, аналогичная наблюдаемой при 30-33°С – медленный рост, максимумом оптической плотности составил около 0,2 усл.ед. В случае среды на легкой воде с 1-ых суток интенсивность роста превалировала над контролем и к 4-ым суткам культивирования превышала среду на обычной воде более чем в 5 раз, что соответствовало 2,5107кл/мл. Можно предположить, что лучший рост родококка на легкой воде связан с наличием стрессовой ситуации, в виде понижения температуры. Для более детального изучения влияния легкой воды на Rhodococcus erythropolis В2, рассмотрены такие параметры как: показатель гидрофобности и эмульгирующую активность.
Показатель гидрофобности (ПГ) – служит для процентного определения соотношения гидрофильных и гидрофобных компонентов в клеточной стенке бактерий. Так как Rhodococcus erythropolis В2 выращивался на минеральной среде с сахарозой, являющейся гидрофильным углеродным субстратом, гидрофобность клеток родококка была минимальна – около 10 % [Нефтеокисляющий штамм Rhodococcus erythropolis как…, 2012].
На рисунке 4 представлены величины ПГ клеток в процессе роста. Как видно из приведённых данных отсутствует заметная разница между гидрофобностью бактерий, выросших на легкой и обычной воде. В процессе культивирования гидрофобность клеток снижается.
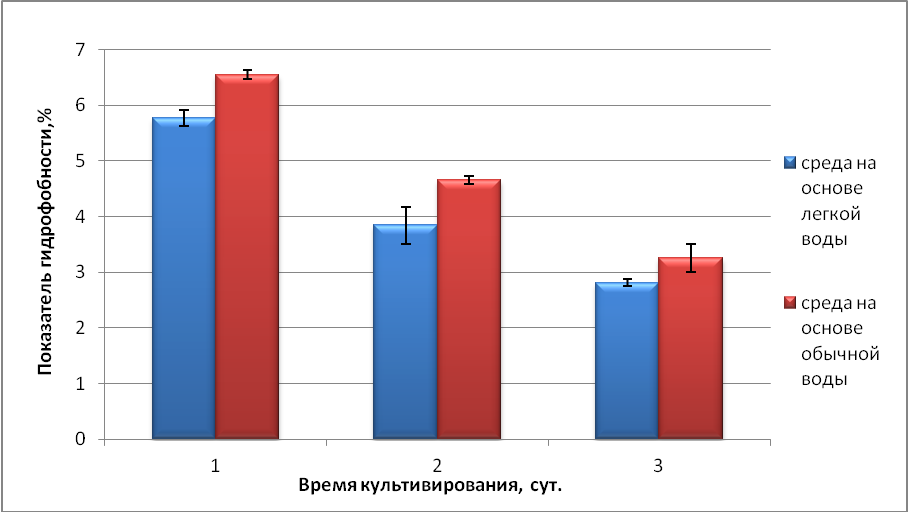
Рисунок 4 – Показатель гидрофобности клеток для культуры В2
Эмульгирующая активность (ЭА) – это показатель, благодаря которому можно определить с какой активностью микроорганизмы могут эмульгировать нефть и её производные.
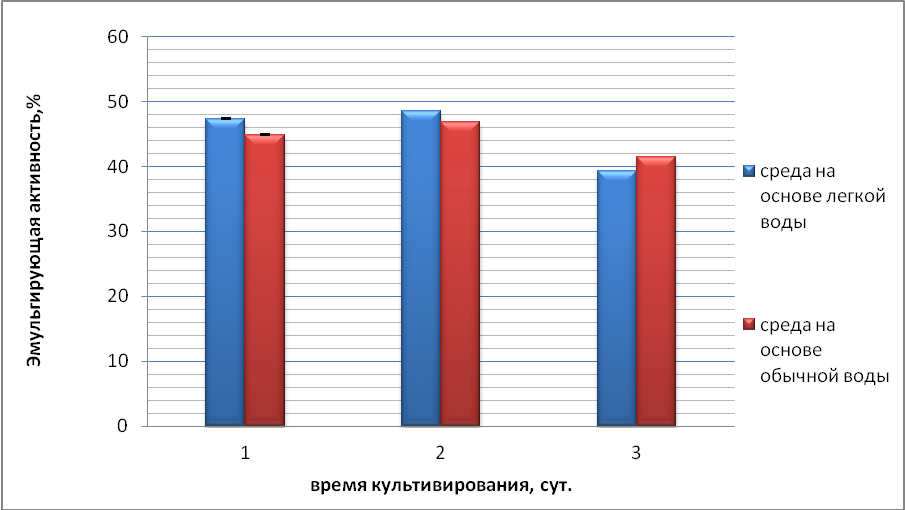
Рисунок 5 – Эмульгирующей активность клеток для культуры В2
На рисунке 5 приведены значения ЭА клеток в процессе роста. Как видно из представленных данных, у бактерий, выросших на легкой и обычной воде, ЭА варьирует в пределах 40 % - 50 %. Наличие ЭА связанно с продуцированием штаммом бактерий Rhodococcus erythropolis B2 биосурфактантов, необходимых для диспергирования и облегчения биоразложения нефтепродуктов [Волченко, Карасева, 2006].
3.3 Влияние изотопного состава воды на накопление биомассы Rhodococcus erythropolis B2
Для опыта использовалось 30 конических колб с минеральной средой на основе легкой воды. Приготовленные среды инокулировали 0,5 мл суспензии клеток Rhodococcus erythropolis В2 смытых с мясопептонного агара (МПА) до стартовой ОП = 0,05-0,07 усл.ед. Культивирование проводилось в течение 7 суток, на орбитальной качалке при 100 об/мин. После окончания культивирования отбиралось по 10 мл суспензии клеток во взвешенные пробирки (на гравиметрию). Опыт проводился в 2 этапа по 3 повторности.
Для оценки влияния изотопного состава воды на накопление биомассы микроорганизмов мы варьировали концентрацию легкой воды в среде роста от 0 до 100 % с шагом в 25 %. В качестве источника углерода использовали сахарозу (С12Н22О11) и гексадекан (С16Н34). На первом этапе культивирование проводилось на минеральной среде при температуре 25 С, где источником углерода являлась сахароза. Концентрация легкой воды в колбах с минеральной средой увеличивалась с шагом в 25%.
Как видно из рисунка 6, наибольшее количество биомассы наблюдается при культивировании культуры В2 в средах с содержанием легкой воды в концентрациях 25% и 100%. В средах с содержанием легкой воды в концентрации 50% и 75% концентрация биомассы незначительно меньше по сравнению с 25% и 100% легкой воды в среде, но превышает количество биомассы по сравнению с контролем.
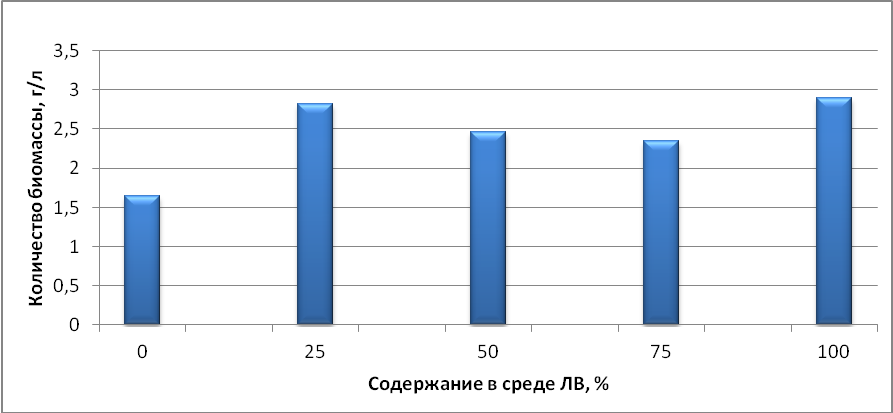
Рисунок 6 – Концентрация биомассы клеток культуры В2 на среде с сахарозой
На втором этапе суспензией клеток взятой из каждой колбы первого этапа инокулировали колбы с минеральной средой где в качестве источника углерода служил гексадекан с соответственной концентрацией легкой воды до значения оптической плотности в диапазоне равном 0,075-0,1 условной единицы.
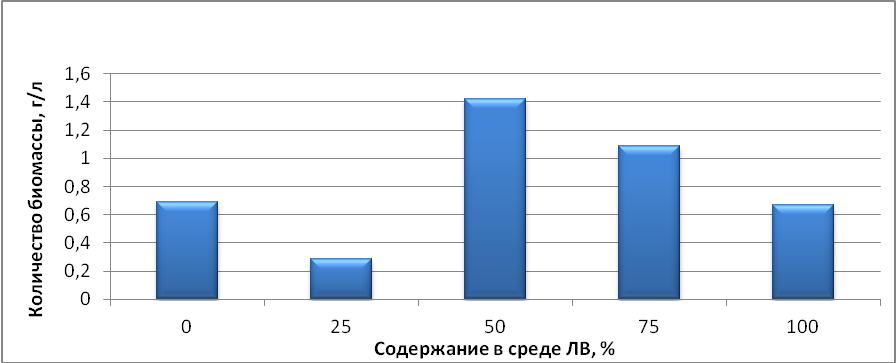
Рисунок 7 – Концентрация биомассы клеток культуры В2 на среде с гексадеканом
По полученным данным, показанным на рисунке 7 обнаружено, что наибольшее значение концентрации биомассы в процессе культивирования достигается при концентрациях легкой воды в среде равных 50% и 75%. Значение количества биомассы при 50% легкой воды равняется 1,4 г/л, что в 2,5 раза больше чем в контроле. При концентрации легкой воды равной 75% накопление биомассы клеток равно 1,1 г/л, это в 2 раза больше чем в контроле. Исходя из представленных данных можно сделать вывод, что для наиболее быстрого накопления биомассы в процессе культивирования необходимо добавление в среду роста легкой воды в концентрации 50%.
3.4 Влияние различной концентрации легкой воды на показатель гидрофобности бактерий вида Rhodococcus erythropolis штамм В2
Для оценки влияния изотопного состава воды на показатель гидрофобности родококков, варьировали концентрацию легкой воды в среде роста от 0 до 100 % с шагом в 25 %. В качестве источника углерода использовали сахарозу (С12Н22О11) или гексадекан (С16Н34). Культивирование проводилось в течение 6 суток.
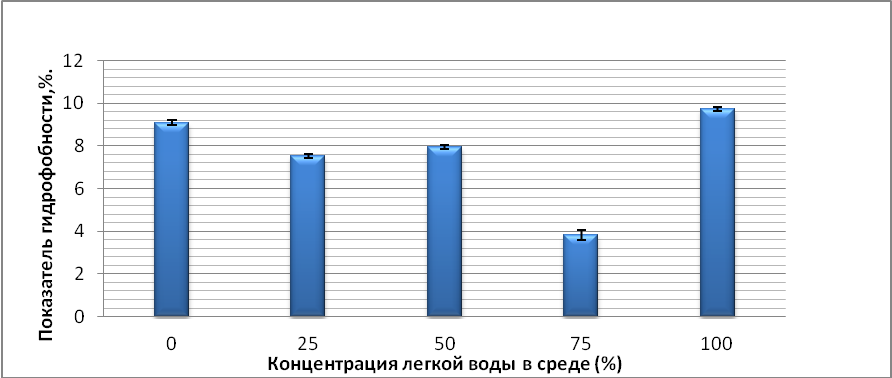
Рисунок 8 – Показатель гидрофобности клеток на среде с сахарозой
Как видно из рисунка 8 максимальная гидрофобность клеток (10 %) зарегистрирована в среде со 100 % содержанием легкой воды, минимальная в среде с содержанием 75 % легкой воды, остальные результаты занимали промежуточное значение. Таким образом, зависимость ПГ клеток от изотопного состава водной среды культивирования носит не линейный характер, гидрофобность клеток значительно не изменяется.
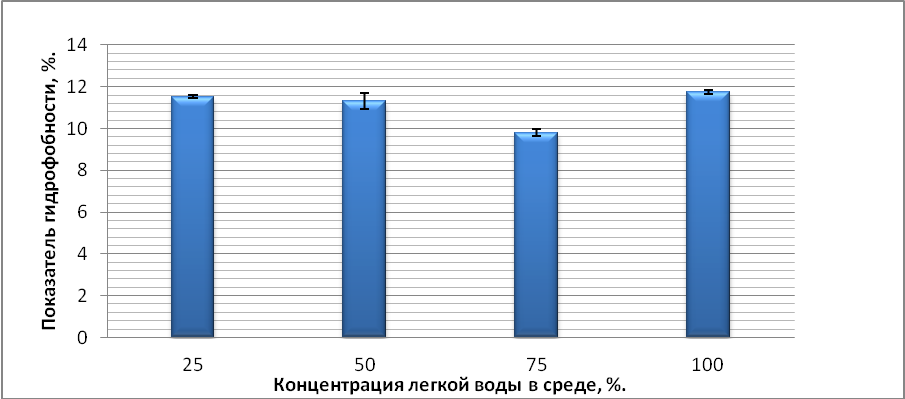
Рисунок 9 – Показатель гидрофобности клеток на среде с гексадеканом
Как видно из данных представленных на рисунке 9, ПГ значительно не различается. То есть видно незначительное изменения ПГ от изотопного состава воды в среде. Так как разница ПГ в средах с различными концентрациями легкой воды минимальна и сильно не отличается, то нельзя судить о достоверных изменениях ПГ от изотопного состава воды в среде роста.
3.5 Влияние гидролизата мяса ферментативного в составе среды на накопление биомассы бактерий
Ключевой задачей культивирования нефтеокисляющих микроорганизмов является увеличение выхода биомассы. С этой целью исследовали эффект включения в состав среды гидролизата мяса ферментативного (ГМФ). ГМФ был выбран в качестве стимулирующей добавки как дополнительный источник широко круга факторов роста (преимущественно полипептидов и аминокислот).
Для опыта использовалось 10 конических колб с осветленной вытяжкой нитроаммофоски из расчета 8 г/л (на водопроводной воде) и сахарозой 14 г/л. В среду вносился гидролизат мяса ферментативный в концентрациях: 10 г/л; 1 г/л; 0,1 г/л. Приготовленные среды инокулировали 0,5 мл суспензии клеток Rhodococcus erythropolis В2 смытых с мясопептонного агара (МПА) до стартовой ОП = 0,05-0,07 усл.ед. Культивирование проводилось в течении 7 суток на орбитальной качалке при 100 об/мин. После окончания культивирования отбиралось по 10 мл суспензии клеток во взвешенные пробирки для весового определения концентрации биомассы. Опыт проводился в 2 параллелях.
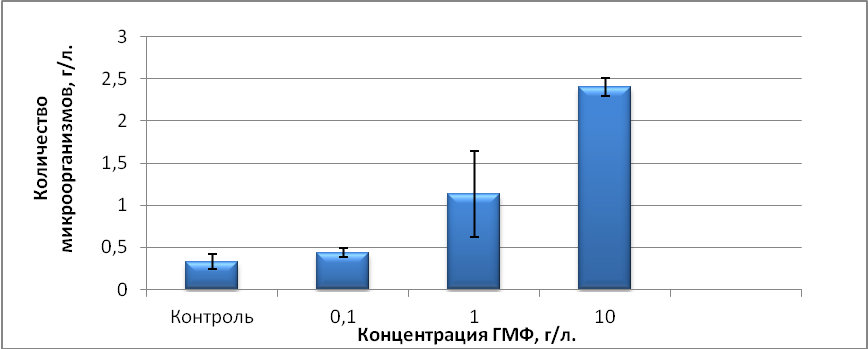
Рисунок 10 – Зависимость количества клеток от концентрации ГМФ
В качестве контролей использовали инокулированую среду без ГМФ и среду с ГМФ без внесения биомассы. Зависимость выхода биомассы от концентрации ГМФ в среде представлены на рисунке 10. Можно отметить линейный положительный характер зависимости прироста биомассы от увеличения концентрации ГМФ. Максимальная активизация роста была достигнута при внесение ГМФ в концентрации 10 г/л и в 7 раз превышала прирост клеток в контроле. С экономической точки зрения более рентабельно вносить в качестве стимулятора ГМФ в количестве 1 г/л, поскольку при снижении выхода биомассы в 2 раза затраты ГМФ снижаются в 10 раз.
При этом затраты на приготовления среды с ГМФ-бульоном и без ГМФ-бульона различается в 2 раза. Для достижения такой же концентрации клеток как в 1 литре среды содержащей ГМФ-бульон, потребуется 3,5 литра стандартной среды. Соответственно их себестоимость будет равна 4,504 рубля и 9,464 рубля, без затрат на воду, энергоснабжение. В процессе масштабирования процесса культивирования с увеличением объемов используемых сред увеличиваются и затраты нас сам процесс. Для достижения такой же концентрации клеток как в 90 литрах среды содержащей ГМФ-бульон, потребуется 315 литров стандартной среды. На приготовление 90 литров среды содержащей ГМФ-бульон затраты будут составлять 405,36 рублей, а на приготовление 315 литров стандартной среды затраты составят 851,76 рублей, без учета стоимости водоснабжения, электроэнергии, хранение, транспортировку, работы сотрудников, а так же увеличения времени культивирования. В связи с этим более рентабельным будет использование среды роста с содержанием ГМФ-бульона, для более быстрого накопления биомассы микроорганизмов, с меньшими затратами по времени и затратами на коммунальные услуг
3.6 Влияние различных источников азота на скорость роста бактерий
Целью данного опыта, было выявить влияние различных источников азота, как органических, так и неорганических, на скорость роста и накопление биомассы Rhodococcus erythropolis B2. В качестве источников азота нами было выбраны: KNO3 – как стандартный источник; NH4HCO3 как неорганический источник азота и мочевина ((NH2)2CO) – как органический источник азота.
Для опыта использовалось 6 конических колб с объемом среды равным 100 мл. в качестве сред использовали две модифицированные минеральные среды и контрольная среда. Опыт проводился в 3 параллелях и 3 повторностях. Приготовленные среды инокулировали 2 мл суспензии клеток Rhodococcus erythropolis В2 смытых с мясопептонного агара (МПА) до стартовой ОП = 0,075-0,09 усл.ед. Культивирование проводилось в течение 4 суток на орбитальной качалке при 120 об/мин. После окончания культивирования культура с каждой среды отсевалась на чашки Петри с МПА для определения чистоты. В процессе культивирования отбирались пробы по 10 мл в целях определения оптической плотности суспензии клеток и рН среды.
Анализируя кривую роста Rhodococcus erythropolis В2 приведенную на рисунке 11 можем заключить, что микроорганизмы выращиваемые на минеральной среде с мочевиной по данным на 1 сутки роста превышают значение ОП культур на стандартной среде и среде, где в качестве источника азота являлся NH4HCO3. На 2 сутки культивирования культуры В2 показатели прироста биомассы для среды с KNO3 и NH4HCO3 одинаковые, а в среде с мочевина значение ОП продолжало лидировать. В последующие дни культивирования бактерии растущие на минеральной среде с мочевиной продолжали лидировать по отношению к другим средам, а микроорганизмы выращиваемые на минеральной среде с NH4HCO3 заметных изменений в увеличении концентрации клеток не имели. По данным снятым на 3 сутки уже наблюдаются значительные изменения в значениях интенсивности роста, которые были так же видны невооруженным глазом по мутности исследуемых сред культивирования. По сравнению с данными снятыми на вторые сутки значение ОП бактериальной суспензии выращенных на средах с такими источниками азота как KNO3 и NH4HCO3 отличались в два раза. На 4 сутки культивирования данные по приросту биомассы культуры на мочевине были равны 1,5 условной единицы, что равно концентрации клеток 4108 на 1 мл среды, и соответственно превышали значение ОП культуры на KNO3 в 1,5 раза. Значение концентрации биомассы культуры культивируемой на NH4HCO3 было меньше от других сред более чем в 2 раза. Исходя из этого, можно сделать вывод, что наиболее оптимальной средой для культивирования Rhodococcus erythropolis B2, среди нами исследованных, является минеральная среда, где в виде источника азота использовалась мочевина.
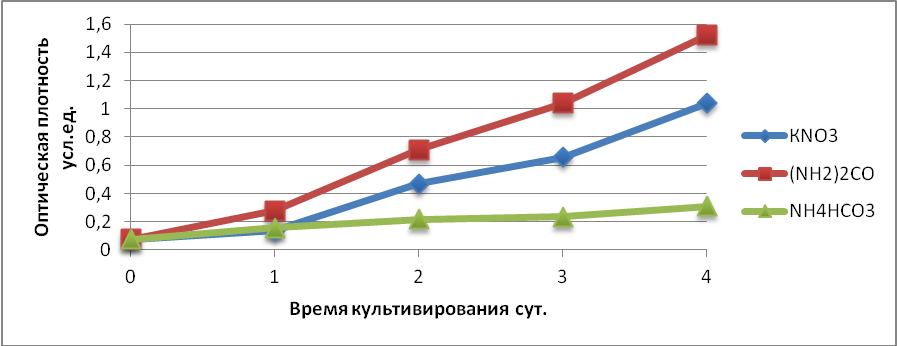
Рисунок 11 – Кривая роста для исследуемого штамма с различными источниками азота
Естественное изменение рН среды в процессе культивирования является, возможно, одной из причин изменения динамики роста бактерий, за счет выделения в питательную среду продуктов их жизнедеятельности и сдвига рН за пределы зоны оптимума. Для сравнительного анализа изменения рН среды и накопления биомассы в процессе культивирования были взяты суспензии культуры штамма В2 из трех сред, для определения кислотности среды.
Как видно из рисунка 12 рН среды с KNO3 была близка к нейтральной, в отличии от рН среды с мочевиной, которая была более слабощелочной, и рН среды с NH4HCO3, которая была слабокислой. При анализе данных представленных на рисунке 11 и рисунке 12, можно заключить, что при росте клеток на среде с KNO3 происходит подщелачивание, в среде с мочевиной кислотность среды не меняется, в отличие от среды с NH4HCO3, где среда подкисляется. Возможно поэтому рост культуры на среде с NH4HCO3 был незначительный и сильно не изменялся. В ходе эксперимента было установлено, что оптимальная кислотность среды для более быстрого накопления биомассы Rhodococcus erythropolis B2, находится в диапазоне от 6,9 до 8,5.
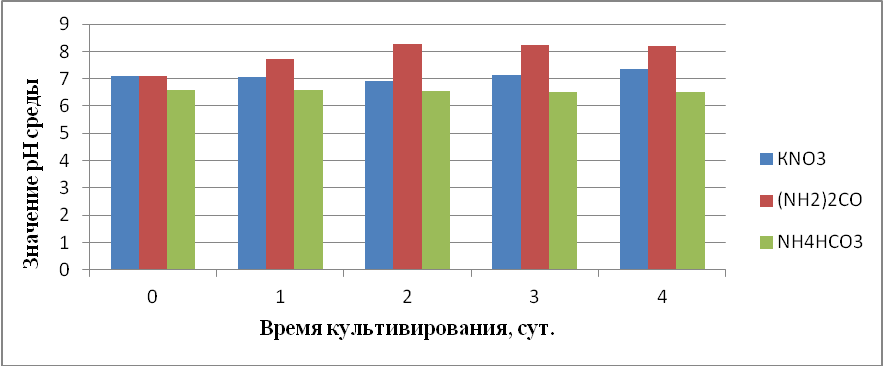
Рисунок 12 – Изменение рН среды от времени культивирования штамма Rh. Erythropolis B2 и источников азота
ЗАКЛЮЧЕНИЕ
По результатам работы сделаны следующие выводы:
- Изотопный состав воды оказывал положительное влияние на активность роста бактерий штамма Rhodococcus erythropolis B2 при температуре культивирования 20-23 °С, где на 4 сутки значения оптической плотности бактериальной суспензии равнялась 1 условной единицы, что более чем в 5 раз превышает значения на контрольной среде и оказывал нейтральное воздействие на рост микроорганизмов при 30-33°С, где значения ОП практически не различались на всех стадиях кривой в случае обычной и легкой воды.
- Наличие легкой вода в составе среды роста не влияет на такие свойства нефтеокисляющих бактерий как показатель гидрофобности клеток и их эмульгирующие свойства.
- На минеральных средах с различной концентрацией легкой воды, где в качестве источника углерода использовался гексадекан, наибольшее накопление биомассы Rh. erythropolis В2 наблюдается при концентрации легкой воды равной 50% и 75%,. Значение количества биомассы при 50% легкой воды равняется 1,4 г/л, что в 2,5 раза больше чем в контроле. При концентрации легкой воды равной 75% накопление биомассы клеток равно 1,1 г/л, это в 2 раза больше чем в контроле.
- ГМФ активизирует рост микроорганизмов, в связи с чем накопление биомассы клеток равно 1,1 г/л при концентрации ГМФ равной 1г/л равно 1,1 г/л, и при концентрации ГМФ 10 г/л концентрация микроорганизмов в процессе культивирования равна 2,4 г/л, в связи с этим ГМФ-бульон может быть использован как химическая добавка в среде роста.
- Мочевина оказывает положительное влияние на рост Rhodococcus erythropolis B2 и может быть использована как источник азота. Значения оптической плотности на среде с мочевиной были равны 1,5 условной единицы и превышали показатели прироста биомассы для сред с KNO3 NH4HCO3 более чем в 1,5 раза.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК.
- Асланова-Мирзоева Ф.О., Ганбаров Х.Т. Влияние источников азота на рост дрожжевых грибов, выделенных из спонтанных простокваш // Вестник МГОУ. Серия: Естественные науки. 2012. №1. С. 22-25.
- Биологическая реабилитация земель, загрязненных нефтепродуктами, в условиях южного федерального округа / Э.В. Карасёва [и др.] // Вестник биотехнологии и физико-химической биологии им. Ю.А. Овчинникова. 2006. Т.2, №4. С. 47-48.
- Биоремедиация чернозёмной почвы, загрязненной нефтью / Э.В. Карасева [и др.] // Биотехнология. №2. С. 67-72.
- Влияние витамина В1 и органических кислот на образование каротиноидов различными микробами. / Л.В. Кравченко [и др.] // Микробиология. 2003 Т. 72, №1. С. 48-53.
- Влияние кальция на изменение состава липидов клеток Rhodococcus erythropolis AC-858 T в процессе периодического и полунепрерывного культивирования на средах с различной концентрацией гексадекана. / В.В. Ревин [и др.] // Вестник ОГУ. 2008. №11. С. 143-149.
- Влияние поверхностно-активных веществ на рост и деструктивную активность углеводородокисляющих микроорганизмов / К.А. Антипова [и др.] // Вестник Казанского технологического университета 2014. Т.17. №3. С. 256-259.
- Влияние состава клеточных липидов на формирование неспецифической антибиотикорезистентности алканотрофных родококков. / М.С. Куюкина [и др.] // Микробиология. 2000. Т.69, С. 62-69.
- Волченко Н.Н., Карасёва Э.В. Способ отбора нефтеокисляющих бактерий-продуцентов биосурфактантов // Биотехнология. 2006. №2. С. 57-62.
- Дараселия Г.Я. Влияние витаминов на рост и каротиногенез Rhodococcus sp. // Известие вузов. Северо-кавказский регион. 2004. №4. С. 54-56.
- Дараселия Г.Я., Фомина М.И. Стимуляция роста и каротиногенеза Rhodococcus specium штамм 44 // Вестник АГТУ 2008. №3. С.173-177.
- Деградация нефтяных масел нокардиоподобными бактериями. / И.С. Звягинцева [и др.] // Микробиология. 2001. Т.64, С. 67-71.
- Динамика микробных процессов в пластовых водах Ромашкинского нефтяного месторождения. / А.Л. Тарасов [и др.] // Микробиология 2002. Т.71, №6. С. 849-857.
- Егорова-Зачернюк Т.А., Складнев Д.А., Швец В.И. Биотехнологическое получение униформно дейтерированных пурпурных мембран галобактерий для нанобиотехнологии // Биотехнология. 2008. №6. С. 60-72.
- Исследование способности нефтеокисляющих бактерий утилизировать углеводороды нефти / Ф.М. Хабибулина [и др.] // Биотехнология 2002. №6. С. 524-548.
- Заварзин Г.А., Колотилова Н.Н. Введение в природоведческую микробиологию М, 2001. 255с.
- Костина Е.Г., Атыкян Н.А., Ревин В.В. Изучение возможности использования Rhodococcus erythropolis для деградации дизельного топлива. // Современные наукоёмкие технологии. 2008. №2. С. 36-41.
- Костина Л.В., Куюкина М.С., Ившина И.Б. Изучение устойчивости актинобактерий к солям ванадия. // Вестник Пермского Университета. 2004. №2. С. 114-117.
- Кудрина Е.А., Максимов А.Ю., Биодеградация дибензотиофена и алканов нефти бактериями рода Rhodococcus // Материалы конференции «Актуальные аспекты современной микробиологии». М. 2007. С.57-58.
- Методы общей бактериологии / под ред. Ф. Герхарда [и др.]. М. 1983 Т.1. 536 с.
- Микроорганизмы, разлагающие нефтяные углеводороды при пониженной температуре / Т.Ю. Коршунова [и др.] // Известия УНЦ РАН. 2012. №3. С 76-82.
- Могилевкая И.В., Владимирцева И.В. Углеводородокисляющие микроорганизмы для биологической отчистки сточных вод и загрязненных почв // Материалы конференции « Современные наукоемкие технологии» 2005. №9. С. 67-68.
- Нефтеокисляющий штамм Rhodococcus erythropolis B2, как основа создания биопрепарата для ликвидации углеводородных загрязнений и рекультивации земель / Э.В. Карасева [и др.] // Научный журнал Кубанского государственного аграрного университета. 2012. №83. С. 154-167.
- Никитин Д.И., Оранская М.Н., Лобышев В.И. Специфичность отклика бактерий на вариации изотопного состава воды // Биофизика. 2003. Т.48, №4. С. 678-682.
- Новиков Ю.В., Комзолова Н.В. Исследования бактериального препарата Путидойл, предназначенного для очистки водоемов от нефти // Водное хозяйство. 1992. №2. С.121-123.
- Особенности распределения и физиологического состояния микроорганизмов нефтешлама – отхода нефтехимического производства / Е.В. Никитина [и др.] // Микробиология 2003. Т.72, №5. С. 699-706.
- Оценка гидрофобных свойств бактериальных клеток по адсорбции на поверхности капель хлороформа. / Е.В. Серебрякова [и др.] // Микробиология. 2002. Т. 71, №2. С. 237-239.
- Перспективы использования бактерий рода Rhodococcus и микробных поверхностно-активных веществ, для деградации нефтяных загрязнений / Е.В. Карпенко [и др.] // Прикладная биохимия и микробиология. 2006. Т.42, №2. С. 157-159.
- Пименова М.Н., Гречушкина Н.Н., Азова Л.Г. Руководство к практическим занятиям по микробиологии М. 1971. 221с.
- Применение различных технологий в промышленной микробиологии. / А.П. Кравченко [и др.], // Биотехнология. 2004. Т. 46, №5. С. 164-170.
- Режимы раздельного и совместного культивирования микроорганизмов – деструкторов нефти родов Pseudomonas и Rhodococcus / А.Е. Филонов [и др.] // Биотехнология. 2008. №6. С 80-83.
- Рубан Е.Л., Практикум по микробиологии / под ред. Н. С. Егорова. М. 1976. 59, 275 с.
- Свойства углеводородокисляющих бактерий, изолированных из нефтяных месторождений Татарстана, Западной Сибири и Вьетнама / И.А. Борзенков [и др.] // Микробиология. 2006. Т.75, №1. С.82-89.
- Семенов К.Т., Асланян Р.Р. Особенности роста культуры одноклеточных зеленых водорослей на средах с дейтериевой водой // Биофизика. 2013. Т.58, С. 70-74.
- Специфика влияние витаминов различных групп на рост и активность микроорганизмов. / Л.В. Косенко [и др.] // Микробиология. 2003. Т.72, №1. С. 40-47.
- Сравнительная характеристика отечественных биопрепаратов, предлагаемых для отчистки почв и грунтов от загрязнений нефтью и нефтепродуктами / Е.А. Рогозина [и др.] // Нефтегазовая геология. Теория и практика. 2010. Т.5, №3. 18с.
- Утилизация нитрилов и амидов штаммом Rhodococcus erythropolis E 84 / В.А.Демаков [и др.] // Биология 2008. №9. С. 48-52.
- Фрумин П.Т. Экологическая химия и экологическая токсикология. СПб. 2002. 245с.
- Халдун А.О., Нуратинов Р.А. Испытание новой питательной среды при изучении экологии микроорганизмов родов Nocardia и Rhodococcus // Юг России: экология, развитие 2008. №4. С. 125-129.
- BrownW.A.,Punchik R., Cooper D.S. Determing biomass from differential total organic carbon // Biotechnology Techniques 1997. Vol. 11. №3. P. 213-216.
- Capacity of Oil-Oxidizing Bacteria of Utilizing Oil Hydrocarbon / F.M. Khabibullina [et al.] // Biotechnology in Russia. 2002. №6. Р. 55-60.
- Christofi N., Ivshina I.B. Microbial surfactants and their use in field studies of soil remediation. // Appl. Microbiol. 2002. V.93. P 915-929.
- Combined Use of Biogenic Additives and the Devoroil Preparation for Rehabilitation of Oil-Polluted Soil / I.M. Gabbosova [et al.] // Biotechnology in Russia. 2002. №2. Р. 41-47.
- Eriksson M., Dalhammar G., Borg-Karlson A.K., Biological degradation of selected hydrocarbons in an old creosote contaminated soil from a gas work site // Appl. Microbiol. Biotechnology. 2000. V.53. P.619-626.
- Isolation and partial biochemical characterization of a protein a ceous antibacterial and anti compound produced by Lactobacillus paracasei / M. Atanassova [et al.] // Inter four. Food microbiology 2003. Vol. 87. P. 63-73.
- Jung I.G., Park C.H. Characteristics of Rhodococcus pyridinovorans PYJ-1 for the biodegradation of benzene, toluene, xylene (BTX), and their mixtures // Biosci. Bioeng. 2004. V.97. №6. Р.429-431.
- Marino F., Karp J.M., Cooper D.G. Biomass measurement in hydrocarbon fermentation // Biotechnology Techniques 1998. Vol. 12. №5. P. 385-388.
- Tsitko I.V., Zaitsev G.M., Lobanok A.G., Salkinoja-Salonen M.S. Effect of aromatic compounds on cellular fatty acid compositing of Rhodococcus opacus // Appl. Environ. Microbiol. 2003. V.65. №2. Р. 853-855.
- Willumsen Р.A., Karlson U.. Screening of bacteria, isolated from PAH-contaminated soils, for production of biosurfactants and bioemulsifiers // Bio-degradation. 1997. V.7. P.415-423.
ВЛИЯНИЕ ФИЗИКО-ХИМИЧЕСКИХ ФАКТОРОВ НА РОСТ НЕФТЕОКИСЛЯЮЩИХ АКТИНОБАКТЕРИЙ