Диссоциация воды. Водородный показатель
Диссоциация воды. Водородный показатель.
Вода является очень слабым электролитом. (Электролит – вещество, раствор или расплав которого проводит электрический ток). Вода диссоциирует (распадается) на составляющие ее ионы:
H2O Н+ + ОН-
Ионное произведение воды КW =[ Н+] · [ОН-] = 10 -14 =const (в квадратных скобках условно указана молярная концентрация ионов моль/л). На практике применяют водородный показатель для определения среды. Водородный показатель – отрицательный десятичный логарифм молярной концентрации ионов водорода: рН= - lg [ Н+] и находится в пределах 0<рН<14
|
Ионы в растворе
|
среда
|
рН
|
|
[ Н+] > [ОН-]
|
Кислая
|
рН< 7
|
|
[ Н+] = [ОН-]=10-7моль/л
|
Нейтральная
|
рН= - lg [ Н+] = - lg10-7 = - ( - 7) = 7
|
|
[ОН-] >[ Н+]
|
Щелочная
|
pH > 7
|
|
где
|
рН
|
где
|
рН
|
|
желудок
|
1-2
|
Дождь
|
5,5-6,5
|
|
кишечник
|
8,5 - 9
|
Водопроводная вода
|
6-6,5-7
|
|
кожа
|
5,5 -6
|
Морская вода
|
8-8,5
|
|
кровь
|
7,35-7,45
|
Почва
|
4-10
|
Гидролиз
Взаимодействие ионов соли с ионами воды, при котором происходит изменение водородного показателя рН, называется гидролизом. Это обратимая реакция.
Если при растворении соли рН не меняется (остается рН=7), то гидролиз не происходит.
Наличие в соли слабого иона обуславливает гидролиз - именно слабый ион присоединяет к себе противоположно заряженный ион воды, образуя при этом новую частицу (с зарядом или без него), а оставшийся ион воды организует среду: Н+ - кислую, ОН - щелочную.
Сильные электролиты.
|
Сильные кислоты
|
Сильные основания
|
|
HCl Н+ + Cl
|
NaOHNa+ + ОН
|
|
H2SO4 2 Н+ + SO42
|
KOH K+ + ОН
|
|
HNO3 Н+ + NO3
|
|
Если в таблице частицы нет, то это будет слабая частица (слабый ион).
Соль состоит из катиона (положительный ион) и аниона (отрицательный ион):
Ме+n К.О.-n (кислотный остаток)
Возможны 4 комбинации соли: 1. сильный + и сильный
2. сильный + и слабый
3. слабый + и сильный
4.слабый + и слабый
Рассмотрим реакции с такими вариациями ионов:
1.NaCl + H2O гидролиза нет, так как нет слабой частицы в соли, и не меняется рН (равен 7)
силь+силь
реакция нейтральная, и идет диссоциация на ионы: NaCl + H2O Na++ Cl+ H2O
2. гидролиз соды (технической)
Na2CO3 + H2O
сильн+слаб
CO32+ Н+ОН- Н+CO32 + ОН- среда щелочная, рН>7 , нужно далее написать в молекулярном виде
Na2CO3 + H2O Na+ Н+CO32 О + Na+ОН- О
3. Гидролиз сульфата цинка
ZnSO4 + H2O
слаб+сильн
Zn+2 + Н+ОН- Zn+2ОН- + + Н+ среда кислая, рН<7, нужно далее написать в молекулярном виде
2ZnSO4 +2H2O ( Zn+2ОН- )+2 SO42- О + Н2+ SO42- О
4. гидролиз карбоната алюминия идет до конца, так как соль составлены из двух слабых частиц.
Al2(СO3)3 + 6H2O 2Al(OH)3 + 3H2CO3
Электрохимия
Если пластину металла поместить в раствор его соли, то на границе твердой и жидкой фаз образуется двойной электрический слой, величину которого оценивают значением электродного потенциала . Для многих металлов электродные потенциалы определены с помощью водородного электрода, потенциал которого принят равным нулю =0. Данные электродных потенциалов представлены в таблице №3 Приложения в методике 4/23/2 «Рабочая программа и задание для контрольной работы».
Стандартные электродные потенциалы ( 0 )
некоторых металлов ( ряд напряжений ) при 298К.
|
Электродная полуреакция
|
, В
|
Электродная полуреакция
|
, В
|
|
Li+ (водн.) + 1e- = Li (тв.)
|
-3.045
|
Cd2+ (водн.) + 2e- = Cd (тв.)
|
-0.403
|
|
Rb+ (водн.) + 1e- =Rb(тв.)
|
-2.925
|
Co2+ (водн.) + 2e- = Co (тв.)
|
-0.277
|
|
K+ (водн.) + 1e- = K (тв.)
|
-2.924
|
Ni2+ (водн.) + 2e- = Ni (тв.)
|
-0.250
|
|
Cs+ (водн.) + 1e- = Cs (тв.)
|
-2.923
|
Sn2+ (водн.) + 2e- = Sn (тв.)
|
-0.136
|
|
Ba2+ (водн.) + 2e- = Ba (тв.)
|
-2.905
|
Pb2+ (водн.) + 2e- = Pb (тв.)
|
-0.126
|
|
Ca2+ (водн.) + 2e- = Ca (тв.)
|
-2.866
|
Fe3+ (водн.) + 3e- = Fe (тв.)
|
-0.037
|
|
Na+ (водн.) + e- = Na (тв.)
|
-2.714
|
2H+ (водн.) + 2e- = H2 (г.)
|
0.000
|
|
Mg2+ (водн.) + 2e- = Mg (тв.)
|
-2.363
|
Sb3+ (водн.) + 3e- = Sb (тв.)
|
+0.200
|
|
Al3+ (водн.) + 3e- = Al (тв.)
|
-1.663
|
Bi3+ (водн.) + 3e- = Bi (тв.)
|
+0.215
|
|
Ti2+ (водн.) + 2e- = Ti (тв.)
|
-1.630
|
Cu2+ (водн.) + 2e- = Сu (тв.)
|
+0.337
|
|
Zr4+ (водн.) + 4e- = Zr (тв.)
|
-1.539
|
Cu+ (водн.) + e- = Cu (тв.)
|
+0.520
|
|
Mn2+ (водн.) + 2e- = Mn (тв.)
|
-1.179
|
Ag+ (водн.) + e- = Ag (тв.)
|
+0.799
|
|
V2+ (водн.) + 2e- = V (тв.)
|
-1.175
|
Hg2+ (водн.) + 2e- = Hg (ж.)
|
+0.850
|
|
Cr2+ (водн.) + 2e- = Cr (тв.)
|
-0.913
|
Pd2+ (водн.) + 2e- = Pd (тв.)
|
+0,987
|
|
Zn2+ (водн.) + 2e- = Zn (тв.)
|
-0.763
|
Pt2+ (водн.) + 2e- = Pt (тв.)
|
+1,188
|
|
Cr3+ (водн.) + 3e- = Cr (тв.)
|
-0.744
|
Au3+ (водн.) + 3e- = Au (тв.)
|
+1,498
|
|
Fe2+ (водн.) + 2e- = Fe (тв.)
|
-0.440
|
Au+ (водн.) + e- = Au (тв.)
|
+1,692
|
Электродные потенциалы со знаком «минус» относятся к тем металлам, которые вытесняют водород из кислот. В заголовке таблицы – «Стандартные электродные потенциалы» соответствуют потенциалам, определенных в стандартных условиях: температура t =250C (Т = 298 К), давление Р = 1 атм, концентрация раствора, в который погружен электрод С = 1 моль/л. 0 --- ст. усл.
Чем меньше электродный потенциал , тем активнее металл, тем большим восстановителем он является.
Пример. Какой металл более активный цинк или алюминий? Ответ: Алюминий, так как его потенциал (по таблице №3) меньше, чем у цинка.
Гальванические элементы.
Гальваническим элементом (ГЭ) называют устройство, в котором энергия химической реакции непосредственно превращается в электрическую. ГЭ состоит из соединенных между собой металлических электродов, погруженных в растворы их соли. Пластины металлов соединены через показывающий прибор. Полуэлементы соединяются в электрическую цепь с помощью трубки, заполненной токопроводящим раствором (так называемого солевого мостика). На рис.1. приведена схема медно-цинкового гальванического элемента (Якоби-Даниэля). Zn/Zn2+/ /Cu2+/Cu+
3
1 5
2 4
Zn Cu
- +
ZnSO4 CuSO4
Рис. 1. Схема гальванического элемента: 1 - электрод (Zn); 2- сосуд с раствором ZnSO4; 3 - солевой мостик; 4- сосуд с раствором CuSO4; 5- электрод (Си).
Выписываем значения электродных потенциалов для цинка и меди из таблицы №3:
0 = 0,337 В 0 = 0,763 В
Cu2+ / Cu0 Zn2+ / Zn0
Металл, имеющий меньшее значение электродного потенциала считается анодом и он окисляется.
Видим, что значение потенциала для цинка меньше, чем для меди, делаем вывод, что цинк
анод (выполняет функцию отрицательного электрода) А Zn0 - 2 Zn2+
Металл, имеющий большее значение электродного потенциала считается катодом и он восстанавливается.
Реакция на правом электроде для меди, так как он катод (выполняет функцию положительного электрода) соответствует процессу восстановления:
К Сu2+ + 2 Cu0
Гальванические элементы изображаются следующей записью:
Zn0 / ZnSO4 / / CuSO4 / Cu0 + или в ионной форме: Zn0 / Zn2+ / / Cu2+/ Cu0
в которой вертикальные линии символизируют границу металл - раствор, а двойная - границу между растворами электролитов.
Работа ГЭ оценивается величиной его Э.Д.С.(наибольшее напряжение, которое может дать ГЭ). ЭДС гальванического элемента представляет собой разность электродных потенциалов окислителя и восстановителя, то есть равна разности электродных потенциалов катода и анода.
Е = К0 А 0 (1) Етеор= Красч Арасч
Электродный потенциал металла зависит от концентрации его ионов в растворе.
Эта зависимость выражается уравнением Нернста :
где - стандартный потенциал металла, R - универсальная газовая постоянная, Т - абсолютная температура, n - число рабочих электронов, переходящих от анода к катоду, F - число Фарадея 1F= 96500 Кл, С - концентрация ионов металла.
Если в приведенном уравнении заменить константы R и F их численным значениями, а натуральный логарифм десятичным, то оно примет следующий вид:
Если концентрации растворов у электродов неодинаковы, то сначала рассчитывают новые значения потенциалов для катода и анода с поправкой на концентрацию по уравнению Нернста, а затем подставляют в уравнение (1).
Концентрационный гальванический элемент (КГЭ) состоит из двух пластин одного металла, погруженных в растворы его соли, которые отличаются лишь концентрацией. Zn0/Zn2+/ / Zn2+/Zn0+
3
1 5
2 4
Zn Zn
- +
ZnSO4 ZnSO4
С1 С2 Рис. 2. Схема гальванического элемента:1,5 - электроды (Zn); 2, 4 - сосуды с раствором ZnSO4; 3 - солевой мостик.
Электрод, который погружен в раствор с меньшей концентрацией считается анодом.
Допустим, С1 < С2, тогда левый электрод 1 является анодом, а правый электрод 2 будет катодом. КГЭ работает до тех пор, пока не выровняются концентрации С1’= C’2.
Коррозия металлов
это разрушение (окисление) металлов под действием окружающей среды.
Поляризация – замедление коррозии за счет образования на поверхности металла: 1) тонкой, невидимой глазом, пленки, которая препятствует дальнейшему проникновению окислителя; такая пленка есть у Al, Ti, Zn, Sn, Pb, Mn, Cd, Tl .
2) толстого слоя продуктов коррозии (видим), который затрудняет подход к самому металлу. В этом случае степень поляризации зависит от пористости этого слоя. Например, зеленая патина на меди имеет состав (CuOH)2CO3 и пористость ее меньше, чем у железа (продукт ржавчина Fe2O3·nH2O), следовательно патина лучше защищает медь, чем ржавчина железо.
Деполяризация – ускорение коррозии. Различают водородную и кислородную.
1) Водородная деполяризация происходит в кислых средах (разбавленные кислоты HCl, H2SO4, HNO3 и т.д.). При электрохимической коррозии, так как во многие металлы вводят лигирующие металлические добавки и за счет разности потенциалов образуются микрогальванические элементы, на катоде происходит восстановление среды, то есть восстановление водорода из кислоты:
К 2Н+ + 2 Н02 ,
а на аноде А окисление металла.
2) Кислородная деполяризация происходит в нейтральных и слабощелочных средах (рассматриваем атмосферную коррозию)
К 2Н2О + + O2 + 4 4ОН ,
А Fe0 - 2 Fe2+ окисление железа до Fe2+ в начале коррозии, только потом, со временем, происходит доокисление до Fe3+.
Продукт коррозии Fe(OH)2 + O2 Fe(OH)3 или Fe2O3·nH2O бурая ржа.
ВЫВОД: коррозия (окисление) металла всегда анодный процесс, а на катоде происходит восстановление среды.
Многие концентрированные кислоты пассивируют (блокируют, резко уменьшают скорость коррозии) многие металлы. Так концентрированная серная кислота пассивирует железо: на поверхности образуется плотная тонкая пленка FeSO4, которая препятствует проникновению серной кислоты.
Влияние водородного показателя на скорость коррозии.
График 1 для металлов Al, Zn, Sn, Pb. Эти металлы устойчивы в нейтральной среде за счет амфотерности (стоят между истинными металлами и неметаллами в таблице Менделеева) и продукты коррозии реагируют и с кислотами и со щелочами. Таким образом, необходимо подготавливать воду для работы с теплообменниками из алюминия (поправка: Al устойчив при рН=7; Pb при рН=8; Sn при рН=9; характер кривой тот же).
скорость VКОР
коррозии
VКОР
| |
0 7 pH 0 7 pH
График 1. График 2.
На графике 2 представлена кривая для железа: он устойчив в сильнощелочных средах.
Способы защиты металлов от коррозии.
- Легирование металлов – введение металлических добавок в основной металл, с целью получения новых свойств: а) увеличение твердости – рельсы, колесо Mn, W, Zn, Cr, Mo и т.д.; б) усиление коррозионной устойчивости – различные типы нержавеющей стали; в) появление пластичности и мягкости; г) ферромагнитные свойства.
- Введение ингибиторов коррозии – веществ, которые уменьшают агрессию среды: поглотители кислорода в растворе Na2SO3; катодные замедлители – образуют пленку на металле (хроматы, бихроматы K2Cr2O7, нитриты и т. д.); для кислых сред применяют органические соединения (катапин).
- Неметаллические покрытия: лаки, краски, смазки, воски, пасты, полимеры, резины, эбониты. Защита резиной и эбонитом называется гуммированием.
- Электрохимическая защита: а) металлические покрытия; б) протекторная защита; в) катодная защита.
- Защита от блуждающих токов: считается что 50% коррозии на ж/д транспорте происходит за счет блуждающих токов, подвергаются все части подвижного состава и то, что находится в земле. Идея защиты состоит в отведении части токов через направляющие в земле, которые подсоединены к диоду, который организует прохождение тока в одном направлении (отсос).
- Защита от микробиологической коррозии: лаки- краски на основе полимеров, воздухообмен, температурный режим не выше 200С и влажность не более 80%, консерванты с применением ингибиторов, протекторная и катодная защита.
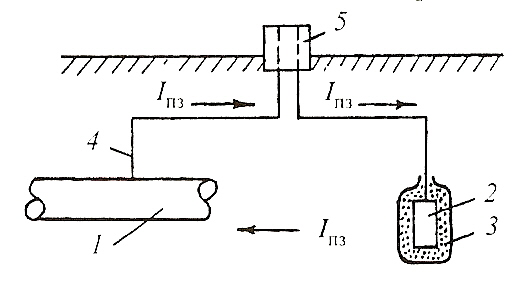
Протекторная защита: I- стальная конструкция, Катодная защита:I- труба с покрытием,
2- протектор, 3- наполнитель, 4- электрический 2- соединительные провода, 3- источник
контакт с конструкцией, 5 – контрольно- постоянного тока, 4- анод.
измерительный вывод (IПЗ – ток протекторной Механизм: электролиз
защиты). Механизм: ГЭ
При протекторной (анодной) электрохимической защите к защищаемой конструкции металла присоединяют протектор - металл с более отрицательным зна�чением электродного потенциала. Активность металла, выбранного в качестве защиты, может быть оценена радиусом действия протектора, т.е. тем расстоянием, на которое распространяется действие выбранного метал�ла. Для протекторной защиты стали используется чаще всего цинк, а также алюминий, кадмий и магний. Радиус действия протекторной за�щиты составляет примерно 50 м.
При защите кабелей, трубопроводов и других конструкций, находя�щихся в грунте, протекторы из цинка устанавливаются в заполнитель состава: 25%CaSO4·2Н2О, 28%Na2SО4 · 10 Н2О, 50%глины. Протекто�ры для установки в грунт обычно изготовляют в виде цилиндров. Для контакта с соединительным проводом, который обычно припаивается, в протекторе имеется стальной оцинкованный сердечник.
Скорость коррозии при анодной защите может быть снижена до минимальной величины, соответствующей току полной поляризации, но никогда не уменьшается до нуля, как в случае катодной защиты.
Катодная электрохимическая защита применяется для предохране�ния металлических изделий, находящихся в почве. Она осуществляется присоединением металлоконструкций к отрицательному полюсу внеш�него источника постоянного тока. При катодной защите в качестве вспомогательного электрода (анода) используют нераствори�мые материалы (графит, уголь) или растворяющийся металлический лом (рельсы, старые трубы), который периодически нужно возобнов�лять. В случае борьбы с подземной коррозией положительный полюс внешнего источника тока заземляют. Радиус действия катодной защиты составляют около 2 км.
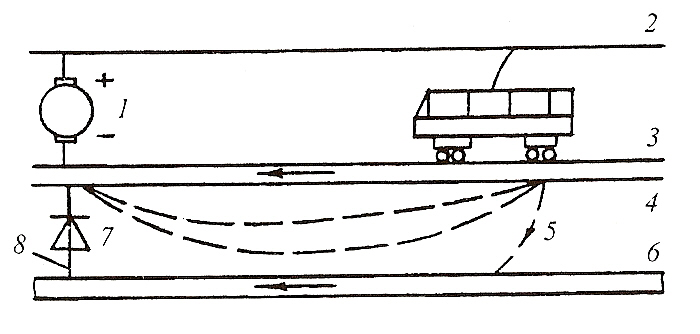
Защита от блуждающих токов: I – выпрямительная подстанция, 2- воздушная контактная сеть, 3- рельсы, 4- почва, 5- блуждающий ток, 6- трубопровод, 7- диод, 8- металлическая перемычка.
Для защиты подземных металлических сооружений от разрушения блуждающими токами используется электродренажная защита. Она осуществляется соединением металлическим проводником анодного участка подземного сооружения (трубы) с источником блуждающих токов, например, рельсом. Ток проходит по металлическому проводни�ку, вследствие чего устраняется разность потенциалов земля-рельс, а значит, и опасность коррозии. Так как на электрифицированных желез�ных дорогах ток часто может менять свое направление, то для большей надежности защиты применяют поляризованный электрический дре�наж. Для этого в металлические соединения включают выпрямитель, например, кремниевый или германиевый диод, который гарантирует прохождение тока только в нужном направлении.
ЭЛЕКТРОЛИЗ
Это превращение вещества под действием электрического тока. При этом на катоде восстанавливаются положительные частицы (катионы), а на аноде окисляются отрицательные частицы (анионы).
При электролизе применяются растворимые (металлические) и нерастворимые (угольные) электроды. Растворимость электрода важна только для анодного процесса. По умолчанию применяются угольные электроды.
Первый закон Фарадея.
При пропускании через раствор или расплав вещества количества электричества 1F = 96500 Кл на катоде и на аноде выделяется по одному эквиваленту продуктов электролиза.
Второй закон Фарадея.
Масса или объем продукта электролиза прямо пропорционально зависит от силы тока, времени пропускания электричества и природы продукта электролиза.
и ,
Где I – сила тока, А; t – время, с; Эпрод – массовый эквивалент, г; ЭVпрод – объемный эквивалент, л. Выход по току
Для электролиза характерны высокие значения выхода по току: 97- 99%.
Электролиз применяется для получения высокочистых веществ, металлов, для нанесения покрытий, гальваностегия, гальванопластика, разделение смесей веществ, для проведения электрокоагуляции, для выработки водорода как альтернативного топлива, в катодной защите от коррозии и т.д..
Правила написания уравнений электролиза для водных растворов.
- Восстановление катионов на катоде.
а) Если металл соли стоит в «ряду напряжений» до Al включительно, то на катоде восстанавливается водород из воды, а металл остается в растворе:
К 2Н+ + 2 Н02
б) Если металл соли стоит в «ряду напряжений» от Ti до Н включительно, то на катоде восстанавливается и водород из воды и металл:
К 2Н+ + 2 Н02 и Cr3+ + 3 Cr0
в) Если металл соли стоит в «ряду напряжений» после водорода, то на катоде восстанавливается один металл:
К Ag+ + 1 Ag0
- Окисление анионов на аноде
а) для нерастворимых (угольных) электродов:
S2-, I-, Br -, Cl-, OH-, NO3-, SO42-, PO43-
возрастание трудности окисления анионов.
б) для растворимых(металлических) электродов:
анионы соли остаются в растворе, а окисляется материал растворимого металлического анода.
PAGE 7
катион +
анион
Диссоциация воды. Водородный показатель