Физика и химия высокомолекулярных соединений
Физика и химия высокомолекулярных соединений
к.х.н., доцент Зайнуллина Айгуль Шайхуллаевна.
Оглавление:
- Предмет «Физика и химия высокомолекулярных соединений». Основные понятия химии ВМС.
- Классификация полимеров. Понятия конформации, конфигурации, гибкости полимеров.
- Понятие средней молекулярной массы полимеров.
- Методы синтеза полимеров. Радикальная полимеризация.
- Кинетика радикальной полимеризации.
- Радикальная сополимеризация. Способы проведения полимеризации.
- Катионная полимеризация.
- Анионная полимеризация.
- Поликонденсация.
- Влияние различных факторов на процесс поликонденсации. Способы проведения поликонденсации.
- Химические превращения полимеров.
- Деструкция полимеров.
- Кристаллические и аморфные полимеры. Три физических состояния аморфных полимеров.
- Растворы полимеров.
- Отдельные представители полимеров.
Модуль 1. Основные понятия химии полимера их классификация и синтез методами радикальной и катионной полимеризации.
1.1. Основные понятия химии высокомолекулярных соединений
- Основные понятия и определения.
- Основные отличия высокомолекулярных соединений от низкомолекулярных соединений.
- Основные понятия и определения.
Химия высокомолекулярных соединений (ВМС) является одной из наиболее быстро развивающихся и перспективных отраслей науки, которая отделилась в самостоятельный раздел химии в 30-х годах 19 века.
Термин «полимер» в 1833 году ввел Берцелиус.
К ВМС относятся вещества с молекулярной массой от 5 тыс. до нескольких миллионов. ВМС получили свое название из-за большой величины их молекулярных масс, отличающих их от НМС. Соединения с молекулярной массой от 5тыс. до 6 тыс. называют олигомерами.
Молекулу ВМС из-за больших размеров называют макромолекулой.
Полимерами называются ВМС, макромолекулы, которых построены из одинаковых многократно повторяющихся групп атомов, которые называются элементарными звеньями. Элементарные звенья соединены между собой ковалентными химическими связями.
кат
n CH2= CH2——> […-CH2- CH2-CH2- CH2- …] n
мономер полимерная цепь
Мономером называется низкомолекулярное соединение (НМС), молекулы которого способны реагировать между собой или с молекулами других соединений с образованием полимера. Термин «мономер» произошел от греч. слова «монос» - «один» и «мерос» - «часть».
Существует три метода синтеза полимеров:
- полимеризация
- поликонденсация
- химическая модификация
Первым двум методам соответствуют два типа мономера:
1. полимеризационные мономеры, содержащие в своем составе кратные связи или две двойные связи. Например, этилен CH2=CH2, ацетилен CHCH, бутадиен CH2=CH–CH=CH2. Либо циклические группировки, например, капролактам, оксид олефина, оксид этилена.
2. поликонденсационные – содержащие в своем составе не менее двух функциональных групп, например, дикарбоновые кислоты: HOOC–R–COOH, диамины: H2N–R–NH2, аминокислоты: HOOC–R– NH2, гликоли: HO–R–OH.
Число повторяющихся звеньев линейной макромолекулы называется степенью полимеризации.
Мm полимера
n = ————————
Мm элемент. звена Мm полимера = n·Мm элемент. звена
Мm – молекулярная масса
n – степень полимеризации
Молекулярная масса полимера равна произведению степени полимеризации на молекулярную массу элементарного звена.
Название полимера складывается из приставки «поли» и названия соответствующего полимера. Например, полиэтилен, полипропилен, полистирол.
1.1.2. Основные отличия высокомолекулярных соединений от низкомолекулярных соединений.
При синтезе мономера образуются макромолекулы с разной молекулярной массой, т.е. они характеризуются различной степенью полимеризации. Таким образом, ВМС представляют собой смесь полимергомологов общего химического состава, но с разной молекулярной массой. Такое явление называется полидисперсностью.
1. Для НМС значение молекулярной массы – константа, а для полимеров вводится понятие средней молекулярной массы, представляющей собой среднюю арифметическую из суммы молекулярных масс всех входящих в полимер макромолекул.
2. Из-за полидисперсности полимеры, в отличие от НМС, не имеют определенной температуры плавления. Они плавятся или размягчаются в некотором интервале температур.
3. ВМС, в отличие от НМС, могут существовать только в двух фазовых состояниях: в твердом и в жидком. Газообразного состояния у полимера нет из-за высокой молекулярной массы полимера. Полимеры не летучи и не могут быть переведены в газообразное состояние. При нагревании выше температуры плавления происходит термическое разложение полимеров.
4. Отличительной способностью ВМС является гибкость полимеров, т.е. способность макромолекулы занимать в пространстве различные положения, отличающиеся друг от друга. Понятие гибкости макромолекулы относится только к ВМС, т.к молекулы НМС малы и не могут принимать различные формы.
5. Наименьшей частицей ВМС участвующей в реакции является не молекула, а элементарное звено.
6. В отличие от НМС свойства полимеров зависят от геометрической формы макромолекулы (палочка, спираль, клубок).
7. Полимеры способны к большим обратимым деформациям в высоко эластическом состоянии.
8. В отличие от НМС полимеры способны образовывать пленки и волокна.
9. В отличие от НМС растворение полимера протекает через стадию набухания.
10. Растворы полимера характеризуются высокой вязкостью.
1.2. Классификация полимеров. Понятие конфигурации, конформации и гибкости полимеров.
1.2.1. Классификация полимеров в зависимости от происхождения.
1.2.2. Классификация полимеров по строению основной цепи.
1.2.3. Классификация полимеров в зависимости от формы макромолекулы.
1.2.4.Классификация полимеров в зависимости от природы расположения звеньев макромолекулы.
1.2.5. Классификация полимеров в зависимости от поведения при повышенных температурах.
1.2.6. Стереорегулярные полимеры.
1.2.7. Конфигурация полимеров.
1.2.8. Конформация полимеров.
1.2.9. Гибкость полимеров.
1.2.1. Классификация полимеров в зависимости от происхождения.
ВМС в зависимости от происхождения подразделяются на:
а) синтетические, т.е. полученные путем синтеза из НМС – (полиэтилен, капрон, полистирол);
б) природные – выделенные из природных материалов (крахмал, целлюлоза);
в) искусственные – полученные путем химической модификации природных полимеров (ацетилцеллюлоза).
1.2.2. Классификация полимеров по строению основной цепи.
По строению основной цепи ВМС делятся на:
а) карбоцепные полимеры, основная цепь которых построена из атомов углерода (натуральный каучук, природный полимер - алмаз, графит и полиэтилен)
–C–C–C–
б) гетероцепные полимеры, основная цепь которых построена из разных элементов: углерод, азот, сера и кислород. Например, природные – белки и полисахариды, синтетические – полиамиды, полиэфиры.
– C– C– C– C– C– C –N–C– C– C– C– C– C–С–
в) ВМС с системой сопряженных связей:
– C = C – C = C – C = C
| | | | | |
Полиацетилен Полифенилен
г) полимеры с неорганическими главными цепями, основная цепь которых построена с участием неорганических элементов. Например, полисилоксаны.
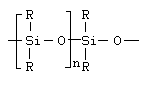
1.2.3.Классификация полимеров в зависимости от формы макромолекулы.
. ВМС классифицируются в зависимости от формы макромолекулы на:
а) линейные полимеры. Например, натуральный каучук и целлюлоза. В случае гибких полимеров, линейные полимеры могут свертываться в клубок. К ним относятся большое число синтетических полимеров, которые хорошо растворяются и применяются для изготовления пластмасс и химических волокон.
б) разветвленные полимеры имеют боковые ответвления, присоединенные к основной цепи. Они лучше растворяются, чем линейные полимеры, имеют меньшую температуру плавления, применяются для изготовления лаков, пленок и клея.
в) сетчатые полимеры, или пространственные полимеры построены из макромолекулярных цепей, соединенных между собой поперечными связями. Их можно рассматривать как сшитые линейные полимеры. Например, алмаз, кварц, графит, фенолоформальдегидные и глифталевые смолы. Сшитые полимеры не плавятся, не растворяются, характеризуются жесткостью и хрупкостью. Для сетчатых полимеров понятие молекулярная масса становится неопределенным, т.к. трудно определить границу макромолекулы.
1.2.4.Классификация полимеров в зависимости от природы расположения звеньев макромолекулы.
Полимеры подразделяются в зависимости от природы расположения звеньев макромолекулы:
а) гомополимеры – полимеры, состоящие, из одинаковых звеньев и синтезированные из одного мономера (например,полиэтилен).
– – – – А– –
б) сополимеры – полимеры, состоящие из звеньев нескольких мономеров (например,бутадиен, стирольный каучук).
– – – – – –
в) блок-сополимеры – полимеры, в которых различные звенья собраны в длинные участки и чередуются между собой.
– (A)m – (B)n – (A)x – (B)y–
1.2.5. Классификация полимеров в зависимости от поведения при повышенных температурах.
В зависимости от поведения при повышенных температурах полимеры делятся на:
а) термопластичные. Термопластами называют такие полимеры, которые при нагревании переходят в вязкотекучее состояние, а при охлаждении переходят в твердое, стеклообразное состояние без изменения первоначальных свойств.
б) термореактивные полимеры, которые при нагревании образуют сетчатые структуры и превращаются в твердые, неплавкие, нерастворимые полимеры (фенолоформальдегидные и глифталевые смолы).
1.2.6. Стереорегулярные полимеры.
Стереорегулярными полимерами называются полимеры, в макромолекуле которых имеется ассиметричный атом углерода.
n CH2= СН - CH2 – CН – CH2– CН-
R R R
C - третичный атом углерода ассиметричный, т.к. помимо атома водорода и радикала каждый из них связан с участками молекулярной цепи различной длины. В связи с этим появляется оптическая изомерия.
Полимеры, в которых заместители расположены по одну сторону плоскости, называют изотактическими.
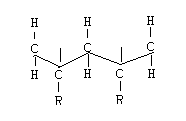
Когда по разные стороны плоскости называют синдиотактические.
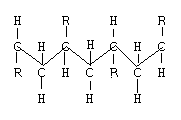
Когда заместители расположены в беспорядке, называют атактическими.
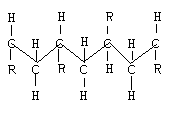
1.2.7. Конфигурация полимеров.
В целом структура полимера характеризуется его конфигурацией и конформацией.
Конфигурация – это строго определенное пространственное расположение атомов в молекуле, не изменяющееся в процессе теплового движения. Т.к. разные виды конфигурации стабильны во времени и не изменяются в процессе теплового движения, они представляют собой стабильные изомеры макромолекул. Переход из одной конфигурации в другую без разрыва химических связей невозможен.
Для полимера выделяется несколько конфигурационных уровней:
1. Конфигурация звена (характерна для полимеров с двойной связью в основной цепи). Например:
цис транс
Цис-изомеры характеризуются расположением заместителей по одну стороны от двойной связи, а транс – по разные.
В полимере цис и транс расположения атомов характерно для каждого повторяющегося звена, содержащего двойную связь. Например: макромолекула натурального каучука.
2. Оптические изомеры характеризуются наличием ассиметричного атома углерода:
D-изомер L-изомер
Оптические изомеры способны вращать плотность поляризации поляризованного света соответственно вправо или влево, т.е. имеют разные оптические свойства.
В полимере заместители m и n всегда различны, это части основной цепи, отличающиеся длиной.
Стереоизомеры – стереорегулярные полимеры, возникающие благодаря ассиметричному атому углерода.
1.2.8. Конформация полимеров.
Конформацией называется пространственное расположение атомов в молекуле, которое может меняться под действием теплового движения или внешнего поля без разрушения химических связей между атомами или группами атомов.
1. Клубок
2. Глобула
3. Прямая
4. Спираль
5. Складчатая
6. Коленчатый вал
1.2.9. Гибкость полимеров.
Макромолекула в результате теплового движения располагается не прямолинейно, как жесткий стержень, а криволинейно, причем искривления могут происходить в разных направлениях и меняться во времени.
Гибкостью макромолекул называют способность макромолекул изменять свою форму под влиянием теплового движения или внешнего поля.
Гибкость является важной особенностью полимера. При большом числе атомов в молекуле, в результате теплового движения, макромолекулы не просто искривляются, а сворачиваются и образуют молекулярный клубок.
Факторы, влияющие на гибкость:
- Структура и связь в макромолекуле.
- Наличие функциональных групп.
Сегмент – это отрезок полимерной цепи длиной А, положение которого зависит от положения соседних атомов звеньев.
Различают термодинамическую и кинетическую гибкость.
Термодинамическая – способность полимерной цепи изгибаться под влиянием теплового движения. Она определяется разностью потенциальных энергий двух состояний, конечного и первоначального.
U=U1 – U2
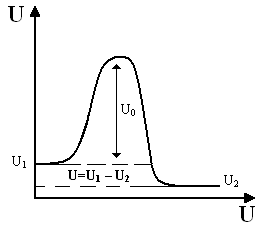
На термодинамическую гибкость влияют:
- Химическое строение основной цепи
полиэтилен полифенилен
более гибкий
- Природа и размер заместителя
поливинилхлорид полистирол
более гибкий
Кинетическая гибкость цепи отражает переход цепи из одного энергетического состояния в другое (U1 U2) и определяется влиянием следующих факторов:
- Величиной Еакт
- Температурой. С повышением температуры, гибкость полимеров увеличивается.
- Наличие поперечных связей между макромолекулами (сетчатые полимеры). Чем больше степень сетчатости полимера, тем ниже его гибкость.
- Понятие средней молекулярной массы полимеров.
- Молекулярная масса полимеров. Явление полидисперсности. Влияние молекулярной массы полимеров на физические свойства полимеров.
- Кривые молекулярно – массового распределения.
- Молекулярная масса полимеров. Явление полидисперсности. Влияние молекулярной массы полимеров на физические свойства полимеров.
1.3.3. Среднечисловая молекулярная масса.
1.3.4. Среднемассовая молекулярная масса.
1.3.5. Средневязкостная молекулярная масса.
1.3.6. Понятие функциональности.
1.3.1. Молекулярная масса полимеров. Явление полидисперсности. Влияние молекулярной массы полимеров на физические свойства полимеров.
Для НМС значение молекулярной массы – это константа, характеризующая его индивидуальность. А любой образец полимера представляет собой смесь полимергомологов различной длины, отсюда и различие молекулярной массы, т.е. полимеры, отличаются полидисперсностью и характеризуются средней молекулярной массой. С увеличением молекулярной массы различие в свойствах полимергомологов сглаживаются, они теряют свою индивидуальность.
Зависимость температуры кипения углеводородов от их молекулярной массы.
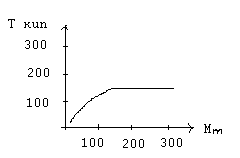
Видно, что с увеличением молекулярной массы различие в физических свойствах сглаживаются, поэтому смесь полимер гомологов невозможно разделить на индивидуальные вещества с определенной молекулярной массой, а удается разделить лишь на фракции, состоящие из макромолекул с близкими значениями молекулярной массы.
- Кривые молекулярно – массового распределения.
Наряду со средней молекулярной массой полимер более полно может быть охарактеризован кривой молекулярно – массового распределения (ММР). Образцы полимера с одинаковой средней молекулярной массой могут иметь разное ММР и поэтому различаться по свойствам.
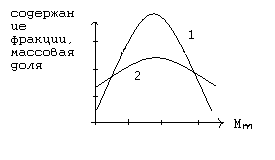
На рисунке показаны кривые распределения по молекулярным массам двух полимеров с одинаковой средней молекулярной массой, но с различной полидесперсностью. Полимер, характеризующийся на графике кривой 1 более однороден по молекулярной массе, чем
Полимер с кривой распределения 2. следовательно, полимер 1 имеет лучшие физически – механические свойства по сравнению с полимером характеризующимся кривой 2.
Многие свойства полимеров (физические и химические) зависят от характера ММР. Форма ММР может дать ценную информацию о механизме полимеризации. Механическая прочность полимера начинает проявляться с увеличением молекулярной массы от 5 – 10 тыс. и далее возрастает, но до определенного предела. Дальнейшее увеличение молекулярной массы уже не приводит к улучшению механических свойств.
Большое содержание высокомолекулярных фракций в полимере придает ему высокие прочностные свойства, повышенную твердость, термостойкость и смещение температуры начала пластического течения в области более высоких температур.
Полимеры с большим содержанием низкомолекулярных фракций имеют низкие прочностные свойства и худшие физико-механические свойства в целом. Значение средней молекулярной массы и ММР очень важно для получения полимера с заданными механическими свойствами, т.к. существует некоторый интервал молекулярной массы полимера с соответствующими ему оптимальными свойствами.
1.3.3. Среднечисловая молекулярная масса.
Среднечисловая молекулярная масса (), экспериментально определяется методами, основанными на определении числа молекул в разбавленных растворах полимеров, таких как: осмометрия, эбуллиоскопия, криоскопия, а также по количеству концевых групп макромолекул, определенных спектроскопическим и химическими методами.
Величина представляет собой суммарную массу () всех молекул в образце полимера, деленную на общее число молекул в полимере ( n).
n· M
= ———— = —————— = ·M
n n
n Где, = —— - числовая доля молекул i – той фракции с М= Mот общего числа молекул
n
мономера.
n- число молекул с М= M.
1.3.4. Среднемассовая молекулярная масса.
Среднемассовая молекулярная масса () определяется методами, основанными на определении массы отдельных макромолекул, такими как: светорассеяние в растворах полимера, а также методами седиментации. Величина представляет собой отношение произведения массы всех фракций полимера на молекулярную массу фракции, деленная на массу одной фракции.
W· M n· M· M n· M
= ———— = —————— = —————
W n· M n· M
W n· M
= ——— = ———–
W n· M
= W· M
Где, W - масса фракции с М= M;
- массовая доля i – той фракции.
1.3.5. Средневязкостная молекулярная масса.
Средневязкостная молекулярная масса полимера определяется измерением вязкости разбавленных растворов, используя эмпирическую формулу Марка-Куна-Хаувинка
[ ] = k·М
Где, [ ] – характеристическая вязкость полимера.
k и – эмпирические константы, зависящие от конформации и конфигурации макромолекулы в растворе. Обычно = 0,5 – 0,9, при значении = 1 средневесовая молекулярная масса равна средневязкостной (= ).
В случае монодисперсного образца полимера, т.е. когда полимер состоит из макромолекул с очень близкими друг к другу молекулярными массами среднемассовая молекулярная масса примерно равна среднечисловой молекулярной массе ( ).
Для обычного полидисперсного образца среднемассовая молекулярная масса больше среднечисловой молекулярной массы (>).
Среднемассовая молекулярная масса () более чувствительна к высокомолекулярным фракциям, а среднечисловая молекулярная масса () - к низкомолекулярным. С увеличением доли высокомолекулярной фракции в полимере средние молекулярные массы возрастают в следующем порядке: > >. При расширении молекулярно массового распределения различия в средних молекулярных массах увеличивается.
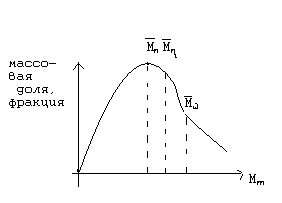
На кривой ММР указаны примерные положения различных средних молекулярных масс. Отношение среднемассовой молекулярной массы к среднечисловой молекулярной массе (/), является мерой полидисперсности. Для однородного полимера коэффициент полидисперсности близок к 1. Для реальных полимеров он всегда больше 1 и возрастает с увеличением полидисперсности.
1.3.6. Понятие функциональности.
Синтез полимера возможен в том случае, если молекула исходного вещества может взаимодействовать не менее чем с двумя другими молекулами, т.е. исходное вещество не менее чем бифункционально.
Функциональность вещества определяется числом функциональных групп, содержащихся в этой молекуле.
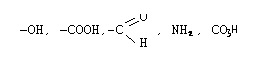
По числу функциональных групп, соединения бывают: моно-, би-, три- и тетрофункциональные и т.д.
Функциональность вещества может определяться наличием в его молекуле двойных или тройных связей, или наличием подвижных атомов водорода.
CH = CH + Br CH2Br - CH2Br
CH CH + 2 Br CHBr2 – CHBr2
Таким образом, функциональность соединения зависит также от характера реакций и условий ее проведения. Полимер, синтезированный из бифункционального мономера, имеет линейное строение, если функциональность больше 2, то могут образовываться разветвленные или сетчатые полимеры. Полифункциональность мономера является необходимым, но недостаточным условием для синтеза полимеров, т.к. стирол бифункциональный и легко полимеризуется, а 1,1-дифенилэтилен является также бифункциональным, не полимеризуется из-за затруднений связанных с наличием больших функциональных заместителей.
1.4. Методы синтеза полимеров. Радикальная полимеризация.
1.4.1. Полимеризация.
1.4.2. Мономеры, вступающие в радикальную полимеризацию.
1.4.3. Стадии радикальной полимеризации. Инициирование (термическое, окислительно-восстановительное, фотохимическое).
1.4.4. Рост цепи.
1.4.5. Обрыв цепи.
1.4.6. Передача цепи.
1.4.7. Регуляторы молекулярной массы полимера.
1.4.8. Ингибиторы реакции полимеризации.
1.4.1. Полимеризация.
Полимеризация – процесс получения высокомолекулярных соединений, при котором рост молекулярной цепи осуществляется в результате последовательного присоединения молекул мономера к активному центру, находящемуся на его конце.
ММ• + М ММ• и т.д., где
М - цепь длиною в n звеньев;
М• - активный центр;
М – молекула мономера.
По числу мономеров, участвующих в полимеризации, различают:
а) гомополимеризацию (1 мономер);
б) сополимеризацию (2 и более мономера) – например, бутадиен- стирольный каучук.
В зависимости от химической природы активного центра, полимеризация подразделяется на:
а) радикальную (активный центр – радикал);
б) ионную (активный центр – ион). Ионная полимеризация, в свою очередь, подразделяется на:
а) анионную (активный центр – анион);
б) катионную (активный центр – катион).
1.4.2. Мономеры, вступающие в радикальную полимеризацию.
Одним из наиболее распространенных методов синтеза полимеров, является цепная полимеризация.
Радикальная полимеризация всегда протекает по цепному механизму. Большая заслуга в разработке теории цепной полимеризации принадлежит Шульцу, Медведеву, Багдасаряну.
К числу распространенных мономеров, вступающих в радикальную полимеризацию, относятся: CH = CH(этилен); CH = CH (винилхлорид); CH = CH (винилацетат);
| |
Cl ОСОСН
Cl
CF = CF (тетрафторэтилен); CH = C (винилденхлорид); CH = CH (акрилонитрил);
|
Cl CN
СН
CH = C (метакрилонитрил); CH = CH (метилакрилат);
CN СООСН
СН
CH=С (метилметакрилат); CH = CH – CH = CH (1,3-бутадиен) и др.
СООСН
1.4.3. Стадии радикальной полимеризации. Инициирование (термическое, окислительно-восстановительное, фотохимическое).
Инициирование состоит из двух реакций. В начале, в результате гомолитического распада молекулы инициатора (I) или катализатора, образуется два радикала..
I 2 R·
Затем, образовавшийся радикал присоединяется к молекуле мономера с образованием инициирующего центра растущей цепи.
R· + М R-М·
R· + CH = CH R– CH - CH·
| |
X X
I. Термическое инициирование. Наиболее широко применяются термический, гомолитический распад инициаторов. В качестве инициаторов используется ограниченный круг соединений с энергией диссоциации связи 25 – 40 килокаллорий на моль, содержащие связи О- О, S–S, N–O. Наиболее широко используются перекиси и азосоединения.
- Ацилпероксиды.
Распад пероксида бензоила:
(СН-СОО)2СН-СОО· СН + СО
Распад пероксида ацетила:
(СН-СОО) 2СН-СОО· СН· + СО
- Алкилпероксиды. Пероксид тетрабутила [(СН3)3СО]2; пероксид кумола [С6Н5(СН3)2СО]2.
Распад пероксида кумола:
СН СН СН
СН– C – O – O – C – СН2 СН– C – O
СН СН СН
Распад пероксида тетрабутила:
СН СН СН
СН– C – O – O – C – СН2 СН– C – O
СН3 СН3 СН3
- Гидропероксиды: гидропероксид третбутила (СН)С –О– OH, гидропероксид кумола СН(СН)С–О– OH, гидропероксид ацетила СНСО – O – OH.
Распад гидропероксида кумола:
СН СН
СН– С – О – OH СН– С = О + ·OH + СН
(СН)
СН
(СН)
Распад гидропероксида третбутила:
СН СН
СН– С – О – OH СН– С = О + ·OH + СН3
СН3
Распад 2,2'- азобисизобутиронитрил (АИБН)
СН СН СН
NС – C –N = N– C – CN 2 NС – C· + N
СН СН СН
Легкое разложение азосоединеий обусловлено образованием в процессе их распада молекул азота.
. Окислительно-восстановительное инициирование. Особенностью является очень низкая энергия активации (12 – 20 ккал./моль вместо 35 ккал./моль) при термическом инициировании, что позволяет проводить реакцию при низких температурах ( от 0 до 50С) и тем самым уменьшить возможность протекания побочных процессов.
Fe + НО Fe + ОН+ ·ОН
Радикал ·ОН, присоединяясь к молекуле мономера, инициирует радикальную полимеризацию. Применяются также окислительно-восстановительные системы, растворимые в воде – персульфат натрия, тиосульфат натрия, а также растворимые в органических растворителях – органические пероксиды (амиды).
.Фотохимическое инициирование. В этом случае радикалы образуются в результате ультрафиолетового облучения чистого мономера, а также мономера, содержащего катализатор или фотосенсибилизатор. Мономер, поглощая квант света, переходит в возбужденное состояние.
М + h М
квант
света
Возбужденные частицы, в результате гомолитического разрыва химических связей, распадаются на радикалы: М R· + R'·, которые способны инициировать полимеризацию.
Сенсибилизатор С, поглощая квант света, переходит в возбужденное состояние, затем передает свою энергию мономеру М, который в возбужденном состоянии распадается на радикалы:
С + h С
С+ М С + М
М R· + R'·
V. При радиохимическом инициировании радикальной полимеризации, образование радикалов происходит под действием ионизирующих излучений (гамма-лучей, альфа-частиц, нейтронов, быстрых электронов, бета-лучей). Под действием высоких энергий происходит ионизация соединений углерода с выбросом электронов по схеме:
С + излучение С +
Радикал может также образоваться при диссоциации катиона: С + А· + В
Выброшенный электрон может присоединиться к катиону В с образованием другого радикала, т.е. В+В.
1.4.4. Рост цепи.
Стадия роста цепи представляет собой последовательное взаимодействие растущих свободных радикалов с молекулами мономера.
Рост цепи:
R– CH – CH + CH = CH R– CH– CH – CH – CH + CH = CH
x х х х х
R– CH– CH – CH – CH – CH – CH и т.д. + 25,5 ккал. или 94,28 кДж
х х х
Где, - константа скорости роста цепи.
Молекула мономера может присоединяться к растущему радикалу по типу:
1 – («голова к голове»);
2 – («хвост к хвосту»);
3 – («голова к хвосту»).
1.4.5. Обрыв цепи.
Рост цепи не происходит до бесконечности, т.к. происходит реакция обрыва цепи, приводящая к исчезновению в системе активных радикалов. Обрыв цепи, в основном, происходит за счет рекомбинации двух растущих радикалов:
~ CH – CH + · CH – CH ~ ~ CH – CH – CH – CH~
х х х х
Реже обрыв цепи происходит в результате реакции диспропорционирования с образованием двух нейтральных молекул.
~ CH – CH + ~ CH – CH· ~ CH – CH + CH = CH
х х х х
Обрыв цепи может происходить между макромолекулами разной длины, что приводит к образованию макромолекул разной молекулярной массы (разной степени полимеризации). Этим объясняется полидисперстность синтетических полимеров, которая описывается кривыми молекулярно-массового распределения. Обрыв цепи за счет реакции диспропорционирования увеличивается при высоких температурах.
При полимеризации метилметакрилата при температуре 60С, обрыв цепи за счет реакции диспропорционирования протекает на 60% . Аналогичные тенденции наблюдаются при полимеризации винилацетата.
1.4.6. Передача цепи.
Реакция передачи цепи может протекать через мономер, растворитель и инициатор. При этом растущий макрорадикал, отрывая водород или другой атом от какой-либо молекулы (передатчиков цепи), превращается в нейтральную молекулу. Происходит обрыв материальной цепи, при этом образуется новый радикал:
М· + АВ М– А + В
М· + НХ М–Н + Х
Образующийся новый радикал, в случае его реакционной способности, может вновь инициировать реакцию полимеризации:
В + М М
Передача цепи через молекулу мономера (винилацетат).
~ CH – CH + CH = CH ~ CH – CH + CH = CH – ОСОСН·
ОСОСН ОСОСН ОСОСН
растущая винил- активная
полимерная ацетат частица - радикал
цепь (инициатор)
CH = CH – ОСОСН · + CH = CH CH = CH – ОСОСН– CH– CH · и т.д.
ОСОСН ОСОСН
Образующийся радикал может взаимодействовать с молекулой мономера, начиная рост новой макромолекулы.
Передача цепи на макромолекулу.
Рассмотрим передачу цепи на макромолекулу на примере полимеризации этилена в присутствии четыреххлористого углерода.
~ – CH – CH + CCl ~ CH – CHCl + CCl·
CCl· + CH = CH CCl– CH– CH·
начало новой цепи
Или в присутствии растворителя – толуола.
х
СН – СН + СН = CH СН – СН– CH– CH· и т.д.
х х
рост новой цепи
Реакция передачи цепи используется для регулирования молекулярной массы полимеров, изменяя соотношение мономера и ССl можно получить низкомолекулярные соединения (реакция теломеризации), которая используется для синтезов других полимеров.
2 CH = CH + ССl Сl – СН– CH– СН– CH– CCl
тетрахлорпентан
1.4.7. Регуляторы молекулярной массы полимера.
В качестве регуляторов молекулярной массы полимера применяют ССl, тетрахлорэтилен ССl= ССl, гексахлорэтан C2Cl6, меркаптаны R-SH.
~ CH – CH + R –SН ~ CH – CH + RS
меркаптан
х х
RS + CH = CH RS – CH– CH· и т.д.
х х
Регуляторы играют важную роль в производстве каучуков.
1.4.8. Ингибиторы реакции полимеризации.
Если в ходе реакции передачи цепи образуется неактивный радикал, неспособный начать новую полимеризационную цепь, то такой передатчик цепи называют ингибитором полимеризации. Ингибиторы прекращают реакцию полимеризации, а замедлители - замедляют процесс полимеризации. В качестве ингибиторов используются хинон, гидрохинон, бензохинон, ароматизированные нитросоединения, амины, йод, соли меди, железа, хрома.
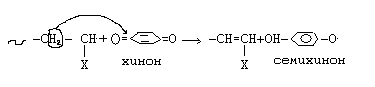
Семихинон, вследствие эффекта сопряжения, обладает малой реакционной способностью, и присоединяется к растущему радикалу, обрывая реакционную цепь.
Рассмотрим график термической полимеризации стирола:
1 – в отсутствии ингибитора;
2 – в присутствии ингибитора бензохинона;
3 – в присутствии замедлителя.
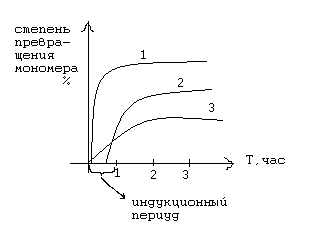
В индукционный период расходуется ингибитор бензохинон, а по исчерпанию его, полимеризация начинает идти с обычной скоростью.
Ингибиторы используются для предотвращения полимеризации мономера при хранении.
Количество ингибитора колеблется в пределах 0,1 – 1% от массы полимера.
1.5. Кинетика радикальной полимеризации. Влияние различных факторов на процесс радикальной полимеризации.
1.5.1. Кинетика радикальной полимеризации.
1.5.2. Влияние температуры на процесс радикальной полимеризации.
1.5.3. Влияние концентрации инициатора на процесс радикальной полимеризации.
1.5.4. Влияние концентрации мономера на процесс радикальной полимеризации.
1.5.5. Влияние давления на процесс радикальной полимеризации.
1.5.1. Кинетика радикальной полимеризации.
Рассмотрим кинетику стационарного состояния реакции полимеризации, когда число возникающих свободных радикалов равно числу макрорадикалов, исчезающих в результате реакции рекомбинации. В этих условиях можно принять, что скорость реакции инициирования (V) равна скорости обрыва радикалов (V).
(V) = (V)
1.Стадия инициирования.
I 2 R·
V = К[ I ], где
V - скорость реакции инициирования;
К - константа скорости образования активных центров.
2.Стадия роста цепи.
~М· + М ~М – М·
Скорость реакции прямо пропорциональна концентрации реагирующих веществ.
V= К [ М ] [ М ]
К - константа скорости роста цепи;
V- скорость роста цепи;
М – концентрация мономеров;
[ М ] – концентрация активных центров.
Суммарная скорость реакции полимеризации равна скорости роста цепи. Общая скорость равна скорости роста цепи.
3. Стадия обрыва цепи.
~М· + .М~ ~М – М~ (рекомбинация)
V= К · [ М ], где
V- скорость обрыва цепи;
К - константа обрыва цепи.
Из предположения, что скорость инициирования равна скорости образования, запишем равенство:
V = V
К[ I ] = К · [ М ]
Подставляя значение [ М ] в выражение для скорости роста цепи, приходим к следующим уравнениям:
[ М ] = (1)
V= V = К [ М ], если К ·[ М ] = К, тогда
V= V = К
Таким образом, суммарная скорость полимеризации возрастает пропорционально квадратному корню из концентрации инициатора.
Средняя степень полимеризации () образующегося полимера определяется соотношением скорости роста цепи и обрыва цепи:
V К [ М ] [ М ]
= ——— = ———————— (2)
V К · [ М ]
Подставим из уравнения (1) значение концентрации [ М ] в уравнение (2) и получим выражение:
К [ М ] К [ М ] К
= ————— = ——————— = —— = К
К К
Средняя степень полимеризации изменяется обратно пропорционально квадратному корню из концентрации инициатора.
= К
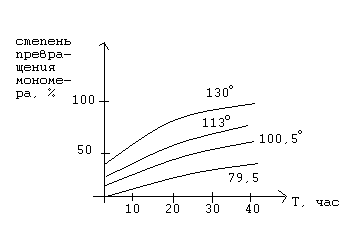
1.5.2. Влияние температуры на процесс радикальной полимеризации.
С увеличением температуры увеличивается скорость всех элементарных стадий реакции полимеризации. Однако, наибольшее влияние температура оказывает на скорость образования активных центров. Это приводит к увеличению их концентрации, что в свою очередь, ведет к увеличению скорости роста цепи и скорости обрыва цепи.
V= К [ М ] [ М ]
V= К · [ М ]
Видно, что скорость обрыва цепи с увеличением концентрации активных центров возрастает больше, т.к. в уравнении для скорости обрыва цепи концентрация активных центров входит в квадрате ([М]). Соответственно, уменьшается средняя степень полимеризации, определяемая соотношением скоростей роста и обрыва цепей:
V
= ——
V
С увеличением температуры увеличивается суммарная скорость полимеризации, уменьшается степень полимеризации, а, следовательно, и молекулярная масса.
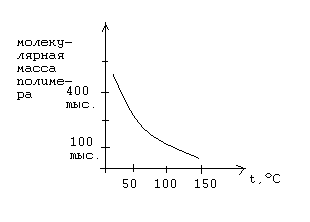
1.5.3. Влияние концентрации инициатора на процесс радикальной полимеризации.
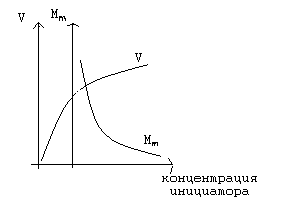
С увеличением концентрации инициатора число свободных радикалов, образующихся при его распаде, возрастает, что приводит к увеличению числа активных центров, а, следовательно, к возрастанию суммарной скорости реакции полимеризации. Молекулярная масса образующегося полимера, как и при повышении температуры, уменьшается.
1.5.4. Влияние концентрации мономера на процесс радикальной полимеризации.
При проведении полимеризации в среде растворителя, суммарная скорость полимеризации и молекулярная масса, образующегося полимера, увеличивается с повышением концентрации мономера.
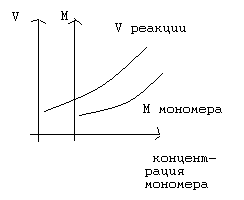
1.5.5. Влияние давления на процесс радикальной полимеризации.
Давление порядка нескольких десятков атмосфер практически не влияет на процесс полимеризации. Высокое давление (300-5000 атмосфер и выше) значительно ускоряет полимеризацию, при этом молекулярная масса полимера не уменьшается.
1.6. Радикальная сополимеризация. Способы проведения радикальной сополимеризации.
1.6.1. Радикальная сополимеризация.
1.6.2. Кинетика радикальной сополимеризации.
1.6.3. Диаграмма состава сополимера от исходной смеси мономеров.
1.6.4. Определение констант сополимеризации методом Майо – Льюиса.
1.6.5. Определение констант сополимеризации методом Файмана - Росса.
1.6.6. Способы проведения полимеризации в блоке.
1.6.7. Способы проведения полимеризации в растворе.
1.6.8. Способы проведения полимеризации в эмульсии.
1.6.9. Способы проведения полимеризации в суспензии.
1.6.1. Радикальная сополимеризация.
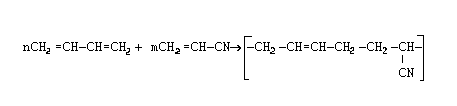
Сополимеризация – процесс образования сополимеров совместной полимеризацией двух или нескольких различных по природе мономеров. Этим методом получают ВМС с широким диапазоном физических и химических свойств. Например, в результате сополимеризации бутадиена с акрилонитрилом образуется бутадиен-нитрильный каучук (СКН), обладающий высокой стойкостью к маслам и бензинам. Из него изготавливают уплотнительные прокладки для деталей, соприкасающихся с маслами и растворителями:
Сополимеризацией изобутилена с изопреном получают бутилкаучук с высокой газонепроницаемостью.
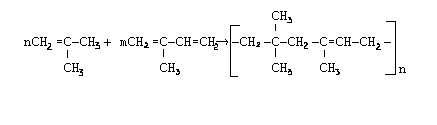
При сополимеризации мономеры могут вести себя несколько иначе, чем при их раздельной полимеризации. В этом случае проявляется взаимное влияние различных мономеров, в результате чего реакционная способность одного из них сильно зависит от природы второго. Процесс сополимеризации еще более усложняется, если в реакции принимают участие несколько мономеров.
1.6.2. Кинетика радикальной сополимеризации.
Стадия инициирования:
I 2R
R + M1 M1
R + M2 M2
Реакция роста цепи может протекать по четырем направлениям:
k11
- M1 + M1 - M1M1 = k11. [M1] . [M1]
k12
- M1 + M2 - M1M2 = k12 . [M1] . [M2]
k22
- M2 + M2 - M2M2 = k22 . [M2] . [M2]
k21
- M2 + M1 - M2M1 = k21 . [M2] . [M1]
Скорость расходования мономеров выражается уравнениями:
-d[M1]/dt = k11 . [M1] . [M1] + k21 . [M2] . [M1]
-d[M2]/dt = k12 . [M1] . [M2] + k22 . [M2] . [M2]
k12 . [M1] . [M2] = k21 . [M2] . [M1]
[M2] = (k12/ k21) . [M1] . ([M2]/ [M1])
d[M1] [M1] (k11/ k12) . [M1] + [M2]
d[M2] [M2] (k22/ k21) . [M2] + [M1]
Отношение констант обозначается как:
k11/ k12 = r1 k22/ k21 = r2, где r1 и r2 – константы сополимеризации.
d[M1]/d[M2] = [m1]/[m2], где [m1] и [m2] – концентрация мономерных звеньев M1 и M2 в сополимере.
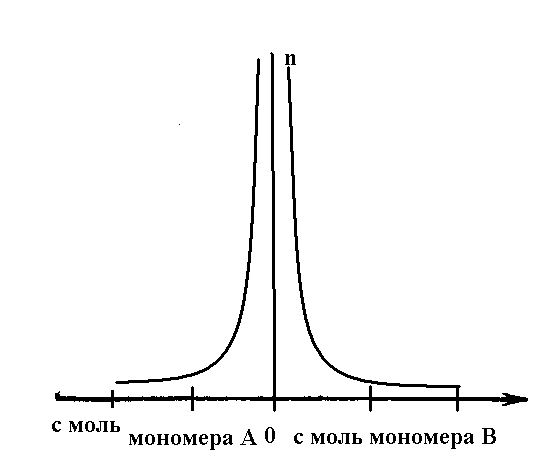
1.6.3. Диаграмма состава сополимера от исходной смеси мономеров.
Зависимость состава сополимера от состава смеси удобно характеризовать диаграммой: состав мономерной смеси - состав сополимера.
1 – если r1= r2 = 1, т.е. реакционные способности обоих радикалов и мономеров одинаковы. При этом, при любом соотношении мономеров состав сополимера равен составу исходной смеси.
2 – если r1< 1, r2> 1, то активность мономера М2 выше активности мономера М1. При этом, при любых соотношениях мономеров сополимер обогащен звеньями мономера М2.
3 – если r1< 1, r2< 1, то оба мономера склонны к совместной сополимеризации. При этом, до перегиба сополимер обогащен звеньями мономера М2, а после перегиба – звеньями мономера М1.
4 – если r1 > 1, r2 < 1, то активность мономера М1
выше активности мономера М2. При этом, при
любых соотношениях мономеров сополимер
обогащен звеньями мономера М1.
1.6.4. Определение констант сополимеризации методом Майо – Льюиса.
Преобразуя уравнение состава сополимера
можно получить после преобразования следующее выражение, в котором константа сополимеризации r2 линейно зависит от r1, а и являются параметрами прямой:
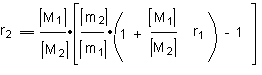
Каждая пара значений этих параметров (соответствующие одному опыту) дает прямую в системе координат r1 и r2. На основании каждого опыта можно построить одну прямую, а по точке пересечения прямых, полученных из опытов, можно определить значение r1 и r2 для изученных систем.
По результатам эксперимента строят три прямые, теоретически эти прямые должны пересечься в одной точке, однако из-за ошибок опытов они ограничивают некоторую область наиболее вероятных значений r1 и r2.
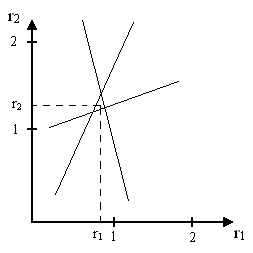
1.6.5. Определение констант сополимеризации методом Файмана - Росса.
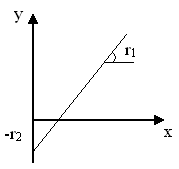
Если обозначим [M1]/[M2] = F, а [m1]/[m2] = f, из уравнения состава сополимера после преобразования получим:
(F/f) . (f –1) = r1 . (F2/f) – r2
По данным эксперимента строят график зависимости y = y(x), где y = F(f – 1)/f, а x = F2/f
Каждый опыт (т.е. пара значений F и f) дает точку на этом графике, а серия опытов – прямую.
Угловой коэффициент прямой соответствует значению r1, а отрезок, отсекаемый на оси ординат – значению r2 с обратным знаком.
Обычно прямую не строят, а производят расчет параметров прямой y = y(x) методом наименьших квадратов.
1.6.6. Способы проведения полимеризации в блоке.
Полимеризацию в блоке проводят в отсутствии растворителя. Реакционной средой служит сам мономер. Полимеризация проводится в присутствии инициаторов радикальной и катализаторов ионной полимеризации, растворимых в мономере. При полимеризации могут вноситься различные добавки - стабилизаторы, пластификаторы. При полимеризации образуется монолит (блок), который при периодическом методе полимеризации приобретает форму реакционного сосуда, а при непрерывном методе - принимает форму и размеры отверстия, через которые полимер выпускается из аппарата (ленты, стержни). Достоинствами данного способа являются: возможность использования блоков полимера без последующей переработки, отсутствие стадии отделения от растворителя, возможность получения полимера более высокой степени чистоты по сравнению с суспензионным и эмульсионным методами, а также возможность изготовления блоков с высокими оптическими свойствами. Основной недостаток – трудность отвода выделяющегося тепла с повышением вязкости реакционной среды. В результате в блоке могут образоваться пузырьки, включения мономера и другие дефекты. Местные перегревы ведут к образованию полидисперсного полимера, что ухудшает его физико-механические свойства, которые ухудшаются от периферии к центру. Молекулярная масса полимера в блоке от периферии к центру уменьшается.
1.6.7. Способы проведения полимеризации в растворе.
Полимеризацию в растворе проводят в среде, в которой растворяется мономер и образующийся полимер. Достоинством этого метода является легкость отвода выделяющегося тепла, что приводит к получению полимера со сравнительно высокой однородностью молекулярной массы. Недостатками данного метода являются: необходимость дополнительных затрат на подготовку растворителя, отделения и регенерации растворителя, промывка и сушка полученного полимера, трудность получения полимера с высокой молекулярной массой. Молекулярная масса полимера зависит от природы растворителя. В активных растворителях (CCl4, CHCl3) образуются полимеры с низкой молекулярной массой, вследствие передачи цепи на растворитель. Полимеризацию в растворе обычно применяют для получения лаков, клея, а также для прядения из растворов. Разновидностью этого метода является полимеризация в таком веществе, в котором растворяется мономер, но не растворяется полимер, тогда образующийся полимер выпадает в осадок, и может быть легко отделен от растворителя. Этот метод применяется для производства полиэтилена высокой плотности, полипропилена и их сополимеров.
1.6.8. Способы проведения полимеризации в эмульсии.
Эмульсионная полимеризация - это наиболее распространенный промышленный метод, использующийся для получения полимеров на основе бутадиена, изопрена винилацетата, винилхлорида, акрилатов, метакрилатов и их смесей. При эмульсионной полимеризации в качестве дисперсионной среды обычно используют воду, в качестве эмульгатора- различные мыла. Эмульгатор- это поверхностно активное вещество, в составе которого есть гидрофильные и гидрофобные части. В качестве инициаторов эмульсионной полимеризации используют водорастворимые инициаторы, окислительно-восстановительные системы. Полимеризация может протекать в молекулярном растворе мономера в воде, на поверхности раздела капля мономера- вода, на поверхности или внутри мицелл мыла, а также на поверхности или внутри образующихся полимерных частиц, набухших в мономере. Достоинством данного метода является возможность осуществления процесса с большими скоростями, получения полимера с высокой молекулярной массой и относительно низкой степенью полидисперсности при относительно низкой температуре и скорости реакции, значительно превышающих скорость полимеризации в блоке и в растворе, а также легкость теплоотвода и возможность получения полимера в виде тонкого порошка. После окончания эмульсионной полимеризации полимер можно непосредственно использовать для формирования различных изделий, минуя стадию его выделения. Недостатками данного метода являются необходимость удаления остатков эмульгаторов, загрязнение полимера коагулянтами, что приводит к ухудшению его диэлектрических свойств, и большое количество сточных вод, требующих специальной очистки.
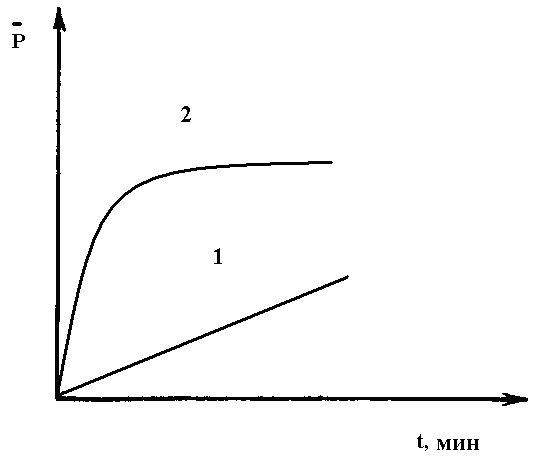
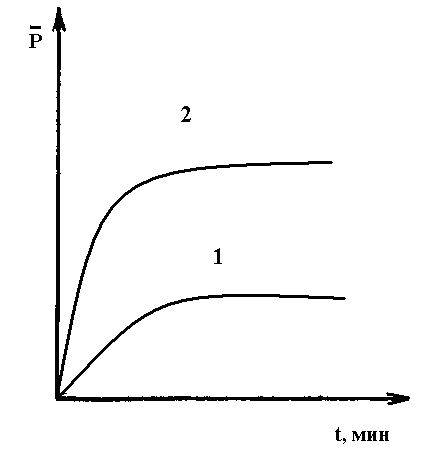
.
1 – в присутствии эмульгатора 1- 0,4 моль эмульгатора.
2- без эмульгатора. 2- 0,9 моль эмульгатора
1.6.9. Способы проведения полимеризации в суспензии.
При проведении полимеризации в суспензии мономеры диспергируются перемешиванием в воде до образования капель. Капли стабилизируют водорастворимыми полимерами (поливиниловый спирт, желатин), а также тальком, глиной, оксидом марганца. При суспензионной полимеризации используются радикальные инициаторы, растворимые в мономере. Полимеризация протекает в капле, как в миниатюрном блоке. Преимуществом данного способа являются: отвод тепла осуществляется с помощью дисперсионной среды, отсутствует необходимость осаждать полимер, в отличие от эмульсионной полимеризации. Однако недостатками данного способа являются: необходимость отмывки гранул от стабилизатора и необходимость сушки полимера.
1.7. Катионная полимеризация.
1.7.1. Мономеры, участвующие в катионной полимеризации.
1.7.2. Стадии катионной полимеризации (инициирование, рост цепи, передача цепи на мономер).
1.7.3. Кинетика катионной полимеризации.
1.7.1. Мономеры, участвующие в катионной полимеризации.
В катионную полимеризацию вступают виниловые и диеновые мономеры, содержащие электронодонорные заместители у двойной связи:
CH3 CH3
| |
CH2 = C СH2 = C CH2 = CH CH2 = CH – C =CH2
| | | |
CH3 OR CH3
изобутилен виниловые эфиры изопрен
-метил стирол
А также карбонилсодержащие соединения: СН2 = О СН3 – СН – СН2
формальдегид
О
пропиленоксид
и другие оксиды олефинов.
Катализаторами служат электроноакцепторные соединения: сильные протонные кислоты (H2SO4 , H3PO4 , HClO4 ). При использовании таких катализаторов происходит прямое протонирование мономера М с образованием карбкатиона:
+ –
НХ + СН2 = СН СН3 –– СН Х
кислота |
R R противоион
мономер карбкатион
В качестве катализатора также используют кислоты Льюиса (апротонные кислоты, не содержащие водород): BF3, SnCl4, FeBr3, TiCl4, AlBr3. При этом необходимы сокатализаторы, содержащие в своем составе водород: H2O, спирты, эфиры.
В качестве примера рассмотрим полимеризацию изобутилена в присутствии катализатора BF3 и сокатализатора – воды.
1.7.2. Стадии катионной полимеризации (инициирование, рост цепи, передача цепи на мономер).
1. ИНИЦИИРОВАНИЕ
BF3 + Н+ОН- Н+[BF3OH]-
катализатор сокатализатор
CH3 CH3
+ – + –
Н [BF3OH] + CH2 = C CH3 – C [BF3OH]
CH3 CH3
мономер активный
изобутилен центр
2. РОСТ ЦЕПИ
CH3 CH3 CH3 CH3 CH3
| + – | | | + – |
CH3 – C [BF3OH] + CH2 = C CH3 – C – CH2 – С [BF3OH] + CH2 = C
| | | | |
CH3 CH3 CH3 CH3 CH3
CH3 CH3 CH3 CH3
| | | + – |
CH3 – C – CH2 – C – CH2 – С [BF3OH] + CH2 = C и т.д.
| | | |
CH3 CH3 CH3 CH3
3. ОБРЫВ ЦЕПИ
При катионной полимеризации обрыв цепи является редким явлением, так как одинаково положительно заряженные частицы макромолекулы взаимно отталкиваются, и поэтому невозможен обрыв цепи путем рекомбинации, как в радикальной полимеризации.
В некоторых случаях возможен обрыв цепи за счет присоединения анионного фрагмента противоиона и карбкатиона.
CH3 CH3 CH3 CH3
| | + – | |
~ – CH2 – C – CH2 – С [BF3OH] ~ – CH2 – C – CH2 – С – OH + BF3
| | | |
CH3 CH3 CH3 CH3
Катализатор BF3 регенерируется, т.е. возвращается в реакционную среду.
Обрыв цепи таким образом может происходить вследствие отщепления протона от растущего макрокатиона к противоионам.
CH3 CH3 CH3 CH2
| | | ||
~ – CH2 – C – CH2 – С+ [BF3OH] – ~ – CH2 – C – CH2 – С + BF3 + H2O ;
| | | |
CH3 CH3 CH3 CH3
CH3 CH3 CH3 CH3
| | | |
~ – CH2 – C – CH2 – С+ [BF3OH]– ~ – CH2 – C – CH = С + BF3 + H2O ;
| | | |
CH3 CH3 CH3 CH3
В ходе реакции обрыва цепи регенерируется исходный комплекс катализатор-сокатализатор, т.е. BF3 и H2O.
4. ПЕРЕДАЧА ЦЕПИ
Реакция ограничения цепи может происходить вследствие передачи цепи на мономер. В результате реакции образуется новый активный центр, который может вновь инициировать рост новой цепи.
CH3 CH3 CH3 CH3 CH2 CH3
| | | | || |
~ – CH2 – C – CH2 – С+[BF3OH]– + CH2 = C ~ – CH2 – C – CH2 – С + CH3 – С+[BF3OH]–
| | | | | |
CH3 CH3 CH3 CH3 CH3 CH3
Аналогично протекает полимеризация в присутствии других катализаторов - сокатализаторов:
SnCl4 + HCl H+[ SnCl5]–
TiCl4 + HOH H+[ TiCl4OH]–
SnCl4 + HOH H+[ SnCl4OH]–
1.7.3. Кинетика катионной полимеризации.
Максимальная скорость полимеризации достигается при определенной концентрации сокатализатора – воды.
Если концентрация сокатализатора выше необходимой, то скорость полимеризации и степень полимеризации, а следовательно, и молекулярная масса падает, т.к. вода и другие сокатализаторы являются эффективными агентами передачи цепи.
Мм
оптимальная оптимальная
концентрация концентрация
сокатализатора сокатализатора
концентрация воды С, моль/л концентрация воды С, моль/л
Скорости всех элементарных стадий зависят от природы растворителя. Молекулярная масса полимера не зависит от концентрации инициатора.
Кинетическая схема процесса:
Стадия инициирования: V ин= kин . [I]
Стадия роста цепи: Vр= kр . [М+]. [M]
Стадия обрыва цепи: Vобр= kобр . [М+]
Стадия передачи цепи: V= kпц . [М+]. [M]
В стационарных условиях в катионной полимеризации: Vин = Vобр
kин . [I] = kобр . [М+], отсюда [М+]=, подставляем значение [М+] в уравнение для скорости роста цепи и получаем: Vр= kр . . [I] . [M]
Средняя степень полимеризации определяется по формуле:
Суммарная энергия активации процесса Есумм = Еин + Ер- Еобр ,Т.К. Еин – обычна мала, то
Есумм Ер- Еобр . Еобр в ряде случаев оказывается выше Ер, тогда Есумм <0. Следствием этого является возрастание скорости реакции и молекулярной массы с понижением температуры.
Модуль 2. Синтез полимеров методом анионной полимеризации. Химическое превращение полимеров. Кристаллические и аморфные полимеры. Растворы полимеров. Отдельные представители.
2.1. Анионная полимеризация.
2.1.1. Мономеры, вступающие в анионную полимеризацию.
2.1.2. Стадии анионной полимеризации (инициирование, рост цепи, передача цепи на растворитель и на мономер).
2.1.3. Особенности анионной полимеризации. Скорость анионной полимеризации.
2.1.4. Анионная полимеризация в присутствии щелочных металлов, а также алкилов щелочных металлов.
2.1.5. Анионно - координационная полимеризация.
2.1.6. Ионно-координационная полимеризация.
2.1.1. Мономеры, вступающие в анионную полимеризацию.
В анионную полимеризацию вступают виниловые (СН2=СНX) и диеновые мономеры (СН2=СНСН=СН2), содержащие, как правило, электронно-акцепторные заместители у двойной связь.
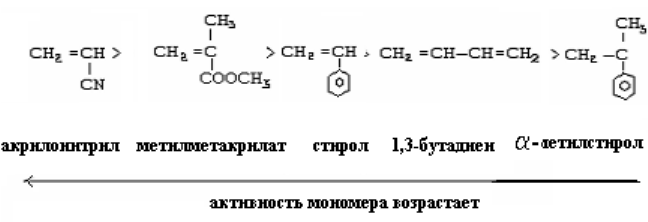
Способность этих мономеров к анионной полимеризации возрастает с увеличением электроотрицательности заместителя. Электроноакцепторные заместители, к которым относятся нитрильная (СN), карбонильная (С=О) – альдегиды и кетоны, карбоксильная
(-СООН) - (кислоты или их эфиры) облегчают атаку двойной связи анионными частицами, вследствие уменьшения электронной плотности такой связи. Они стабилизируют растущие анионы в следствие делокализации отрицательно заряженного иона между углеродом и азотом нитрильной группы СN.
+ -
СН2=СН Х (СN, NО2)
Хотя алкенильные группы (СН=СН2) и фенильные (-С6Н5) обладают электронно-донорным индуктивным эффектом, они, как и нитрильная группа, могут стабилизировать растущий анион, следовательно, такие мономеры как стирол и бутадиен-1,3 полимеризуется и по катионному, и по анионному механизму.
Кроме того, в анионную полимеризацию могут вступать оксиды олефина, лактоны, альдегиды (по связи С=О), формальдегид.
Анионная полимеризация инициируется электрическим током, ионизирующими излучениями, а также щелочными металлами, амидами металлов, алкилами, алкоголятами металлов, комплексами щелочных металлов с ароматическими углеводородами (нафтил натрия и нафтил калия).
2.1.2. Стадии анионной полимеризации (инициирование, рост цепи, передача цепи на растворитель и на мономер).
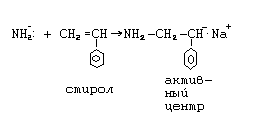
Рассмотрим стадии анионной полимеризации на примере полимеризации стирола в присутствии амида натрия в жидком аммиаке.
1. Инициирование.
Инициирование происходит путем диссоциации амида натрия и присоединения образующегося иона NН2- к мономеру:
Nа NН2 Nа+ + NН2-
диссоциация
2. Рост цепи.
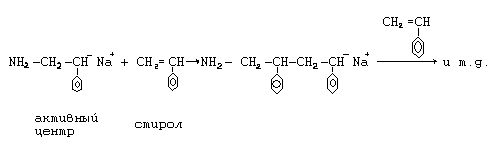
3. При анионной полимеризации реакции ограничения роста цепи возможны за счет реакции передачи цепи на растворитель или мономер.
Передача цепи на растворитель:
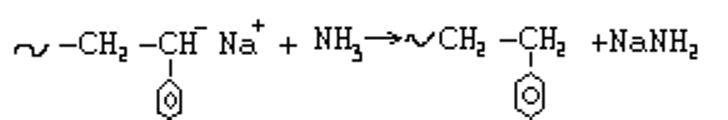
Передача цепи на растворитель проходит путем отрыва протона (Н) от растворителя.
Передача цепи на мономер:
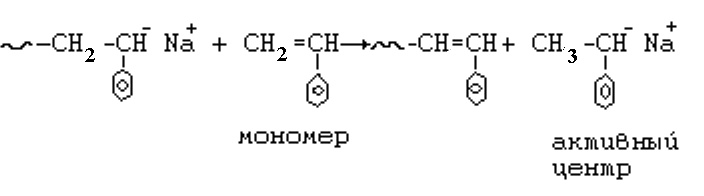
2.1.3. Особенности анионной полимеризации. Скорость анионной полимеризации.
В анионной полимеризации, как и при катионной полимеризации, невозможен обрыв цепи путем соединения растущих макроионов, т.к. они одинаково отрицательно заряжены.
В ряде случаев анионная полимеризация, в отличие от радикальной и катионной, в отсутствии примесей и доноров протона, может протекать без обрыва цепи до полного исчерпания мономера. При этом в реакционной массе сохраняются макроионы, т.е. макромолекулы с отрицательно заряженным ионом на конце, и полимеризация при этом может осуществляться по механизму «живых цепей». Если в такую реакционную массу добавить мономер, то полимеризация продолжится. Можно добавить другой мономер, тогда получится блок-сополимер.
Обычно скорость роста цепи характеризуется первым порядком по концентрации мономера, не зависимо от типа растворителя и противоиона.
V= К [ М ] ·[I]
Скорость анионной полимеризации обычно возрастает с увеличением диэлектрической проницаемости растворителя.
Полимеры, полученные методом анионной полимеризации, имеют более регулярную структуру, чем полимеры, полученные методом радикальной полимеризации.
Анионная полимеризация более широко используется в промышленности, по сравнению с катионной.
Анионная полимеризация позволяет получить полимеры монодисперсные (равномерные) по молекулярной массе. В случае отсутствия обрыва цепи, быстрого инициирования и одинаковых условий в любой точке реакционной системы (перемешивание), удается получить полимеры с приблизительно одинаковой молекулярной массой.
2.1.4. Анионная полимеризация в присутствии щелочных металлов, а также алкилов щелочных металлов.
При использовании в качестве катализаторов анионной полимеризации щелочных металлов, на стадии инициирования за счет переноса электронов от металла на молекулу мономера возникают анион-радикалы:
СН2=СН + Nа Н2-СН- Nа+
Х Х
анион-радикал
Анион-радикал быстро рекомбинирует, образуя дианионы:
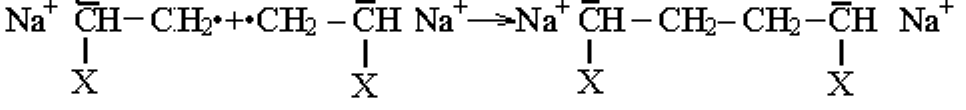
В результате реакционноспособными оказываются оба конца растущей цепи. Следующие молекулы мономера присоединяются по обоим концам.
В анионной полимеризации в качестве катализаторов алкилов щелочных металлов наиболее широко применяется бутил лития (СНLi ).
Стадия инициирования:
СН Li + СН =СН СН – СН СН Li
Х Х
Стадия роста цепи:
СН – СН СН Li + СН= СН СН– СН СН– СН СН Li и т.д.
Х Х Х Х
Реакция проводится в среде эфиров или неполярных углеводородов.
Стадия обрыва цепи:
СН– СН СН– СН СН Li + НОН СН– СН СН – СН СН+ LiОН
Х Х Х Х
2.1.5. Анионно-координационная полимеризация.
Рассмотрим особенности полимеризации на примере изопрена в присутствии бутиллития. Мономер с катализатором образует комплекс с двумя активными центрами: металл и алкил, в котором металл связан с мономером координационной связью. Такая полимеризация называется анионно-координационной.
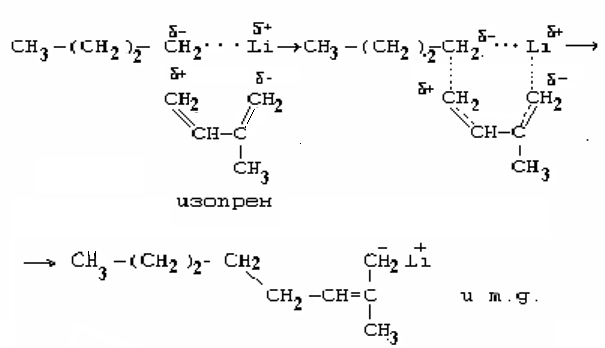
В процессе роста цепи двухцентровой комплекс координирует новую молекулу изопрена в пространстве так, что мономер внедряется между отрицательно заряженным алкильным остатком и положительно заряженным ионом лития, что приводит к последующему образованию стереорегулярного полимера. В связи с этим в процессе полимеризации образуется полиизопрен с высоким содержанием цис – 1,4 звеньев, который является синтетическим аналогом натурального каучука.
Анионно-координационная полимеризация с образованием стереорегулярных полимеров протекает в среде инертных растворителей в присутствии литийорганических соединений.
Стереорегулярные полимеры не образуются, если алкильная группа литийорганического соединения содержит меньше четырех атомов углерода.
2.1.6. Ионно-координационная полимеризация.
Ионно-координационная полимеризация проводится в присутствии комплексных катализаторов Циглера – Натта, в состав которых входит металлоорганические соединения Al и других металлов I-III групп, а также галогениды переходных металлов IV-VIII групп.
Открытие комплексных катализаторов, позволило получить высокомолекулярные, стереорегулярные, кристаллические поли--олефины (изотактический полипропилен), полидиены (1,2-полибутадиен; 1,4-цис- 1,4-транс-полибутадиены).
Наиболее распространенная каталитическая система – TiCl3 и триэтилалюминий (Al(C2H5)3). Рентгеноструктурный анализ комплекса показал, что его строение соответствует формуле:
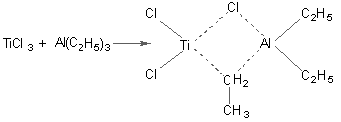
Реакция протекает по анионно-координационному механизму. В начале образуется – комплекс за счет взаимодействия двойной связи мономера с переходным металлом (Ti). Возникновение – комплекса приводит к диссоциации связи TiCH2 – CH3, после чего происходит внедрение мономера с образованием шестичленного комплекса с координационной связью Ti – C метиленовой группы:
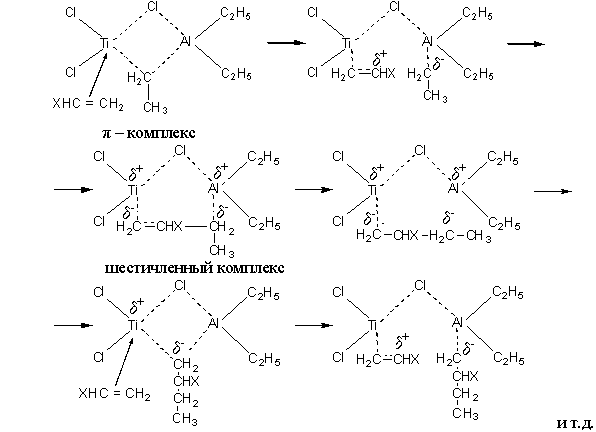
При этом заместитель Х при атоме С в молекуле мономера сохраняет строго определенное пространственное расположение относительно основной цепи. Возможно образование изотактического полимера, когда все заместители Х расположены по одну сторону от плоскости основной цепи макромолекулы, а также синдиотактические полимеры, когда заместители Х правильно чередуются в пространстве относительно плоскости основной цепи.
Стереорегулярность полимера резко уменьшается при наличии в реакционной среде посторонних примесей, а также с увеличением температуры.
С повышением концентрации TiCl3 молекулярная масса полимера уменьшается и практически не зависит от температуры.
При 70 С образуются синдиотактические полимеры, при 50-100 С – изотактические, при температуре >100 С – атактические.
При полимеризации пропилена в присутствии TiCl3 с хлоридом металлов I-III групп, стереорегулярность падает в ряду: Be>Al>Mg>Li~Na~Zn.
2.2. Поликонденсация.
2.2.1. Мономеры, вступающие в реакцию поликонденсации.
2.2.2. Классификация поликонденсации (гомополиконденсация, гетерополиконденсация, линейная, трехмерная, циклополиконденсация, равновесная и неравновесная поликонденсации).
2.2.3. Основные отличия поликонденсации от полимеризации.
Поликонденсация – это процесс образования макромолекул из би- и полифункциональных соединений, сопровождающихся отщеплением низкомолекулярных соединений (воды, NH, C2H5OH (R-OH), HCl). В качестве мономеров используются соединения, содержащие в молекуле не менее двух функциональных групп.
n a–A–a + n b–B–b a [-A-B-] b + (2n - 1) ab, где
а, в – функциональные группы (-OH, -NH, -COOH, -COCl ).
аb - низкомолекулярные соединения, которые выделяются (H2O, NH3, HCl).
2.2.1. Мономеры, вступающие в реакцию поликонденсации.
В качестве мономеров для поликонденсации используются соединения, содержащие в молекуле не менее двух функциональных групп.
1. Гликоли, содержащие гидроксильные группы (-ОН):
HO-CH2-CH2-OH HO- CH2-CH(OH)-CH2-OH
этиленгликоль глицерин
1,2-этандиол 1,2,3-пропантриол
2. Диамины, содержащие аминогруппы (-NH2 ):
NH2-(CH2)6-NH2
гексаметилендиамин
3. Дикарбоновые кислоты, содержащие группы (–СООН):
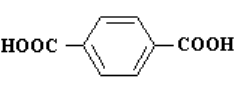
терефталевая кислота
4. Дихлорангидриды карбоновых кислот, содержащие хлорангидридные группы (–СОСl):
дихлорангидрид адипиновой кислоты
5. Диизоцианаты, содержащие изоцианатные группы (–N=C=O):
O=C=N – (CH2)6 – N=C=O
гексаметилендиизоцианат
2.2.2. Классификация поликонденсации (гомополиконденсация, гетерополиконденсация, линейная, трехмерная, циклополиконденсация, равновесная и неравновесная поликонденсации).
Процесс поликонденсации, в котором участвуют однородные мономеры, называется гомополиконденсацией. Например, реакция полиамидирования:
n HN - R - COOH H[-HN - R - CO-]OH + n HO.
аминокислота полиамид
Процесс поликонденсации, в котором участвуют разнородные мономеры, называется гетерополиконденсацией. Например, реакция полиамидирования:
n H2N-R-NH + n HOOC-R`-COOH H[-HN- R-NH-CO-R`-CO-]OH + (2n- 1) H2O
диамин дикарбоновая кислота полиамид
Реакция поликонденсации бифункциональных соединений, то есть бифункциональных мономеров, приводящая к образованию линейных полимеров, называется линейной поликонденсацией.
Поликонденсация мономеров, содержащих более двух функциональных групп, приводящих к образованию разветвленных или сетчатых полимеров, называется трехмерной поликонденсацией. Например, образование фенолформальдегидных, глифталевых смол. Двухступенчатая реакция, в которой образовавшийся на первой стадии продукт линейной поликонденсации, на второй стадии подвергается внутримолекулярной циклизации, называется циклополиконденсацией.
Поликонденсация в зависимости от значения константы равновесия (Кравн) подразделяется на равновесную (обратимую) и неравновесную (необратимую).
Константа равновесия равна отношению концентрации продуктов реакции к концентрации исходных реагентов.
k- константа скорости реакции.
Если Кравн = 1 , то система находится в состоянии равновесия.
К необратимой поликонденсации относится поликонденсация с константой равновесия
Кравн >10 (например, синтез фенолформальдегидных смол сетчатого строения), а к обратимой относится поликонденсация с константой равновесия Кравн <10 (обычно 0,1 или 10). Например, синтез полиамидов и полиэфиров.
При неравновесной поликонденсации обычно образуются значительно более высокомолекулярные полимеры (с молекулярной массой 100000), чем при равновесной поликонденсации (молекулярная масса от 20000 до 70000). Обратимый характер реакции поликонденсации объясняется тем, что может протекать не только прямая реакция образования полимера, но и обратная реакция за счет взаимодействия полимера с выделяющимся низкомолекулярным соединением. Этим объясняется тот факт, что молекулярная масса полимера при поликонденсации растет не до бесконечности, а получается полимер с ограниченной молекулярной массой. Удаляя из сферы реакции выделяющиеся низкомолекулярные соединения, можно сместить равновесие в сторону образования продуктов реакции, и получить полимер с более высокой молекулярной массой.
По характеру функциональных групп, взаимодействующих между собой при поликонденсации, мономеры подразделяются на:
- Мономеры с однородными функциональными группами.
Например, образование простых эфиров:
n НО- СН2-СН2-ОН Н-[-О-СН2-СН2-]n-ОН + n Н2О
этиленгликоль полиэфир
1,2- этандиол
2) Мономеры, содержащие в молекуле разнородные функциональные группы.
Например, образование полиамидов:
n НООС- R – NН2 НО- [-ОС- R- NН-]n-Н + n Н2О
аминокарбоновая кислота полиамид
Получение полигексаметиленадипамида (анида,найлона-6,6):
1. n Н2N-(CH2)6-NH2 + n HOOC-(CH2)4-COOH
гексаметилендиамин адипиновая кислота
H-[-HN-(CH2)6-NH-OC-(CH2)4-CO-]n-OH + (2n-1) H2O
полигексаметиленадипамид (анид, найлон-6,6).
2. n Н2N-(CH2)6-NH2 + n ClOC-(CH2)4-COCl
гексаметилендиамин дихлорангидрид адипиновой кислоты
H-[-HN-(CH2)6-NH-OC-(CH2)4-CO-]n-Cl + (2n-1) HCl
полигексаметиленадипамид (анид, найлон-6,6).
Получение поли--капроамида (капрона):
n HN –(СН2)5 - COOH H[-HN – (СН2)5 - COO-]OH + n HO
аминокапроновая кислота поли--капрамид (капрон)
Получение полиэфиров.
Получение полиэтилентерефталата (лавсана):
n НО- СН2-СН2-ОН + n HOOC-(C6H4)-COOH
этиленгликоль,1,2- этандиол терефталевая кислота
H-[-О-(CH2-СН2-О-OC-(C6H4)-CO-]n-OH + (2n-1) H2O
полиэтилентерефталат (лавсан)
Лавсан расшифровывается, как «Лаборатория высокомолекулярных соединений Академии Наук».
Получение полиуретанов:
n O=C=N- R- N=C=O + n НО- R1-ОН [-CO-NH-R-NH-CO-O-R1-O-]n-
диизоцианат гликоль полиуретан
- Основные отличия поликонденсации от полимеризации.
|
Поликонденсация. |
Полимеризация |
|
1. Мономеры исчезают в начальной стадии процесса. Молекулярная масса полимера растет за счет взаимодействия олигомеров. 2. В ходе реакции поликонденсации выделяется низкомолекулярный продукт, поэтому состав полимера отличается от состава исходных мономеров. 3. Любые две молекулы в системе способны взаимодействовать за счет функциональных концевых групп. 4. Во многих случаях макромолекулы претерпевают изменения в результате обмена функциональными группами мономера и полимера, без образования разветвленного высокомолекулярного соединения. 5. На любой стадии реакции присутствуют молекулы различной величины и их распределения по молекулярным массам может быть рассчитано. |
1. Концентрация мономеров уменьшается постепенно. Рост молекулярной массы осуществляется за счет присоединения мономера к растущей полимерной цепи. 2. Так как реакции протекают без выделения низкомолекулярного продукта, и идет за счет разрыва кратных связей, то состав полимера и мономера одинаков. 3. Полимерные молекулы не взаимодействуют друг с другом, кроме реакции обрыва цепи. 4. Взаимодействие растущей цепи с макромолекулой (передача цепи на полимер) приводит к образованию разветвленного высокомолекулярного соединения. 5. В реакционной системе присутствуют только мономер, полимер и растущая цепь в количестве около 10-6 %. |
2.3. Влияние различных факторов на процесс поликонденсации.
2.3.1. Влияние различных факторов на процесс поликонденсации.
2.3.2. Побочные реакции.
2.3.3. Кинетика линейной поликонденсации.
2.3.4. Способы проведения линейной поликонденсации.
2.3.1. Влияние различных факторов на процесс поликонденсации.
- Влияние концентрации мономера на скорость поликонденсации и молекулярную массу полимера.
Скорость поликонденсации пропорциональна концентрации реагирующих веществ. С повышением концентрации мономера сокращается время, необходимое для достижения равновесия и получения полимера с максимальной молекулярной массой.
Чем больше вязкость полимера, тем больше его молекулярная масса. Оптимальная концентрация мономеров около 30 весовых %. При проведении реакции в растворе, понижение молекулярной массы полимера, при увеличении концентрации мономера выше оптимальной, происходит вследствие увеличения вязкости среды. Чем больше концентрация функциональных групп, тем больше скорость и степень полимеризации. Это следует из уравнения скорости реакции:
v = k.[Ca] . [Cb] . [Cкат]
2. Влияние температуры.
С повышением температуры скорость реакции увеличивается. Молекулярная масса полимера с увеличением температуры возрастает до определенного момента, а затем понижается, что связано с увеличением доли побочных реакций (циклизации, деструкции полимеров, кипения растворителя). Так например, при проведении реакции поликонденсации в среде растворителя крезола, имеющего температуру кипения 187 С°, оптимальная температура равна 180 С°.
Высокая температура способствует удалению низкомолекулярного продукта поликонденсации, смещая тем самым равновесие в сторону образования высокомолекулярного продукта.
Температура проведения реакции зависит от типа полимера. Некоторые полимеры получают при температуре 200-300 °С. При проведении реакции в растворе крезола и фенола реакцию проводят при температуре 170-190 °С. При использовании хлорангидридов дикарбоновых кислот реакцию проводят при температуре от -40 до 100°C.
Синтез циклолинейных полимеров осуществляют в 2 стадии:
Первую стадию проводят при температуре 10-60°C, а вторую – циклодегидратацию проводят при температуре 300-400°C.
3. Влияние катализатора.
Применение катализатора зависит от типа получаемого полимера. Катализаторами реакции полиэтерификации служат минеральные кислоты, щелочные металлы и их оксиды. При синтезе фенолформальдегидных смол используются щелочи, кислоты. При синтезе полиамидов - третичные амины, карбоновые кислоты и их амиды. Катализатор повышает скорость реакции, ускоряет приближение системы к равновесию. При больших значениях константы равновесия, катализаторы, ускоряя реакцию, способствуют увеличению молекулярной массы полимера, а, следовательно, и средней степени полимеризации. Увеличение концентрации катализатора приводит сначала к увеличению молекулярной массы полимера, а затем к снижению.
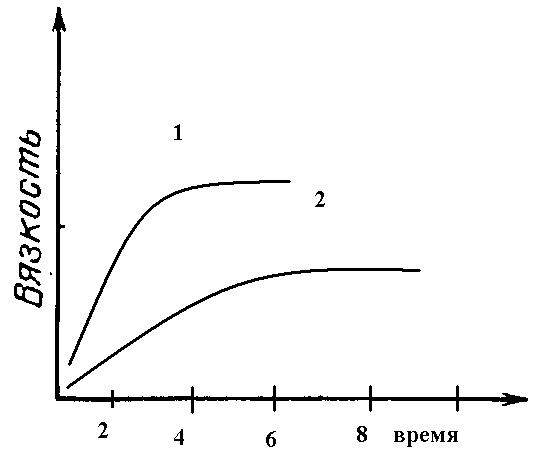
1- с катализатором, 2- без катализатора
4. Влияние продолжительности реакции на молекулярную массу полимера.
С увеличением продолжительности реакции молекулярная масса полимера увеличивается до достижения состояния равновесия, а затем практически не меняется.
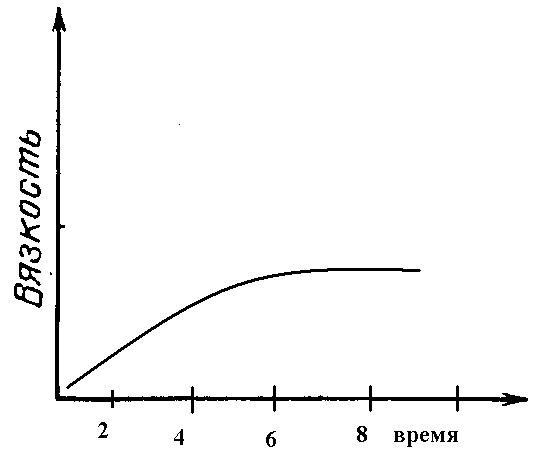
5. Влияние соотношения исходных компонентов.
Необходимым условием образования высокомолекулярного полимера является эквимолекулярное соотношение исходных мономеров. При избытке одного из исходных мономеров или при наличии монофункциональных примесей, избыточные группы блокируют концевые группы растущих цепей, препятствуя дальнейшему росту молекулярной массы полимера.
2.3.2. Побочные реакции.
Наряду с реакциями образования полимера могут протекать побочные реакции (циклизация, обменные реакции). Циклизация может быть внутримолекулярной, когда циклы образуются за счет взаимодействия функциональных групп одной молекулы:
O
HO-CH2-CH2-CH2-COOH CH2 CO
| |
CH2 CH2
-оксимасляная кислота бутиролактон
При нагревании -оксимасляной кислоты вместо полимера образуется циклический бутиролактон;
При циклизации - оксивалериановой кислоты образуется лактон с шестичленным кольцом, переходящий в полиэфир при действии небольших количеств воды или кислоты:
O
HO-CH2-CH2-CH2-CH2-COOH CH2 CO H-[-O-(CH2)4-CO-]n-OH
| |
CH2 CH2
\ /
CH2
- оксивалериановая кислота валеролактон полиэфир
Циклы могут возникать и в результате межмолекулярных реакций или димеризации:
|
COOH H2N CO - NH / \ / \ R –CH + CH-R R-CH CH-R + 2H2O \ / \ / NH2 HOOC HN - CO
- аминокислота дикетопиперазин |
CH2-OH HOOC CH2 - OOC-C=O CH2 - OOC
| + | | | | |
CH2-OH HOOC -H2O CH2OH OH -H2O CH2 - OOC
этилен- щавелевая димер циклический
гликоль кислота сложный эфир
Циклизация является основным направлением в реакции, когда могут образовываться пяти- и шестичленные циклы.
Повышение температуры и концентрации мономеров, способствующие реакции поликонденсации, еще в большей степени оказывают влияние на деструкцию полимера. При каждой температуре между этими двумя процессами устанавливается определенное равновесие, от положения которого зависят молекулярная масса и фракционный состав полимера.
Обменные реакции, реакции деструкции обусловлены взаимодействием полимерных молекул с низкомолекулярными продуктами поликонденсации, мономерами, еще не вступившими в реакцию или находящимися в избытке, и концевыми группами макромолекул.
При действии воды на полиамид протекает реакция гидролиза:
а)
|
. . . – NH– (CH2)n –NH – CO-(CH2)m –CO - . . . H – OH . . . –NH–(CH2)n –NH2 + HOOC-(CH2)m –CO - . . . |
При действии дикарбоновых кислот на полиэфиры протекает реакция ацидолиза :
б)
. . . – О–(CH2)n – О– CO-(CH2)m –CO - . . .
HOOC-R-CO–OH
. . . –O–(CH2)n –O-COR -COOH + HOOC-(CH2)m –CO - . . .
При действии диаминов на полиамиды протекает реакция аминолиза :
в)
. . . – NH–(CH2)6 –NH–CO-(CH2)4 –CO - . . .
H – NH–(CH2)6 –NH2
. . . – NH–(CH2)6 –NH2 + H2N- (CH2)6 –NH-CO-(CH2)4 –CO - . . .
При действии спирта на полиэфир протекает реакция алкоголиза:
. . . -O–R - O¦CO-R`-CO- . . . . . . -OR–OH + R``-OCO-R`-CO - . . .
H ¦OR``
2.3.3. Кинетика линейной поликонденсации.
n a–A–a + n b–B–b a [-A-B-]b + (2n - 1) ab
Принцип Флори.
В основе рассмотрения кинетики поликонденсации лежит принцип независимости реакционной способности функциональных групп от размера молекул и вязкости реакционной среды. Это позволяет в расчетах вместо концентрации веществ использовать концентрации функциональных групп.
Скорость химической реакции прямо пропорциональна концентрации, участвующих в реакции веществ: , где
- константа скорости реакции;
- концентрация катализатора;
и - концентрации функциональных групп веществ А и В, соответственно;
Скорость реакции поликонденсации равна скорости исчезновения функциональных групп.
В связи с тем, что в поликонденсации исходные мономеры берутся в эквимольном соотношении, то скорости исчезновения функциональных групп а и в, равны: ;
Принимая концентрации функциональных групп «а» и «в» одинаковыми и равными величине «С» и обозначая , получаем:
(1)
Степень завершенности реакции или глубина превращения «q» определяется уравнениями:
; ; ; .
Таким образом, степень завершенности реакции q является параметром, показывающим долю функциональных групп, прореагировавших за время t.
Интегрируя уравнение (1) и подставляя вместо величины «С» величину «С0(1-q)», получаем:
, где
- начальная концентрация функциональных групп;
- текущая концентрация функциональных групп.
Средняя степень полимеризации образующегося полимера выражается в виде:
- уравнение Карозерса.
Величина средней степени полимеризации определяется глубиной превращения и линейно возрастает с увеличением продолжительности реакции (q1). При степенях превращениях, близких к единице (q0.95), могут образоваться высокомолекулярные полимеры. Чем сильнее
степень завершенности реакции или глубина превращения «q» стремится к единице, тем выше вероятность получения высокомолекулярных соединений.
2.3.4. Способы проведения линейной поликонденсации.
Существует четыре основных способа проведения поликонденсации.
Поликонденсация в расплаве.
Реакцию проводят при температуре на 10-20 °C, превышающей температуру плавления образующегося полимера, обычно при температуре 200-300 °C в отсутствии растворителя. Во избежание окисления мономеров, а также побочных реакций (окисления, деструкции) процесс проводят в токе инертного газа, а затем в вакууме для более полного удаления низкомолекулярного продукта реакции и смещения равновесия в сторону образования высокомолекулярного продукта.
Преимущества способа: возможность применения малореакционноспособных мономеров, простота технологической схемы, высокий выход и степень чистоты образующегося полимера, возможность формования из полученного расплава полимера волокон и пленок.
Недостатки: необходимость использования термически устойчивых мономеров и проведения процесса при высоких температурах, длительность процесса, использование катализаторов.
Поликонденсацией в расплаве получают полиамиды (найлон), полиэфиры (лавсан).
Поликонденсация в растворе.
Мономеры и полимер находятся в растворе. Процесс проводят при температуре25-250 °C.
Преимущества способа: возможность проведения реакции поликонденсации при сравнительно невысоких температурах; способность растворителя выполнять функции катализатора; хорошая теплопередача; возможность использования полученных растворов полимеров для изготовления пленок и волокон.
Недостатки: необходимость дополнительных затрат на растворитель, его очистку и сушку полимера от растворителя.
В промышленности этот метод используется редко. Важную роль играет природа растворителя.
3. Межфазная поликонденсация- поликонденсация на поверхности раздела двух несмешивающихся жидкостей или жидкости и газа.
Этим способом получают полиэфиры, полиамиды, полиуретаны, поликарбамиды.
Межфазная поликонденсация- это гетерогенный необратимый процесс, скорость которого лимитируется скоростью диффузии реагентов к поверхности раздела фаз. Для проведения поликонденсации исходные реагенты растворяют раздельно в двух несмешивающихся жидкостях (фазах). При контакте приготовленных растворов на границе раздела фаз мгновенно образуется полимер в виде пленки, которую непрерывно вытягивают из реакционной среды до полного исчерпания мономера. Для межфазной поликонденсации наиболее целесообразно применять мономеры с высокой реакционной способностью (дихлорангидриды дикарбоновых кислот, диамины), так как время контакта реагентов при этом уменьшается. Высокая реакционная способность мономеров позволяет провести межфазную поликонденсацию при низких температурах, что исключает протекание побочных реакций. Поэтому межфазную поликонденсацию обычно проводят при комнатной температуре. При повышении температуры, как правило, уменьшается выход и молекулярная масса полимера.
Преимущества: высокие скорости и низкая температура проведения реакции поликонденсации; не требуется высокая степень очистки реагентов; стехиометрическое соотношение мономеров поддерживается автоматически. Межфазная поликонденсация ограниченно применяется в промышленности, вследствие использования дорогостоящих мономеров. Применение этого метода целесообразно для тех продуктов, синтез которых другими способами затруднен или невозможен ( термически нестойкие мономеры), высокоплавких полимеров, для получения высокодисперсных полимерных порошков.
4.Поликонденсация в твердой фазе.
Реакция поликонденсации в твердой фазе протекает с высокой скоростью вблизи температуры плавления мономера, причем скорость реакции резко возрастает по мере приближения к температуре плавления мономера. Этот метод используется для синтеза полимеров из мономеров, разлагающихся при температуре плавления.
2.5. Деструкция полимеров.
2.5.1.Реакции деструкции.
2.5.2. Химическая деструкция.
2.5.3. Окислительная деструкция.
2.5.4. Термическая деструкция.
2.5.5. Фотохимическая деструкция.
2.5.6. Действие ионизирующих излучений.
2.5.7. Механохимические процессы.
2.5.1.Реакции деструкции.
Реакциями деструкции называются реакции, протекающие с разрывом связей основной молекулярной цепи и приводящие к понижению молекулярной массы полимера без изменения его химического состава. Деструкция является очень важной реакцией в химии высокомолекулярных соединений. Ею пользуются для определения строения высокомолекулярных соединений, а также для получения из природных полимеров ценных низкомолекулярных веществ, например, глюкозы из целлюлозы и крахмала. Иногда деструкцию используют для частичного понижения молекулярной массы полимеров, чтобы облегчить их переработку. Процессы расщепления макромолекул полимеров, протекающие с образованием свободных макрорадикалов, применяют для синтеза модифицированных полимеров. Деструкция полимеров может протекать под действием химических агентов (воды, кислот, спиртов, кислорода) или под влиянием физических воздействий (тепла, света, ионизирующего излучения, механической энергии).
2.5.1. Химическая деструкция.
Химическая деструкция протекает под действием полярных веществ, таких как, кислоты, амины, спирты или кислород.
Наиболее распространенным видом химической деструкции полимеров является гидролиз- расщепление химической связи с присоединением молекулы воды. Катализаторами процесса гидролиза служат водородные или гидроксильные ионы. Гидролиз некоторых высокомолекулярных соединений ускоряется в присутствии некоторых природных катализаторов- ферментов, избирательно действующих на некоторые связи. Склонность к гидролизу определяется природой функциональных групп и связей, входящих в состав полимера. При гидролизе функциональных боковых групп изменяется химический состав полимера; при гидролизе связей, входящих в состав основной молекулярной цепи, происходит деструкция и уменьшается молекулярная масса полимера. Концевые группы вновь образующихся молекул по своей природе не отличаются от концевых групп исходного полимера. При невысокой степени деструкции доля вновь образующихся концевых групп настолько мала, что они не влияют на химический состав полимера, и свойства полимера практически не изменяются. С повышением степени деструкции увеличивается доля концевых групп, и их влияние на свойства полимера становится заметным.
2.5.2. Окислительная деструкция.
Окислительная деструкция полимеров, хотя и относится к химическим процессам расщепления, но протекает значительно менее избирательно, чем другие виды химической деструкции.
Процесс в общем виде может быть представлен схемой:
1) распад перекисей с образование радикалов R·, RO· и ROO·;
2) передача неспаренного электрона макромолекуле полимера и разрыв молекулярной цепи с образованием нового радикала:
··· –CH– CH–CH– CH– CH– ··· + RO· ··· –CH–Н–CH– CH– CH– ··· + ROН
··· –CH–Н–CH– CH– CH– ··· ··· –CH–СН= CH + - CH– CH– ···
3) обрыв цепи в результате диспропорционирования свободных радикалов.
В зависимости от строения полимера изменяется скорость окислительной деструкции, и получаются разные конечные продукты реакции. Так, ненасыщенные высокомолекулярные углеводороды деструктируются под влиянием кислорода значительно быстрее, чем насыщенные.
2.5.3. Термическая деструкция.
Принципиально процесс термического расщепления полимеров ничем не должен отличаться от процесса крекинга углеводородов, цепной механизм которого установлен с полной достоверностью. Устойчивость полимеров к нагреванию, скорость термического распада и характер образующихся продуктов зависят от химического строения полимеров. Однако первой стадией процесса всегда является образование свободных радикалов, а рост реакционной цепи сопровождается разрывом связей и понижением молекулярной массы. Обрыв реакционной цепи может происходить путем рекомбинации или диспропорционирования свободных радикалов и приводить к появлению двойных связей на концах макромолекул, изменению фракционного состава и образованию разветвленных и пространственных структур.
Как всякая цепная реакция, термическая деструкция ускоряется веществами, легко распадающимися на свободные радикалы, и замедляется в присутствии веществ, которые являются акцепторами свободных радикалов. Так, диазо- и азосоединения ускоряют термические превращения каучуков. При нагревании разбавленных растворов каучуков при температуре 80 – 100С в присутствии этих инициаторов происходит только деструкция полимера; с повышением концентрации полимера в растворе преобладают межмолекулярные реакции, приводящие к образованию пространственной структуры и гелеобразованию.
При термической деструкции полимеров наряду с понижением средней молекулярной массы и изменением структуры полимера происходит отщепление полимера – деполимеризация. Выход мономера зависит от природы полимера, условий его синтеза и термического расщепления.
Термиче ская деструкция полимеров протекает по свободнорадикально му механизму. В этом случае расщепление макромолекулы мо жет происходить по закону случая, при разрыве цепи по сла бым местам (например, рядом с дефектами структуры или раз ветвлениями) или на концах цепи.
Предполагается, что в процессе образования полиметилметакрилата (блочная полимеризация с перекисью бензоила) обрыв цепи происходит по механизму диспропорционирования, и 50 % макромолекул содержат на конце цепи двойные связи:
СН СН СН СН СН
··· –CH– С – CH– С – CH – С· + ·С – CH – С – CH – ···
СООСН3 СООСН3 СООСН3 СООСН3 СООСН3
СН СН СН СН СН
··· –CH– С – CH– С – CH = С + СН – CH – С – CH – ···
СООСН3 СООСН3 СООСН3 СООСН3 СООСН3
Молекулы указанных двух типов при термической деструкции должны вести себя различно; энергии активации образования свободных радикалов также должны иметь разное значение.
При термическом распаде макромолекулы, содержащей на конце двойную связь, может образоваться аллильный радикал, стабилизованный сопряжением.
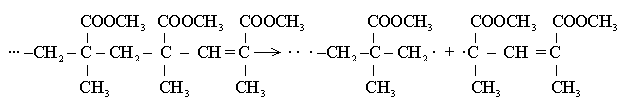
Тогда как при аналогичном расщеплении молекулы, не содержащей двойной связи, образуется нестабилизированный радикал, что энергетически невыгодно.
СООСН СООСН СООСН СООСН СООСН СООСН
··· –CH– С – CH– С – CH–СН ··· –CH– С – CH· + ·С – CH–СН
СН СН СН СН СН СН
Упрощенно схему деструкции полиакриламида в водных растворах в присутствии радикалов R., образовавшихся при термическом распаде инициатора, можно представить следующим образом.
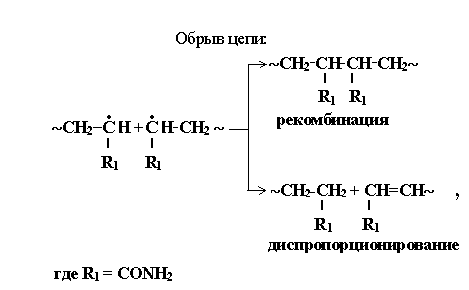
2.5.4. Фотохимическая деструкция.
Реакции, протекающие при облучении полимеров, играют большую роль в процессах старения полимеров и часто определяют срок службы природных и синтетических волокон, изделий из резины и пластических масс, лакокрасочных покрытий.
Действие на полимерные материалы так называемой светопогоды является результатом сложных процессов фотохимической деструкции полимеров, процессов гидролиза и окисления с участием влаги и кислорода воздуха, активированных солнечной энергией. В результате этих процессов может изменяться молекулярная масса, состав, а иногда строение полимера.
По-видимому, основным процессом, вызывающим изменение свойств полимера, в большинстве случаев является цепная фотохимическая реакция расщепления молекулярных цепей полимера, активированная кислородом воздуха. Интенсивность процессов, протекающих при облучении полимеров, зависит от длины волны, интенсивности облучения, наличие инициаторов и природы полимера.
Стабилизация полимеров к фотохимической деструкции основана на введении в полимер соединений, которые легко поглощают световую энергию и трансформируют ее так, что она излучается ими квантами меньшей энергии, безопасными для полимера.
Эффективными стабилизаторами поливинилхлорида являются оловоорганические соединения. Радикальный механизм действия этих стабилизаторов доказан экспериментально:
R· + (CH)Sn(OCOCH) R CH+ CH Sn(OCOCH)
2.5.5. Действие ионизирующих излучений.
Под влиянием ионизирующих излучений полимеры претерпевают глубокие химические и структурные изменения, приводящие к изменению физико-химических и физико-механических свойств. Регулируя интенсивность облучения, можно изменять свойства полимеров в заданном направлении, например, переводить их в неплавкое, нерастворимое состояние. Такая обработка некоторых полимеров применяется в промышленном масштабе. Облученный полиэтилен обладает очень высокой термостойкостью, химической стойкостью и другими стойкими свойствами.
При действии ионизирующих излучений макромолекулы полимеров могут распадаться на свободные радикалы с разрывом связей С-С, С-Н и др. При этом образуются малоподвижные радикалы и такие легкоподвижные радикалы, как Н·, ·CH, СН- Н, СН- Н,
СН- Н, которые, отрывая атом водорода от макромолекулы, удаляются из сферы реакции в виде летучих продуктов.
Облучение полимеров сопровождается образованием двойных связей. Деструкция и образование пространственных структур при облучении полимеров всегда протекают одновременно, но соотношение скоростей этих двух процессов настолько меняется в зависимости от химического строения полимеров, что одни полимеры полностью деструктируются под влиянием ионизирующих излучений, а в других преобладают процессы сшивания макромолекул.
2.5.6. Механохимические процессы.
Процессы, протекающие в полимере под влиянием механической энергии, имеют очень большое практическое значение. Измельчение твердых полимеров, вальцевание, продавливание вязких растворов или расплавов полимеров через капиллярные отверстия, а также процессы, связанные с механическими воздействиями, широко используются в различных отраслях промышленности, перерабатывающих полимерные материалы. В процессе эксплуатации изделия, сформированные из полимеров, претерпевают различные виды деформации. При деформации в полимерах протекают механохимические процессы, которые приводят к изменению структуры и свойств полимеров. Они вызывают утомление полимеров, выражающееся в изменении их свойств, при длительных статистических или динамических воздействиях.
Полимер подвергается самым разнообразным механическим воздействиям. Еще в 1934 г. Штаундингер установил, что при многократном пропускании растворов полимеров через капилляр вязкость раствора вследствие деструкции макромолекул уменьшается.
Механическая деструкция также протекает при размоле и вальцевании полимеров, при интенсивном перемешивании их растворов скоростными мешалками. Полимеры деструктируются под действием ультразвука, при замораживании в водной среде, а также при деформации изделий в процессе эксплуатации.
Стойкость высокомолекулярных соединений к механическим воздействиям зависит от приложенного напряжения, продолжительности действия нагрузки и температуры. При малом напряжении и низкой температуре полимеры разрушаются очень медленно. Увеличение напряжения при той же температуре сокращает время, необходимое для разрушения полимера. При повышенных температурах возможна термическая деструкция, которая ускоряется приложенными извне напряжениями. Во всех случаях разрушение полимера происходит в результате разрыва макромолекул.
Разрыв макромолекул приводит к образованию макрорадикалов, которые служат началом реакционной цепи и могут дальше взаимодействовать с макромолекулами полимера, вступать в реакции рекомбинации или диспропорционирования. В результате этих реакций могут изменяться молекулярная масса и структура полимеров. При механической деструкции в присутствии кислорода воздуха возникающие свободные радикалы могут инициировать цепной процесс окислительной деструкции, что приводит к еще более глубокому разрушению полимера.
2.6. Структура макромолекул и физическое состояние аморфных полимеров.
2.6.1. Структурные элементы макромолекулы.
2.6.2. Надмолекулярные структуры.
2.6.3. Три физических состояния аморфных полимеров.
2.6.4. Стеклообразное состояние.
2.6.5. Высокоэластическое состояние.
2.6.6.Релаксация напряжения.
2.6.1. Структурные элементы макромолекулы.
Структурными элементами макромолекулы являются:
- сегменты;
- звенья.
Отрезок цепи, перемещающийся как единое целое в элементарном акте теплового движения, называется сегментом цепи.
Перемещение сегментов макромолекулы под действием теплового движения обозначено пунктирной линией.
Величина сегмента является мерой гибкости макромолекулы. Гибкие макромолекулы характеризуются меньшей длиной сегмента
(в сегмент входит 10 – 20 звеньев), а в жестких макромолекулах сегмент может состоять из многих десятков звеньев.
В зависимости от степени упорядоченности структуры макромолекулы, все полимеры подразделяются на:
1) кристаллические;
2) аморфные.
Размер молекулы полимера определяется степенью полимери зации n, т.е. числом звеньев в цепи. Если степень полимеризации n=10...20, то вещества представляют собой легкие масла. С возрастанием п увеличива ется вязкость, вещество становится воскообразным, наконец, при n=1000 образуется твердый полимер. Степень полимеризации неограниченна: она может достигать 104, и тогда длина молекул достига ет микрометров. Молекулярная масса полимера обычно находится в пределах 103 до 3 .105. Столь большая длина молекул препятствует их правильной упаковке, и структура полимеров варьируется от аморф ной до частично кристаллической. Доля кристалличности в зна чительной мере определяется геометрией цепей. Чем ближе укла дываются цепи, тем более кристалличным становится полимер. Конечно, кристалличность даже в лучшем случае оказывается несовершенной.
Аморфные полимеры плавятся в диапазоне температур, зави сящем не только от их природы, но и от длины цепей; кристалли ческие полимеры имеют точку плавления.
Существует ближний и дальний порядок в расположении структурных звеньев в макромолекуле.
Для полимеров характерно два фазовых состояния: кристаллическое и аморфное.
В кристаллических полимерах существует дальний трехмерный порядок расположения звеньев и сегментов.
Для аморфных полимеров характерен ближний порядок расположения звеньев и сегментов.
Дальний порядок предусматривает определенное упорядоченное расположение звеньев и сегментов на достаточно большом протяжении цепи.
Ближний порядок предусматривает наличие отдельных областей с более или менее упорядоченным расположением отрезков макромолекулы, то есть существует упорядоченность в размещении близко расположенных молекул.
а- кристаллический полимер
в - аморфный полимер
Для характеристики степени упорядоченности структурных элементов в полимере вводится понятие степени кристалличности, которое определяется по формуле:
, где Vк – объем кристаллической фазы; V – общий объем полимера;
Максимальная величина степени кристалличности составляет X = 80 %.
2.6.2. Надмолекулярные структуры.
Под надмолекулярной структурой полимеров понимают различные виды упорядоченности во взаимном расположении макромолекул, то есть способ упаковки макромолекул. Основным элементом кристаллических полимеров является монокристалл.
В полимерных монокристаллах макромолекулы находятся в складчатых конформациях.
При кристаллизации образуется пластина (ламель), построенная из параллельно расположенных участков макромолекул, многократно изогнутых на 180 градусов, при этом оси макромолекул направлены перпендикулярно пластине.
Схема строения пластинчатого монокристалла (L-период складывания).
Пластинчатые монокристаллы образуются при медленной кристаллизации из разбавленных растворов полимеров.
Складывание макромолекул в монокристаллах может быть регулярным и нерегулярным. Поверхностный слой ламели
образует петли, свободные концы макромолекул «реснички», а также проходные цепи, которые участвуют в построении нескольких соседних ламелей. Эти элементы составляют дефектность кристаллической решетки.
Схема соединений ламелей проходными молекулами в однослойном (а) и двухслойном (б) кристалле:
1-петля; 2-«реснички»; 3-проходная молекула;
Для монокристаллов характерны две формы:
- сферолит; 2) фибриллярные кристаллы.
Сферолит представляет собой трехмерное поликристаллическое образование со сферической симметрией относительно центра. Размеры сферолитов колеблются от нескольких микрон до долей миллиметра (иногда до 1 см). Сферолиты бывают радиальные (образованы плоскими ламелями) и кольцевые (образованы спиральными ламелями)


радиальный кольцевой
сферолит сферолит
Вырожденной формой пластинчатых кристаллов являются фибриллярные кристаллы, которые характеризуются большим отношением длины к толщине.
фибриллярные кристаллы
Для гибких аморфных полимеров простейшим типом структур является глобула, состоящая из макромолекулы, свернутой в клубок, которые могут образовывать между собой би-, три- и полимолекулярные глобулы.
 глобулярная структура
глобулярная структура
В структуре аморфного полимера имеются упорядоченные области (домены) складчатого строения и неупорядоченные области (концы цепей, проходные цепи).

упорядоченные области – домены (д); междоменное пространство (мд).
2.6.3. Три физических состояния аморфных полимеров.
Аморфные полимеры могут находиться в трех физических состояниях: стеклообразном, высокоэластическом и вязкотекучем.
1) твердые полимеры, имеющие аморфное или кристаллическое строение, мало изменяют свою форму даже при больших механических нагрузках. После устранения нагрузки они восстанавливают первоначальную форму.
Твердые аморфные полимеры, не успевшие при охлаждении закристаллизоваться, но потерявшие текучесть, называют стеклообразными полимерами.
2) Высокоэластичные полимеры (эластомеры), имеющие в ненапряженном состоянии аморфное строение (каучуки и резины), деформируются под воздействием относительно небольших нагрузок. При нагревании многие твердые полимеры становятся высокоэластичными (полистирол, поливинилхлорид).
3) текучие полимеры, имеющие аморфное строение, необратимо изменяют свою форму под действием незначительных нагрузок (например, низкомолекулярный полиизобутилен, разветвленный фенолформальдегидный полимер - резол).
В зависимости от температуры и условий механического воздействия аморфный полимер способен переходить из одного физического состояния в другое без скачкообразных изменений термодинамических свойств. Во всех трех физических состояниях аморфный полимер является жидкой фазой.
Изучение зависимости механических свойств от температуры или, иначе говоря, получение термомеханической зависимости или термомеханической кривой отвечает не только на вопросы о свойствах полимера при данной температуре, но и дает возможность проанализировать структуру полимера, гибкость его макромолекул. Чем более гибки макромолекулы, тем до более низкой температуры полимер остается эластичным.
Термомеханическую кривую удобно получить в форме зависимости деформируемости полимера от температуры. Вырежем из полимера кубик, измерим его, поместим в термостат при определенной температуре Т и подействуем грузом Р. Пусть время воздействия груза будет, например, 10 секунд. Измерим высоту кубика под грузом и рассчитаем деформацию полимера при температуре Т.
Нагреем образец до температуры Т и снова на 10 секунд нагрузим его тем же грузом Р. Измерим деформацию при более высокой температуре Т. Продолжим эту процедуру далее и получим ряд значений , , , и т.д. при соответствующих температурах Т,Т, Т, Т и т.д. По этим экспериментальным данным можно построить термомеханическую кривую.
Зависимость деформации полимера от температуры при действии на него постоянной нагрузки в течение определенного времени выражается графиком – термомеханической кривой.
Термомеханическая кривая аморфного полимера:
- область стеклообразного состояния;
- переходная область;
III- область высокоэластического состояния, характерная только для полимеров;
IV- область вязкотекучего состояния.
В стеклообразном состоянии происходят колебательные движения атомов и групп атомов около положения равновесия.
В области высокоэластического состояния в полимере происходит вращение сегментов.
В области вязкотекучего состояния происходит перемещение отдельных участков макромолекул, то есть полимер течет.
Выше температуры текучести (Тт) наблюдаются необратимые деформации. В стеклообразном состоянии наблюдаются небольшие обратимые деформации, а в высокоэластическом состоянии наблюдается значительная деформация.
2.6.4. Стеклообразное состояние.
При низкой температуре деформация мала. Она мало увеличивается с температурой. Аморфный полимер ведет себя при низких температурах как стекло. Мы говорим, что полимер находится в стеклообразном состоянии.
Начиная с некоторой температуры, называемой температурой стеклования Тс, деформация начинает увеличиваться и, наконец, достигает несколько десятков, а при снятии кривой в режиме растяжения – и сотен процентов. При дальнейшем нагревании деформация снова мало зависит от температуры, что на кривой выражается наличием протяженного плато. Промежуточная область между температурой стеклования и температурой выхода на плато носит название переходной области. Полимер при этом деформируется «вяло»: он перестал быть жестким стеклообразным телом и не стал еще эластичным, как хорошая резина. Его механическое поведение напоминает поведение при изгибе полоски натуральной кожи или линолеума, которые, будучи изогнутыми, медленно возвращается в исходное положение.
2.6.5. Высокоэластическое состояние.
При температуре выхода на плато полимер переходит в развитое высокоэластическое состояние. Он легко деформируется при действии силы и быстро возвращается в исходное положение после снятие груза. Такая деформация непременно связана с изменением формы макромолекулярных статистических клубков и поэтому называется высокоэластической деформацией, а полимер во всем интервале температур, ограниченном плато на термомеханической кривой, находится в высокоэластическом состоянии.
2.6.5. Вязкотекучее состояние.
Высокоэластическая деформация, величина, которая определятся изменением формы макромолекулярных клубков, мало зависит от температуры. По этой причине рост деформации под действием той же силы и за тот же промежуток времени, как определено выше, может быть обусловлен только развитием нового типа деформации – деформации вязкого течения. Температура, при которой в полимере обнаруживается заметная деформация вязкого течения, приводящего к появлению изгиба на термомеханической кривой, называется температурой текучести. Выше температуры текучести полимер находится в вязкотекучем состоянии.
Влияние молекулярной массы полимера на температуру текучести. На рисунке показано изменение формы термомеханической кривой для полимергомологов с увеличением их молекулярной массы (М1<M2 <M3<M4< M5).
Низкомолекулярные полимергомологи аморфных полимеров могут находиться в двух физических состояниях: стеклообразном и жидком. Их температура стеклования и текучести совпадают.
С повышением молекулярной массы появляется область высокоэластического состояния, которая с повышением молекулярной массы увеличивается. При этом температура стеклования Тс остается постоянной, а температура текучести Тт повышается.
Гибкие высокомолекулярные полимеры характеризуются низкомолекулярными значениями Тс и высокими Тт, т.е широким температурным интервалом эластичности (от -70 оC до 200 оC). Жесткие высокомолекулярные соединения имеют высокую Тс и небольшой интервал эластичности (от 100 оC до 160 оC).
С увеличением полярности полимера Тт увеличивается.
Вязкотекучее состояние важно при переработке полимера. Чем ниже Тт, тем легче перерабатывать полимер, потому что температура переработки оказывается в области сильно развитой текучести. Если Тт<Тпл, после плавления полимер сразу переходит в вязкотекучее состояние; Тт> Тпл> Тс, после плавления полимер переходит в высокоэластическое состояние
2.6.6.Релаксация напряжения.
Образец эластомера быстро деформируют на заданную величину и сохраняют в деформированном состоянии, замеряя зависимость напряжения от времени.
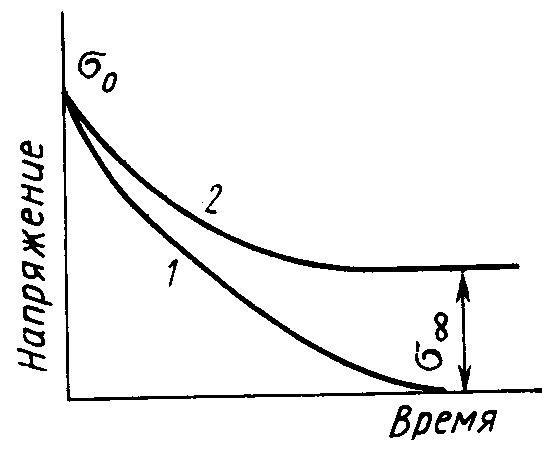
На рисунке представлена релаксация напряжения в линейном (1) и пространственном (2) эластомере.
Из рисунка видно, что со временем в результате перегруппировки звеньев и изменения конформаций макромолекул напряжение в образце уменьшается. Через определенное время клубки макромолекул линейного полимера переходят в прежнее свернутое состояние
(кривая 1). В этот момент напряжение падает до нуля, а структура образца становится такой же, как и до растяжения.
На рисунке представлена зависимость удлинения от времени при действии механического напряжения (пунктиром обозначены часть кривой, соответствующая сокращению образца после прекращения действия силы).
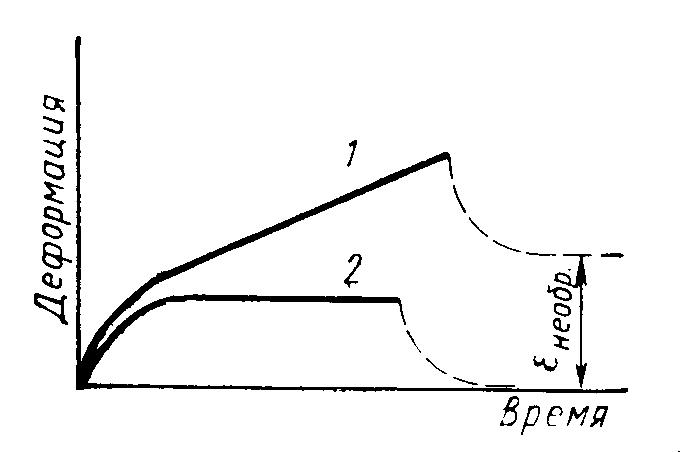
- линейный полимер;
- пространственно-структурированный полимер.
2.7. Растворы полимеров.
2.7.1. Сходство и различие растворов высокомолекулярных соединений и коллоидных растворов.
2.7.2. Признаки растворов.
2.7.3. Особенности процесса растворения полимеров.
2.7.4. Термодинамика растворения полимеров.
2.7.5. Факторы, влияющие на растворение и набухание полимеров.
2.7.6. Уравнение состояния полимера в растворе.
2.7.7. Гидродинамические свойства макромолекул в разбавленных растворах.
2.7.8. Фракционирование полимеров.
2.7.1. Сходство и различие растворов высокомолекулярных соединений и коллоидных растворов.
Растворами называют гомогенную систему, состоящую минимум из двух компонентов:
1) растворяемое вещество; 2) растворитель.
Вначале растворы полимеров рассматривали как коллоидные растворы из-за схожести некоторых свойств (растворы макромолекул соизмеримы с размерами коллоидных частиц, эффект Тиндаля, замедленная диффузия, тиксотропия и др.).
Признаки коллоидных растворов:
- отсутствие сродства между компонентами;
- принудительное образование;
- уменьшение степени дисперсности во времени (коагуляция);
- термодинамическая неустойчивость;
- агрегативная неустойчивость.
Сходство растворов высокомолекулярных соединений и коллоидных растворов:
1. Величина частиц (от 1 до 100 нм);
2. Наличие двух факторов устойчивости: заряда и водной оболочки;
3. Явление опалесценции;
4. Способность к коагуляции;
5. Способность к диализу;
6. Медленная диффузия;
7. Способность к седиментации;
8. Низкое осмотическое давление.
Отличие растворов высокомолекулярных соединений от коллоидных растворов:
1. В растворах высокомолекулярных соединений частицы- молекулы высокомолекулярных соединений, а не мицеллы;
2. У частиц высокомолекулярных соединений в растворах иной механизм возникновения заряда: диссоциация собственных ионогенных групп, а не адсорбция из растворов потенциально - определяющих ионов, добавленных в избытке.
3. У частиц гидрофильных высокомолекулярных соединений иной механизм образования водной оболочки: наряду с зарядом частицы водная оболочка образуется за счет гидрофильных групп, расположенных на поверхности частицы.
4. Растворы высокомолекулярных соединений более устойчивы (G 0).
5. Растворы высокомолекулярных соединений образуются самостоятельно (не нужен «стабилизатор»).
6. Растворы высокомолекулярных соединений обратимы.
В.А. Каргин доказал, что растворы полимеров не относятся к золям и являются истинными растворами.
2.7.2. Признаки растворов.
Истинные растворы являются молекулярно-дисперсными системами и в отличие от коллоидных золей удовлетворяют основным критериям истинных растворов:
- Наличие сродства между компонентами;
- Самопроизвольность образования;(G=H-TS<0);
- Термодинамическая устойчивость (подчиняется правилу фаз Гиббса).
- Равновесность;
- Обратимость;
- Однофазность;
- Гомогенность;
- Агрегативная устойчивость;
- Увеличение степени дисперсности во времени;
- Молекулярная и ионная дисперсность.
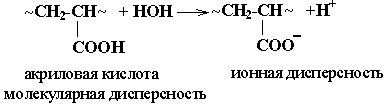
- Постоянство концентрации во времени.
Специфические свойства растворов высокомолекулярных соединений:
1.Способность к набуханию;
2.Способность к желатинированию
3.Наличие аномальной вязкости;
4.Свободное вращение отдельных звеньев полимеров с изменением конформации.
Истинные растворы полимеров не подчиняются (отклоняются) от различных законов растворов, что связано с большой разницей между молекулярной массой полимера и растворителя.
2.7.3. Особенности процесса растворения полимеров.
Первой стадией растворения полимера является его набухание. При соприкосновении полимера с низкомолекулярной жидкостью, молекулы жидкости начинают быстро проникать в фазу полимера. Поэтому прежде чем раствориться, полимер набухает.
Набухание- это процесс поглощения низкомолекулярного вещества полимером, сопровождающееся увеличением его массы, объема, изменением структуры, конформации его макромолекул. Набухший полимер представляет собой раствор низкомолекулярной жидкости в полимере.
Если процесс растворения самопроизвольно прекращается на стадии набухания, то говорят об ограниченном набухании. Сшитые полимеры не могут полностью раствориться без разрыва химических связей. Они ограниченно набухают, образуя гели.
Состояние набухания характеризуется степенью набухания (), которая определяется как количество поглощенной полимером жидкости, отнесенное к единице массы или объема полимера:
= = , где
mо, Vо – масса и объем исходного полимера;
m, V – масса и объем набухшего полимера.
2.7.4. Термодинамика растворения полимеров.
Растворы полимеров представляют собой гомогенные термодинамически устойчивые системы. Процесс растворения полимеров происходит с уменьшением изобарно-изотермического потенциала (G): G=H-TS,
где S- энтропия;
H – энтальпия.
Для того, чтобы произошло самопроизвольное растворение, G должен быть отрицательным (G<0). Это возможно в следующих случаях:
1. H<0 и S>0, т.е. растворение сопровождается выделением тепла и возрастанием энтропии, что происходит при растворении жесткоцепных полимеров (например, растворение полиметилметакрилата).
2. H<0 и S<0, но при условии | H |> |T .S|, т.е. растворение происходит самопроизвольно, реакция экзотермическая (с выделением тепла), и сопровождается с уменьшением энтропии, что наблюдается при растворении полярных полимеров в полярных растворителях (например, растворение полиакриловой кислоты, поливинилового спирта, полиакриламида в воде.
3. H >0 и S>0, но при условии | H | < |T .S|, т.е. растворение является эндотермическим (с поглощением тепла) и сопровождается увеличением энтропии, что соответствует самопроизвольному растворению гибкоцепных малополярных полимеров в неполярных жидкостях (например, растворение полибутадиена, полиизопрена в бензоле).
4. H = 0 и S>0, т.е. растворение атермическое, сопровождается увеличением энтропии раствора, что наблюдается при растворении, например, поливинилацетата в этилацетате, полиизобутилена в изооктане.
Растворением называется самопроизвольный процесс образования термодинамически устойчивой гомогенной системы.
2.7.5. Факторы, влияющие на растворение и набухание полимеров.
На процесс растворения и набухания оказывают влияние следующие факторы:
- Природа полимера и растворителя.
Полярные полимеры растворяются в полярных растворителях, неполярные полимеры в неполярных растворителях, т.е. подобное растворяется в подобном.
2) Молекулярная масса полимера.
Чем больше молекулярная масса полимера, тем хуже растворимость.
- Гибкость макромолекулы.
Гибкие полимеры растворяются легче и быстрее.
- Степень упаковки макромолекулы.
Чем выше степень упаковки макромолекулы (чем плотнее упаковка полимера), тем
труднее растворяется полимер.
5) Фазовое состояние.
Аморфные полимеры растворяются лучше и быстрее, чем кристаллические полимеры.
- Степень поперечых швов.
Сшитые полимеры не растворяются, а только набухают.
2.7.6. Уравнение состояния полимера в растворе.
Уравнением состояния называется уравнение, связывающее давление, объем, температуру, концентрацию и другие параметры системы, находящейся в равновесии. В общем виде это уравнение можно записать так: f (P, T,V …) = 0. Уравнение состояния для растворов полимера связывает осмотическое давление с температурой, концентрацией раствора. Закон Вант-Гоффа для низкомолекулярных соединений:
Р = с . R . Т, где
Р- осмотическое давление;
с- концентрация раствора;
R- универсальная газовая постоянная;
Т- температура.
Осмотическое давление низкомолекулярных соединений прямо пропорциональна концентрации растворенного вещества. Для растворов полимеров закон Вант-Гоффа не подходит.
Для растворов полимеров подходит следующее уравнение Вандер-Ваальса:
, где
А1, А2, А3 , Аn – вириальные коэффициенты.
А1= , где М- молекулярная масса полимера;
А2 – учитывает отклонения полимера от идеального поведения. Коэффициент А2 определяется по тангенсу угла наклона зависимости приведенного осмотического давления () от концентрации раствора (с). А2 = tg a.
1 - в хорошем растворителе А2 > 0;
2 - в Q- растворителе А2 < 0
3 – в плохом растворителе А2 < 0
Таким образом, чем больше (), тем больше А2. Вериальный коэффициент А2 является мерой термодинамического сродства растворителя к полимеру.
А2 = ,
где 1- плотность растворителя; 2 – плотность полимера; М1 – молекулярная масса растворителя; К – параметр Флори Хаггинса, т.е. параметр взаимодействия полимера с растворителем. Эта мера качества растворителя.
Если А2 = 0 для низкомолекулярных
К = 0 веществ;
Если А2 > 0 для высокомолекулярных
К < 0,5 веществ;
Если А2 = 0 идеальный
К = 0,5 растворитель;
Если А2 > 0 хороший
К < 0,5 растворитель;
Если А2 < 0 плохой
К > 0,5 растворитель.
2.7.7. Гидродинамические свойства макромолекул в разбавленных растворах.
Метод вискозиметрии позволяет получить такие характеристики макромолекул, как молекулярная масса, размеры, коэффициент набухания макромолекулярного клубка, степень полдисперсности макромолекул. Вязкость (внутреннее трение жидкости) обусловлена взаимодействием молекул жидкости и проявляется при ее течении.
Вязкость полимеров определяют прибором, который называется вискозиметром.
При исследовании разбавленных растворов полимеров определяют не абсолютную, а относительную вязкость отн, т.е. отношение вязкости растворов полимера к вязкости чистого растворителя о, которое при условии, что плотности разбавленного раствора и чистого растворителя совпадают, равно отн = /о = /о, где и о время истечения раствора и чистого растворителя.
Удельная вязкость уд = -о/о показывает относительный прирост вязкости вследствие введения в растворитель полимера;
Приведенная вязкость раствора пр=уд./с
lim уд./с при с 0, называется характеристической вязкостью [] .
Характеристическая вязкость полимера зависит от размеров макромолекулы в растворе, от природы растворителя и температуры раствора.
[] =К. - уравнение Марка-Куна-Хаувинка, где
- константа, связанная с конформацией макромолекулы в растворе.
Молекулярная масса полимера, определенная по уравнению Марка-Куна-Хаувинка, является средневязкостной М.
Для гибких макромолекул в хороших растворителях а = 0,6-0,8 ;
Для жестких макромолекул = 1,0-1,5;
Для палочкообразных частиц = 2,0 .
Таким образом, «» изменяется в пределах 0 2,0.
Константы К и находят, представив уравнение Марка-Куна-Хаувинка в логарифмической форме:
lg[ ] = lg К+ lg M
Молекулярные масс серии узких фракций полимера определяют с помощью какого- либо абсолютного метода (осмометрии, светорассеяния и др.). Из прямолинейной зависимости lg[ ] от lg M находят К и .
Зависимость приведенной вязкости от концентрации раствора полимера описывается уравнением Хаггинса:
уд./с = [ ] + К’. [ ] . c, где
К’ – константа Хаггинса, характеризующая взаимодействие макромолекул в данном растворителе. В хороших растворителях К/= 0,2-0,3, а в плохих К/ 0,5;
2.7.8. Фракционирование полимеров.
Фракционирование полимеров – деление полимеров на фракции с различной молекулярной массой. Существует 4 способа фракционирования:
1. Метод дробного растворения. Метод состоит в последовательном экстрагировании полимера рядом жидкостей, растворяющая способность которых по отношению к данному полимеру последовательно возрастает. Растворившуюся часть полимера отделяют. Снова добавляют растворитель. Количество растворителя постоянно увеличивают и так до полного растворения полимера. Получаемые фракции обладают последовательно возрастающими молекулярными массами М1<М2<М3<М4 < . . . Мi
Затем определяем молекулярную массу фракций.
2. Метод дробного осаждения. Метод состоит в последовательном осаждении из раствора полимера ряда фракций, молекулярные массы которых монотонно убывают М1>М2 >М3 >М4 >. . . Мi . Полимер растворяют, затем в раствор полимера вводят осадитель (т. е. растворитель, в котором полимер не растворяется) и полимер выпадает в осадок. Осадок отделяют и заново добавляют осадитель. Определяют молекулярную массу фракции.
3. Метод ультрацентрифугирования. Большая скорость дает равномерное разделение полимера по молекулярной массе. Вначале оседают наиболее высокомолекулярные фракции. Метод относительно сложен и требует дорогостоящего оборудования.
4. Метод гель-проникающей хроматографии. Этот метод относится к аналитическим методам. Фракционирование этим методом основано на применении принципа молекулярного сита, т.е. разделение молекул происходит только по размерам и не зависит от химической природы компонентов. Через колонку, заполненную частицами пористого полимерного геля в растворителе, пропускают раствор полидисперсного полимера. Частицы геля содержат открытые поры разных размеров. Относительно небольшие макромолекулы диффундируют через поры внутрь частиц геля, и те полимеры, которые имеют молекулярную массу до 2000, остаются в адсорбенте, а с молекулярной массой М > 2000, проходят. Затем добавляют в колонку растворитель, чтобы смыть полимеры, которые вошли в поры адсорбента. Метод применяется для фракционирования сополимеров и полимерных веществ биологического происхождения (белков, нуклеиновых кислот и др.)
2.8. Основные представители полимеров.
2.8.1.Карбоцепные полимеры. Непредельные углеводороды.
2.8.2.Галогенпроизводные представители углеводородов.
2.8.3. Ароматические углеводороды.
2.8.4. Сложные полиэфиры. Полиэтилентерефталат (лавсан).
2.8.5. Синтетические полиамиды.
2.8.6. Полиуретаны.
2.8.1.Карбоцепные полимеры. Непредельные углеводороды.
Полиэтилен.
n CH2 = CH2 [CH2 CH2]n
этилен полиэтилен
Полиэтилен получают методом радикальной полимеризации под давлением 1000 атмосфер и температуре 100-3000 С, или методом ионной полимеризации при небольшом или атмосферном давлении. Макромолекулы полиэтилена высокого давления не строго линейны, а содержат боковые ответвления.
По методу Циглера – Натта полимеризацию этилена проводят при атмосферном давлении и обычной температуре в присутствии триэтилалюминия (Al(C2H5)3) и четырех хлористого титана (TiCl4) в среде бензина. При этом образуется полиэтилен строго линейного строения с большой плотностью и высокой кристалличностью и температурой плавления, чем полиэтилен, полученный при высоком давлении.
При комнатной температуре полиэтилен не растворим ни в одном из растворителей. При температуре более 800 С начинает растворяться в CCl4, бензоле, толуоле, но при охлаждении полимер выпадает из раствора.
Полиэтилен обладает химической стойкостью, водостойкостью, имеет высокие физико-механические и диэлектрические показатели. Полиэтилен применяется в качестве электроизоляционного материала, в радиотехнике, в качестве антикоррозионных покрытий, в химической промышленности, используется для производства упаковочной пленки, посуды, а также для пропитки ткани, бумаги, древесины.
Полипропилен.
n CH2 = CH [CH2 CH]n
| |
CH3 CH3
пропилен полипропилен
Полипропилен стереорегулярный, высокомолекулярный полимер.
Полипропилен получают в присутствии катализаторов (Al(C2H5)3 и TiCl4). В результате образуется твердый кристаллический продукт. Полипропилен имеет молекулярную массу от 60 тыс. до 200 тыс., температуру плавления 1700С, обладает высокими физико-механическими свойствами, стоек к действию кислот, оснований и масел. При обычной температуре он ни в чем не растворяется, а при температуре более 800С растворяется в бензоле, толуоле и CCl4.
Полипропилен применяется для производства упаковочной пленки, посуды, электроизоляционных покрытий, труб, а также больших емкостей, аккумуляторных баков, деталей холодильников и радиоприемников. Волокно из полипропилена превосходит все известные природные и синтетические волокна по прочности и свойствам.
Полистирол.
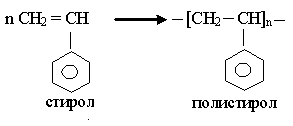
Полистирол получают радикальной полимеризацией стирола блочным или эмульсионным методами с перекисным инициатором.
Технический полистирол имеет молекулярный вес 70 тыс. – 200 тыс., получены полимеры с молекулярным весом около 6 млн. Температура стеклования полистирола 800С, плотность 1,05-1,07 г/см3. Полистирол растворим в ароматических углеводородах, устойчив к действию спиртов, воды, кислот и щелочей; является прекрасным диэлектриком, но имеет относительно низкую механическую прочность и термостойкость (при нагревании на воздухе начинает разлагаться при температуре 1500С, в отсутствии кислорода устойчив до 2500С).
Изотактический полистирол кристаллизуется, имеет температуру плавления 2300С, повышенную плотность (1,1 г/см3) и значительно более высокие физико-механические показатели, чем обычный полистирол.
Полистирол применяется, главным образом, как электроизоляционный материал, особенно на установках токов высокой частоты, в радиотехнике и телевидении, и для изготовления пенопластов (легкая газонаполненная пластическая масса). Сополимеры стирола с бутадиеном применяются в промышленности синтетического каучука.
Поливиниловый спирт.
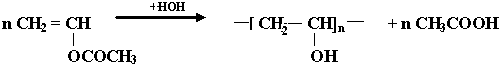
винилацетат поливиниловый спирт
Поливиниловый спирт получают кислотным или щелочным омылением поливинилацетата; растворяется в воде, в растворах щелочей, образуя вязкие растворы, из которых формуют волокно и пленки. Поливиниловый спирт применяется для производства волокон в пищевой и фармацевтической промышленности, для производства гибких труб, стойких к действию масел и бензола.
Поливинилацетат.
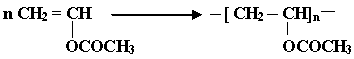
винилацетат поливинилацетат
Поливинилацетат имеет молекулярную массу 50 тыс., разлагается при температуре 1500 С, растворяется в спиртах.
Применяется в основном для переработки в поливиниловый спирт, в композиции с другими полимерами применяется для изготовления лаков и клеев.
Полиакриловая и полиметакриловая кислота.
Полиакриловая и полиметакриловая кислоты растворимы в воде, используются для сополимеризации с другими виниловыми и диеновыми мономерами.
Полиметилметакрилат.
метилметакрилат полиметилметакрилат
Полиметилметакрилат имеет молекулярную массу 50 – 200 тыс., растворяется в ацетоне, CCl4; используется для производства органического стекла.
Другие акрилаты и метакрилаты применяются для производства лаков, пленок, гибких шлангов и для отделки тканей.
Полиакрилонитрил.
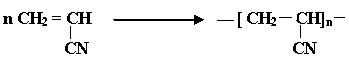
акрилонитрил полиакрилонитрил
Полиакрилонитрил получают радикальной полимеризацией, имеет молекулярную массу 70 тыс., температуру разложения 2200 С., растворяется в диметилформамиде; обладает хорошей термостойкостью, высокими физико-механическими свойствами.
По светостойкости превосходит почти все известные полимеры, используется для производства волокон и пластмасс. Широко применяются сополимеры полиакрилонитрила с винилхлоридом и винилацетатом.
2.8.2. Галогенпроизводные представители углеводородов.
Поливинилхлорид.
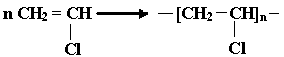
винилхлорид поливинилхлорид
Поливинилхлорид получают эмульсионной или суспензионной полимеризацией винилхлорида с перекисными инициаторами.
Молекулярная масса 30 тыс.; поливинилхлорид не кристаллизуется, разлагается при температуре 130-1500С, растворим в кетонах, в CCl4, а в воде и предельных углеводородах не растворим; стоек к кислотам, щелочам при температуре 200С.
Поливинилхлорид применяется для производства листовых и плиточных материалов, покрытий, кабельной изоляции, для изготовления труб и деталей аппаратуры, ограниченно для производства волокон.
Практическое применение имеют сополимеры винилхлорида, винилацетата, акрилонитрила, винилиденхлорида.
Поливинилиденхлорид.
винилиденхлорид поливинилиденхлорид
Поливинилиденхлорид получают радикальной полимеризацией в эмульсии. Он не растворяется ни в одном из растворителей; применяется для производства волокна, широкое применение находят его сополимеры.
Политетрафторэтилен.
n F2C = CF2 [CF2 CF2]n
Политетрафторэтилен получают радикальной полимеризацией в присутствии перекиси в эмульсии. Он ни в чем не растворяется, имеет необычно высокую химическую стойкость к концентрированным кислотам, щелочам, органическим растворителям, является хорошим диэлектриком. Политетрафторэтилен применяется для изготовления электрических и радиотехнических изделий, химически стойких труб, насосов, для производства волокон, обладает термостойкостью, температура плавления 320-3270 С.
2.8.3. Ароматические углеводороды.
Полифенилен.
Полифенилен получают поликонденсацией парадибромбензола в присутствии в качестве катализатора меди при температуре 2500С.
Полифенилен вследствие большой жесткости не растворим, а наличие сопряженных связей обуславливает высокую термостойкость (> 5000 С).
Фенолформальдегидные смолы.
Фенолформальдегидные смолы получают конденсацией фенола с формальдегидом, который сначала присоединяется к фенолу с образованием метилопроизводных. Поликонденсация метилопроизводных протекает с отщеплением воды. При соотношении фенола и формальдегида 7:6 в присутствии кислого катализатора образуется линейный полимер с молекулярным весом 1300, называемый новолаком.
Новолаки применяют для производства лаков и прессовочных порошков.
При действии формальдегида на поли--метиленоксифенилен или при поликонденсации фенола с избытком формальдегида получаются разветвленные полимеры – резолы:
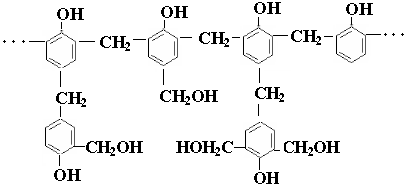
или пространственные полимеры – резиты:
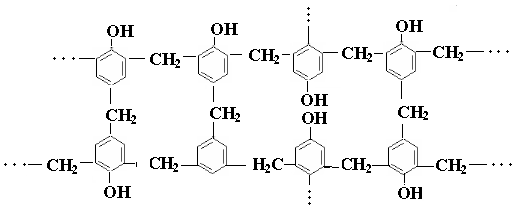
При хранении или при нагревании резолы легко переходят в резиты с соответствующим изменением свойств полимера. Резолы применяются при производстве пластмасс в смеси с наполнителями для формования различных изделий, а также для изготовления слоистых пластиков из ткани или бумаги, пропитанной резолом. В процессе производства резолы превращаются в резиты, и полученные изделия применяются в электротехнике, в машиностроении и для других целей.
2.8.4. Сложные полиэфиры. Полиэтилентерефталат (лавсан).
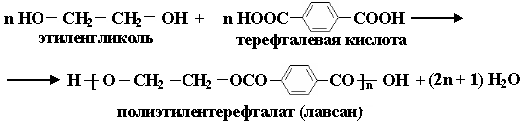
Полиэтилентерефталат плавится при температуре 2640С; обладает влаго- и светостойкостью и очень высокой термостойкостью; стоек по отношению к кислороду и щелочам.
Применяется для производства синтетического волокна – лавсан и пластмасс.
2.8.5. Синтетические полиамиды.
Молекулярная масса колеблется от 11 тыс. до 22 тыс.
Синтетические полиамиды отличаются высокими физико-механическим свойствами; используются для производства волокон, пластмасс; растворимы в феноле, муравьиной кислоте, концентрированной соляной и серной кислотах , температура плавления больше, чем у полиэтилена.
Поли- – капроамид (капрон).
Поли--капроамид получают полимеризацией -капролактама в присутствии воды в качестве активатора.
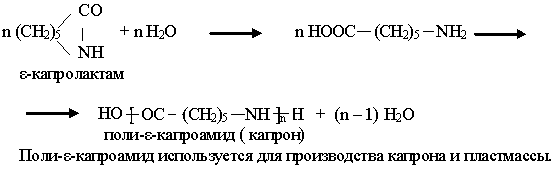
Полигексаметиленадипамид (нейлон, анид).
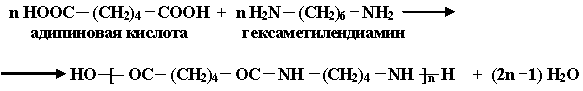
Температура плавления 2550 С.
Полипирамилитимид.
Полипирамилитимид получают дегидратацией полиамидной кислоты, которая синтезируется поликонденсацией в растворе диангидрида пирамилитовой кислоты и диамина.
Полиимид обладает механическими и диэлектрическими свойствами, стойкостью к окислению, радиации, действию растворителей
Полиимиды не изменяют своих диэлектрических и механических свойств при температуре 3000С в течении года.
При нагревании на воздухе они стойки до температуры 4200 С. Полиимиды используют для формования пленок и волокон.
2.8.6. Полиуретаны.
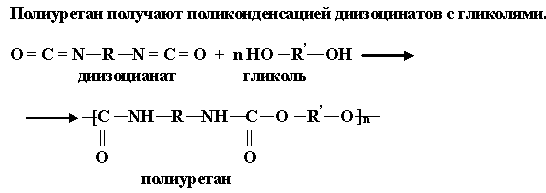
Линейные полиуретаны растворяются в концентрированных минеральных кислотах; менее гигроскопичны, чем полиамиды; используются для производства подошвы для обуви.
Учебно-методическое обеспечение дисциплины.
Список рекомендуемой литературы.
Основная литература
1. Стрепихеев А.А.,Деревицкая В.А. “Основы химии высокомолекулярных соединений”, М.: Химия,1976.
Дополнительная литература
2. Кулезнев В.Н. “ Основы физики и химии полимеров”, М.: Высшая школа, 1988.
3. Шур А.М « Высокомолекулярные соединения», М.: Высшая школа, 1981.
4. Догадкин Б.А.,Донцов А.А., Шершнев В.А. “Химия эластомеров”,М.:Химия, 1981.
5. Роговин З.А. ” Основы химии в технологии химических волокон”,М.: Химия, 1974.
6. Оудиан Дж. «Основы химии полимеров»,М.: Мир, 1974.
Физика и химия высокомолекулярных соединений