Врожденные пороки сердца
Оглавление:
1. Введение
2.1 Развитие сердца плода
2.2 Кровообращение плода
2.3 Кровообращение у новорожденного
3. Врожденные пороки сердца
3.1 Этиология ВПС
3.2 Классификация
3.3 Клиника
3.4 Диагностика
3.4.1 УЗИ признаки пороков сердца новорожденного
3.5 Лечение
3.6 Осложнения ВПС
3.7 Прогноз
4. Наиболее часто встречающиеся ВПС
5. Список литературы
1. Введение
Врожденные пороки сердца представляют собой весьма обширную и разнородную группу заболеваний, в которую входят как относительно легкие формы, так и состояния, несовместимые с жизнью ребенка. ВПС образуются вследствие нарушений процессов эмбриогенеза сердца или задержки его нормального формирования в постнатальном периоде.
Врождённый порок сердца (ВПС) — дефект в структуре сердца и крупных сосудов. Большинство пороков нарушают ток крови внутри сердца или по большому (БКК) и малому (МКК) кругам кровообращения. ВПС составляют 30% всех врожденных пороков развития и и занимают третье место после аномалии опорно-двигательного аппарата и ЦНС, однако в структуре смертности, связанной с пороками развития, они находятся на первом месте. Среди всех заболеваний сердца они составляют 1-2%. Рождаемость детей с врожденными аномалиями сердечно-сосудистой системы колеблется от 0,7 до 1,7%, и за последние годы отмечена выраженная тенденция к увеличению их числа. В нашей стране ежегодно рождается 35000 детей с врожденными пороками сердца, в США - 30000. Основная масса детей погибает в течении первого года жизни (до 70-90%), а из них в течении первого месяца. После первого года жизни смертность резко снижается, и в период от 1 года до 15 лет погибают не более 5% детей.
Увеличение количества патологии связано с множеством причин, в число которых входит и улучшение выявляемости врожденных пороков развития.
Необходимость снижения материнской и неонатальной смертности способствовала созданию в Англии в 1901 году дородовой помощи, и за годы накопления опыта было выделено понятие пренатальной медицины, объединяющей опыт акушеров и неонатологов.
Причины патологии сердечно-сосудистой системы следует оценивать, опираясь на этапы формирования сердца.
2.1 Развитие сердца плода
Закладка сердца начинается у эмбриона на 2-3-й неделе развития. Сердце первоначально представляет собой две парные трубки, расположенные в шейной части зародыша. По мере обособления тела зародыша от внезародышевых частей парные трубки сближаются и смещаются медиально в грудную полость.

На 3-ей неделе развития сердечная трубка устроена следующим образом: имеется два конца- артериальный ствол и венозный синус. В середине расположены ближе к артериальному стволу первичный общий желудочек, а к венозному синусу - первичное общее предсердие. Между ними существует узкий предсердно-желудочковый канал и перегородка.
Артериальный ствол имеет шесть аортальных дуг. В венозный синус впадают: две кардинальные вены, несущие кровь из тела эмбриона, пупочные вены, по которым кровь поступает от ворсинчатой оболочки плаценты, желточные вены, через которые кровь поступает от желточного пузыря.
На 4-5-й неделе появляются на месте перегородки между общим желудочком и общим предсердием глубокая перетяжка с узким и коротким предсердно-желудочковым каналом, где к этому моменту уже имеется закладка клапанного аппарата. Это стадия двухкамерного сердца и в это время существует только большой круг кровообращения.
На 5-й неделе утолщается перетяжка между желудочком и предсердием и формируются предсердно-желудочковые отверстия. Формируется также межжелудочковая перегородка и ее соединение с артериальным стволом. В последнем образуется перегородка.
Между предсердиями образуется также перегородка с овальным окном. Левая кардинальная вена дает начало венозному синусу, правая - верхней полой вене.
Таким образом, к 6-й неделе беременности сердце становится четырехкамерным с наличием атриовентрикулярных клапанов и имеется разделение артериального ствола на аорту и легочную артерию.
С аортальными дугами происходит следующая трансформация: первая и вторая редуцируются, третья становится внутренними сонными артериями, четвертая делится на левую, из которой формируется дуга аорты и правая часть, дающая начало безымянной и правой подключичной артерии, пятая редуцируется, шестая делится аналогично четвертой на две части, из одной формируется легочная артерия, из второй – артериальный проток.
2.2 Кровообращение плода
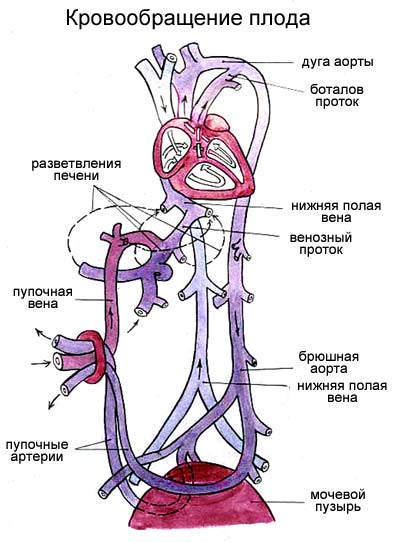
Для плода основные функции дыхания, пищеварения и удаления отработанных веществ выполняются матерью. В период этого паразитарного существования система кровообращения плода выполняет транспортную функцию и при этом она должна быть готова приспособиться к независимому существованию сразу же после рождения. У плода легкие находятся в спавшемся состоянии и не выполняют дыхательной функции.
Общая дифференцировка всех систем легкого заканчивается от 6 до 8,5 месяцев внутриутробной жизни.
Начиная с периода сформированных предсердий и венозного синуса, примитивное сердце активно качает кровь через развивающуюся систему кровообращения. Во время сердечных сокращений перистальтического типа ретроградный ток крови предупреждается выбуханиями эндотелиальной ткани, которая выступает в просвет в месте соединения примитивных предсердий и желудочков. При каждом сокращении эти эндо-телиальные подушки приближаются друг к другу, блокируя конус, тем самым на ранней стадии развития формируются простые, но весьма эффективные атриовентрикулярные клапаны.
На протяжении беременности кровообращение плода из примитивной формы претерпевает значительные изменения.
Ангиографическое исследование системы кровообращения плодов с экстракардиальной патологией развития было проведено в 1949 году Lind J. Wegelius С.
Кровь из плаценты течет через пупочную вену и входит в венозный проток и сосудистую сеть печени. Из пупочной вены кровь поступает в брюшную полость плода через аранциев проток. От нескольких ветвей аранциева протока кровь также поступает в печень плода, это практически чистая артериальная кровь.
Аранциев проток впадает в нижнюю полую вену. Туда же поступает и смешанная артериальная кровь из пупочной вены и кровь от нижней части туловища плода. После этого по сосудам плода циркулирует артериовенозная кровь. Из нижней полой вены через евстахиеву заслонку кровь направляется через овальное окно в левое предсердие и далее в левый желудочек и аорту. Из верхней полой вены чисто венозная кровь поступает в правый желудочек и легочную артерию. Антенатально поток через легочную артерию составляет всего лишь 12 % кровотока. Основной объем через открытый артериальный проток поступает в нисходящую часть аорты. При поступлении в правое предсердие поток крови разделяется на два потока: основная масса крови поступает в левое предсердие через овальное отверстие, а меньшая ее часть плюс кровь из верхней полой вены и коронарного синуса поступает в правый желудочек. Согласно данным Windie W.F. и BeckerRJ., кровь из нижней полой вены проходит через овальное окно, тогда как кровь из верхней полой вены устремляется через правое атриовентрикулярное сообщение в правый желудочек. Оба потока практически не смешиваются.
Более поздние исследования радиоизотопным методом обнаружили, что 1/4 часть крови из полых вен все-таки смешивается в правом предсердии. Таким образом, ни одна из тканей плода, за исключением печени, не снабжается кровью, насыщенной более 60-65%.
Кровь из правого желудочка также делится на два потока: большой объем крови поступает в артериальный проток и далее в аорту, а меньший объем проходит через легкие. Функцию легких у плода выполняет плацента, из которой пупочная вена доставляет к печени плода кровь, на 80% насыщенную кислородом.
Овальное окно и боталлов проток действуют как обходные шунты, позволяющие крови из полых вен, минуя легкие, поступать в систему большого круга кровообращения.
Особенностью кровообращения плода являются условия, при которых, несмотря на наличие значительно уменьшенного легочного кровотока, работа двух желудочков сохраняется одинаковой. Таким образом, баланс правых и левых отделов сердца поддерживается на протяжении внутриутробной жизни.
По мере развития легких - это период от 24 до 38 недель беременности - объем крови через боталлов проток уменьшается.
Минутный объем большого круга кровообращения складывается из венозно-артериального объема крови через овальное окно и потока из легочной артерии в аорту на уровне боталлова протока.
Внутриутробно сердце плода функционирует как насос и как распределитель венозных и артериальных потоков.
Следует отметить, что правая и левая половины сердца соединяются параллельно, а не последовательно, как у взрослых, и поэтому одинаковое количество крови в обеих половинах сердца не имеет большого значения. Было показано, что левый желудочек у плода изгоняет на 20% крови меньше, чем правый.
Основная особенность деятельности сердца плода состоит в том, что оба желудочка нагнетают кровь в аорту, т.е. в большой круг кровообращения.
Маленькое сердце плода позволяет обеспечить ткани и органы количеством крови, превышающим в два-три раза кровоток взрослого человека.
Высокий метаболизм плода (зародыша) предполагает начало пульсации сердца к концу третьей недели, на 22 день зачатия после образования трубчатого сердца. Вначале эти сокращения слабые и неритмичные. Начиная с шестой недели, можно при помощи ультразвука зарегистрировать сокращения сердца, они становятся более ритмичными и составляют в шесть недель 110 ударов в минуту, в 7-8 недель - 180-190 ударов в минуту, на 12-13 неделе- 150-160 сокращений в минуту.
Заслуживают внимания полученные при допплеркардиографии изменения показателей скорости кровотока через аортальные и легочные клапаны. Результаты исследований отмечают, что к концу беременности прирост скорости кровотока через аортальное кольцо превышает аналогичный показатель через клапаны легочной артерии. Объемная скорость кровотока, равная в 28 недель всего лишь 210 мл/мин, в 40 недель равна 614 мл/мин. Таким образом, эти показатели снижения величины общепериферического сопротивления свидетельствуют о подготовке кровообращения плода к постнатальному гемодинамическому режиму.
2.3 Кровообращение у новорожденного
Кровообращение новорожденного значительно отличается от кровообращения плода. Переход к внеутробному кровообращению сопровождается прекращением плацентарного кровотока, установлением легочного кровообращения и закрытием фетальных коммуникаций. Эти изменения происходят постепенно и неонатальный период имеет переходный период, т.е. от внутриутробного до кровообращения взрослого типа. С первым вдохом новорожденного легочный кровоток возрастает с 12% в 5-6 раз. В результате вентиляции легких, повышения парциального напряжения кислорода и понижения парциального напряжения углекислоты происходит уменьшение легочно-сосудистого сопротивления до 1/5 от первоначальной величины.
Увеличение сердечного выброса и снижение легочно-сосудистого сопротивления снижают давление в легочной артерии. Однако это происходит не ранее, чем через 3-12 часов после рождения. Непосредственное измерение величины систолического давления в легочной артерии, проведенное у новорожденных от 6 до 720 минут жизни показало, что первоначально давление в легочной артерии превышает величину аортального систолического давления на 10-12 мм рт.ст. Через 3-12 часов оно снижается, его величина становится ниже показателя давления в аорте, но тем не менее систолическое легочное давление остается высоким и составляет 60-85% от системного. Уменьшение величины систолического легочного давления происходит в течение первых 5-7 суток жизни, а нормализация происходит в сроки до 14 дней после рождения.
Снижение давления в легочной артерии является результатом морфологической перестройки легочных сосудов (расширение альвеол, регресс гипертрофированного мышечного слоя арте-риол и мелких легочных артерий). Процесс этот медленный, и инволюция легочных сосудов заканчивается ко 2-3-му месяцу жизни.
Поддержанию высоких цифр легочно-сосудистого давления способствуют некоторые факторы:
- спазм легочных сосудов в результате гипоксии и ацидоза, возникших в родах;
- сохранение внутриутробного строения мелких легочных сосудов и артерий;
- возросший легочный кровоток в результате вентиляции легких,
- наличие артериально-венозного сброса крови через фетальные коммуникации.
Прекращение плацентарного кровообращения оказывает влияние на общепериферическое сопротивление. Однако в первые часы жизни падает артериальное давление, больше диастолическое, и расценивается это как воздействие вазомоторного центра в результате асфиксии при родах. Повышение и нормализация артериального давления происходит в первую неделю жизни. В норме показатели артериального давления у новорожденных составляют в первые часы жизни: систолическое -65-80 и диастолическое - 35-40 мм рт.ст. В конце первой недели жизни оно равно в систолу 70-80 и в диастолу 40-45 мм рт.ст.
После перевязки пуповины давление в нижней полой вене падает, что обусловлено прекращением венозного возврата из плаценты. С началом дыхания и уменьшением давления и сопротивления в легочных сосудах повышается величина давления в левом предсердии и между предсердиями исчезает градиент давления, имеющийся антенатально. Эти изменения приводят к тому, что клапанный лоскут отверстия (cristadividens) приближается к краю межпредсердной перегородки. Функциональное закрытие осуществляется за несколько часов. При малейшей нагрузке, способствующей повышению давления в правом предсердии (крик, плач, кормление), овальное окно начинает функционировать.
Клинически, по данным Nadas A.S.,, у 50% детей до года овальное окно продолжает функционировать. Анатомическое закрытие наступает к 1-2 годам жизни.
Следует отметить, что после отделения плода от плаценты прекращается не только "венозный возврат" насыщенной кислородом крови через пупочную вену, но и снабжение пупочной вены кислородом. Это и вызывает ее сужение. И в этом случае анатомическая облитерация продолжается несколько месяцев.
Этот период изменчивой гемодинамики в зависимости от состояния новорожденного относят к периоду неустойчивого транзиторного, или персистирующего кровообращения.
Артериальный проток оказывает существенное воздействие на неустойчивость данного периода. Высокое насыщение крови кислородом после включения легочного дыхания вызывает спазм протока. Срок его функционального закрытия наступает через 10-15 часов после рождения. Полная анатомическая облитерация протока наблюдается к концу двух-трех месяцев жизни, абсолютная же его облитерация в 90% случаев к году жизни. Множество факторов воздействует как на закрытие, так и на его функцию в раннем неонатальном периоде. Отмечено, что у недоношенных детей чем меньше масса тела, тем длительнее период функционирования артериального протока. Диагностика функционирующего боталлова протока облегчает оценку клинических проявлений и способствует выбору тактики лечения, особенно у недоношенных детей с синдромом дыхательных расстройств, вызванных болезнью гиалиновых мембран с нарушением равновесия между вентиляцией и перфузией легких. В этой ситуации приобретает значение не только диагностика наличия открытого артериального протока, но и оценка его "гемодинамической значимости", так как при таких факторах, как дыхательные расстройства, внутриутробная инфекция, открытый артериальный проток может стать одним из факторов возникновения отека легких, ишемических поражений головного мозга, язвенно-некротического энтероколита. Для "гемодинамически значимого" функционирующего боталлова протока" характерны следующие клинические признаки:
- базальная частота сердечных сокращений более 150 ударов в минуту;
- ритм галопа;
- систолический или систолодиастолический шум;
- скачущий пульс;
- усиление сердечного толчка;
- пульсовое давление более 25 мм рт.ст.
Функционирующий артериальный проток способствует диастолическому обкрадыванию церебрального кровотока. Индекс сосудистой резистентности при этом увеличивается.
Сброс крови через функционирующий артериальный проток может достигать 45% от величины минутного объема крови. Отмечено, что показатели ультразвукового исследования могут значительно варьировать при синдроме дыхательных расстройств (СДР), для которого характерно разнообразие клинической картины. Были выделены пять групп нарушения гемодинамики.
3. Врожденные пороки сердца
3. 1 Этиология ВПС
Причины возникновения врожденных пороков сердца складываются из следующих факторов:
1. Хромосомные нарушения -5%;
2. Мутация одного гена - 2-3%;
3. Факторы среды:
а) алкоголизм;
б) биологические мутагены (главным образом — вирус краснухи, ведущий к врожденной краснухе с характерной триадой Грега — ВПС, катаракта, глухота) 1-2%;
в) химические мутагены (фенолы лаков, красок; нитраты; бензпирен при табакокурениии; тератогенные медикаменты — антибиотики и ХТП, НПВС и т. д.).
г) физические мутагены (главным образом — ионизирующее излучение).
4. Полигенно-мультифакторное наследование.
5. Метаболические нарушения, такие как диабет, фенилкетонурия.
Теории
Рокитанский (Rokitansky, 1875) считал, что врожденные пороки объясняются остановкой в развитии сердца на различных стадиях онтогенеза.[4] Шпитцер (Spitzer, 1923) трактует их как возврат к одной из стадий филогенеза.[5] Крымский, синтезируя две предыдущие точки зрения, рассматривает врожденные пороки сердца как остановку развития на определённой стадии онтогенеза, соответствующей тому или другому этапу филогенеза.[6] В рамки этих теорий укладываются только атавистические пороки сердца (женские и нейтральные), а вся группа мужских пороков не находит объяснения, так как ни одному из мужских компонентов врожденных пороков сердца не соответствует аналогичное образование у нормального эмбриона или у филогенетических предшественников человека.[2][3] Применение «Тератологического правила полового диморфизма» позволяет объяснить все три группы пороков.
Исследование связи врожденных пороков сердца с полом было проведено в начале 70-х годов по данным, собранным в нескольких крупных кардиохирургических центрах СССР, а также литературным данным. В результате анализа 31814 больных, страдавших врожденными пороками сердца и магистральных сосудов, была выявлена четкая связь типа порока с полом больного. По соотношению полов врожденные пороки можно разделить на три группы — «мужские», «женские» и «нейтральные».
Наиболее четко выраженные женские врожденные пороки—открытый артериальный проток (1 : 2.72); болезнь Лаутембахера (1 : 2.1); дефект предсердной перегородки вторичного типа (1 : 1.84); дефект межжелудочковой перегородки и открытый артериальный проток (1 : 1.51); триада Фалло, то есть сочетание дефекта предсердной перегородки, сужения устья легочной артерии и гипертрофии правого желудочка (1 : 1.45).
Наиболее четко выраженные «мужские» врожденные пороки—врожденный аортальный стеноз (2.66 : 1), коарктация аорты (2.14 : 1), транспозиция магистральных сосудов (1.90 : 1), тотальная аномалия соединения легочных вен (1.39 : 1), коарктация аорты и открытый артериальный проток (1.37 : 1). Ни одному из мужских компонентов врожденных пороков сердца не соответствует аналогичное образование у нормального эмбриона или у филогенетических предшественников человека.[2][3]
Остальные врожденные пороки сердца относятся к «нейтральному» типу. Их частота примерно одинакова у обоих полов. Среди них также можно выделить простые (дефект аорто-легочной перегородки, дефект предсердной перегородки первичного типа, стеноз легочной артерии) и сложные (частичный и полный дефект предсердножелудочковой перегородки, аномалия Эбштейна, атрезия трехстворчатого клапана и др).
Подразделение врожденных пороков сердца и крупных сосудов на мужские, женские и нейтральные позволяет использовать пол больного как диагностический симптом. При этом, пороки мужского и женского типа имеют довольно большое значение коэффициента диагностической ценности. Например, учет информации o поле больного увеличивает вероятность диагноза для открытого артериального протока в 1.32 раза.[7]
Хромосомные нарушения как причина врожденных пороков сердца
В 2-3% наблюдений хромосомные нарушения обусловлены мутацией единичных генов. Отмечается высокая частота хромосомных аббераций при врожденных пороках сердца.
Тип наследования врожденных пороков сердца это полигенно-мультифакторная модель, признаки которой следующие:
1. Риск повторного поражения возрастает с увеличением больных среди родственников 1 степени.
2. В случае, когда в общей популяции имеются различия в заболевании патологией определенного пола, среди родственников оказываются пораженными особи противоположного пола.
3. Чем тяжелее порок сердца, тем выше риск его повторения.
4. Риск повторения порока у родственников 1 степени больного индивидуума равен приблизительно корню квадратному из частоты патологии среди общей популяции.
Врожденные пороки сердца являются частью определенных синдромов. Большинству синдромов свойственна вариабельная экспрессивность: изменения в сердце могут варьировать от легкой степени поражения до тяжелой. Это наиболее выражено при межсемейственной мутации гена.
При описании нозологических форм врожденных пороков сердца будут представлены наиболее часто встречаемые синдромы.
Инфекции как причины врожденных пороков сердца
Врожденные пороки сердца, возникающие в результате инфекции, вирусной интоксикации и т.д., по рекомендации международной группы кардиологов называют ЭМБРИОПАТИЕЙ.
Пик инфекции следует сопоставлять с временем интенсивного формирования органов и систем.
Подробно о воздействии инфекционных факторов на развитие сердца плода и формирование патологии у новорожденных будет представлено в следующих наших статьях.
Лекарственные препараты и алкоголь как причина врожденных пороков сердца плода
Тератогенным действием на сердечно-сосудистую систему обладают:
АЛКОГОЛЬ - чаще формируются дефекты межжелудочковой и межпредсердной перегородок и открытый артериальный проток.Частота возникновения составляет 25-30%. При алкоголизме у матери возникает эмбриофетальный алкогольный синдром в 30%. По данным же Kramer H. et al.,, частота возникновения врожденных пороков сердца составляет лишь 1 %.
Из лекарственных препаратов тератогенным эффектом обладают следующие противосудорожные препараты: Гидантоин вызывает развитие стеноза легочной артерии, коарктацию аорты и открытый артериальный проток. Триметадоин способствует формированию транспозиции магистральных сосудов, тетрады Фалло и гипоплазии левого сердца, а препараты лития - аномалии Эбштейна, атрезии трикуспидального клапана, т.е. имеют избирательное действие на трикуспидальный клапан.
К препаратам, прием которых может быть причиной возникновения врожденных пороков сердца, также относятся амфитамины, прогестагены, вызывающие формирование сложных врожденных пороков сердца.
Факторами негативного воздействия при формировании патологии сердца плода считают также оральные контрацептивы и противогипертензионные средства.
Метаболические нарушения как причина врожденных пороков сердца плода
Диабет, по результатам, опубликованным в зарубежной литературе, вызывает в 3-5% формирование врожденных пороков сердца. По данным Савельевой Г.М. (1971), это 6,2% и имеется прямая зависимость от класса сахарного диабета.
Скрининговое ультразвуковое исследование в России в настоящее время не представляется возможным, поэтому основное внимание должно быть уделено группам риска, когда фетальное кардиологическое исследование должно быть обязательным и неоднократным.
Copel J.A. et al. выделили две группы факторов риска, основанные на 1193 исследованиях, и в 74 случаях из них был диагностирован врожденный порок сердца.
Факторы риска:
пожилой возраст матери,
эндокринные нарушения у супругов,
токсикозы первого триместра беременности,
угрозы прерывания беременности,
мертворождения в анамнезе,
прием женщиной эндокринных препаратов для сохранения беременности.
Первая группа - причины, связанные с развитием плода.
Экстракардиальные аномалии плода.
По результатам клиники Венского Университета сочетание врожденных пороков сердца и внесердечных аномалий наблюдаются в 23% случаев.
Хромосомные нарушения, из которых наиболее часто встречается 13, 18, и 21 трисомия. Их число составляет от 5 до 32% данным же Responndek M.L. (1994) [16] процент нарушений достигает 42.
Нарушение ритма сердечных сокращений плода в 50% наблюдений сопутствует врожденным порокам сердца. Такие врожденные пороки как дефект межжелудочковой перегородки (50%), атриовентри-кулярный септальный дефект (80%) антенатально протекают с наличием полного сердечного блока, т.е. пороки, анатомически затрагивают проводящие пути сердца.
Наличие выпота в брюшной, плевральной и перикардиальной полостях в большинстве случаев являются следствием врожденного порока сердца.
Задержка внутриматочного роста плода может возникать в результате наличия врожденного порока сердца. Процент частоты сочетания не установлен. Наиболее часто это наблюдается при симметричной форме внутриутробной задержки развития.
Наличие нереактивного стресса при дородовом тестировании.
Вторая группа риска связана непосредственно с родителями.
К ним относятся:
- Врожденные пороки сердца у матери.
- Наличие инфекции.
- Обменные заболевания.
- Врожденные порок сердца у отца.
- Воздействие лекарственных препаратов.
- Использование крепкого кофе более 8 г в сутки также повышает риск рождения ребенка с врожденным пороком сердца и расщеплением твердого неба.
В институте профилактической кардиологии медицинского колледжа в штате Колорадо Nora J. et Nora A. были разработаны критерии формирования патологии определенных структур сердца в зависимости от периода воздействия экзогенных или эндогенных факторов.
Ведущими являются два механизма.
1. Нарушение кардиальной гемодинамики перегрузка отделов сердца объёмом (пороки по типу недостаточности клапанов и септальных дефектов) или сопротивлением (пороки по типу стенозов отверстий или сосудов) истощение вовлеченных компенсаторных механизмов (гомеометрического Анрепа на сопротивление, и гетерометрического Франка-Старлинга на объём) развитие гипертрофии и дилятации отделов сердца развитие сердечной недостаточности СН (и, соответственно, нарушения системной гемодинамики).
2. Нарушение системной гемодинамики (полнокровие/малокровие малого круга кровообращения МКК, малокровие большого круга кровообращения БКК) развитие системной гипоксии (главным образом — циркуляторной при белых пороках, гемической — при синих пороках, хотя при развитии острой левожелудочковой СН, например, имеет место и вентиляционная, и диффузионная гипоксия).
3.2 Классификация
Известно более 90 видов врожденных пороков сердца, а также множество их сочетаний. На выживаемость детей с врожденными пороками сердца влияет множество факторов, разделяемых на первичные и вторичные. Первичные факторы риска, возникающие с первым вдохом ребенка, позволили выделить четыре группы риска.
В первую группу входят пороки с относительно благоприятным исходом - это открытый артериальный проток, дефекты межпредсердной и межжелудочковой перегородок, нерезко выраженный стеноз легочной артерии. Детская смертность не превышает в данной группе 8-11%.
Вторая группа врожденных пороков сердца - это болезни миокарда и перикарда, тетрада Фалло. Смертность возрастает в данной группе до 24-30%.
Третью группу врожденных пороков сердца составляют более сложные врожденные пороки сердца: транспозиция магистральных сосудов, коарктация и стеноз аорты, атрезия правого предсердно-желудочкового отверстия, болезнь Эбштейна, общий атриовентрикулярный канал или атриовентрикулярный септальный дефект (в мировой литературе этот порок называют дефектом эндокардиальных подушек), двойное отхождение сосудов от правого желудочка. Гибель новорожденных достигает в третьей группе 36-52%.
Четвертая группа врожденных пороков сердца дает наиболее высокий процент смертности (79-97), в нее входят: гипоплазия одного из желудочков, атрезия клапанов с интактной межжелудочковой перегородкой, единственный желудочек сердца, преждевременное закрытие овального окна, общий артериальный ствол и т.д.
Врожденные пороки сердца редко влияют на развитие плода, однако есть пороки, несовместимые с жизнью. Некоторые врожденные пороки сердца, даже несложные формы, в раннем неонатальном периоде протекают злокачественно, обуславливая развитие декомпенсации кровообращения и дыхательную недостаточность. Главной причиной этого является несовершенство компенсаторных механизмов.
Предложено несколько классификаций врожденных пороков сердца, общим для которых является принцип подразделения пороков по их влиянию на гемодинамику.
I ВПС условно делят на 2 группы:
1. Белые (бледные, с лево-правым сбросом крови, без смешивания артериальной и венозной крови).
2. Синие (с право-левым сбросом крови, со смешиванием артериальной и венозной крови).
Белые пороки можно разделить на 4 группы:
1. С обогащением МКК
ОАП — открытый артериальный проток,
ДМПП — дефект межпредсердной перегородки,
ДМЖП -дефект межжелудочковой перегородки,
АВ-коммуникация и т. д.
2. С обеднением МКК
ИПС – изолированный пульмональный стеноз и т. д.
3. С обеднением БКК
ИАС — изолированный аортальный стеноз,
КА — коарктация аорты и т. д.
4. Без существенного нарушения системной гемодинамики
диспозиции сердца — декстро-, синистро-, мезо-;
дистопии сердца — шейная, грудная, брюшная.
Синих пороков 2 группы:
1. С обогащением МКК
ПТМС — полная транспозиция магистральных сосудов,
комплекс Эйзенменгера и т. д.
2. С обеднением МКК
болезнь Фалло,
аномалия Эбштейна и т. д.
II Классификация ВПС
I группа: - пороки синего типа, сброс венозной крови в артериальное русло (справа на лево).
Триада Фалло;
Тетрада Фалло;
Пентада Фалло;
Атрезия трехстворчатого клапана;
II группа: - белые пороки, сброс артериальной крови в венозное русло (слева направо).
Дефект межпредсердной перегородки (ДМПП);
Дефект межжелудочной перегородки (ДМЖП);
Открытый артериальный (боталлов) проток (ОАП);
Аортолегочный свищ;
Митральный стеноз с дефектом МПП.
III группа: - ВПС в основе которых лежит сужение магистральных сосудов сердца:
Изолированный стеноз легочной артерии;
Стеноз устья аорты;
Коарктация аорты.
III Наиболее обобщающая систематизация пороков характеризуется объединением их, в основном по влиянию на легочный кровоток, в следующие 4 группы:
I. Пороки с неизмененным (или мало измененным) легочным кровотоком: аномалии расположения сердца, аномалии дуги аорты, ее коарктация взрослого типа, стеноз аорты, атрезия аортального клапана; недостаточность клапана легочного ствола; митральные стеноз, атрезия и недостаточность клапана; трехпредсердное сердце, пороки венечных артерий и проводящей системы сердца.
II. Пороки с гиперволемией малого круга кровообращения:
1 ) не сопровождающиеся ранним цианозом –
- открытый артериальный проток,
- дефекты межпредсердной и межжелудочковой перегородок,
- синдром Лютамбаше,
- аортолегочный свищ,
коарктация аорты детского типа
2) сопровождающиеся цианозом –
- трикуспидальная атрезия с большим дефектом межжелудочковой перегородки,
- открытый артериальный проток с выраженной легочной гипертензией и током крови из легочного ствола в аорту
III. Пороки с гиповолемией малого круга кровообращения:
1) не сопровождающиеся цианозом - изолированный стеноз легочного ствола
2) сопровождающиеся цианозом –
- триада, тетрада и пентада Фалло,
- трикуспидальная атрезия с сужением легочного ствола или малым дефектом межжелудочковой перегородки,
- аномалия Эбштейна (смещение створок трикуспидального клапана в правый желудочек), гипоплазия правого желудочка
IV. Комбинированные пороки с нарушением взаимоотношений между различными отделами сердца и крупными сосудами:
- транспозиция аорты и легочного ствола (полная и корригированная),
- их отхождение от одного из желудочков,
- синдром Тауссиг - Бинга,
- общий артериальный ствол,
- трехкамерное сердце с единым желудочком и др.
Приведенное подразделение пороков имеет практическое значение для их клинической и особенно рентгенологической диагностики, т. к. отсутствие или наличие изменений гемодинамики в малом круге кровоoбращения и их характер позволяют отнести порок к одной из групп I-III или предположить пороки IV группы, для диагностики которых необходима, как правило, ангиокардиография.
Некоторые врожденные пороки сердца (особенно IV группы) встречаются весьма редко и только у детей. У взрослых из пороков 1-II групп чаще выявляются аномалии расположения сердца (прежде всего декстрокардия), аномалии дуги аорты, ее коарктация, аортальный стеноз, открытый артериальный проток, дефекты межпредсердной и межжелудочковой перегородок; из пороков III группы - изолированный стеноз легочного ствола, триада и тетрада Фалло.
Клинические проявления и течение определяются видом порока, характером гемодинамических нарушений и сроками наступления декомпенсации кровообращения.
Пороки, сопровождающиеся ранним цианозом (так наз. "синие" пороки), проявляются сразу или вскоре после рождения ребенка. Многие пороки, особенно I и II группы, долгие годы имеют бессимптомное течение, выявляются случайно при профилактическом медицинском обследовании ребенка или при появлении первых клинических признаков нарушений гемодинамики уже в зрелом возрасте больного.
Пороки III и IV групп могут относительно рано осложняться сердечной недостаточностью, приводящей к летальному исходу.
3.3 Клиника
Клинические проявления каждого отдельно взятого порока свои. Но все же клинику ВПС можно вложить в 4 синдрома:
Кардиальный синдром (жалобы на боли в области сердца, одышку, сердцебиение, перебои в работе сердца и т. д.; при осмотре — бледность или цианоз, набухание и пульсация сосудов шеи, деформация грудной клетки по типу сердечного горба; пальпаторно — изменения АД и характеристик периферического пульса, изменение характеристик верхушечного толчка при гипертрофии/дилятации левого желудочка ЛЖ, появление сердечного толчка при гипертрофии/дилятации правого желудочка ПЖ, систолическое/диастолическое кошачье мурлыканье при стенозах; перкуторно — расширение границ сердца соответственно расширенным отделам; аускультативно — изменения ритмичности, силы, тембра, монолитности, тонов, появление характерных для каждого порока шумов и т. д.).
Синдром сердечной недостаточности (острая либо хроническая, право- либо левожелудочковая, одышечно-цианотические приступы и т. д.) с характерными проявлениями.
Синдром хронической системной гипоксии (отставание в росте и развитии, симптомы барабанных палочек и часовых стекол и т. д.)
Синдром дыхательных расстройств (в основном при ВПС с обогащением МКК).
3.4 Диагностика
Данные лабораторно-инструментальных методов исследования вариабельны в зависимости от конкретного порока. Среди ведущих методик можно выделить:
ЭКГ (право- либо левограмма, разнообразные варианты аритмий и т. д.).
ФКГ (дублирует и уточняет аускультативные данные).
Обзорная рентгенография сердца (митральная конфигурация для пороков с обогащением МКК, аортальная — с обеднением) и контрастные рентгенологические методики (ангиография, вентрикулография и т. д.).
Эхо-КГ (основная методика — позволяет увидеть морфологию порока и определить функциональное состояние сердца).
Доплер-эхо-КГ (позволяет определить направление тока крови — выявить регургитацию и турбулентность).
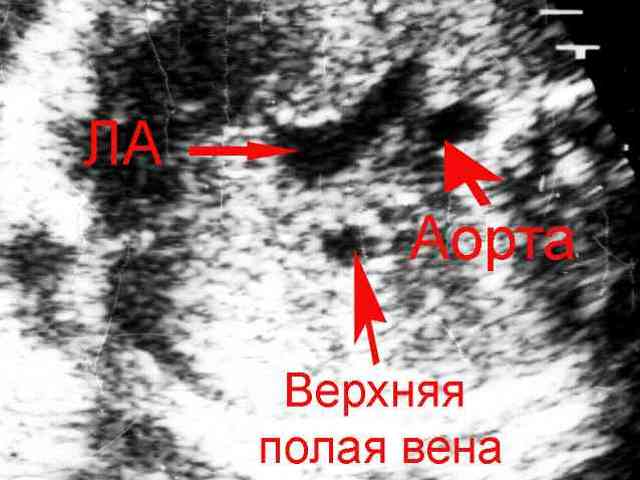
3.4.1 УЗИ признаки пороков сердца новорожденного
1. ГИПОВОЛЕМИЯ
Клинические признаки гиповолемии новорожденного: бледность, акроцианоз, "мраморный рисунок" кожных покровов, глухость сердечных тонов, периферический пульс слабого наполнения, брадикардия, сопутствующая всегда кровоизлиянию в мозг.
Ультразвуковые признаки гиповолемии новорожденного:
• уменьшение диаметра левого предсердия,
• уменьшение конечно-диастолического размера левого желудочка,
• увеличение отношения периода напряжения миокарда левого желудочка к периоду изгнания крови,
• уменьшение ударного и минутного объемов сердца,
• изменение формы диастолической части движения митрального клапана в виде нисходящего "плато", имитирующего митральный стеноз. По данным наблюдений отделения, характер движения задней створки митрального клапана в норме в первые дни жизни может быть как дискордантным, так и конкордантным по отношению к передней створке.
2. ТРАНЗИТОРНАЯ ДИСФУНКЦИЯ МИОКАРДА ЛЕВОГО ЖЕЛУДОЧКА
Клинические признаки транзиторной дисфункции миокарда левого желудочка:
- картина острой левожелудочковой недостаточности с признаками ишемии на электрокардиограмме.
Ультразвуковые признаки транзиторной дисфункции миокарда левого желудочка:
• дилатация левого желудочка и левого предсердия,
• снижение степени укорочения переднезадне-го размера левого желудочка в систолу,
• увеличение соотношения периода напряжения к периоду изгнания,
• уменьшение средней и максимальной скорости кровотока в аорте.
3. ТРАНЗИТОРНАЯ ДИСФУНКЦИЯ МИОКАРДА ПРАВОГО ЖЕЛУДОЧКА
Клинические признаки транзиторной дисфункции миокарда правого желудочка, во время прохождения осмотра согласно календарю беременности:
- усиление пульсации правого желудочка,
- систолический шум в нижней трети грудины, обусловленный трикуспидальной недостаточностью,
- ишемия миокарда на электрокардиограмме.
Ультразвуковые признаки транзиторной дисфункции миокарда правого желудочка:
• увеличение размера правого предсердия,
• асимметричная гипертрофия межжелудочковой перегородки,
• снижение средней скорости кровотока в стволе легочной артерии,
• признаки трикуспидальной недостаточности.
4. ИДИОПАТИЧЕСКАЯ ЛЕГОЧНАЯ ГИПЕРТЕНЗИЯ
Клинические признаки легочной гипертензии у новорожденного:
- цианоз резко выражен, усиление верхушечного толчка правого желудочка,
- акцент II тона,
- систолический шум, вызванный трикуспидальной регургитацией.
Ультразвуковые признаки легочной гипертензии у новорожденного:
• дилатация легочной артерии,
• дилатация правого желудочка,
• уменьшение амплитуды волны "а" на М-эхо-грамме движения клапана легочной артерии,
• значительное увеличение отношения периода напряжения правого желудочка к периоду изгнания крови из него,
• снижение средней скорости кровотока в легочной артерии.
5. ФУНКЦИОНИРУЮЩИЙ АРТЕРИАЛЬНЫЙ ПРОТОК
Перед началом исследования плода на функционирующий артериальный проток необходимо посмотреть на календарь беременности, так как на определенных сроках беременности функционирующий артериальный проток не должен вызывать опасений и должен восприниматься как норма.
Клинические и ультразвуковые признаки открытого артериального протока смотрите в наших дальнейших статьях.
По мнению Smallhorn J.F., непосредственная визуализация протока возможна в раннем неонатальном периоде при надгрудинной поперечной секторальной эхокардиографии. Прекардиальный доступ, предложенный Sahn D.J. et al. (1978) не всегда эффективен в диагностике открытого артериального протока. При большом диаметре протока визуализация его не представляет трудности, при его диаметре менее 2 мм - затруднена. К сложностям визуализации относится небольшое надгрудинное окно при наличии гипоплазии легких, смещении средостения, обструкции дыхательных путей.
3.5 Лечение
Лечение ВПС принципиально можно поделить на хирургическое (в большинстве случаев оно единственное является радикальным) и терапевтическое (чаще является вспомогательным).
Хирургическое лечение. Зависит от фазы порока.
В первой фазе — операция по экстренным показаниям (при обогащении МКК — искусственное стенозирование ЛА по Мюллеру-Альберту, при обеднении МКК — искусственный боталов проток). Целесообразность данных операций, тем не менее, — вопрос неоднозначный и сугубо индивидуальный.
Во второй фазе — операция в плановом порядке (конкретная при конкретном пороке). Сроки выполнения — вопрос дискутабельный и постоянно пересматривается (в литературе сроки варьируют от внутриутробного выполнения операции до пубертата, но все-же больше склоняются к раннему оперированию).
В третьей фазе — операция не показана.
Терапевтическое лечение
Как радикальное показано редко. Классический пример — ОАП, когда назначение индометацина по соответствующей схеме приводит к облитерации боталового протока.
Как симптоматическое включает в себя терапию:
Острой левожелудочковой СН (сердечная астма, отек легких).
Одышечно-цианотических приступов (ОЦП).
Хронической СН.
Аритмий.
Ишемии миокарда.
3.6 Осложнения ВПС
Сердечная недостаточность (встречается практически при всех ВПС).
Бактериальный эндокардит (чаще отмечается при цианотических ВПС).
Ранние затяжные пневмонии на фоне застоя в малом круге кровообращения.
Высокая легочная гипертензия или синдром Эйзенменгера (характерна для ВПС с обогащением малого круга кровообращения).
Синкопэ вследствие синдрома малого выброса вплоть до развития нарушения мозгового кровообращения (по ишемическому типу — при цианотических ВПС и стенозе аорты; по геморрагическому типу — при коарктации аорты).
Стенокардитический синдром и инфаркты миокарда (наиболее характерны для стенозов аорты, аномального отхождения левой коронарной артерии).
Одышечно-цианотические приступы (встречаются при тетраде Фалло с инфундибулярным стенозом легочной артерии, транспозиции магистральных артерий и др.).
Релятивная анемия — при цианотических ВПС. [8]
3.7 Прогноз
При раннем выявлении и возможности радикального лечения относительно благоприятный. При отсутствии такой возможности — сомнительный или неблагоприятный.
4. Наиболее часто встречающиеся ВПС
Белые пороки
Открытый артериальный проток (ОАП, боталлов проток) – сосуд соединяющий аорту и легочную артерию. Порок описан Галеном во II веке, но первое сообщение принадлежит G. Aranzio (1564). Название дано в честь итальянского врача Л. Боталло, описавшего порок немного позже.
Это один из наиболее распространенных пороков: по клиническим данным частота его составляет 10-18% от всех ВПС.
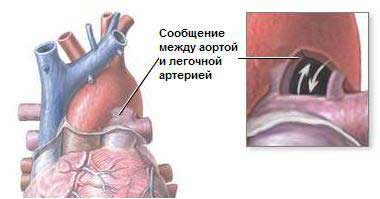
Анатомия: А. проток отходит от аорты на уровне левой подключичной артерии и впадает в ствол легочной артерии. Чаще он изолирован, но может сочетаться с другими ВПС (ДМЖП, ДМПП и т.д.). ОАП у 50% может быть в течении нескольких месяцев, чаще у детей рожденных с весом менее 1700 гр. Длина протока 3-25 мм, ширина 2-30 мм.
Различают 4 формы этого протока:
- цилиндрический
- воронкообразный
- аневризматический
- окончатый
Гемодинамика: в период внутриутробного развития основное количество крови плода из правого желудочка поступает через артериальный проток в аорту. После рождения, с первым вдохом легочное сопротивление падает и повышается давление в аорте, что ведет к обратному сбросу из аорты в легочную артерию. Высокое насыщение крови кислородом вызывает спазм протока. Окончательная облитерация происходит от 2-ой до 14-й недели внеутробной жизни, превращаясь в lig. arteriosum.
Увеличенное насыщение крови кислородом является главным стимулом для сокращения гладкомышечных клеток. Выделяющиеся брадикинин и ацетилхолин способствуют сокращению протока.
При открытом артериальном протоке происходит сброс оксигенированной крови из аорты в легочную артерию. Сброс как во время систолы, так и во время диастолы, т.к. давление в аорте выше чем в легочной артерии. Таким образом , часть циркулирующей крови совершает круговорот по укороченному пути, минуя большой круг кровообращения. Гемодинамические нарушения при ОАП обуславливают расширение левых отделов сердца (ЛЖ), развитие легочной гипертензии, дилатацию и гипертрофию ПЖ. Возникает резкая легочная гипертензия, равная систолическому кровотоку.
Клиническая тяжесть течения порока определяется:
Размерами,
Углом отхождения (более благоприятное – под острым углом),
Величиной общелёгочного сопротивления.
При далеко зашедшей стадии сброс крови становится двунаправленным: из аорты в л.а. и из л.а. в аорту. В последующем это приводит в основном к сбросу из л.а. в аорту.
Клиника
ОАП чаще встречается у девочек, чем у мальчиков (2—3:1), что свидетельствует о его мультифакториальном наследовании. Течение порока может быть различным: от бессимптомного до появления крайне тяжелых форм. При больших размерах протока (относительно диаметра аорты) он проявляет себя уже с первых дней и месяцев жизни. Клиническая картина включает признаки сердечной недоста�точности (одышка, тахикардия, гепатоспленомегалия), отставание в физическом и моторном развитии, снижение толерантности к физической нагрузке (при кормлении, ходьбе, беге). При небольших и средних размерах протока течение порока длительно может быть бессимптомным.
Цианоз при этом пороке не выражен, однако при развитии синдрома Эйзенменгера, в основе которого лежит легочная гипертензия, появляется двунаправленный сброс крови, появляется цианоз.
Характерно учащение ЧСС, систолическое давление в норме – 110-120 мм рт.ст., диастолическое давление снижено – 30-20 мм рт. ст., иногда снижается до 0 мм рт.ст.
Над областью сердца в 2-ом межреберье слева выслушивается «машинный» шум (систолодиастолический). По мере уменьшения сброса из-за развития легочной гипертензии вначале снижается интенсивность шума; в последующем может выслушиваться лишь короткий систолический шум.
ЭКГ – а) гипертрофия ЛЖ, затем присоединяется гипертрофия ПЖ.
б) м.б. мерцательная аритмия из-за дилатации ЛП.
ФКГ – во 2-3 межреберьях слева ромбовидный систолодиастолический шум.
Рентгенография – отмечается усиление сосудистого рисунка в легких, расширение или выбухание ствола легочной артерии, расширение восходящей аорты.
Зондирование полостей сердца и ангиография.
Повышение давления в ПЖ
Повышение давления в легочной артерии
Контраст поступает из аорты в легочную артерию.
Диагностика порока абсолютна, если во время катетеризации удается провести зонд из легочной артерии через проток в нисходящую аорту. При этом он занимает специфическую позицию, по форме напоминающую греческую букву (фи).
Осложнения:
пневмония,
легочная гипертензия,
бактериальный эндокардит,
сердечная недостаточность,
аневризма протока с разрывом.
Течение заболевания. Средняя продолжительность жизни без операции – 39 лет. К 30 годам умирает 20% больных. К 45 – 42% больных, к 60 годам – 60% больных.
Показания к хирургическому лечению.
Сердечная недостаточность, не купирующаяся медикаментозно,
Гипотрофия,
Прогрессирующая легочная гипертензия,
Рецидивирующие пневмонии,
Дети старше 6-12 мес. с установленным диагнозом ОАП.
Хирургическое лечение.
Выполняется левосторонняя торакотомия, перевязка ОАП или наложение клипсы. При широком ОАП производится наложение заплат из синтетического материала на аорту и легочную артерию. Возможна эндоваскулярная баллонная окклюзия протока с помощью боталлоокклюдера при диметре протока до 8 мм.
Летальность – 1,1-2,3%.
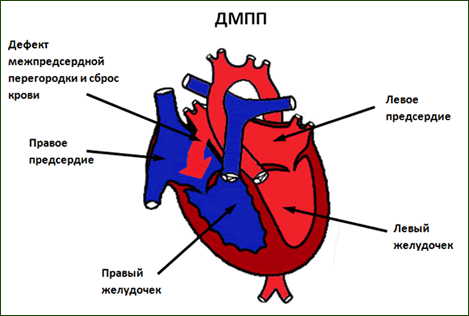
Дефект межпредсердной перегородки (ДМПП) – сообщение между двумя предсердиями – является результатом нарушения развития первичной и вторичной межпредсердной перегородок. Встречается у 7-25% больных с ВПС. Соотношение женщин и мужчин 3:1.
Различают первичные и вторичные дефекты.
Первичный ДМПП возникает вследствие незаращения первичного сообщения между предсердиями. Располагается в нижнем отделе межпредсердной перегородки непосредственно над предсердно-желудочковыми отверстиями и сочетается с ДМЖП.
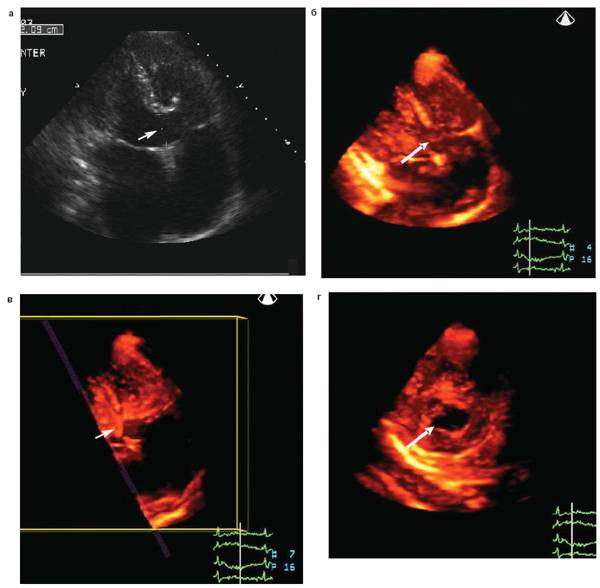
Вторичный дефект – наиболее распространенная форма порока и встречается в 85-95% случаев от общего числа изолированных ДМПП. Наиболее часто (65%) он располагается в центре межпредсердной перегородки. Вторым по частоте (12%) является нижний дефект, располагающийся над устьем нижней полой вены. Реже множественные дефекты (7%) и верхние – у устья верхней полой вены (7%). «Задние» дефекты встречаются в 2,5%. Наиболее редкая локализация вторичного дефекта в передней части перегородки.
Стрелка указывает на вторичный дефект межпредсердной перегородки.
Гемодинамика. Суть гемодинамических нарушений — это артерио-венозный сброс из левого предсердия в правое, что приводит к гиперволемии малого круга кровообращения, диастолической перегрузке и дилатации полости правого желудочка. Величина сброса может достигать 10-15 л/мин. Возникает перегрузка ПЖ, его дилатация, переполнение кровью легочных сосудов, легочная гипертензия, которая вначале носит рефлекторный характер из-за спазма артерий ведущая к постепенной облитерации. Склеротическая фаза наступает после 25-30 лет.
Клиника, диагностика:
Порок обнаруживается в 2-3 раза чаще у женщин, чем у мужчин. Большинство детей с ДМПП ведут нормальный образ жизни, некоторые могут даже заниматься спортом. С возрастом выявляется большая утомляемость и одышка при физической нагрузке по сравнению со здоровыми сверстниками. Цианоза не бывает, но если появляется, то следует заподозрить большой дефект и общее предсердие или наступила склеротическая фаза (старше 20 лет). Почти у 2/3 больных в анамнезе отмечаются повторные бронхиты, пневмонии. Изредка у детей первых месяцев и лет жизни отмечается тяжелое течение порока с одышкой, тахикардией, отставание в физическом развитии, гепатомегалией. Сердечный горб встречается нечасто. Во II межреберье определяется систолический шум – обусловлен усилением легочного кровотока и стенозом легочной артерии. Над легочной артерией II тон расщеплен и его легочный компонент акцентирован.
ЭКГ:
деформация зубца Р,
удлинение сегмента PQ,
блокада правой ножки пучка Гиса,
отклонение электрической оси сердца влево при первичном дефекте или вправо при вторичном.
ФКГ:
расщепление I тона,
II тон над легочной артерией широко и стойко расщеплен,
систолический шум во II межреберье в форме веретена.
Рентгенография:
расширение границ сердца за счет правых отделов,
выбухание дуги легочной артерии,
усиление легочного рисунка,
усиленная пульсация корней легких.
Эхокардиография – парадоксальное движение межпредсердной перегородки, увеличение амплитуды задней стенки левого предсердия.
Катетеризация сердца и ангиография:
увеличение давления в правом предсердие, правом желудочке, легочной артерии,
повышение насыщения крови кислородом в правых отделах,
баллонная катетеризация с контрастом определяет диаметр дефекта,
при ангиографии сброс контраста из ЛП ПП ПЖ.
Данный порок может осложнятся:
- Сердечной недостаточностью по правожелудочковому типу – в основном у детей раннего возраста и после 20-30 лет.
- Мерцательной аритмией.
- Тромбоэмболией сосудов головного мозга.
Течение. Вторичный ДМПП имеет благоприятное течение. Средняя продолжительность жизни составляет 36-40 лет.
ДМПП может закрываться спонтанно в первые 5 лет жизни в результате относительного уменьшения размеров дефекта с ростом сердца. Оптимальные сроки для операции – 5-10 лет.
Показания к операции:
- неэффективность консервативной терапии возникающей сердечной недостаточности,
- значительный артерио-венозный сброс (когда легочный кровоток по отношению к систолическому составляет 2,5:1 и более),
- отставание в физическом развитии,
- признаки легочной гипертензии.
Оперативное лечение сопровождается повышенным риском у детей первых лет жизни и взрослых с явлениями сердечной недостаточности и легочной гипертензии.
Причины летальности у неоперированных:
- правожелудочковая сердечная недостаточность,
- тромбоз легочной артерии,
- аритмии,
- парадоксальная эмболия сосудов головного мозга,
- у детей раннего возраста – ОРВИ и пневмонии.
Хирургическое лечение (слайды № 10-17). Операция выполняется в условиях искусственного кровообращения и гипотермии.
В настоящее время стандартное искусственное кровообращение предусматривает проведение пер�фузии с объемными скоростями от 1,8 до 2,4 л/(мин-м2) под умеренной гипотермией (26°—30° С) и гемодилюцией (гематокрит 25—30%, гемоглобин не ниже 80 г/л).
Для газообмена применяют пенопленочные оксиге�наторы многоразового использования, одноразовые пузырьковые оксигенаторы либо мембранные. Для заполнения аппарата используют растворы глюкозы 5%, 10% раствора маннитола, раствор Рингера—Локка, цельная кровь. В цельную кровь вводят гепарин, кальция хлорид, натрия гидрокарбонат.
Для проведения ИК в качестве магистралей исполь�зуют трубки из поливинилхлорида. Оксигенатор должен располагаться на 50 см ниже сердца оперируемого.
Методика подключения АИК к магистралям носит стандартный характер. Сначала канюлируют аорту. Эту канюлю подключают к артериальной магистрали, эвакуируют воздух. Затем канюлируют полые вены и подсоединяют венозную магистраль, также стараясь не допустить попадания в нее воздуха.
На исход операции с ИК влияют достаточные дозы гепарина и последующая адекватная нейтрализация его протамином сульфатом. Первичная доза гепарина составляет 3 мг/кг. Обычно рекомендуется, чтобы хирург сам вводил гепарин перед канюляцией в правое предсердие. Содержание гепарина в крови определяют через 5 мин после начала ИК. Вводимую дозу протамина сульфата определяют по содержанию гепарина.
Для суждения об адекватности ИК достаточно непрерывно определять артериальное давление, контро�лировать газы артериальной крови, артериовенозную разницу по кислороду; состояние КОС и диурез.
Перед окончанием операции с ИК хирург должен удалить воздух из аорты и камер сердца. Профилактика воздушной эмболии является исключительно важным элементом операции на открытом сердце.
Техника операции. Доступ к сердцу – срединная стернотомия. Через ушко правого предсердия производят ревизию для определения положения, размеров дефекта и состояния его краев.
Для устранения ДМПП применяется:
- Широкое вскрытие ПП, ушивание дефекта – при незначительном диаметре отверстия.
- При диаметре дефекта 1-2 см – синтетическая заплата или из перикарда.
- синтетическая заплата + коррекция расщепленной створки митрального клапана.
Летальность 1,4-2,0%.
Послеоперационные осложнения:
- ОССН, ОДН.
- Нарушение ритма (результат повреждения области атриовентрикулярного узла).
- Нарушение проводимости - атриовентрикулярная блокада.
- Воздушная эмболия в головной мозг.
- Бактериальный эндокардит.
- Остаточный сброс (негерметичность ушивания).
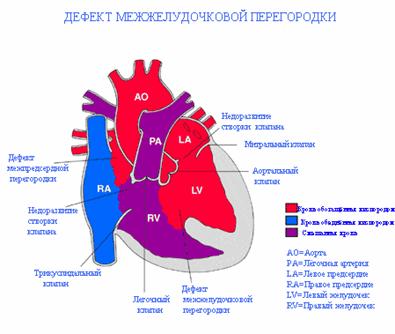
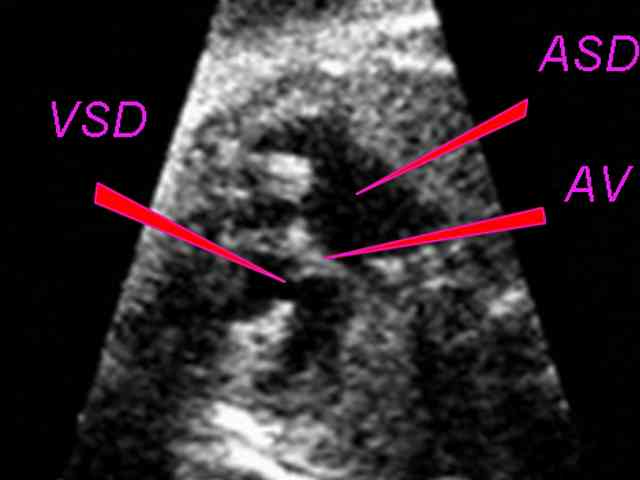
Дефект межжелудочковой перегородки (ДМЖП) – самый частый ВПС. Встречается в 9-25% случаев.
Классификация S. Milo (1980)
1. Перимембранозный дефект
– приточный
– трабекулярный
– инфундибулярный
2. Инфундибуляный дефект
–мышечный
– субартериальный
3. Мышечный дефект
Классификация R. Anderson, A. Becker (1983)
- Перимембранозные (периперипончатые) дефекты:
- трабекулярной части;
-
входной, или приточной части
- выходной, или отточной части
- Подартериальные отточные дефекты.
- Мышечный дефект:
- входной, или приточной части;
- трабекулярной части;
- выходной части или отточной.
В 2/3 случаев ДМЖП сочетается с другими ВПС.
Выделяют большой ДМЖП – его величина сходна с диаметром аорты или превышает его, и небольшой или средних размеров – меньше диаметра аорты, обычно 0,5-1,5 см.
Гемодинамика.
Артериальная кровь сбрасывается из левого в правый желудочек и легочную артерию, откуда возвращается в левые отделы сердца. Направление сброса обуславливается более высоким давлением в левом желудочке.
При диаметре дефекта 5 мм – сброс равен 2,5-3 л/мин, а при диаметре 1,5-2 см – 15-20 л/мин.
Компенсаторно возникающий спазм легочных сосудов препятствует их переполнению кровью и легочная гипертензия в этот период носит «сбросовый» характер. При длительном существовании порока формируется склеротическая фаза легочной гипертензии, а давление в легочной артерии превышает системное. Развивается синдром Эйзенменгера. Сброс крови через дефект идет справа налево. В большой круг кровообращения начинает поступать венозная кровь, появляется цианоз.
Стойкая легочная гипертензия приводит к перегрузке ПЖ и развитию правожелудочковой недостаточности.
Клиника, диагностика.
При больших дефектах заболевание проявляется спустя 12 мес. после рождения. Родители обращают на трудности при кормлении: появляется одышка, ребенок делает паузы, остается голодным, беспокойным, возникает гипотрофия.
Характерны выраженная потливость (результат гиперсимпатикотонии), бледность, мраморность кожных покровов с небольшим периферическим цианозом.
Появления цианоза в более старшем возрасте свидетельствует о высоком легочном сопротивлении и постоянном веноартериальном сбросе.
Одним из ведущих симптомов больших ДМЖП является одышка по типу тахипноэ с участием вспомогательной мускула�туры. Нередко возникает навязчивый кашель, усиливающийся при перемене положения тела. К 14-15 годам развиваются необратимые явления в сосудах легких. Быстро развивается правожелудочковая недостаточность.
При осмотре обращает на себя внимание рано развивающийся парастернальный сердечный горб, иногда значительных размеров («грудь Девиса»). Верхушечный толчок смещен влево и вниз. При пальпации улавливается систолическое дрожание в третьем и четвертом межреберьях слева, что свидетельствует о сбросе крови в правый желудочек. Границы сердечной тупости расширены в обе стороны, особенно влево.
Во II межреберье слева диастолический шум свидетельствует о присоединении недостаточности клапана легочной артерии. Выслушиваются застойные влажные хрипы в легких. Отмечается увеличение печени, отеки.
При дефекте мышечной части межжелудочковой перегородки (болезнь Толочинова — Роже) жалоб нет, клинические проявле�ния порока отсутствуют, за исключением скребущего систоли�ческого шума средней интенсивности («много шума из ничего») в четвертом — пятом межреберьях.
Крайним выражением легочной гипертензии является реакция Эйзенменгера. В результате высокого давления в малом круге кровообращения в правом желудочке возникает веноартериальный сброс, у больного появляется акроцианоз. Постепенно развивается симптом «барабанных палочек» и «часовых стекол». Могут быть носовые кровотечения, сердцебиение, боли в сердце.
ЭКГ при ДМЖП отражает систолическую и диастолическую перегрузку желудочков, степень легочной гипертензии. При не�больших дефектах ЭКГ нормальная. По мере повышения давления в легочной артерии электрическая ось сердца смещает�ся вправо, к гипертрофии миокарда левого желудочка присое�диняются признаки перегрузки правого желудочка и предсердий.
На ФКГ при ДМЖП фиксируется высокочастотный систолический шум, связанный с I тоном, занимающий 2/з или всю систолу.
При рентгенографии органов грудной клетки при средних и больших дефектах МЖП легочный рисунок усилен по артериальному руслу, ствол и ветви легочной артерии расширены, дуга выбу�хает. Ослабление легочного рисунка по периферии указывает на реак�цию Эйзенменгера (склеротическая фаза легочной гипертензии).
Катетеризация полостей сердца и ангиокардиография показа�ны больным с ДМЖП при сердечной недостаточности, призна�ках легочной гипертензии, подозрении на сопутствующие ВПС. Если при зондировании правых отделов удается провести катетер в аорту, то диагноз ДМЖП становится бесспорным. Он под�тверждается также повышенной оксигенацией венозной крови в правом желудочке (уровень «кислородного скачка»), увеличени�ем давления в нем.
Варианты течения ДМЖП:
Спонтанное закрытие дефекта. Оно происходит в 15—60 % случаев. Неболь�шие дефекты закрываются, как правило, к 5—6 годам.
Развитие легочной гипертензии и реакции Эйзенменгера.
Переход ДМЖП в «бледную форму» тетрады Фалло. В связи с турбулентностью тока крови при сбросе через дефект со временем возникает инфундибулярный (подклапанный) сте�ноз легочной артерии, в результате чего формируется «приобре�тенная» форма тетрады Фалло. Развитие инфундибулярного стеноза носит защитный характер, предотвращая развитие высо�кой легочной гипертензии, но выраженная степень обструкции вызывает формирование ВПС синего типа.
Показаниями к хирургическому лечению у детей первых лет жизни являются:
– раннее развитие легочной гипертензии,
– рефрактерная сердечная недостаточность,
– рецидивирующие пневмонии,
– гипотрофия II—III степени.
Хирургическое лечение:
1. Ушивание ДМЖП отдельными П-образными швами при диаметре дефекта до 5 мм.
2. Пластическое закрытие заплатой из синтетической или биологической ткани, которая фиксируется отдельными П-образными швами или непрерывным швом (при диаметре дефекта более 0,5 см).
3. При аортальной не�достаточности коррекцию ее производят трансаортальным досту�пом посредством «пликации» вальвулопластики, укорочения ство�рок и аннулопластики.
Летальность при небольших дефектах около 1%. При высокой легочной гипертензии у детей раннего возраста летальность 2,4-10%.
Причины летальности:
1. Высокая легочная гипертензия.
2. Негерметичность закрытия дефекта.
3. Развитие полной атриовентрикулярной блокады.
4. Недостаточность аортального и трехстворчатого клапанов.
III группа пороков – сужение магистральных сосудов
Стеноз легочной артерии (СЛА)
Изолированный стеноз легочной артерии (ИСЛА) относится к числу распространенных ВПС и встречается в 6,8—9% всех пороков [Бураковский В. И., 
Иваницкий А. В., 1982; Bankl H., 1980] одинаково част о у мальчиков и девочек. Первое описание принадлежит S. De Senae (1749) и G. В. Morgagni (1761).
Классификация. Н. Bankl (1980) предлагает выделять следующие его вари�анты.
1. Стеноз клапанов легочной артерии (ЛА) – клапанный.
2. Инфундибулярный стеноз может образовываться за счет фиброзно-мышечной полосы у места соединения полости правого желудочка и инфундибулума либо за счет гипертрофированных мышц, формирующих суженный выход из правого желудочка и располагающихся непосредственно под клапанами ЛА или ниже, в выводном тракте.
3. Суправальвулярный (надклапанный) стеноз легочной артерии.
4. Стеноз выходного отдела правого желудочка вследствие аномалии мышц. В этом случае имеется субинфундибулярная мышеч�ная преграда, разделяющая желудочек на проксимальную камеру с высоким давлением и дистальную — с низким.
5. Атрезия ЛА.
6. Отсутствие ствола и ветвей легочной артерии.
Гемодинамика. Препятствие к выбросу крови из правого желудочка ведет к тому, что систолическое давление в нем значитель�но повышается – до 200 мм рт. ст. В результате этого образу�ется систолический градиент давления между правым желудоч�ком и легочной артерией, что обеспечивает сохранность сердеч�ного выброса. У больных с тяжелой формой ИСЛА давление в правом предсердии повышается.
Клиника, диагностика. Клинические особенности СЛА цели�ком зависят от степени стеноза. При «бледных» вариантах ИСЛА дети хорошо развиваются, жалобы незначительные и в основном сводятся к одышке при нагрузке; может наблюдаться небольшой акроцианоз. Единственными проявлениями порока являются систолическое дрожание и грубый систоличес�кий шум во втором межреберье слева у грудины в сочетании с ослабленным II тоном (клапанный стеноз). У детей с инфундибулярным или комбинированным стенозом систолическое дрожание и шум определяются в третьем и четвертом межреберьях слева.
При резком стенозе обращают на себя внимание цианоз, ин�тенсивность которого нарастает с возрастом, симптомы «часовых стекол» и «барабанных палочек». Больные предъявляют жалобы на одышку при малейшей физической нагрузке и боль в об�ласти сердца. Дети с выраженной гипоксемией, как правило, отстают в физическом развитии. Ино�гда у больных отмечаются головокружения и синкопальные состояния.
У большинства детей образуется правосторонний сердечный горб. Определяется усиленный сердечный толчок.
На ЭКГ у больных с СЛА имеются признаки гипертрофии правого предсердия (зубец Р высокий, заостренный в отведениях II, III, VI), резкое отклонение электрической оси сердца вправо.
На ФКГ систолический шум имеет ромбовидную форму, зани�мает почти всю систолу.
На рентгенограмме отмечается резкое обеднение легочного рисунка, выбухание начального отдела ЛА, кардиомегалия (шаровидное сердце) связанное с увеличением ПП, ПЖ и относительной недостаточностью трикуспидального клапана.
При катетеризации полостей сердца обнаруживается высокое систолическое давление в правом желудочке. Если катетер, несмотря на стеноз, удается провести в ЛА, то измеряют величину систо�лического градиента давлений между ней и правым желудочком, отражающую степень стеноза.
Течение, лечение. Тяжелые формы порока (резкий стеноз) про�являются рано и требуют хирургической коррекции, так как стеноз быстро прогрессирует. Менее тяжелые формы характери�зуются относительно благополучным течением, удовлетворитель�ной переносимостью физических нагрузок до 20—30 лет, затем появляются признаки сердечной недостаточности, резко снижает�ся трудоспособность. К 50 годам остаются живыми только 12 % больных. Средняя продолжительность жизни при СЛА равняет�ся 24,5 годам.
Показаниями к хирургическому лечению являются:
– выраженный цианоз,
– кардиомегалия,
– сердечная недостаточность,
– увеличение градиента давления между правым желудочком и ЛА до 40—50 мм рт. ст. и более,
– давление в правом желудочке — до 70—75 мм рт. ст. и выше.
Операция выполняется на открытом сердце в условиях уме�ренной гипотермии или искусственного кровообращения и заклю�чается в рассечении стеноза по комиссурам. При развившемся подклапанном стенозе этим доступом производят его иссечение.
В последние годы в лечении больных клапанным стенозом ЛА используется чрескожная баллонная вальвулопластика.
Летальность после хирургического устранения СЛА не пре�вышает 3 %.
Осложнением оперативного вмешательства может быть ост�рая сердечная недостаточность, бактериальный эндокардит.
Стеноз аорты — врожденный порок сердца, сопровождающий�ся деформацией створок клапана и/или сужением клапанного, надклапанного или подклапанного отверстия. Надклапанный стеноз – 10%, клапанный – 65-70%, подклапанный – 20-25%.
При стенозах аорты наблюдается гипертрофия миокарда лево�го желудочка с нормальной или дилатированной его полостью.
Гемодинамика. При аортальном стенозе в аорту поступает меньше крови. Миокард левого желудочка работает с повышен�ной нагрузкой из-за препятствия к выбросу крови в аорту. Раз�вивающаяся гипертрофия миокарда делает желудочек ригидным при наполнении, возникает компенсаторный подъем конечнодиастолического давления в нем, уменьшается относительный коронарный кровоток, в том числе субэндокардиальный. Одно�временно повышается давление в левом предсердии, легочных венах, легочной артерии. Стеноз считается критическим для де�тей, если п лощадь отверстия менее 0,5 см2, для взрослых — менее 1 см2.
У 1/3 больных с патологической ориентацией дна полулунного клапана это ведет к развитию постстенотического расширения аорты и недостаточности аортальных клапанов.
Клиника, диагностика.
Стеноз аорты в 2—3 раза чаще встре�чается у мужчин. Большинство детей со стенозом аорты долго не предъявляют жалоб, нормально развиваются. В случаях вы�раженного стеноза признаки заболевания появляются на первом году жизни в виде бледности кожных покровов, одышки, тахикардии, могут быть приступы внезапного беспокойства, сердечная недос�таточность. В старшем возрасте после длительного «благопо�лучия» появляются жалобы на ангинозные боли, приступы серд�цебиения, одышку, синкопе. Синкопе — признак тяжелого стено�за с градиентом давления между аортой и левым желудочком более 50 мм рт.ст. Причиной кратковременной потери сознания являются сниженный сердечный выброс и аритмии.
Почти 30 % детей с надклапанным стенозом аорты имеют своеобразную внешность — лицо «эльфа» (синдром Вильямса — Бойрена): утолщенные кожные складки над верхними ве�ками, эпикант, косоглазие, вывернутые ноздри, толстые губы, полуоткрытый рот.
При аускультации I тон громкий при всех видах аортального стеноза. При пальпации часто определяет�ся систолическое дрожание во втором межреберье справа при клапанном и надклапанном стенозе, а при подклапанном — в третьем и четвертом межреберьях слева. Грубый систолический шум, связанный с I тоном, стенотического тембра, выслушивает�ся во втором межреберье справа при клапанном и надклапанном стенозе, при подклапанном стенозе — в третьем и четвертом меж�реберьях слева. Здесь же при пальпации определяется систолическое дрожание.
При стенозах аорты пульс на ногах и руках пониженного на�полнения, АД на нижней границе нормы.
На ЭКГ имеются признаки гипертрофии миокарда левого желудочка. При выраженном стенозе и гипертрофии миокарда на ЭКГ регистрируются измене�ния типа «strain» — снижение сегмента ST ниже изолинии на 2 мм и более с отрицательным зубцом Т в отведениях V5-6.
На ФКГ высокоамплитудный ромбовид�ной формы систолический шум, связанный с I тоном.
При двухмерной эхокардиографии определяется характерный симптом порока: створки дугообразно выбухают в просвет сосуда, отмечается их движение в виде «колебания маятника».
На рентгенограммах легочный рисунок нормальный. Кон�фигурация тени сердца характерная: резко выражена талия, за�кругленная, приподнятая над диафрагмой верхушка образует острый угол с диафрагмой. В косых проекциях опреде�ляются признаки гипертрофии миокарда левого желудочка. Типичным признаком клапанного стеноза следует считать расширение восходящей аорты.
Характерным признаком стеноза аорты при катетеризации по�лостей сердца следует считать систолический градиент давлений между левым желудочком и аортой.
При левой вентрикулографии в передней и боковой проекциях отмечается узкая струя контрастного вещества, поступающего в аорту.
Течение. При естественном течении порока почти 25 % больных умирают на первом году жизни, 60 % — в возрасте до 40 лет. Не диагностированный своевре�менно стеноз аорты — одна из основных причин внезапной смерти молодых спортсменов от острой коронарной недостаточности.
Причины смерти неоперированных больных — сердечная недо�статочность, бактериальный эндокардит, аритмии, асистолия при физической нагрузке.
Показаниями к хирургическому лечению являются прогрессирующая сердечная недостаточность, синкопе, боли в сердце при нагрузке, электрокардиографические признаки гипертрофии и ишемии миокарда, градиент давления между левым желу�дочком и аортой более 50 мм рт. ст.
Хирургическое лечение. В настоящее время при коррекции порока применяется искус�ственное кровообращение в сочетании с гипотермией.
1. При клапанном стенозе операция состоит в рассечении сросшихся створок клапана строго по комиссурам. В тех случаях, когда по�рок осложняется деформацией, утолщением и кальцинозом ство�рок последние иссекают и на их место имплантируют протез.
2. При подклапанном стенозе приме�няются две принципиально различные методики операций:
а) Пер�вая из них, предложенная S. Konno и соавт. (1975) и получившая название аорто-вентрикулопластики, заключается в расширении выводного отдела левого желудочка и устья аорты с одновремен�ным протезированием аортального клапана.
б) По второй методике, предложенной W. Wernhard и соавт. (1975) и D. Cooley и соавт. (1976), выполняется обходное шунтирование стеноза вшиванием клапансодержащего трубчатого протеза между верхушкой левого желудочка и восходящей аортой.
3. При надклапанном – рассечение стеноза с вшиванием заплаты из синтетического материала.
Хирургическая летальность колеблется от 4,2 до 18 %. Наибольшая летальность наблюдается у младенцев с кри�тическими стенозами, требующими экстренных операций, и ко�леблется от 25 до 52 %. 15-летняя выживаемость после операции составляет 90 %.
Пороки синего типа
Тетрада Фалло относится к наиболее распространенным поро�кам сердца синего типа. Частота порока у новорожденных со�ставляет 5—8%, а в старшем возрасте— 12—14% всех ВПС и 50—75 % синих пороков.
При классическом варианте тетрады Фалло обна�руживают 4 признака:
1. стеноз выводного отдела правого желу�дочка,
2. дефект межжелудочковой пере�городки (ДМЖП),
3. гипертрофия миокарда правого желудочка,
4. декстропозиция аорты.
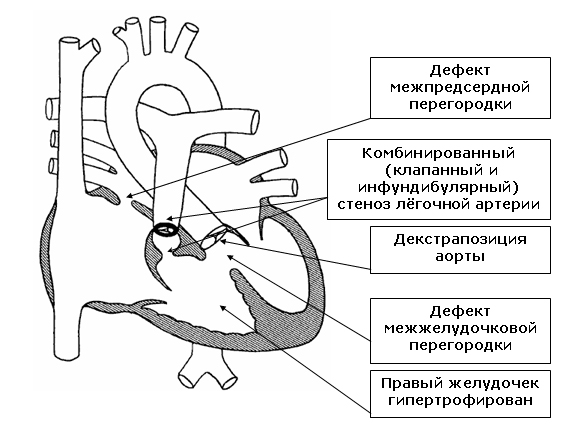
Стеноз легочной артерии при тетраде Фалло обязательно инфундибулярный (низкий, высокий или в виде диффузной гипо�плазии).
При тетраде Фалло имеются выраженные морфологические изменения сосудов малого круга кровообращения. В начальной стадии они незначительны и заключаются в разрастании интимы, затем периферические сосуды значительно сужа ются, появляются «многоствольные» сосуды, ангиоматозные структуры, артерии за�мыкающего типа и артериовенозные анастомозы. В 10—15 лет�нем возрасте и позже отмечается выраженная наклонность к тромбообразованию в легочных сосудах.
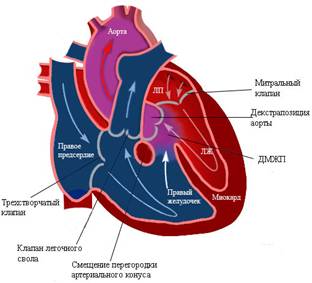
Гемодинамика. Особенности гемодинамики при тетраде Фалло определяются размером ДМЖП и выраженностью стеноза легоч�ной артерии. При значительном стенозе и больших размерах дефекта (наиболее частая анатомическая ситуация) во время систолы кровь из обоих желудочков поступает в аорту и в мень�шей степени в легочную артерию. Минутный объем большого круга кровообращения обычно увеличен. Расположение аорты «верхом» на межжелудочковой перегородке приводит к беспрепятствен�ному выбросу в нее крови из правого желудочка, в силу чего при тетраде Фалло обычно не развивается правожелудочковая сердечная недостаточность. При выраженном стенозе ЛА наблюдается праволевый (веноартериальный) сброс крови – цианотическая форма порока.
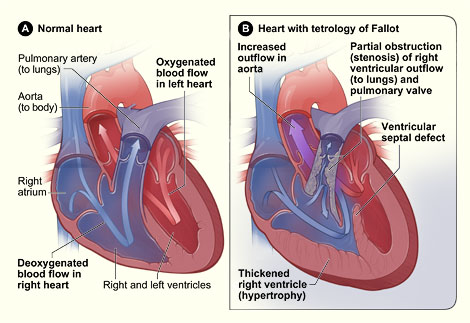
Левые отделы сердца при тетраде Фалло функционально недогружены, что является причиной отно сительной гипо�плазии левого желудочка.
Клиника. Диагноз чаще устанавливается в первые 6 мес по грубому систолическому шуму, одышке, цианозу. Симптом «часовых стекол» и барабанных палочек» появляется в зависимости от степени гипоксемии на 1-2-м году жизни. Толерантность к физической нагрузке снижена, они часто присаживаются на корточки или лежат в постели с приведенны�ми к животу ногами, облегчая тем самым свое состояние из-за уменьшения венозного притока крови к сердцу.
Основным симптомом тетрады Фалло, обусловливающим тя�жесть состояния и развитие осложнений со стороны ЦНС, явля�ются, одышечно-цианотические приступы, которые протекают наиболее тяжело в возрасте от 6 до 24 мес. Приступ начинается внезапно, ребенок становится беспокойным, усиливается одышка, цианоз, уменьшается интенсивность шума, затем возможны апноэ, потеря сознания (гипоксическая кома), судороги с последующим появлением гемипареза. Возникновение приступов связано со спазмом инфундибулярного отдела правого желудочка, в результате чего вся веноз�ная кровь через ДМЖП поступает в аорту и вызывает или усиливает гипоксию ЦНС.
У детей старшего возраста нередко отмечается отставание в физическом развитии. Для больных с тетрадой Фалло характерны повтор�ные ОРВИ, кариес зубов, хронический тонзиллит, гайморит.
При тетраде Фалло одышка выражена по типу диспноэ — углубленное, аритмичное дыхание, меньше меняется частота ды�хания. Сердечный горб чаще отсутствует, так как сердце не�большое; иногда отмечают систолическое дрожание. При аускультации определяется громкий I тон, выслушивается грубый систолический шум изгнания с максимумом в третьем и чет�вертом межреберьях слева (при инфундибулярном стенозе) или во втором межреберье (при сочетании с клапанным). В ОАК полицитемия (эр. 6-10 х 1012), полиглобулия – гемоглобин 130-150 г/л, способствующие увеличению кислородной емкости крови.
На ЭКГ обнаруживаются отклонение электрической оси серд�ца вправо, признаки гипер�трофии миокарда правого желудочка. Неполная блокада правой ножки пучка Гиса определяется у 1/5 больных.
На ФКГ регистрируется ромбовидной формы систолический шум с пиком в первую половину систолы, легочный компонент II тона значительно ослаблен или отсутствует (при резком сте�нозе), систолодиастолический шум обычно не фиксируется.
На рентгенограммах органов грудной клетки легоч�ный рисунок обеднен. Форма сердца обычно типичная — в виде «деревянного башмачка», за счет за�кругленной, приподнятой над диафрагмой верхушкой и западения дуги легочной артерии; тень сердца небольшая, увеличение может иметь место при атрезии легочной артерии. Другим рент�генологическим признаком является гипертрофия миокарда пра�вого желудочка, справа видна право-расположенная дуга аорты; возможно увеличение правого пред�сердия, расширение восходящей аорты.
При катетеризации полостей сердца обнаруживается высо�кое давление в правом желудочке. Насыщение арте�риальной крови кислородом составляет в среднем около 70%, при атрезии легочной артерии оно меньше. Прохождение катете�ра из правого желудочка в аорту является характерным признаком тетрады Фалло. При рентгеноконтрастном исследовании аорта и легочная артерия заполняются контрастом одновременно.
Двухмерная эхокардиография позволяет непосредст�венно определить величину смещения аорты, ДМЖП, степень ле�гочного стеноза и гипертрофию правого желудочка.
У больных раннего возраста с тетрадой Фалло можно вы�делить 3 клинические фазы порока:
1) фаза относительного клинического благополучия (с рождения до 6 мес), нет отставания в физическом развитии, состояние вполне удовлетворительное, приступы чаще отсутствуют;
2) фаза одышечно-цианотических приступов (от 6 до 24 мес), имеется наибольшее число осложнений со стороны ЦНС и летальных исходов, так как происходит возрастная перестройка эритропоэза и становление других компенсаторных механизмов, одновременно увеличивается гемодинамический эффект стеноза;
3) переходная фаза, когда клиническая картина порока начинает приобретать черты, характерные для детей старшего возраста, несмотря на нарастание цианоза, исчезают приступы (или они предотвра�щаются изменением положения тела — на корточках), уменьша�ются одышка и тахикардия, в крови развиваются полицитемия и полиглобулия, в легких — коллатеральное кровообращение.
Осложнений при тетраде Фалло:
1) абсцесс мозга, который образуется путем перехода гнойного процесса из внутреннего уха, придаточных пазух носа на головной мозг.
2) Бактериальный эндокардит. Источником его могут быть гнойные за�болевания кожи, кариозные зубы, хронический тонзиллит и гаймо�рит. Место локализации эндокардита — клапаны легочной арте�рии, выводной тракт правого желудочка (возможно резкое его сужение разросшимися вегетациями), трехстворчатый клапан, реже — края ДМЖП.
Течение, лечение. Средняя продолжительность жизни неопе-рированных больных — около 12 лет. Однако примерно 10 % из них достигают 20-летнего возраста. Причины смерти неоперированных больных: нарушения гемо-, ликвородинамики, гипоксия, эмболия сосудов мозга, инсульт, абсцессы головного мозга, сердечная недостаточность, бактериальный (септический) эндокардит.
Хирургическое лечение показано всем больным с тетрадой Фалло.
Радикальная коррекция заключается в закрытие ДМЖП и устранения стеноза легочной артерии. Для закрытия ДМЖП применяются синтетические и биологические заплаты. Летальность от 5,5% до 15%.
Паллиативные операции: их цель (у детей до 3-х лет) – дополнительная оксигенация крови, поступающей из ПЖ в аорту, чтобы дети пережили опасный период и впоследствии произвести радикальную операцию.
Среди различных типов паллиативных вмешательств наиболь�шее распространение получили системно-легочные или межарте�риальные анастомозы Блелока — Тауссиг (подключично-легочный анастомоз), Ватерстоуна — Кули (внутриперикардиальный анастомоз между восходящей аортой и правой легочной артери�ей), соединение данных сосудов с помощью биологических (анастомоз Вишневского — Донецкого) или синтетических про�тезов и в меньшей степени анастомоз Поттса — Смита (анастомоз между нисходящей аортой и левой легочной арте�рией).
Летальность после шунтирующих операций колеблется от 1,6 до 15,6 % в зависимости от вида анастомоза и возраста больных.
Триада Фалло:
- стеноз легочной артерии;
- ДМПП;
- гипертрофия миокарда правого желудочка.
Пентада Фалло – тетрада + ДМПП.
5. Список литературы
- Белоконь Н.А., Подзолков В.П.: Врожденные пороки сердца. – М.: Медицина, 1990.
- Геодакян В. А., Шерман А. Л. (1970) Экспериментальная хирургия и анестезиология. 32 № 2, с. 18-23.
- Жеденов В. Н. (1954) Легкие и сердце животных и человека. М.: Медицина, 350 с.
- Джагарян А. Д. (1961) Атлас хирургии сердца, Ереван, Армянское Гос. изд-во. 311 с.
- Rokitarisky K. E. (1875) Die defecte der Scheidewande des Herzens. Wien.
- Spitzer A. (1923) Arch. Pathol. Anat. 243, 81-272.
- Крымский Л. Д. (1963) Патологическая анатомия врожденных пороков сердца и осложнений после их хирургического лечения. М., Медицина.
- Шерман А. Л. (1970) Некоторые вопросы обработки медицинской информации и машинная диагностика врожденных пороков сердца. Канд. дис. М.
- Л. В. Симонова Врожденные пороки сердца у детей, Москва, 2005 год
PAGE 29
Врожденные пороки сердца