Різноманітність бінарних сполук бору з гідрогеном. Будова молекул
PAGE 3
Зміст
Вступ...................................................................................................................3
- Різноманітність бінарних сполук бору з гідрогеном. Будова молекул....................................................................................................4
- Отримання гідридів бору........................................................................7
- Фізичні та хімічні властивості боранів.................................................9
Висновки..........................................................................................................10
Література........................................................................................................11
Вступ
Бор тільки зараз має суттєве практичне значення. Ще нещодавно сполуки бору використовувались лише для виготовлення емалей та скла. Зараз же по всьому світу видобувають вище мільйона тонн природних солей борної кислоти, продукти переробки яких використовують у різноманітних отраслях техніки.
Має значення використання бору та його сполук як гідриручих агентів для вулканізації каучука та як каталізаторів процесів полімерізації. Особливий інтерес представляє проблема заміни ізоляційних, еластичних та пластичних органічних матеріалів новими, які витримують без зруйнування більш високу температуру, високомолекулярними речовинами, що містять замість углероду або нарівні з ним В, N, S, P, Si.
Зараз викликають інтерес також різноманітні сполуки бору з гідрогеном, можливість їх використання у різноманітних процесах синтезу та як реактивне паливо.
1. Різноманітність бінарних сполук бору з гідрогеном. Будова молекул
Бінарні сполуки бору з гідрогеном мають назву – борани. В даний час можна з упевненістю сказати, що, окрім діборану і тетраборану, існує багато різноманітних по складу і будові бороводородів.
Найбільш вивчені серед них відповідають рядам з загальними формулами: BnHn+6, BnHn+4, BnHn (таблиця 1.1).
Таблиця 1
Бінарні сполуки бору з гідрогеном (борани)

Крім того, є відомості про тверді полімерні гідриди невизначеного складу, що відповідають проміжним формулам від [BH1,5]x до [BH0,8]x. Ці полімери зазвичай розкладаються до свого випаровування в інтервалі температур від 100 до 400° С [5, c. 319].
Бороводороди - сполуки з дефіцитом електронів. Наприклад, у В2Н6 загальне число валентних электронів дорівнює 12, тобто їх не вистачає для утворення восьми звичайних двоелектронних двоцентрових зв'язків. У діборані В2Н6 має місце дво- та трицентрові зв'язки (малюнок 1).
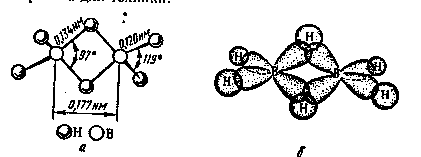
Мал.1. Будова молекули (а) та схема перекриття атомних орбіталей (б) у молекулі В2Н6.
Дві кінцеві групи ВН2 лежать в одній площині, а атоми водню і бору зв'язані двохцентровими двоелектронними зв'язками. Два ж центральні атоми водню розташовано симетрично над цією площиною і під нею та об`єднані з атомами бору трьохцентровим двоелектронним зв'язком.
Трьохентровий зв'язок виникає в результаті перекриття двох sp3-гибридных орбіталей бору (по одній від кожного атома) та 1s-орбиталі атому водню. Це відповідає утворенню звязуючої, незв'язуючої та разрихляючої молекулярних орбіталей (малюнок 2).
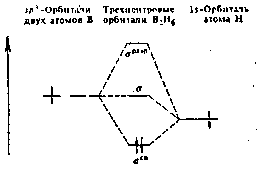
Мал. 2. Схема рівней трицентрових орбіталей молекули В2Н6.
Пара електронів займає зв'язуючу орбіталь, що забезпечує стійкість молекули В2Н6.. Ефективний заряд на мостикових атомах водню негативний (0,22-), а на атомах бору (0,22+) позитивний.
У молекулах інших боранівв, крім двохцентрових (зовнішніх) зв'язків В-Н п трицентрових (мостикових) зв'язків В- Н- В виявляються також зв'язки В-В. В результаті виникають досить складні структури.
Так, у молекулі тетраборана B4Н10 шість зв'язків В-Н, чотири трьохцентрові зв'язки В- Н- В і один зв'язок В-В.
У молекулі пентаборана В5Н9 електрони делокалізовані ще в більшому ступені і утворюють п`ятицентровий зв'язок. У молекулі В5Н9 з 24 електронів десять використовуються на утворення п'яти двохцентрових зв'язків В-Н, вісім - на утворення чотирьох трьохцентрових зв'язків В-Н-В, а решта (шість електронів) бере участь в побудові п`ятицентрового зв'язку, що охоплює остов з п'яти атомів бору. Унаслідок делокалізації зв'язку координаційне число бору в пентаборані досягає шести.
Структурні формули простих боранів приведені нижче (пунктиром позначені многоцентрові зв'язки!:
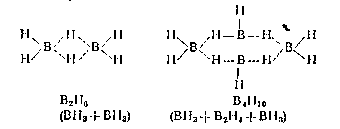
[1, c. 418 - 419].
2. Отримання гідридів бору
Одним із способів отримання бороводородів є реакція взаємодії соляної, або ще краще, фосфорної кислоти з боридом магнію MgB2. В результаті отримують бор, розчин магнієвої солі і водень в кількості, майже еквівалентній магнію, що прореагував з кислотою; бороводороди складають лише невелику домішку до водню, що виділяється (близько міллілітра на літр газової суміші).
Розділення водню та боранів проводиться за допомогою сильного охолоджування, причому важко зріджуваний водень відокремлюється від боранів і зазвичай присутніх кремнєводородів та СО2. Далі, за допомогою фракційної перегонки побічні речовини відокремлюються, і залишається головним чином тетраборан B4Н10 з виходом 2-3% від ваги початкового бору.
Останніми роками, коли боранами зацікавилися як перспективним реактивним паливом і реагентом для ряду синтезів, були розроблені нові методи отримання,які дають кращі виходи. Як початкові речовини використовуються вже не MgB2, а BF3 або ВС13.
Відносно ВС13 (і ще краще ВВг3) відоме, що при охолоджуванні і тихих електричних розрядах через суміш їх паров з воднем виникає В2Н6:
2ВВг3 + 5Н2 = В2Н5Вг + 5НВг (1)
і далі йде дісмутація:
6В2H5Вг = 5В2Н6 + 2ВВг3 (2)
Ще зручніше, мабуть, використовувати реакцію галідів бору з гідридами лужних металів - літію або натрію:
4NaH + BF3 = [Na+BH4-] + 3NaF (3)
Отримана соль (боранат натрію) містить згадуваний вже нами аніон BB4-, При дії на боранат соляної кислоти утворюється діборан, з якого неважко синтезувати інші борани і їх похідні:
2NaBH4 + 2HC1 = 2NaCl + B2H6 + 2Н2 (4)
Хорошим методом отримання діборану є реакція LiAlH4 з ВС13:
3LiAlH4 + 4ВС13 = 3LiCl + 3A1C13 + 2В2Н6 (5)
а також взаємодія NaBH4 з BF3:
3NaBH4 + 4BF3 = 2В2Н6 + 3NaBF4 (6)
В даний час найбільш застосовним на практиці є спосіб відновлення пари галіда бору воднем в присутності металів (Al, Mg, Zn, Na) як каталізаторів при підвищених температурах (метали не тільки вступають в реакції, але в основному, будучи присутними в надлишку, грають роль каталізаторів). Так, процес йде у присутності алюмінію при 350° С:
2ВС13 + 2А1 + ЗН2 = В2Н6 + 2А1С13 (7) [5, c. 320].
3. Фізичні та хімічні властивості боранів
При дії соляної кислоти на борид магнію Mg3B2 отримують складну суміш різних бороводородів, аналогічних угле- і кремнєводню. З цієї суміші виділені в чистому вигляді наступні бороводороди:
B2 H6; В4 Н10; B5H9; В5Н11; В6 Н11; В10Н11
Газоподібний Рідкі Твердий
Тетраборан В4 Н10 - летюча рідина (темп. кип. 180 С) з дуже неприємним запахом, пари якого спалахують на повітрі. При зберіганні тетраборан поступово разлагаєтся з утворенням найпростішого з отриманих бороводородів - діборана В2Н6. Останній є газом, який конденсується в рідину при -92,5 °С. На повітрі він не спалахує, але за допомогою води, як і інші бороводороди, негайно ж розкладається з відокремленням водню та утворенням борної кислоти Н3ВО3:
В2Н6 + 6Н2О = 2 Н3ВО3 + 6Н2 (8) [2, с. 631 - 632].
Пентаборан В5Н11 дуже легко займається на повітрі при кімнатній температурі. Декаборан В10Н14 також самозаймається при зіткненні з киснем, але лише при 100° С, а водою гидролізуєтся тільки при кип`ятінні [5, с. 323].
Всі вони дуже отруйні, руйнуються водою, деякі займаються на повітрі, згораючи з виділенням величезної кількості теплоти. Внаслідок цього гидріди бору використовують як паливо для ракет та ракетної авіації, наприклад:
В2Н6 + ЗО2 = В2О3 + ЗН2О + 2026 кДж (9) [4, с. 350].
З металами бор утворює бориди. Борид активних металів розкладається кислотами (Mg3B2), а бориди d-металів, які обладають електронегативністю, близькою до електронегативністі бору (1,7-1,9), можуть проявляти властивості металоподібних сполук [3, с. 405].
Висновки
1. Бінарні сполуки бору з гідрогеном мають назву – борани. Найбільш вивчені серед них відповідають рядам з загальними формулами: BnHn+6, BnHn+4, BnHn.. Крім того, є відомості про тверді полімерні гідриди невизначеного складу, що відповідають проміжним формулам від [BH1,5]x до [BH0,8]x.
2. Бороводороди - сполуки з дефіцитом електронів.
3. Одним із способів отримання бороводородів є реакція взаємодії соляної, або ще краще, фосфорної кислоти з боридом магнію MgB2. В результаті отримують бор, розчин магнієвої солі і водень в кількості, майже еквівалентній магнію, що прореагував з кислотою; бороводороди складають лише невелику домішку до водню, що виділяється.
4. Серед бінарних сполук бору з гідрогеном є тверді, газоподібні та рідкі.
5. Борани реагують з водою, киснем (більшість спалахує при зіткненні з ним), з металами утворюють бориди.
6. Всі бінарні сполуки дуже отруйні.
Література
1. Ахметов Н. С. Общая и неорганическая химия. – М.: Высшая школа, 1988. – 640 с.
2. Глинка Н. Л. Общая химия. – Л.: Химия, 1978. – 720 с.
3. Фролов В. В. Химия. – М.: Высшая школа, 1986. – 543 с.
4. Харин А. Н. Курс химии. – М.: Высшая школа, 1983. – 511 с.
5. Щукарев С. А. Лекции по общему курсу химии. Т.2. – Л.: Издательство Ленинградского университета, 1964. – 444 с.
Різноманітність бінарних сполук бору з гідрогеном. Будова молекул