Расчет и анализ параметров горения вещества динитрокрезола
МИНИСТЕРСТВО РОССИЙСКОЙ ФЕДЕРАЦИИ ПО ДЕЛАМ ГРАЖДАНСКОЙ ОБОРОНЫ, ЧРЕЗВЫЧАЙНЫМ СИТУАЦИЯМ И ЛИКВИДАЦИИ ПОСЛЕДСТВИЙ СТИХИЙНЫХ БЕДСТВИЙ
ФГБОУ ВПО ВОРОНЕЖСКИЙ ИНСТИТУТ
ГОСУДАРСТВЕННОЙ ПРОТИВОПОЖАРНОЙ СЛУЖБЫ
Кафедра химии и процессов горения
КУРСОВАЯ РАБОТА
по дисциплине «Теория горения и взрыва»
Тема: «Расчет и анализ параметров горения вещества динитрокрезола »
Выполнил: Студен т 21 учебной группы
Закотельников Е .В.
Руководитель: Начальник кафедры химии и процессов горения
полковник внутренней службы
Чуйков А. М.
Защиена_____________________Оценка _____________________дата
Воронеж 2014
СОДЕРЖАНИЕ
Введение ……………………………………………………………………….3
Теоретическая часть ……………………………………………………….....4
Методика решений .………………………………………………………….10
Решение …………………………………………………………………….....17
Заключение …………………………………………………………………...20
Список использованной литературы …………………………………….....21
ВВЕДЕНИЕ
С появлением и развитием промышленности число взрывов и пожаров стало увеличиваться и поэтому изучение опасных веществ стало одной из важнейших задач. Стали проводиться опыты на различных веществах, начали изучать их поведение при определенных условиях, а так же определяли степень опасности, которую может вызвать то или иное вещество. Затем начали создаваться своды правил и норм безопасности при работе в взрывопожароопасными веществами, требующие строгого выполнения.
В наше время изучение свойств веществ необходимо для обеспечения безопасности людей, зданий, сооружений, технологических процессов.
За последние годы в этом направлении удалось далеко продвинуться и тем самым в разы уменьшить количество взрывов и пожаром. Так, например, количество взрывов в шахтах удалось снизить благодаря приборам, которые замеряют концентрацию взрывоопасных веществ в воздухе и предупреждают рабочих, если она приближается к опасной отметке. Помимо этого, исследования помогли разработать новые средства тушения пожаров: пены, порошки, газовые составы, твердотопливные аэрозолеобразующие составы. Так же в пожаротушении были внесены ограничения по поводу использования воды как огнетушащего средства. С появлением новых веществ вода стала менее эффективна в борьбе с пожарами класса B2 и выше, а в некоторых случаях даже опасна. Например, при тушении нефти ее нельзя использовать так как может произойти разбрызгивание продуктов горения.
В данной курсовой работе я покажу как рассчитывать различные параметры горения на примере вещества динитрокрезола (C7H7 О5N2).
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Вопрос №8 «Понятие скорости выгорания , способ ее определения, область применения , методика расчета»
Скорость выгорания - потеря массы веществ и материалов в единицу времени при горении.
Данный параметр изначально определяет наличие и параметры многих опасных факторов пожара, так как количество продуктов сгорания, в том числе дыма, а также температура, во многом зависят от того, сколько и какого вещества сгорело.
Процесс термического разложения, в том числе горения материалов на пожаре, сопровождается уменьшением массы веществ и материалов. Эта потеря массы, в расчете на единицу времени и единицу площади горения, квалифицируется как удельная массовая скорость выгорания.
Таким образом - удельная массовая скорость выгорания это масса жидкой или твердой горючей технологической среды, сгорающей в единицу времени с единицы площади, кг/(м·с),
Даный параметр определяется эксперементально для каждого вещества методом их сжигания в специальной лабораторной установка и фиксации потери массы образца за определенный промежуток времени.
Скорость выгорания зависит от многих условий, в частности:
• агрегатное состояние вещества;
• химический состав;
• начальная температура;
• интенсивность и площадь испарения - для жидкостей;
• геометрические размеры и способ укладки - для твердых горючих материалов;
• размеров поверхности, доступной для горения;
• наличие окислителя в окружающей среде.
Ниже, в таблице, приведена для примера удельная массовая скорость выгорания некоторых веществ.
|
Вещества и материалы
|
Удельная массовая скорость выгорания
x10 кг·м/с
|
|
Бензин
|
61,7
|
|
Керосин
|
48,3
|
|
Этиловый спирт
|
33,0
|
|
Древесина (бруски) W = 13,7%
|
39,3
|
|
Бумага (книги, журналы)
|
4,2
|
|
Каучук натуральный
|
19,0
|
|
Полистирол
|
14,4
|
|
Резина
|
11,2
|
|
Волокно штапельное
|
6,7
|
|
Полиэтилен
|
10,3
|
|
Хлопок разрыхленный
|
21,3
|
|
Лен разрыхленный
|
21,3
|
Скорость выгорания - количество горючего, сгорающего в единицу времени с единицы площади; используют при расчетных определениях продолжительности пожара в резервуарах, интенсивности тепловыделения и температурного режима пожара.
Скорость выгорания может быть использована для сравнительной характеристики отдельных горючих. Из этого следует, что летучесть жидких топлив при их горении играет решающее значение, в то время как нормаль-пая скорость пламени для большинства горючих имеет один п тог же порядок.
Скорость выгорания ( количество горючего, сгорающего в единицу времени с единицы площади), характеризующая интенсивность сгорания вещества в условиях пожара, используется при расчетах продолжительности пожара в резервуарах, интенсивности тепловыделения и температурного режима пожара в зданиях.
Скорость выгорания определяется количеством вещества, сгорающего в единицу времени с единицы площади.
Скорость выгорания С составляет: в основной печи - 0 006 - 0 010 % в минуту, а в кислой - обычно 0 003 % в минуту. Повышение температуры ускоряет окисление С.
Скорость выгорания зависит от природы жидкости.
Скорость выгорания определяется количеством вещества, сгорающего в единицу времени с единицы площади.
Методы расчета скорости выгорания
Если известны параметры состояния исследуемой жидкости, то в зависимости от имеющихся данных скорость выгорания (m) в любом режиме горения можно вычислить, не проводя экспериментальных исследований, по формулам:
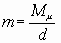
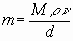
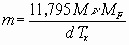
где M - безразмерная скорость выгорания;
m - динамическая вязкость паров жидкости при температуре кипения, Н·с·м-2;
r - плотность паров жидкости при температуре кипения, кг·м-3;
n - кинематическая вязкость паров жидкости при температуре кипения, м2·с-1; если величина n неизвестна, то ее вычисляют по формуле
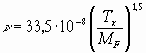
MF - молекулярная масса жидкости, кг·моль-1;
d - характерный размер зеркала горящей жидкости, м. Определяется как корень квадратный из площади поверхности горения; если площадь горения имеет форму окружности, то характерный размер равен ее диаметру. При расчете скорости турбулентного горения можно принять d = 10 м;
Тк - температура кипения жидкости, К.
Порядок расчета следующий.
Определяют режим горения по величине критерия Галилея Ga, вычисляемого по формуле
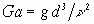
где g - ускорение свободного падения, м·с-2.
В зависимости от режима горения вычисляют безразмерную скорость выгорания М. Для ламинарного режима горения:
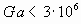 ;
; 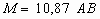
Для переходного режима горения:
если 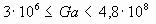 , то
, то 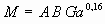
если 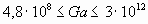 , то
, то 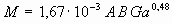
Для турбулентного режима горения:
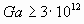 ;
; 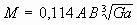
где 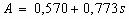 ;
; 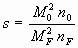 ;
;
M0 - молекулярная масса кислорода, кг·моль-1;
n0 - стехиометрический коэффициент кислорода в реакции горения;
nF - стехиометрический коэффициент жидкости в реакции горения.
Примечание - При Ga < 4,8·108 для ароматических углеводородов A = 1,45 при 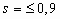 и A = 3,40s - 1,56 при s > 0,9.
и A = 3,40s - 1,56 при s > 0,9.
B - безразмерный параметр, характеризующий интенсивность массопереноса, вычисляемый по формуле
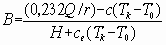
где Q - низшая теплота сгорания жидкости, кДж·кг-1;
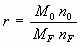 - безразмерное значение массы кислорода, необходимого для сгорания 1 кг жидкости;
- безразмерное значение массы кислорода, необходимого для сгорания 1 кг жидкости;
c - изобарная теплоемкость продуктов горения ( принимается равной теплоемкости воздуха c = 1), кДж·кг-1·К-1;
T0 - температура окружающей среды, принимаемая равной 293 К;
H - теплота парообразования жидкости при температуре кипения, кДж·кг-1 ;
ce - средняя изобарная теплоемкость жидкости в интервале от T0 до Tк.
Если известны кинематическая вязкость пара или молекулярная масса и температура кипения исследуемой жидкости, то скорость турбулентного горения вычисляют с использованием экспериментальных данных по формуле
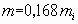
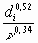
где mi - экспериментальное значение скорости выгорания в переходном режиме горения.
di - диаметр горелки, в которой получено значение mi, м. Рекомендуется использовать горелку диаметром 30 мм. Если в горелке диаметром 30 мм наблюдается ламинарный режим горения, следует применять горелку большего диаметра.
Если не известны кинематическая вязкость паров или молекулярная масса и температура кипения исследуемой жидкости, то оценку скорости выгорания проводят в следующем порядке.
Находят скорость выгорания жидкости в горелках диаметром 10, 15, 18, 20. 25 и 30 мм. Полученные результаты заносят в табл.
Вычисляют среднее арифметическое значение (md), л, для всех испытаний в которых наблюдалось ламинарное горение.
Примечание - Обычно значения 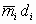 в условиях ламинарного горения близки по значению или монотонно убывают с увеличением диаметра горелки. Для переходного режима горения характерно возрастание значений
в условиях ламинарного горения близки по значению или монотонно убывают с увеличением диаметра горелки. Для переходного режима горения характерно возрастание значений 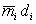 .
.
|
Диаметр горелки, di, м
|
Скорость выгорания 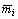 , кг·м-2·с-1 , кг·м-2·с-1
|
Режим горения (визуальное наблюдение)
|
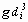 , м·с-2 , м·с-2
|
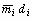 , кг·м-1·с-1 , кг·м-1·с-1
|
|
|
|
|
|
|
Результаты испытаний, относящиеся к переходному режиму горения, заносят в таблицу в виде функций 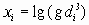 ,
, 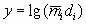 ,
, 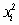 ,
, 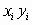 с точностью до четвертого знака после запятой.
с точностью до четвертого знака после запятой.
Количество экспериментальных точек должно быть не менее трех, в противном случае проводят дополнительные эксперименты, в горелках диаметром более 30 мм.
Вычисляют по столбцам таблицы 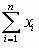 ,
, 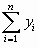 ,
, 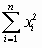 ,
, 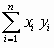 , и средние
, и средние
значения 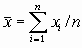 ,
, 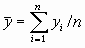 ,
,
где n - число экспериментальных точек, относящихся к переходному режиму горения.
Вычисляют параметры а и b по формулам:
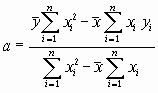 ,
, 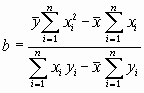 .
.
Определяют кинематическую вязкость паров исследуемой жидкости (n) по формуле:
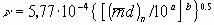 .
.
МЕТОДИКА РЕШЕНИЙ
1. Порядок составления уравнения реакции горения
Уравнение реакции горения составляется при многих пожарно-технических расчетах (для расчета объема воздуха, объема продуктов горения и т.д.).
Во-первых, необходимо знать основные продукты полного сгорания веществ (таблица соответствия продуктов горения химическому элементу, входящему в состав вещества):
С - СО2 Н2 - Н2О S - SО2 Cl - HCl
Р - Р2О5 Аl - Аl2О3 Na - Na2О F - HF
Са - СаО Si - SiO2 Br – HBr I - НI
N2 - N2 O2- в свободном виде не выделяется
Для составления уравнения реакции горения допускают, что воздух состоит из 79% азота и 21% кислорода. Тогда на 1 объемную часть кислорода в воздухе приходится: 79/21=3,76 объемных частей азота.
В левую часть записывают Горючее Вещество (ГВ) + воздух.Для уравнивания вспомним сущность материального баланса: суммарная масса веществ, вступающих в реакцию равна массе веществ, получившихся в ходе реакции. Число атомов химического элемента должно быть одинаково, независимо от того, в состав какого вещества этот элемент входит.
Порядок уравнивания: начинаем с Н2, затем продолжаем с другими химическими элементами. Кислород уравнивается в последнюю очередь, причем справа налево, множитель перед 3,76 N2 равен множителю перед О2.
Концентрация соответствующая такому соотношению горючего и воздуха называется стехиометрической, то есть такой, при которой смесь горючего вещества с воздухом наиболее взрывоопасна. Необходимо обратить внимание на то, что расчет ведут на один моль (1 м3) горючего вещества, поэтому в уравнении могут появляться дробные коэффициенты.
2. Порядок расчета объема воздуха, необходимого для горения
Расчет Vв необходим для прогнозирования развития пожара в помещении. Минимальное количество воздуха, необходимое для полного сгорания единицы массы или объема горючего вещества, называется теоретически необходимым.
При пожаре горение чаще всего происходит с избытком воздуха, что учитывается в расчетах коэффициентом избытка воздуха (=2, =3 и т. д.).
Если =1, то Vв равен теоретически необходимому, и такая концентрация воздуха и горючего называется стехиометрической.
Для расчета Vв используются формулы, которые достаточно просто выводятся из уравнения материального баланса процесса горения.
A) Для ТГВ и жидкостей:
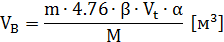
где: m – масса горючего (дается в условии задачи),
– стехиометрический коэффициент,
Vt – обьем 1-го киломоля воздуха при заданных условиях,
– коэффициент избытка воздуха,
М – молярная масса.
Если жидкость дана в литрах, необходимо перевести литры в кг по формуле (в 1 м3 - 1000 литров).
Если давление Р и температура t по условиям задачи не соответствую нормальным, то объем одного киломоля воздуха рассчитывают по формуле:
(Ро=101325 Па, Tо=273K, Vo =22,4 м3),
Б) Для газов:
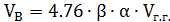
где: Vг.г. – объем горючего газа.
3. Порядок расчета объема продуктов горения
Для расчета применяются формулы, которые выводятся из уравнения материального баланса и, поэтому, похожи на формулы для определения V воздуха
Для твердых и жидкостей:
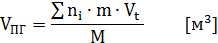
где: ni –суммарное количество килограмм-молей продуктов горения,
m – масса горючего (дается в условии задачи),
Vt – обьем 1-го киломоля вещества при заданных условиях,
М – молярная масса,
Vпг– объем продуктов горения.
Если давление и температура по условиям задачи не соответствуют нормальным (Ро=101325 Па, tо=0оС), то объем одного киломоля вещества рассчитывают по формуле:
[м3]
где Р и t – заданные температура и давление
Если горение протекает с избытком воздуха (1), то необходимо рассчитать О2= ( -1) и N2=3,76 ( -1)
Для газов:
[м3]
Где Vгг - заданный объем горючего газа (м3)
Процентный состав продуктов горения рассчитывается, исходя их общего числа килограмм-молекул продуктов горения. Общее число килограмм-молекул продуктов горения ni принимаем за 100% и по пропорции вычисляем процентное содержание каждого компонента продуктов горения.
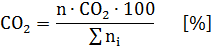
аналогично и для других продуктов горения.
4. Определение низшей Qн и высшей Qв теплоты сгорания веществ по формуле Д.И. Менделеева
Формулы имеют вид:
Qн=339С+1256Н-109(О+N-S)-25(9H+W) [кДж/кг],
Qв=339С+1256Н-109(О+N-S) [кДж/кг]
где С, Н, О, N, S, W – содержание (в %) соответствующего химического элемента в веществе (задается по условию или рассчитывается через молярную массу).
5. Определение плотности паров, газов по воздуху
Формула имеет вид:
Dв=М/29,
где М – молярная масса вещества
6. Расчет ПДВК.
Расчет предельно допустимой взрывобезопасной концентрации горючего вещества осуществляется по формуле:
ПДВК=н ·Кб
где Кб – коэффициент безопасности (допускается брать его равным 0,05);
н – нижний КПРП (рассчитывается или берется из справочной литературы).
Коэффициент безопасности Кб может изменяться в зависимости от условий, в которых присутствуют горючие пары или газы и характера технологического процесса.
Кб=0,1 – для производственных помещений;
Кб=0,5 – для аппаратов, в которых не предусмотрено применение источников зажигания;
Кб=0,05 – для помещений и аппаратов, в которых будут вестись ремонтные работы с применением открытого огня.
7. Расчет стехиометрической концентрации
Стехиометрическая концентрация – такая концентрация, при которой смесь горючего вещества с воздухом наиболее взрывоопасна.
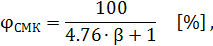
где - стехиометрический коэффициент, рассчитанный по уравнению горения.
8. Определение группы горючести веществ
Группу горючести веществ можно определить расчетным путем, используя формулу:
К=4nC+4nS+nн + nN -2nO-2nCl-3nF-5nBr ,
где nC, nS, nн, nN nO, nCl, nF, nBr – количество атомов С, S, H, N, O, Cl, F, Br соответственно (указано в формуле вещества).
К-коэффициент горючести, причем, если К<1, то жидкость не горит и наоборот, если К>1, то жидкость является горючей.
9. Определение КПРП газов и паров
КПРП газопаровоздушных смесей имеют большое значение в обеспечении пожарной безопасности. КПРП определяются экспериментальным путем, но их можно и рассчитывать. Методика экспериментального определения приведена в ГОСТ 12.1.044-89. Предпочтительнее экспериментальный метод. Кроме этого, значения КПРП приведены в справочной литературе или электронных программах.
Рассмотрим, как рассчитывается КПРП для индивидуальных веществ (имеющих химическую формулу).
Существует две основных формулы для расчета КПРП:
А) [%] ( используется только для газов)
Значения Qн приводятся в справочнике А. Я. Корольченко или рассчитывается по формуле Менделеева (была приведена выше)
Б) [%],
(используется для вещества в любом агрегатном состоянии)
Где коэффициенты a и в, приведенные в таблице:
Таблица 1
|
Область применения
|
a
|
b
|
|
Для вычисления НКПРП
|
8,684
|
4,679
|
|
Для вычисления ВКПРП
при 7,5
при > 7,5
|
1,550
0,768
|
0,560
6,554
|
- стехиометрический коэффициент (из уравнения горения) или по формуле:
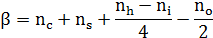
где пс,пs,пн,,пх,по- число атомов в молекуле соответственно - углерода, серы, водорода, галогенов и кислорода.
10. Пересчет КПРП из % в г/м3 , кг/м3, при изменении температуры
А) При проведении пожарно-технических расчетов встречается необходимость пересчитать КПРП из % в г/м3 или наоборот. Например, в справочнике значение дано КПРП в %, а для расчетов пожаровзрывоопасности пылей или паров горючих жидкостей необходимо значение в г/м3.
Пересчет из % в г/м3 осуществляется по формуле:
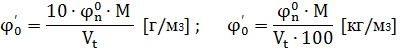
Где Vt - объем одного киломоля воздуха, М- молярная масса
Пересчет из г/м3 в %: [%]
Б) Если температура смеси отличается от 298 К (25) более чем на 15 градусов, КПРП находят по формулам:
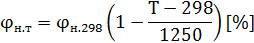
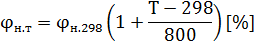
где н.298 -рассчитывается по универсальной формуле или берется из справочника;
Т=Т0+t=273+t.
11. Определение температуры вспышки жидкостей
Существует формула Элея для расчета tвсп по известному значению температуры кипения (берется из справочника А.Я. Корольченко):
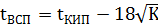
где: К - коэффициент горючести, (порядок расчета приведен выше),
tкип – взять из справочника А.Я. Корольченко.
12. Определение температурных пределов распространения пламени жидкостей
Температурные пределы распространения пламени жидкостей определяются по известному значению температуры кипения. Формула имеет вид:
tн(в)=k·tкип – L
Формула для расчета нижнего ТПРП и верхнего ТПРП одна и та же, различны коэффициенты k и L, которые берутся из таблицы
Таблица 2
|
Гомологический ряд
|
ТПРП
|
k
|
L
|
|
Нормальные алканы
СН3-(СН2)n-СН3
|
Н
В
|
0,6957
0,7874
|
73,8
50,3
|
|
2-Метилалканы
СН3-СН-(СН2)n-СН3
|
Н
В
|
0,6885
0,79
|
74,9
52,2
|
|
Нормальные алкены
СН2-СН-(СН2)n-СН3
|
Н
В
|
0,6867
0,7976
|
74,5
49,5
|
|
1-Фенилалканы
С6Н5-(СН2)n-СН3
|
Н
В
|
0,6751
-
|
70,2
-
|
|
Нормальные спирты
СН3-(СН2)n-ОН
|
Н
В
|
0,5746
0,6928
|
33,7
15,0
|
|
Изоспирты
(СН3)2-СН (СН2)n-ОН
|
Н
В
|
0,6582
0,7278
|
44,1
21,5
|
|
Сложные эфиры муравьиной кислоты НСОО-(СН2)n-СН3
|
Н
В
|
0,5359
0,6050
|
47,6
25,0
|
|
Сложные эфиры уксусной кислоты
СН3СОО-(СН2)n- СН3
|
Н
В
|
0,5940
0,7761
|
50,9
40,8
|
|
Первичные амины
СН3-NH2
|
Н
В
|
0,5004
-
|
54,6
-
|
13. Определение времени образования минимальной взрывоопасной концентрации паров
Расчет времени образования взрывопасных концентраций проводиться для оценки пожароопасной обстановки в помещении в результате розлива горючих жидкостей. Для этого применяются следующие формулы:
[с],
где т - масса жидкости, которая должна испариться для образования концентрации паров равной н в г/м3.
S – площадь поверхности испарения [м2];
Wисп - скорость испарения [кг/м2·с]
где Vп – объем помещения, в котором находятся пары жидкости;
- нижний КПРП в г/м3 или кг/м3, рассчитывается по формулам или берется из справочной литературы.
РЕШЕНИЕ
1. Стехиометрический коэффициент , с написанием уравнения реакции горения.
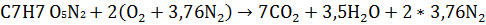
Ответ: = 2
2. Количество воздуха, необходимое для горения
м3
м3
Ответ: 121,08 м3
3. Объем продуктов горения
м3
О2= ( -1)=3 к Моль
N2=3,76 ( -1)=11,28 к Моль
ni=2+3.76 + 3 +11,28= 20,4 к Моль
Ответ: 70,66 м3
4. Высшая и низшая теплота сгорания
Qв = 339С+1256Н-109(О+N-S) = 339·98+1256·9-109(94+33) = 30683 кДж/кг
Qн = 339С+1256Н-109(О+N-S)-25(9H+W) = 399+1256-109(94+33)-25(9·9)=28658 кДж/кг
С7 - 84 кг–
H7 – 7кг –
О5 – 80кг-
N2 – 28кг-
Ответ:30683 кДж/кг, 28658 кДж/кг
5. Предельно допустимая взрывобезопасная концентрация
ПДВК = н · Кб = не считаем как твердое вещество.
6. Нижний и верхний концентрационные пределы
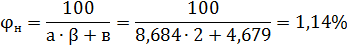
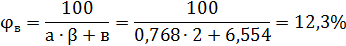
Перерасчет концентрационных пределов для температуры 64
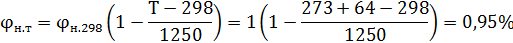
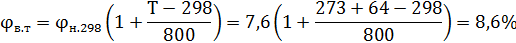
Ответ: 0,95%, 8,6%
7. Перерасчет НКПРП в г/м3
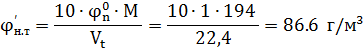
Ответ: 86,26 г/м3
8.Коэффициент горючести
К = 4nC + 4nS + nН + nN – 2nO– 2nCl – 3nF – 5nBr = 4 · 7+ 7+2 = 37
Ответ: 37
9. Температура вспышки
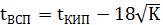
Не считаем как твердое вещество
10. Нижний и верхний температурные пределы распространения пламени
tв k·tкип – L
tн k·tкип – L
11. Плотность паров по воздуху
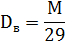
12. Стехиометрическая концентрация
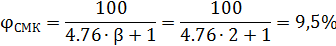
Ответ: 9,5%
13. Определение времени образования минимальной взрывоопасной концентрации
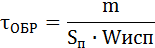
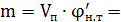
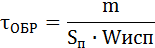
ЗАКЛЮЧЕНИЕ
В курсовой работе я рассчитал некоторые параметры горения вещества динитрокрезол (C7H7O5 N2): количество воздуха, необходимое для горения вещества, объем продуктов горения, теплота сгорания, предельно допустимая взрывобезопасная концентрация, концентрационные пределы распространения пламени, температура вспышки, температурные пределы распространения пламени, плотность паров, коэффициент горючести. Эти данные необходимы для разработки мер предотвращения возникновения пожаров и взрывов, а так же для оценки условий их развития и подавления.
СПИСОК ЛИТЕРАТУРЫ
1. Абдурагимов И. М., Андросов А. С., Исаева Л. К., Крылов Е. В. Процессы горения. – М.: Химия – 2012, 250 с.
2. Баратов А. Н. Горение – Пожар – Взрыв – Безопасность. – М.: ФГУ ВНИИПО МЧС России, 2008. – 364 с.
3. Варнатц Ю., Маас У., Диббл Р. Горение. Физические и химические аспекты, моделирование, эксперименты, образование загрязняющих веществ. – М.: ФИЗМАТЛИТ, 2009. – 352 с.
4. Горшков В.И. Тушение пламени горючих жидкостей. – М.: Пожнаука, 2008. – 268 с.
5. Горшков В.И. Самовозгорание веществ и материалов. – М.: ФГУ ВНИИПО МЧС России, 2009. – 446 с.
6. Демидов П.Г., Шандыба В.Н., Щеглов П.П. Горение и свойства горючих веществ. – М.: Химия – 2012, 230 с.
7. Дурнев В. Д., Сапунов С. В., Федюкин В. К. Товароведение промышленных материалов. – М.: Информационно-издательский дом «Филинъ», 2008. – 536 с.
8. Коробкин В. И., Передельский Л. В. Экология. – Ростов н/Д.: «Феникс», 2009. – 576 с.
9. Корольченко А. Я., Корольченко Д. А. Пожаровзрывоопасность веществ и материалов и средства их тушения. Справочник: в 2-х ч. – М.: Асс. «Пожнаука», 2008. – Ч. I. – 713 с., - Ч. II. – 774 с.
10. Корольченко А. Я. Процессы горения и взрыва. – М.: Пожнаука, 2012 – 266 с.
11. Методика определения условий теплового самовозгорания веществ и материалов. – М.: ВНИИПО, 2008. – 67 с.
12. Расчет основных показателей пожаровзрывоопасности веществ и материалов: Руководство. – М.:ВНИИПО, 2009.- 77с.
13. Семенова Е. В., Кострова В. Н., Федюкина У. В. Химия. – Воронеж: Научная книга. – 2008, 284 с.
14. Таубкин И. М. Пожары и взрывы, особенности экспертизы. – М.: Химия – 2009, 150 с.
15. Теребнев В. В. Справочник руководителя тушения пожара. – М.: ИБС-Холдинг, 2009. – 225 с.
PAGE \* MERGEFORMAT1
Расчет и анализ параметров горения вещества динитрокрезола