РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ
Лекция 17
РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ
Реакции гиперчувствительности могут быть классифицирова�ны на основе иммунологических механизмов, их вызывающих.
При реакциях гиперчувствительности I типа иммунный ответ сопровождается высвобождением вазоактивных и спазмогенных веществ, которые действуют на сосуды и гладкие мышцы, нару�шая таким образом их функции.
При реакциях гиперчувствительности II типа гуморальные ан�титела непосредственно участвуют в повреждении клеток, делая их восприимчивыми к фагоцитозу или лизису.
При реакциях гиперчувствительности III типа (иммунокомп-лексных болезнях) гуморальные антитела связывают антигены и активируют комплемент. Фракции комплемента затем привлека�ют нейтрофилы, которые вызывают повреждение ткани.
При реакциях гиперчувствительности IV типа возникает по�вреждение ткани, причиной которого является патогенный эф�фект сенсибилизированных лимфоцитов.
194
РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ I ТИПА -АНАФИЛАКТИЧЕСКИЕ РЕАКЦИИ
Реакции гиперчувствительности I типа бывают системными и местными. Системная реакция развивается обычно в ответ на внутривенное введение антигена, к которому организм хозяина уже сенсибилизирован. При этом часто спустя несколько минут развивается шоковое состояние, которое может стать причиной смерти. Местные реакции зависят от места, в которое попадет антиген, и носят характер локализованного отека кожи (кожная аллергия, крапивница), выделений из носа и конъюнктивы (ал-лергический ринит и конъюнктивит), сенной лихорадки, бронхи�альной астмы или аллергического гастроэнтерита (пищевая ал-лергия).
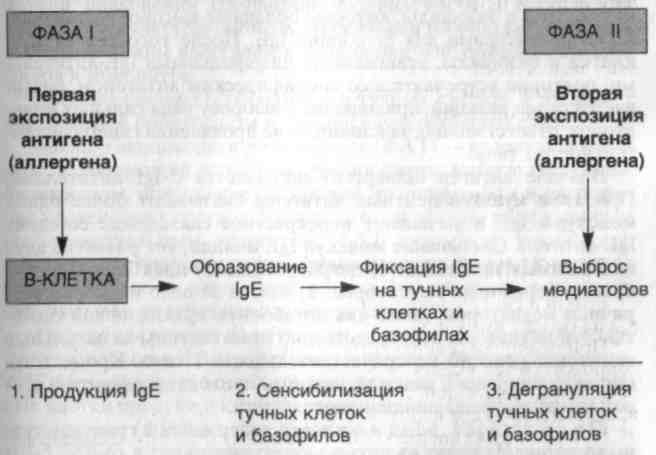
Схема 25. Реакции гиперчувствительности I типа — анафилактические реакции
Известно, что реакции гиперчувствительности I типа прохо�дят в развитии две фазы (схема 25). Первая фаза инициального ответа характеризуется расширением сосудов и повышением их проницаемости, а также, в зависимости от локализации, спазмом гладкой мускулатуры или секрецией желез. Эти признаки появ�ляются через 5—30 мин после экспозиции аллергена. Во многих Случаях вторая (поздняя) фаза развивается через 2—8 ч, без до-
195
полнительной экспозиции антигена и продолжается несколько дней. Эта поздняя фаза реакции характеризуется интенсивной ин�фильтрацией эозинофилами, нейтрофилами, базофилами и мо�ноцитами, а также деструкцией ткани в виде повреждения эпите�лиальных клеток слизистых оболочек.
Тучные клетки и базофилы играют главную роль в развитии реакций гиперчувствительности I типа; они активируются по�средством перекрестно реагирующих высокоаффинных рецепто�ров к IgE. Кроме того, тучные клетки активируются компонента�ми комплемента С5а и СЗа (анафилатоксины), а также цитокина-ми макрофагов (интерлейкин-8), некоторыми лекарственными веществами (кодеин и морфин) и физическими воздействиями (тепло, холод, солнечный свет).
У человека реакции гиперчувствительности I типа вызывают�ся иммуноглобулинами класса IgE. Аллерген стимулирует про�дукцию IgE В-лимфоцитами в основном в слизистых оболочках в месте попадания антигена и в регионарных лимфатических узлах. IgE-антитела, образованные в ответ на аллерген, атакуют туч�ные клетки и базофилы, которые обладают высокочувствитель�ными рецепторами для Fc-порции IgE. После того как тучные клетки и базофилы, атакованные цитофильными IgE-антитела-ми, повторно встречаются со специфическим антигеном, разви�вается серия реакций, приводящая к выбросу ряда сильных меди�аторов, ответственных за клинические проявления гиперчувстви-тельности I типа.
Вначале антиген (аллерген) связывается с IgE-антителами. При этом мультивалентные антигены связывают более одной молекулы IgE и вызывают перекрестное связывание соседних IgE-антител. Связывание молекул IgE инициирует развитие двух независимых процессов: 1) дегрануляцию тучных клеток с вы�бросом первичных медиаторов; 2) синтез de novo и выброс вто�ричных медиаторов, таких как метаболиты арахидоновой кисло�ты. Эти медиаторы непосредственно ответственны за начальные симптомы реакций гиперчувствительности I типа. Кроме того, они включают цепь реакций, которые приводят к развитию вто�рой (поздней) фазы инициального ответа.
Первичные медиаторы содержатся в гранулах туч�ных клеток. Их делят на четыре категории. - Биогенные амины включают гистамин и аденозин. Гистамип вызывает выраженный спазм гладкой мускулатуры бронхов, уси�ление сосудистой проницаемости, интенсивную секрецию носо�вых, бронхиальных и желудочных желез. Аденозин стимулирует тучные клетки к выбросу медиаторов, вызывающих бронхоспазм и торможение агрегации тромбоцитов.
- Медиаторы хемотаксиса включают эозинофильный хемо-таксический фактор и нейтрофильный хемотаксический фактор.
- Ферменты содержатся в матриксе гранул и включают проте-азы (химаза, триптаза) и некоторые кислые гидролазы. Фермен�ты вызывают образование кининов и активацию компонентов комплемента (СЗа), воздействуя на их предшественников, - Протеогликан — гепарин.
Вторичные медиаторы включают два класса со�единений; липидные медиаторы и цитокины. - Липидные медиаторы образуются благодаря последователь�ным реакциям, происходящим в мембранах тучных клеток и при-водящим к активации фосфолипазы А2. Она воздействует на фосфолипиды мембран, вызывая появление арахидоновой кис-лоты. Из арахидоновой кислоты в свою очередь образуются лей-котриены и простагландины.
Лейкотриены играют исключительно важную роль в патоге�незе реакций гиперчувствительности I типа. Лейкотриены С4 и D4 — самые сильные из известных вазоактивных и спазмогенных агентов. Они действуют в несколько тысяч раз активнее гистами-на при повышении сосудистой проницаемости и сокращении гладкой мускулатуры бронхов. Лейкотриен В4 обладает сильным хемотаксическим действием в отношении нейтрофилов, эозино-филов и моноцитов.
Простагландин D2 образуется в тучных клетках и вызывает интенсивный бронхоспазм и повышенную секрецию слизи.
Фактор активации тромбоцитов (ФАТ) — вторичный меди�атор, вызывающий агрегацию тромбоцитов, выброс гистамина, бронхоспазм, повышение сосудистой проницаемости и расшире�ние кровеносных сосудов. Кроме того, он обладает выраженным провоспалительным эффектом. ФАТ оказывает токсическое действие в отношении нейтрофилов и эозинофилов. В высоких концентрациях он активирует клетки, участвующие в воспале�нии, вызывая их агрегацию и дегрануляцию. - Цитокины играют важную роль в патогенезе реакций гипер�чувствительности I типа благодаря их способности рекрутиро-вать и активировать воспалительные клетки. Полагают, что туч�ные клетки продуцируют ряд цитокинов, включая фактор некро-»а опухоли а (ФНО-а), интерлейкины (ИЛ-1, ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6) и гранулоцитарно-макрофагальный колониестиму-лирующий фактор (ГМ-КСФ). В экспериментальных моделях по�казано, что ФНО-а является важным медиатором lgE-зависи-мых кожных реакций. ФНО-а считают сильным провоспали�тельным цитокином, который может привлекать нейтрофилы и эозинофилы, способствуя их проникновению через стенки сосу�дов и активируя их в тканях. Наконец, ИЛ-4 необходим для рек�рутирования эозинофилов. Воспалительные клетки, накаплива�ющиеся в местах развития реакции гиперчувствительности I ти-
196
197
па, являются дополнительным источником цитокинов и гнета�минвысвобождающих факторов, которые вызывают дальней�шую дегрануляцию тучных клеток.
Таким образом, гистамин и лейкотриены быстро выделяются из сенсибилизированных тучных клеток и ответственны за не�медленно развивающиеся реакции, характеризующиеся отеком, секрецией слизи, спазмом гладкой мускулатуры. Многие другие медиаторы, представленные лейкотриенами, ФАТ и ФНО-а. включаются в позднюю фазу ответа, рекрутируя дополнитель�ное количество лейкоцитов — базофилов, нейтрофилов и эози-нофилов.
Среди клеток, которые появляются в позднюю фазу реакции, особенно важны эозинофилы. Набор медиаторов в них столь же велик, как и в тучных клетках. Таким образом, дополнительно рекрутированные клетки усиливают и поддерживают воспали�тельный ответ без дополнительного поступления антигена.
Регуляция реакций гиперчувствительности I тина цитокина-ми. Во-первых, особую роль в развитии реакций гиперчувстви�тельности I типа играет IgE, секретируемый В-лимфоцитами в присутствии ИЛ-4, ЙЯ-5 и ИЛ-6, причем ИЛ-4 абсолютно необ�ходим для превращений IgE-нродуцирующих В-клеток. Склон ность некоторых антигенов вызывать аллергические реакции от части обусловлена их способностью активировать Т-хелперы-2 (Th-2). Наоборот, некоторые цитокпны. образованные Т-хелпе-рами-1 (Th-I), например гамма интерферон (ИНФ-у). снижают синтез IgE. Во-вторых, особенностью реакций пшерчувствитель-ности I типа является повышенное содержание тучных клеток в тканях, рост и дифференциронка которых зависят от некоторых ЦИТОКИНОВ, включая ЙЛ-3 и ИЛ-4. В-третьих, ИЛ-5, выделяемый Th-2, исключительно важен для образования эозинофилов из их предшественников. Он также активирует зрелые эозинофилы.
Системная и местная анафилаксия
Системная анафилаксия возникает после введения гетероло-гичных белков, например антисывороток, гормонов, ферментов, полисахаридов и лекарственных веществ. Тяжесть заболевания зависит от уровня сенсибилизации. Шоковая доза антигена, одна�ко, может быть исключительно мала. Например, для кожного те�стирования различных форм аллергии достаточно минимального количества антигена. Спустя несколько минут после экспозиции появляются зуд, крапивница и кожная эритема, затем через ко�роткое время развивается спазм респираторных бронхиол и поя�вляется респираторный дистресс. Рвота, спазмы в животе, понос и обструкция гортани могут закончиться шоком и смертью боль�ного. На вскрытии в одних случаях обнаруживаются отек и кро-
воизлияние в легких, тогда как в других — острая эмфизема лег�ких с расширением правого желудочка сердца.
Местную анафилаксию называют атопической аллергией. Около 10 % населения страдает от местной анафилаксии, возни�кающей в ответ на попадание в организм аллергенов: пыльцы растений, перхоти животных, домашней пыли и т.п. К заболева�ниям, в основе которых лежит местная анафилаксия, относят крапивницу, ангионевротический отек, аллергический ринит (сенная лихорадка) и некоторые формы астмы. Существует се�мейная предрасположенность к этому типу аллергии.
РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ II ТИПА -ЦИТОТОКСИЧЕСКИЕ РЕАКЦИИ
При реакциях гиперчувствительности II типа в организме по�являются антитела, которые направлены против антигенов, рас�положенных на поверхности клеток или других компонентов тканей. Антигенные детерминанты могут быть связаны с клеточ�ной мембраной или представляют собой экзогенный антиген, ад�сорбированный на поверхности клеток. В любом случае реакция гиперчувствительности возникает как следствие связывания ан�тител с нормальными или поврежденными антигенами на по�верхности клетки. Описаны три антителозависимых механизма развития реакции этого типа.
Комплементзависимые реакции (схема 26). Существует два механизма, с помощью которых антитело и комплемент могут вызывать реакции гиперчувствительности II типа: прямой лизис и опсонизация. В первом случае антитело (IgM или IgG) реагиру�ет с антигеном на поверхности клетки, вызывая активацию сис�темы комплемента и приводя в действие мембраноатакующий комплекс, который нарушает целостность мембраны, "продыря�вливая" липидный слой. Во втором случае клетки сенсибилизи�рованы к фагоцитозу посредством фиксации антитела или СЗЬ — фрагмента комплемента к поверхности клетки (опсонизация). При этом варианте реакции гиперчувствительности II типа чаще всего затрагиваются клетки крови (эритроциты, лейкоциты и тромбоциты), но антитела могут быть направлены также против внеклеточных структур, например против гломерулярной ба-зальной мембраны.
Клинически такие реакции возникают в следующих случаях: - при переливании несовместимой крови, когда клетки донора реагируют с антителами хозяина;
- при эритробластозе плода, когда имеются антигенные разли�чия между матерью и плодом, а антитела (IgG) матери, проникая сквозь плаценту, вызывают разрушение эритроцитов плода;
198
199
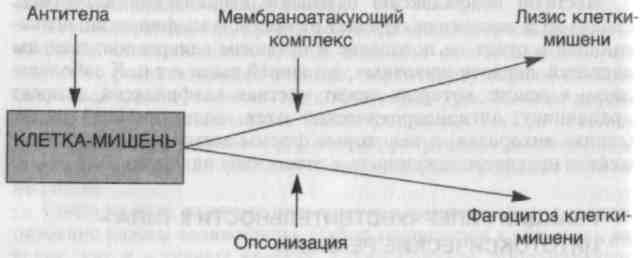
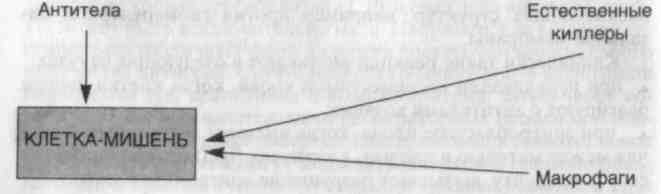
Схема 26. Реакция гиперчувствительности II типа — комплементзависимые реакции
200
- при аутоиммунной гемолитической анемии, агранулоцитозе и тромбоцитопении, когда происходит образование антител против собственных клеток крови, которые затем разрушаются; - при некоторых реакциях на лекарства образующиеся антите�ла реагируют с препаратами, образуя комплексы с эритроцитар-ным антигеном.
Антителозависимая связанная с клетками цитотоксичность (схема 27) не сопровождается фиксацией комплемента, однако вызывает кооперацию лейкоцитов. Клетки-мишени, покрытые IgG-антителами в низких концентрациях, уничтожаются несенси-билизированными клетками, которые обладают Fc-рецепторами. Несенсибилизированные клетки связывают клетки-мишени ре�цепторами для Fc-фрагмента IgG, а лизис клеток происходит без фагоцитоза. В этом виде цитотоксичности участвуют моноциты, нейтрофилы, эозинофилы и естественные киллеры (NK). Хотя в большинстве случаев в данном типе реакции участвуют антитела IgG; иногда (например, при связанной с эозинофилами цитоток�сичности против паразитов) задействованы IgE-антитела. Этот вид цитотоксичности также имеет значение при реакции оттор�жения трансплантата.
Схема 27. Реакция гиперчувствительности II типа — антитело-зависимая связанная с клетками цитотоксичность
Антителоопосредованная клеточная дисфункция. В некото�рых случаях антитела, направленные против рецепторов на по-верхности клеток, нарушают их функционирование, не вызывая повреждения клеток или развития воспаления. Например, при миастении антитела вступают в реакцию с ацетилхолиновыми рецепторами в двигательных концевых пластинках скелетных мышц, нарушая нервно-мышечную передачу и вызывая таким образом мышечную слабость. Наоборот, при антителоопосредо-ванной стимуляции функций клетки развивается базедова бо-лезнь. При этом заболевании антитела против рецепторов тирео-тропного гормона на эпителиальных клетках щитовидной желе-зы стимулируют клетки, что приводит к гипертиреозу. Этот же механизм лежит в основе реакций инактивации и нейтрализации.
РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ III ТИПА -ИММУНОКОМПЛЕКСНЫЕ РЕАКЦИИ
Развитие реакций гиперчувствительности III типа вызывают комплексы антиген — антитело, которые повреждают ткань в связи с их способностью активировать различные медиаторы сы�воротки крови, главным образом систему комплемента (схема 28). Токсическая реакция возникает тогда, когда антиген связы�вается с антителом или в кровеносном русле (циркулирующие иммунные комплексы), или вне сосудов, где антиген может осаж�даться (иммунные комплексы in situ). Отдельные формы гломе-рулонефрита, при которых иммунные комплексы образуются in situ, начинаются с имплантации антигена в гломерулярную ба-зальную мембрану. Комплексы, образованные в кровотоке, вы�зывают повреждение тогда, когда они попадают в стенки крове�носных сосудов или оседают в фильтрующих структурах, таких как гломерулярный фильтр. Образование комплексов антиген — антитело еще не означает болезнь, так как они встречаются при многих иммунных процессах и могут представлять собой нор�мальный механизм элиминации антигена.
Известны два типа иммунокомплексных повреждений: 1) при поступлении в организм экзогенного антигена (чужеродный бе�лок, бактерия, вирус) и 2) при образовании антител против собст�венных антигенов (эндогенные). Заболевания, развитие которых обусловлено иммунными комплексами, могут быть генерализо�ванными, если иммунные комплексы образуются в крови и осе�дают во многих органах, или местными, когда иммунные компле�ксы локализованы в отдельных органах, таких как почки (гломе-рулонефрит), суставы (артрит) или мелкие кровеносные сосуды кожи (местная реакция Артюса).
201
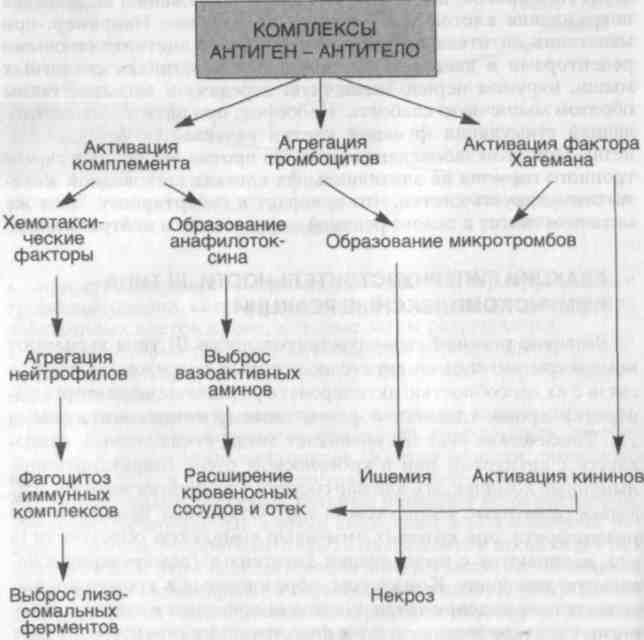
Схема 28. Реакции гиперчувствительности III типа — иммунокомплексные реакции
Системная и местная иммунокомплексная болезнь
Системная иммунокомплексная болезнь. Одной из ее разно�видностей является острая сывороточная болезнь, которая часто возникает в результате многократного введения большого коли�чества чужеродной сыворотки крови, используемой для пассив�ной иммунизации.
Патогенез системной иммунокомплексной болезни скла�дывается из трех фаз:
- образование в крови комплексов антиген — антитело; - осаждение иммунных комплексов в различных тканях; - воспалительная реакция в разных частях тела.
202
Первая фаза начинается с попадания антигена в кровь и его взаимодействия с иммунокомпетентными клетками, приводяще�го к образованию антител. Приблизительно через 5 дней после введения сыворотки вырабатываются антитела против ее компо�нентов, которые, еще находясь в кровотоке, образуют комплек�сы антиген — антитело. Во вторую фазу эти комплексы оседают в различных тканях. Дальнейшее течение болезни определяют два фактора: 1) размеры иммунных комплексов и 2) состояние системы моноцитарных фагоцитов (СМФ).
Очень крупные комплексы образуются при значительном из�бытке антител, быстро удаляются из кровотока клетками СМФ и относительно безвредны. Наиболее патогенны мелкие и средних размеров комплексы, которые образуются при незначительном избытке антител, дольше циркулируют и не так жадно захваты�ваются фагоцитирующими клетками.
В связи с тем что СМФ в норме разрушает циркулирующие иммунные комплексы, ее перегрузка или существенная дисфунк�ция увеличивает возможность персистенции иммунных комплек�сов в кровотоке и их осаждение в тканях.
Кроме того, такие факторы, как заряд иммунных комплексов (анионный или катионный полюс комплекса), валентность анти�гена, авидность антитела, аффинность антигена к компонентам различных тканей, трехмерная структура комплексов (решетка) и гемодинамические факторы, влияют на осаждение иммунных комплексов в тканях. Чаще всего иммунные комплексы оседают в почечных клубочках, а также в суставах, коже, сердце, сероз�ных оболочках и мелких кровеносных сосудах.
Для того чтобы комплексы покинули систему кровообраще�ния и осели в тканях, должна увеличиться проницаемость сосуди�стого русла. Во-первых, IgE-антитела, образовавшиеся вскоре после поступления в кровь антигена, связываются с циркулирую�щими базофилами, и происходит выброс гистамина и ФАТ. Эти медиаторы раздвигают эндотелиальные клетки, и иммунные комплексы проходят сквозь стенку сосудов. Как только иммун�ные комплексы оседают в тканях, они вызывают острую воспа�лительную реакцию. В эту фазу (приблизительно через 10 дней после введения антигена) наблюдаются клинические проявления болезни, такие как лихорадка, крапивница, артралгии, увеличе�ние лимфатических узлов и протеинурия. Вслед за осаждением иммунных комплексов происходит активация системы компле�мента с образованием его биологически активных компонентов.
Активация системы комплемента сопровождается провоспа-лительными эффектами: выбросом СЗb-опсонина, способствую�щего фагоцитозу; образованием хемотаксических факторов, вы�зывающих миграцию полиморфно-ядерных лейкоцитов и моно�цитов (С5, С5b67); выбросом анафилотоксинов (СЗа и С5а), кото-
203
рые увеличивают проницаемость сосудов и вызывают сокраще�ние гладких мышц; образованием мембраноатакующего компле�кса (С5—9), вызывающего разрушение клеточных мембран и ци�толиз.
Фагоцитоз комплексов антиген — антитело лейкоцитами при�водит к выбросу или образованию различных дополнительных провоспалительных веществ, включая простагландины, сосудо�расширяющие белки и хемотаксические вещества, например не�которые лизосомальные ферменты, в том числе протеазы, спо�собные растворять базальную мембрану, коллаген, эластин и хрящ. Повреждение тканей опосредуется также свободными ра�дикалами кислорода, продуцируемыми активированными ней-трофилами.
Иммунные комплексы вызывают агрегацию тромбоцитов и активацию фактора Хагемана, что приводит к усилению воспа�лительного процесса и образованию микротромбов. В результа�те развиваются васкулит, гломерулонефрит, артрит и т.п.
Все эти повреждения возникают при участии комплементсвя-занных антител (IgG и IgM). Однако, так как IgA может активи�ровать комплемент по альтернативному пути, IgA-содержащие комплексы также могут вызывать тканевые повреждения. Важ�ная роль комплемента в патогенезе тканевых повреждений под�тверждается наблюдением, что истощение комплемента в сыво�ротке крови (в эксперименте) обычно уменьшает выраженность повреждений.
В морфологической картине иммунокомплексного поврежде�ния доминирует острый некротизирующий васкулит с образова�нием фибриноида и экссудацией нейтрофилов. Например, пора�женные клубочки почки всегда увеличены вследствие набухания и пролиферации эндотелиальных и мезангиальных клеток, ин�фильтрации нейтрофилами и моноцитами. При иммунофлюорес-центной микроскопии иммунные комплексы видны в виде грану�лярных депозитов иммуноглобулина и комплемента, а под элек�тронным микроскопом — в виде электронно-плотных депозитов вдоль гломерулярной базальной мембраны. Если заболевание возникает после разовой массивной экспозиции антигена, напри�мер при остром постстрептококковом гломерулонефрите и ост�рой сывороточной болезни, то все повреждения имеют тенден�цию к разрешению благодаря катаболизму иммунных комплек�сов.
Для развития хронической иммунокомплексной болезни необ�ходима постоянная антигенемия, так как иммунные комплексы чаще всего оседают в сосудистом русле. Это наблюдается при не�которых заболеваниях, таких, как системная красная волчанка, которая обусловлена персистенцией аутоантигенов. Часто, одна�ко, несмотря на наличие характерных морфологических измене-
ний и других признаков, свидетельствующих о развитии иммуно�комплексной болезни, антиген остается неизвестным, например при ревматоидном артрите, узелковом периартериите, мембра-нозном гломерулонефрите и некоторых васкулитах.
Местная иммунокомплексная болезнь. Ее еще называют ре�акцией Артюса. Она заключается в местном некрозе ткани, воз�никающем вследствие острого иммунокомплексного васкулита. Реакцию можно вызвать в эксперименте путем внутрикожного введения антигена иммунному животному, которое имеет цирку�лирующие антитела против антигена. Вследствие избытка анти�тел, когда антиген проникает в стенки сосудов, образуются круп�ные иммунные комплексы, которые вызывают воспалительную реакцию. В отличие от IgE-опосредованных реакций гиперчувст�вительности 1 типа, которые возникают немедленно, реакция Ар�тюса развивается в течение нескольких часов и достигает пика через 4—10 ч после инъекции. При иммунофлюоресцентном ок�рашивании удается выявить комплемент, иммуноглобулины и фибриноген, осажденные в стенках сосудов, обычно венул; при светооптическом исследовании — фибриноидный некроз сосу�дов. Разрыв сосудов приводит к возникновению кровоизлияний, но чаще наблюдается тромбоз, способствующий развитию мест�ных ишемических повреждений.
РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ IV ТИПА -ИММУНОКЛЕТОЧНЫЕ РЕАКЦИИ
Реакции гиперчувствительности IV типа вызывают специфи�чески сенсибилизированные Т-лимфоциты. К реакциям этого ти�па относятся классические замедленные реакции гиперчувстви�тельности, вызываемые СD4+Т-лимфоцитами, и прямая клеточ�ная цитотоксичность, опосредованная СD8+Т-лимфоцитами. Это основной тип иммунного ответа на различные внутриклеточные патогенные агенты, особенно микобактерии туберкулеза, а так�же на многие вирусы, грибы, простейшие и паразиты. Другими примерами являются контактная кожная чувствительность к хи�мическим веществам и реакция отторжения. Описаны два вари�анта реакций гиперчувствительности IV типа.
Гиперчувствительность замедленного типа (схема 29). Хоро�шо известным примером такого варианта является реакция на введенный внутрикожно туберкулин — белково-липополисаха-ридный компонент микобактерии туберкулеза. У сенсибилизиро�ванного пациента через 8—12 ч возникают покраснение и уплот�нение в месте введения, а пик реакции наступает через 24—72 ч. У сильно сенсибилизированных больных в месте инъекции мо�жет развиться некроз. Гиперчувствительность замедленного ти�па (ГЗТ) характеризуется накоплением мононуклеарных клеток
204
205
в дерме и подкожной основе (подкожно-жировая клетчатка). Наблюдается преимущественное накопление клеток вокруг мел�ких вен и венул с образованием характерных периваскулярных манжеток. Увеличение сосудистой проницаемости сопровожда�ется образованием пор между эндотелиальными клетками. Вы�ход белков плазмы за пределы сосудистого русла увеличивает отек дермы и сопровождается оседанием фибрина в интерстиции. С помощью иммунопероксидазного метода в участках поврежде�ний обнаруживается преобладание СD4+Т-лимфоцитов-хелпе-ров.
Схема 29. Реакции гиперчувствительности IV типа — гиперчувствительность замедленного типа
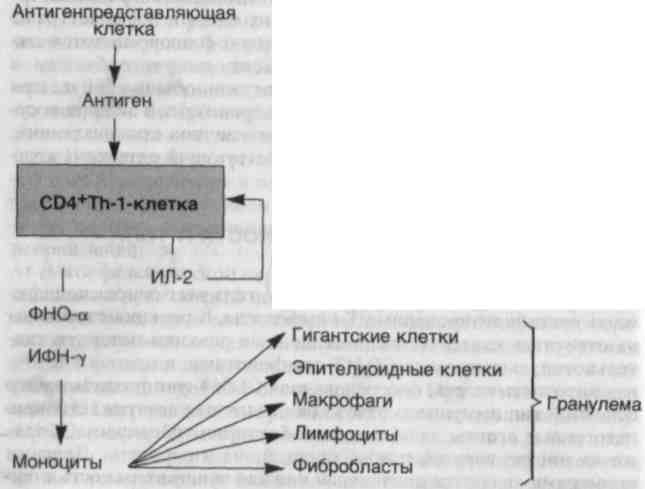
При персистенции антигена макрофаги часто трансформиру�ются в эпителиоидныс клетки, которые окружает вал из лимфо�цитов — формируется гранулема. Такой тип воспаления характе�рен для реакций гиперчувствительности IV типа и называется гранулематозным воспалением.
Последовательность событий при ГЗТ можно рассмотреть на примере туберкулиновой реакции, которая начинается с первой встречи индивидуума с микобактериями туберкулеза. CD4+T-лимфоциты распознают белки туберкулезной микобактерии, связанные с молекулами II класса на поверхности моноцитов или
206
других антигенпредставляющих клеток. Эта первая встреча вы�зывает дифференцировку СD4+Т-клеток в Th-1-клетки. Образо-вание Th-1-клеток является важным звеном в патогенезе ГЗТ, так как ее дальнейшее развитие зависит от цитокинов, которые секретируются Th-1-клетками. У неиммунизированного хозяина микроорганизмы впервые подвергаются атаке макрофагами, что приводит в некоторых случаях к продукции ИЛ-12. Этот цитокин регулирует дифференцировку СD4+Т-клеток в Th-1. Таким обра-зом, развитие ГЗТ может быть связано с продукцией ИЛ-12. Сен�сибилизированные Th-1-клетки поступают в кровоток и остают�ся там длительное время, иногда годами. В ответ на инъекцию ту�беркулина индивидууму, который имел раньше контакт с мико-бактериями туберкулеза, сенсибилизированные Th-1 -клетки вза�имодействуют с антигеном на поверхности антигенпредставляю�щих клеток и активируются, например подвергаются блаеттранс-формации и пролиферации. Эти изменения сопровождаются сек�рецией цитокинов, ответственных за ГЗТ.
ИФН-у является наиболее важным медиатором ГЗТ и силь�ным активатором макрофагов. Активированные макрофаги об�ладают способностью к фагоцитозу и уничтожают микроорга�низмы. На поверхности макрофагов имеются молекулы II клас�са, с помощью которых они способствуют представлению анти�гена. Возрастает их активность, направленная на элиминацию опухолевых клеток. Макрофаги секретируют некоторые поли-пептидные факторы роста, такие как тромбоцитарный фактор роста и трансформирующий фактор роста. Последний стимули�рует пролиферацию фибробластов и усиливает синтез коллаге�на. Таким образом, активированные макрофаги обеспечивают элиминацию антигена, а если активация продолжается, то спо�собствуют развитию фиброза и его отграничению.
ИЛ-2 вызывает аутокринную и паракринную пролиферацию Т-клеток, которые аккумулируются в местах развития ГЗТ, при�чем включение в инфильтрат антигенспецифических CD4+T-лимфоцитов активируется ИЛ-2.
ФНО-а и лимфотоксин являются цитокинами, оказывающи�ми воздействие на эндотелиальные клетки. Повышенная секре�ция простациклина эндотелиальными клетками приводит к уве�личению кровотока в результате вызываемого им расширения сосудов. Наблюдается усиление экспрессии адгезивной молекулы Е-селектина (ELAM-1), что способствует прикреплению при�шлых лимфоцитов и моноцитов. Происходит усиление секреции низкомолекулярных хемотаксических факторов, например ИЛ-8. Все эти изменения в эндотелии способствуют выходу лимфоци-
тов моноцитов за пределы сосудистого русла в места развития реакции ГЗТ. ФНО-а также играет важную роль в образовании гранулем. 207
Этот тип гиперчувствительности является главным механиз�мом защиты от различных внутриклеточных патогенных аген�тов, включая микобактерии, грибы и некоторых паразитов, а также может участвовать в отторжении трансплантата и опухо�левом иммунитете.
Цитотоксичность, опосредованная Т-лимфоцитами. При дан�ной цитотоксичности сенсибилизированные СD8+Т-лимфоциты уничтожают клетки-мишени, которые являются носителями ан�тигена. Такие эффекторные клетки называют цитотоксически-ми Т-лимфоцитами (ЦТЛ). Т-лимфоциты, направленные против антигенов гистосовместимости на поверхности клеток, играют важную роль в отторжении трансплантата. Они также участвуют в защите от вирусных инфекций. В клетках, пораженных виру�сом, вирусные пептиды связываются с молекулами I класса и в виде комплексов транспортируются к поверхности клетки. Этот комплекс распознается CD8+ЦТЛ. Лизис зараженных клеток за�вершается до репликации вируса, что приводит к уничтожению инфекции. Полагают, что многие опухолевые антигены также могут быть представлены на поверхности клеток, а ЦТЛ могут участвовать и в противоопухолевом иммунитете.
Отторжение трансплантата
В отторжении трансплантата принимают участие некоторые реакции гиперчувствительности (схема 30). Реакция отторжения зависит от распознавания хозяином пересаженной ткани как чу�жеродной. Антигенами, ответственными за такое отторжение у человека, являются антигены главного комплекса гистосовме�стимости (HLA). Отторжение трансплантата — сложный про�цесс, во время которого имеют значение как клеточный иммуни�тет, так и циркулирующие антитела.
Реакции, обусловленные Т-лимфоцитами. Активированные СD4+Т-хелперы участвуют в активации CD8+ ЦТЛ. Развитие ре�акций, опосредованных Т-лимфоцитами, происходит при встрече лимфоцитов реципиента с антигенами HLA донора. Полагают, что наиболее важными иммуногенами являются дендритические клетки в донорских органах. Т-клетки хозяина встречаются с дендритическими клетками в пересаженном органе, а затем миг�рируют в регионарные лимфатические узлы. Предшественники СD+ЦТЛ (прекиллеры Т-клеток), обладающие рецепторами к HLA-антигенам 1 класса, дифференцируются в зрелые ЦТЛ. Процесс дифференцировки сложен и не совсем понятен. В нем участвуют антигенпредставляющие клетки, Т-лимфоциты и ци-токины ИЛ-2, ИЛ-4 и ИЛ-5. Зрелые ЦТЛ лизируют пересажен�ную ткань. Кроме специфических ЦТЛ, образуются лимфокинсе-кретирующие СD4+Т-лимфоциты, которые играют исключи-
208
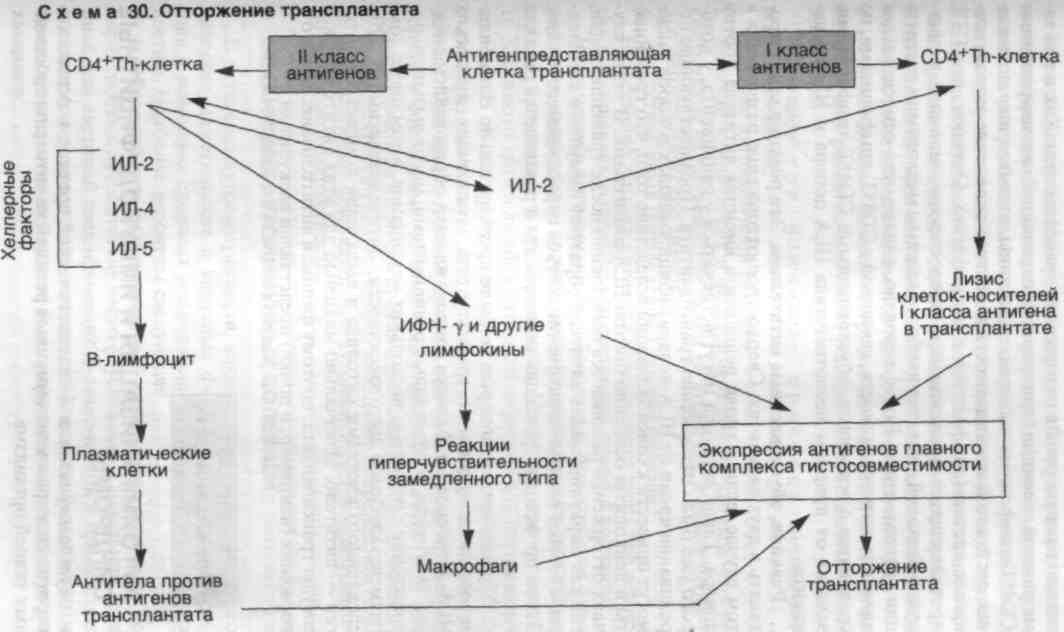
тельно важную роль в отторжении трансплантата. Как и при за�медленной реакции гиперчувствительности, активированные СD4+Т-лимфоциты выделяют цитокины, вызывающие повыше�ние сосудистой проницаемости и местное скопление мононукле-арных клеток (лимфоцитов и макрофагов). Считают, что ГЗТ, проявляющаяся повреждением микрососудов, ишемией и дест�рукцией тканей, является наиболее важным механизмом деструк�ции трансплантата. Более вероятно, однако, что относительная важность цитотоксичности, связанной с СD8+Т-лимфоцитами, по сравнению с реакциями, обусловленными СD4+Т-лимфоцитами, зависит от природы несоответствия HLA донора и HLA реци�пиента.
Реакции, обусловленные антителами. Эти реакции могут про�текать в двух вариантах. Сверхострое отторжение развивается в том случае, если в крови реципиента имеются антитела против донора. Такие антитела могут встречаться у реципиента, у кото�рого уже было отторжение трансплантата. Предшествующие пе�реливания крови от HLA-неидентифицированных доноров также могут привести к сенсибилизации вследствие того, что тромбоци�ты и лейкоциты особенно богаты HLA-антигенами. В таких слу�чаях отторжение развивается немедленно после трансплантации, так как циркулирующие антитела образуют иммунные комплек�сы, которые оседают в эндотелии сосудов пересаженного органа. Затем происходит фиксация комплемента и развивается реакция Артюса.
У реципиентов, которые не были предварительно сенсибили�зированы к антигенам трансплантата, экспозиция донорских HLA-антигенов 1 и II класса сопровождается образованием анти�тел. Антитела, образованные реципиентами, могут вызывать по�вреждение с помощью нескольких механизмов, в том числе ком-плементзависимой цитотоксичности, антителозависимого, обу�словленного клетками цитолиза и выпадения комплексов анти�ген — антитело. Изначально мишенью для этих антител служат сосуды трансплантата, поэтому феномен антителозависимого от�торжения (например, в почке) представлен васкулитом.
210
211
РЕАКЦИИ ГИПЕРЧУВСТВИТЕЛЬНОСТИ