Основні поняття і визначення технічної термодинаміки. Рівняння стану ідеальних газів. Суміші газів
PAGE 1
Л е к ц і я 1.1. Вступ. Основні поняття і визначення технічної термодинаміки. Рівняння стану ідеальних газів. Суміші газів.
Роль теплотехніки як науки та її теоретична база. Предмет та метод технічної термодинаміки. Термодинамічна система. Параметри стану однорідного робочого тіла. Рівноважний та нерівноважний стан термодинамічної системи. Термодинамічний процес. Час релаксації в реальному процесі. Оборотний і необоротний термодинамічний процес. Кругові процеси. Рівняння стану ідеальних газів. Газова стала та її фізичний зміст. Суміші газів та способи їх завдання. Закони Дальтона та Амага. Умовна молярна маса суміші. Рівнянням стану суміші
Джерела інформації: [1], с.5-17, 19-32, 54-56; [2], с7-17; [8], с.5-22, 27-29.
Роль теплотехніки як науки та її теоретична база. Предмет і метод технічної термодинаміки. Теплотехніка – наукова дисципліна та галузь техніки, яка охоплює методи отримання теплоти, перетворення її в інші види енергії, розподіл, транспортування, використання теплоти за допомогою теплових машин, апаратів і установок. Теоретичною базою теплотехніки є технічна термодинаміка та теплопередача.
Технічна термодинаміка вивчає закономірності взаємного перетворення теплоти у роботу, властивості тіл, які беруть участь у цих перетвореннях, а також теплові процеси, що протікають у різних теплових машинах, апаратах і установках.
За призначенням теплові машини поділяють на теплові двигуни (теплові установки) та холодильні установки. Тепловими двигунамим називають безперервно діючі пристрої, у яких відбувається перетворення теплоти в роботу. Теплові двигуни використовують природні енергетичні ресурси – хімічне або ядерне паливо. Теплові двигуни поділяють на поршневі, роторні та реактивні. Можливі комбінації цих двигунів, наприклад турбореактивний двигун. За способом підведення теплоти для нагрівання робочого тілі теплові двигуни поділяють на двигуни внутрішнього згоряння і зовнішнього згоряння (наприклад, двигун Стирлінга).
Теплові машини, які призначені для зниження температури тіл по відношенню до температури оточуючого середовища і безперервного підтримання цієї температури, називають холодильними установками. Ці ж машини, які використовуються для підвищення температурного рівня оточуючого середовища, називають трансформаторами теплоти, або тепловим насосами. Розрізняють компресорні холодильні машини, в яких відбувається стиснення робочого тіла (холодильного агента), холодильні машини, які споживають теплову енергію, та термоелектричні холодильні машини, основані на Пельтьє ефекті.
На основі технічної термодинаміки здійснюється розрахунок та проектування всіх теплових двигунів (поршневих двигунів внутрішнього згорання, парових та газових турбін, реактивних та ракетних двигунів), холодильних та компресорних машин, різноманітного технологічного обладнання, формуються методи прямого перетворення теплоти у електричну енергію, здійснюється аналіз ефективності термодинамічних циклів, процесів теплообміну, вивчаються термодинамічні властивості різних речовин.
Термодинаміка розглядає тільки макроскопічні системи, тобто такі матеріальні об’єкти, які складаються з великої кількості частинок. Розміри макроскопічних систем несумірно більше розмірів молекул та атомів. Розглядаючи макроскопічні системи, термодинаміка вивчає закономірності теплової форми руху матерії.
Сукупність кінетичної енергії мікрочастинок складає енергію теплового руху матерії, яка так само, як і механічна енергія, може передаватися від однієї частини матерії до іншої. Сукупність енергії теплового руху усіх мікрочастинок системи та енергії їх взаємодії складає внутрішню енергію системи. Перенесення енергії теплового руху відбувається при різниці температур частин матерії внаслідок їх зіткнення або безладних електромагнітних коливань.
Найважливішими поняттями термодинаміки є такі: внутрішня енергія U, робота L і теплота Q. Енергія взагалі це міра різних форм матеріального руху. Кожній формі руху відповідає певний вид енергії. Енергія, яка відповідає молекулярно-хаотичному руху, у термодинаміці називають внутрішньою енергією U. Складається вона з кінетичної енергії руху молекул і потенціальної енергії сил міжмолекулярної взаємодії. У загальному випадку до складу внутрішньої енергії входить ще енергія, яка відповідає внутрішньомолекулярній, внутрішньоатомній та внутрішньоядерній взаємодіям. У технічній термодинаміці ці останні складові внутрішньої енергії не враховуються.
Усі енергетичні взаємодії, внаслідок яких змінюється стан тіла, можна звести до двох форм. Перша форма зумовлена силовою механічною взаємодією одного тіла з іншим, що супроводжується видимим переміщенням тіл, і має назву робота L. При цьому кількість енергії, яка передається від одного тіла до іншого, у формі направленого руху зветься роботою процеса. Це може бути робота не тільки звичайних сил механічної природи, а також електричних, магнітних сил та інших.
Друга форма Q пов’язана з наявністю різниці температур і обумовлена хаотичним рухом безлічі мікрочастинок, з яких складаються макротіла. Обмін енергією у цьому випадку відбувається шляхом або безпосереднього стискання тіл, які мають різну температуру, або випромінюванням. Кількість переданої енергії у формі хаотичного руху мікрочастинок зветься теплотою процеса (теплотою) Q. Кількість роботи і теплоти виражається у тих одиницях, що і енергія, у джоулях.
Основу термодинаміки складають два фундаментальні закони. Перший закон термодинаміки установлює кількісні співвідношення у процесах взаємного перетворення енергії і є застосуванням загального закону збереження та перетворення енергії до теплових процесів. Цей закон пов’язаний з принципом еквівалентності теплоти і роботи. Другий закон термодинаміки характеризує напрям природних (необоротних) процесів і визначає якісну відмінність теплоти від інших форм передачі енергії. Цей закон пов’язаний з принципом існування ентропії.
У термодинаміці при вивченні фізичних властивостей макроскопічних систем використовують два методи: феноменологічний (термодинамічний) та статистичний. Феноменологічний метод не потребує залучення модельних уявлень про структуру речовини. Спираючись на математичне формулювання першого та другого законів термодинаміки, побудована теорія теплових процесів, яка отримала назву феноменологічної термодинаміки. Вона може передбачити кінцевий результат, не розкриваючи фізичну сутність та механізм теплових процесів. Статистичний метод ґрунтується на використанні теорії ймовірностей, законів механіки та певних моделях будови систем і становить зміст статистичної термодинаміки (статистичної фізики). Статистична термодинаміка (або молекулярно-кінетична теорія теплоти) дозволяє з’ясувати молекулярну сутність теплових явищ. При вивченні теплових явищ феноменологічна та статистична термодинаміки доповнюють одна іншу.
Термодинамічна система. Об’єктом вивчення у термодинаміці є різні термодинамічні системи, що являють собою сукупність матеріальних тіл, які можуть енергетично взаємодіяти між собою та навколишнім середовищем і обмінюватися з ним речовиною. Окремо взяте макротіло також можна розглядати як термодинамічну систему. Все, що знаходиться поза системою, зветься навколишнім середовищем. Поверхня, що відокремлює термодинамічну систему від навколишнього середовища, зветься контрольною. Термодинамічні системи бувають закриті, якщо у них відсутній обмін речовиною через контрольну поверхню, і відкриті, у яких обмін речовиною з навколишнім середовищем відбувається через контрольну поверхню. Система, яка не обмінюється енергією і речовиною з навколишнім середовищем, зветься ізольованою. Якщо система не обмінюється енергією у формі теплоти, то вона зветься адіабатною.
У технічній термодинаміці розглядають головним чином системи (тіла), за допомогою яких відбувається взаємоперетворення теплоти і роботи (процеси у теплових машинах). Це так звані робочі тіла. У якості робочих тіл, як правило, використовують гази та пари, які здатні значно змінювати свій об’єм при зміні зовнішніх умов. Різниці між газом і паром немає (газ розглядається як пара, що знаходиться далеко від стану зрідження, та навпаки, пара – як реальний газ, близький до стану зрідження). Якщо впливом сил взаємодії між молекулами і об’ємом самих молекул можна знехтувати (сильно нагрітий газ при невеликому тиску), такий газ зветься ідеальним, у протилежному стані – реальним.
Робоче тіло у тепловій машині одержує або віддає теплоту під час взаємодії з більш нагрітими або більш холодними зовнішніми тілами. Такі тіла звуться джерелами теплоти. Тіло, яке віддає теплоту робочому тілу і не змінює свою температур, зветься тепловіддавачем, а тіло, яке отримує теплоту від робочого тіла і не змінює свою температуру – теплоприймачем.
Параметри стану однорідного робочого тіла. Макроскопічні величини (величини, що характеризують робоче тіло у цілому), які описують фізичні властивості системи (робочого тіла) у даний момент, звуться термодинамічними параметрами стану. Вони поділяються на інтенсивні, які не залежать від маси робочого тіла, і екстенсивні, які пропорційні масі робочого тіла.
До основних параметрів стану відносять абсолютний тиск p, питомий об’єм v і абсолютна температура Т. Вони носять назву термічні параметри стану і піддаються безпосередньому вимірюванню простими технічними засобами. До параметрів стану, як буде показано далі, відносять також калоричні параметри стану: внутрішня енергія U, ентальпія H і ентропія S.
Тиск зумовлений взаємодією молекул робочого тіла з поверхнею і чисельно дорівнює силі, яка діє на одиницю площі поверхні тіла по нормалі до останньої. Відповідно до молекулярно-кінетичної теорії тиск газу визначається співвідношенням
, (1.1)
де n – кількість молекул у одиниці об’єму; m – маса молекули; – середня квадратична швидкість поступального руху молекул. У системі одиниць СІ тиск виражається у паскалях (1Па = 1 Н/м2): кілопаскаль 1кПа = 103 Па і мегапаскаль (1МПа = 106 Па). Позасистемна одиниця 1 бар = 105Па (0,1 МПа).
Тиск вимірюється за допомогою манометрів, барометрів, мановакуумметрів. Рідинні (рис. 1.1) та пружинні манометри вимірюють надлишковий тиск, який становить різницю між абсолютним (повним) тиском p середовища і атмосферним тиском pатм
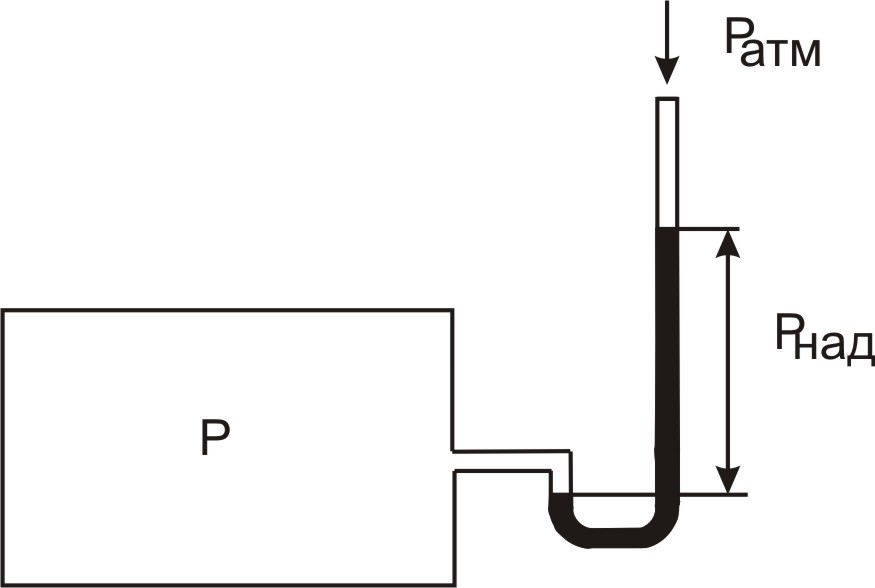
pнад = pабс – pатм.
Прилади для вимірювання тиску нижчого за атмосферний звуться вакуумметрами; вони показують розрідження (або вакуум) – надлишок атмосферного тиску над абсолютним
pв = pатм – pабс.
Параметром стану є абсолютний тиск, який входить у термодинамічні рівняння.
Рис. 1.1. Рідинний манометр
Температурою зветься фізична величина, яка характеризує ступінь нагрітості тіла. З точки зору молекулярно-кінетичної теорії температура є мірою інтенсивності теплового руху молекул. Чисельне значення температури пов’язане з величиною середньої кінетичної енергії молекул речовини співвідношенням
, (1.2)
де k – стала Больцмана, яка дорівнює 1,38066210–23 Дж/К; T – абсолютна температура.
Чисельне значення температури залежить від вибраної шкали температур. Поняття шкали температур включає два елементи: нуль відліку та значення одного градуса.
Найбільш універсальною є абсолютна термодинамічна шкала температур Т – шкала Кельвіна, яка побудована на основі другого закону термодинаміки. Температура, при якій повністю припиняється тепловий рух молекул, прийнято за абсолютний нуль – початок відліку. Інша точка, яка визначає термодинамічну шкалу температур, є температура потрійної точки води (температура рівноваги між льодом, водою і парою), якій приписується чисельне значення 273,16 К. Потрійна точка легко реалізується з високою точністю. За одиницю температури у абсолютній термодинамічній шкалі прийнято Кельвін (T, К), який дорівнює 1/273,16 частини інтервалу від абсолютного нуля температури до температури потрійної точки води.
Термодинамічна шкала температур лежить у основі Міжнародної практичної температурної шкали – шкали Цельсія (t, оС), за нуль відліку у якій прийнята температура плавлення льоду, а за 100 оС – температура кипіння води при нормальному атмосферному тиску 101325 Па (760 мм. рт. ст). Температурі потрійної точки води 273,16 К відповідає 0,01 оС, отже співвідношення між цими температурами Т = t + 273,15.
У промисловості і лабораторних умовах температуру вимірюють за допомогою рідинних термометрів, термометрів опору, термоелектричних термометрів (термопар), пірометрів і інших засобів, у яких використовується залежність від температури якихось властивостей речовини (наприклад, теплового розширення, електрорушійної сили між двома металами, електричного опору, інтенсивності випромінювання).
Питомий об’єм v – це об’єм одиниці маси речовини
v = V / m,
де V – об’єм тіла масою m. У системі СІ одиниця питомого об’єму м3/кг.
Між питомим об’ємом та густиною речовини існує співвідношення
v = 1 / .
Для порівняння величин, які характеризують системи у однакових станах, запроваджено поняття „нормальні фізичні умови”: p = 760 мм.рт.ст = 101325 Па; Т = 273,15 К (t = 0 оС). У техніці застосовують також поняття „нормальні технічні умови”: p = 735,6 мм.рт.ст = 98000 Па, t = 15 оС.
Рівноважний та нерівноважний стан термодинамічної системи. Стан термодинамічної системи може бути рівноважним і нерівноважним. Якщо усі термодинамічні параметри постійні у часі і однакові в усіх точках системи, то такий стан системи зветься рівноважним. Якщо між різними точками у системі існує різниця температур, тиску і інших параметрів, то система зветься нерівноважною. У таких системах під дією градієнтів параметрів виникають потоки теплоти, речовини і інші, які намагаються повернути її у стан рівноваги. Ізольовані системи з часом завжди приходять у стан рівноваги і ніколи довільно вийти з нього не можуть. У класичній термодинаміці розглядаються тільки рівноважні системи.
Термодинамічний процес. Час релаксації в реальному процесі. Зміна стану термодинамічної системи у часі внаслідок енергетичної взаємодії з навколишнім середовищем зветься термодинамічним процесом. У термодинамічному процесі змінюється хоча б один параметр стану. Так, при переміщенні поршня у циліндрі об’єм, а з ним тиск і температура будуть змінюватися, буде відбуватися процес розширення або стиснення газу.
Система, яка виведена із стану рівноваги і залишена при постійних параметрах навколишнього середовища, через деякий час знову прийде у рівноважний стан, який відповідає цим параметрам. Таке спонтанне (без зовнішнього впливу) повернення системи у стан рівноваги зветься релаксацією, а проміжок часу, за який система повертається у стан рівноваги, зветься часом релаксації. Для різних процесів час релаксації відрізняється: якщо для встановлення рівноважного стану у газі потрібно всього 10–16с, то для вирівнювання температури у об’ємі також газу потрібні десятки хвилин, а в об’ємі твердого тіла – іноді кілька годин.
Усякий процес зміни стану робочого тіла є відхиленням від стану рівноваги. Термодинамічний процес зветься рівноважним, якщо всі параметри системи при його протіканні змінюються достатньо повільно у порівнянні з відповідним процесом релаксації. У цьому випадку система фактично увесь час знаходиться у стані рівноваги з навколишнім середовищем, чим і визначається назва процесу. Для того, щоб процес був рівноважним, швидкість зміни параметрів системи dA/d повинна задовольняти співвідношенню
dA/d<<срелA/рел,
де А – параметр, що найбільш швидко змінюється у процесі; срел – швидкість зміну цього параметру у релаксаційному процесі; рел – час релаксації.
Розглянемо, наприклад, процес стиснення газу у циліндрі. Якщо час переміщення поршня від одного положення до іншого значно перевищує час релаксації, тиск і температура устигають вирівнятися у всьому об’ємі циліндра. Це вирівнювання забезпечується безперервним зіткненням молекул, у результаті чого енергія від поршня достатньо швидко і рівномірно розподіляється між молекулами. Стан робочого тіла у цидіндрі у кожний момент часу буде практично рівноважний. Таким чином, рівноважний процес – це безперервна послідовність рівноважних станів системи. При цьому у кожній точці процесу стан термодинамічної системи можна описати рівнянням стану даного робочого тіла. Класична термодинаміка оперує у своїх дослідженнях тільки рівноважними процесами. Вони є зручним ідеалізуванням реальних процесів, що значно спрощує рішення задач. Така ідеалізація цілком обґрунтована, тому що умова (dA/d<<Срел) виконується на практиці досить часто. Оскільки механічні збурення розповсюджуються у газах зі швидкістю звуку, процес стиснення газу у циліндрі буде рівноважним, якщо швидкість переміщення поршня значно менше швидкості звуку.
Процеси, які не задовольняють умові dA/d<<Срел, протікають з порушенням рівноваги і звуться нерівноважними. Якщо, наприклад, швидко підвищити температуру навколишнього середовища, то газ у циліндрі буде поступово прогріватися через його стінки, релаксуючись до стану рівноваги, які відповідають новим параметрам навколишнього середовища. У процесі релаксації газ не знаходиться у рівновазі з навколишнім середовищем і його неможливо характеризувати рівнянням стану хоча б тому, що у різних точках об’єму газу температура має різні значення.
Таким чином рівноважним зветься процес, який протікає настільки повільно, що у системі (робочому тілі) у кожну мить часу устигає установитися рівноважний стан. Рівноважним може бути тільки нескінченно повільний процес.
Важливо засвоїти, що протікання рівноважного процесу при змінній температурі робочого тіла можливо здійснити у тому випадку, коли джерело теплоти змінює власну температуру таким же чином, як і робоче тіло (у загальному випадку при наявності нескінченної кількості джерел теплоти). Якщо є тільки одне джерело теплоти з постійною температурою, то рівноважний процес буде протікати при постійній температурі, яка дорівнює температурі джерела теплоти (такий процес зветься ізотермічним).
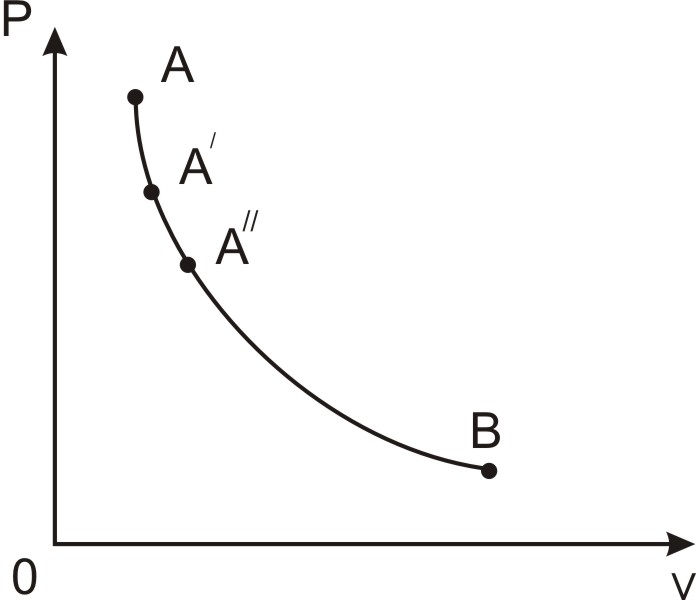
Рівноважні стани (А, А’, А’’) і рівноважний процес ( А – В) можна зобразити у вигляді діаграм (рис. 1.2), на осях яких відкладають значення параметрів рівноважних станів. Нерівноважний процес неможливо зобразити графічно, тому що робоче тіло одночасно має кілька різних значень параметрів у різних частинах.
Оборотний і необоротний термодинамічний процес. Оборотним процесом зветься такий термодинамічний процес, який протікає через ті ж самі рівноважні стани у прямому (А – В) і зворотному (В – А) напрямках так, що у робочому тілі та навколишньому середовищі не відбувається ніяких залишкових змін. Процеси, які не задовольняють цій умові, називають необоротними.
Рис. 1.2. Рівноважний процес
Оборотні процеси – це ідеалізовані процеси з максимальною роботою при розширенні і мінімальною роботою при стисненні. При прямому оборотному процесі виробляється робота достатня для повернення системи у початковий стан. При необоротних процесах система не може повернутися у початковий стан без додаткового зовнішнього впливу. Кожний процес, який супроводжується тертям і завихренням, є необоротним, тому що при цьому частина роботи перетворюється у теплоту, яка нагріває навколишнє середовище і у ній відбуваються залишкові зміни. Усі процеси передачі теплоти від нагрітих тіл до холодних при скінченній різниці температур також є необоротними, тому що зворотний перехід теплоти від холодних тіл до гарячих неможливий без витрати енергії ззовні.
Таким чином, головні умови здійснення оборотного процесу такі: теплова та механічна рівновага, тобто рівність температур і тиску робочого тіла і навколишнього середовища у кожному стані процесу (умова зовнішньої оборотності); відсутність тертя, завихрень та інших односторонніх процесів (умова внутрішньої оборотності).
Оборотні процеси у чистому вигляді у природі не зустрічаються, тому що реальні процеси завжди протікають зі скінченними швидкостями і різницями температур, і в робочому тілі не встигає установитися рівноважний стан. Проте вивчення оборотних процесів грає велику роль, тому що багато реальних процесів близькі до них. Крім того, оборотні процеси приводять до максимальної ефективності перетворення енергії у теплових машинах і служать мірою порівняння і оцінки ефективності реальних необоротних процесів.
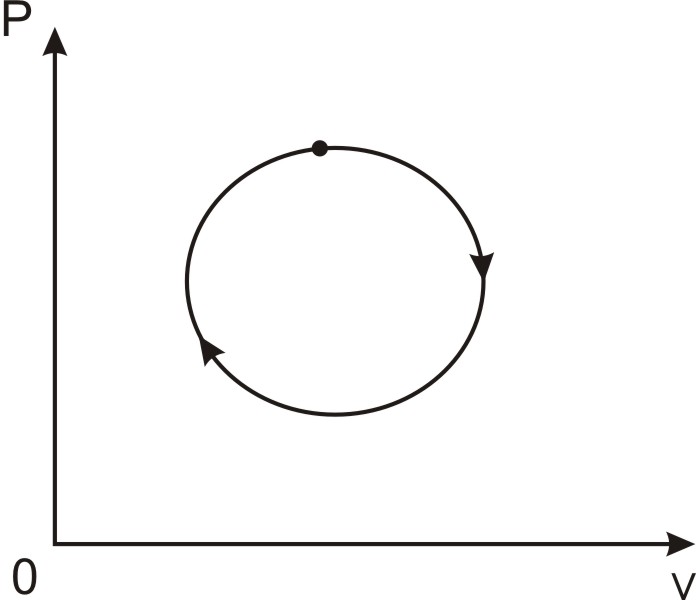
Коловий процес (цикл). Коловим процесом, або циклом, зветься процес, внаслідок здійснення якого робоче тіло повертається у початковий стан А (рис. 1.3). Цикли можуть розрізнятися за напрямом (прямі та зворотні), температурним рівнем, конфігурацією та іншими ознаками.
Рис. 1.3. Коловий процес
Оборотні колові процеси складають основу теоретичних циклів теплових двигунів і холодильних машин. Порівняння ефективності реальних (необоротних) циклів з ефективністю теоретичних (зворотних) циклів слугує мірою досконалості процесів, які протікають у реальних умовах.
Рівняння стану ідеального газу. Газова стала та її фізичний смисл. Дослід і теорія показують, що параметри р, v і Т простих систем, котрими є гази, пара, рідина, у рівноважному стані пов’язані між собою функціональною залежністю
f (p, v, T) = 0,
яка зветься термічним рівнянням стану.
Рівняння стану може бути отримано на основі експерименту або методами статистичної фізики. Вид рівняння стану залежить від індивідуальних властивостей речовини.
З рівнянь (1.1) і (1.2) витікає, що для ідеального газу . Розглянемо 1 кг газу. Ураховуючи, що в ньому міститься N молекул і, отже, , отримаємо: . Сталу величину , віднесену до 1 кг газу, позначають і називають газовою сталою. Тому
. (1.3)
Отримане співвідношення для ідеального газу є рівняння Клапейрона (1834 р.). Якщо (1.3) помножити на , отримаємо рівняння стану для маси газу :
. (1.4)
Газова стала , (кДж/(кг К)), характеризує роботу 1 кг ідеального газу при постійному тиску і зміні температури на 1 К. Вона залежить від хімічної структури газу і має для кожного газу своє значення.
Якщо помножити обидві частини рівняння (1.3) на молярну масу газу , кг/кмоль, (молярна маса – фізична величина, яка дорівнює відношенню маси газу до кількості молів у ньому M ), отримаємо рівняння Клапейрона-Менделєєва :
, (1.5)
де – молярний об'єм робочого тіла, м3/кмоль (при нормальних фізичних умовах = 22,41 м3/кмоль); – універсальна газова стала ( = 8314 Дж/(кмоль·К)).
Суміші ідеальних газів та способи їх завдання. Закони Дальтона і Амага. У техніці частіше застосовують не однорідні гази, а механічні суміші окремих газів (наприклад, атмосферне повітря, продукти згоряння палива, які у багатьох випадках розглядають як ідеальні гази). Суміші ідеальних газів підкоряються закону Дальтона, згідно якому тиск суміші ідеальних газів дорівнює сумі парціальних тисків її складових (компонентів):
, (1.6)
і закону Амага, у відповідності до якого об'єм суміші ідеальних газів дорівнює сумі приведених об'ємів її окремих компонентів:
. (1.7)
Парціальним тиском компонента суміші називають його тиск, віднесений до об'єму і температури усієї суміші. Приведений об'єм – це об'єм який займав би компонент газу, якби його тиск і температура дорівнювали тиску і температурі суміші.
Cпособи задання складу суміші. Склад суміші задається масовими, об'ємними та мольними частками.
Масова частка -ого компонента – відношення його маси до маси суміші : .
Об'ємна частка -ого компонента – відношення приведеного об'єму компонента до об'єму суміші :
.
Згідно до закону Авогардо об'єми одного моля будь-якого газу при однакових і однакові, тому для -ого компонента , а для суміші . З цього витікає, що об'ємні та мольні частки газу чисельно однакові: = . Вочевидь, що і .
Умовна молярна маса суміші. Виходячи з того, що маса -ого компонента дорівнює додатку його молярної маси на кількість молів , масу суміші можна також виразити аналогічно: , де – умовна молярна маса суміші, - кількість молів у суміші. Отже
Якщо суміш задана масовими частками, то легко показати, що .
Співвідношення між масовими та мольними (об'ємними) частками компонентів суміші можна отримати таким чином:
.
Парціальний тиск окремого компонента суміші може бути обчислений, якщо відома об'ємна (мольна) частка компонента . Для -ого компонента можна записати: та , або . Звідси , тоді .
Записавши рівняння стану для усіх компонентів суміші:
; ; ...
та підсумувавши ліві та праві частини цих рівнянь:
,
з урахуванням (1.6) отримаємо
. (1.8)
Останнє рівняння є термічним рівнянням стану суміші ідеальних газів, де величина є питома газова стала суміші. Питому газову сталу суміші можна визначити також через умовну молярну масу суміші :
.
Основні поняття і визначення технічної термодинаміки. Рівняння стану ідеальних газів. Суміші газів