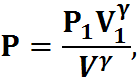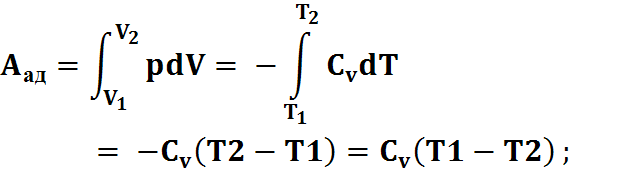Первое начало термодинамики
Первое начало термодинамики
План
- Внутренняя энергия.
- Первое начало термодинамики.
- Изопроцессы.
- Работы при изопроцессах.
- Адиабатический процесс.
- Теплоемкость.
- Внутренняя энергия тела.
Внутренняя энергия тела слагается из кинетической энергии поступательного и вращательного движения молекул, кинетической и потенциальной энергии колебательного движения атомов в молекулах, потенциальной энергии взаимодействия между молекулами и внутримолекулярной энергии (внутриядерной).
Кинетическая и потенциальная энергия тела как целого не входит во внутреннюю энергию.
Внутренняя энергия термодинамической системы тел слагается из внутренней энергии взаимодействия между телами и внутренней энергии каждого тела.
Работа термодинамической системы над внешними телами заключается в изменении состояния этих тел и определяется количеством энергии, которую термодинамическая система передает внешним телам.
Теплота - это количество энергии, представляемое системой внешним телам при теплообмене. Работа и теплота не являются функциями состояния системы, а функцией перехода из одного состояния в другое.
Термодинамической системой – называют такую систему, совокупность макроскопических тел, которые могут обмениваться энергией между собой и с внешней средой (с другими телами) (Например, жидкость и находящийся над ней пар). Термодинамическая система характеризуется параметрами:
P, V, T, и т.д.
Состояния системы, когда хотя бы один из параметров изменяется, называется неравновесными.
Термодинамические системы, которые не обмениваются с внешними телами энергией, называются замкнутыми.
Термодинамический процесс – переход системы из одного состояния (P1,V1,T1) в другое (P2,V2,T2) – нарушение равновесия в системе.
- Первое начало термодинамики.
Количество теплоты, сообщенное системе, идет на приращение внутренней энергии системы и на совершение системой работы над внешними телами.
Первый закон термодинамики - это специальный случай закона сохранения энергии, учитывающий внутреннюю энергию системы:
Q=U2-U1+A;
U1, U2 - начальное и конечное значения внутренней энергии тела.
A - работа, совершаемая системой.
Q - Количество теплоты, сообщаемое системе.
В дифференциальном виде:
dQ=dU+dA;
dU - есть полный дифференциал, и он зависит от разности начального и конечного состояния системы.
dQ и dA – неполные дифференциалы, зависят от самого процесса, то есть от пути совершения процесса. Работа совершается тогда, когда изменяется объем:
dA=Fdx=pSdx =pdV;
dA=pdV;
Первое начало термодинамики - невозможен вечный двигатель первого рода, то есть двигатель, который совершал бы работу в большем количестве, чем получаемая им извне энергия.
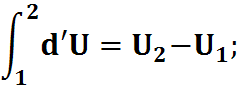
- не зависит от пути интегрирования.
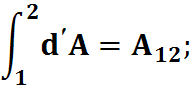
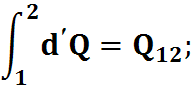
- зависит от пути интегрирования функции процесса и нельзя записать:
A2 - A1; Q2 - Q1;
A, Q - не являются функциями состояния. Нельзя говорить о законе работы и теплоты.
Это и есть не что иное, как закон сохранения энергии.
- Изопроцессы.
1) Изохорический процесс:
V=сonst;
Процесс при нагревании газа в замкнутом объеме.
dQ=dU+pdV,
pdV=0; dU=dU,
Первое начало термодинамики приобретает такой вид.
Теплоемкость при V-const:
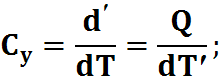
Теплоемкость определяется отношение приращения полученного системой тепла к приращению температуры.
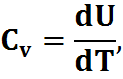
2) Изобарический процесс:
P=const;
dQ=dU+dA;
Разделим на dT (для 1 моля газа):
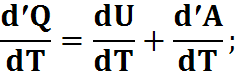
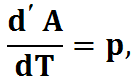
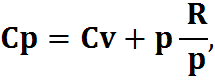
pV=RT,
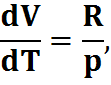
Cp=Cv+R,
3) Изотермический процесс:
T=const,
PV=A;
Поскольку внутренняя энергия зависит от T, то при изотермическом расширении dU=0:
dQ=dA,
Подводимые к газу при изотермическом расширении тепло целиком превращается в работу расширения.
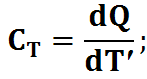
dQ стремится к , dT стремится к 0.
4) Адиабатический процесс:
Без теплообмена с окружающей средой. Первое начало термодинамики приобретает вид:
dQ=0; dU+dA=0,
dU+dA=0; dA=-dU,
При адиабатическом процессе работа совершается только за счет убыли внутренней энергии газа.
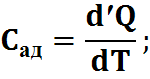
Процессы, в которых dQ=0 - адиабатические. Адиабатические процессы всегда сопровождаются изменением температуры тела. Так как при адиабатическом расширении работа, совершается за счет внутренней энергии (1кал= 4,19 Дж).
- Работа при изопроцессах.
1) Изохорический процесс:
V=const
dA=pdV=0; Av=0,
Работа сил давления при равновесном процессе численно равна площади под кривой, изображающей процесс на PV - диаграмме:
dA=pdV.
2) Изобарический процесс:
p=const;
dA=pdV;
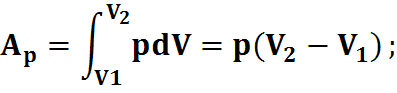
3) Изотермический процесс:
T=const;
dA=pdV;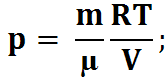
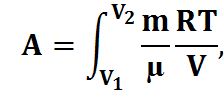
dV=RT;
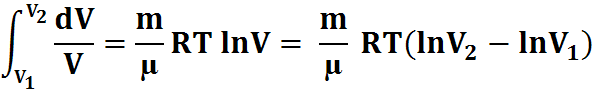
;
Равновесие процесса:
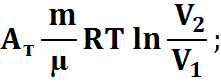
4) Адиабатический процесс:
dQ=dU+pdV;
dU=-pdV,
dQ=0; dU=CvdT,
,
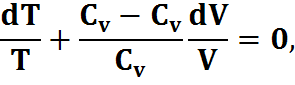
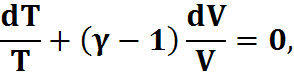
Интегрируем:
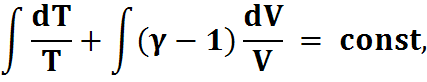
+ (-1)·lnV= const,
(TV-1)= const,
(TV-1) = const – уравнение Пуассона
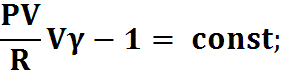
; 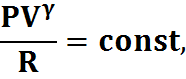
РV = const.
6. Теплоемкость.
1) Теплоемкостью тела называют количество теплоты, которое надо сообщить телу, чтобы оно нагрелось на 1 0С.
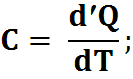
Cp= CV+R; CP>CV,
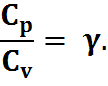
Теплоемкость можно отнести к единице массы, одному молю и единице объема. Соответственно: удельная, молярная, объемная ([Дж/кг*град]; [Дж/мол*град]; [Дж/м3*град]).
2)Теплоемкость в реальных газах: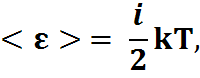
Внутренняя энергия моля:
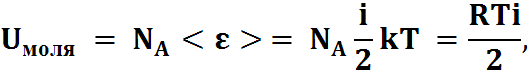
Nak=R,
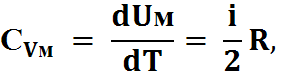
– теплоемкость одного моля при неизменном объеме (v=const).
;
– теплоемкость одного моля при неизменном давление (p=const).
Удельная теплоемкость.
[ ];
Функция состояния.
W=U+PV; Cp>Cv
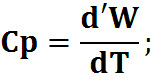
При нагревании с сохранением Р часть Q идет на расширение. Только расширяясь можно сохранять Р.
Изотерма: PV=const;
Адиабата: PV=const;
Поскольку >1, то кривая адиабаты идет круче изотермы.
;
CvdT + pdV=0;
dA=pdV= - CvdT;
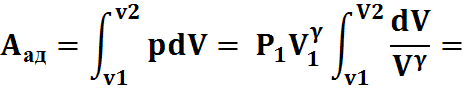
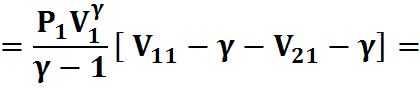
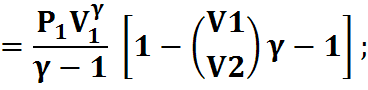
PV=P1V1,