Основи теорії сплавів. Основні типи діаграм фазової рівноваги
PAGE 2
Тема5
Основи теорії сплавів. Основні типи діаграм фазової рівноваги (2 год)
План
1. Основні поняття. Атомна будова фаз в сплавах: хімічні сполуки, тверді розчини, механічні суміші.
2. Діаграми стану подвійних сплавів1,2,3,4 роду. Правила концентрацій і відрізків.
3. Зв’язок між властивостями сплавів і типом діаграми стану (правила Курнакова).
4. Практичне значення діаграм стану.
–1–
Системою називають сукупність речовин у твердому, рідкому і газоподібному станах.
Сплавами називаються речовини, отримані сплавленням двох або декількох компонентів.
Фазою називається однорідна частина системи, відділена від інших частин поверхнею поділу, при переході через яку стрибкоподібно змінюються хімічний склад і властивості. Фаза (від грец.–поява) – окрема, однорідна складова, відмежована поверхнею розділу від інших частин системи (наприклад, суміш льоду й води при 00 С являє собою систему, а лід і вода –тверда і рідка фаза цієї системи).
Під час кристалізації атоми компонентів розташовуються у певному порядку, утворюючи кристалічну речовину — сплав. При цьому існують такі типи взаємодії компонентів сплаву:
механічна суміш;
хімічна сполука;
тверді розчини.
Механічна суміш – це сплави, утворені з компонентів із власними кристалічними решітками, що не розчиняються один в одному та не утворюють хімічну сполуку. Механічну суміш, утворену при кристалізації з рідкого стану двома компонентами називають евтектикою.
Тверді розчини – це сплави, які при переході з рідкого стану в твердий зберігають однорідність і розчинність компонентів та в них один компонент (розчинник) зберігає свою кристалічну решітку, а атоми інших компонентів розміщуються в решітці розчинника. Залежно від характеру розміщення: ТР заміщення й ТР проникнення (рисунок 1.1).
ТР заміщення атоми компонента, що розчиняється, заміщують частину атомів розчинника у вузлах кристалічної ґратки. Якщо компоненти заміщують один одного в будь-яких пропорціях, – ТР з необмеженою розчинністю. Якщо вміст розчинених у розчиннику компонентів становить 1–2 % – це ТР з обмеженою розчинністю.
ТР проникнення – атоми компонента, що розчиняється між атомами розчинника, наприклад, вуглець.
ХС – це сплави зі строго визначеним співвідношенням компонентів АпВт (Fe3C, Fe203), утворені здатністю атомів об’єднуватися у пропорції з утворенням нової кристалічної решітки.
Відмінності сплаві з різними типом взаємодії між компонентами: механічна суміш може мати декілька фаз, а ТР і ХС одну. ТР існують в інтервалах концентрацій компонентів, а ХС в строго визначеному співвідношенні компонентів.
Діаграма стану – це графічне зображення фазового та структурного складу сплавів системи в залежності від температури і хімічного складу.
Діаграми стану будують на основі визначених у процесі повільного охолодження критичних точках (температури, при яких починаються або закінчуються фазові перетворення сплаву). Ознака критичної точки зміна властивостей або тепловий ефект.
Діаграми стану будують у координатах “температура - хімічний склад ”.
Закономірності існування стійких фаз виражаються правилом фаз або законом Гіббса:
с=k-f+1, (3.1)
де с – число ступенів вільності системи (число зовнішніх (t) і внутрішніх (хімічний склад) факторів, які можна змінювати без зміни кількості фаз у системі, що знаходяться у рівновазі);
k – кількість компонентів; f – кількість фаз;
1 – число зовнішніх факторів (температура).
Якщо с=0 (нонваріантна рівновага), неможливо змінювати зовнішні і внутрішні фактори без зміни числа фаз.
Якщо с=1 (моноваріантна рівновага), зміна одного з факторів не викличе зміну числа фаз.
Якщо с=2 (біваріантна рівновага), можлива зміна двох факторів без зміни числа фаз.
– 2–
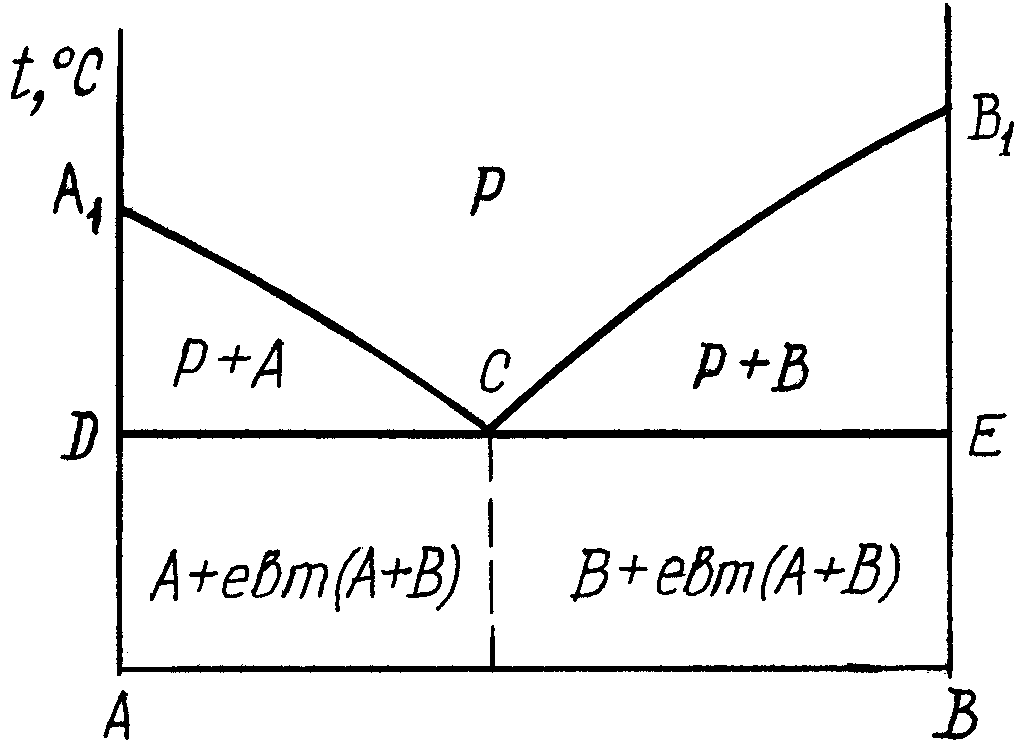
2.1. Діаграма стану сплавів, компоненти яких не розчиняються один в одному в твердому стані та не утворюють хімічних сполук. рис.1.
Лінія А1СВ1 – ліквідус – геометричне місце точок (температур) початку кристалізації сплавів даної системи. По А1С починається кристалізація чистого компонента А, а по СВ1 – компонента В. Ліквідус (від лат. liquidus –рідкий).
Лінія DCE – солідус – геометричне місце точок кінця кристалізації. Солідус (від лат. solidus – твердий).
DCE ще має назву лінії евтектичного перетворення–, коли рідка фаза, склад якої відповідає точці С, кристалізується з утворенням одночасно кристалів А і В. Евтектика (від грец. – легкоплавкий) – суміш речовин у такому співвідношенні, за якого температура плавлення її нижча, ніж при інших співвідношеннях.
Механічна суміш двох видів кристалів, які одночасно кристалізуються із рідкої фази, називається евтектикою. Евтектичний сплав має найнижчу температуру кристалізації серед сплавів даної системи.
Сплави, які розміщені лівіше точки С, називаються доевтектичними. Їх структура складається кристалів компонента А та евтектики.
Сплав, який за хімічним складом відповідає точці С діаграми, називається евтектичним і його структура складається з евтектики.
Сплави, які розміщені правіше точки С діаграми, називаються заевтектичними. Їх структура складається із надлишкових кристалів компонента В і евтектики.
2.2.Діаграма стану сплавів, компоненти яких можуть необмежено розчинятися у рідкому і твердому станах
Складається з ліквідус А1МВ1 і солідус A1NB1. Вище А1МВ1 усі сплави даної системи у рідкому стані. При досягнені у процесі охолодження лінії А1МВ1 (точка t1) починається кристалізація -твердого розчину складу хе.
При охолодженні до температури t2 у рівновазі з рідиною складу ха будуть знаходитися кристали -твердого розчину складу хв, а при t3 склад рідкої фази визначається точкою хf, а кристалів -твердого розчину – хс.
При повільному охолодженні внаслідок дифузійних процесів хімічний склад вирівнюється і кристали будуть мати однаковий склад хс.
Якщо процес кристалізації відбувається в умовах прискореного охолодження, що має місце при отриманні литих деталей і злитків, дифузійне вирівнювання складу не встигає відбутися, тому отримується неоднорідний хімічний склад. Явище неоднорідності хімічного складу у межах одного кристала називається мікроліквацією. Явище неоднорідності хімічного складу у різних зонах злитка називається макроліквацією.
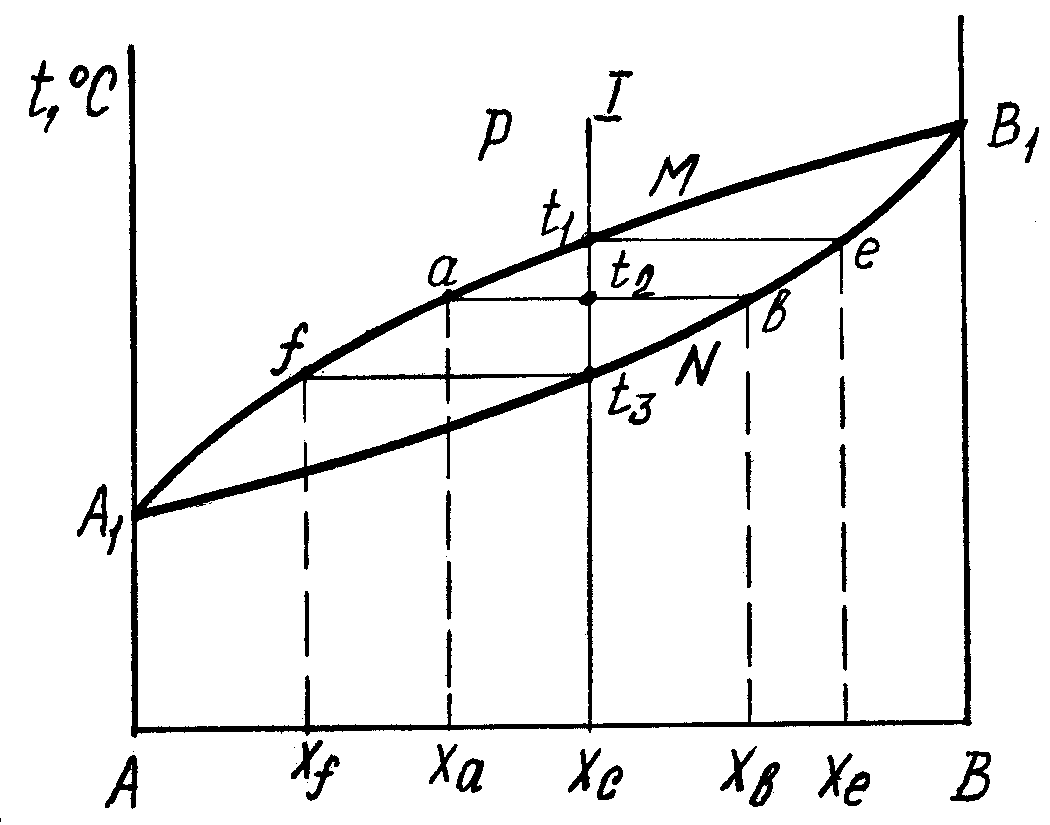
Рис. 2. Діаграма стану сплавів, компоненти яких утворюють необмежений твердий розчин
За діаграмою стану можна прослідкувати за фазовими перетвореннями будь-якого сплаву та визначити склад і кількісне співвідношення фаз у будь-якій точці двофазної області. Це здійснюється за допомогою правил.
–3–
1. Правило концентрацій. Для визначення концентрації компонентів у двох фазах через задану точку t2 (рис.3.2), яка характеризує стан сплаву, необхідно провести горизонтальну лінію (коноду) до її перетину з лініями діаграми, які обмежують область, де знаходиться точка. Проекції точок перетину (а і b) на вісь концентрацій (ха, хв) визначають склад фаз. Для сплаву І в точці t2 (рис. 3.2) склад рідкої фази визначається координатою ха, а склад -твердого розчину – хв.
2. Правило відрізків або правило важеля. Для визначення кількісного співвідношення фаз через задану точку t2 проводять горизонтальну лінію. Відрізки цієї лінії (коноди) між точкою t2 та точками а і b, які визначають склад фаз, (рис.3.2) обернено пропорційні кількостям цих фаз:
Qp/Q =bt2/at 2, (3.3)
де Qp, Q – кількість рідкої фази та - твердого розчину; bt2, at 2 – довжина відрізків коноди.
–4–
2.3.1. Діаграма стану сплавів, компоненти яких обмежено розчинюються у твердому стані та утворюють евтектики.
Діаграма стану сплавів (рис. 3) має риси діаграми першого типу і діаграми другого типу. На відміну від діаграми першого типу в даній системі кристали чистих компонентів А і В в процесі кристалізації не утворюються, а утворюються кристали обмежених твердих розчинів і : – це розчин компонента В в А, а – розчин компонента А в В.
По лінії А1D починається утворення -твердого розчину, а по лінії DB1 - -твердого розчину, А1DB1 – лінія ліквідус. Лінія А1CDEB1 – солідус. По лінії А1С закінчується процес кристалізації -твердого розчину, а по лінії ЕВ1 – -твердого розчину. Лінія СDE – це лінія евтектичного перетворення, тобто утворенні із рідкого сплаву евтектичного складу одночасно суміші кристалів і - евтектики:
PD евтектика (+) (3.4)
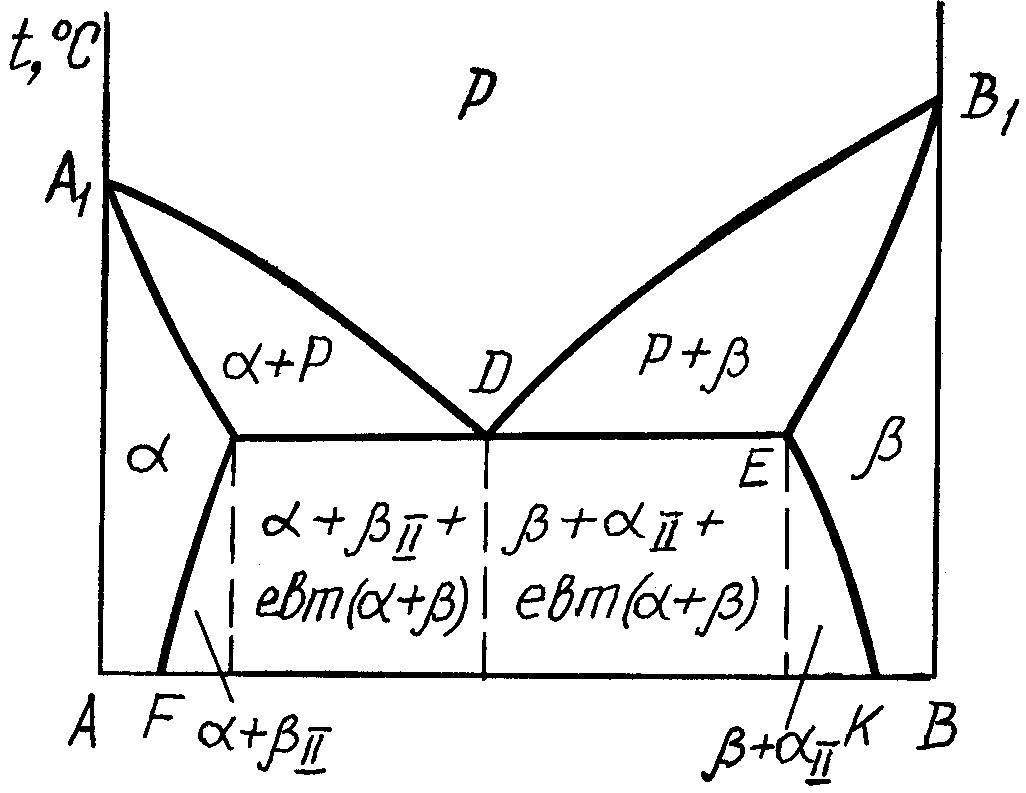
Лінії СF і EK – це лінії граничної концентрації, компонента В в -твердому розчині та А в -твердому розчині. По лінії CF при зниженні температури із -твердого розчину починається виділення надлишкового компонента В у вигляді -фази (вторинні кристали), а по лінії ЕК – надлишкового компонента А у вигляді -фази (вторинні кристали) з -твердого розчину.
Сплави цієї системи поділяються на доевтектичні, евтектичні та заевтектичні (аналогічно сплавам діаграми стану першого типу)
2.3.2. Діаграма стану сплавів, компоненти яких обмежено розчинюються у твердому стані та зазнають перитектичного перетворення
рис. 4. А1СВ1 – ліквідус. По А1С починається кристалізація -твердого розчину, по СВ1 - -твердого розчину. Лінія А1EFB1 – солідус. По А1Е закінчується процес кристалізації -фази, а по FB1 - -фази. СEF – це лінія перитектичного перетворення (префікс пери з грецьк–навколо, зверх, через):
РC + F E, (3.5)
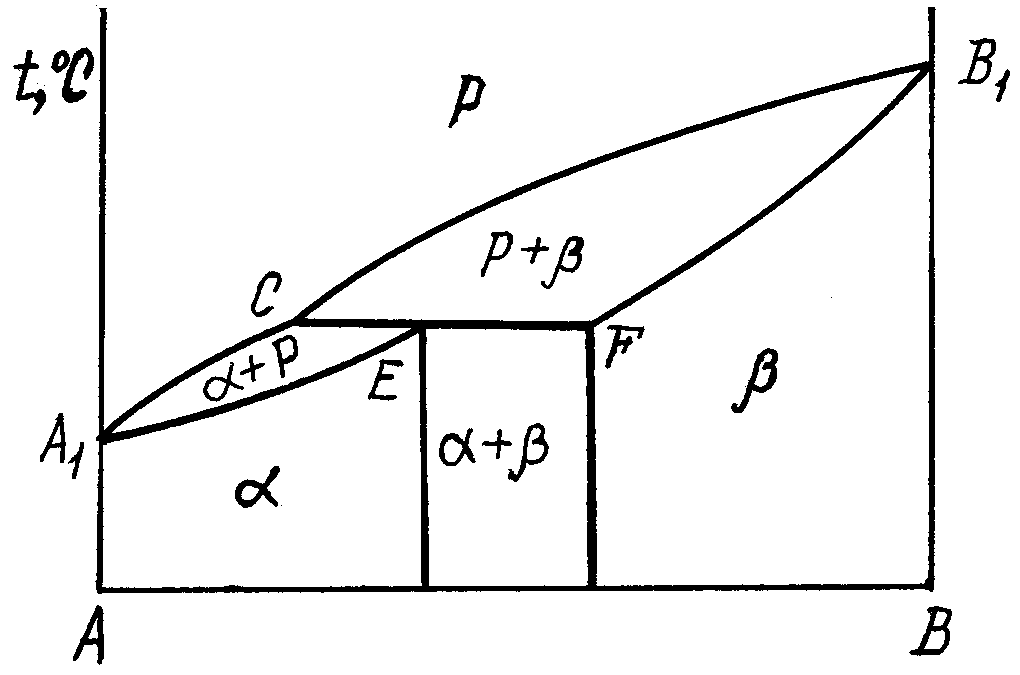
Сплав за складом відповідає точці Е, після перитектичного перетворення залишається одна фаза – -твердий розчин. У доперитектичних (від С до Е) і заперитектичних (від Е до F) сплавах після протікання перитектичної реакції залишається частина другої (надлишкової) фази: у доперитектичних – рідка фаза, а у заперитектичних – -твердий розчин, процеси, які відбуваються по СЕF можна записати так:
доперитектичні сплави – РС + F Е+ +РСзал. (3.6)
заперитектичні сплави – РС + F Е+ Fзал. (3.7)
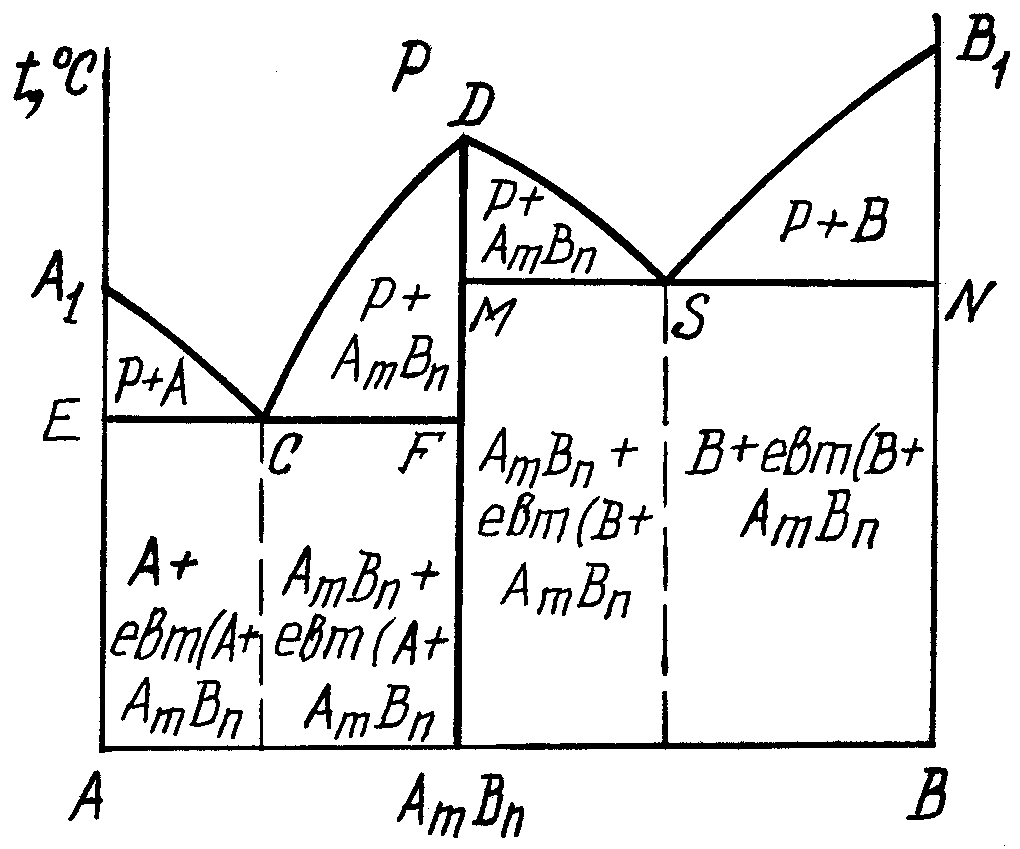
2.4. Діаграма стану сплавів, компоненти яких утворюють стійку хімічну сполуку
рис. 3.5. Хімічну сполуку AmBn, яку утворюють компоненти А і В, можна розглядати як новий, третій компонент, що поділяє діаграму стану А-В на дві діаграми першого типу – А-AmBn і AmBn-В.
Для першої лінія А1СD – ліквідус, ECF – солідус, а для другої діаграми DSB1 – ліквідус, MSN – солідус. По А1С починається кристалізація компонента А, по SB1 – компонента В, а по CD і DS – хімічної сполуки AmBn. По ECF і MSN евтектичне перетворення, по ECF: РСА+AmBn, (3.8)
по MSN: РS AmBn+B (3.9)
Користуючись діаграмами стану, можна визначити перетворення, які відбуваються у сплавах даної системи в залежності від температури і хімічного складу, фази та структурні складові, які при цьому утворюються. Фазовий та структурний склад сплавів зумовлює їх фізико-механічні й експлуатаційні властивості, за діаграмою стану можна прогнозувати характер зміни властивостей від хімічного складу сплаву.
На рис. 6 наведено залежність між хімічним складом і властивостями сплавів для різних типів діаграм стану (правило М.С.Курнакова).
Велика віддаль між лініями ліквідус і солідус на діаграмі стану показує на схильність сплаву до ліквації по густині, утворення усадкових раковин і стовпчастої структури, тріщин у виливках.
Кращі ливарні властивості у двофазних сплавів евтектичного складу, які мають найменшу температуру плавлення.
Деформаціям краще піддаються однофазні сплави – тверді розчини. Двофазні сплави, якщо у них нема дуже твердих фаз, краще піддаються різанню. А однофазні сплави стійкіші до корозії.
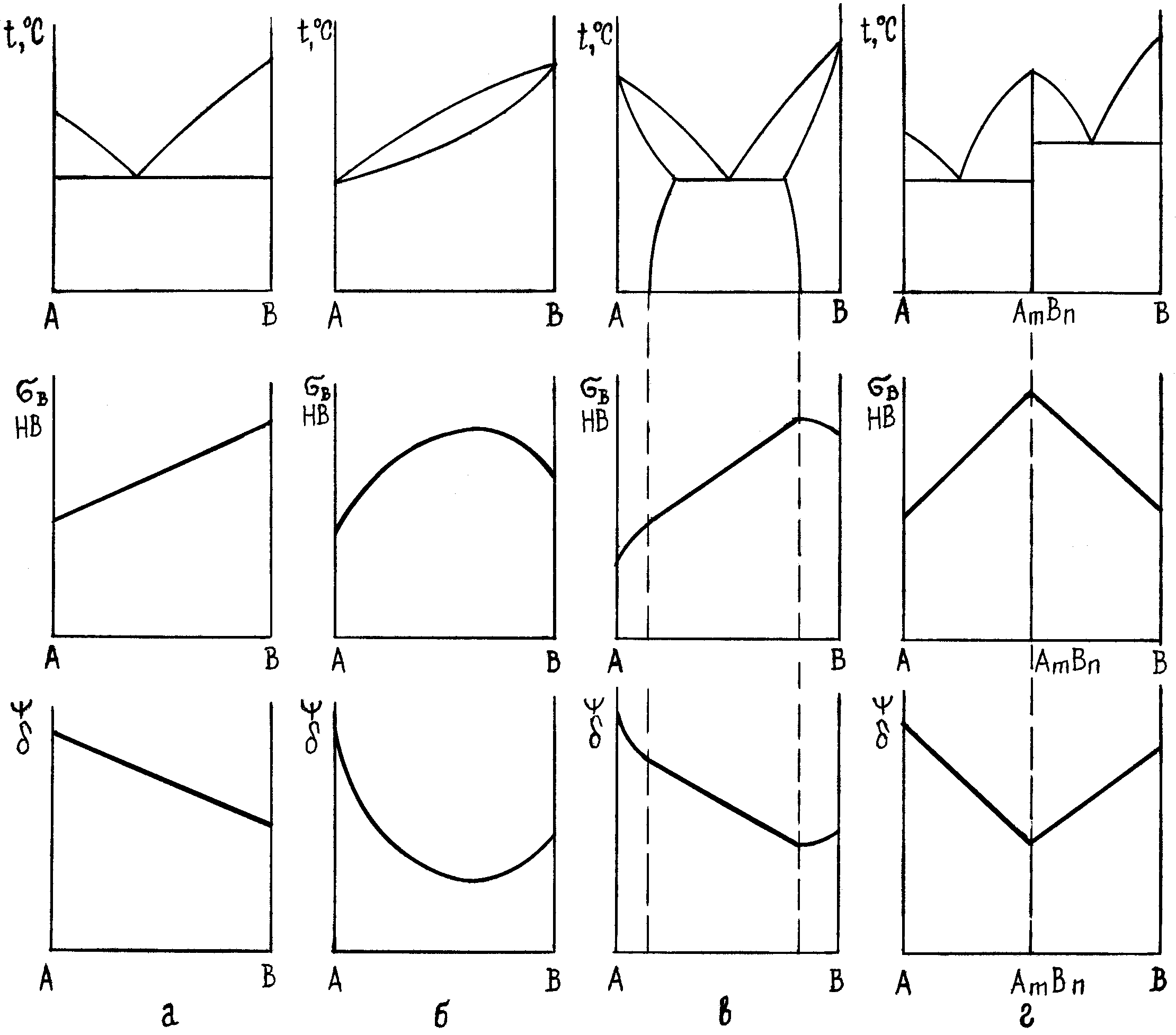
Рис.6. Залежність між типом діаграми стану, хімічним складом і властивостями сплавів
–4–
Визначити температури фазових перетворень у сплавах будь-якого складу, якість і кількість фаз у різних областях діаграми стану.
Форма, за якою проявляються фази, називається структурою сплаву. Прогнозувати структуру, що утворюється зі сплавів різного складу, бо структури сплавів визначають механічні властивості. наприклад, сталі і білі чавуни складаються із одних фаз, але властивості відрізняються тому, що структури сплавів різні.
Якщо відбуваються фазові перетворення, то поряд з охолодженням сплаву відбувається виділення прихованої теплоти перетворення і швидкість охолодження знижується, протягом деякого часу сплав може зберігати постійну температуру.
При утворенні одної фази С = 2-2+1 = 1на кривій охолодження виникає згин. Коли у перетворенні беруть участь три фази С = 0, температура перетворення постійна (на кривій охолодження утворюється горизонтальна ділянка).
Основи теорії сплавів. Основні типи діаграм фазової рівноваги