Атомно-кристалічна будова металів
PAGE 9
ЛЕКЦІЇ
з навчальної дисципліни «Матеріалознавство»
ТЕМА1 (2 години)
«Атомно-кристалічна будова металів»
Питання
Агрегатні стани речовини. Аморфні і кристалічні тіла. Типи зв’язку в кристалах та їх вплив на структуру і властивості твердих тіл.
Поняття про металознавство. Загальна характеристика металів.
Кристалічна будова металів. Типи кристалічних ґраток. Поліморфні перетворення (алотропія) у металах. Анізотропні й ізотропні речовини.
Дефекти кристалічної будови: точкові, лінійні, поверхневі.
Структурні і фізичні методи дослідження металів. Методи визначення механічних властивостей.
План
Методи дослідження структури металів
–1–
Матеріалознавство - наука, яка вивчає залежність між складом, будовою та властивостями матеріалів та закономірності їхніх змін під впливом зовнішніх чинників: теплових, хімічних, механічних, електромагнітних і радіоактивних.
Мета навчальної дисципліни – сформувати в студентів знання принципів вибору конструкційних матеріалів, технологію їх обробки та уміння й навички вивчення фізико-механічних властивостей матеріалів і впливу на них.
Завдання навчальної дисципліни – навчити майбутніх учителів технологій визначати необхідні властивості матеріалів, режими їх термічної, механічної й інших видів обробки залежно від температурних і силових умов роботи деталей машин.
–2–
Агрегатний від лат. аggregatus– зібраний. Агрегатні стани – це фізичні стани речовини, що зумовлюються відмінністю в особливостях теплового руху і взаємодії її частинок (молекул, атомів, іонів). Агрегатні стани бувають: твердий; рідинний, газоподібний, плазма (іонізований газ). Зміна агрегатного стану називається фазовими переходами. Фазові переходи бувають: плавлення (з твердого стану в рідинний); кипіння (з рідкого в газоподібний); сублімація (з твердого в газоподібний); конденсація (з газоподібного в рідинний).
–3–
2. Аморфні і кристалічні тіла
Тверді тіла поділяються на дві групи: кристалічні і аморфні. У кристалічному частинки (атоми, молекули) мають геометрично правильне розміщення. В аморфних тілах розміщення частинок хаотичне.. До них належать скло, смоли, каніфоль пластмаси, каучуки, органічне скло.
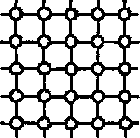
Рис. Схема просторової решітки кристалів
Кристалічні тіла складаються з одного або багатьох кристалів. Зовнішньою ознакою кристала є геометрична форма, зокрема, утворення граней на кристалі.
3. Типи зв’язку в кристалах та їх вплив на структуру і властивості твердих тіл
Існують такі типи зв’язку частинок (атомів, іонів, молекул) кристалів: 1) іонний; 2) ковалентний; 3) металевий; 4) залишковий або ван-дер-ваальсівський та відповідні види кристалічних решіток: іонні, ковалентні, металеві, полярні.
Іонний зв’язок утворюється шляхом передачі атомом одного хімічного елемента свого валентного електрона атому іншого хімічного елемента, що призводить до утворення позитивних і негативних іонів. Для іонних кристалів характерні крихкість та велика температура плавлення.
Ковалентний зв’язок утворюється шляхом об’єднання валентних електронів двох сусідніх атомів. Для ковалентних кристалів характерна велика твердість та мала електропровідність при низьких температурах.
Металевий зв’язок утворюється шляхом електростатичного притягання між позитивними іонами і електронним газом (колективізованими електронами).
Полярний зв’язок утворюється шляхом електростатичного притягання молекул при миттєвій поляризації атомів при їх наближені. Для молекулярним кристалів із полярним зв’язком характерні низька температура плавлення та властивості діелектрика.
4. Поняття про металознавство. Загальна характеристика металів
Металознавство - це наука, яка встановлює взаємозв’язок між хімічним складом, внутрішньою будовою та властивостями металів і сплавів.
Властивості металів: високі електро- і теплопровідність; мають на зламі характерний блиск, підвищену здатність до пластичної деформації.
Чому металів багато? Це обумовлено особливостя їх внутрішньої будови: розподілом і характером руху електронів в атомах; розміщенням атомів, іонів і молекул в просторі; розмірами, формою і характером кристалічних утворень.
При відносному переміщенні іонів їх зв’язок з електрона не втрачається, (іони течуть всередині "електронного газу"). В результаті метали пластичні, тобто можуть змінювати форму без руйнування.
Характерний металевий блиск обумовлений взаємодією електромагнітних світлових хвиль з вільними електронами.
5. Кристалічна будова металів. Типи кристалічних ґраток. Поліморфні перетворення (алотропія) у металах. Анізотропні й ізотропні речовини.
У вузлах кристалічної решітки металів знаходяться позитивно заряджені іони, між якими рухаються негативно заряджені електрони. Для вивчення кристалічної будови в кристалічній решітці виділяють елемент об’єму із мінімальної кількості частинок (атомів), багаторазовим переносом (трансляцією) якого в просторі побудувати весь кристал.
Елементарний об’єм, який характеризує особливості будови кристала, називається елементарною коміркою.
Поширені кристалічні решітки типів: об’ємноцентрована кубічна (ОЦК); гранецентрована кубічна (ГЦК); гексагональна,–укладена (ГЩУ) і нещільно укладена.
Кубічна об’ємноцентрована (ОЦК) – частинки розміщені у вершинах і в центрі куба. Кожна частинка оточена вісьмома сусідні частинка.
ОЦК характерна для вольфраму, альфа заліза тощо
Гранецентрована кубічна (ГЦК) – частинки в ній розміщені у вершинах і центрах граней куба. ГЦК характерна для золота, срібла, платини, гама заліза тощо.
Гексагональна (шестикутна) щільно укладена решітка. ГЩУ характерна для магнію, цинку тощо.
У гексагональній щільноупакованій (ГЩУ) гратці атоми розташовані в кутах і центрі шестикутних основ призми і три атоми в середній площині призми.
Розміри кристалічних граток характеризуються періодами a, b, c, під якими розуміють відстань між найближчими атомними площинами, що утворюють елементарну комірку. Період вимірюється в нанометрах (нм) (1 нм=10-9 м=10 А) і знаходиться в межах 0,1…0,7 нм.
Щільність кристалічної гратки - об’єму, зайнятого атомами, характеризується координаційним числом, під яким розуміють число атомів, які знаходяться на рівній і найменшій відстані від даного атома. Чим більше координаційне число, тим більша щільність упаковування атомів. В ОЦК-гратці найменша відстань між атомами відповідає d=0,5а3. На цій відстані від даного атома знаходяться 8 сусідів, координаційне число для цієї гратки - 8 К8. координационное число К - число соседей данного атома: для ОЦК равно 8, т.е. атомы, находящиеся в вершине, принадлежат восьми элементарным ячейкам , для ГЦК – 12, т.е. атомы, находящиеся в вершине, принадлежат двенадцати элементарным ячейкам (рис. 2.1.б).
Коефіцієнт заповнення осередку - відношення об’єму, зайнятого атомами, до об’єму елементарної комірки, складає 68 %.
Для ГЦК-гратки координаційне число дорівнює 12 (К12) - кожний атом має 12 найближчих сусідів на відстані d=0,5а2, що відповідає найбільшій щільності упаковування або укладки у виді кульок
ГЩУ-гратка, для якої с/а=1,633, має координаційне число 12 (Г12). У багатьох металів, які кристалізуються в гексагональній системі, відношення с/а може знаходитися у межах 1,57...1,64.
Гранецентрована кубічна і гексагональна щільноупакована гратки - найкомпактніші. Їхній коефіцієнт заповнення об’єму атомами - 74 відсотки. При зменшенні координаційного числа в гратці Г12 до 6 коефіцієнт заповнення складає 50 відсотків, а при координаційному числі 4 - усього 25 відсотків.
Половину найменшої відстані між центрами атомів називають атомним радіусом. Атомний радіус зростає при зменшенні координаційного числа, тому що при цьому збільшується простір між атомами.
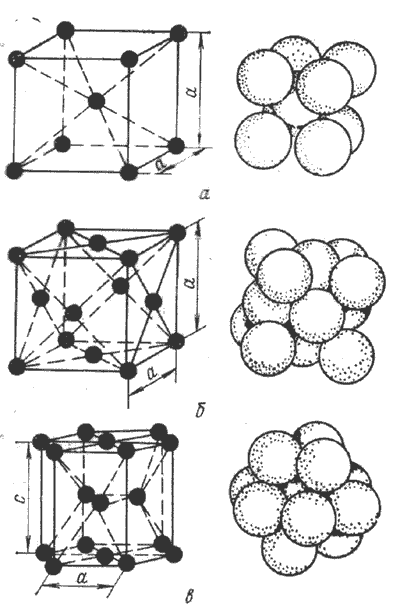

Рис. Кристалічні ґратки металів: Рис. Координаційні числа
а – об’ємноцентрована кубічна; для різних кристалічних граток
б – гранецентрована кубічна;
в – гексагональна щільноупакована
Кількість атомів, що припадає на одну елементарну комірку, називається базисом ‘ратки. Базис показує складність ‘ратки.
Существование одного и того же металла в нескольких кристаллических формах носит название полиморфизма или аллотропии. Различные кристаллические формы одного вещества называются полиморфными или аллотропическими модификациями (таблица 2.1).
Таблица 2.1
Аллотропические модификации металлов
|
Металл |
Группа |
Модификация |
Кристаллическая решетка |
|
Железо |
VIII |
Fe до 910 1401-1539 Fe 910-1401 |
Кубическая объемноцентрированная Кубическая гранецентрированная |
|
Кобальт |
VIII |
Co до 477 Co 477-1490 |
Гексагональная плотноупакованная Кубическая гранецентрированная |
Існування одного і того ж металу (речовини) в декількох кристалічних формах у залежності від температури чи тиску називають поліморфізм або алотропія. Різні кристалічні фор однієї речовини називаються поліморфни, або алотропічни модифікація.
Перехід до нового типу кристалічної ‘ратки супроводжується зменшенням вільної енергії кристалів, що утворюються порівняно з вихідни кристала. практичне значення має температурний поліморфізм, тобто наявність у металі різної кристалічної будови в інтервалі певних температур. На кривих охолодження поліморфному перетворенню відповідає горизонтальний відрізок сталої температури, завдяки виділенню прихованого тепла перекристалізації.
Поліморфні перетворення супроводжуються стрибкоподібною зміною властивостей металу. Ці перетворення лежать в основі зміцнювальних і знеміцнювальних термообробок.
Найзагальніша з ознак кристалічного стану речовини - наявність анізотропії – кристал у різних напрямках має нові фізичні властивості. при нагріванні кристал розширюється в різних напрямках неоднаково.
Анізотропія кристалів пояснюється тим, що в них у різних напрямках на одиницю довжини припадає нова кількість атомів
всі кристалічні тіла можна поділити на дві групи: монокристалічні і полікристалічні. Монокристал - це тіло, всі частинки якого вкладаються в одну спільну просторову гратку. Монокристали анізотропні. Це Полікристалічне тіло - це тіло, що складається із величезної кількості дрібних монокристалів, безладно розміщених. Тому полікристали ізотропні. (метали тіла полікристалічні).
6. Дефекти кристалічної будови: точкові, лінійні, поверхневі.
по характеру их измерения в пространстве:
- Точечные. нарушения периодичности кристалла, размеры которых сопоставимы с размерами атома во всех измерениях: вакансии, межузельные атомы, примеси замещения, примеси чужеродных атомов внедрения (рис. 2.5).
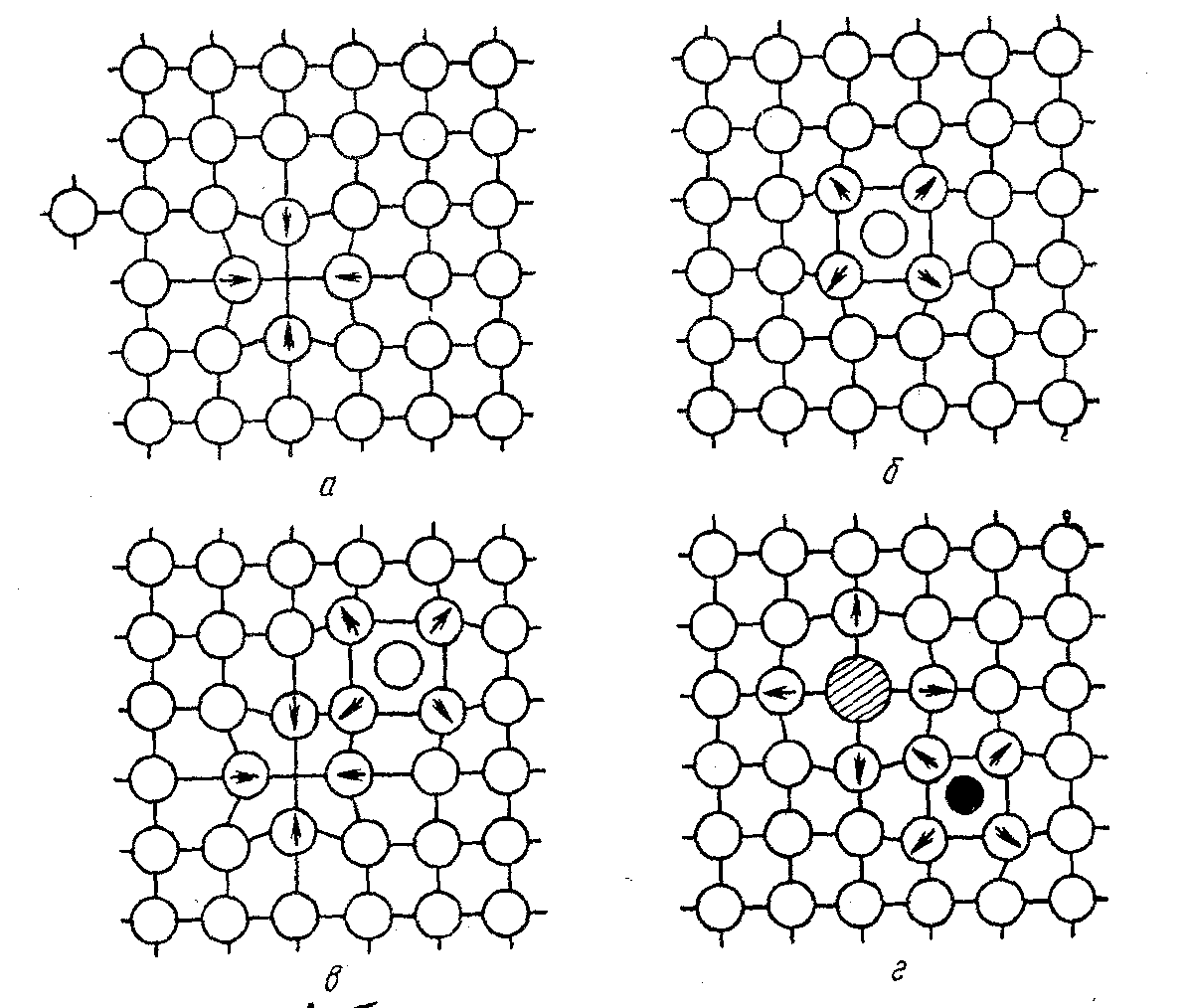
Рис..Точкові дефекти: а- вакансія;
б - міжвузловий атом; в- дефект Френкеля; г- атоми-домішки заміщення (великий) і впровадження (малий).
Стрелками указаны направления смещений атомов в решетке.
Вакансии и межузельные атомы появляются в кристаллах при температуре выше абсолютного нуля из-за тепловых колебаний атомов. Каждой температуре соответствует равновесная концентрация вакансий, а также межузельных атомов. Например, в меди при температуре 20-25 оС содержится 10-13 ат. % вакансий, а вблизи точки плавления - уже 0,01 ат. % (одна вакансия на 104 атомов).
Вакансии являются самой важной разновидностью точечных дефектов; они ускоряют процессы, связанные с перемещениями атомов: диффузию, спекание порошков и т. д.
2. Линейные. их поперечные размеры не превышают нескольких межатомных расстояний, а длина может достигать размера кристалла. К линейным дефектам относятся дислокации – линии, вдоль и вблизи которых нарушено правильное периодическое расположение атомных плоскостей кристалла.
Виды линейных - краевые и винтовые дислокации (рис.2.6).

Рис. Кубічна решітки: а – з кураєвою дислокацією; б - без дислокації
3. Поверхностные (двумерные). нарушения, обладают большой протяженностью в двух измерениях и протяженностью в несколько межатомных расстояний в третьем измерении.
К поверхностным дефектам относятся дефекты упаковки, двойниковые границы, границы зерен.
4.Объемные (трехмерные). нарушения, которые в трех измерениях имеют неограниченные размеры. относят трещины, поры, усадочные раковины.
Винтовая дислокация получена при помощи частичного сдвига по плоскости Q вокруг линии EF На поверхности кристалла образуется ступенька, от точки Е до края кристалла. сдвиг нарушает параллельность атомных слоев, кристалл превращается в одну атомную плоскость, закрученную по винту в виде полого геликоида вокруг линии EF, которая представляет границу, отделяющую часть плоскости скольжения, где сдвиг уже произошел, от части, где сдвиг не начинался. Вдоль линии EF макроскопический характер области несовершенства, в других направлениях ее размеры составляют несколько периодов.

Рис. 2.4. Утворення гвинтової дислокації
Методы исследования структуры металлов и сплавов:
а.Макроскопический анализ.
б.Микроскопический анализ.
в.Рентгеноструктурный анализ и рентгеновская дефектоскопия.
а.Макроскопический анализ.
Различают макроструктуру, микроструктуру и тонкую структуру.
Строение металлов и сплавов, видимое глазом или при увеличениях до 30 раз, называется макроструктурой. Макроструктура изучается путём макроанализа. строение изучают в изломе или образцах -- макрошлифах. изучить - первичную кристаллизацию, дефекты, нарушающие сплошность металла, неоднородность структуры…Поверхность образца (темплета) выравнивают на наждачном круге, затем шлифуют. После темплет травят в реактивах, которые по-разному растворяют структурные составляющие и растравливают дефекты. выявляет пороки в слитках и отливках (усадочные раковины, газовые пузыри, трещины…); величину, форму и расположение зерен; дефекты, нарушающие сплошность металла (усадочную пористость, газовые пузыри, раковины, трещины); химическую неоднородность металла; дефекты в сварных швах.
б.Микроскопический анализ.
микроанализ,–изучение структуры металлов при увеличениях с помощью металлографического микроскопа– 50…2000 раз. обнаружить элементы структуры размером до 0,2 мкм.
Металлографический микроскоп рассматривает металл в отражённом свете. при помощи электронного микроскопа, лучи света заменены потоком электронов (до 100 000 раз). Просвечивающие микроскопы. Поток электронов проходит через объект. Изображение результатом неодинакового рассеяния электронов на объекте. Для изучении микроструктуры также приготавливаются шлифы -- микрошлифы, но после шлифования дополнительно производится полирование до зеркального блеска, затем производят травление шлифа.
- в.Рентгеноструктурный анализ и рентгеновская дефектоскопия.
основан на способности атомов отражать рентгеновские лучи. оставляют на фотопластинке группу пятен или колец. По характеру расположения колец определяют тип кристаллической решётки,.
внутренние дефекты металла: трещины, усадочные раковины, пороки сварки рнтгеновские лучи, частично поглощаются. менее плотные части изделия (участки с пороками) поглощают лучи слабее, чем плотные (сплошной металл). на снимке участки с пороками тёмные или светлые пятна на фоне сплошного металлрентгеновские аппараты позволяют просвечивать на глубину до 60 – 100 мм. амма-лучи. просвечивать стальные детали толщиной до 300 мм.
Атомно-кристалічна будова металів