ОЧИСТКА КОНВЕРТИРОВАННОГО ГАЗА ОТ ДИОКСИДА УГЛЕРОДА РАСТВОРОМ ГОРЯЧЕГО ПОТАША В ПРОИЗВОДСТВЕ АММИАКА
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
Пермский национальный исследовательский политехнический университет
Кафедра Химические технологии
КУРСОВОЙ ПРОЕКТ
По дисциплине: Общая химическая технология
ОЧИСТКА КОНВЕРТИРОВАННОГО ГАЗА ОТ ДИОКСИДА УГЛЕРОДА РАСТВОРОМ ГОРЯЧЕГО ПОТАША
В ПРОИЗВОДСТВЕ АММИАКА
СОДЕРЖАНИЕ
- Введение. Краткое изложение существа работы……………………………4
- Выбор и обоснование источников сырья,
энергоресурсов, географической точки строительства……………………..6
- Выбор и обоснование способа производства………………………………10
- Обоснование оптимальных параметров технологического процесса…….17
3.1 Термодинамический анализ (стр. 18)
3.2 Кинетический анализ (стр. 22)
- Синтез и анализ ХТС………………………………………………………...27
- Химическая модель (стр. 27)
- Структурная схема (стр. 28)
- Операторная схема (прил . 1)
Технологическая схема (прил. 2, стр.29),
- Выбор и основание конструкции основного аппарата……………………31
Эскиз основного аппарата (прил. 3)
- Расчет материального и энергетического балансов. Определение расходных норм по сырью и энергии. Пути использования вторичных энергоресурсов………………………………………………………………33
- Материальный баланс процесса (стр. 33)
- Тепловой баланс (стр.35)
- Расходные нормы по сырью и энергии (стр.36)
- Пути использования вторичных ресурсов (стр.37)
- Экологическая оценка производства. Отходы производства и их утилизация. ПДК.……………………………………………………………37
- Заключение…………………………………………………………………..41
- Список литературы………………………………………………………….42
1. ВВЕДЕНИЕ. КРАТКОЕ ИЗЛОЖЕНИЕ СУЩЕСТВА РАБОТЫ
Во всех индустриально развитых странах азотная промышленность является в настоящее время одной из основных ведущих отраслей. Бурное развитие азотной промышленности диктуется в первую очередь необходимостью удовлетворения неудержимо растущего населения земного шара продуктами земледелия. Без минеральных удобрений, и в первую очередь азотных, невозможно решить задачи интенсификации сельского хозяйства.
Производству азотных удобрений и их основы, аммиака, в нашей стране всегда уделялось первостепенное внимание. Среднегодовой прирост темпа аммиака за последние 20 лет составляет 10-19%.
Технологический газ, пригодный для синтеза аммиака, может быть полу�чен практически из любого углеводородного сырья: природного газа, попутно�го газа нефтедобычи, газов переработки нефти, из нефти и ее производных: бензинов, мазутов, из каменного и бурого углей, сланцев и торфа. Основным сырьем производства аммиака (и азотных удоб�рений на его основе) в нашей стране является природный газ. Производство аммиака подраз�деляется на 6 стадий:
- Подготовка природного газа к конверсии (сероочистка);
- Двухступенчатая паровоздушная конверсия (риформинг) природного газа;
- Конверсия оксида углерода водяным паром;
- Очистка конвертированного газа от диоксида углерода;
- Метанирование оксидов углерода;
- Синтез аммиака
Важную роль в производстве аммиака играет очистка газов[1]. Она предусматривает удаление из промышленных или природных газов вредных и балластных примесей с тем, чтобы очищеный газ был пригоден для транспортирования, дальнейшей химической переработки и непосредственного использования.
К настоящему времени на практике применяются следующие виды очистки конвертированного газа от СО2:
- Абсорбция растворами карбонатов
- Абсорбция органическими растворителями
- Водная и щелочная очистка
- Очистка водным раствором аммиака
В большем количестве получил распространение метод поташной очистки (в зависимости от предприятия и технологической схемы горячие поташные растворы или растворы, активированные соединениями мышьяка).
2. ВЫБОР И ОБОСНОВАНИЕ ИСТОЧНИКОВ СЫРЬЯ, ЭНЕРГОРЕСУРСОВ, ГЕОГРАФИЧЕСКОЙ ТОЧКИ СТРОИТЕЛЬСТВА
Процесс производства аммиака характеризуется большой энергоемкостью, что является главным его недостатком. Именно поэтому постоянно ведутся научные разработки, которые призваны решить проблемы экономии энергии. В частности разрабатываются способы утилизации выделенной энергии, а также совмещение, например, производства аммиака и карбамида. Все это способствует удешевлению деятельности предприятий и повышению их полезной отдачи.
Первостепенным энергоресурсом будет являться электроэнергия, расходуемая на работу оборудования: насосы, компрессоры, установок, предназначенных для нагрева (котлы, печи) посредством электрической энергии. Помимо технологического применения электричество используется для освещения производственных помещений. Основным теплоносителем и хладагентом будет являться водяной пар и вода.
Сама технологическая схема производства аммиака зависит, прежде всего, от сырья, из которого получается конечный продукт. Дело в том, что, в отличие от азота, который содержится в воздухе в больших количествах, водород в чистом виде в природе практически не присутствует, а выделять его из воды - довольно трудоемкий и энергозатратный процесс[2].
Географическое расположение подразумевает размещение завода вблизи основного сырья - месторождений газа или заводов нефтепереработки, которые могут предоставить попутный нефтяной газ или природный газ на продажу.
Начнем рассмотрение процесса с изучения сырья и получаемого целевого продукта. В качестве сырья для производства аммиака в основном используются углеводороды, содержащиеся в природном газе. По использованию окислителя и технологическому оформлению можно выделить следующие варианты процесса получения водородосодержащих газов: высокотемпературная кислородная конверсия, каталитическая парокислородная конверсия в шахтных еакторах, каталитическая пароуглекислотная конверсия в трубчатых печах. Перед переработкой конвертированного природного газа необходимо провести процесс очистки. Очистка технологического газа направлена на снижение концентрации диоксида углерода с последующим его выводом из системы.
Оксид углерода(IV) — углекислый газ, газ без запаха и цвета, при сильном охлаждении кристаллизуется в виде белой снегообразной массы — «сухого льда». При атмосферном давлении он не плавится, а испаряется, температура сублимации 78 °С. Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Растворим в воде (1 объём углекислого газа в одном объёме воды при 15 °С). Плотность при нормальных условиях 1,97 кг/м. Концентрация углекислого газа в атмосфере Земли составляет в среднем 0,0395 %. Углекислый газ легко пропускает ультрафиолетовые лучи, и лучи видимой части спектра, которые поступают на Землю от Солнца и обогревают её. В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Диоксид углерода играет одну из главных ролей в живой природе, участвуя во многих процессах метаболизма живой клетки, получается в результате множества окислительных реакций у животных, и выделяется в атмосферу с дыханием. Углекислый газ атмосферы — основной источник углерода для растений. Однако, ошибкой будет утверждение, что животные только выделяют углекислый газ, а растения — только поглощают его. Растения поглощают углекислый газ в процессе фотосинтеза, а без освещения они тоже его выделяют.
Диоксид углерода не токсичен, но не поддерживает дыхание. Большая концентрация в воздухе вызывает гиперкапнию — состояние, связанное с избытком CO2 в крови (оно может вызываться и задержкой дыхания), когда его парциальное давление превышает 45 мм рт. ст. Однако недостаток углекислого газа в крови (гипокапния, возникающая, например, при гипервентиляции лёгких) тоже опасен.
В пищевой промышленности углекислота используется как консервант и разрыхлитель, обозначается на упаковке кодом Е290. Так же применяется для газирования лимонада и газированной воды, в качестве защитной среды при сварке проволокой. «Сухой лёд» — используется в качестве хладагента.
Очистку будем проводить поташным раствором, рассмотрим его свойства. Карбонат калия (углекислый калий, поташ) K2CO3 — средняя соль калия и угольной кислоты. Это белое кристаллическое вещество, хорошо растворимое в воде. Малотоксичен, относится к III классу опасности. Старое название соли — поташ, от лат. Potassa. Поташ — одна из солей, известных людям ещё в древности. Обычно поташ загрязнён различными примесями, поэтому не имеет такого чисто-белого цвета, как измельчённый карбонат калия. До XX века поташ был одним из важнейших промышленных химических реагентов. Его получали путём водной экстракции из растительной золы, с дальнейшей очисткой до необходимого уровня. Производство было сосредоточено в местах, богатых лесом — кое-где в Европе, но, в основном, в России и Северной Америке.
В промышленности используют следующие виды поташа: кальцинированный и полутораводный. В зависимости от физико-химических свойств поташ подразделяется также на первый, второй и третий сорт. Используется в химической и стекольной промышленности, в пожарном деле, в легкой промышленности и в других отраслях. В строительстве поташ применяют в качестве противоморозной добавки, в химической – для изготовления красок, в легкой – для выделки кож. Также поташ применяется в изготовлении моющих средств. Он служит сырьем для производства оптического стекла. В пожарном деле поташом обрабатывают деревянные строения и конструкции. В сельском хозяйстве поташ применяется в качестве удобрений, т.к. калий является жизненно важным элементом для растений. Зарегистрирован в качестве пищевой добавки E501.
-
ВЫБОР И ОБОСНОВАНИЕ СПОСОБА ПРОИЗВОДСТВА
Диоксид углерода содержится в природном и коксовом газах, в конвертированном газе. В последнем содержание СО2 наибольшее и составляет в зависимости от исходного сырья и метода конверсии 20 – 30 % объемных. Можно выделить физические и химические методы очистки от диоксида углерода. Физические методы основаны на повышенной растворимости его в жидкостях или на конденсации СО2 при умеренном охлаждении. Большинство химических методов основано на абсорбции этих примесей растворами химических реагентов, а в случае тонкой очистки - на каталитическом восстановлении их Н2 до СН4. Почти все способы удаления СО2 дают возможность получить его в качестве побочного продукта, используемого в производстве карбамида.
Для грубой очистки газа от двуокиси углерода применяются следующие способы:
- Водная очистка под давлением, а также физическая абсорбция органическими растворителями, имеющими низкое давление паров при обычной температуре
- Моноэтаноламиновая очистка при атмосферном давлении
- Очистка горячим раствором поташа
Для тонкой очистки газа от двуокиси углерода применяются следующие способы:
- Моноэтаноламиновая очистка под давлением
- Очистка водными растворами щелочей
- Низкотемпературная очистка органическими растворителями с одновременным удалением из газа двуокиси углерода и органических сернистых соединений
- Каталитическое гидрирование, осуществляемое совместно с очисткой от окиси углерода
Водная очистка газов от СО2 под давлением
Способ очистки основан на различной растворимости в воде двуокиси углерода. При невысоких парциальных давлениях растворимость СО2 в воде невелика, но с увеличением давления она возрастает. При следующем снижении давления растворённая двуокись углерода выделяется из раствора. Водная очистка газа от двуокиси углерода под давлением весьма эффективна при высоком содержании СО2 в газе. Этот способ отличается простотой и позволяет многократно использовать оборотную воду. Одновременно с растворением двуокиси углерода в воде растворяются и другие компоненты конвертированного газа: водород, азот, окись углерода, сернистые соединения. По химическим свойствам СО2 является ангидридом угольной кислоты. С водой реагирует с образованием угольной кислоты, согласно уравнению:
Н2О + СО2 Н2СО3
В технической оборотной воде, используемой для водной очистки от СО2, содержатся растворённые соли, которые понижают растворимость СО2 в технической воде по сравнению с чистой. Существенное значение для экономичности процесса водной очистки имеет расход воды на очистку и расход энергии на подачу этой воды.
Расход воды на очистку конвертированного газа от двуокиси углерода зависит от степени извлечения СО2, температуры, общего и парциального давления СО2 в газовой смеси до очистки. Если конвертированный газ в процессе конверсии углеводородов или газификации топлива получают при атмосферном давлении, то перед водной очисткой газ компримируют. Выбор давления для водной очистки от СО2 зависит от нескольких факторов.
С увеличением давления возрастает растворимость СО2 в воде и уменьшается количество воды, необходимой для промывки, почти обратно пропорционально давлению. При этом снижается расход энергии на подачу воды. С другой стороны, работа сжатия двуокиси углерода от начального низкого давления до давления абсорбции с увеличением давления возрастает. Суммарный расход энергии на водную промывку газа в пределах 1-3 МПа практически не зависит от давления. Однако с увеличением давления уменьшаются размеры абсорбера и возрастает степень очистки газа от СО2.
Очистка газов от СО2 растворами этаноламинов
Для очистки газа от СО2 применяют растворы этаноламинов (аминоспиртов), которые обладают щелочными свойствами и при взаимодействии с кислотами образуют соли. Обычно используют водные растворы моноэтаноламина СН2ОН-СН2-NH2, диэтаноламина (СН2ОН-СН2)2NH и триэтаноламина (СН2ОН-СН2)3N. Наиболее сильным основанием среди этаноламинов является моноэтаноламин, который нашёл широкое применение в промышленности для очистки газов. При абсорбции СО2 растворами этаноламинов образуются карбонаты и бикарбонаты. Попутно может абсорбироваться сероводород, и образовываться сульфиды и бисульфиды. Эти соединения при температуре выше 100 °С диссоциируют с выделением из растворов СО2 и H2S.
В процессе этаноламиновой очистки газа от СО2 протекают побочные реакции, вызывающие необратимые изменения состава раствора, снижающие его поглотительную способность и приводящие к потерям амина. Растворы этаноламинов вызывают коррозионное разрушение оборудования в определённых условиях, особенно при высоких степенях насыщения кислыми газами. Подобно растворам аммиака, они разрушающе действуют на медь, цинк и их сплавы. Поэтому аппараты и трубы, соприкасающиеся с растворами аминов, нельзя выполнять из этих металлов.
Очистка газов от СО2 горячим раствором поташа
Данный процесс основан на абсорбции кислых газов водными растворами карбонатов калия и натрия, содержащими активирующие добавки поливалентных металлов (As, Se, Te, Sb) или циклических органических соединений. В промышленности в качестве таких активирующих добавок получили соединения мышьяка, вводимые в растворы, как правило, в виде мышьяковистого ангидрида.
Реакции поглощения двуокиси углерода можно представить в виде следующих уравнений:
K2CO3 + H2O + CO2=2 KHCO3
KH2AsO3 + CO2+ H2O= KHCO3 + H3AsO3
H3AsO3 + K2CO3= KHCO3+ KH2AsO3
Эффективность абсорбции CO2 горячими растворами поташа, активированными мышьяком, зависит от температуры, парциального давления двуокиси углерода и водяного пара над раствором, концентрации активирующей добавки и щелочности раствора.
Регенерация отработанных растворов с целью выделения из них поглощенной двуокиси углерода производится путем снижения давления раствора, поступающего на регенерацию. При регенерации таких растворов воздухом возникает опасность окисления трехвалентного мышьяка в пятивалентный, обладающий сильными кислотными свойствами, что снижает эффективность абсорбента. Это нежелательное явление устраняется при частичном отборе раствора для его последующего восстановления.
Недостатками метода очистки синтез-газа моноэтаноламином являются коррозионные свойства растворителя, высокий расход электроэнергии и пара для отгонки растворителя. Промывку синтез-газа горячим раствором карбоната калия выгодно применять при давлениях 14 ат.
Щелочная очистка газа от СО2
Очистка газов от СО2 водным раствором едкого натра NaOH основана на необратимой реакции:
NaOH + СО2 = Na2СО3 + Н2О
Парциальное давление СО2 над раствором едкого натра NaOH в процессе поглощения равно нулю до тех пор, пока вся щёлочь не перейдёт в карбонат. Поглощение СО2 раствором карбоната натрия протекает с образованием бикарбоната:
СО2 + Na2СО3 + Н2О = 2NaHСО3
Скорость абсорбции СО2 щёлочью возрастает с повышением температуры. Увеличение концентрации карбоната в растворе способствует снижению скорости абсорбции. В азотной промышленности очистка водным раствором едкого натра NaOH применяется в качестве последней ступени тонкой доочистки от СО2 конвертированного и коксового газа после водной очистки (когда концентрация СО2 в газе составляет не более 0,3% объёмных).
Процесс проходит в жидкой фазе при 90 - 95 °С и перемешивании. Установка регенерации щёлочи известью является громоздкой и процесс недостаточно удовлетворяет современным санитарно - гигиеническим требованиям (измельчение и гашение извести, транспортирование шлама в отвал и т. д.). Поэтому регенерацию отработанной щёлочи предусматривают только при значительном расходе щёлочи и необходимости привоза её со стороны. В остальных случаях водные растворы отработанной щёлочи стараются использовать для вспомогательных процессов нейтрализации и сбрасывают в специальные системы химически загрязнённых стоков.
Очистка газа от СО2 методом низкотемпературной абсорбции метанолом
В интервале температур от -30 до -60 °С и при давлении 1 - 3 МПа метанол является эффективным абсорбентом не только двуокиси углерода, но и сероводорода, органических соединений серы и некоторых других примесей, присутствующих в газовой смеси. Растворимость СО2 в метаноле значительно выше, чем в воде, и возрастает с понижением температуры и увеличением давления. Так, при -60 °С растворимость двуокиси углерода в метаноле в 75 раз превышает её растворимость в воде при 25 °С. Поэтому при промывке газа метанолом в условиях низких температур расход абсорбента на очистку единицы объёма газа значительно меньше, чем при водной очистке от СО2.
Благодаря этому соответственно уменьшаются энергетические расходы в процессе абсорбции. Потери водорода при низкотемпературной абсорбции также снижаются по сравнению с их потерями при водной промывке газа под давлением. Это связано не только с сокращением удельного расхода абсорбента, но и с уменьшением растворимости водорода в метаноле при понижении температуры. Процесс низкотемпературной абсорбции наиболее целесообразно проводить при 1 - 3 МПа. Нижний предел давления составляет 0,5 МПа. Этот метод эффективен в случае одновременного удаления из газовой смеси нескольких примесей при их достаточно высоком начальном содержании. Несмотря на необходимость применения холодильной машины, энергетические расходы в описанном процессе не превышают расхода энергии при промывке газа водой.
Сравнение различных методов очистки
При выборе процесса очистки окончательным критерием является величина приведенных затрат, зависящих в основном от энергетических и капитальных затрат.
Однако в каждом случае необходимо учитывать факторы, зависящие от конкретных условий и влияющие на экономику процесса. Эти факторы можно разбить на три группы:
- внешние технологические параметры процесса - состав, давление и температура очищаемого газа, требуемая степень очистки, параметры энергоресурсов (давление пара, наличие отбросного тепла, возможность использования вторичных энергоресурсов и т. д.);
- внутренние параметры процесса - расход тепла, электроэнергии, растворителя, отходы, тип и вес аппаратов;
- экономические факторы - цены на энергию, сырье, отходы, аппаратуру, а также дефицитность каких-либо видов сырья и энергии.
Кроме того, следует иметь в виду, что для крупнотоннажных агрегатов при сравнении методов очистки необходимо учитывать степень надежности процесса и оборудования.
Наиболее распространенный производственный вариант достаточно полной очистки – очистка горячим раствором поташа. Метод не требует больших затрат на энергию и сырье, протекание процесса позволяет повторно использовать некоторые ресурсы.
- ОБОСНОВАНИЕ ОПТИМАЛЬНЫХ ПАРАМЕТРОВ ТЕХНОЛОГИЧЕСКОГО ПРОЦЕССА
Очистка конвертированного газа от CO2 – процесс, протекающий в несколько стадий. Во-первых, происходит физическая абсорбция газа (растворение), во-вторых – химическая реакция, результатом которой является связывание растворенного (абсорбированного) газа. Протекание абсорбционных процессов характеризуется их статикой и кинетикой:
Статика абсорбции, т. е. равновесие между жидкой и газовой фазами, определяет состояние, которое устанавливается при весьма продолжительном соприкосновении фаз. Равновесие между фазами определяется термодинамическими свойствами компонента и поглотителя и зависит от состава одной из фаз, температуры и давления.
Кинетика абсорбции, т. е. скорость процесса массообмена определяется движущей силой процесса (т. е. степенью отклонения системы от равновесного состояния), свойствами поглотителя, компонента и инертного газа, а также способом соприкосновения фаз (устройством абсорбционного аппарата и гидродинамическим режимом его работы). В абсорбционных аппаратах движущая сила, как правило, изменяется по их длине и зависит от характера взаимного движения фаз (противоток, прямоток, перекрестный ток и т. д.).
Различают физическую абсорбцию и хемосорбцию.
При физической абсорбции растворение газа не сопровождается химической реакцией (или, по крайней мере, эта реакция не оказывает заметного влияния на процесс). В данном случае над раствором существует более или менее значительное равновесное давление компонента и поглощение последнего происходит лишь до тех пор, пока его парциальное давление в газовой фазе выше равновесного давления над раствором. Полное извлечение компонента из газа при этом возможно только при противотоке и подаче в абсорбер чистого поглотителя, не содержащего компонента.
При хемосорбции (абсорбция, сопровождаемая химической реакцией) абсорбируемый компонент связывается в жидкой фазе в виде химического соединения. При необратимой реакции равновесное давление компонента над раствором ничтожно мало и возможно полное его поглощение. При обратимой реакции над раствором существует заметное давление компонента, хотя и меньшее, чем при физической абсорбции. Уравнение реакции, лежащей в основе хемосорбции рассматриваемого процесса при очистке конвертированного газа:
K2CO3 + H2O + CO2=2 KHCO3
Бикарбонат калия взаимодействует с растворенным углекислым газом, связывая его, что влияет на изменение парциального давления над раствором. С помощью термодинамического анализа определим термодинамические условия протекания процесса, температуру, давление, концентрацию компонентов; определим тепловой эффект реакции и температуру начала реакции. Так же найдем условия протекания побочных реакций и условия максимального выхода целевого продукта (в случае очистки подразумеваем максимальное связывание примесей в ходе протекающей реакции).
- ТЕРМОДИНАМИЧЕСКИЙ АНАЛИЗ
Воспользуемся энтропийным методом для расчета энергии Гиббса:
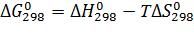
Термодинамические константы исходных веществ и продуктов реакции взяты из справочной литературы[3] и представлены в таблице 3.1.
Проводим расчет и по формулам:
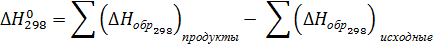
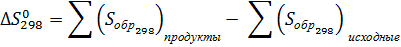
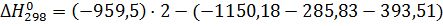
89,48 кДж/моль
89,48 кДж/моль
Таблица 4..1
Термодинамические константы участников основной реакции
|
Термодинамическая величина
|
Вещество
|
|
|
K2CO3
|
H2O
|
CO2
|
KHCO3
|
|
, кДж/моль
|
-1150,18
|
-285,83
|
-393,51
|
-959,5
|
|
, Дж/моль·К
|
155,52
|
68,95
|
213,66
|
128,7
|
Реакция идет с небольшим выделением тепла (экзотермична), для смещения равновесия к продуктам необходимо отводить тепло от системы. За счет последующего применения отведенного тепла к другим процессам можем снизить затраты на энергию (вторичный энергоресурс).
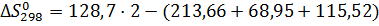
Дж/моль·K
Процесс трудно осуществить при атмосферном давлении, так как энтропия отрицательна. Определим температуру начала реакции, используя следующее условие:
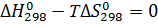
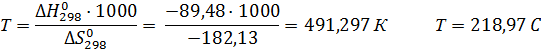
На основе температуры начала реакции выберем температурный интервал расчета энергии Гиббса: 300600 К. С помощью энтропийного метода проведем расчет при различных температурах:
= 89480 300· (182,13) = 34841 Дж/моль
= 89480 400· (182,13) = 16628 Дж/моль
= 89480 430· (182,13) = 11164 Дж/моль
= 89480 460· (182,13) = 5700,2 Дж/моль
= 89480 500· (182,13) = 1585 Дж/моль
= 89480 600· (182,13) = 19798 Дж/моль
Отобразим полученные данные на графике (рис. 4.1) в координатах . Сделаем вывод о влиянии температуры на протекание реакции. Термодинамическая вероятность протекания основной реакции с увеличением температуры уменьшается, необходимость отведения тепла от системы подтверждается.
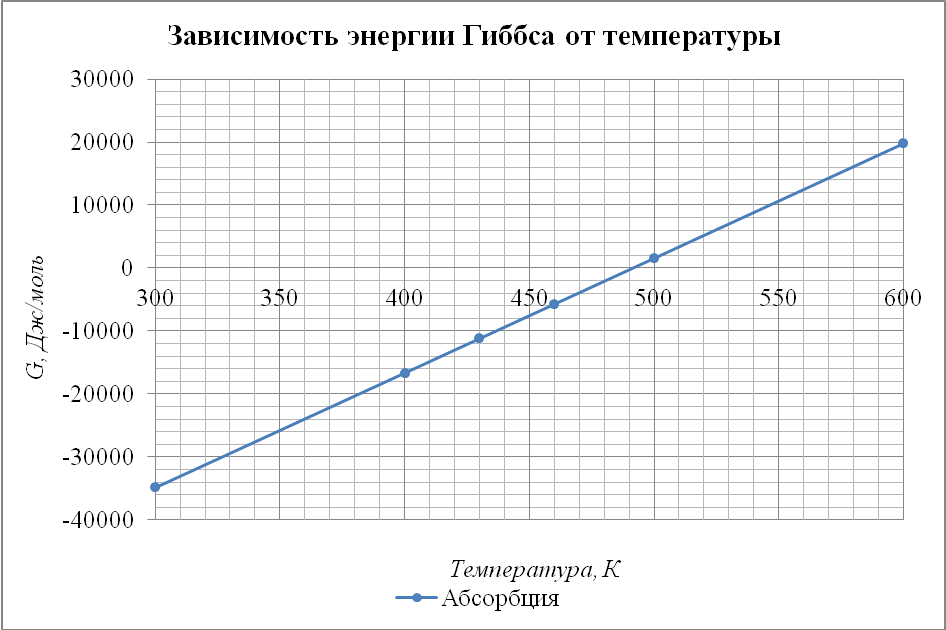
Рис. 4.1.1 График зависимости энергии Гиббса от температуры
Зависимость константы равновесия от температуры может быть представлена в виде уравнения:
Рассчитаем значения констант равновесия в указанном интервале температур, результаты представим в виде таблицы 4.2. Построим график зависимости константы равновесия от температуры протекания процесса.
Таблица 4.1.2
Значения константы равновесия основной реакции при различных температурах
|
Температура, К
|
K2CO3 + H2O + CO2=2 KHCO3
|
|
|
lgKp
|
Kp
|
|
300
|
6,073
|
9,3 1013
|
|
400
|
2,174
|
149,250
|
|
430
|
1,358
|
22,790
|
|
460
|
0,648
|
4,447
|
|
500
|
-0,166
|
0,683
|
|
600
|
-1,726
|
0,019
|

Рис. 4.1.2 График зависимости константы равновесия от температуры
Термодинамический анализ процесса очистки конвертированного газа от диоксида углерода раствором поташа позволил сделать следующие выводы:
- В рассматриваемом интервале температур (300-600 К) термодинамическая вероятность самопроизвольного протекания процесса уменьшается, о чем свидетельствует значение энергии Гиббса.
- Согласно принципу Ле-Шателье увеличение давления способствует смещению равновесия в сторону продуктов реакции (Растворимость СО2 в горячем растворе поташа в значительной степени зависит от парциального давления двуокиси углерода над раствором)
- Увеличение концентрации раствора поташа по сравнению со стехиометрическим ведет к смещению равновесия в сторону продуктов реакции (предельная концентрация соли в горячем растворе 40%, т.к. дальше наблюдается выпадение осадка); горячие растворы поташа вызывают коррозионное разрушение углеродистой стали, поэтому в растворы добавляют ингибиторы коррозии.
- КИНЕТИЧЕСКИЙ АНАЛИЗ
В качестве побочной реакции рассмотрим процесс, который применяют для выделения поглощенного газа (абсорбтива) из абсорбента и получения его в чистом виде, а также для повторного использования абсорбента в процессе абсорбции. Для проведения десорбции газа из жидкости необходимо, чтобы концентрация этого газа в газовой фазе была ниже концентрации, соответствующей равновесной в системе газ – жидкость. На практике для проведения процесса десорбции используют три следующих метода:
- отгонку в токе инертного газа или водяного пара;
- отгонку под действием подводимой к абсорбенту теплоты;
- отгонку при снижении давления над абсорбентом
Учитывая термодинамическую вероятность самопроизвольного протекания основной реакции, заключаем, что в интервале температур 300-600 К возможно протекание обратной реакции (десорбции газа), при подведением тепла к системе.
В общем случае метод хемосорбционной очистки обладает рядом особенностей оп сравнению с физической абсорбцией:
- Возможность абсорбции при низком парциальном давлении вследствие более высокой поглотительной абсорбции раствора;
- Относительно малая циркуляция раствора и соответственно небольшой расход энергии на перекачку сорбента;
- Регенерацию осуществляют, как правило, путем нагревания в сочетании со сбросом давления, при этом расход тепла на десорбцию относительно невелик;
- Регенерацию проводят часто при кипении абсорбента, его пары могут играть роль десорбирующего агента;
- Возможность проведения весьма тонкой очистки;
- Увеличение коррозии и протекание побочных реакций, обусловленных применением повышенных температур и щелочных агентом – сильных и слабых электролитов
Метод поташной очистки основан на применении относительно дешевого абсорбента, но имеет ряд недостатков: малая растворимость карбоната в воде (особенно бикарбоната) при обычной температуре, низкая скорость абсорбции, что приводит к необходимости значительной циркуляции раствора и обуславливает увеличение габаритов аппаратов. Кроме того, равновесное парциальное давление СО2 над растворами поташа относительно велико, и не удается достичь тонкой очистки газа (0,08 –0,15% СО2 в газе после очистки). Преимущество метода – сравнительно низкий расход тепла на регенерацию.
Скорость процесса абсорбции может быть рассмотрена через применение основного уравнения массопередачи[4]. Если выразить движущую силу процесса в концентрациях газовой фазы (парциальные давления), то оно принимает следующий вид:
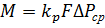
Где – средняя движущая сила процесса, выраженная в единицах давления;
– коэффициент массопередачи, отнесенный к единице движущей силы, выраженной через парциальные давления поглощаемого газа;
Химическая реакция, сопровождающая процесс абсорбции, оказывает существенное влияние на кинетику процесса, т.к. скорость определяется не только интенсивностью массопереноса, но и скоростью протекания химической реакции. Благодаря химической реакции растворенный CO2 переходит в связанной состояние (KHCO3). Концентрация свободного газа в жидкости уменьшается, а процесс абсорбции ускоряется (рост величины ), в сравнении с абсорбцией без химического взаимодействия фаз[1]. Скорость хемосорбция зависит как от скорости химической реакции, так и от скорости массопереноса между фазами. В зависимости от лимитирующего процесса различаются кинетическую и диффузионную области процесса хемосорбции.
Кинетическая область определяется как протекание процесса, при котором скорость химического взаимодействия меньше скорости массопереноса. В диффузионной области лимитирующая стадия – скорость диффузии компонента в зоне реакции, которая зависит от гидродинамических условий в системе и физических свойств.
Абсорбция, как и другие процессы, протекает на границе раздела фаз. Как следствие – абсорбционные аппараты (далее – абсорберы) должна иметь развитую поверхность контакта между жидкой и газовой фазами. Абсорберы по своим конструктивным особенностям делят на следующие основные группы: пленочные, насадочные, тарельчатые, распыливающие. На практике очистка конвертированного газа от CO2 проводится в насадочных колоннах. Варьирование площади поверхности раздела фаз происходит за счет смены насадки. Основные применяемые виды – кольца Рашига и седловидная насадка Берля.
Значения коэффициентов абсорбции CO2 растворами карбонатов могут быть вычисленные по уравнениям[4]:
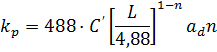
Где – объемный коэффициент абсорбции, отнесенный к газовой пленке, кмоль/(м3·ч·атм)
L – расход жидкости, кг/(м3·ч)
– удельная поверхность несмоченной насадки, м2/м3
C’, n – константы, зависящие от типа насадки
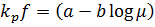
Где – объемный коэффициент абсорбции, отнесенный к газовой пленке,
кмоль/(м3·ч·атм)
– удельная поверхность насадки, м2/м3
a – 0,288 + 0,00316u, (u – плотность орошения), м3/(м2ч)
b = 0,0059
– вязкость раствора
Таблица 4.2
|
Насадка
|
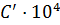
|
n
|
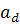
|
|
Кольца Рашига
d=9,5 мм
d=25 мм
|
1,53
0,81
|
0,56
0,36
|
485
190
|
|
Седловидная (насадка Берля),
l = 25 мм
|
1,00
|
0,42
|
259
|
Выводы теоретического анализа:
- По условиям равновесия абсорбция происходит тем полнее, чем ниже температура. Однако, скорость абсорбции тем выше, чем выше температура. На основании сопоставления термодинамических и кинетических факторов выбираем оптимальную температуру абсорбции 35-100оС. Реакции, протекающие при очистке, являются экзотермическими и обратимыми, при повышении температуры раствора химическое соединение разлагается с выделением исходных компонентов, регенерация раствора протекает при 120-135оС.
- Согласно принципу Ле-Шателье увеличение давления способствует смещению равновесия в сторону продуктов реакции. На производстве применяется абсорбционный метод с давлением 2,5 – 2,8 мПа, с последующей тонкой очисткой растворами моноэтаноламина или едкого натра.
- При десорбции применяется дросселирование поглотительного раствора, при котором раствор вскипает и CO2 выдувается образующимся водяным паром.
- На основании справочных данных о влиянии степени карбонизации на температуру выпадения твердой фазы в водных растворах K2CO3, выбираем оптимальную концентрацию раствора 30 – 40%.
- СИНТЕЗ И АНАЛИЗ ХТС
- ХИМИЧЕСКАЯ МОДЕЛЬ
Абсорбционная очистка газа – циклический процесс, на стадии абсорбции диоксид углерода поглощается растворителем, очищенный газ отправляется на последующую переработку, а насыщенный раствор регенерируют, что требует дополнительного расхода энергии. Процесс абсорбции проводим в массообменном аппарате типа насадочной колонны (насадка – кольца Рашига или седловидная насадка Берля).
Первоначально происходит физическая абсорбция CO2 раствором, после чего поглощенный диоксид углерода вступает в реакцию с карбонатом калия. Благодаря химической реакции растворенный CO2 переходит в связанной состояние (KHCO3). Концентрация свободного газа в жидкости уменьшается, а процесс абсорбции ускоряется. Особую важность представляет десорбция компонента и вторичное использование поташного раствора в целях экономии сырья. При десорбции применяется дросселирование поглотительного раствора, при котором раствор вскипает и CO2 выдувается образующимся водяным паром.
Очистка газа поташным раствором основана на взаимодействии диоксида углерода с карбонатом калия по суммарному уравнению
K2CO3 + H2O + CO2 = 2 KHCO3
Скорость реакции практически полностью лимитируется скоростью медленно протекающей реакции в жидкой фазе
СO2 + ОН– = HCO3–
- СТРУКТУРНАЯ СХЕМА
Схема 4.2.1 Структурная схема очистки конвертированного газа от СО2 раствором горячего поташа
Метод основан на применении относительно дешевого абсорбента, но имеет ряд недостатков: малая растворимость карбоната в воде (особенно бикарбоната), низкая скорость абсорбции, что приводит к необходимости значительной циркуляции раствора и обуславливает увеличение габаритов аппаратов. Кроме того, равновесное парциальное давление СО2 над растворами поташа достаточно велико, и не удается достичь тонкой очистки газа (0,08 – 0,15% СО2 в газ после очистки). Преимущество метода – сравнительно низкий расход тепла на регенерацию.
- ТЕХНОЛОГИЧЕСКАЯ СХЕМА
Проведен анализ различных технологических схем, представленных в литературе[1] [4] [5] [8] [9]. Выделены следующие виды схем: с разделенным потоком, схема поташной очистки с активатором, схема поташной очистки без активатора.
Описание технологической схемы
Газ под давлением 12,5 – 15 атм при температуре 155оС, которая развивается при сжатии его в компрессоре, поступает в теплообменник 1, куда подводится отработанный раствор после абсорбции. Часть тепла газ передает раствору, охлаждаясь при этом до температуры 125-130 оС, затем проходит водяной холодильник 2, где охлаждается до 122оС, и через влагоотделитель 3 поступает в абсорбер 4.
В абсорбере имеется несколько слоев насадки из колец Палля. Сюда подается регенерированный раствор поташа, 2/3 которого из регенератора 5 поступает в нижнюю часть абсорбера при температуре 102 °С. Примерно 1/3 раствора охлаждается в водяном холодильнике до 80 °С и затем подается в верхнюю часть абсорбера. Такая схема циркуляции раствора способствует снижению остаточного содержания СО2 в газе.
В абсорбере 4 газ очищается с 18 – 19% начальной концентра�ции СО2 до остаточного содержания 0,3 – 1,5% и при темпера�туре 80 °С выходит из абсорбера. Далее очищенный газ охлаждается в водяных холодильниках и, пройдя влагоотделитель, поступает на сжатие в газовые компрессоры.
Отработанный поташный раствор удаляется из абсорбера че�рез автоматический клапан регулятора уровня, проходит теплооб�менник 1 и дросселируется в верхнюю часть регенератора 5, где поддерживается избыточное давление порядка 0,06 – 0,07 атм. При этом из раствора выделяется двуокись углерода, концентрация которой достигает 99,5 – 99,8% СО2.
Регенератор представляет собой вертикальный колонный аппарат с двумя слоями насадки из колец Палля. Раствор стекает сверху вниз по насадке; при нагревании его парам из раствора выделяется двуокись углерода. К низу регенератора подключен выносной подогреватель, в котором раствор нагревает�ся глухим паром до 104 – 105 °С.
Горячий регенерированный раствор перекачивается из реге�нератора насосом 8 на орошение абсорбера 4. Уровень раствора в регенераторе регулируется изменением подачи свежего конден�сата в куб этого аппарата.
Операторная и технологическая схема поташной очистки конвертированного газа от СО2 приведены в приложениях 1 и 2 соответсвенно.
- ВЫБОР И ОСНОВАНИЕ КОНСТРУКЦИЯ ОСНОВНОГО АППАРАТА
Основными аппаратами на стадии очистки являются абсорберы[7] и регенераторы, в которых осуществляются массообменные процессы поглощения и выделения диоксида углерода.
К массообменной температуре очистки предъявляют следующие требования:
- Большая пропускная способность по газу и жидкости, что позволяет создать малогабаритные аппараты и делает возможным их транспортирование по железной дороге с завода изготовителя
- Высокая степень насыщения хемосорбента а абсорбере, что обеспечивает высокие технико-экономические показатели процесса
- Глубокая степень извлечения СО2 из газа, остаточное содержание не должно превышать 0,03 – 0,15% об.
- Минимальный расход тепла в регенераторе
- Стабильность в работе и легкость регулирования работы аппарата
Для очистки технологического газа от СО2 в крупнотоннажных агрегатах производства аммиака используют насадочные колонны (для случая не активированного поташного раствора). Массообменные аппараты с нерегулярной насадкой обеспечивают высокую надежность эксплуатации в широком диапазоне нагрузок по газу и жидкости, что важно для агрегатов большой единичной мощности. В качестве насадки в абсорберах и регенераторах применяют кольца Рашига, насадку Берля, металлические кольца Палля, керамические седла Инталлокс.
Абсорбер представляет собой двухсекционный аппарат, верхняя секция имеет диаметр 3,9, нижняя – 4,2 м. Аппараты изготовляют из конструкционной низколегированной стали 09Г2С с термообработкой сварных швов. Рабочий диапазон температур для стали от –70оС до +450оС.
Общий вид абсорбера поташной очистки из справочной литературы [5] и показан в приложении 3 Технологические и некоторые конструктивные данные, характеризующие абсорбер приведены в таблице 5.1., проведен сравнительный анализ представленных данных на основе расчетов из литературы[6].
Таблица 5.1
Технологические и конструктивные характеристики абсорбера
поташной очистки
|
Показатель
|
Значение
|
|
Диаметр аппарата, м
|
4,242/2,740
|
|
Высота аппарата, м
|
58,5
|
|
Характеристика насадки, м
|
|
|
нижняя секция, 3 слоя колец Палля, м
|
0,05
|
|
|
верхняя секция, 2 слоя колец Палля, м
|
0,04
|
|
Скорость газа на входе в аппарат, м/с
|
0,24
|
|
Давление в абсорбере, МПа
|
2,7
|
|
Температура раствора, оС
|
|
|
вход, I поток
|
80
|
|
|
вход, II поток
|
102
|
|
|
выход
|
80
|
|
Концентрация СО2 в газе, %
|
|
|
вход
|
18 – 19%
|
|
|
выход
|
0,3 – 1,5
|
|
Сопротивление аппарата, МПа
|
0,05
|
Помимо основных аппаратов – абсорберов и регенераторов, на стадии очистки применяют теплообменные аппараты – газовые и паровые кипятильники, воздушные холодильники, конденсатор-холодильник. Для подачи в абсорбер регенерированного раствора используют насосы с приводом от паровых турбин или с электроприводом.
- РАСЧЕТ МАТЕРИАЛЬНОГО И ЭНЕРГЕТИЧЕСКОГО БАЛАНСОВ. ОПРЕДЕЛЕНИЕ РАСХОДНЫХ НОРМ ПО СЫРЬЮ И ЭНЕРГИИ. ПУТИ ИСОЛЬЗОВАНИЯ ВТОРИЧНЫХ ЭНЕРГОРЕСУРСОВ
- МАТЕРИАЛЬНЫЙ БАЛАНС
Используя данные из литературы[4][5] по входящему и выходящему из абсорбера потоков, рассчитаем материальный баланс в программе Microsoft Office Excel 2007. Исходные данные потоков представлены в таблице 6.1.
Таблица 6.1
Исходные данные по входному и выходному потоку абсорбционного аппарата в методе поташной очистки конвертированного газа от диоксида углерода в производстве аммиака
|
КОНВЕРТИРОВАННЫЙ ГАЗ
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вход в абсорбер
|
|
|
|
Выход из абсорбера
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Статья
|
|
|
% об.
|
|
|
Статья
|
|
|
% об.
|
|
Разница
|
|
|
|
Газ
|
207123
|
|
|
|
Сухой газ
|
171336
|
|
|
35787
|
|
|
|
|
N2
|
41298
|
19,59
|
|
|
|
N2
|
41298
|
23,86
|
|
0
|
|
|
|
|
Ar
|
521
|
0,25
|
|
|
|
Ar
|
521
|
0,30
|
|
0
|
|
|
|
|
H2
|
127671
|
60,56
|
|
|
|
H2
|
127671
|
73,75
|
|
0
|
|
|
|
|
CO
|
1036
|
0,49
|
|
|
|
CO
|
1036
|
0,60
|
|
0
|
|
|
|
|
CO2
|
35958
|
17,06
|
|
|
|
CO2
|
171
|
0,10
|
|
35787
|
|
|
|
|
CH4
|
639
|
0,30
|
|
|
|
CH4
|
639
|
0,37
|
|
0
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0
|
|
|
|
Вода
|
3690
|
1,75
|
|
|
Вода
|
1777
|
1,03
|
|
1913
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В систему приходит
|
210813
|
|
|
|
Выходит из системы
|
173113
|
|
|
37700
|
|
|
Начальное содержание СО2 в газе
|
17,06
|
%
|
|
Остаточное содержание СО2 в газе
|
0,099
|
%
|
|
Степень очистки от СО2
|
|
99,421
|
%
|
|
На хемосорбцию расходуется СО2
|
35787
|
нм3/ч
|
|
Конденсируется воды
|
|
|
1913
|
нм3/ч
|
Таблица 6.2
|
|
Вход в абсорбер
|
|
|
Выход из абсорбера
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Статья
|
|
|
Об.
|
Масс.
|
|
Статья
|
|
Об.
|
Масс.
|
|
|
|
Конвертированный газ
|
210813
|
113489,20
|
|
Сухой газ
|
173113
|
43193,30
|
|
|
14
|
|
N2
|
|
41298
|
25811,25
|
|
|
N2
|
41298
|
25811,25
|
|
|
40
|
|
Ar
|
|
521
|
930,36
|
|
|
Ar
|
521
|
930,36
|
|
|
2
|
|
H2
|
|
127671
|
11399,20
|
|
|
H2
|
127671
|
11399,20
|
|
|
28
|
|
CO
|
|
1036
|
1295,00
|
|
|
CO
|
1036
|
1295,00
|
|
|
44
|
|
CO2
|
|
35958
|
70631,79
|
|
|
CO2
|
171
|
335,89
|
|
|
16
|
|
CH4
|
|
639
|
456,43
|
|
|
CH4
|
639
|
456,43
|
|
|
18
|
|
H2O
|
|
3690
|
2965,18
|
|
|
H2O
|
1777
|
1427,95
|
|
|
|
|
|
|
|
|
|
Вода, конденсат
|
|
|
|
|
|
|
|
|
|
|
|
|
H2O конд
|
1913
|
1537,23
|
|
|
|
Раствор поташа
|
|
734911,61
|
|
Раствор поташа
|
|
|
|
|
|
|
K2CO3
|
|
|
220473,48
|
|
|
H2O
|
|
485680,71
|
|
|
|
|
H2O
|
|
|
514438,13
|
|
На десорбцию
|
|
|
|
|
|
|
|
|
|
|
|
|
KHCO3
|
|
319526,786
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В систему приходит
|
|
|
848400,80
|
|
Выходит из системы
|
|
848400,80
|
|
|
|
|
|
|
|
кг/ч
|
|
|
|
кг/ч
|
|
Сводная таблица материального баланса для абсорбера поташной очистки от диоксида углерода в производстве аммиака
Вывод: Согласно материальному балансу для данного аппарата за час абсорбируется 35787 нм3, а на десорбцию уходит 848400,8 кг абсорбента. Используя последний показатель можно рассчитать материальный баланс для десорбции.
- ТЕПЛОВОЙ БАЛАНС
|
Вход
|
395
|
K
|
|
Выход
|
353
|
K
|
|
|
|
|
|
|
Cp= a + b·T + c·T2
|
|
|
a
|
b
|
c'
|
|
Cp= a + b·T + c'·T-2
|
|
N2
|
27,88
|
0,00427
|
|
|
29,567
|
Дж/моль·К
|
|
Ar
|
27,88
|
0,00427
|
|
|
29,567
|
|
|
H2
|
27,28
|
0,00326
|
0,000005
|
|
28,568
|
|
|
CO
|
28,41
|
0,0041
|
-4,6E-05
|
|
30,029
|
|
|
CO2
|
44,14
|
0,00904
|
-0,00085
|
|
47,711
|
|
|
CH4
|
14,32
|
0,07466
|
-0,00017
|
|
16,616
|
|
|
H2O
|
39,02
|
0,07664
|
0,001196
|
|
69,293
|
|
|
K2CO3
|
80,29
|
0,10904
|
|
|
123,361
|
|
Используя данные из литературы[3] по коэффициентами теплоемкости рассчитаем теплоемкость веществ на входе и количество теплоты приносимое веществами в систему.
|
ПРИХОД ТЕПЛА В СИСТЕМУ
|
|
|
|
|
|
|
|
|
|
|
|
Тепло, приносимое конвертированным газом
|
1672565,221
|
кДж/ч
|
|
|
|
|
|
|
|
|
|
|
|
Теплота химической реакции
|
|
|
39710,06076
|
кДж/ч
|
|
|
|
|
|
|
|
|
|
|
|
Тепло, подводимое
|
|
2310792,774
|
кДж/ч
|
|
|
|
|
|
Итого
|
4023068,055
|
кДж/ч
|
|
|
|
|
|
|
|
|
|
РАСХОД ТЕПЛА СИСТЕМОЙ
|
|
|
|
Теплота конденсации воды
|
3549469,018
|
кДж/ч
|
|
|
|
Тепло, уносимое очищенным газом
|
451046,7019
|
кДж/ч
|
|
|
|
Потери тепла
|
|
|
|
22552,3351
|
кДж/ч
|
|
|
|
|
|
Итого
|
4023068,055 кДж/ч
|
Расчет теплового баланса показал, что необходимо подводить к абсорберу количество теплоты, равное 4023060 кДж. Подача такого количества энергии возможна через нагрев раствора поташа.
- ВТОРИЧНОЕ ИСПОЛЬЗОВАНИЕ ЭНЕРГОРЕСУРСОВ
Технологическая схема, описанная ранее, подразумевает циклическое использование раствора поташа и переносимого им тепла.. На примере теплообменника 01 можем наблюдать охлаждение газа за счет частичной передачи теплоты охлажденному отработанному раствору. Далее отработанный раствор переходит в десорбер 05, где претерпевает дросселирование и обработку водяным паром, за счет чего происходит регенерация поташного раствора, в результате которой горячий раствор идет на дальнейшую абсорбцию, а пар, частично сконденсировавшаяся вода и СО2 выходят из системы. Данная технология позволяет существенно экономить энергию на нагрев и поддержание температуры газа и поташного раствора.
Так же возможно замыкание обмена воды между теплообменниками 02, 03, подачей водяного пара и скруббером-промывателем, что так же существенно снизит затраты на использование энергии и ресурса технической воды.
Тонкая очистка от СО2 позволяет получить два готовых к синтезу или транспортировке и последующей продаже следующие продукты: конвертированный газ (производство аммиака) и СО2 (производство карбамида)
- ЭКОЛОГИЧЕСКАЯ ОЦЕНКА ПРОИЗВОДСТВА. ОТХОДЫ ПРОИЗВОДСТВА, ИХ УТИЛИЗАЦИЯ. ПДК
Экологические проблемы отрасли производства аммиака непосредственно связаны с ее экономическими проблемами. Устаревшие технологии и оборудование не способствуют решению проблем загрязнения среды. Поэтому вложения в модернизацию промышленности напрямую связаны с улучшением экологической ситуации в отрасли. Недостаток таких вложений ведет к снижению спроса на продукцию и объема производства. Неэффективность производства и относительно большое количество отходов на единицу продукции уменьшают доходы, необходимые для инвестирования в природоохранные объекты В производстве аммиака имеются выбросы газов в атмосферу, сточные воды и твёрдые отходы.
Выбросы в атмосферу
Выбросы газов в атмосферу разделяются на:
- постоянные выбросы газов, обусловленные ведением постоянного технологического процесса;
- периодические выбросы газов в период пуска и остановки производства;
- периодические выбросы газов, обусловленные нарушением технологического режима;
В производстве аммиака имеются постоянные выбросы газов, содержащие вредные компоненты: дымовые газы после подогревателя природного газа, дымовые газы после трубчатой печи и вспомогательной печи, «грязная фракция» СО2 или «чистая фракция» СО2 вместе с «грязной», вентвыбросы из аккумуляторной и кислотной. Вредными веществами в выбрасываемых дымовых газах огневого подогревателя сероочистки и первичного риформинга является сернистый ангидрид, окислы азота, окись углерода. Вредными веществами, выбрасываемыми в атмосферу с углекислым газом, является угарный газ, моноэтаноламин и сероводород.
Диаметры и высоты труб выбросов выбраны таким образом, чтобы количество вредных веществ, выбрасываемых в атмосферу, не создавали в приземном слое концентраций вредных веществ, превышающие санитарные нормы (после их рассеивания).
Периодически при пуске агрегата в атмосферу выбрасываются:
- дымовые газы из огневого подогревателя синтеза
- парогазовая смесь из отпарной колонны
Периодически при пуске, остановке, нарушении технологического режима предусмотрено сжигание газов в факельной установке для предотвращения загрязнения атмосферы при выбросах газа. Кроме того, периодически в аварийных случаях в атмосферу сбрасываются выбросы от предохранительных клапанов и перед ремонтом оборудования.
Сточные воды
Для обеспечения надёжности охраны водных ресурсов при аварийных ситуациях и остановках на ремонт агрегата предусмотрено наличие аварийных и дренажных ёмкостей. Все вредные стоки направляются на очистные сооружения и на биологическую очистку. Сбросы после химической очистки (промывки) системы парообразования перекачиваются в накопительные ёмкости и далее на очистные сооружения.
Стоков, содержащих аммиак, из блоков синтеза не имеется. Аммиачная вода, образующаяся в период восстановления катализатора синтеза, а также опорожнения аппаратов от остаточного количества аммиака перед ремонтом направляются в дренажную ёмкость, размещённую на складе жидкого аммиака.
Твёрдые и жидкие отходы
Отработанные катализаторы процессов сероочистки, конверсии метана, конверсии диоксида углерода, метанирования и синтеза аммиака отправляются в отвал, на металлолом или на переработку.
Продувочные газы
Продувочные газы разделяются на фракции в зависимости от температуры. Разделение происходит на аммиачную воду; водород, который поступает обратно на компрессор сжатия газа; метан, который используется в качестве топлива и аргон, который является готовой продукцией.
Рассмотрим предельно допустимые концентрации вредных веществ в воздухе рабочей зоны. Данные представлены в документе ГН 2.2.5.2100-06 "Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны" и Дополнению N 2 к ГН 2.2.5.1313-03.
При концентрации углерода диоксида в воздухе 0,25-1% у человека изменяется функция дыхания и кровообращения, при 2,5-5% наблюдается головная боль, раздражение верх, дыхательных путей и др., при 7% учащается сердцебиение, появляются рвота, головокружение и другие симптомы. При высоких концентрациях углерода диоксида в воздухе наступает смерть от остановки дыхания (при 20% через несколько секунд).
Окись углерода образует с гемоглобином крови стойкие соединения, кровь теряет способность поглощать кислород воздуха, наступает кислородное голодание. Лёгкое отравление угарным газом сопровождается головной болью, шумом в ушах, мельканием и туманом в глазах, слабостью и сильным головокружением, рвотой. При остром отравлении наступает отдышка, потеря сознания, судороги, удушье. Систематическое отравление небольшими дозами угарного газа сопровождается быстрой утомляемостью, раздражительностью, головными болями. ПДК газа в воздухе рабочей зоны составляет 20 мг/м3. Окись углерода – горючий газ, в смеси с воздухом или кислородом образует взрывоопасные смеси.
Водород (Н2) – физиологически инертный газ без запаха и цвета. Может вызывать удушье вследствие снижения концентрации кислорода в воздухе. Легко воспламеняется, пламя бледно-голубого цвета. В смеси с воздухом и кислородом образует взрывоопасные смеси.
Аммиак (NH3) – сильно токсичное, огне- и взрывоопасное вещество. В нормальных условиях – газ, хорошо растворим в воде, имеет резкий характерный запах нашатырного спирта. При нарушении герметичности оборудования и трубопроводов высокого давления мгновенно образует облако большой концентрации. В зоне выделения аммиака у человека могут возникнуть спазмы органов дыхания: из-за сильного слезотечения и рези в глазах происходит потеря ориентации. ПДК аммиака 20 мг/м3.
Моноэтаноламин (МЭА) – и его растворы имеют запах аммиака, токсичны и огнеопасны, вызывают ожоги, опасно попадание их в глаза.
- ЗАКЛЮЧЕНИЕ
В ходе курсовой работы была рассмотрена технологическая схема поташной очистки конвертированного газа раствором горячего поташа. В современной технологии переработки природного газа очистка от диоксида углерода с использованием растворов поташа занимает первое место в общем числе промышленных способов.
Как уже было отмечено выше, эффективность процесса абсорбции СО2 карбонатными растворами зависит от температуры, парциального давления диоксида углерода и водяного пара над раствором, состава и концентрации активирующих добавок, а также от основности раствора. Повышение температуры абсорбции, хотя и приводит к уменьшению поглотительной способности раствора, однако увеличивает растворимость карбонатных солей в воде и скорость абсорбции. В промышленности существуют различные модификации этого процесса, основными отличиями которых являются различные активаторы, температура и концентрация растворов
Дальнейшие научные и технические разработки для данного процесса необходимо направить на повышение степени очистки конвертированного газа и повышение степени десорбции поташного раствора для снижения количества используемого сырья и частичного решения проблем экологического характера.
- СПИСОК ЛИТЕРАТУРЫ
[1] Семенова, Т.А. Очистка технологических газов / Семенова Т.А., Лейтес И.Л., Аксельрод Ю.В., [и др.] М:, Химия 1977, – 488с.
[2] Степанов, А.В. Получение водорода и водородосодержащих газов /Степанов А.В, Киев: Наукова думка 1982, – 312 с.
[3] Равдель, А.А. Краткий справочник физико-химических величин / Равдель, А.А., Пономарева А.М., Спб:. Иван Федоров 2003, – 240 с.
[4] Справочник азотчика: Физико-химические свойства газов и жидкостей. Производство технологических газов. Очистка технологических газов. Синтез аммиака. – 2-е изд., перераб / Под редакцией Е.Я. Мельников, М.: Химия 1986, – 512 с.
[5] Семенов, В.П. Производство аммиака / Семенов В.П., Киселев Г.Ф., Орлов А.А., Семенова Т.А., М:. Химия, 1985, – 368 с..
[6] Александров, И.А. Ректификационные и абсорбционные аппараты: Методы расчета и основы конструирования / Александров И.А., М:. Химия, – 296 с.
[7] Андреев Ф.А. Технология связанного азота/ Андреев Ф.А., Каргин С.И., Козлов Л.И., Приставко В.Ф., М:. Химия 1966, – 500 с.
[8] Ведерников М.И. Производство аммиака из природного газа / Ведерников М.И., Киев: Технiка 1970, – 232 с.
ОЧИСТКА КОНВЕРТИРОВАННОГО ГАЗА ОТ ДИОКСИДА УГЛЕРОДА РАСТВОРОМ ГОРЯЧЕГО ПОТАША В ПРОИЗВОДСТВЕ АММИАКА