Микрофлора воздуха
Мiкрофлора повiтря
Дефiцит вологи та поживних речовин, сонячна радiацiя перешкоджають розмноженню мiкроорганiзмiв в атмосферному повiтрi. Мiкроби потрапляють до повiтря з поверхнi ТСрунту та рослин, з вiдходами виробництва, iз тваринних органiзмiв. Мiкрофлора атмосферного повiтря i вторинною та досить бiдною за видовим складом. Вона залежить вiд iнтенсивностi сонячноi радiацii, вiтру, опадiв, пори року.
При чханнi, кашлi, розмовi iз верхнiх дихальних шляхiв людини в повiтря викидаiться безлiч краплинок слизу з епiтелiальними клiтинами та мiкроорганiзмами. Зваженi в повiтрi краплинки утворюють стiйкий мiкробний аерозоль, дрiбнодисперснi фракцii якого здатнi проникати навiть в середнi та нижнi вiддiли респiраторного тракту людини.
Повiтряно-крапельним шляхом вiдбуваiться передача збудникiв т. з. респiраторних iнфекцiй тАУ грипу та корi, туберкульозу, коклюшу, дифтерii, краснухи, паротиту. Мiкробний аерозоль може стати причиною розвитку алергiчних захворювань, особливо за наявностi в повiтрi цвiльових грибiв та актиномiцетiв.
Розповсюдження мiкробiв за участi повiтря може реалiзовуватись й iншим шляхом, якщо викинутi з респiраторного тракту краплинки висихають на поверхнях i перетворюються на бактерiальний пил. Доведено, що в бiлковому субстратi деякi бактерii виживають довше i такий бактерiальний пил може iнтенсивно перемiщуватись з повiтряними потоками.
Мiкробiологiчнi дослiдження повiтря мають за мету контроль стану повiтряного середовища замкнених примiщень: операцiйних, асептичних палат i блокiв, боксiв аптек, дитячих закладiв i бактерiологiчних лабораторiй.
Для дослiдження мiкрофлори повiтря використовують наступнi методи:
1. Звичайна седиментацiя тАУ т. з. чашковий метод Коха з пасивним осадженням мiкробiв на поверхню щiльного поживного середовища за певний час, зазвичай 5-10хв.
2. Примусова седиментацiя мiкроорганiзмiв повiтря з використанням спецiальних приладiв тАУ iмпакторiв типу приладу Кротова (мiкроби осаджують на поверхню щiльних поживних середовищ) та iмпiнджерiв типу приладу Дьяконова (при продуваннi повiтря мiкроби поступають в рiдкi поживнi середовища). Цi методи найбiльш надiйнi, бо дозволяють давати кiлькiсну характеристику забрудненостi повiтря мiкроорганiзмами та вивчати iх видовий склад.
3. Фiльтрацiйний метод тАУ повiтря продувають крiзь воду або мембраннi фiльтри з наступним мiрним висiвом на поживнi середовища.
Критерiями оцiнки мiкробiологiчного стану повiтря замкнених примiщень i:
а) Загальне мiкробне число (ЗМЧ) тАУ кiлькiсть бактерiй в перерахунку на 1м3 повiтря, що виросли при посiвi на поверхню поживного агару. Посiви iнкубують добу при 370С, потiм ще добу при температурi ~200С.
б) РЖндекс санiтарно-показових бактерiй - кiлькiсть в перерахунку на 1м3 повiтря умовно-патогенних мiкробiв дихальних шляхiв тАУ гемолiтичних стрептококiв, золотистого стафiлокока, грамнегативних бактерiй, дрiжджеподiбних та цвiльових грибiв.
Велике значення для профiлактики гнiйних ускладнень маi мiкробна чистота повiтря в таких мiсцях, як, наприклад, операцiйнi примiщення, для яких ЗМЧ в 1м3 повiтря не повинно перебiльшувати до операцii 500, а пiсля тАУ 1000.
Мiкрофлора ротовоi порожнини
Ротова порожнина людини являi собою унiкальну екосистему з багатством харчових ресурсiв, постiйною вологiстю, оптимальними значеннями рН i температури, що створюють сприятливi умови для адгезii, колонiзацii та розмноження мiкроорганiзмiв.
Однак наявнiсть в ротовiй порожнинi слини та ii бактерицидних компонентiв (iмуноглобулiнiв, лiзоциму, ферментiв), а також потужного епiтелiального покриву, обмежуi можливiсть оральних мiкроорганiзмiв викликати патологiчнi змiни.
В наш час описано кiлькасот видiв мiкроорганiзмiв, що складають нормальну мiкрофлору ротовоi порожнини. До ii складу входять бактерii, вiруси, гриби та найпростiшi.
Серед мiкробiв ротовоi порожнини зустрiчаються автохтоннi (постiйнi) та аллохтоннi види тАУ iммiгранти з iнших бiотопiв хазяiна (носоглотки, кишечнику та iн.) та заносна мiкрофлора iз зовнiшнього середовища. Автохтонна мiкрофлора подiляiться на облiгатну, яка постiйно мешкаi в ротовiй порожнинi, та тимчасову тАУ транзиторну, до складу якоi частiше входять патогеннi або умовно-патогеннi бактерii.
Основна маса грампозитивних кокiв ротовоi порожнини представлена гетерогенною групою стрептококiв, якi приймають активну участь у процесах, що призводять до вражень твердих тканин зуба i пародонта(Streptococcus mutans, S.sanguis, S.mitis, S.salivarium). Вони вiдрiзняються за здатнiстю ферментувати вуглеводи, утворювати перекис водню, синтезувати полiсахариди. Цi види зустрiчаються у ротовiй порожнинi в рiзних кiлькiсних спiввiдношеннях, якi залежать вiд дiiти, гiгiiни ротовоi порожнини та iнших факторiв.
Друга група грампозитивних кокiв тАУ пептококи, якi активно розщеплюють пептони та амiнокислоти. Найчастiше вони зустрiчаються в асоцiацiях з фузобактерiями та спiрохетами при рiзних захворюваннях ротовоi порожнини.
Грамнегативнi анаеробнi коки представленi родом Veillonella, якi приймають активну участь в розщепленнi лактату, пiрувату, ацетату. За рахунок катаболiзму лактату утвореного стрептококами вейлонелли можуть здiйснювати протикарiозну дiю.
Таблиця 1. Бактерii, що входять до складу зубного нальоту
Морфологiчнi
форми
|
Вiдношення до фарбування за Грамом
|
Грампозитивнi мiкроорганiзми
|
Грамнегативнi
мiкроорганiзми
|
|
|
Аероби,
Факультативнi
анаероби
|
Анаероби
|
Аероби,
Факультативнi
анаероби
|
Анаероби
|
|
Коки
|
Стрептококи
|
Пептококи
Стрептококи
|
Нейсерii
|
Вейлонелли
|
|
Палички
|
Актиномiцети
Лактобактерii
Коринебактерii
|
Бiфiдобактерii
Пропiонiбактерii
|
_______
|
Бактероiди
Фузобактерii
Лептотрiхii
Порфiромонаси
|
|
Спiрохети
|
________
|
________
|
Лептоспiри
|
Трепонеми
Борелii
|
Грампозитивнi палички представленi родом Lactobacillus, характерною ознакою представникiв якого i розщеплення вуглеводiв з утворенням великоi кiлькостi молочноi кислоти, зберiгаючи життiздатнiсть у кислому середовищi. Це явище i одним з факторiв, що сприяють розвитку карiiсу зубiв людини.
Грамнегативнi анаеробнi та мiкроаерофiльнi бактерii частiше за все вiдносяться до бактероiдiв, якi не мають каталази i ферментують цукри до газiв, а пептони тАУ з утворенням амiнокислот. До них належать три роди: Bacteroides, Fusobacterium, Leptotrichia.
Bacteroides melaninogenicus та B.gingivalis характеризуються низькою сахаролiтичною активнiстю, але глюкозу розщеплюють з утворенням сумiшi кислот, причому рН середовища залишаiться досить високим (~6.0). Через наявнiсть великоi рiзноманiтностi протеолiтичних ферментiв мають велике патогенетичне значення.
Рiд Фузобактерii, що представлений веретеноподiбними паличками складаi разом з бактероiдами автохтонну мiкрофлору ротовоi порожнини. Утворюють з пептону або глюкози молочну кислоту.
Представники роду Leptotrichia(L.buccalis) мають вигляд попарно розташованих зернистих паличок, часто ниткоподiбноi форми. Ферментують глюкозу з утворенням великоi кiлькостi молочноi кислоти, що призводить до зниження рН (~4.5).
Представники роду Actinomyces кiнцевими продуктами розщеплення глюкози мають молочну, оцтову, мурашину та янтарну кислоти, характеризуються слабкою протеолiтичною активнiстю, приймають участь в утвореннi зубного каменю, зубних бляшок.
Бактерii роду Коринебактерii мають здатнiсть знижувати окисно-вiдновний потенцiал, створюючи таким чином умови для розвитку анаеробiв.
Спiрохети, що мешкають в ротовiй порожнинi, вiдносять до трьох родiв:
Treponema, Borrelia, Leptospira, представники яких вiдрiзняються один вiд одного за бiохiмiчними та iн. особливостями.
В ротовiй порожнинi зустрiчаються й мiкоплазми (M.orale, M.salivarium), якi гiдролiзують аргiнiн та не ферментують глюкозу.
Практична частина
Найпоширенiшим методом дослiдження мiкрофлори повiтря i чашечний метод(м-д Коха), суть якого полягаi у культивуваннi (при певних умовах) мiкроорганiзмiв, що осiли на щiльне середовище (МПА, КА) чашки Петрi. Кiлькiсть колонiй, що виросли на середовищi визначаiться безпосереднiми пiдрахунками. Колонiя не завжди i результатом подiлу однiii клiтини. У звтАЩязку з цим фактом виникаi необхiднiсть виражати кiлькiсть мiкроорганiзмiв в КУО (колонiiутворюючих одиницях) на 1м3 повiтря. Це спiввiдношення знаходить свою реалiзацiю у формулi Омелянського(для методу Коха):
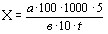 ;
;
при тому, що х тАУ кiлькiсть мiкробiв в 1м3 повiтря;
а тАУ кiлькiсть колонiй в чашцi Петрi;
в тАУ площа чашки Петрi;
t тАУ час експозицii;
5 тАУ час за розрахунками Омелянського;
100 тАУ площа, на яку вiдбувалось осадження;
1000 тАУ дослiджуваний обтАЩiм повiтря.
ОбтАЩiктами дослiджень стали примiщення буфету та кафедри мiкробiологii.
В результатi пiдрахункiв зтАЩясованi наступнi значення КУО:
а) для мiкробiологiчноi аудиторii 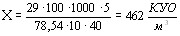 ;
;
б) для буфету 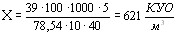 .
.
При дослiдженнi отриманих колонiй iх розрiзняють за такими ознаками, як:
форма, консистенцiя, розмiр, край, колiр, профiль, поверхня.
Дослiдивши вищевказанi ознаки складаiмо таблицю № 1.
Наступними завданнями практичних робiт були роботи по видiленню чистих культур мiкроорганiзмiв методом штриха, що виснажуiться, перевiрка iх однорiдностi свiтловою мiкроскопiiю з додаванням емерсii i т.д.
Таблиця 1. Морфолого-культуральнi властивостi мiкроорганiзмiв.
Пож. серед
|
К-iсть
колонiй
одного
типу
|
Ознаки колонiй
|
Морфологiя
клiтин
|
Форма
|
Розмiр,мм
|
Колiр
|
Поверхня
|
Профiль
|
Край
|
Консистенц.
|
МПА
|
4
|
амебоiдна
|
4-8
|
жовтий
|
зморшкувата
|
кратероподiбний
|
хвилястий
|
тверда
|
маленькi коки
|
МПА
|
2
|
амебоiдна
|
8-14
|
бiлий
|
зморшкувата
|
випуклий
|
хвилястий
|
мтАЩяка
|
бацили
|
МПА
|
6
|
округла
|
5-6
|
бiлий
|
блискуча
|
випуклий
|
рiвний
|
мтАЩяка
|
бацили
|
МПА
|
2
|
округла
|
1-3
|
рожев.
|
гладенька
|
випуклий
|
рiвний
|
мтАЩяка
|
коки
|
КА
|
6
|
округла
|
2-5
|
жовтий
|
блискуча
|
випуклий
|
рiвний
|
мтАЩяка
|
тетракоки
|
КА
|
5
|
округла
|
1-3
|
рожев
|
гладенька
|
випуклий
|
рiвний
|
мтАЩяка
|
коки
|
КА
|
3
|
амебоiдна
|
8-9
|
бiла
|
зморшкувата
|
випуклий
|
хвилястий
|
мтАЩяка
|
бацили
|
КА
|
4
|
амебоiдна
|
6-9
|
жовта
|
зморшкувата
|
кратероподiбний
|
хвилястий
|
тверда
|
маленькi коки
|
Вивчення бiохiмiчних та фiзiологiчних властивостей мiкроорганiзмiв.
Вищезазначенi властивостi вiдiграють провiдну роль в iдентифiкацii та систематицi мiкроорганiзмiв. Бiохiмiчнi властивостi, в першу чергу, дослiджуються шляхом визначення здатностi мiкроорганiзмiв утилiзувати певнi вуглеводи за участю специфiчних ферментiв, та здатностi нейтралiзувати iншi речовини (наприклад, визначення каталазноi активностi бактерiй).
Грампозитивнiсть та грамнегативнiсть мiкроорганiзмiв визначаiться в реакцii з 3% розчином КОН.
Рухливiсть визначаiться характером росту мiкроорганiзмiв засiяних уколом у напiврiдке поживне середовище.
Отриманi практично данi, використовуiмо при заповненнi таблицi:
Таблиця 2.
Морфолого-культуральнi та фiзiолого-бiохiмiчнi властивостi видiленоi культури.
|
Ознаки колонii
|
Рожева, округла, 1-3 мм, край рiвний, профiль випуклий, поверхня гладенька, мтАЩяка консистенцiя
|
|
Морфологiя клiтин
|
коки
|
|
Спороутворення
|
невиявлене
|
|
Рухливiсть
|
невиявлена
|
|
Грампозитивнiсть
Грамнегативнiсть
|
Грамнегативнi
|
Засвоiння цукрiв
|
Виявлена гiдролiзацiйна ативнiсть до глюкози
|
Мiкрофлора зубного нальоту та ротоглотки
При дослiдженнi мiкрофлори зубного нальоту вiдбiр зразку проводився стерильною зубочисткою, готувався препарат, який пiсля фарбування розглядався з iмерсiiю.
При вивченнi мiкрофлори зiву проби брались ватним тампоном, попередньо змоченим у фiзрозчинi. Пiсля цього проводився висiв проби на МПА газоном з одночасним використанням методу стандартних паперових дискiв насичених розчином антибiотикiв для перевiрки чутливостi культури до iх дii. Результатом i утворення зон затримки росту, дiаметр яких залежить вiд чутливостi мiкроорганiзму та, вiдповiдно, активностi антибiотика.
Таблиця 3.
Морфологiя клiтин зубного нальоту та ротоглотки.
|
Морфологiя мiкроорганiзмiв зубного нальоту
|
Морфологiя мiкроорганiзмiв ротоглотки
|
|
Дрiбнi паличковиднi
|
Великi та малi коки
|
|
Нитковиднi
|
Диплококи
|
|
Малi та великi коки
|
Дрiжджi
|
Паралельно з методом стандартних паперових дискiв використовували метод блокiв, при якому використовують поверхневi культури продуцентiв антимiкробних речовин. Результати чутливостi мiкроорганiзмiв внесли до наступноi таблицi:
Таблиця 4.
Чутливiсть мiкрофлори ротоглотки до антибiотикiв та метаболiтiв актиномiцетiв.
|
Назва антибiотикiв та актиномiцетiв
|
Дiаметр зон затримки росту
|
|
Тетрациклiн
|
25 мм
|
|
Еритромiцин
|
5-7 мм
|
|
Бензiлпенiцилiн
|
19мм
|
|
Streptomyces sp.1
|
24 мм
|
|
Streptomyces cyanogenes, Streptomyces griseus
|
_________
|
Висновок
В результатi проведення курсу практичноi мiкробiологii з ознайомлення екологiчних нiш мiкроорганiзмiв, iх складу у рiзних бiотопах, фiзико-хiмiчних та бiологiчних властивостей, патогенезу та важливих корисних функцiй опанували комплекс цiнних методик, а саме:
а) Визначення КУО за методом Коха та з використанням методик Омелянського;
б) отримання чистих культур методом штриха, що виснажуiться;
в) вивчення специфiчних морфологiчних та фiзiолого-бiохiмiчних особливостей видiленоi культури;
г) визначення мiкрофлори зубного нальоту та ротоглотки;
д) опанування важливого в медицинi метода визначення активностi певних антибiотикiв та екзометаболiтiв актиномiцетiв на бактерiальнi колонii.
Киiвський нацiональний унiверситет iм. Тараса Шевченка
Бiологiчний факультет
Звiт з мiкробiологii
Студента РЖРЖРЖ курсу
Групи бiохiмii
Фролова Артема
Киiв 2002
План:
РЖ. Теоретична частина
1. Мiкрофлора повiтря
2. Мiкрофлора ротовоi порожнини
РЖРЖ. Практична частина
1. Методологiя
2. Таблицi
3. Пояснення та хiд роботи
РЖРЖРЖ. Висновок.
Вместе с этим смотрят:
Многообразие ресничных червейМолочное животноводство ПодмосковьяМутацияНаблюдение и уход за больными с заболеваниями органов дыхания