Атомно-молекулярное учение и его законы
Атомно-молекулярное учение и его законы
Химия - наука о веществах, изучающая их состав, строение, свойства, а также превращения веществ, на сопровождающиеся изменением состава атомных ядер.
Использование для нужд человека природных ресурсов тАФ руд, каменного угля, нефти, природного газа, известняков, глин, песка тАФ тесно связано с их химической переработкой. Из природного сырья производятся разнообразные вещества, используемые во всех отраслях техники, в сельском хозяйстве и быту.
Химизация народного хозяйства является одним из решающих факторов технического прогресса. Использование новейших достижений химии позволяет значительно повысить выплавку металлов из руд, создать сплавы высокой прочности и термостойкости. Развитие, в частности, атомной энергетики и космической техники, тесно связано с применением новых материалов, высококалорийного топлива и т. д. Растёт потребность в различных пластических массах и синтетических материалах, которые во всё больших масштабах производятся химической промышленностью.
1. Атомно-молекулярное учение
Представление о том, что все вещества состоят из отдельных частиц, возникло задолго до нашей эры. Древнегреческие философы считали, что вещества построены из мельчайших неделимых частиц тАФ атомов, находящихся в непрерывном движении. В промежутках между атомами находится пустое пространство. Древние мыслители полагали, что все вещества отличаются друг от друга формой, числом и расположением образующих их атомов, а все происходящие в природе изменения объясняли соединением или разъединением атомов.
Наиболее ярко эти взгляды были развиты в древней Греции. Греческий ум отличался особой силой творчества в области гипотез. Он практически исчерпал все мыслимые теории для объяснения Вселенной. Рассмотрим наиболее известных представителей греческой философии и вкратце опишем суть их идей.
Фалес Милетский (640-550 гг. до н. э.) тАФ тАЬНачало всех вещей тАФ вода, из воды всё происходит и всё возвращается к водетАЭ. Вода тАФ главный элемент мироздания из неё всё происходит. Историки науки усматривают в этом Египетские мотивы, где плодородие Земли находилось в прямой зависимости от нильских вод. Это подтверждается тем, что Фалес бывал в Египте.
Анаксимандр (610-547 гг. до н. э.) считал началом всех вещей первоначальное, качественно неопределённое первичное и бесконечное вещество, из коего выделяются первоначальные противоположности тепла и холода, сухости и влажности. Из влажного начального периода произошла Земля и из него же развились постепенно под влиянием тепла растения и животные, и лишь с постепенным высыханием Земли они примяли другие формы.
Анаксимен (ок. 550 г до н. э.) тАФ тАЬВсе тела произошли из воздуха, сгущаясь воздух превращается в воду, а вода в землю, через разряжение воздуха происходит огонь. Все вещества вдыхают воздух, живут им и в него в конце концов возвращаются.
Пифагор Самосский (582-500). Основал в Кротоне школу и философско-политический тайный союз. Поступивший в него осуждался на пятилетнее молчание, и несмотря на это, общество увеличивалось и потом было свергнуто. Пифагор умер добровольной голодной смертью в храме Муз.
Ксенофан тАЬВсё, что произрастает или рождается, тАФ земля и водатАЭ
Гераклит Эффесский утверждал, что начало всему любовь и вражда, что бог тАФ это умный огонь, что всё движется в противоположных направлениях и ничего не стоит. Огонь создал мир и управляет миром.
Анаксагор (500-428 до н. э.) тАФ тАЬГреки ошибочно предполагают, будто что-либо начинается или прекращается; ничто не возникает вновь и не уничтожается; всё сводится к сочетанию или разъединению вещей, существовавших от века. Вернее было бы признать возникновение сочетанием, а прекращение разъединением мельчайших, невидимых глазу частиц которых существует бесконечное множество, и все они непреходящие и неизменяемые первоначальные вещества, отличающиеся друг от друга по форме, цвету и вкусу.
Эмпедокл из Агригента (492-432 до н. э.) тАФ тАЬБезумцы полагают, что может возникнуть что-либо никогда не бывшее или погибнуть, исчезнуть без следа что-либо существенное.. В природе нет возникновения того, что может умереть; нет полного уничтожения; ничего, кроме смешения и разъединения сочетаемого, только невежды называют это рождением и смертьютАЭ. В основу своих сочинений Эмпедокл кладёт четыре стихии или тАЬкорнятАЭ: землю, воду, воздух и огонь. Стихии эти неизменны и неспособны ни возникнуть одна из другой, ни переходить друг в друга. Из их смещения и разъединения происходит всё.
Чтобы прослыть божеством бросился в жерло вулкана тАФ Этны. По легенде гора низвергла назад железные сандалии, показав этим, что божество было мнимым.
Демокрит Абдерский (460-370 гг. до н. э.) разрабатывал атомистическую картину мира, развивая учение своего учителя Левкиппа.
Вселенная состоит из пустого пространства и бесконечного множества неделимых мельчайших частиц тАФ атомов отличающихся по своему очертанию. Тела возникают и исчезают лишь путём сочетания и разъединения атомов, так как из ничего не может произойти ничего и ничто существующее не может исчезнуть. Движение атомов обуславливается не влиянием какой-либо внешней, независимой от них силы, а действием силы, присущей им самим от века. Все атомы находятся в состоянии непрерывного падения в бесконечном пространстве.
Наличие пустоты в пространстве доказывается Демокритом возможностью движения в пространстве, возможностью разряжения с сгущения тел.
Платон (429-342 до н. э.) тАФ земля покоится в центре Вселенной, планеты следуют друг за другом, элементы огня имеют форму тетраэдров, элементы воздуха тАФ октаэдров, воды тАФ икосаэдров, а элементы земли тАФ кубов. Этим элементам соответствуют четыре области: ниже всех лежит наиболее тяжёлая стихия земля; затем следует вода, воздух и огонь. Каждая стихия стремится занять своё место, и тела следуют движению преобладающего в них начала: камень падает на землю, огненные пары поднимаются вверх.
Аристотель (Стагирит) (384-322 гг. до н. э.) учился в академии Платона. Был учителем Александра Македонского, который сказал о нём: тАЬЯ чту Аристотеля наравне со своим отцом, так как если отцу я обязан жизнью, то Аристотеля обязан всем, что даёт ей ценутАЭ.
Природа есть совокупность физических тел, состоящих из вещества и находящихся в состоянии непрерывного движения или изменения. Всякое движение предполагает пространство и время. Пространство сплошь заполнено материей и следовательно не существует пустого пространства, ни мельчайших неделимых частиц материи или атомов.
Если мы будем искать начала чувственных, т. е. осязаемых вещей, то мы найдём не более четырёх противоположностей, доступных ощущению и не выводимых из каких-либо начал: тепло и холод, сухость и влажность. Они представляют собой первоначальные качества материи, т. к. противоположности не могут быть соединимы, то из попарного сочетания их получаются четыре
Сухость
Земля Огонь
Холод Тепло
Вода Воздух
Влажность
основных вещества: жаркий и холодный тАФ огонь; жаркий и влажный тАФ воздух; холодная и влажная тАФ вода; холодная и сухая тАФ земля. Эти четыре вещества содержатся во всех телах либо в действительности, либо потенциально и могут быть выделены из всех тел.. И эти тела неспособны разлагаться на другие вещества, поэтому их и называют стихиями или началами. Начала по природе своей легки и тяжелы. Земля абсолютно тяжёлая, огонь абсолютно лёгкая стихия, воздух и вода по тяжести занимают промежуточное положение. Все тела стремятся вниз к Земле или вверх к небу и движутся в этом направлении до тех пор, пока сопротивление другого тела не остановит их движения.
Наиболее совершенное движение, движение по кругу, продолжающееся равномерно и однообразно во веки веков. Для осуществления этого совершеннейшего движения в природе находится ещё пятое начало, которому также свойственно круговое движение тАФ это эфир, из которого состоит небо тАФ квинтэссенция. Сфера неподвижных звёзд состоит из чистого эфира.
Весьма вероятно, что Эмпедокл и Аристотель не самостоятельно дошли до своего учения об элементах, а заимствовали его из других источников. В древнеиндийских рукописях говорится, что Вселенная состоит из названных четырёх элементов и из эфира, имеющего много общего с квинтэссенцией Аристотеля.
Представления Аристотеля господствовали в науке две тысячи лет. Из теории Аристотеля алхимики сделали вывод о возможном превращении химических элементов. А из квинтэссенции тАФ возможность получения философского камня (эликсира долголетия, универсального растворителя и т. д.).
Роберт Бойль для обозначения атома ввёл понятие тАЬкорпускулатАЭ. Корпускулы по Бойлю различаются размером и формой. Корпускулы первого порядка посредствам имеющихся у них зазубринок соединяются образуя корпускулы второго порядка.
Исаак Ньютон полагал, что мельчайшие частицы, из которых состоят тела, обладают массой. Между частицами действуют силы притяжения и отталкивания.
Основные положения атомно-молекулярного учения:
1. Все вещества состоят из находящихся в непрерывном движении частиц тАФ корпускул (молекул).
2. Корпускулы, в свою очередь, состоят из элементов (атомов).
3. Атомы подобно молекулам находятся в состоянии непрерывного движения и характеризуются определенными химическими свойствами, весом и размерами.
С беспрерывным движением молекул связан целый ряд физических явлений, подтверждающих реальное существование молекул. Одно из таких явлений тАФ диффузия тАФ проникновение молекул одного вещества в другое вещество. Диффузию в газах и жидкостях наблюдать легко: сернистый газ (который вдвое тяжелее воздуха) распространяется по всему помещению, где горела сера; кристаллик перманганата калия (марганцовки), опущенный на дно цилиндра с водой, растворяется и окрашивает весь раствор в малиновый цвет. Диффузия металлов была доказана таким опытом: две отшлифованные пластинки тАФ свинцовая и золотая тАФ были положены одна на другую и оставлены под грузом. Через несколько лет во всех частях свинцовой пластинки были найдены частицы золота (и наоборот).
При нагревании твёрдого тела амплитуда колебаний его молекул всё время увеличивается. По достижении определённой температуры взаимное притяжение частиц уже не может обеспечить строгого порядка в их расположении и вещество плавится.
В жидкостях с повышением температуры всё большее число молекул приобретает энергию, позволяющую им преодолеть молекулярные силы сцепления, оторваться от поверхности жидкости и вылететь в пространство над ней. При температуре кипения парообразование происходит не только на поверхности, но и в объёме тАФ она закипает. Атомы также находятся в непрерывном движении, но его характер более или менее ограничен.
Большинство физических явлений (переход вещества из твёрдого состояния в жидкое или газообразное, увеличение объёма при нагревании и т. п.) не сопровождается изменением химического состава молекул. Так молекулы воды состоят из двух атомов водорода и одного атома кислорода независимо от того, в каком состоянии находится вода тАФ твёрдом, жидком или газообразном. В результате химических реакций атомы переходят из одних молекул в другие. Образуются молекулы новых химических веществ.
До конца XIX в реальность существования атомов и молекул не могла быть подтверждена из-за невозможности непосредственно их измерить и взвесить. Считалось, что атомно-молекулярное учение не отражает объективной реальности, а введено в науку для облегчения понимания химических процессов. Этим сомнениям был положен конец классическими опытами французского физика Перрена.
Он изготовил из смолистого вещества очень маленькие шарики, которые в его опытах играли роль моделей молекул газа. Шарики были приблизительно одинакового объёма, и их массу можно было вычислить. Взболтав эти шарики в воде, Перрен наблюдал в микроскоп их распределение в сосуде. Вычислив количество шариков в единице объёма на различных уровнях, учёный установил, что оно точно соответствует закону уменьшения концентрации газов с высотой. А этот закон был выведен из кинетической теории газов, в основе которой лежало атомно-молекулярное учение.
Перрен определил также кинетическую энергию частиц и обнаружил, что она полностью совпадает с кинетической энергией молекул газов, вычисленной при той же температуре на основании кинетической теории газов.
В настоящее время возмлжно не только вычислить размеры отдельных молекул и их абсолютную массу, но и определить расстояние между ними, а в некоторых случаях тАФ даже сфотографировать их.
Однако не все окружающие нас вещества состоят из молекул. Как показали исследования в области кристаллохимии, структурными единицами не всегда являются молекулами. Если органические вещества (в газообразном, жидком и кристаллическом состоянии) образованы в основном из отдельных, относительно самостоятельных молекул, то у большинства неорганических соединений, находящихся в кристаллическом состоянии, молекул обнаружить не удавалось. Более того, оксиды металлов, их гидроксиды, а также соли не имеют молекул не только в кристаллическом состоянии, но и в расплавах, водных растворах. Так, хлорид натрия при обычных условиях представляет собой кристаллическое вещество с ионами натрия и хлора в узлах кристаллической решётки. Каждый положительно заряженный ион натрия находится в окружении шести отрицательно заряженных ионов хлора, и наоборот: ион хлора удерживает вокруг себя шесть ионов натрия. Очевидно, что такая связь ионов натрия с ионами хлора не даёт никаких оснований для выводов о наличии обособленных, индивидуальных молекул в кристаллах данного вещества. Молекулы NaCl образуется лишь при высоких температурах, когда соль переходит в газообразное состояние. Для карбоната кальция молекулы вообще не известны: в твёрдом состоянии тАФ это кристаллическое вещество с чередующимися в узлах решётки ионами Са2+ и СО32-, в жидкое и тем более газообразное состояние его перевести нельзя, так как при нагревании оно разлагается на оксиды.
Помимо органических соединений молекулярную структуру имеют некоторые неорганические вещества. К ним относятся соединения, в состав которых входят лишь неметаллы, а именно водородные и кислородные соединения неметаллов, соединения неметаллов с азотом, кислородсодержащие кислоты.
2. Закон сохранения массы веществ
Масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции.
С точки зрения атомно-молекулярного учения этот закон объясняется тем, что при химических реакциях общее количество атомов не изменяется, а происходит лишь их перегруппировка. Закон сохранения массы веществ является основным законом химии, все расчёты по химическим реакциям производятся на его основе. Именно с открытием этого закона связывают возникновением современной химии как точной науки.
С законом сохранения массы веществ тесно связан закон сохранения энергии:
энергия не возникает из ничего и не исчезает бесследно, но одни её виды могут превращаться в другие в строго эквивалентных количествах.
Так при разложении воды, кислот, щелочей или солей посредством электрического тока электрическая энергия превращается в химическую. То же наблюдается при зарядке аккумулятора. Обратный процесс тАФ превращение химической энергии в электрическую тАФ происходит при разрядке аккумулятора.
Альберт Эйнштейн показал, что между массой тела и его энергией Е существует связь, выражаемая соотношением:
E = mc2
где с - скорость света в вакууме, равная 300 000 км/с. Это уравнение применимо ко всем энергетическим процессам; в том числе к химическим и ядерным реакциям. Из него следует, что если масса системы изменяется, то происходит изменение и её энергии, и наоборот: изменение внутренней энергии системы всегда сопровождается изменением массы. Вследствие химических реакций всегда выделяется или поглощается энергия. Поэтому строго говоря, масса веществ, участвующих в этих реакциях, должна изменяться: при выделении теплоты тАФ уменьшаться, а при поглощении тАФ увеличиваться. Однако вследствие очень большой величины множителя с2 изменения массы при химических реакциях настолько малы, что определить их существующими методами невозможно.
Рассчитаем, например, какому количеству энергии соответствует изменение массы на 1 г:
Е = 1В·10-3В·(3В·108)2 = 9В·1013 Дж.
При образовании 1 моля воды из газообразных водорода и кислорода выделяется 285,9 кДж энергии, то уменьшение массы составит 3,2В·10-9 г. Эта величина далеко за пределами возможностей взвешивания. Тепловые эффекты химических реакций таковы по своей величине, что изменение массы веществ в их результате не могут быть изменены. Поэтому закон сохранения массы веществ не могут быть измерены. Поэтому закон сохранения массы веществ соблюдается практически при всех химических реакциях.
3. Закон постоянства состава
Закон сохранения массы послужил основой для изучения количественного состава различных химических соединений. Многочисленные опыты показали, что качественный и количественный состав различных сложных веществ постоянен и не зависит от способа их получения.
Так, 44 г углекислого газа (СО2) соединяясь с 56 негашеной извести (СаО), образуют 100 г мела (СаСО3). При этом никакие другие вещества не образуются, а данные соединения вступают в реакцию полностью. Если через негашёную известь пропустить избыток углекислого газа, то он не будет реагировать с образовавшимся мелом.
Чистая (без примесей) вода независимо от того, получена она синтезом из водорода и кислорода, при нейтрализации щёлочи кислотой или при любой другой реакции, и чистая природная вода всегда состоит из водорода и кислорода в соотношении 1:8 по массе.
Французский учёный Жан Луи Пруст, обобщив большой экспериментальный материал о составе различных веществ, сформулировал в 1799 г закон постоянства состава:
каждое химическое соединение имеет постоянный качественный и количественный состав независимо от способа его получения.
Этот закон находится в полном соответствии с атомно-молекулярным учением. Действительно, молекула любого вещества состоит из вполне определённого количества атомов, имеющих постоянную массу. Поэтому её массовый состав и, следовательно, массовый состав вещества постоянны независимо от способа его получения. Такие соединения называются дальтониды.
Современная химия располагает данными, из которых следует, что закону постоянства состава подчиняются главным образом вещества, имеющие молекулярную структуру, если же вещества не имеют молекулярной структуры, то возможны отклонения от этого закона.
Действительно соединения переменного состава, называемые бертолиды, существуют и с каждым годом их открывают всё больше. Эти соединения не имеют определённой химической формулы. Впервые бертолиды были обнаружены в системах, состоящих их нескольких металлов (интерметаллические сплавы), затем среди оксидов, сульфидов, селенидов металлов и др. Например, оксид титана (II) имеет состав от ТiO0,59 до TiO1,33, в соединении таллия с висмутом на 1 часть таллия приходится от 1,24 до 1,82 частей висмута по массе. В природе бертолиды распространены значительно шире, чем дальтониды.
Отклонения от закона постоянства состава может быть обусловлено не только изменениями атомного состава соединений, но и причинами связанными с наличием в природе изотопов. Например, для водорода известны три изотопа с массовыми числами 1 (протий), 2 (дейтерий) и 3 (тритий). Естественно, что в молекуле воды, образованные первым, вторым или третьим изотопом, на 1 атом кислорода приходятся 2 атома водорода (атомный состав постоянен), однако процентное содержание кислорода в этих соединениях переменно и составляет соответственно 88,89; 80 и 72,73 %.
4. Закон кратных отношений. Закон объёмных отношений.
Известны случаи, когда два элемента, соединяясь между собой в различных количественных соотношениях, образуют несколько химических соединений. Так, углерод с кислородом образуют два соединения следующего состава: монооксид углерода (угарный газ) СО тАФ 3 весовых части углерода и 4 весовых части кислорода; диоксид углерода (углекислый газ) СО2 тАФ 3 весовых части углерода и 8 весовых частей кислорода.
Количество весовых частей кислорода, приходящееся в этих соединениях на одно и то же количество углерода (3 весовых части), соотносится между собой как 4:8 или 1:2.
Азот с кислородом образует пять оксидов (табл. 1).
Таблица 1. Состав оксидов азота
Оксид
|
Состав в %
|
Состав в единицах массы
|
|
|
азот
|
кислород
|
азот
|
кислород
|
Гемиоксид азота
|
63,7
|
36,3
|
1
|
0,57
|
Монооксид азота
|
46,7
|
53,3
|
1
|
1,14
|
Сесквиоксид азота
|
36,9
|
63,1
|
1
|
1,71
|
Диоксид азота
|
30,5
|
69,5
|
1
|
2,28
|
Гемипентаоксид азота
|
25,9
|
74,1
|
1
|
2,85
|
Количество весовых частей кислорода приходящееся в этих соединениях на одну весовую часть азота соотносится между собой как 0,57 : 1,14 : 1,71 : 2,28 : 2,85 = 1 : 2 : 3 : 4 : 5.
Данные о количественном составе различных соединений, образованных двумя элементами, и исходя из атомистических представлений, английский химик Джон Дальтон в 1803 году сформулировал закон кратных отношений:
если два элемента образуют между собой несколько соединений, то на одно и то же весовое количество одного элемента приходятся такие весовые количества другого элемента, которые относятся между собой как небольшие целые числа.
То, что элементы вступают в соединения определенными порциями, явилось ещё одним подтверждением правильности атомистического учения и объяснения с его позиций химических процессов.
Однако атомистические представления сами по себе не могли объяснить, например, количественных соотношений, которые наблюдаются в химических реакциях между газами.
Французский учёный Ж. Гей-Люссак, изучая химические реакции между газообразными веществами, обратил внимание на соотношения объёмов реагирующих газов и газообразных продуктов реакции. Он установил, что 1 л хлора целиком вступает в реакцию с 1 л водорода с образованием 2 л хлороводорода; 1 л кислорода взаимодействует без остатка с 2 л водорода, образуя 2 л водяного пара. Эти опытные данные Гей-Люссак обобщил в законе объёмный отношений:
Объёмы реагирующих газообразных веществ относятся между собой и к объемам образующихся газообразных веществ как небольшие целые числа.
5. Закон Авогадро
Итальянский физик Амедео Авогадро сделал очень важное дополнение к атомистической теории. Он ввел понятие о молекуле как мельчайшей частице вещества, способной к самостоятельному существованию. Он использовал понятие молекулы для объяснения простых объёмных отношений между реагирующими газами. В 1811 году он выдвинул следующую гипотезу:
в равных объёмах различных газов при одинаковых условиях (давлении и температуре) содержится равное число молекул.
Авогадро принял, что молекулы простых газов состоят из двух атомов: О2, Н2, Cl2, N2. При этом допущении реакцию между хлором и водородом, приводящую к образованию хлороводорода можно представить уравнением:
Н2 + Сl2 = 2 HСl
из которого видно, что из одной молекулы водорода и одной молекулы хлора образуются две молекулы хлороводорода. Следовательно, и объём, занимаемый хлороводородом, должен быть вдвое больше объёма вступившего в реакцию водорода или хлора. Суммарный же объём исходных газов в соответствии с приведённым уравнением должен быть равен объёму образовавшегося хлороводорода.
Гипотеза Авогадро была подтверждена большим числом экспериментальных данных и вошла в науку под названием закона Авогадро. Этот закон вводил в науку представление о молекулах, как мельчайших частицах элемента.
6. Основные химические понятия
В середине XIX века атомно-молекулярное учение завоевало полное признание. На международном съезде химиков в г. Карлсруэ в 1860 г. были приняты чёткие определения понятий атома и молекулы.
Молекула тАФ наименьшая частица вещества, способная к самостоятельному существованию и обладающая химическими свойствами данного вещества.
Такие физические свойства, как температура плавления и кипения, механическая прочность и твёрдость, зависит от прочности связи между молекулами в данном веществе, поэтому для отдельной молекулы они не имеют смысла. Такие величины, как плотность существуют как для молекулы в целом, так и для вещества. Плотность молекулы всегда значительно больше, чем для твёрдого вещества, так как в каждом веществе при любом агрегатном состоянии между молекулами всегда есть свободное пространство. Электропроводность, теплоёмкость определяются структурой вещества в целом, а не свойствами отдельных молекул. Это подтверждается резким изменением электропроводности при переходе от одного агрегатного состояния вещества в другое. Изменение этих свойств не являются изменением состава молекул, которые при плавлении или кипении вещества, как правило, не претерпевают существенных превращений.
Атом тАФнаименьшая частица химического элемента, входящая в состав молекул и сохраняющая химические свойства данного элемента.
Молекулы могут содержать различное число атомов. Так, молекулы благородных газов одноатомны, простых газов тАФ двухатомны. воды тАФ трёхатомны и т. д., а молекулы белков построены из сотен тысяч атомов.
Химический элемент тАФ есть вид атомов, характеризующийся одинаковым зарядом ядра. В результате сочетания одноатомных атомов образуется простое вещество, которое является формой существования химического элемента в свободном состоянии. Сочетание разных атомов даёт сложное вещество, т. е. химическое соединение.
Многие химические элементы образуют не одно, а несколько простых веществ. Такое явление называется аллотропией, а каждое из этих простых веществ тАФ аллотропным видоизменением (модификацией) данного вещества.
Существование аллопропных видоизменений обусловлено неодинаковой кристаллической структурой простых веществ или различным числом атомов, входящих в состав молекул отдельный аллотропных форм.
Аллотропия наблюдается у углерода, кислорода, серы, фосфора и ряда других элементов. Так, графит и алмаз тАФ аллотропные видоизменения химического элемента углерода. При сгорании каждого из этих веществ образуется диоксид углерода (CO2). Это подтверждает то, что графит и алмаз состоят из одинаковых атомов тАФ атомов химического элемента углерода. Для серы известны три аллотропных модификации: ромбическая, моноклинная и пластическая (некристаллическая форма). Все они состоят из атомов серы и при их сгорании в кислороде образуется одно и то же вещество сернистый газ (SO2). Фосфор образует три аллотропные модификации тАФ белый, красный и чёрный фосфор. Продуктом их сгорания является гемипентаоксид фосфора (Р2О5).
Аллотропные видоизменения химического элемента различаются физическими свойствами и химической активностью. Так, белый фосфор светится в темноте, очень ядовит, воспламеняется на воздухе, легко вступает в химические реакции с другими элементами. Красный фосфор, напротив, не светится, неядовит, не воспламеняется на воздухе, в химические реакции вступает при более высоких температурах, чем белый.
7. Атомная масса. Молекулярная масса
Одной из важнейших характеристик атома является его масса. Абсолютная масса атома (т. е. масса выращенная в граммах) величина очень малая. Так атом водорода имеет массой 1,67В·10-24 г. Поэтому для практических целей удобнее пользоваться атомной единицей массы (а.е.м.). В качестве 1 а.е.м. принята точно 1/12 часть массы атома изотопа углерода 12С.
Атомной массой элемента называется масса его атома выраженная в атомных единицах массы. Иными словами, атомная масса показывает, во сколько раз масса данного атома больше 1/12 массы атома 12С. Так атом азота в 14/12 раза тяжелее атома углерода.
Молекулярной массой вещества называется масса молекулы, выраженная в атомных единицах массы. Например М(СО2) = 44 а.е.м.
До 1961 года для измерения атомных масс использовалась кислородная единица (к. е.), равная 1/16 атома кислорода. Введение углеродной шкалы атомных масс вместо кислородной связано с различием эталонов физической и химической атомных шкал. При масс-спектроскопических измерениях атомных масс в качестве единицы измерения принималась 1/16 массы изотопа кислорода-16, а в основе химической шкалы была 1/16 средней массы атома природного кислорода, состоящего из смеси изотопов 16О, 17О, 18О. Поэтому величины некоторых констант рассчитанные по физической и химической шкалам были различными. Кроме того изотопный состав природного кислорода также непостоянен. В связи с чем и был осуществлён переход на углеродную единицу.
Зная формулу химического соединения, можно рассчитать его молекулярную массу как сумму масс всех входящих в неё атомов. Например:
М(H2SO4) = 1В·2 + 32 + 16В·4 = 98 а.е.м.
Широко применяется в химии и единица количества вещества тАФ моль.
Моль тАФ это количество вещества содержащее столько структурных единиц (атомов, молекул, ионов, электронов и др.), сколько их содержится в 12 г изотопа углерода-12.
Число частиц в одном моле вещества в настоящее время определено с большой точностью тАФ 6,0249В·1023. В практических расчетах его принимают равным 6,02В·1023. Это число называется Числом Авогадро и обозначается буквой N.
Чтобы представить себе, как велико число Авогадро, допустим, что нам удалось пометить все молекулы, содержащиеся в одном моле воды (18 г). Если эту воду вылить в океан и дождаться, когда воды Мирового океана перемешаются, то набрав в любом месте стакан воды, мы найдём в нём примерно 100 меченых молекул.
Масса одного моля вещества называется его молярной массой. Молярную массу обычно выражают в граммах на моль (г/моль) или килограммах на моль (кг/моль). Так, М(СаСО3) = 100 г/моль = 0,1 кг/моль.
Моль любого вещества содержит одно и тоже число структурных элементов независимо от его химических свойств и агрегатного состояния.
Из этого следует, что моль молекул различных газов при одних и тех же условиях занимает одинаковый объём. Этот вывод был подтверждён опытными данными.
Объём, занимаемый одним молем газа при нормальных условиях (температура 0 В°С, давление 760 мм рт. ст. или 101325 Па) называют мольным объёмом. Он равен 22,4 литра.
8. Закон эквивалентов
Закон постоянства состава позволил установить количественные соотношения, в которых различные химические элементы соединяются между собой, Д. Дальтон ввёл в науку понятие о соединительных весах элементов, впоследствии названных эквивалентами.
Эквивалентной массой элемента называют такое его количество, которое соединяется единицей (точнее 1,008)массы водорода или с 8 единицами массы кислорода или замещает эти же количества в их соединениях.
Теперь эквивалентом элемента называют такое его количество, которое взаимодействует с 1 молем атомов водорода. Например, в соединениях HCl, H2S, NH3, CH4 эквивалент хлора, серы, азота и углерода равен соответственно 1, 1/2, 1/3 и 1/4 моль. Масса 1 эквивалента элемента называется эквивалентной массой. В приведённых выше примерах эквивалентная масса хлора равна 35,5 г/моль, серы тАФ 16 г/моль, азота тАФ 4,67 г/моль, углерода тАФ 3 г/моль. Из опытных данных следует, что единица массы водорода эквивалентна (равноценна) 8 единицам массы кислорода, или 16 единицах массы серы или 9 единицам массы алюминия, или 35,5 единицам массы хлора и т. д.
Введение в химию понятия эквивалент позволило сформулировать закон эквивалентов:
вещества вступают в реакцию в количествах, пропорциональных их эквивалентам.
При решении некоторых задач удобно пользоваться другой формулировкой закона: массы реагирующих веществ пропорциональны их эквивалентным массам.
Для определения эквивалентной массы элемента необходимо знать состав его соединения с другим элементом, эквивалентная масса которых известна.
Пример.
1. Определим эквивалентную массу и эквивалент кальция, если известно, что при сгорании 0,5 г этого металла образуется 0,7 г оксида.
Следовательно оксид содержит 0,5 г металла и 0,2 г кислорода, а эквивалентная масса кислорода 8 г/моль, отсюда:
0,5 г металла взаимодействует с 0,2 г кислорода,
а Мeg(X) взаимодействует c 8 г кислорода
Мeg(X) = 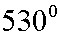 = 20 г/моль.
= 20 г/моль.
Эквивалент кальция равен 1/2 моля.
Пример.
2. Определить Мeg(Al) и эквивалент алюминия, зная, что в хлориде алюминия содержится 20,2 % алюминия.
Хлор в соединениях с металлами имеет валентность 1, следовательно Мeg(Cl) = 35,5 г/моль, отсюда:
Мeg(Al) соединяется с 35,5 г хлора,
а 20,2 г -тАЭ- с 79,5 г
Мeg(Al) =  = 9 г/моль
= 9 г/моль
Эквивалент алюминия равен 1,3 моль.
Если один элемент образует с другим элементом несколько соединений, то его эквивалентная масса в этих соединениях неодинакова. Например, сера с кислородом образует диоксид серы SO2 и триоксид серы SO3. В первом соединении на 8 единиц массы кислорода приходится 8 единиц массы серы. В триоксиде серы на 8 единиц массы кислорода приходится 5,3 единицы массы серы. Следовательно, в диоксиде серы её эквивалент равен 1/4 моль, а в триоксиде 1/6 моль.
Важной характеристикой химического элемента является его валентность. Валентностью называется свойство атомов данного элемента присоединять или замещать в соединении определённое число атомов другого элемента. За единицу валентности принята валентность атома водорода, которая во всех соединениях равна единице. Валентность элемента выражается только целым числом.
Валентность, эквивалентная масса и молярная масса связаны соотношением:
М(Х) = ВВ·Мeg(X).
Из этого уравнения следует, что эквивалентная масса элемента можно рассчитать, разделив мольную массу атомов элемента на его валентность.
Понятие об эквиваленте и эквивалентной массе распространяются и на сложные вещества. Химическим эквивалентом сложного вещества называют такое количество его, которое взаимодействует без остатка с одним эквивалентом водорода или с одним эквивалентом любого другого вещества.
При решении задач на вычисление эквивалентных масс необходимо иметь в виду следующее:
1) эквивалентная масса оксида равна сумме эквивалентных масс кислорода и элемента, входящего в состав оксида;
2) эквивалентная масса кислоты равна сумме эквивалентных масс водорода и кислотного остатка;
3) эквивалентная масса основания равна сумме эквивалентных масс металла и гидроксильной группы;
4) эквивалентная масса соли равна сумме эквивалентных масс металла и кислотного остатка.
Для вычисления эквивалентной массы кислоты необходимо разделить её мольную массу на основность кислоты, которая для данной реакции определяется числом атомов водорода, замещающихся металлом.
Так, ортофосфорная кислота Н3РО4 в зависимости от условий протекания реакций может быть вступать как одно-, двух- или трёхосновная. Так при образовании дигидрофосфата, гидрофосфата и фосфата эквивалент фосфорной кислоты будет соответствовать 1, 1/2 и 1/3 моль.
Чтобы вычислить эквивалентную массу основания, необходимо его молярную массу разделить на кислотность основания, определяемую числом вступающих в реакцию гидроксильных групп.
Мeg(NaOH) = 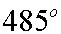 = 40 г/моль; Мeg(Ca(OH)2) =
= 40 г/моль; Мeg(Ca(OH)2) =  74/2 = 37 г/моль.
74/2 = 37 г/моль.
Для соли:
Мeg(NaNO3) =  = 85 г/моль; Мeg(Cr2(SO4)3) =
= 85 г/моль; Мeg(Cr2(SO4)3) =  = 65,4 г/моль.
= 65,4 г/моль.
Из приведённых примеров следует, что эквивалентная масса сложного вещества в общем случае не является величиной постоянной, а зависит от химической реакции, в которой принимает участие данное соединение.
Если в реакции принимают участие газообразные вещества, пользуются понятием об эквивалентном объёме, т. е. объёме, который занимает при данных условиях один эквивалент газообразного вещества. Так, при нормальных условиях эквивалентный объём водорода равен 11,2 л, эквивалентный объём кислорода тАФ 5,6 л.
9. Определение молекулярной и атомной массы
Некоторые методы определения молекулярных масс
Закон Авогадро открывает путь для экстремального определения молекулярных масс газов и веществ, переходящих в газообразное состояние без разложения. Пусть число молекул в заданном объёме сравниваемых газов составляет N. Если массу молекулы первого газа m1, а массу молекулы второго газа тАФ m2, то массы заданных объёмов, т. к. объёмы принимаются равными будут относиться, как молекулярные массы.
Отношение массы данного объёма газа к массе такого же объёма другого газа называется плотностью одного газа по второму и обозначается буквой D:
D = m1/m2
Принимая во внимание, что молярная масса пропорциональна молекулярной:
M = 6,02В·1023m
получаем: D = M1/M2.
Плотность D газа показывает, во сколько раз один газ тяжелее другого. Если известны плотность D первого газа по второму и молярная масса M2 последнего, можно вычислить молярную массу M1 первого газа.
Обычно плотность газа определяют по водороду или по воздуху, вводя соответственно обозначение DH или Dвозд.
Если известна плотность газа по водороду, то M1 = DHВ·M(H2), а так как молярная масса водорода округленно равна 2, то М1 = 2 DH.
Если известна плотность газа по воздуху, средняя молярная масса которого принимается равной 29, то искомая молярная масса газа M1 = 29 Dвозд.
Примеры.
3. Вычислить молярную массу монооксида азота, плотность которого по водороду равна 15. М(NO) = 2В·15 = 30 г/моль.
4. Вычислить молярную массу бутана, если его плотность по воздуху равна 2. М(С4Н10) = 2В·29 = 58 г/моль.
Для определения молярной массы газа можно использовать представление о его молярном объёме. Моль любого газа про нормальных условиях занимает объём 22,4 л. Следовательно, если известна масса m некоторого объёма V газа при нормальных условиях, то M можно вычислить по пропорции:
V л газа имеют массу m г
22,4 л -тАЭ- х г
x =  ; M = x г/моль
; M = x г/моль
Примеры.
5. Вычислить молярную массу этана 5,6 л которого при нормальных условиях имеют массу 7,5 г.
5,6 л этана имеют массу 7,5 г,
а 22,4 л -тАЭ- х г
х =  = 30 г.
= 30 г.
Зная молярную массу газа легко вычислить его плотность по водороду, воздуху или любому другому газу, молярная масса которого известна.
6. Вычислить плотность по водороду гемиоксида азота.
DH(N2O) = = 22
= 22
7. Найти плотность по воздуху тетрафторида кремния.
Dвозд. (SiF4) =  = 3,59.
= 3,59.
Измерения объёмов газов обычно проводят при условиях, отличных от нормальных. Для приведения объёма газа к нормальным условиям используют уравнение объединенного газового закона Бойля-Мариотта и Гей-Люссака:
 =
= 
В этом уравнении V тАФ объём данной массы газа при заданных давлении p и температуре T (в Кельвинах); Vо тАФ объём этой же массы газа при нормальных условиях (при давлении 101325 Па, или 760 мм рт. ст. и температуре 273 К).
Если Vо означает объём, занимаемый при нормальных условиях 1 молем газа, т. е. 22,4 л, то для всех газов соотношение  будет постоянной величиной. Эта величина называется универсальной газовой постоянной, обозначается буквой R, имеет размерность единица энергии/(КельвинВ·моль). Численное значение R зависит от единиц, в которых выражается объём и давление газа.
будет постоянной величиной. Эта величина называется универсальной газовой постоянной, обозначается буквой R, имеет размерность единица энергии/(КельвинВ·моль). Численное значение R зависит от единиц, в которых выражается объём и давление газа.
В Международной системе единиц (СИ) давление выражается в паскалях (Па, 1 Па = 1 Н/м2), объём в кубических метрах (м3), следовательно значение универсальной газовой постоянной определяется значением:
R =  1,013В·105В·22,4В·10-3 / 273 = 8,314 Дж/(КВ·моль).
1,013В·105В·22,4В·10-3 / 273 = 8,314 Дж/(КВ·моль).
В практике химических исследований объём и давление часто выражают в единицах других систем: объём тАФ в литрах или миллилитрах, давление тАФ в атмосферах или миллилитрах ртутного столба. Для перевода результатов измерений в единицы СИ пользуются соотношениями:
1 атм = 760 мм рт. ст. = 101325 Па
1 мм рт. ст. = 1,31В·10-3 атм = 133,322 Па.
Если давление ро выражено в атмосферах, а объём Vo тАФ в литрах, то:
R =  = 0,082 лВ·атм/(КВ·моль).
= 0,082 лВ·атм/(КВ·моль).
Для случая, когда ро выражено в миллиметрах ртутного столба, а объём V6 тАФ в миллилитрах, получим:
R =  = 62360 млВ·мм рт. ст./(КВ·моль).
= 62360 млВ·мм рт. ст./(КВ·моль).
Подставим в уравнение  =
=  вместо
вместо  постоянную R и получим уравнение для 1 моля газа:
постоянную R и получим уравнение для 1 моля газа:
 = R, или pV = RТ
= R, или pV = RТ
Для n молей газа это уравнение приобретает следующий вид:
pV = nRТ
Это уравнение получило название уравнение Клапейрона-Менделеева. Учитывая, что число молей газа n равно отношению массы газа в граммах к его мольной массе, т. е. n = m/M, уравнение Клапейрона-Менделеева часто применяют в виде:
рВ·V =  .
.
Уравнение Клапейрона-Менделеева позволяет рассчитать молярную массу, а следовательно и молекулярную массу любого вещества, находящегося в газообразном состоянии:
M =  .
.
Пример.
8. Вычислить молекулярную массу диэтилового эфира, если 215 мл его паров при 77 В°С и давлении 700 мм рт. ст. имеют массу 0,51 г.
M =  =
=  = 74 г/моль
= 74 г/моль
Молярная масса диэтилового эфира равна 74 г/моль, следовательно, его молекулярная масса 74 а.е.м.
9. Найти молекулярную массу оксида углерода (IV), если 73,3 г его при 27 В°С находясь в сосуде ёмкостью 10 л, создают давление 4,1 атм:
М = 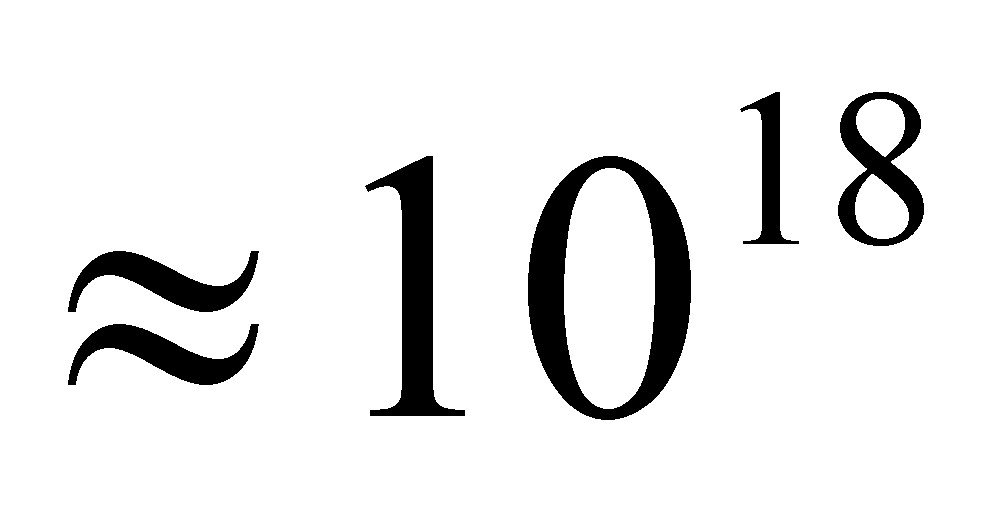 = 44 г/моль.
= 44 г/моль.
Следовательно молекулярная масса диоксида углерода равна 44 а.е.м.
Некоторые методы определения атомных масс химических элементов
Метод Авогадро. Как было показано, закон Авогадро позволяет определить молекулярные массы газов. С другой стороны, результаты изучения объёмных соотношений газов, вступающих в реакцию, и полученных газообразных продуктов позволяют определить число атомов в молекуле. Так, при взаимодействии одного объёма хлора с одним объёмом водорода образуются два объёма хлороводорода. Из этого следует, что молекула хлора, как и молекула водорода, состоит из двух атомов. Аналогично было установлено, что молекулы других простых газов, таких как кислород, азот, также двухтомны. Атомную массу перечисленных газов находят делением их молекулярной массы на два.
Например, молекулярная масса хлора равна 71, следовательно его атомная масса 35,5.
О количестве атомов, входящих в состав молекул, можно также судить по их молярной теплоёмкости. Именно по результатам измерения этой характеристики благородных газов было установлено, что их молекулы одноатомны и атомная масса этих газов равна их молекулярной массе.
Метод Канниццаро. Этот метод применим для определения атомных масс элементов, дающих газообразные или легколетучие соединения. Для нахождения атомной массы этим методом определяют молярную массу возможно большего числа газообразных или легколетучих соединений данного элемента. Затем на основании данных анализа рассчитывают, сколько атомных единиц массы приходится на долю этого элемента в молекуле каждого из взятых соединений. Наименьшее количество данного элемента в молекуле изученных веществ и будет его атомной массой, так как в молекуле не может находиться меньше одного атома.
В табл. 2 приведены молекулярные массы ряда соединений углерода, процентное содержание углерода в каждом из них, а также масса углерода, содержащаяся в каждом из этих соединений.
Наименьшая масса углерода, содержащегося в молекулах приведённых соединений равна 12 а.е.м. Следовательно атомная масса углерода не может быть больше 12 (иначе пришлось бы предположить, что в состав сероуглерода, диоксида и монооксида углерода входит часть атома углерода). Считать атомную массу углерода меньше 12, также нет оснований, так как соединения, содержащие менее 12 а.е.м. углерода неизвестны.
Таблица 2. Молекулярные массы некоторых углеродсодержащих соединений и содержание в них углерода.
|
Соединение
|
Молекулярная масса
|
Содержащие углерода
в % в а.е.м.
|
Сероуглерод
|
76
|
15,79
|
12
|
Диоксид углерода
|
44
|
27,27
|
12
|
Монооксид углерода
|
28
|
42,86
|
12
|
Ацетон
|
58
|
62,07
|
36
|
Диэтиловый эфир
|
74
|
64,86
|
48
|
Ацетилен
|
26
|
92,31
|
24
|
Бензол
|
78
|
92,31
|
72
|
Нафталин
|
128
|
93,75
|
120
|
Метод Менделеева. Атомную массу элемента можно рассчитать, исходя из положения этого элемента в Периодической системе. Приблизительную атомную массу элемента можно вычислить как среднеарифметическое атомных масс соседний с ним элементов. Так, атомная масса алюминия, рассчитанная как среднеарифметическое атомных масс магния, кремния, бора и скандия:
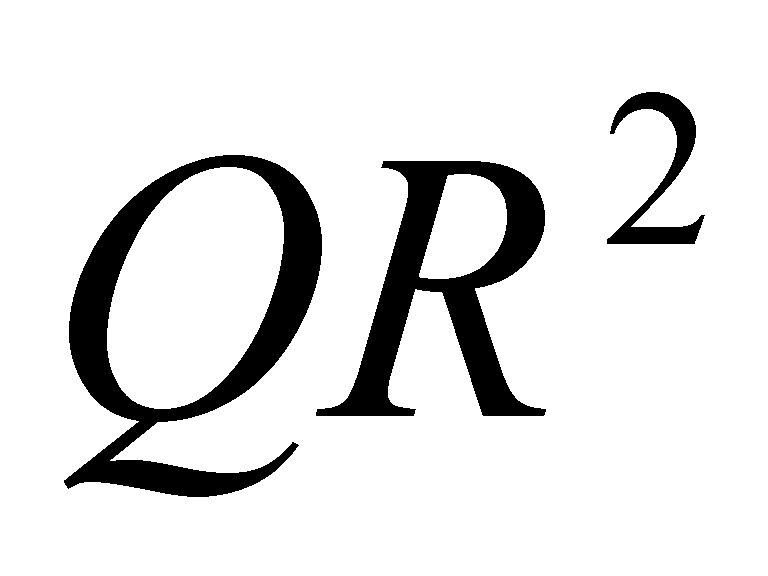 = 27,05
= 27,05
вполне удовлетворительно согласуется с табличной величиной 26,98. Для определения точного значения атомной массы элемента необходимо знать его эквивалентную массу. Разделив приблизительное значение атомной массы элемента на его эквивалентную массу, находят валентность элемента, округлив её до целочисленного значения, и затем, умножая эквивалентную массу на валентность элемента, находят его точную атомную массу.
Метод, основанный на законе Дюлонга и Пти. Французские учёные П. Дюлонг и А. Пти установили закон, согласно которому атомная теплоёмкость простого вещества в твёрдом состоянии (т. е. произведение его удельной теплоёмкости на молярную массу атомов) есть величина постоянная и равная в среднем 26 Дж/((КВ·моль).
Из закона Дюлонга и Пти следует, что разделив 26 на удельную теплоёмкость простого вещества, легко определяемую экспериментально, можно найти приблизительное значение атомной массы данного элемента.
Чтобы перейти от приблизительного значения атомной массы к точному её значению, предварительно определяют опытном путём эквивалентную массу данного элемента. Разделив приблизительное значение атомной массы на его эквивалентную массу, находят валентность элемента, часто несколько отличающуюся от целого числа. Так как валентность выражается только целыми числами, найденное значение округляют. Умножив эквивалентную массу на валентность, получают точное значение мольной массы атомов.
Пример.
10. Определить атомную массу металла, удельная теплоёмкость которого равна 0,226 Дж/(гВ·К), а его оксид содержит 21,23 % кислорода.
Вычислим приблизительное значение молярной массы атомов металла
М(Ме) ≈ 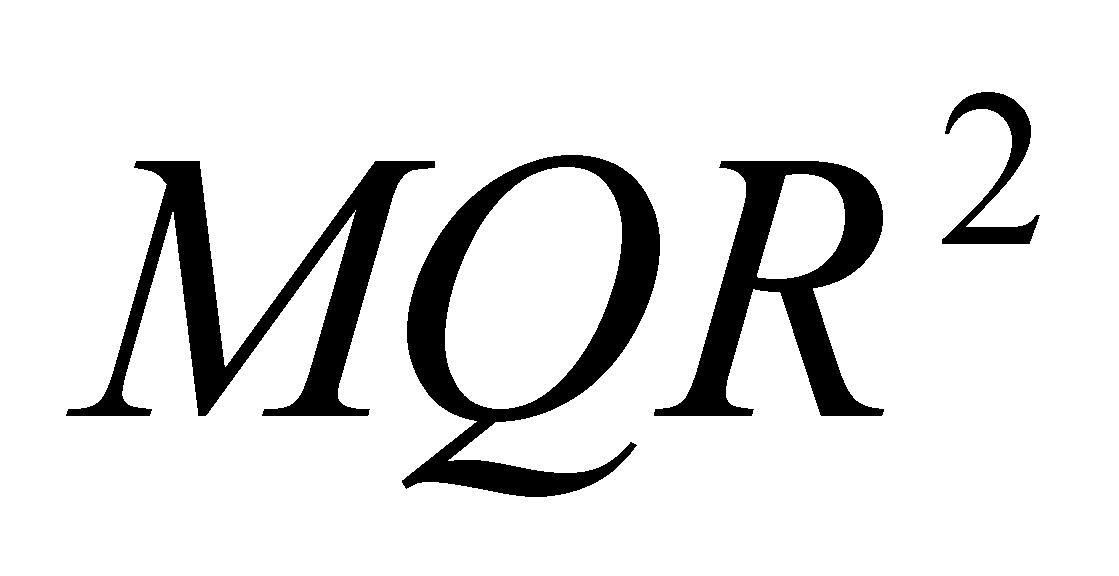 = 115 г/моль
= 115 г/моль
значение эквивалентной массы металла:
21,23:78,77 = 8:х х = 78,77В·8 / 21,23 = 29,68 г/моль
и валентность металла:
 = 3,87
= 3,87
Так как валентность может выражаться только целым числом, полученное значение округляем до 4. Умножая эквивалентную массу на валентность, вычислим точное значение молярной массы атомов металла:
29,68 В· 4 = 118,70 г/моль
По Периодической системе находим, что это олово.
10. Химические формулы
Для обозначения состава молекул простых и сложных веществ пользуются химическими формулами. Все молекулы данного вещества одинаковы, поэтому химическая формула выражает состав не только отдельной молекулы, но и всего химического соединения. Химическая формула вещества показывает, из каких элементов состоит данное вещество и сколько атомов каждого элемента входит в состав его молекулы.
Химическая формула позволяет вычислить молекулярную массу веществ, а также массу и процентное содержание входящих в его состав элементов.
Пример.
Вычислим процентный состав карбоната калия. Молекулярная масса M(K2CO3) = 2 В· 3,91 + 12 + 3 В· 16 = 138,2. Следовательно, содержание калия равно 56,59 % 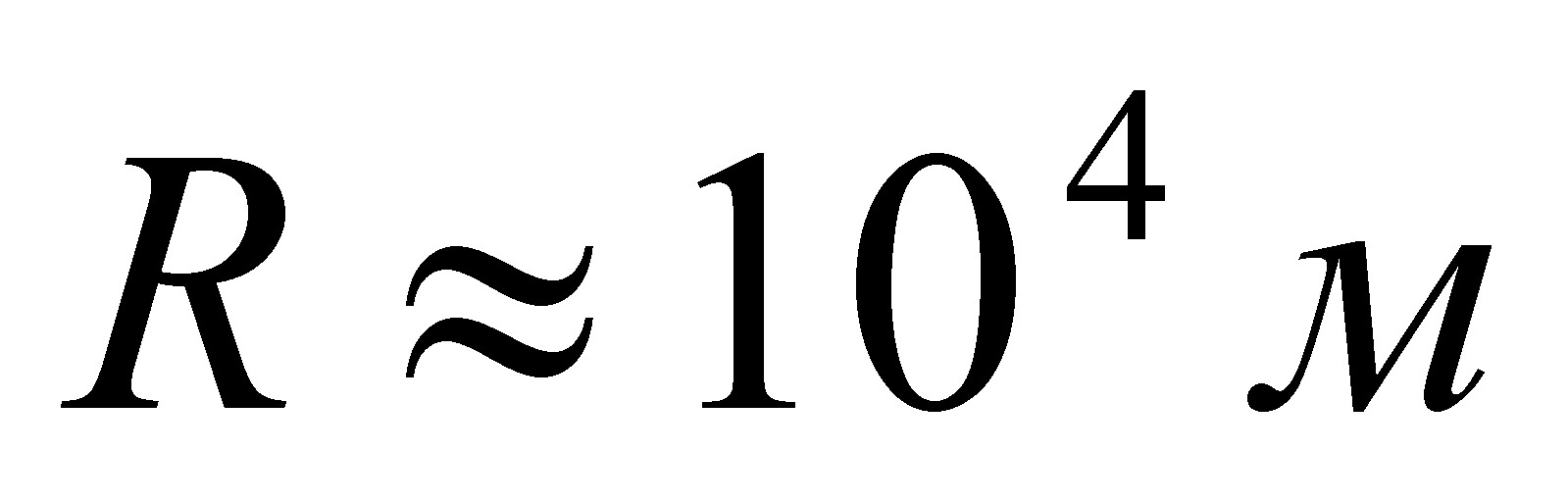 , содержание углерода тАФ 8,68 %
, содержание углерода тАФ 8,68 % 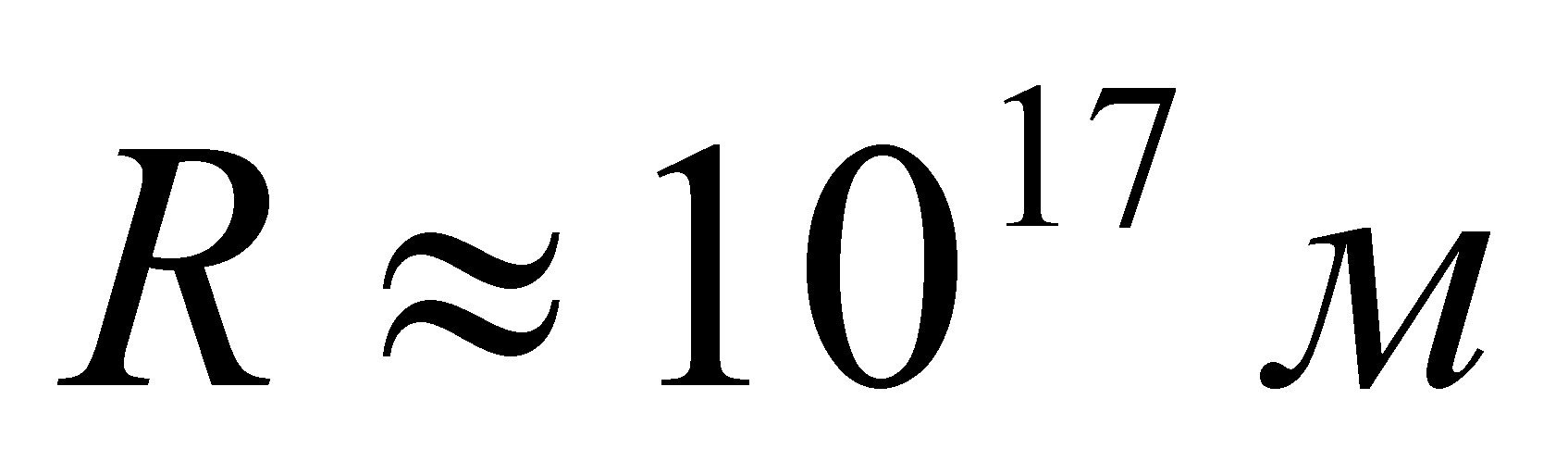 , содержание кислорода тАФ 34,73 %
, содержание кислорода тАФ 34,73 %  .
.
Если известно процентное содержание каждого элемента, входящего в состав данного вещества, можно установить формулу этого вещества.
Пример.
Выведем формулу углеводорода, содержащего 83,72 % углерода и 16,28 % водорода. Плотность паров этого углеводорода по водороду равна 43.
Предположим, что в молекулу этого углеводорода входят x атомов углерода и y атомов водорода, т. е. углеводород имеет формулу CxHy. Масса углерода в этом соединении составит 12 В· x, а водорода 1 В· y. Очевидно, соотношение масс углерода и водорода будет равно соотношению процентного содержания этих элементов в углеводороде:
12x : y = 83,72 : 16,28.
Разделим соответствующие члены этой пропорции на атомные массы углерода и водорода:
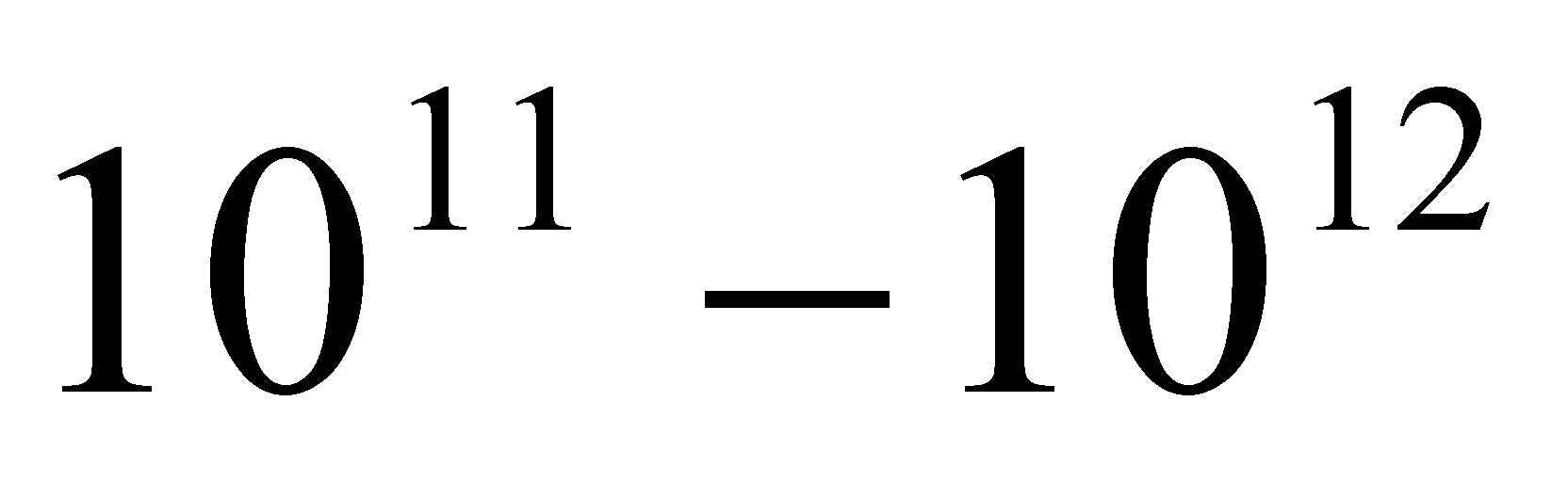 .
.
Разделим в правой части пропорции на меньшее из них:
x : y = 1 : 2,33,
а затем умножим числа в правой части пропорции на 3:
x : y = 3 : 6,99.
Из найденного видно, что в исходном углеводороде на 3 атома углерода приходится 7 атомов водорода. Этому условию отвечает ряд соединений: C3H7, C6H14, C9H21 и т. д.
Химическая формула, показывающая соотношение атомов в молекуле, выраженное минимальными числами, называется простейшей. Следовательно, C3H7 является простейшей формулой искомого углеводорода.
Для нахождения истинной химической формулы соединения необходимо знать его молекулярную массу. По условию задачи плотность углеводорода по водороду равна 43. Следовательно, его молекулярная масса согласно уравнению М = 2 DH будет равна 2 В· 43 = 86.
Найденная величина вдвое превышает молекулярную массу, отвечающую простейшей формуле C3H7, следовательно, истинная формула искомого углеводорода C6H14.
Пример.
Выведем простейшую формулу соединения, содержащего 17,1 % кальция, 1,7 % водорода, 26,5 % фосфора и 54,7 % кислорода. Запишем формулу искомого соединения следующим образом: CaXHyPzOv. Принимая во внимание процентный состав соединения, записываем:
40x : y : 31z : 16v = 17,1 : 1,7 : 26,5 : 54,7,
и далее:
x : y : z : v = 
x : y : z : v = 0,43 : 1,7 : 0,86 : 3,42.
Разделив числа в правой части соотношения на меньшее из них, получим:
x : y : z : v = 1 : 3,85 : 2 : 7,95.
Полученные данные позволяют заключить, что простейшая формула искомого соединения тАФ CaH4P2O8 или Ca(H2ВнPO4)2.
Часто для большей наглядности химические соединения изображают графически, показывая последовательность, в которой атомы соединены друг с другом в молекуле данного вещества. При этом символ каждого элемента снабжается количеством черточек, равным валентности элемента в этом соединении. Изображая те или иные соединения графически, необходимо следить, чтобы все единицы валентности атомов, входящих в молекулу этого соединения, были взаимно насыщены.
При графическом изображении молекул кислородсодержащих кислот необходимо помнить, что атомы водорода, способные замещаться металлом, всегда соединяются с кислотообразующим элементом через атом кислорода:
HтАФOтАФCl 
Хлорноватистая Серная Ортофосфорная
кислота кислота кислота
В молекулах оснований гидроксильная группа ОН- всегда присоединяется к атому металла посредством атома кислорода:
NaтАФOтАФH 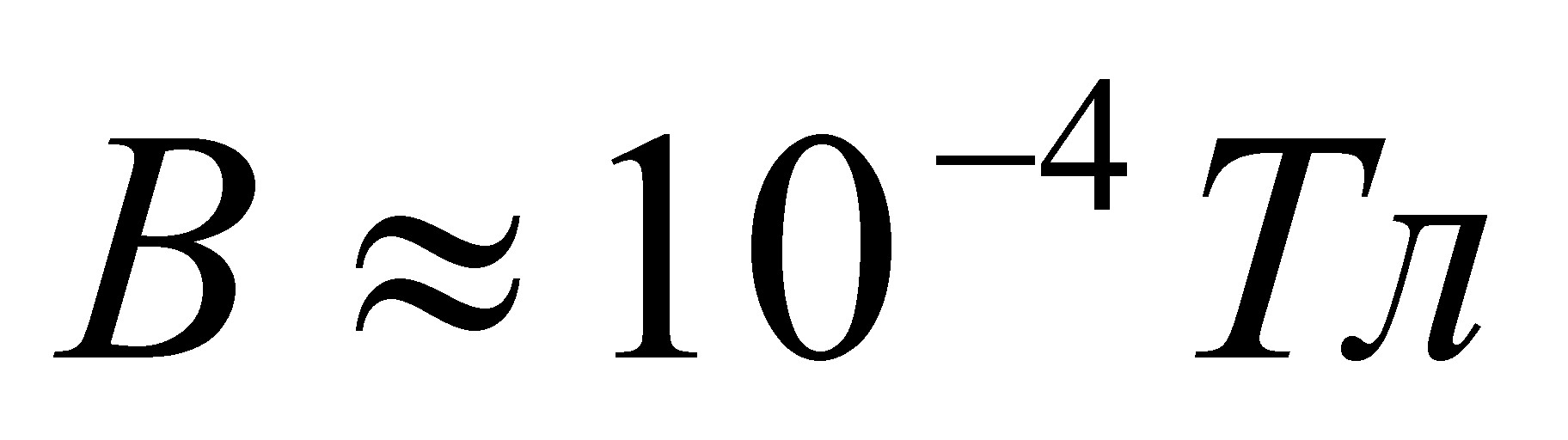
Гидроксид натрия Гидроксид кальция
Ниже приведены графические формулы сульфата железа (III) Fe2(SO4)3 (а), гипохлотита магния Mg(OCl)2 (б), оксихлорида магния Mg2OCl2 и оксихлорида алюминия Al2OCl4 (г):

а
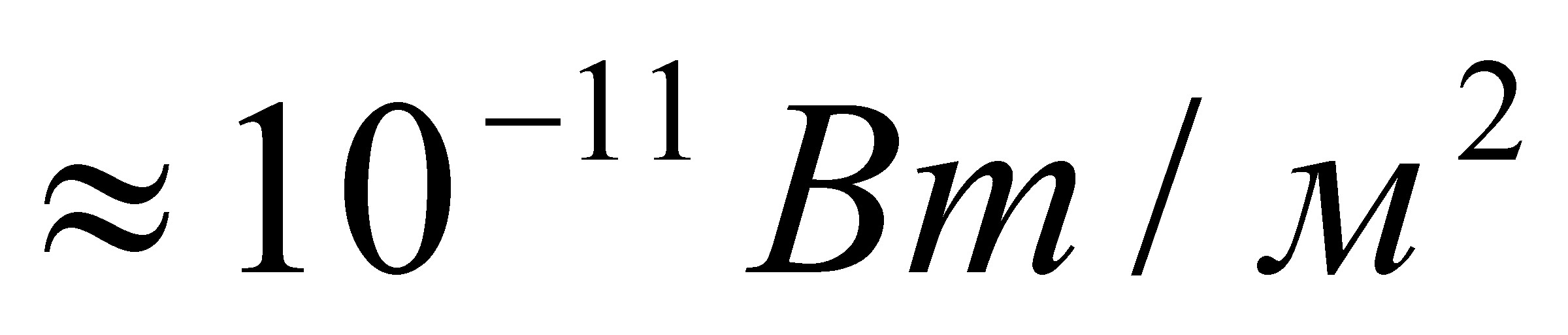
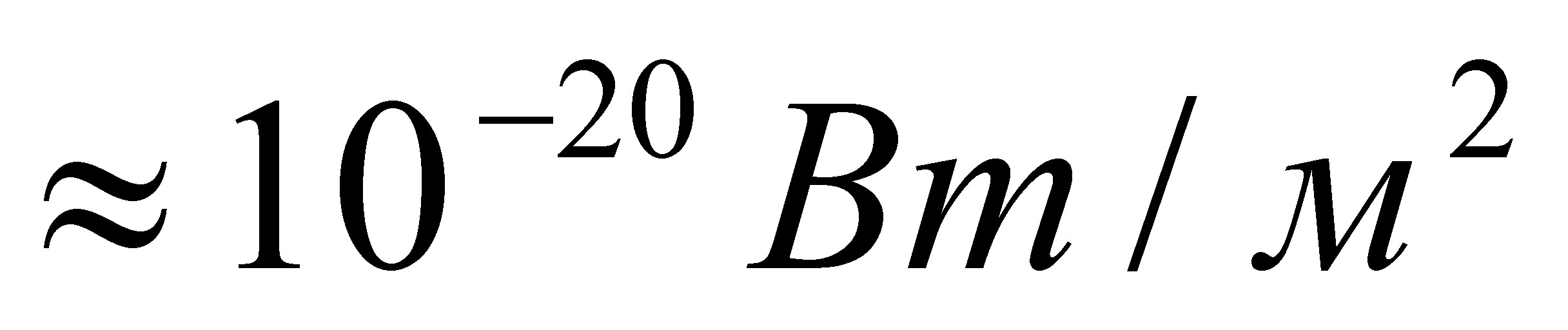
б в г
Следует, однако, иметь в виду, что графическое изображение формул не всегда отражает действительное расположение и связи атомов в молекуле вещества. Поэтому нельзя отождествлять графическое изображение со структурной формулой. Совпадение графического изображения со структурной формулой наблюдается у веществ с молекулярным типом кристаллической решётки. У этих соединений молекулы, находящиеся в углах кристаллической решётки, сравнительно слабо связаны между собой. Молекулярные кристаллические решётки имеют многие кислоты, оксиды неметаллов и большинство органических соединений.
При написании формул соединений с ионным типом кристаллической решётки тАФ солей, оснований, оксидов металлов тАФ ограничиваются графическим изображением, так как у этих соединений весь кристалл представляет собой гигантскую молекулу. Находящиеся в узлах кристаллической решётки ионы симметрично окружены противоположно заряженными ионами.
Структурные формулы, изображая порядок соединения атомов в молекуле, не отражают, однако, их действительного пространственного расположения. С помощью пространственных моделей можно наглядно представить связи между атомами и их взаимное расположение. Шаро-стержневые модели молекул делают наглядным относительное положение атомов в пространстве, но не соответствуют действительному соотношению атомных радиусов и длин химических связей.
Масштабные пространственные модели молекул, сделанные на усечении шаров (Стюарт, Бриглеб и др.), широко используются для установления возможной степени сближения групп в молекуле. На рис. 1 приведено несколько способов изображения молекул водорода, воды и аммиака.
|
|
Молекулярная формула
|
Структурная формула
|
Модели молекул
|
Водород
|
Н2
|
H
H
|
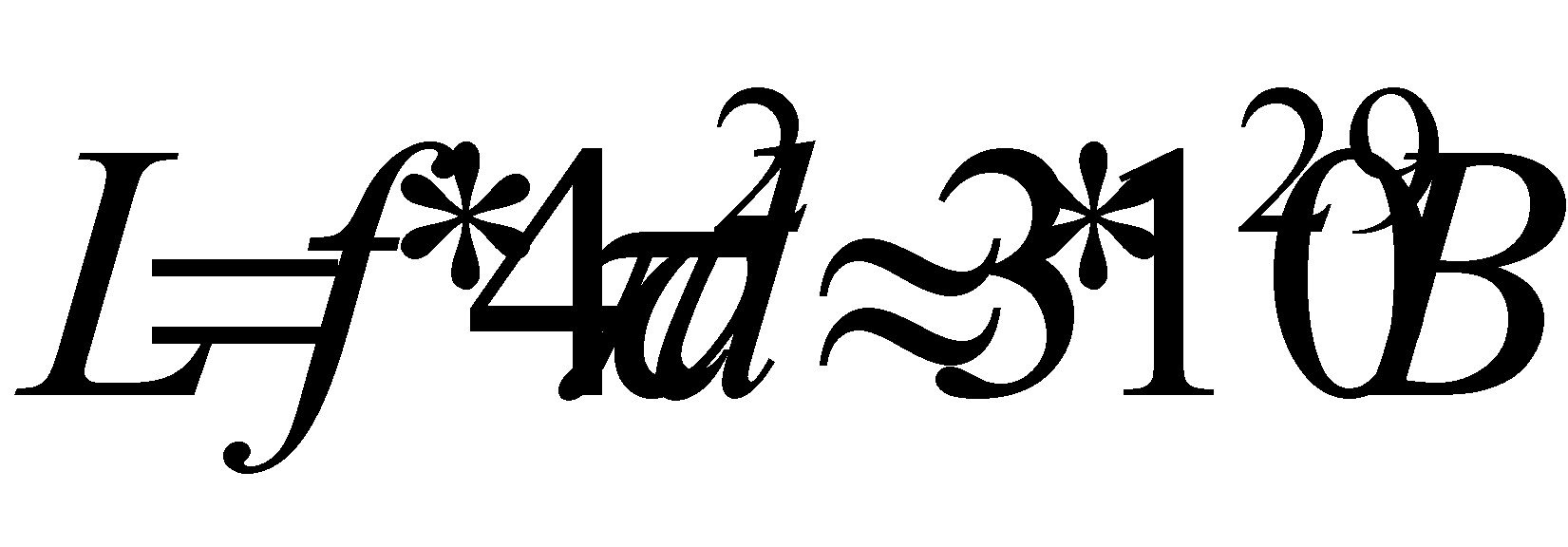
|
Вода
|
Н2О
|
O
H
H
|

|
Аммиак
|
NH3
|
N
H
H
H
|
|
Рис. 1. Способы изображения молекул.
11. Химические уравнения
Выражение реакции при помощи химических формул называется химическим уравнением. Химические уравнения показывают, какие вещества вступают в химическую реакцию и какие вещества образуются в результате этой реакции. Уравнение составляется на основе закона сохранения массы и показывает количественные соотношения веществ, участвующих в химической реакции.
В качестве примера рассмотрим взаимодействие гидроксида калия с фосфорной кислотой:
Н3РО4 + 3 КОН = К3РО4 + 3 Н2О.
Из уравнения видно, что 1 моль ортофосфорной кислоты (98 г) реагирует с 3 молями гидроксида калия (3В·56 г). В результате реакции образуется 1 моль фосфата калия (212 г) и 3 моля воды (3В·18 г).
Подписав под формулами веществ, принимавших участие в реакции их количества:
Н3РО4 + 3 КОН = К3РО4 + 3 Н2О.
98 168 212 54
98 + 168 = 266 г; 212 + 54 = 266 г видим, что масса веществ, вступивших в реакцию, равна массе продуктов реакции. Уравнения химической реакции позволяет производить различные расчёты, связанные с данной реакцией.
Пример.
14. Определить количество граммов фосфата калия, который получится при нейтрализации фосфорной кислоты 42 г гидроксида калия.
В соответствии с приведённым выше химическим уравнением решим пропорцию:
168 г гидроксида калия образуют 212 г фосфата калия,
а 42 г гидроксида -тАЬ- х г фосфата
х = 42В·212/168 = 53 г.
В уравнении реакции коэффициенты перед газообразными веществами показывают не только соотношение масс реагирующих газов, но и их объёмные соотношения. Это позволяет рассчитать объёмы участвующих в реакции газов непосредственно по уравнению минуя вычисления массы газа.
Пример.
15. При взаимодействии металлического натрия с водой выделилось 280 мл водорода (при н. у.). Сколько граммов натрия вступило в реакцию?
Запишем уравнение реакции взаимодействия натрия с водой:
2 Na + 2 H2O = 2 NaOH + H2↑
46 36 80 22,4
Из уравнения следует, что 2 моля натрия (2В·23 г) вытесняют из воды 1 моль водорода (22,4 л при н. у.). Количество вступившего в реакцию натрия можно найти по пропорции
46 г натрия вытесняет из воды 22,4 л водорода,
а х г натрия -тАЬ- 0,28 л
х = 46В·0,28/22,4 = 0,575 г.
Примеры решения типовых задач.
1. Соединение некоторого элемента Х с кислородом содержит 60 % этого элемента. Найти его эквивалентную массу (Meg).
Решение. Массовое процентное содержание элемента Х показывает сколько его весовых частей приходится на 100 вес. частей соединения, следовательно 40 весовых частей в оксиде кислорода. Meg(O) = 8 г/моль, следовательно:
60 г элемента соединяются с 40 г кислорода,
а Meg(X) соединяется с 8 г кислорода.
Meg(X) = 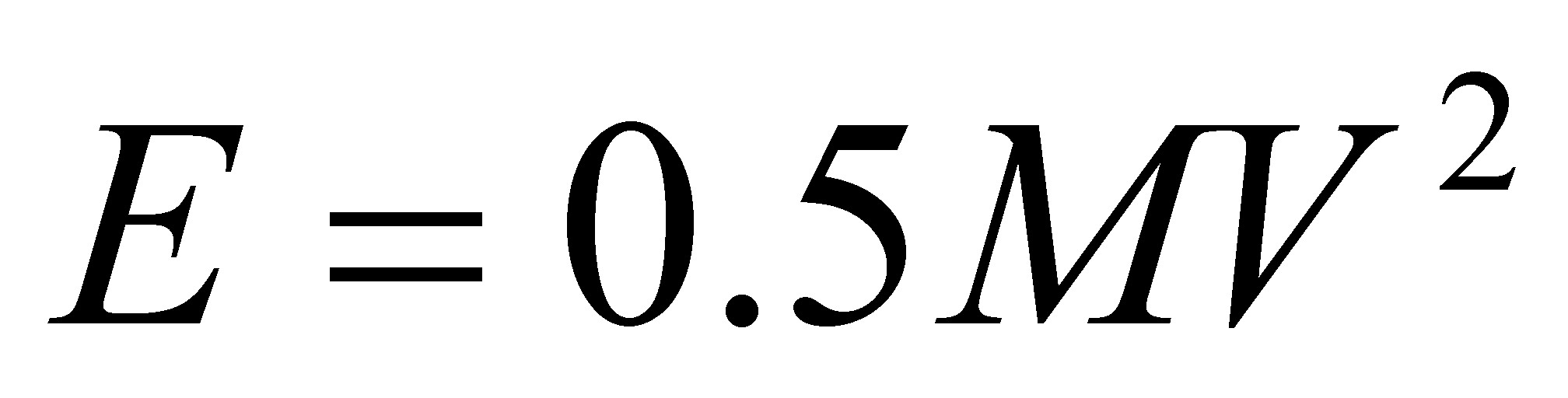 = 12 г/моль
= 12 г/моль
2. Вычислить эквивалентную массу металла, 1 г которого вытесняет из кислоты 700 мл водорода, измеренного при нормальных условиях.
Решение. Водород имеет валентность 1. Молекула простого вещества имеет формулу Н2. Молярный объём водорода 22,4 л, эквивалентный 11,2 л.
1 г металла вытесняет 0,7 л водорода,
а Meg(Me) вытесняет 11,2 л водорода.
Meg(Me) =  = 16 г/моль.
= 16 г/моль.
3. Определить эквивалентную массу золота, зная, что 0,5 г некоторого металла вытесняют из раствора хлорида золота (III) 1,01 г золота, а из серной кислоты тАФ 172,3 мл водорода, измеренного при нормальных условиях.
Решение. Из закона эквивалентов следует, что количество эквивалентов золота в 1,01 г его равно числу эквивалентов в 172,3 мл водорода н. у., эквивалентный объём водорода 11,2 л, откуда:
1,01 золота содержит столько же эквивалентной, сколько 0,1723 л Н2,
а Мeg(Au)-тАЬ- 11,2 л
Мeg(Au) =  = 65,65 г/моль.
= 65,65 г/моль.
4. Определить эквивалентную массу металла, 1 г оксида которого образует 1,81 г сульфата этого металла.
Решение. По правилам определения эквивалентных масс (без учёта валентности металла):
Meg(MO) = Meg(M) + Meg(O)
Meg(MSO4) = Meg(M) + Meg(SO42-)
обозначим Meg(M) = Х,
т. к. Meg(O) = 8 г/моль, Meg(SO42-) = 48 г/моль, тогда
Из 1 г оксида получается 1,81 г сульфата,
а их (Х + 8) получится (Х + 48) г сульфата, отсюда:
1,81В·(Х + 8) = Х + 48; 1,81В·Х + 14,48 = Х + 48; 0,81В·Х = 33,52; Х = 41,38 г/моль.
5. Определите эквивалентную массу воды в её реакции : а) с калием; б) с оксидом калия.
2 К + 2 Н2О = 2 КОН + Н2
К2О + Н2О = 2 КОН
В первом случае моль воды даёт один эквивалент КОН, поэтому Мeg(Н2О) = 18 г/моль, а во втором два эквивалента КОН, поэтому во втором случае Мeg(Н2О) = 9 г/моль.
6. Вычислить молекулярную массу газа, 870 мл которого при 17 В°С и 750 мм рт. ст. имеют массу 2,31 г.
Решение. Из уравнения Клапейрона-Менделеева получаем
M =  .
.
Так как объём газа дан в миллилитрах, масса тАФ в граммах, а давление тАФ в миллиметрах ртутного столба, используем значение универсальной газовой постоянной R, равное 62360 млВ·мм рт. ст./(КВ·моль).
М =  = 64 г/моль
= 64 г/моль
М(тАЬСИтАЭ) = 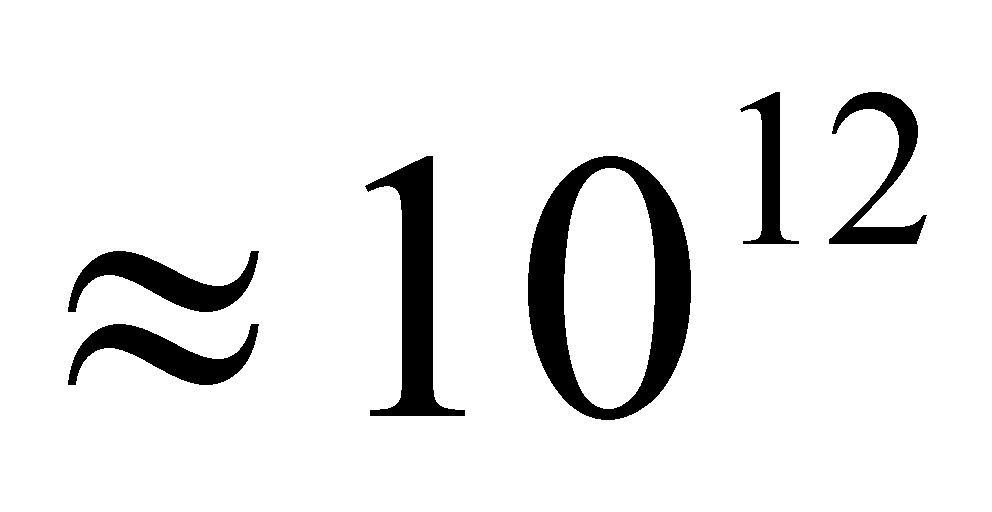 = 0,064 кг/моль.
= 0,064 кг/моль.
7. Определить объём 400 г азота при давлении 8 атм и температуре 7 В°С.
Решение. Из уравнения Клапейрона-Менделеева находим:
V = 
Поскольку давление газа выражено в атмосферах, используем значение R, равное 0,082 лВ·атм/(КВ·моль):
V = 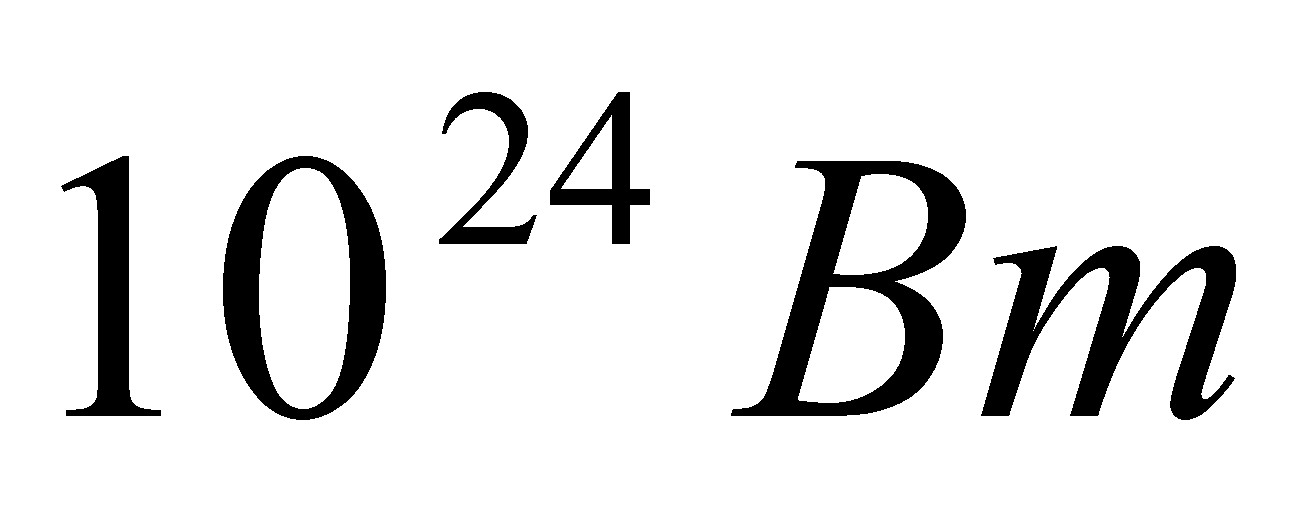 = 41 л
= 41 л
V(тАЬСИтАЭ) =  = 0,041 м3.
= 0,041 м3.
8. Определить температуру кислорода при которой масса 1 л его при нормальном давлении составляет 1 г.
Решение. Из уравнения Клапейрона-Менделеева находим:
T = 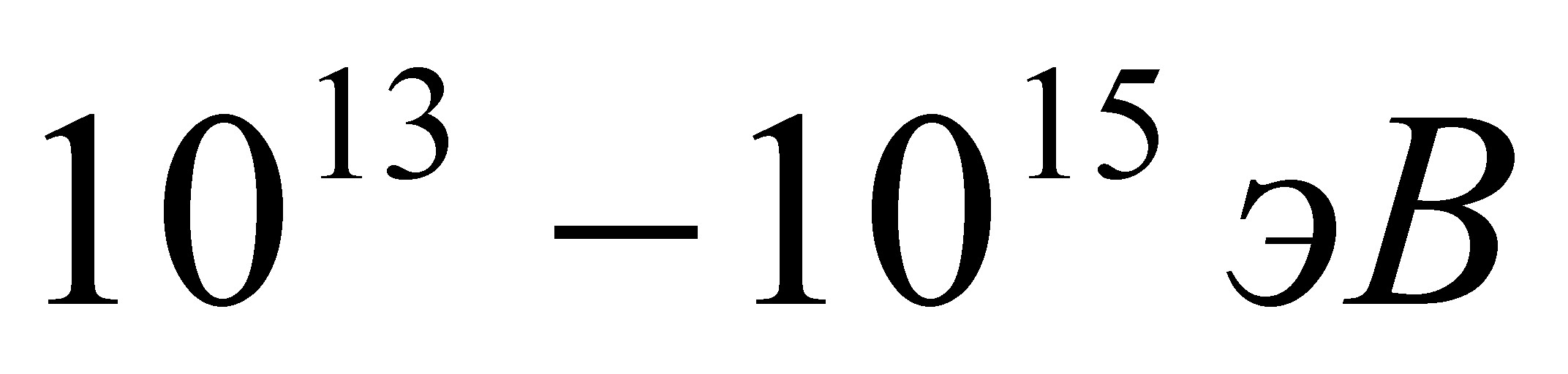 = 390 K
= 390 K
T(тАЬСИтАЭ) = 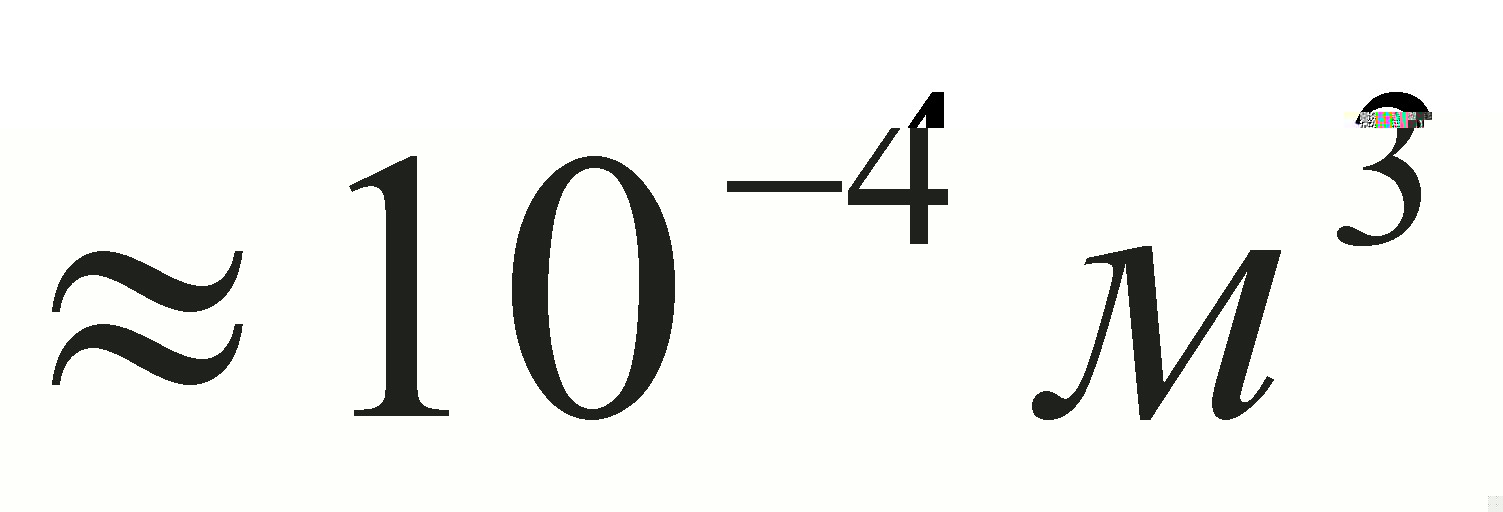 = 390 К
= 390 К
390 - 273 = 117 В°С.
9. Определить массу гексана С6Н14 содержащегося в баллоне ёмкостью 40 л под давлением 0,35 атм при температуре 93 В°С.
Решение. Из уравнения Клапейрона-Менделеева
m =  = 40,1
= 40,1
m(тАЬСИтАЭ) =  = 0,0401 кг/моль.
= 0,0401 кг/моль.
10. Вычислить давление в баллоне ёмкостью 20 л, содержащем при 27 В°С 160 г кислорода.
Решение. По уравнению Клапейрона-Менделеева, учитывая, что молярная масса кислорода равна 32 г/моль, получаем:
р = 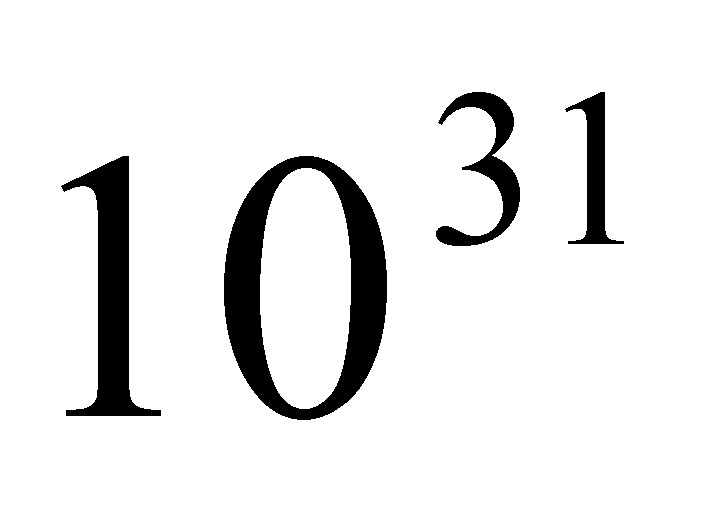 = 6,15 атм.
= 6,15 атм.
р(тАЬСИтАЭ) =  = 623250 Па.
= 623250 Па.
11. Даны 250 л газа при 27 В°С и давлении 8 атм. При каком давлении объём газа при 0 В°С станет равным 1 м3?
Решение. Из объединенного газового закона:
из которого
р =  = 1,82 атм.
= 1,82 атм.
р(тАЬСИтАЭ) =  = 184,4 кПа
= 184,4 кПа
12. В закрытом баллоне газ находится при температуре 7 В°С. До какой температуры должен быть нагрет газ, чтобы давление внутри баллона увеличилось на 10 %?
Решение. Искомую температуру можно определить из уравнения, выражающего закон Гей-Люссака:
 , откуда T =
, откуда T = 
Подставляя заданные величины, получаем
Т =  = 308 К
= 308 К
Следовательно, газ должен быть нагрет до 35 В°С.
13. При растворении в серной кислоте 10 г сплава цинка с магнием выделилось 5,2 л водорода, измеренного при 26 В°С и давлении 920 мм рт. ст. Определить процентный состав сплава.
Решение. Определим количество молей выделившегося водорода:
рV = υRT, откуда ν =  = 0,2566 моль.
= 0,2566 моль.
Пусть в реакцию с кислотой вступило х моль цинка и у моль магния, тогда:
х + у = 0,2566 63,37В·х + 63,37В·у = 16,261
63,37В·х + 24,31В·у = 10 63,37В·х + 24,31В·у = 10, вычитая из первого второе получаем 39,06В·у = 6,261; у = 0,1603; х = 0,0963.
m(Zn) = 6,1 г; m(Mg) = 3,9 г.
Следовательно сплав содержит 61 % цинка и 39 % магния.
14. К 100 мл смеси этана с азотом прибавили 200 мл кислорода. После сгорания этана объём смеси составил 175 мл (объём воды образовавшейся при горении этана, по внимание не принимать). Определить объёмный состав исходной газовой смеси.
Решение. Горение этана происходит по уравнению:
2 С2Н6 + 7 О2 = 4 СО2 + 6 Н2О
Объём газовой смеси в результате реакции уменьшился на:
300 - 175 = 125 мл
Из уравнения реакции видно, что объём образовавшейся газовой смеси уменьшается по сравнению с объёмом исходной смеси на 5 объёмов (2 + 7 - 4), что составляет 125 мл. Следовательно единица объёма газовой смеси составляет 25 мл. Это означает, что в реакцию вступило 50 мл этана и 175 мл кислорода и образовалось 100 мл диоксида углерода.
Таким образом, исходная газовая смесь содержала 50 мл этана и 50 мл азота.
15. В закрытом сосуде при 150 В°С находится смесь одного объёма ацетилена и двух объёмов кислорода. Как изменится давление в сосуде, если ацетилен сжечь за счёт кислорода и сосуд привести к исходной температуре?
Решение.
2 С2Н2 + 5 О2 = 4 СО2 + 2 Н2О
Из уравнения реакции видно, что на один объём ацетилена требуется 2,5 объёма кислорода, а у нас только два, следовательно ацетилен останется в избытке. При этих условиях вода будет газообразна. Поэтому кислород вступит в реакцию полностью, с ним прореагирует 0,8 объёма ацетилена, в результате реакции получится 1,6 объёма углекислого газа и 0,8 объёма воды. Отсюда: до реакции было 2 + 1 = 3 объёма, а после реакции 0.2 + 1,6 + 0,8 = 2,6 объёма, т. к. объём сосуда не менялся, то давление в нём уменьшилось и стало 2,6:3 = 0,87 от первоначального. Следовательно оно уменьшилось на 13 %.
16. После прокаливания 1,738 г смеси карбоната кальция и стронция получили 1,078 г смеси оксидов. Определить количество карбоната кальция в исходной смеси.
Решение. Пусть число молей оксида и карбоната кальция Х, число молей оксида и карбоната стронция У, тогда:
100В·х + 148В·у = 1,738 ⇔ х = 0,01738 - 1,48В·у
56В·х + 104В·у = 1,078 ; 56В·(0,01738 - 1,48В·у) + 104В·у = 1,078
0,97328 - 82,88В·у + 104В·у = 1,078; 21,12В·у = 0,10472; у = 0,005; х = 0,01.
Следовательно, в исходной смеси содержится 1 г карбоната кальция.
17. В наполненном кислородом и запаянном сосуде объёмом 2 л прокалили 2,9 г карбоната железа (II). Рассчитать давление в сосуде после прокаливания и охлаждения продуктов реакции до исходной температуры, если начальное давление составляло 1 атм.
Решение. Процессы, происходящие в сосуде при нагревании можно выразить уравнениями:
4 FeCO3 = 4 FeO + 4 CO2
4 FeO + O2 = 2 Fe2O3
------------------------------
4 FeCO3 + O2 = 2 Fe2O3 + 4 CO2
Первая реакция приводит к повышению, а вторая тАФ к снижению давления в сосуде. Расчёты удобно производить по суммарному уравнению.
ν(FeCO3) =  = 0,025 моль
= 0,025 моль
Vвыд. газа =  = 0,42 л.
= 0,42 л.
Таким образом, в запаянном сосуде заключено 2,42 л, приведённых к нормальным условиям. А так как объём сосуда равен 2 л, давление в нём возрастает до 1,21 атм.
18. Цинковую пластинку опустили в раствор нитрата свинца. Когда она покрылась свинцом, масса её увеличилась на 5 г. Сколько грамм цинка перешло в раствор?
Решение. Цинковая пластинка реагирует с раствором нитрата свинца по уравнению:
Zn + PbSO4 = ZnSO4 + Pb
Из уравнения реакции находим, что при переходе в раствор 1 моль цинка изменение массы пластинки составит: Δm = m(Pb) - m(Zn) = M(Pb)ν(Pb) - M(Zn)ν(Zn) = 207 г/мольВ·1 моль - 65 г/мольВ·1 моль = 142 г, то есть, на изменение массы в 142 г приходится 65 г (1 моль) цинка. Тогда:
изменению массы пластинки в 142 г соответствует 65 г цинка
В» В» В» 5 г В» х г В»
Масса цинка составит х = m(Zn) =  = 2,29 г.
= 2,29 г.
19. Определить количество гидрофосфата кальция, образующегося при взаимодействии 3,7 г гидроксида кальция с 5,88 г ортофосфорной кислоты.
Решение. ν(Са(ОН)2) = 0,05 моль; ν(Н3РО4) = 0,06 моль.
Образование гидрофосфата происходит по уравнению:
Са(ОН)2 + Н3РО4 = СаНРО4 + 2 Н2О
Избыток кислоты идёт на образование дигидрофосфата кальция по уравнению:
СаНРО4 + Н3РО4 = Са(Н2РО4)2.
По первой реакции: ν(Са(ОН)2) = ν(Н3РО4) = ν(СаНРО4) = 0,05 моль
По второй реакции: ν(СаНРО4) = ν(Н3РО4) = 0,01 моль.
Следовательно, ν(СаНРО4) = 0,04 моль или 5,44 грамма.
20. Масса смеси карбонатов калия и натрия равна 7,64 г. После превращения карбонатов в нитраты масса смеси увеличилась до 11,48 г. Определить количество карбоната калия в исходной смеси.
Решение. Обозначим число граммов карбоната калия в смеси через х; тогда количество граммов карбоната натрия в смеси будет (74 - х) г. Выразим содержание в смеси карбонатов металлов в молях:  молей K2CO3;
молей K2CO3;  молей Na2CO3.
молей Na2CO3.
Превращение карбоната металла в нитрат сопровождается увеличением массы соли, обусловленным замещением одного остатка угольной кислоты двумя остатками азотной кислоты:
K2CO3 + 2 HNO3 = 2 KNO3 + CO2 + H2O.
Переход одного моля K2CO3 (NaВн2CO3) в два моля KNO3 (NaNO3) приводит к увеличению массы на 124 (2В·62) - 60 (1В·60) = 64 г.
По условию задачи увеличение массы смеси составило 11,48 - 7,64 = 3,84 г. Следовательно, число молей карбонатов металлов, превратившихся в нитраты, составляет 0,06 моль (3,84:64 = 0,06). Это позволяет записать уравнение:

Решив это уравнение, находим, что масса карбоната калия в исходной смеси составляла 5,52 г.
21. Определить плотность по водороду газовой смеси, состоящей из 15 л метана и 5 л пропана.
Решение. Молярная масса метана равна 16 г/моль, пропана тАФ 44 г/моль. Если плотность смеси по водороду обозначить через DH, то молярная масса газовой смеси будет равна 2В· DH. Разделив молярные массы на мольный объём (22,4 л), получим значения массы 1 л метана, пропана и газовой смеси .
Принимая во внимание полученные выражения для объёмов газов и смеси, условие задачи можем записать в виде уравнения:
В· 15 + В· 5 = В· 20
решив которое, получим DH = 11,5, т. е. плотность газовой смеси по водороду составляет 11,5.
22. К 110 мл смеси метана, водорода и азота прибавили 180 мл кислорода. После реакции объём составил 104 мл. При пропускании продуктов реакции через раствор гидроксида натрия объём уменьшился до 32 мл.
При сгорании водород даёт воду, метан тАФ воду и диоксид углерода. Азот с кислородом не реагирует. Тогда 104 мл тАФ смесь диоксида углерода, азота и (возможно) избытка кислорода. С гидроксидом натрия реагирует только СО2, поэтому можно найти его объём как изменение объема смеси: 104 мл - 32 мл = 72 мл. Найдём объём метана : V(СН4) =V(СО2) = 72 мл (из уравнения реакции СН4 + 2 О2 = СО2 + 2 Н2О). Тогда объём израсходованного на сгорание метана кислорода равен V(O2) = 2V(CO2) = 2В·72 мл = 144 мл (из уравнения реакции).
Пусть х мл тАФ объём водорода в исходной смеси; тогда:
х/2 мл тАФ израсходованный на сгорание водорода объём кислорода,
(110 - 72 - х) мл тАФ объём азота,
(180 - х/2 - 144) мл тАФ объём избытка кислорода.
По условию задачи, объём смеси азота с избытком кислорода (т. е. объём оставшейся после пропускания через гидроксид натрия смеси) равен 32 мл, поэтому
(110 - 72 - х) + (180 - х/2 - 144) = 32
1,5х = 42
х = 28
Таким образом, объём водорода в исходной газовой смеси равен 28 мл. Объём азота равен 110 мл - 72 мл - 28 мл = 10 мл.
(79). Какой объём озонированного кислорода, содержащего 24 % озона по объёму, необходим для сжигания 11,2 л водорода?
Решение. Озон и кислород реагируют с водородом следующим образом:
а) 2 Н2 + О2 = 2 Н2О
б) 3 Н2 + О3 = 3 Н2О
Обозначим через х л необходимый объём озонированного кислорода; тогда:
0,24х л тАФ объём озона в смеси,
0,76х л тАФ объём кислорода в смеси,
0,24хВ·3 = 0,72х л тАФ объём водорода, реагирующего с озоном (из уравнения реакции б)
0,76хВ·2 = 1,52х л тАФ объём водорода, реагирующего с кислородом (из уравнения реакции а)
По условию задачи, суммарный объём водорода равен 11,2 л, поэтому:
0,72х + 1,52х = 11,2
2,24х = 11,2
х = 5, т. е. необходимый объём озонированного кислорода равен 5 л.
(82). При прохождении смеси равных объёмов азота и водорода через контактный аппарат 30 % азота превращаются в аммиак. Определить в процентах объёмный состав газовой смеси, которая выходит из контактного аппарата.
Решение. Уравнение реакции:
N2 + 3 H2 = 2 NH3.
Пусть общий объём исходной смеси 1 л. Тогда в ней содержится 0,5 л азота и 0,5 л водорода. В аммиак превращаются 30 % азота, т. е.  = 0,15 л. Тогда количество превратившегося в аммиак водорода в три раза больше (из уравнения реакции): 0,45 л, а количество образовавшегося аммиака 0,3 л (0,15В·2). Тогда количества оставшихся водорода и азота равны соответственно 0,05 л (0,5 - 0,45) и 0,35 л (0,5 - 0,15). Суммарный объём конечной смеси 0,35 + 0,05 + 0,3 = 0,7 л; содержание в ней аммиака
= 0,15 л. Тогда количество превратившегося в аммиак водорода в три раза больше (из уравнения реакции): 0,45 л, а количество образовавшегося аммиака 0,3 л (0,15В·2). Тогда количества оставшихся водорода и азота равны соответственно 0,05 л (0,5 - 0,45) и 0,35 л (0,5 - 0,15). Суммарный объём конечной смеси 0,35 + 0,05 + 0,3 = 0,7 л; содержание в ней аммиака  В·100 % = 42,9 %; азота тАФ
В·100 % = 42,9 %; азота тАФ  В·100 % = 50 %, водорода тАФ
В·100 % = 50 %, водорода тАФ  В·100 % = 7,1 %.
В·100 % = 7,1 %.
18. Вывести молекулярную формулу вещества, содержащего 58,5 % углерода, 4,1 % водорода, 11,4 % азота и 26 % кислорода. Молекулярная масса вещества тАФ 123 а. е. м.
Решение. Из условия задачи вытекает, что данное вещество состоит из четырёх элементов тАФ углерода, водорода, азота и кислорода. В общем виде такое соединение можно представить формулой CxHyNzOt. Масса углерода в молекуле этого соединения составляет 12x, водорода тАФ 1y, азота тАФ 14z, кислорода тАФ 16t а. е. м. Очевидно, соотношение масс углерода, водорода, азота и кислорода в молекуле этого вещества равно соотношению процентного содержания этих элементов в веществе:
12x : 1y : 14z : 16t = 58,5 : 4,1 : 11,4 : 26.
Избавившись от коэффициентов при неизвестных:
x : y : z : t =
получим:
x : y : z : t : = 4,87 : 4,1 : 0,81 : 1,62
Так как x, y, z и t обозначают количества атомов в молекуле соединения и поэтому не могут быть дробными, полученное соотношение превращаем в соотношение целых чисел. Для этого все числа данного соотношения делим на меньшее:
x : y : z : t = = 6 : 5 : 1 : 2
Следовательно, простейшая формула соединения тАФ C6H5NO2. Молекулярная масса вещества, рассчитанная как сумма атомных масс, составляет 123 а. е. м. Значит, полученная простейшая формула этого соединения C6H5NO2 является его истинной молекулярной формулой.
19. При полном сгорании 3,1 г органического вещества образовалось 8,8 г диоксида углерода, 2,1 г воды и 0,47 г азота. Найти молекулярную формулу вещества, если масса 1 л паров этого вещества, приведённого к нормальным условиям, составляет 4,15 г.
Решение. Определим содержание углерода в веществе:
в 44 г СО2 содержится 12 г углерода
В» 8,8 г В» х г В»
х =  = 2,4 г.
= 2,4 г.
По количеству образовавшейся воды вычислим содержание кислорода во взятом веществе:
в 18 г воды содержится 2 г водорода
В» 2,1 г В» у г В»
у =  = 0,23 г.
= 0,23 г.
Суммарная масса углерода, водорода и азота тАФ 3,1 г (2,4 + 0,23 + 0,47 = 3,1) тАФ равна массе исходного вещества, следовательно, кислород в состав соединения не входит.
Если общая формула органического соединения тАФ CxHyNz, то можно записать и решить уравнение:
12x : 1y : 14z = 2,4 : 0,23 : 0,47
x : y : z =  = 0,2 : 0,23 : 0,033 = 6 : 7 : 1.
= 0,2 : 0,23 : 0,033 = 6 : 7 : 1.
Простейшая формула соединения тАФ C6H7N (М = 93).
Зная массу 1 л паров этого вещества, можно рассчитать его молярную массу:
1 л паров имеет массу 4,15 г
22,4 л В» В» В» х г
х =  = 93 г.
= 93 г.
Вычисленная молекулярная масса соединения равна 93, следовательно, простейшая формула тАФ C6H7N тАФ является его истинной формулой.
20. Для сжигания некоторого количества азотосодержащего вещества потребовалось 504 мл кислорода. Масса образовавшейся при этом воды равна 0,45 г. Объём газообразных продуктов реакции составил 560 мл. После пропускания газовой смеси через раствор едкого натра её объём уменьшился до 112 мл (объёмы газов измерены при нормальных условиях, объём образовавшейся воды во внимание не принимать). Вывести молекулярную формулу вещества, если его молекулярная масса равна 75 а. е. м.
Решение. Количество образовавшейся воды позволяет рассчитать количество содержащегося в веществе водорода:
в 18 г воды содержится 2 г водорода
В» 0,45 г В» х г В»
х =  = 0,05 г.
= 0,05 г.
При прохождении газообразных продуктов реакции через раствор едкого натра объём газовой смеси уменьшился на 448 мл (560 - 112 = 448) в результате поглощения диоксида углерода. Можно вычислить содержание углерода в веществе:
в 22,4 л СО2 содержится 12 г углерода
В» 0,448 л В» у г В»
у = 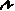 = 0,14 г.
= 0,14 г.
Непоглотившийся газ (112 мл) тАФ азот, масса которого вычисляется из пропорции:
22,4 л азота имеют массу 28 г
0,112 л В» В» В» z г
у =  = 0,14 г.
= 0,14 г.
Рассчитаем количество кислорода, содержащегося в продуктах реакции. В образовавшейся воде (0,45 г) на долю кислорода приходится 0,4 г (0,45 - 0,05).
Содержание кислорода в 448 мл диоксида углерода находим из соотношения:
в 22,4 л СО2 содержится 32 г кислорода
В» 0,448 л В» а г В»
а =  = 0,24 г.
= 0,24 г.
Рассчитаем количество кислорода, содержащегося в продуктах реакции. В образовавшейся воде (0,45 г) на долю кислорода приходится 0,4 г (0,45 - 0,05)
Общее содержание кислорода в продуктах реакции равно 1,04 г (0,4 + 0,64).
Расход кислорода для сжигания вещества вычислим из пропорции:
22,4 л кислорода имеют массу 32 г
0,504 л тАЬ-тАЬ в г.
в =  = 0,72 г.
= 0,72 г.
Поскольку содержание кислорода в продуктах реакции превышает количество взятого кислорода на 0,32 г (1,04 - 0,72) можно заключить, что исходное вещество содержало 0,32 г кислорода.
Итак, вещество содержало 0,24 г углерода, 0,05 г водорода, 0,32 г кислорода и 0,14 г азота, простейшая его формула будет:
 = 2:5:2:1 или С2Н5О2N. Молекулярная масса этого вещества, рассчитанная как сумма атомных масс, равна 75. Следовательно простейшая формула является его молекулярной формулой.
= 2:5:2:1 или С2Н5О2N. Молекулярная масса этого вещества, рассчитанная как сумма атомных масс, равна 75. Следовательно простейшая формула является его молекулярной формулой.
Вместе с этим смотрят:
Белки и полипептидыБелковые веществаБиологическая роль каротина и каротиноидовБиосинтез белков