Нильс Бор
СОДЕРЖАНИЕ
Введение 3
1. Нильс Бор - ученый и человек 4
2. От великих открытий конца XIX века к теории атома Бора 5
3. Развитие учения о спектрах 10
4. Теория атома Бора 16
5. Заключение 27
Литература 28
- 3 -
Введение
Вот Бор всем известный..
А вот дополнительный закон,
Который был Бором провозглашен,
Который описывает с двух сторон
Как электрон, так и протон
Атома,
Который построил Бор.
А вот электронные уровни
Атома,
Который построил Бор.
Которые спектр характерный дают
На них перескакивают электроны,
Атома
Который построил Бор.
А вот ядро
Атома,
Который построил Бор,
Которое видит он как каплю,
Которая находится точно в центре
Атома,
Который построил Бор.
Стихи Р.Е. Пайерлса в честь семидесятой годовщины со дня рождения Нильса Бора.
В своем выступлении на вечере памяти Нильса Бора в Политехническом музее в Москве 16 декабря 1962 года академик И. Е. Тамм сказал: "Бор не только был основателем квантовой теории, которая открыла человечеству путь к познанию нового мира - мира атомов и элементарных частиц - и тем самым проложила путь в атомный век и позволила овладеть атомной энергией. Труды Бора наряду с работами Эйнштейна оказали решающее влияние не только на физику нашего века, но и на современное научное мировоззрение в целом".
Одной из главных научных работ Нильса Бора является его статья "О строении атомов и молекул", три части которой вышли в июле, сентябре и ноябре 1913 года. В ней Бор рассматривал модель атома Резерфорда с использованием кванта действия Планка. Получившая, в последствии, название модель атома Резерфорда-Бора объясняла многие физические явления и стала основой квантовой теории. Истории создания этой модели атома и посвящен этот реферат.
- 4 -
1. НИЛЬС БОР УЧЕНЫЙ И ЧЕЛОВЕК.
Нильс Бор родился 7 октября 1885 г. в Копенгагене. Отец Нильса Бора, профессор Христиан Бор был известным физиологом. В 1903 г. Нильс поступает в Копенгагенский университет. В 1907 г. ему присуждается золотая медаль Королевской Датской академии за экспериментальное исследование поверхностного натяжения жидкостей. В 1909 г. Бор получает степень магистра наук, а затем в феврале 1911 г. - докторскую степень.
В сентябре того же года бор получает стипендию Карлсбергского фонда для стажировки за границей у Дж. Дж. Томсона в Кавендишской лаборатории.
В марте 1912 г. он переезжает к Резерфорду в Манчестер. В лаборатории Резерфорда он столкнулся с трудностями теории атома того времени: устойчивость планетарного атома не совместима с законами классической электродинамики и механики. Исходя из теории квантования энергии, Бор создает свою теорию.
1918 г. - Бор дает общую формулировку принципа соответствия.
1921 г. - открытие института Бора.
1927 г. - формулировка принципа дополнительности.
1933 г. - приход к власти Гитлера, создание Бором Датского комитета помощи немецким изгнанникам-антифашистам.
1934 г. - первая поездка в Советский Союз.
1937 г. - работа Бора - Калькара о превращении атомных ядер.
1944 г.- работа в Лос-Аламосе. Бор предвидит будущую политику атомного шантажа, встречи с Рузвельтом и Черчиллем, борьба за международный контроль над ядерным оружием.
1950 - Бор пишет "Открытое Письмо" ООН с программой борьбы за мир.
Нильс Бор был не только видный ученый, но и ярый борец за мир, за невоенное использование ядерной энергии. Смерть Бора 18 ноября 1962 года - это потеря человечеством не только замечательного ученого, но и великого человека.
- 5 -
2. ОТ ВЕЛИКИХ ОТКРЫТИЙ КОНЦА XIX ВЕКА К ТЕОРИИ АТОМА.
История создания теории Бора не ограничивается тем кратким промежутком с 1912 года, когда он познакомился с Резерфордом и результата ми его исследований. Исследования которые привели Бора к его квантовой теории атома начались гораздо раньше с исследований оптических спектров и других явлений, связанных со строением вещества.
В конце XIX в. были открыты рентгеновские лучи (1895 тАУ Вильгельм Конрад Рентген, впоследствии первый лауреат Нобелевской премии по физике), радиоактивность (1896 - Анри Беккерель), электрон (1897 - Томсон).
Рентген к своему открытию пришел в результате систематических поисков излучения, которое было бы способно проникать сквозь вещества, непрозрачные для обычного света.
Рентген работал с разрядной трубкой, в которой был достигнут довольно высокий вакуум. Для обнаружения излучения он пользовался флуоресцирующим экраном, покрытым платиносинеродистым барием. При излучении достаточно коротких волн он наблюдал свечение экрана, которое продолжалось и в том случае, когда разрядная трубка полностью закрывалась бумагой. В своем первом сообщении от 28 декабря 1895 года Рентген писал, что при достаточном затемнении флуоресценция заметна еще на расстоянии двух метров от трубки и что причины флуоресценции исходят именно от разрядной трубки, а не от какого-нибудь места проводника.
Опыты показали, что свечение вызывается особыми лучами, названые Рентгеном Х - лучами, которые проходят через бумагу, дерево, картон. Рентген обнаружил также, что эти лучи действуют на фотографическую пластинку, вызывая ее почернение. При возрастании плотности тел уменьшается их прозрачность в отношении рентгеновских лучей. Прозрачность мала у элементов с большим атомным весом.
Попытки Рентгена получить отражение и преломление рентгеновских лучей не увенчались успехом. Также не увенчались успехом первые попытки его и других исследователей обнаружить интерференцию, дифракцию и поляризацию рентгеновских лучей. Опыты Рентгена по отклонению лучей в магнитном поле привели к отрицательному результату. Возникла проблема какова же природа рентгеновских лучей?
В 1899 г. Хага и Винд, а затем в 1909 г. Вальтер и Поль пытались определить длину волны этих лучей по дифракции на очень узкой щели. Они фотографировали рентгеновскими лучами узкую клиновидную щель. Хотя ширина щель измерялась всего несколькими микронами, расширения изображения щели, которое указывало бы на дифракцию щели, достоверно обнаружить не удалось.
- 6 -
В феврале 1912 года П. Эвальд обратился к Лауэ с вопросом, о поведении световых волн в пространственной решетке из поляризующихся атомов. При обсуждении Лауэ пришла мысль, что если атомы образуют пространственные решетки, то должны наблюдаться явления интерференции, подобные световой интерференции.
В феврале 1912 г. два ученика Рентгена Фридрих и Книппинг, по предложению Лауэ поставили опыт по дифракции рентгеновских лучей на кристаллической решетке. Опыт состоял в следующем. При помощи ряда свинцовых диафрагм выделяли узкий пучок рентгеновских лучей. Этот пучок падал на тонкий кристалл цинковой обманки. Пройдя сквозь кристалл, рентгеновские лучи попадали на фотопластинку. Пластинка была поставлена перпендикулярно начальному направлению лучей. После проявления на пластинке получалось интенсивное центральное пятно и ряд правильно расположенных пятнышек. Было наглядно доказано, что кристаллы являются подходящей дифракционной решеткой для рентгеновских лучей.
Это открытие позволило исследовать с большей точностью спектры рентгеновских лучей, что сыграло важную роль в создании теории Бора. Макс Лауэ разработал простую математическую теорию, которая позволила сравнить длину волны рентгеновских лучей с постоянной решетки кристалла. Абсолютная величина длинны волны, в теории Лауэ, не определялась. У.Г. Брэгг и У.Л. Брэгг и одновременно с ними Г.В. Вульф дали объяснения диаграммам Лауэ и разработали метод абсолютного измерения длины волны рентгеновских лучей. Основная мысль принадлежала Брэггу - сыну. Брэгги стали исследовать не прохождение рентгеновских лучей через кристаллическую пластинку, а отражение их от поверхности пластинки. Бор писал, что самой важной новой информацией на Сольвеевском конгрессе в 1913 году была информация об открытии дифракции рентгеновских лучей в кристаллах, сделанном Лауэ в 1912 году.
Опыты Рентгена привлекли к себе внимание Анри Беккереля, много занимавшегося фосфоресценцией. В начале 1896 г., в тот самый день, когда в Париже стало известно об опытах Рентгена, Беккерель решил проверить, не испускают ли рентгеновские лучи всякое фосфоресцирующее вещество. Опыты не подтвердили его предположения, но он произвел следующий опыт. Фотографическая пластинка с бромжелатиновой эмульсией была завернута в слой черной бумаги. Плоский кристалл сернокислой соли урана был положен сверху. Когда пластинку проявили, на ней был обнаружен черный отпечаток фосфоресцирующего кристалла. Поместив между фосфоресцирующим веществом и бумагой монеты, Беккерель обнаружил на пластинке изображение. Он заключил, что взятое им фосфоресцирующее вещество испускает излучение, проникающее через светонепроницаемую бумагу и действующее на соли серебра.
После того, как Беккерель установил, что источником открытых им лучей
- 7 -
является уран, естественно возник вопрос о том, не существуют ли другие химические элементы, обладающие такими же свойствами. В 1898 г. открытие Беккереля привлекло к себе внимание Г. Шмидта в Германии и М. Кюри во Франции. Кюри исследовала на радиоактивность различные минералы. Некоторые из них оказались радиоактивными, в том числе урановая смоляная обманка, хальколит, отенит и другие. Эти минералы содержат или уран или торий.
Бор многократно обращался к оценке работ М. Кюри. Он полагал, что решающий прогресс в атомной физике стал возможным благодаря порази- тельному открытию радиоактивности некоторых элементов, в истории которого замечательной вехой явилось выделение радия Марией Кюри.
Для рассматриваемого периода существенную роль сыграли работы Дж. Дж. Томсона. Исследуя прохождение электрического тока сквозь разряВнженные газы, Томсон в 1897 г. показал, что отношение электрического заряда к массе (е/m) для частиц - носителей катодных лучей (электронов) во много раз больше, чем для ионов водорода при электролизе. На основании полученВнного отношения e/m он высказал гипотезу, что в катодных лучах электричеВнские заряды переносятся "корпускулами", размер и массы которых во много раз меньше размеров атома водорода.
В 1898 г. Томсон определил заряд "корпускулы" и нашел его равным заряду иона водорода при электролизе. Впервые Томсон сделал вывод о существовании элементарной частицы, названой электроном.
Оптические и рентгеновские спектры, модели атома, учение Планка об излучении - основные вехи на пути создания теории атома Бора. До теории атома Бора было выдвинуто много различных гипотез относительно строения атомов ("модели атома"). В 1902 г. Вильям Томсон (Лорд Кельвин) предположил, что атом имеет вид сферы, равномерно наполненной положительным электричеством. Внутри сферы находится такое число электронов, которое эквивалентно заряду самого шара. Дж. Дж. Томсон широко разработал и усовершенствовал модель атома Вильяма Томсона. Он изучил условия равновесия различных групп электронов внутри сферы с положительным зарядом. Электроны, находящиеся внутри положительного шара, должны совершать гармонические, колебательные движения, вызывая, тем самым, испускание атомами лучистой энергии, которое дает резкие спектральные линии.
Бор придавал большое значение стремлению Дж. Дж. Томсона объяснить периодическую систему исходя из устойчивости различных электронных конфигураций. Он писал: "Со времени знаменитой попытки Дж. Дж. Томсона истолковать периодическую систему на основании исследования устойчивости различных электронных конфигураций идея о разделении электронов в атоме на группы стала исходным пунктом и более новых воззрений. Предположение Томсона, о распределении положительного заряда в атоме, оказалась несовместимо с опытными результатами, полученными на основании изучения ра-
- 8 -
диоактивных веществ. Тем не менее, эта работа содержит много оригинальных мыслей, и оказала большое влияние на дальнейшее развитей атомной теории".
Вместе с тем Бор отметил, что объяснение спектральных законов не удавалось согласовать с оценкой числа электронов в атоме, произведенной Дж. Дж. Томсоном из наблюдения рассеяния рентгеновских лучей, использую при этом классическую теорию.
Бор особенно ценил Дж. Дж. Томсона за то, что в те времена, когда многие физики скептически относились к существованию атомов, Томсон начал исследование внутриатомного мира. Существенно для Бора было то, что из общих идей Томсона о соотношении между числом электронов и местом элемента в периодической таблице следовало обобщение, что для любого элемента число электронов вне ядра в нейтральном атоме определяется атомным номером, указывающим положение элемента в таблице Менделеева.
Решающими, однако, для возникновения теории атома Бора были работы Резерфорда и Планка. В 1895 г. в Кавендишскую лабораторию пришел Резерфорд. Первое время он продолжал начатые им ранее работы по приему электромагнитных волн и совершенствовал свой магнитный детектор. Затем он приступил к работе по ионизации газов рентгеновскими лучами. В сентябре 1898 г. Резерфорд переехал в Монреаль, где стал изучать радиоактивные свойства урана и тория. С января 1901 г. Резерфорд работает вместе с Фредериком Соди. Ими было обнаружено, что радиоактивность сопровождают такие превращения, при которых возникают новые элементы. Они показали, что радиоактивность есть атомное явление, связанное с химическими превращениями, в результате которых появляются новые элементы.
Об этом периоде Бор писал, что благодаря экспериментальным открытиям в области радиоактивности положение с изучением составных частей атома значительно изменилось. Изучение прохождения частиц, испускаемых радиоактивными веществами, привело Резерфорда к мысли о ядерном строении атома. Он предположил, что в атоме имеется ядро, заряженное положительным электричеством. Это ядро очень мало по сравнению с размерами всего атома, однако, в нем сосредоточена большая часть массы атома. Вокруг ядра движется строго определенное число электронов.
Бор многократно обращался к оценке деятельности Резерфорда. В 1913 г. в статье "Теория торможения заряженных частиц при прохождении через вещество" он анализировал работу Резерфорда 1911 г., посвященную теории рассеяния 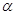 -частиц веществом. Бор писал, что в соответствии с теорией рассеяния
-частиц веществом. Бор писал, что в соответствии с теорией рассеяния 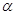 -частиц веществом, развитой Резерфордом, предполагается, что :
-частиц веществом, развитой Резерфордом, предполагается, что :
1) атомы вещества состоят из облаков электронов и ядра;
2) электроны удерживаются силами притяжения к ядру;
- 9 -
3) ядро обладает положительным зарядом, равным сумме отрицательных зарядов электронов;
4) на ядро приходится основная часть массы атома;
5) Размеры ядра малы по сравнению с размерами атома;
6) 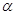 -частица есть ядро атома гелия.
-частица есть ядро атома гелия.
Расчеты Резерфорда навели Бора на мысль, что очень быстрый электрон, пролетающий через атом и сталкивающийся со связанными электронами, теряет свою энергию определенными конечными порциями - квантами. Рассматривая столкновение между свободным и связанным электроном, Бор заключил, что связанный электрон не может приобрести энергию меньшую, чем разность энергий между двумя последовательными стационарными состояниями, а, следовательно, свободный электрон, сталкиваясь с ним, не может терять меньшее количество энергии.
В то время Бор считал, что необходимым следствием теории атома Ре- зерфорда является внутриядерное происхождение 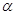 - частиц и что быстрые
- частиц и что быстрые 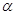 - частицы испускаются ядром.
- частицы испускаются ядром.
- 10 -
3. РАЗВИТИЕ УЧЕНИЯ О СПЕКТРАХ.
Во второй половине XIX в. широкое развитие получило изучение оптических спектров. Их разделяют на спектры испускания, поглощения, рассеяния и отражения. Оптические спектры по виду разделяют на линейчатые, полосатые и сплошные.
В 1648 г. в Праге вышло в свет сочинение Иогана Маркуса Марци "Thaumantias", посвященное вопросу о цветах, получающихся при разложении света призмой. До Марци господствовало представление, что цвета возникают в результате смешения в различных пропорциях света с темнотою. Марци же полагал, что свет превращается в цвета только при определенном преломлении в плотных средах, и различные виды цветов являются частями с различными преломлениями.
Систематические опыты по изучению спектров Марци не проводил, их начал Исаак Ньютон. 19 февраля 1672 г. в "Philosopikal Transactions" , было помещено письмо-статья Ньтона к Ольденбургу, секретарю Лондонского королевского общества, где Ньютон отмечал, что световые лучи , различаются в их способности показывать ту или иную особую окраску точно так же, как они различаются по степени преломляемости. Цвета не являются, как думают обыкновенно, видоизменениями света, претерпеваемыми ими при преломлении или отражении от естественных тел, но суть первоначальные, прирожденные свойства света. Критиками Ньютона выступали Гук, Гюйгенс и др.
В 1802 г. Вильям Волластон, английский естествоиспытатель, известный своими исследованиями в области химии, физики, кристаллографии, минералогии, ботаники, медицины, произвел следующий опыт. Солнечные лучи пропускались в комнату через щель шириной 1,25 мм и рассматривались через хорошую призму на расстоянии 3 м от щели. При этом отдельные спектральные области оказались отдаленными друг от друга тонкими черными линиями. Разлагая прямой свет голубой части пламени свечи, Волластон нашел, что здесь нет непрерывного спектра и свет разлагается на пять отдельных полос, удаленных друг от друга.
В 1817 г. темные линии в спектре тщательно изучил немецкий оптик Йозеф Фраугофер. Он усовершенствовал изготовление больших ахроматических объективов, изобрел окулярный микрометр и гелиометр, наблюдал и объяснил наличие линий поглощения в солнечном спектре. В 1821 г. Фраунгофер применил дифракционную решетку для изучения спектров. При измерении дисперсии света в качестве источника служила свеча. При этом он обнаружил в спектре яркую желтую линию. В работе 1815 г. он писал: "Я решил выяснить, можно ли видеть подобную светящуюся линию в солнечном спектре. И с помощью телескопа я обнаружил не одну линию, а большое количество вертикальных линий, резких и слабых. Слабые оказались темнее остальной части
- 11 -
спектра, а некоторые из них были совершенно черными.."
Фраунгофер обнаружил, что желтая линия в спектре свечи в точности совпадает с темной линией D в солнечном спектре. Для исследования спектров он изготовил решетки из тонких, близко расположенных параллельных нитей; кроме того, он наносил на стеклянную пластинку параллельные штрихи. Решетки, изготовленные им, содержали свыше 300 линий на миллиметр. Опыты Фраунгофера по исследованию спектров продолжали Давид Брюстер, Джон Гершель и Фокс Тальбот.
Во второй половине XIX века широкое развитие получило изучение спектров поглощения. Сплошной спектр имеет вид непрерывной полосы, содержащей все части видимого спектра. Линейчатый спектр состоит из определенного числа отдельных линий в спектре. Спектральные линии группируются в серии. Линии в пределах серии сближаются при переходе к более коротким длинам волн. Полосатый спектр состоит из широких полос, более ярких с одной стороны. Пропустив белый свет через среду, поглощающую те или иные лучи, получают спектр поглощения, представляющий сплошной спектр, от которого отняты определенные цвета.
В 1860 г. Густав Кирхгоф и Роберт Бунзен в работе "Химический анализ с помощью спектральных наблюдений", писали , что ни различие форм соединений, в которых участвуют металлы, ни разнообразие химических процессов в отдельных пламенах, ни громадное различие температур этих пламен, нисколько не влияют на положение спектральных линий, соответствующих отдельным металлам. Больше всего внимание экспериментаторов
привлекал к себе линейчатый спектр. Появилось немало работ, посвященных исследованию спектров различных веществ в зависимости от физических условий. Плюккер и Гитторф указали, что азот, пары серы и некоторых углеводородов в зависимости от физических условий могут дать два или три различных спектра. Оказалось, что при некоторых условиях пары и газы могут давать непрерывный спектр. На протяжении пятидесяти лет (1860-1911) было измерено 120 000 линий между 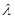 = 2000 и
= 2000 и 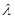 = 7000 А.
= 7000 А.
Вслед за ранними исследованиями спектров различных элементов появи -лись и первые попытки найти определенные закономерности в распределении спектральных линий. Такую попытку сделал в 1863 г. Маскар, а затем Стонер, Шустер и др.
В 1885 г. Иоган Якоб Бальмер установил , что длины волн соответствующие некоторым линиям спектра водорода хорошо укладываются в формулу:
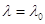
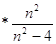
где:  - целое число;
- целое число;
- 12 -
 - постоянная;
- постоянная;
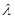 - длина волны.
- длина волны.
Эту формулу оказалось удобнее выразить в виде:
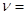
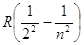 ,
,  = 3, 4, 5, ..
= 3, 4, 5, ..
где: 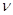 - частота;
- частота;
 - постоянная Ридберга.
- постоянная Ридберга.
К систематике атомных спектров испускания относятся работы шведского физика Йоханнеса Ридберга. Он показал, что расположение линий в спектрах многих элементов подчиняется закономерностям, записываемым как разность двух выражений - термов:
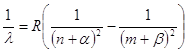 ,
,
где: 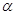 и
и 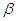 - поправки в сериальной формуле;
- поправки в сериальной формуле;
и m - целочисленные значения.
Вальтер Риц - немецкий физик и математик - предложил поправки в сериальные формулы и сформулировал комбинационный принцип. Сущность принципа в том, что термы, принадлежащие различным сериям данного спектра, можно комбинировать друг с другом. Комбинация дает соответствующие спектральные линии. Комбинационный принцип позволяет, если известен ряд частот спектральных линий данного элемента, предсказывать существование других линий элемента. Однако наблюдаются не все возможные частоты спектральных линий, предсказанные на основании комбинационного принципа. Часть этих линий может быть запрещена правилами отбора.
У щелочных металлов Ридберг установил наличие трех серий. Эти серии были названы главной, первой побочной и второй побочной. Сериальные формулы имеют вид:
Главная серия  , = 2, 3, 4,тАж
, = 2, 3, 4,тАж
Первая побочная серия 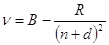 , = 3, 4, 5,тАж
, = 3, 4, 5,тАж
- 13 -
Вторая побочная серия 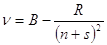 , = 2, 3, 4, ..
, = 2, 3, 4, ..
где: A - предел главной серии;
В - предел первой и второй побочных серий;
s, p, d - поправки к квантовым числам.
В 1908 - 1909 гг. Фридрих Пашен обнаружил две первые линии инфракрасной спектральной серии водорода, названой серией Пашена. Эти линии подчиняются формуле:
 .
.
Генрих Рубенс и его ученики проследили тепловые инфракрасные лучи до 0,3 мм. В 1911 г. Рубенс и Байер обнаружили инфракрасные лучи с длиной волны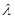 = 342 мкм и 218 мкм. Сложнее дело обстояло с продвижеВннием в изучении ультрафиолетового спектра. В 1898 г. Шуман дошел до 130 мкм, Лайман в 1906 г. - до 100 мкм.
= 342 мкм и 218 мкм. Сложнее дело обстояло с продвижеВннием в изучении ультрафиолетового спектра. В 1898 г. Шуман дошел до 130 мкм, Лайман в 1906 г. - до 100 мкм.
"Отысканием сериальных закономерностей до 1913 г. - писал Д. С. Рождественский, - руководила чистая эмпирика, комбинаторика чисел, в основе которой нельзя было еще усмотреть закона природы. Поэтому символика спектральных серий имела несколько кабалистический вид, отталкивавший многих физиков от этой области науки". Комбинационный принцип, установленный Ритцем, который смог бы служить некоторой опорой в поисках закономерностей спектральных серий, не укладывался в рамки математической физики. Изучение электромагнитных волн связывалось с определенными движениями заряженных частиц. При представлении этих движений в виде ряда Фурье возникают частоты, кратные основной частоте; но в спектре излучения такие линии не наблюдались. Из простых спектральных закономерностей вытекали два существенных вывода:
1) частота входит в формулу в первой степени;
2) линии любой серии по мере приближения к пределу, при 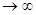 , располагаются все гуще, т.е. ряд частот должен быть дискретным, имея предел на конкретном расстоянии.
, располагаются все гуще, т.е. ряд частот должен быть дискретным, имея предел на конкретном расстоянии.
Поскольку классическая электродинамика категорически утверждала, что частота излучения однозначно определяется частотой колебаний излучателя, возникал вопрос, каковы должны быть осцилляторы, чтобы испускаемые спектральные линии удовлетворяли этим двум требованиям. Ответ на этот вопрос приводил к большим осложнениям. Еще Рэллей обратил внимание на следую-
- 14 -
щее обстоятельство. Для любой системы, движение которой определяется обычными уравнениями механики, всегда получаются соотношения, куда входят квадрат частоты, а не сама частота, как этого требуют спектральные закономерности. Уравнения движения всегда содержат ускорение, а поскольку при периодических движениях время обычно входит в виде 
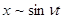 , то значит, вторая производная по времени неизбежно содержит
, то значит, вторая производная по времени неизбежно содержит  .Значит, для получения правильных сериальных формул нельзя воспользоваться моделью упруго или квазиупруго связанного электрона.
.Значит, для получения правильных сериальных формул нельзя воспользоваться моделью упруго или квазиупруго связанного электрона.
Пытаясь обойти эту трудность, Ритц предложил атомную модель, в которой силы, вызывающие колебания электронов, зависели не от их смещения, а от скорости. Тогда ускорения будут представлены как первые производные скорости по времени, а, следовательно, частоты войдут в уравнения в первой степени. Этому условию удовлетворяют магнитные силы. Ритцу удалось получить формулу Ридберга-Ритца, но ценой весьма искусственных предположений о происхождении этих сил и о расположении магнитиков-электронов.
Вторую причину необходимости отказа от квазиупругой силы модели указал Пуанкаре. Независимо от природы квазиупругой силы собственные частоты вызванных ею колебаний определяются волновым уравнением 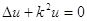 . Пуанкаре показал, что никакими граничными условиями нельзя добиться, чтобы ряд собственных значений имел предел на конечном расстоянии. Отсюда следовало, что частоты не подчиняются спектральным формулам.
. Пуанкаре показал, что никакими граничными условиями нельзя добиться, чтобы ряд собственных значений имел предел на конечном расстоянии. Отсюда следовало, что частоты не подчиняются спектральным формулам.
"На первый взгляд, - писал Пуанкаре, - изучение спектрального распределения приводит нас к мысли о гармониках, с которыми мы уже встречались в акустике. Однако имеется существенное различие: не только волновые числа кратны одной и тоже величине, но мы не находим здесь также никакой аналогии с корнями тех трансцендентных уравнений, к которым так часто приводят задачи математической физики. Спектральные законы проще, но они имеют совершенно другую природу. "Эту вторую трудность пытались обойти путем построения подходящих колебательных систем, идя обратно, от комбинационного принципа. Рикке, Ритцу, Фредгольму удалось довести эти построения до конца, но полученные при этом дифференциальные уравнения были столь сложны, что дать им удовлетворительную физическую интерпретацию оказалось невозможным.
Учение о спектрах вызывало необходимость создания теории строения атома и законопеременности оптического спектра, она должна была привести к результатам, которые согласуются с опытными данными по дисперсии и эффекту Зеемана, а в дальнейшем найти объяснение характеристическим рентгеновским спектрам и эффекту Штарка. Постепенно стали приходить к убеждению, что решить эту задачу в рамках классической электродинамики невозможно. Этому в немалой степени способствовали работы Эйнштейна, успешно приме-
- 15 -
нившего квантовые представления в теории теплоемкости и при рассмотрении фотоэффекта, фотохимических явлений, рентгеновского излучения.
Квантовые представления в той или иной форме применялись еще до работ Бора при рассмотрении отдельных вопросов, связанных со строением атомов и молекул. Нерст рассмотрел молекулярные спектры в предположении, что имеет место квантование вращения молекул. Бьеррум, развил идею Нернста, провел расчет спектра испускания двухатомной молекулы, полагая, что при ее вращении с частотой 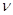 вокруг линии, соединяющей оба атома, энергия вращения кратна
вокруг линии, соединяющей оба атома, энергия вращения кратна 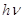 (
( - постоянная Планка).
- постоянная Планка).
Никольсон воспользовался моделью, предложенной Нагаока. Согласно этой модели атом состоит из центральной положительно заряженной частицы, вокруг которой с общей угловой скоростью вращаются кольца, заполненные электронами. Спектры объяснялись колебаниями колец в целом. В дальнейшем Бор указал на основные трудности и недостатки этой теории.
У Никольсона соотношения между частотами, соответствующие опреде- ленным линиям, сравнимы с соотношениями между частотами, соответству- ющими различного рода колебаниями электронного кольца. Он в одной из своих работ, стремясь объяснить наблюденные им спектры астрономических объектов, предположил, что момент импульса электронных колец кратен 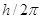 . К проблеме устойчивости Никольсон не подходил.
. К проблеме устойчивости Никольсон не подходил.
Бор увлекся теоретическими проблемами, связанными с моделью Резер- форда, весной 1912 г., сразу же после приезда в Манчестер. Его привлекла возможность отчетливого разделения тех физических свойств элементов, которые определялись непосредственно ядром, от тех, которые вызваны распределением электронов в атоме.
К середине 1912 г. была уже готова значительная часть работы "О строении атомов и молекул", но Бор продолжал исследовать роль кванта действия в электронном строении атома в связи с проблемами излучения. Трудности возникали из-за вопроса устойчивости атома. Ранней весной 1913 г. он нашел решение, когда вовлек в рассмотрение простейшие спектральные закономерности.
- 16 -
4. ТЕОРИЯ АТОМА БОРА.
В 1913 г. в английском журнале "Philosophikal Magazine" была опубликована статья Н. Бора "О строении атомов и молекул". Статья состояла из трех частей. Первая часть озаглавлена "Связывание электронов положительным ядром", вторая - "Системы, содержащие только одно ядро", третья - "Системы с несколькими ядрами".
В статье излагалась новая теория строения атома. "Введение" к статье Бор начал с краткой характеристики модели атома Резерфорда, согласно которой атом состоит положительно заряженного ядра и системы окружающих его электронов. Силами притяжения электроны удерживаются на определенных расстояниях от ядра. Положительный заряд ядра и общий отрицательный заряд электронов равны между собой. Линейные размеры ядра очень малы по сравнению с линейными размерами атома в целом. Основная часть массы атома заключена в ядре. Бор полностью принял модель атома, предложенную Резерфордом. Он считал, что вокруг ядра атома водорода вращается только один электрон и заряд ядра Е = е; в атоме гелия вращаются два электрона, в атоме лития - три электрона и т.д.
До Резерфорда в физике господствовала модель атома Дж. Дж. Томсона, согласно которой атом состоит из шара, равномерно заполненного положи- тельным электрическим зарядом. В этом шаре электроны движутся по окружностям. Основное различие между моделями Томсона и Резерфорда Бор усматривал в том, что в модели Томсона силы, действующие на электроны, допускают такие конфигурации и движения, которое обеспечивают устойчивое равновесие системы, в то время как для модели Резерфорда, по-видимому, такие конфигурации не существуют. Это различие проявляется в том, что среди величин характеризующих атом Томсона, имеется одна величина - радиус положительно заряженного шара - с размерностью длины, в то время как среди величин, характеризующих атом Резерфорда, такая длина отсутствует.
Теория теплового излучения Планка и прямые подтверждения существо-вания элементарного кванта действия в опытах по теплоемкости, фотоэффекту и других, побудили Бора усомниться в применимости классической электродинамики к атомным системам. Бор поставил перед собой задачу ввести в законы движения электронов элементарный квант действия. Атом Резерфорда и квант действия Планка - исходные моменты теории атома Бора.
В первой части статьи Бора на основе теории Планка рассматривается механизм связывания электрона с ядром. На примере простейшей системы, состоящей из положительно заряженного ядра и электрона, движущегося по замкнутой орбите вокруг ядра, показано, что при излучении, которое должно иметь место по законам электродинамики, электрон не может двигаться по стационарным орбитам. В результате излучения энергия будет непрерывно убы-
- 17 -
вать. Электрон будет приближаться к ядру, описывая все меньшие орбиты. Частота его вращения вокруг ядра будет все увеличиваться. Поведение такой системы, вытекающее из основ классической электродинамики, отличается от того, что имеет место в действительности. Атомы длительное время имеют определенные размеры и частоты. "Далее, - пишет Бор, - представляется, что если рассмотреть какой - либо молекулярный процесс, то после излучения определенного количества энергии, характерного для изучаемой системы, эта система всегда вновь окажется в состоянии устойчивого равновесия, в котором расстояния между частицами будут того же порядка величины, что и до процесса".
Бор ясно показал, что следствия классической электродинамики не соответствуют тому, что мы наблюдаем в атомных системах. Высший критерий физики есть опыт. Поскольку опыт в области атомных явлений нельзя объяснить представлениями и теорией классической физики, Бор обращается к теории излучения Планка. Эта теория утверждает, что излучение энергии атомной системы происходит не непрерывно, а определенными раздельными порциями. Количество испускаемой атомным излучателем энергии при каждом процессе излучения равно 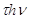 , где
, где 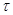 - целое число, h - универсальная постоянная Планка,
- целое число, h - универсальная постоянная Планка, 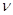 - частота. Бор допускает, что элекВнтрон испускает монохроматическое излучение с частотой
- частота. Бор допускает, что элекВнтрон испускает монохроматическое излучение с частотой 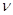 , равной полоВнвине частоты обращения электрона по своей окончательной орбите.
, равной полоВнвине частоты обращения электрона по своей окончательной орбите.
Энергия излучения :
W =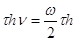 ,
,
где:
 ,
,
W - среднее значение кинетической энергии электрона за одно полное обращение, e и E - заряды электрона и ядра, m - масса электрона. Подставив значение 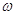 , получим:
, получим:
W =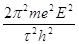 ,
,
Длина большой полуоси орбиты:
- 18 -
2а 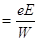 ,
,
Придав 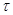 разные значения, мы получим ряд значений W,
разные значения, мы получим ряд значений W, 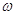 , и а, соответствующих ряду конфигураций системы. В этих состояниях атом не излучает. W принимает максимальное значение при
, и а, соответствующих ряду конфигураций системы. В этих состояниях атом не излучает. W принимает максимальное значение при 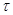 =1, подставив значения E = e = 4,7 * 10-10 , e/m = 5,31 * 1017 , h = 6,54 * 10-27 ,имеем 2а = 1,1 * 10-8 см,
=1, подставив значения E = e = 4,7 * 10-10 , e/m = 5,31 * 1017 , h = 6,54 * 10-27 ,имеем 2а = 1,1 * 10-8 см, 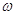 = 6,2 * 1015 с-1, W/e = 13 в. Эти величины того же порядка, что и линейные размеры атома, оптические частоты и ионизационные потенциалы.
= 6,2 * 1015 с-1, W/e = 13 в. Эти величины того же порядка, что и линейные размеры атома, оптические частоты и ионизационные потенциалы.
Бор указывает, какова предыстория применения теории Планка к атомным системам: "На всеобщее значение теории Планка для обсуждения поведения атомных систем впервые указал Эйнштейн. Соображения Эйнштейна, были затем развиты и применены к различным явлениям в особенности Штарком, Нернстом и Зоммерфельдом. Соответствие наблюдаемых частот и размеров атома и вычисленных на основе соображений, приведенных выше, было предметом многочисленных обсуждений". С точки зрения теории Планка Дж. Никольсон рассматривал системы, у которых силы взаимодействия между частицами обратно пропорциональны квадрату расстояния между ними. Однако его теория не в состоянии была объяснить известные спектральные закономерности Р
Вместе с этим смотрят:
"Архитектурная сказка" М. Ф. Казакова
"Великая депрессия" в США
"Византийский стиль" в архитектуре Москвы
"Дворцовые перевороты" и усиление позиций аристократии и гвардии: причины и последствия
"Золотой век" Екатерины II. Россия во II половине XVIII века