Белки: история исследования, химсостав, свойства, биологические функции
Страница 5
4. Валин, лейцин и изолейцин. Представляют собой разветвленные аминокислоты, которые активно участвуют в обмене веществ и не синтезируются в организме.
Моноаминодикарбоновые аминокислоты имеют одну аминную и две карбоксильные группы и в водном растворе дают кислую реакцию. К ним относятся аспарагиновая и глутаминовая к-ты, аспарагин и глутамин. Они входят в состав тормозных медиаторов нервной системы.
Диаминомонокарбоновые аминокислоты в водном растворе имеют щелочную реакцию за сет наличия двух аминных групп. Относящийся к ним лизин необходим для синтеза гистонов а также в ряд ферментов. Аргинин участвует в синтезе мочевины, креатина.
Циклические. Эти аминокислоты имеют в своем составе ароматическое или гетероциклическое ядро и, как правило, не синтезируется в организме человека и должны поступать с пищей. Они активно участвуют в разнообразных обменных процессах. Так фенил-аланин служит основным источником синтеза тирозина – предшественника ряда биологически важных веществ: гормонов (тироксина, адреналина), некоторых пигментов. Триптофан помимо участия в синтезе белка, служит компонентом витамина PP, серотонина, триптамина, ряда пигментов. Гистидин необходим для синтеза белков, является предшественником гистамина, влияющего на кровяное давление и секрецию желудочного сока.
Глава 4. Структура.
При изучении состава белков было установлено, что все они построены по единому принципу и имеют четыре уровня организации: первичную, вторичную, третичную, а отдельные из них и четвертичную структуры.
4.1. Первичная структура
Представляет собой линейную цепь аминокислот, расположенных в определенной последовательности и соединенных между собой пептидными связями. Пептидная связь образуется за счет a-карбоксильной группы одной аминокислоты и a-аминной группы другой:

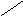
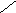
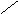 O - H2O O
O - H2O O

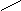
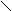 H2N – CH – C + NH – CH – COOH H2N – CH – C ¾ NH – CH – COOH
H2N – CH – C + NH – CH – COOH H2N – CH – C ¾ NH – CH – COOH
| OH H | | |
R R1 R R
|
|  |
Пептидная связь вследствие p, p-сопряжения p-связи карбонильной группы и р-орбитали атома N, на котором находится не поделенная пара электронов, не может рассматриваться как одинарная и вращение вокруг нее практически отсутствует. По этой же причине хиральный атом C a и карбонильный атом C k любого i-го аминокислотного остатка пептидной цепи и атомы N и Сa(i+1)-го остатка находятся в одной плоскости. В этой же плоскости находятся карбонильный атом О и амидный атом Н ( однако накопленный при изучении структуры белков материал показывает, что это утверждение не совсем строго: атомы, связанные с пептидным атомом азота, находятся не в одной плоскости с ним, а образуют трехгранную пирамиду с углами между связями, очень близкими к 120°. Поэтому между плоскостями, образованными атомами Cia, Cik, Oi и Ni+1, Hi+1, Ci+1a , существует некоторый угол, отличающийся от 0°. Но, как правило, он не превышает 1° и не играет особой роли). Поэтому геометрически полипептидную цепочку можно рассматривать как образованную такими плоскими фрагментами, содержащими каждый по шесть атомов. Взаимное расположение этих фрагментов, как и всякое взаимное расположение двух плоскостей, должно определятся двумя углами. В качестве таковых принято брать торсионные углы, характеризующие вращения вокруг s-связей N ¾ C a и C a ¾ C k.
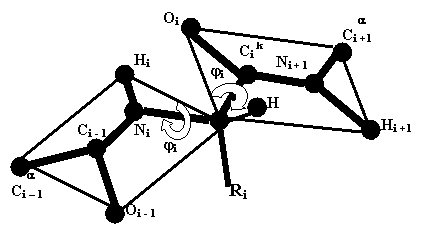
Геометрия любой молекулы определяется тремя группами геометрических характеристик ее химических связей – длинами связей, валентными углами и торсионными углами между связями, примыкающими к соседним атомам. Первые две группы в решающей мере определяются природой участвующих атомов и образующихся связей. Поэтому пространственная структура полимеров в основном определяется торсионными углами между звеньями полимерного остова молекул, т.е. конформацией полимерной цепи. Торсионный угол, т.е. угол поворота связи А-В вокруг связи В-С относительно связи С-D, определяется как угол между плоскостями, содержащими атомы А, В, С и атомы B, C, D.
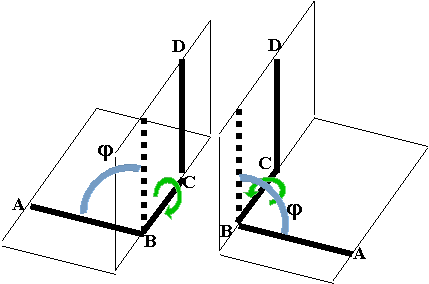
В такой системе возможен случай, когда связи А-В и С-D расположены параллельно и находятся по одну сторону от связи В-С. Если рассматривать эту систему вдоль связи В-С, то связь А-В как бы заслоняет связь C-D, поэтому такая конформация называется заслоненной. Согласно рекомендациям международных союзов химии IUPAC (International Union of Pure and Applied Chemistry) и IUB (International Union of Biochemistry), угол между плоскостями ABC и BCD считается положительным, если для приведения конформации в заслоненное состояние путем поворота на угол не выше 180° ближнюю к наблюдателю связь нужно поворачивать по часовой стрелке. Если эту связь для получения заслоненной конформации нужно поворачивать против часовой стрелки, то угол считается отрицательным. Можно заметить, что это определение не зависит от того, какая из связей находится ближе к наблюдателю.
При этом, как видно из рисунка, ориентация фрагмента, содержащего атомы Ci-1a и Cia [(i-1)-й фрагмент], и фрагмента, содержащего атомы Cia и Ci+1a (i-й фрагмент), определяется торсионными углами, соответствующими вращению вокруг связи Ni¾Cia и связи Cia¾Cik. Эти углы принято обозначать как j и y, в приведенном случае соответственно ji и yi. Их значениями для всех мономерных звеньев полипептидной цепи в основном определяется геометрия этой цепи. Никаких однозначных величин ни для значения каждого из этих углов, ни для их комбинаций не существует, хотя на те и на другие накладываются ограничения, определяемые как свойствами самих пептидных фрагментов, так и природой боковых радикалов, т.е. природой аминокислотных остатков.
К настоящему времени установлены последовательности аминокислот для нескольких тысяч различных белков. Запись структуры белков в виде развернутых структурных формул громоздка и не наглядна. Поэтому используется сокращенная форма записи – трехбуквенная или однобуквенная (молекула вазопрессина):


 Cys – Tyr – Phe – Gln – Asn – Cys – Pro – Arg – Gly – NH2 CYFQNCPRG – NH2
Cys – Tyr – Phe – Gln – Asn – Cys – Pro – Arg – Gly – NH2 CYFQNCPRG – NH2



 S S
S S
При записи аминокислотной последовательности в полипептидных или олигопептидных цепях с помощью сокращенной символики предполагается, если это особо не оговорено, что a-аминогруппа находится слева, а a-карбоксильная группа – справа. Соответствующие участки полипептидной цепи называют N-концом (аминным концом) и С-концом (карбоксильным концом), а аминокислотные остатки – соответственно N-концевым и С-концевым остатками.