Белки: история исследования, химсостав, свойства, биологические функции
Страница 6
4.2. Вторичная структура.
Фрагменты пространственной структуры биополимер, имеющие периодическое строение полимерного остова, рассматривают как элементы вторичной структуры.
Если на протяжении некоторого участка цепи однотипные углы, о которых говорилось на стр.15, приблизительно одинаковы, то структура полипептидной цепи приобретает периодический характер. Существует два класса таких структур – спиральные и растянутые (плоские или складчатые).
Спиральной считается структура, у которой все однотипные атомы лежат на одной винтовой линии. При этом спираль считается правой, если при наблюдении вдоль оси спирали она удаляется от наблюдателя по часовой стрелке, и левой – если удаляется против часовой стрелки. Полипептидная цепь имеет спиральную конформацию, если все атомы Ca находятся на одной винтовой линии, все карбонильные атомы Ck - на другой, все атомы N – на третьей, причем шаг спирали для всех трех групп атомов должен быть одинаков. Одинаковым должно быть и число атомов, приходящихся на один виток спирали, независимо от того, идет ли речь об атомах Ck, Ca или N. Расстояние же до общей винтовой линии для каждого из этих трех типов атомов свое.
Главными элементами вторичной структуры белков являются a-спирали и b-складки.
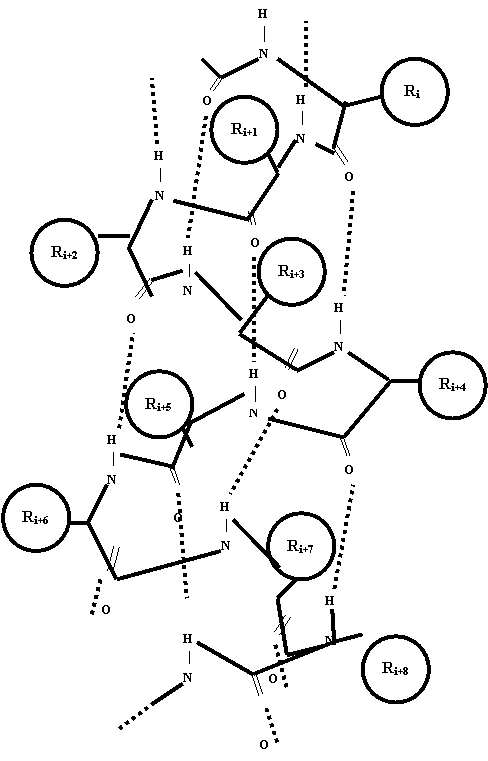
Спиральные структуры белка. Для полипептидных цепей известно несколько различных типов спиралей. Среди них наиболее распространена правая a-спираль. Идеальная a-спираль имеет шаг 0,54 нм и число однотипных атомов на один виток спирали 3,6, что означает полную периодичность на пяти витках спирали через каждые 18 аминокислотных остатков. Значения торсионных углов для идеальной a-спирали j = – 57° y = – 47 ° , а расстояния от атомов, образующих полипептидную цепь, до оси спирали составляет для N 0,15 нм, для C a 0,23 нм, для C k 0,17 нм. Любая конформация существует при условии, что имеются факторы, стабилизирующие ее. В случае a-спирали такими факторами являются водородные связи, образуемые каждым карбонильным атомом (i+4)-го фрагмента. Важным фактором стабилизации a-спирали также является параллельная ориентация дипольных моментов пептидных связей.
Складчатые структуры белка. Одним из распространенных примеров складчатой периодической структуры белка являются т.н. b-складки, состоящие из двух фрагментов, каждый из которых представлен полипептидом.
b-складки также стабилизируются водородными связями между атомом водорода аминной группы одного фрагмента и атомом кислорода карбоксильной группы другого фрагмента. При этом фрагменты могут иметь как параллельную, так и антипараллельную ориентацию относительно друг друга.
Структура, образующаяся в результате таких взаимодействий, представляет собой гофрированную структуру. Это сказывается на значениях торсионных углов j и y. Если в плоской, полностью растянутой структуре они должны были бы составить 180°, то в реальных b-слоях они имеют значения j = – 119° и y = + 113°. Для того чтобы два участка полипептидной цепи располагались в ориентации, благоприятствующей образованию b-складок, между ними должен существовать участок, имеющий структуру, резко отличающийся от периодической.
4.2.1. Факторы, влияющие на образование вторичной структуры.
Структура определенного участка полипептидной цепи существенно зависит от структуры молекулы в целом. Факторы, влияющие на формирование участков с определенной вторичной структурой, весьма многообразны и далеко не во всех случаях полностью выявлены. Известно, что ряд аминокислотных остатков предпочтительно встречается в a-спиральных фрагментах, ряд других – в b-складках, некоторые аминокислоты – преимущественно в участках, лишенных периодической структуры. Вторичная структура в значительной степени определяется первичной структурой. В некоторых случаях физический смысл такой зависимости может быть понят из стереохимического анализа пространственной структуры. Например, как видно из рисунка в a-спирали сближены не только боковые радикалы соседних вдоль цепи аминокислотных остатков, но и некоторые пары остатков, находящихся на соседних витках спирали, в первую очередь каждый (i+1)-й остаток с (i+4)-м и с (i+5)-м. Поэтому в положениях (i+1) и (i+2), (i+1) и (i+4), (i+1) и (i+5) a-спиралей редко одновременно встречается два объемных радикала, таких, например, как боковые радикалы тирозина, триптофана, изолейцина. Еще менее совместимо со структурой спирали одновременное наличие трех объемных остатков в положениях (i+1), (i+2) и (i+5) или (i+1), (i+4) и (i+5). Поэтому такие комбинации аминокислот в a-спиральных фрагментах являются редким исключением.
4.3. Третичная структура
Под этим термином понимают полную укладку в простанстве всей полипептидной цепи, включая укладку боковых радикалов. Полное представление о третичной структуре дают координаты всех атомов белка. Благодаря огромным успехом рентгеноструктурного анализа такие данные, за исключением координат атомов водорода получены для значительного числа белков. Это огромные массивы информации, хранящиеся в специальных банках данных на машиночитаемых носителях, и их обработка немыслима без применения быстродействующих компьютеров. Полученные на компьютерах координаты атомов дают полную информацию о геометрии полипептидной цепи, в том числе значения торсионных углов, что позволяет выявить спиральную структуру, b-складки или нерегулярные фрагменты. Примером такого исследовательского подхода может служить следующая пространственная модель структуры фермента фосфоглицераткиназы:
|
|  |
Общая схема строения фосфоглицераткиназы. Для наглядности a-спиральные участки представлены в виде цилиндров, а b-складки – в виде лент со стрелкой, указывающей направление цепи от N-конца к С-концу. Линии – нерегулярные участки, соединяющие структурированные фрагменты.
Изображение полной структуры даже небольшой белковой молекулы на плоскости, будь то страница книги или экран дисплея мало информативно из-за чрезвычайно сложного строения объекта. Чтобы исследователь мог наглядно представлять простанственное строение молекул сложных веществ, используют методы трехмерной компьютерной графики, позволяющей выводить на дисплей отдельные части молекул и манипулировать с ними, в частности поворачивать их в нужных ракурсах.
Третичная структура формируется в результате нековалентных взаимодействий (электростатические, ионные, силы Ван-дер-Ваальса и др.) боковых радикалов, обрамляющих a-спирали и b-складки, и непериодических фрагментов полипептидной цепи. Среди связей, удерживающих третичную структуру следует отметить:
а) дисульфидный мостик ( – S – S – )
б) сложноэфирный мостик (между карбоксильной группой и гидроксильной группой)
в) солевой мостик (между карбоксильной группой и аминогруппой)
г) водородные связи.
В соответствии с формой белковой молекулы, обусловленной третичной структурой, выделяют следующие группы белков:
1) Глобулярные белки. Пространственная структура этих белков в грубом приближении может быть представлена в виде шара или не слишком вытянутого эллипсоида - глобулы. Как правило, значительная часть полипептидной цепи таких белков формирует a-спирали и b-складки. Соотношение между ними может быть самым различным. Например, у миоглобина (подробнее о нем на стр.28) имеется 5 a-спиральных сегментов и нет ни одной b-складки. У иммуноглобулинов (подробнее на стр.42), наоборот, основными элементами вторичной структуры являются b-складки, а a-спирали вообще отсутствуют. В вышеприведенной структуре фосфоглицераткиназы и те и другие типы структур представлены примерно одинаково. В некоторых случаях, как это видно на примере фосфоглицераткиназы, отчетливо просматриваются две или более четко разделеннные в пространстве (но тем не менее, конечно, связанные пептидными мостиками) части – домены. Зачастую различные функциональные зоны белка разнесены по разным доменам.