Использование чёрной и цветной металлургии, их процессы и характеристики
Использование чёрной и цветной металлургии, их процессы и характеристики
План
1. Анализ базовых технологий цветной металлургии
2. Технико-экономические показатели сталеплавильного производства.
3. Применение цветных металлов и сплавов в народном хозяйстве и их основная характеристика.
4. Характеристика алюминия
5. Технология получения чистого алюминия.
1. Анализ базовых технологий цветной металлургии
По плотности цветные металлы делятся на тяжёлые (> 4,5г/см3) и лёгкие (<4,5г/см3).
Тяжёлые: Pb, Cu, олово, Zn
Лёгкие: Al, Ti, Mg
К легкоплавным металлам относятся металлы, у которых t0 плавления
< 10000C ( St, Pb, Zn, Al, Cu)
Тугоплавкие ( Wo, Md )
По степени окисления металлы делятся на благородные и обыкновенные.
Сплавы меди – бронза и латунь.
Бронза – Cu+37, латунь – Cu+Zn. AL
Легкоплавкий металл (6590 C); 2,7 кг/ м3.
Чистый Al обладает высокими пластическими свойствами, теплопроводностью, высокой карриостойкостью.
Делится на особочистый (А 999 или А 99), высокой чистоты (А 97, А 95, А 965), технически чистый ( А 85, А8, А7, А6, А5 ).
Группы символов Al: деформированные (литейные), литейные (авиация, судостроение).
Литейные автоматизированные сплавы применяются в машиностроении
В их основе Al, силумин, Mg, Zn, Cu.
В природе в чистом виде Al нет. Встречается в виде осколков -Al2O3
2.Технико-экономические показатели сталеплавильного производства.
Сталью называют сплавы железа с углеродом и другими элементами. Такие сплавы обладают пластическими свойствами как в нагретом, так и в холодном состоянии, и могут подвергаться прокатке, волочению ковке, штамповке.
Сталь содержит до 2% углерода и некоторое количество марганца, кремния, а также вредные примеси (фосфор и серу). Кроме этих примесей, в стали могут содержаться и легирующие элементы: хром, никель, ванадий, титан и др.
В настоящее время сталь производят преимущественно путем передела чугуна, при котором из чугуна удаляется избыток углерода, кремния, марганца, а также вредных примесей для придания ей необходимых свойства. Углерод и другие примеси при высокой температуре соединяются с кислородом гораздо энергичнее чем железо, и их можно удалить при незначительных потерях железа.
Углерод, чугуна, соединяясь с кислородом, превращается в газ (окись углерода СО) и улетучивается.
Другие примеси превращаются в окислы SiO2, МnО и P2O5, которые вследствие меньшего по сравнению с металлом удельного веса всплывают и образуют шлак.
В настоящей время в промышленности в основном применяют конверторный и мартеновский; методы получения стали; кроме того, сталь получают в электрических; дуговых и индукционных печах.
3. Применение цветных металлов и сплавов в народном хозяйстве и их основная характеристика.
В промышленности и технике широкое применение находят цветные редкие металлы. Такое использование цветных и редких металлов обусловливается их особыми свойствами (пластичностью, высокой электропроводностью и теплопроводностью, антикоррозионностью, малым удельным весом, большой удельной прочностью и др.), важными для современного машиностроения и других отраслей народного хозяйства.
Цветные металлы подразделяют на тяжелые и легкие.
К тяжелым цветным металлам относят; медь, никель, свинец, олово и цинк. Некоторые физические и механические свойства тяжелых цветных металлов приведены в табл. 1.
Таблица 1
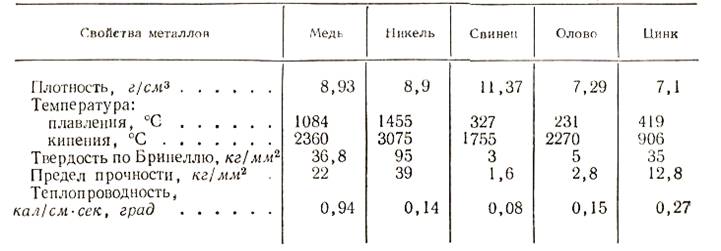
Легкими цветными металлами принято называть такие, которые имеют малый удельный вес. К таким металлам относятся: алюминий, магний, бериллий, щелочные и щелочно-земельные металлы. Некоторые физические и механические свойства алюминия и магния в табл. 2.
К группе редких металлов относят такие металлы, которые мало распространены в природе, имеют большую рассеянность в земной коре; их трудно получать и они являются малоизученными. К редким металлам относят: титан, вольфрам, молибден, панадий, ниобии, цирконий, тантал; все они имеют температуру плавления выше 1700°С. Эти металлы используют главным образом в производстве специальных сталей в качестве раскислителей легирующих добавок, а также при производстве сплавов специального назначения. Из вольфрама делают нити электрических и электронных ламп, а из молибдена, тантала и ниобия — детали электронных устройств. К редким радиоактивным металлам относят уран. торий, актиний и протактиний, В связи с развитием атомной энергии применение этих элементов в промышленности резко возросло.
Таблица2.
Рассеянными редкими металлами называют индий, галлий, таллий, германий и рений. Все эти элементы находятся в земной коре в малых концентрациях. Многие из них не имеют собственных минералов Индий, галлий, таллий, например, залегают со свинцом и цинком, рений с молибденом; германий концентрируется в золе некоторых каменных углей, а также в рудах свинца и цинка. Он применяется в качестве детектора радиолокационных установок и в ультракоротковолновой радиотехнике.
Из всех вышеперечисленных цветных н редких металлов наиболее широкое применение находят и промышленности медь, алюминий, магний, а последнее время также и титан.
4. Характеристика алюминия
Для получения алюминия используют руды, содержащие глинозём Al2O3. К таким рудам относятся бокситы, нефелины, алуниты и каолины. Бокситы в своем составе содержат 30—57% Al2O3; они залегают в Тихвинском районе (Ленинградской области), на Урале, в Сибири и в Московской области. Нефелины получают в виде отходов после обогащения апатито-нефелиновой породы; они содержат около 30% Al2O3. Апатито-нефелиновые руды залегают на Севере и Урале. Алуниты содержат 20—21% Al2O3 они добываются на Кавказе.
Основными рудами для получения алюминия являются бокситы и нефелины. При использовании нефелинов в качестве алюминиевых руд получают ценные побочные продукты — поташ и соду.
Технологический процесс получения алюминия разделяется в основном на две стадии: получение глинозема Al2O3 из руды и алюминия из глинозема.
5. Технология получения чистого алюминия.
Безводная окись алюминия Al2O3 представляет собой прочное Химическое соединение алюминия с кислородом; температура ее плавления 2050°С, температура кипения 2980° С. Получение алюминия из глинозема путем восстановления углеродом или окисью углерода невозможно, так как этот процесс приводит к образованию карбидов Al4С3, Алюминий нельзя получить и электролизом из водного раствора солей, так как на катоде выделяется только водород. Полому алюминий получают электролизом из глинозема путем растворения в расплавленном криолите. Криолит представляет собой фторит алюминия и натрия Na3AlFe6.
В качестве сырья для производства криолита используют плавиковый
 шпат CaF2, гидрат окиси алюминия, соду и серную кислоту.
шпат CaF2, гидрат окиси алюминия, соду и серную кислоту.
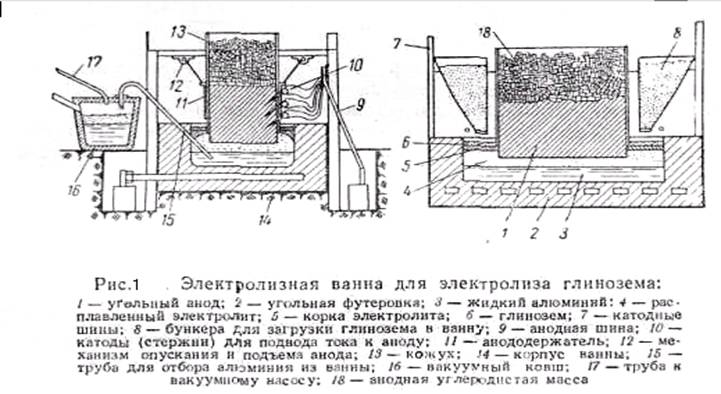
Для электролиза глинозема применяют электролизные ванны (рис. 1). Ванна имеет железный корпус, внутри выложенный теплоизоляционный кирпичом и угольными блоками. В поду ванны вставлены катодные шины, Сверху в ванну опущены угольные электроды, представляющие собой аноды. Электрически постоянный ток к анодам подводится от шин, расположенный над ванной. Ток применяют напряжением от 5 до 10 В, сила тока на одну ванну—от 40000 до 100 000 а. Электрический ток используется как для электрохимического процесса, так и для нагрева электролита до 950—1000°С. Во время электролиза выделяющийся на аноде кислород взаимодействует с углеродом анода, образуя окись СО и двуокись СО2 углерода, которые отводятся из ванны. Жидкий алюминий, собирающийся на дне ванны, периодически выпускается в ковш или выбирается с помощью сифона. При электролизе для получения 1 т алюминия расходуется примерно 2 т глинозема, 100 кг криолита, 600 кг угольных электродов и 16500—18500 квт.ч электроэнергии.