Вода и ее применение в современных технологиях
Страница 3
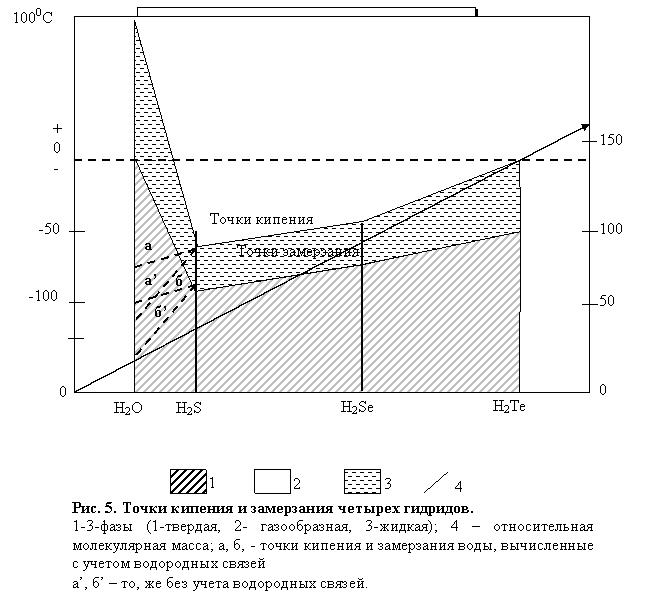
1.3 Точки кипения и замерзания (плавления).
Что касается температуры кипения, то она находится в прямой зависимости от давления: с увеличением давления она возрастает (рис. 5). Это свойство воды раньше использовалось для определения высоты местности в горах. Температура кипения повышается также с увеличением содержания в воде растворенных веществ.
Иная зависимость наблюдается между давлением и точкой замерзания (плавления) воды, с повышением давления она падает (но только до давления 2200 атм). При дальнейшем увеличении давления точка замерзания воды начинает расти: при давлении 3530 атм вода замерзает при минус 17; при 6380 атм—при 0°С, при 16500 атм—при 60, а при 20 670 атм — при 76 °С. В последних двух случаях мы уже имеем горячие льды. Возможно ли существование в земных недрах сочетания таких температур и давлений? В свободно циркулирующих в породах Земли водах, безусловно, нет, так как даже на границе нижней литосферы и верхней мантии, называемой границей Мохоровичича (как мы увидим из дальнейших глав), где давление приблизительно 10000 атм, температура никак не может быть равна 30 "С,
 а всегда и везде будет значительно выше. Таким Образом, встреча горячего льда здесь исключается. Выше же границы Мохоровичича совершенно исключаются давления выше 6000 атм, которые необходимы для образования горячего льда.
а всегда и везде будет значительно выше. Таким Образом, встреча горячего льда здесь исключается. Выше же границы Мохоровичича совершенно исключаются давления выше 6000 атм, которые необходимы для образования горячего льда.
При давлении 1 атм аномальны точки замерзания (плавления) и кипения воды (соответственно 0 и 100°С). Если взять ряд соединений водорода с элементами группы Via периодической системы Менделеева — Н2Те, H2Se H2S и H2O — с учетомих относительной молекулярной массы, то окажется, что точки замерзания и кипения воды не укладываются в закономерность, общую для трех других соединений, у которых чем больше относительная молекулярная масса, тем выше точки кипения и замерзания. Точка замерзания воды должна была бы находиться между минус 90 и минус 120 °С, а в действительности она приходится на ±0 °С. То же самое можно сказать о точке кипения воды, которая должна была бы быть между 75 и 100 °С (рис. 5).
При нормальном давлении вода может «замер-рать» и при положительной температуре. Это наблюдается, например, в газопроводе, когда проходящий по нему газ (в основном метан) плохо осушен, т.е. в нем присутствует вода. Объем молекулы газа по сравнению с объемом молекулы воды значительно больше, что приводит к понижению внутреннего давления и к повышению температуры замерзания от нескольких градусов до 20 °С. Выпадающий «лед» содержит много газа (газогидрат).
Сам факт существования воды в обычных для земной поверхности термодинамических условиях во всех трех фазах (твердой, жидкой и газообразной) делает это вещество крайне удивительным и необыкновенным.
1.4 Теплота плавления.
Познакомимся с еще одной аномалией воды, называемой, может быть, не очень удачно «скрытой теплотой плавления воды». У воды она очень высока — около 80 кал/г (для сравнения «скрытая» теплота плавления чистого железа — 6, серы—9,5 и свинца—5,5 кал/г). Как же проявляется эта аномалия? Лед при давлении 1 атм может иметь температуру от минус 1 до минус 7°С. Казалось бы, чем ниже температура льда, тем больше потребуется тепла, для того чтобы растопить его. Этот вывод как будто настолько естествен, что непосвященный в физику тепла вряд ли станет его оспаривать. Но, оказывается, этот вывод не бесспорен. Например, при температуре льда 7°С ниже нуля скрытая теплота плавления составит не 80, а только 76 кал/г! Вот это уже бесспорная и довольно неожиданная аномалия. С каждым градусом понижения температуры льда теплота плавления уменьшается чуть ли не на полкалории. Объясняется это тем, что удельная теплоемкость у льда меньше, чем у воды.
Скрытая теплота парообразования (539 кал/г) почти в 7 раз выше, чем скрытая теплота плавления. Чтобы превратить жидкую воду с температурой 100 °С в пар с такой же температурой, нужно затратить поистине гигантскую энергию, в то время как '/з этой энергии вполне достаточно, чтобы превратить в пар спирт, и '/в, чтобы жидкую ртуть сделать парообразной. Можете теперь себе представить, какой громадной внутренней энергией в скрытой форме обладает водяной пар, и это только при 100 °С! А если его нагреть до 500 °С, то 1 г его потенциально будет содержать порядка 1000 кал тепла. К сожалению, реализовать эту скрытую энергию практически очень трудно.
Как известно, пар используется в паровых машинах, которых становится все меньше и меньше из-за исключительно низкого (ниже) к. п. д. и не только в силу невозместимых естественных потерь на трение, излучение, теплопроводность и других, но и по причинам малой разности температур между границами существования воды, а также малого контраста между температурой окружающего воздуха и точкой парообразования. Эти обстоятельства в настоящее время заставляют заменить паровые двигатели двигателями внутреннего сгорания, электрическими и другими.
Что же касается скрытой теплоты парообразования, то тут аномальности не наблюдается. Чем холоднее жидкая вода, тем больший приток тепла нужен ей, чтобы обратить ее в пар. Так, при 0°С теплота парообразования 587 кал, при 50 °С — 568, а при 100 °С — 536, при 150 °С — 446 кал.
1.5 Поверхностное натяжение и прилипание.
Поверхностное натяжение — это способность пограничных молекул воды, а также твердых тел сцепляться, «стягиваться», самоуплотняться (когезия). На поверхности воды образуются сцепления молекул, создающие пленку натяжения, для разрыва которой потребуется немалая сила. На этой пленке могут лежать, не погружаясь в воду, предметы, которые в 8 раз и более тяжелее воды, например лезвие безопасной бритвы, иголка и др. Поверхностное натяжение воды при 18°С составляет 72 дин/см— это очень высокое значение (сравните: для спирта оно составляет 22, для ацетона 24, для бензина 29 дин/см). Только ртуть имеет еще более высокое поверхностное натяжение — 500 дин/см.
Теоретически установлено, что для разрыва столбика чистой воды диаметром 2,5 см потребуется приложить усилие 95 те. Поскольку, как уже упоминалось выше, совершенно чистой воды в природе нет, да и в лабораторных условиях получить ее почти невозможно, то в условиях эксперимента с не совсем чистой водой для разрыва столбика воды сечением 6,5 см2 потребуется усилие в пределах «только» 1 те, что близко к прочности стали.
У воды есть и еще одно удивительное свойство — «прилипание» (адгезия), которое можно наблюдать в узких стеклянных трубках (капиллярах), где вода
 Поднимается вверх вопреки силам притяжения (гравитации). В таких трубках сочетаются силы сцепления молекул воды в пограничном с воздухом слое со способностью воды смачивать стекло, «прилипать» к нему. В результате в капилляре образуется вогнутая поверхность выше естественного уровня воды. У ртути, обладающей более высоким поверхностным натяжением, адгезия отсутствует, поэтому ртуть в капиллярной трубке имеет не вогнутую, а выпуклую поверхность. Необходимо заметить, что к поверхностям, покрытым жировым слоем, например парафином, вода не прилипает и мениск ее в капилляре, подобно мениску ртути, будет не вогнутый, а выпуклый.
Поднимается вверх вопреки силам притяжения (гравитации). В таких трубках сочетаются силы сцепления молекул воды в пограничном с воздухом слое со способностью воды смачивать стекло, «прилипать» к нему. В результате в капилляре образуется вогнутая поверхность выше естественного уровня воды. У ртути, обладающей более высоким поверхностным натяжением, адгезия отсутствует, поэтому ртуть в капиллярной трубке имеет не вогнутую, а выпуклую поверхность. Необходимо заметить, что к поверхностям, покрытым жировым слоем, например парафином, вода не прилипает и мениск ее в капилляре, подобно мениску ртути, будет не вогнутый, а выпуклый.
Существует понятие капиллярной постоянной, которая равна произведению высоты подъема жидкости на радиус капилляра. Капиллярная постоянная для чистой воды линейно уменьшается с увеличением температуры, а при достижении критической (см. ниже) становится равной нулю. Предельная высота капиллярного подъема воды при 15 °С составит в крупном песке около 2, в мелком 1,2 м, а в чистой глине 12 м, причем продолжительность подъема для крупных капилляров—5—10 суток, а для мелких до 16 месяцев.
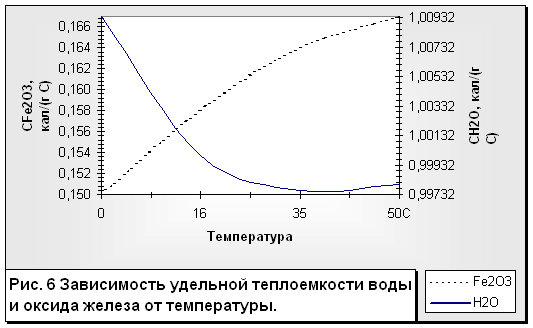
1.6 Теплоемкость воды.
Остановимся на следующей аномалии воды, которая связана с ее теплоемкостью. Теплоемкость воды сама по себе не аномальна, но она в 5—30 раз выше, чем у других веществ. У всех тел, кроме ртути и жидкой воды, удельная теплоемкость с повышением температуры возрастает. У воды же удельная теплоемкость в интервале температур от 0 до 35 °С. падает, а затем начинает возрастать (рис. 6).