Вниз по лестнице температур
Вниз по лестнице температур
Открытие сверхпроводимости было бы невозможным без достижения очень низких температур. Путь к таким температурам начинался с попыток превратить газ в жидкость.
Первые шаги были сделаны в конце XVII века. Английский физик Роберт Бойль в 1662 году и француз Эдм Мариотт в 1676 году независимо друг от друга установили первый газовый закон: при постоянной температуре объем воздуха в закрытом сосуде обратно пропорционален давлению, производимому им на стенки сосуда.
Зависимость одной характеристики состояния вещества от другой при постоянной температуре называется изотермой. Изотермы, найденные Бойлем и Мариоттом, похожи на гиперболы. На графике видно несколько гипербол: каждая из них соответствует своей температуре, причем та гипербола, которая получена при более высокой температуре, располагается выше. Это наблюдение выражается вторым газовым законом, который установил французский ученый Шарль в 1787 году: объем газа при постоянном давлении пропорционален его температуре.

После Шарля расширение газов изучали также и другие ученые, такие как Джон Дальтон, Жозеф Гей-Люссак.
В середине прошлого века французский физик Клапейрон объединил все найденные газовые законы в единый, согласно которому объем V, давление р и температура Т газа связаны простым соотношением pV = RT (R - газовая постоянная, равная примерно 8,3 ДУчебный материал
РОССИЙСКОЙ КОЛЛЕКЦИИ РЕФЕРАТОВ (с) 1996
http://referat.students.ru; http://www.referats.net; http://www.referats.com
ж/К.моль). Этот закон является общим для всех газов.
Двинемся по шкале температур, используя второй газовый закон. Если при снижении температуры на 1оС объем газа уменьшается на 1/273 часть, то примерно при -273оС объем газа должен упасть до нуля, весь газ должен стянуться в точку. Иными словами, должно существовать такое предельное значение температуры, ниже которого само это понятие теряет смысл.
Такое значение температуры английский физик Уильям Томпсон предложил называть абсолютным нулем. Температура Т в законе Клапейрона отсчитывается от этой предельной температуры.
В конце XVII века голландский ученый Маурициус Ван Марум решил выяснить справедлив ли закон Бойля-Мариотта для всех известных к тому времени газов. Среди выбранных им для исследования веществ был аммиак. Ван Марум проводил свои опыты при комнатной температуре, постепенно сжимая газ. Вначале аммиак вел себя так, как предсказывал закон. Но затем произошло неожиданное: при давлении примерно 700 килопаскалей, объем газа резко уменьшился и газ превратился в жидкость.
Физики последовали по пути Ван Марума и смогли сжижить при комнатной температуре еще несколько газов. И все же целый ряд газов, и среди них воздух, кислород, азот и водород, не удавалось превратить в жидкость. Эти газы стали называть "постоянными". Для сжижения постоянных газов требовались не только высокие давления, но и низкие температуры. Одним из первых это понял Майкл Фарадей. В 1823 году Фарадей по поручению английского химика Хамфри Дэви, у которого он тогда работал лаборантом, изучал тепловое разложение химического соединения хлора. Вещество нагревалось в Г-образной герметически запаянной стеклянной трубке. Колено трубки, куда было помещено вещество, нагревалось пламенем спиртовки, второе колено находилось при комнатной температуре. Фарадей обнаружил, что на стенках холодного конца трубки появился какой-то маслянистый желтый налет. После опыта Фарадей долго думал, что это такое и понял, что это мелкие капельки сжиженного хлора. Три года спустя Фарадей вернулся к своему опыту, но теперь дальнее колено он поместил в охлаждающую смесь. Он получил не отдельные капельки, а целы столбик жидкого хлора. Так удалось перевести в жидкое состояние еще несколько газов, но "постоянные" газы устояли и на этот раз.
Опыты продолжались было обнаружено критическое состояние, т.е. состояние при котором нельзя понять, что находится в сосуде жидкость или пар. В середине XVIII века шотландский ученый Томас Эндрюс начал исследования критического состояния. Он работал с окисью азота, хлористым водородом, аммиаком, сероводородом, но основною часть опытов провел с двуокисью углерода. Все эти вещества обнаружили сходное поведение.
Изотермы, полученные Эндрюсом, отличались от изотерм идеального газа. На гиперболах появились прямые участки. Слева от этих участков вещество находиться в жидком состоянии, справа - в виде пара. На самих прямых участках кривой пар и жидкость находятся в равновесии друг с другом, здесь вещество пребывает одновременно в двух агрегатных состояниях.
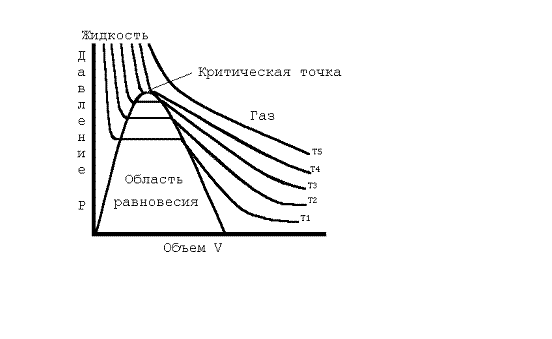
Если температура газа намного превышает критическую, то на диаграмме Эндрюса изотермы представляют собой почти идеальные гиперболы. По мере приближения ее к критической температуре изотермы начинают все более отклоняться от гипербол, и эти отклонения говорят о все большем отличии состояния вещества от идеального газа, все большей близости его к превращению в жидкость.
В 1877 году французский горный инженер Кайте предпринял попытку сжижить "постоянный" газ. Кайте смог получить жидкий кислород путем резкого охлаждения газа при быстром его расширении, выпуске в атмосферу. Но в жидком состоянии кислород находился не долго.
В 1883 году польским физикам Зыгмунту Вроблевскому и Каролю Олбшевскому удалось получить жидкий кислород в устойчивом состоянии. Для охлаждения кислорода они использовали жидкий этилен, который кипел при давлении в три раза меньшем атмосферного и температуре 143 К. Критическая температура кислорода равна 155К, а критическое давление 5 МПа, так что при температуре этилена 143К для сжижения кислорода его уже почти не надо было расширять. Но без этилена кислород опять превращался в газ.
После сжижения кислорода следующими были водород и азот. В 1891 году был открыт новый газ -гелий. Сжижить гелий после нескольких неудачных попыток других ученых попытался голландский физик Хейк Камерлинг-Оннес. Он начал с определения критической температуры гелия. 10 июля 1908 года начался эксперимент. Сначала нужно было сжижить водород, который затем должен был предварительно охлаждать гелий. Затем началась циркуляция охлажденного гелия в его ожижителе. Температура гелия начала понижаться. Жидкий гелий удалось получить.
Открытие и исследование сверхпроводимости
Онесс решил провести измерения электрического сопротивления металлов при гелиевых температурах. Он изготовил проволочки из нескольких образцов платины. Все проволочки были одинаковой длины и сечения, но при измерении в кипящем гелии имели разные значения сопротивлений. Оказалось, что в проволочках было разное количество примесей, и чем больше было примесей, тем более высоким было сопротивление. Онесс решил продолжить свои опыты на более чистом металле. Он испытывал золото. Но даже при максимально чистом золоте обнаруживалось хоть и малое, но все же заметное остаточное сопротивление.
R, Ом






 0,13
0,13
 0,125
0,125

 0,10
0,10
Hg
 0,075
0,075